有机化学学习笔记杂环化合物
有机化学---第17章 杂环化合物

、 内酯、环状酸酐等。
环为平面型共轭体系,环内π电子数符合4n+2规 则,具有一定芳香性的杂环化合物。
2
2、杂环化合物的分类
五元杂环, 如 单杂环 六元杂环, 如 杂环化合物 稠杂环 两个以上单杂环稠并
N N N H
O N
N H
S
苯环与单杂环稠并, 如 N H
N
N
3
3、杂环化合物的命名 (1)音译法 ——在同音汉字左边 + 口字旁
N ..
H2SO4,HgSO4 220℃
N
N
NO2
β-硝基吡啶
SO3H
β-吡啶磺酸
34
当吡啶环上连有供电子基团时,将有利于亲电取
代反应的发生;反之,就更难以进行亲电取代反应。
NO2
HNO3,H2SO4
H3 C N CH3
100℃
H3 C
N
CH3
吡啶环也象硝基苯一样,不能发生F―C烷基化和 酰基化反应。
吲哚具有芳香性,亲电取代反应发生在吡咯环上; 吲哚亲电取代反应的活性比苯高,但比吡咯低。 亲电取代反应的位置:
5 4 3 7
E+
1
苯 环
6
N H
2
吡咯环
26
进攻 C2 N H + E
+
进攻 C3
只有一个带有完 E N 2 H 整苯环的共振杂化体。 H 3 E 3 E H H + + N N H H
OH
6
S1
苯并呋喃
1
苯并吡咯 喹啉
N
9 7 8
苯并噻唑
N N
3
5 4
HO
N H
OH
有机化学16---杂环化合物

H
CH2 CH2 烯醇化
CHO + NH 2 CH CH2
O
C
HO C H CH2 CH2 NH
NH
CH 浓H2SO4 H2O NH CH2 CH2 PhNO2 2H
N
16.3 六元杂环化合物
◇ 亲电取代反应主要发生在苯环的5或8-位, 而亲核取代反应则主要发生在吡啶环的2或4-位。
NO2 混酸 N 0℃ N NO2 N
N
吡啶-3-磺酸
主要发生在α-位
N C6H5
C6H5Li
α-苯基吡啶
16.3 六元杂环化合物
16.3.2 喹啉 ◇ Skraup 合成法 ◇ 历程:
CH2OH CHOH CH2OH 浓H2SO4 2H2O
NH2 + CH2OH CHOH CH2OH 浓H2SO4 PhNO2 ,Δ
N
CH2 CH CHO
2 O
O
CHO + H2
CuO Cr2O3 150 ℃ ,10MPa COOH
O
糠酸
CH2OH
糠醇
O
CHO
KMnO4 KOH
O
CHO + NaOH O
CH2OH +
O
COONa
16.2 五元杂环化合物
d. 合成原料
H2,Ni O
NaCN
O
HCl Cl(CH2) 4Cl 140 ℃ ,0.4MPa
H2O HOOC(CH2)4COOH H2NCH2(CH2)4CH2NH2
S
N H
O
电负性 共轭能
(kJ/mol)
2.55 152 苯 ﹥
2.58 117 噻吩 ﹥
3.04 88 吡咯 ﹥
有机化学-第十七章 杂环化合物
Br
Br
N H
Br2
N H
乙 醇
Br
Br
噻吩对氧化剂稳定,可用一般的硝化剂和磺化剂
H2SO4 , 25℃
S
SO3H S
α-噻吩磺酸
呋喃和吡咯对及氧化剂都比较敏感,应使用特殊的试
剂乙酰硝酸酯进行硝化,使用吡啶三氧化硫进行磺化。
+
N
SO3
-
SO3H O
O CH3 C ONO2 (CH3CO)2O,-10 ℃
O
α-呋喃磺酸
N H
N H
α-硝基吡咯
NO2
吡啶比苯难发生亲电取代反应,反应条件要求和硝基
苯差不多;在发生反应时取代基主要进入β-位。
HNO3 , H2SO4
NO2 N
β(3)-硝基吡啶
N
300 ℃
吡啶的氯代要用AlCl3催化且要加热; 吡啶的磺化要用发烟H2SO4并要加热;
(2) 氧化反应 吡啶环对氧化剂稳定,比苯环难氧化。
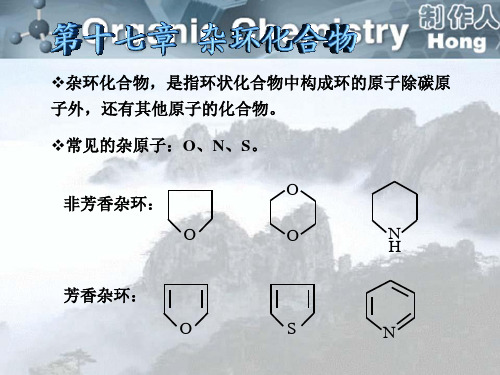
杂环化合物,是指环状化合物中构成环的原子除碳原
子外,还有其他原子的化合物。
常见的杂原子:O、N、S。 非芳香杂环:
O O O N H
芳香杂环:
O
S
N
17-1 分类和命名
一、杂环化合物的分类
单杂环:
{
五元杂环 六元杂环
O
呋喃
N H
吡咯
S
噻吩
N S
噻唑
N N H
咪唑
N
N
吡啶
N
嘧啶
稠杂环:
{
N
1 6 5
N N
3 4
N7
8
N2
2
N9 H
大学有机化学第十一章杂环化合物

环状有机化合物中,构成环的原子除碳原 子外还有其他类型的原子时,这类环状有 机化合物叫做杂环化合物。非碳原子称为 杂原子。最常见的杂原子有O、S、N 。 杂环根据其性质可分为脂杂环和芳杂环。 杂环化合物在自然界中分布广泛,是重要 的、也是最大的一类有机化合物。
一、分类和命名
N HN (in d o le ) H (in d o le ) 吲哚 吲哚
N NH N (p u rin e ) H (p u rin e ) 嘌呤 嘌呤
⑵系统命名法:根据相应的碳环母体命名, 命名时在相应的碳环母体名称前面加上杂原 子的名称。
N H
茂
S S
N H
氮茂 O O
N H
N H
S S O
4γ β 5 α 6 3β 2α
1-硫-3-氮茂 (噻唑) β α
N H N
1,3-二氮苯 (嘧啶)
CH3
O
β α
N
1
一些多杂原子的杂环,有其固定编号。
6 1 5
N N
3
N
7 5 8 6
2 4
N9 H
1,3,7,9-四氮茚 (嘌呤)
当环上连有烃基时,一般以环作为母体。 如连有官能团时,则以环作为取代基。
1.分类: 单杂环:五元杂环和六元杂环 稠杂环:苯环和单杂环稠合、单杂环和单 杂环稠合 2.命名: ⑴音译法:根据杂环的英文名称译音,带 “口”字旁的同音汉字表示。
N NH (pH le ) yrro (p yrro le ) 吡咯 吡咯 N
N N N (p yrim id in e ) (p yrim id in e ) 嘧啶 嘧啶
CH3 N
《有机化学》杂环化合物

N H Pyrrole
吡咯
N
N H Imidazole
咪唑
N O Isoxazole
异噁唑
N N H Pyrazole
吡唑
S
Thiophene
噻吩
N
S Thiazole
噻唑
N S Isothiazole
异噻唑
4
六元环
含一个杂原子:
N Pyridine
吡啶
OБайду номын сангаас
Pyran
吡喃
含两个杂原子:
N N Pyridazine
在所有的杂环母核中,凡是具有共轭双键体系的五 元环和六元环,都具有芳香性。
五个原子分享六个π电子,电子离域使环上各碳原 子的电子云密度相对升高,这类杂环进行亲电性取 代比苯容易。
呋喃
噻吩
吡咯
11
六元杂环化合物:吡啶 •氮原子sp2杂化 •构成芳香体系的是π-π共轭。 •由于氮原子的电负性较强,使 环上碳原子的电子云密度相对 降低,亲电性取代反应比苯要 难,主要在间位。
N
300 oC
H2SO4, SO3 N 230 oC, 24 h
Br
N
-溴吡啶
SO3H
N
-吡啶磺酸
KNO3 + H2SO4
NO2
N
Fe, 300 oC
N -硝基吡啶
16
亲核取代比苯容易,主要发生在α位上。
了解
N
+ NaNH2 100℃
N
H2O NHNa
N NH2
当α 或 γ位上有易离去基时,较弱的亲核试剂就能 发生亲核取代反应。
代基的杂原子编号为1,并使另一个杂原子的编号
有机化学基础知识点杂环化合物的合成与反应

有机化学基础知识点杂环化合物的合成与反应有机化学是研究含碳的化合物以及其反应机理的学科。
杂环化合物是其中一类重要的有机化合物,由多个不同的原子构成的环状结构赋予其特殊的性质和活性。
本文将重点介绍杂环化合物的合成与反应。
一、杂环化合物的合成1. 环状结构的直接合成直接合成是指通过无需过多中间步骤,直接将杂环结构形成的方法。
最常见的有两种:环内缩合与环外缩合。
环内缩合是通过分子内的反应实现环状结构的形成。
例如,可以通过两个官能团的内部反应,如酰胺和酰胺之间的内酰胺化反应,形成含有杂环结构的化合物。
环外缩合是通过分子间的反应实现环状结构的形成。
例如,可以通过偶氮化物和亲电试剂的反应,形成含有杂环结构的化合物。
2. 环状结构的间接合成间接合成是指通过多步反应,将不同的官能团转化为杂环结构。
这种方法更加灵活,可以根据具体需求选择不同的反应路径。
常见的方法有:(1) 拉曼反应:通过烷基金属物与芳香酮之间的反应,将芳香酮上的羰基还原成羟基,形成杂环结构。
(2) 脱水环化反应:通过脱水反应形成环状结构。
最常见的是使用酸催化剂将醇或酸上的羟基与相邻的官能团上的氢原子进行消除反应,形成杂环结构。
(3) 杂环化合物的可溶性和稳定性增大,可使用催化剂或光催化反应进行合成。
二、杂环化合物的反应1. 变性反应杂环化合物可以通过一系列的变性反应进行官能团的转换。
例如,通过酸催化或碱催化的酯水解反应,将酯转化为醇或酸;通过羟胺或胺与酸酐或酰氯的反应,形成酰胺或酰脲。
2. 变位反应变位反应是杂环化合物中常见的反应之一,通过杂环结构上的元素进行位置的变化。
例如,通过环内亲电试剂的攻击,实现环内碳-氧的位置变化,形成环内醇或环内醚。
3. 开环反应通过开环反应,可以将杂环化合物打开,形成更加简单的化合物。
其中最常见的是酸性水解和碱性水解反应,将杂环结构上的官能团裂解成独立的官能团。
综上所述,杂环化合物的合成与反应是有机化学中重要的研究领域。
【基础有机化学】第20章 杂环化合物

2、亲电取代反应
亲电取代反应比吡啶容易,比萘难,主要发生在 苯环上的5和8位。例如:
NO2
HNO3,H2SO4 0℃
N SO3H
+ N
NO2
浓H2SO4
22℃ N
N
Br
Br2 浓H2SO4
+
Ag2SO4
N
N
Br
3、亲核取代反应
亲核取代反应也吡啶容易,主要发生在吡啶环上 的2位。例如:
NaNH2 二甲苯 100℃
将苯胺与无水甘油、硝基苯、硫酸等共热,即可 得喹啉:
NH2 CH2OH
NO2 H2SO4
NH2
+ CHOH +
+
CH2OH
FeSO4
N
反应历程:
CH2 CH CH2 H2SO4 OH OH OH
CH2=CH-CHO + H2O
NH2 CH2=CH-CHO
H
H
N
H2SO4
N
H
-H2O
OH
1,2-二氢喹啉
• 在有机物中通常将除碳和氢之外的其
他元素称为杂原子。
• 杂环化合物是指那些具有与苯环相
似的闭合共轭体系的杂环化合物, 它们具有不同程度的芳香性,所以, 也叫芳杂环。
一、分类和命名
(一)分类
单杂环 杂环
五元杂环 六元杂环
五元一杂 五元二杂 六元一杂 六元二杂
苯环与杂环稠合 稠杂环
杂环与杂环稠合
(二)命名
O 2H-吡喃(无芳香性)
2H-pyran
六元二杂:
N
N 嘧啶 pyrimidine
稠杂环:
N 喹啉 quinoline
有机化学基础知识点整理杂环化合物的性质与应用

有机化学基础知识点整理杂环化合物的性质与应用杂环化合物是有机化学中一类具有杂原子(通常是氮、氧、硫等非碳原子)构成的环状分子。
它们具有多种独特的性质和广泛的应用。
本文将整理一些重要的有机化学基础知识点,涵盖杂环化合物的性质和应用。
一、杂环化合物的命名和结构杂环化合物的命名使用通常的有机化学命名法,如官能团命名法、光谱法等。
其结构通常由杂原子和碳原子组成,可以包含一个或多个杂环。
其中,氮杂环化合物如吡嗪、噻吩和咪唑等具有广泛的结构多样性和化学活性。
二、杂环化合物的性质1. 杂环化合物的稳定性:杂环化合物中的杂原子可以增加分子的稳定性,一些杂环化合物比它们的同系物更稳定。
例如,咪唑酮比噻唑酮更稳定,这是由于含氮原子的电子亲和力高于含硫原子的电子亲和力。
2. 杂环化合物的化学反应:杂环化合物中的杂原子可以参与许多重要的化学反应,如亲电取代、亲核取代、氧化还原等。
以氮杂环化合物为例,它们可以发生亲电取代反应,如芳香性亲电取代、加成反应等。
3. 杂环化合物的光学性质:杂环化合物中存在的共轭体系可以产生有趣的光学性质,如荧光、蓝光发射等。
研究人员利用这些性质开发出许多发光材料,应用于有机光电子器件、荧光探针等领域。
三、杂环化合物的应用1. 杂环化合物在药物领域的应用:许多杂环化合物具有药理活性,并被用作药物的活性成分。
例如,噻唑类和咪唑类化合物具有抗菌和抗肿瘤活性,吡唑类和吡唑酮类化合物被广泛应用于抗癌药物研究。
2. 杂环化合物在染料领域的应用:杂环化合物可以用作染料分子的基础结构,赋予染料分子良好的色谱性能和稳定性。
它们在纺织、油墨和染料敏化太阳能电池等领域有广泛应用。
3. 杂环化合物在有机电子器件中的应用:杂环化合物具有优异的载流子传输性能和独特的光学性质,因此被广泛应用于有机发光二极管(OLED)、有机太阳能电池和有机场效应晶体管等器件中。
四、结语本文对有机化学基础知识中的杂环化合物的性质和应用进行了整理和阐述。
有机化学第13章杂环化合物
2)若环内不止一个杂原子时,则按O、S、N的顺序编 号。若杂原子相同,则使杂原子的编号尽可能小。如:
N
CH3 S 5-甲基噻唑
二、五元杂环化合物 1、结构和芳香性
X = O : 2s22p4 X X = S : 3s23p4
X = NH : 2s22p3 所有原子均为sp2 杂化,杂化轨道表示为:
O:
分子具有平面结构,
S:
有Π56大Π键。所以
N:
有芳香性。
杂化轨道
未杂化轨道
2、鉴别 呋喃蒸汽遇被盐酸浸过的松木片呈绿色; 噻吩在浓硫酸存在下,与靛红加热显示蓝色; 吡咯蒸汽遇被盐酸浸过的松木片呈红色。
3、化学性质 1)芳香性
分子中存在Π56大Π键,Π电子云密度比苯大, 所以它们亲电取代反应的活性比苯高。
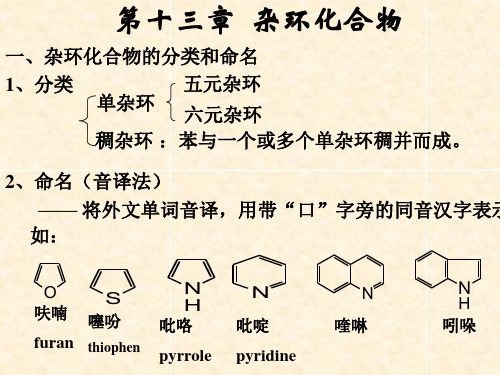
第十三章 杂环化合物
一、杂环化合物的分类和命名
1、分类
五元杂环
单杂环 六元杂环
稠杂环 :苯与一个或多个单杂环稠并而成。
2、命名(音译法)
—— 将外文单词音译,用带“口”字旁的同音汉字表示 如:
O 呋喃
furan
S 噻吩
thiophen
N H 吡咯
pyrrole
N 吡啶 pyridine
N 喹啉
N
H 吲哚
2、性质
1)碱性:
<
N H
NH2
<
.N.
< NH3 < 脂肪胺
pKb: 13.6 9.5
8.8 4.75 3.2
2)成盐
N + HCl
N*HCl (或
+ NHCl )
NH3
应用:分离提纯吡啶。
3)亲电取代反应
有机化学:第十五章 杂环化合物

5 6
7
4 3
2
81
OH 8-羟基喹啉
NH2
1 65
7
2 49 8 3
6-氨基嘌呤
O
4 5
3 CO2H
CH3 1 6 5 N
N 7 CH3
6
12
Br 7
2
O
3
N4 N
8
9
CH3
6-溴吲哚-3-羧酸 1,3,7-三甲基嘌呤-2,6-二酮
标氢:当杂环上含有饱和原子时,往往存在互变异构
体,命名时用“位置编号” +“H” (大写斜体)写在词 首加以区别,并给饱和原子尽可能低的编号。
度的碱性,可成盐。
2.吡啶的水溶性
吡啶氮原子上的一对未共用电子能与水 形成氢键,吡啶能与水互溶,但吡啶环上引 入羟基或氨基后,化合物的水溶性却明显降 低,且引入的羟基或氨基数目愈多,水溶性 愈差,主要原因是溶质分子间缔合(分子间 氢键等),抑制了与水分子间的缔合。
3. 碱性:
吡啶环N原子的一对孤电子对处于sp2杂化轨道上, 它并不参与环上的共轭体系,因此可能和质子结合或 给出电子,呈现弱碱性。吡啶中氮原子上的未共用电 子对处于sp2杂化轨道中,s成分较大,受N的束缚力较 强,给出电子倾向较小,与 H+ 的结合力较弱,所以碱 性较弱。
· ·
·
· ·
N
·
··
叔胺 N
pKb: ~ 4
8.8
N
NH2
H
9.37
~ 14
碱性:叔胺 > 吡啶 > 苯胺 > 吡咯
+ HCl N
· Cl N+ H 吡啶盐酸盐
4.化学反应
⑴
通过氮原子上的未共用电子对,吡啶可以
有机化学:16章 杂环化合物

异喹啉Isoquinoline
H N
吲哚 Indole
编号从杂原子开始,尽可能使取代基的位次较小。遇两
相同杂原子, 则由带取代基(或H)的杂原子开始。含多个
不同杂原子, 则按 O
S
N 顺序编号。
CH3
C2H5 O CH3 N
O2N O CHO
S CH2CH2OH
2-甲基5-乙基呋喃
4-甲基吡啶
5- 硝 基 -2呋喃甲醛
高效杀菌剂
H3C N
NaO3SH2C
CH3
O
N CH3
N
C6H5
退热药安乃近
N
H2N
SO2NH
S
抗菌药磺胺噻唑
近70年前的第一宗二甘醇杀人事件就与“磺胺‘药有关,1937年 ,美国田纳西州的马先吉尔药厂推出了“磺胺酏----马先吉尔” (酏剂是以酒精作溶剂的一种药物剂型),这种配制成又甜
又香消炎药水主要是给小孩服用的。
两个互变异构体的平衡体系
6
1N
5
7
N
2
98
N4 N
3
H
N N
NH N
9H-嘌呤
7H-嘌呤
核酸中存在的嘌呤环系:
NH2
O
N
N
HN
N
NN H
腺嘌呤
H2N N
N H
鸟嘌呤
NH2
N
N
HOCH2 O N
N
HH
H
H
OH OH
腺嘌呤核苷(腺苷)
3. 喹啉、异喹啉
1) 亲电取代反应
N
试推测亲电试剂进入的位置 ----位
1、结构和芳香性
呋喃 furan
有机化学 第十七章杂环化合物

第十七章杂环化合物(heterocyclic compounds)在环状化合物的环中含有碳以外的杂原子,这类化合物统称为杂环化合物。
常见的杂原子是: O, N, S1芳杂环的数目很多,可根据环的大小、杂原子的多少以及单环和稠环来分类。
•常见的杂环为五元、六元单杂环及稠杂环。
稠杂环是由苯环及一个或多个单杂环稠合而成的。
317.2 杂环化合物的命名杂环化合物的命名采用外文名的译音,用带“口”字旁的同音汉字表示。
编号从杂原子开始,用阿拉伯数字(1,2,…) 表示顺序,也可以将杂原子旁的碳原子依次用α、β、γ表示。
417.3 结构和芳香性呋喃、噻吩、吡咯是最重要的含一个杂原子的五元杂环化合物。
呋喃、噻吩、吡咯都是平面结构,环上所有原子都是sp2杂化,各原子均以sp2杂化轨道重叠形成σ键。
9碳未杂化的p 轨道中有一个电子,杂原子的p轨道中有一对电子,p 轨道相互平行重叠,形成闭合的共轭体系,具有芳香性。
下表中给出的1H NMR数据可证实这一点,环上质子的化学位移在7ppm左右与苯类似。
1011表17-1 五元芳杂环的物理性质分别存在于木焦油、煤焦油和骨焦油中αβαβαβ17.4 五元杂环化合物4.1 五元杂环化合物的化学性质呋喃、噻吩、吡咯具有芳香性,容易进行亲电取代反应。
杂原子的大小及电负性不同,它们的活性有差异,但它们的活性都比苯大,顺序为:吡咯> 呋喃> 噻吩> 苯12(丙)吡咯和吲哚•吡咯的物理性质和鉴定•无色油状液体,沸点131℃,微溶于水,易溶于有机溶剂。
•吡咯蒸气遇浸过盐酸的松木片呈红色,可用来检验吡咯。
•吡咯环不如苯环稳定,易被氧化呈褐色并发生树脂化。
2017.5 六元杂环化合物5.1 吡啶和嘧啶吡啶存在于煤焦油和骨焦油中,工业上用无机酸从煤焦油的轻油部分中提取。
吡啶的衍生物广泛存在于自然界中,许多药物也含有吡啶环。
23一、吡啶的物理性质及结构吡啶是一个无色有恶臭的液体b.p. 115.5℃,m.p.-42℃,d: 0.9819与水及许多有机溶剂如乙醇,乙醚等混溶它是良好的溶剂25吡啶的结构与苯的相似吡啶环上的氮以sp2杂化成键,一个p电子参与共轭,形成具有6个p电子的闭合的共轭体系,具有芳香性。
有机化学基础知识点整理杂环化合物的合成与反应

有机化学基础知识点整理杂环化合物的合成与反应有机化学基础知识点整理:杂环化合物的合成与反应有机化学是研究有机物(碳氢化合物)结构、性质、合成和反应的科学。
其中,杂环化合物是由碳和其他元素(如氮、氧、硫等)组成的环状化合物。
杂环化合物的合成和反应是有机化学中的重要内容之一,本文将对其进行整理。
一、杂环化合物的合成方法1. 环内反应:环内反应是在分子内部的某些原子之间发生的反应。
例如,环化反应、氧杂环化反应、氮杂环化反应等。
2. 氧杂环化反应:羟基(-OH)与卤代烃(如溴代烷)反应,可以得到环氧化合物。
环氧化合物是一种含有环氧基(三元环)的化合物,广泛应用于药物合成等领域。
3. 氮杂环化反应:氮杂环化反应是指含有氨基(-NH2)或氨基取代基的化合物与亲电试剂之间发生的反应。
常用的氮杂环化反应有马来酰亚胺反应、亚胺合成反应等。
4. 环外反应:环外反应是指分子之间发生的反应,常分为以下几类:(1)烯烃的环化反应:烯烃经过加热或催化剂作用,发生环加成反应,形成环状化合物。
(2)烃的氧化反应:烃可以通过氧化反应合成含氧杂环化合物,常见的有芳香烃的氧化反应。
(3)烯烃的羟酯形成反应:烯烃与醇反应,得到烯醇或羟酯。
二、杂环化合物的重要反应1. 开环反应:开环反应是指杂环化合物分子内环或环外的原子之间发生的反应。
例如,溶剂的水解、酸催化下的醇化反应等。
2. 环增反应:环增反应是指杂环化合物的分子内部发生新的化学键生成的反应。
例如,芳香化合物的芳香核的取代反应。
3. 杂环开环反应:杂环开环反应是指杂环化合物经过化学反应后裂开环进行变化。
例如,噁唑酮类化合物的反应。
4. 杂环还原反应:杂环还原反应是指杂环化合物中含有的杂原子(如氮、氧等)发生还原反应。
例如,噻吩的氮原子上的取代基发生还原反应。
三、杂环化合物在药物合成中的应用杂环化合物在药物合成中具有重要的应用价值。
其中,吡唑类化合物具有广泛的生物活性,被作为抗生素和抗肿瘤药物的原料合成核心结构。
有机化学第十四章 杂环化合物

3、当杂环侧链含有羧基、醛基、羟基等官能团时, 杂环可以当做取代基命名
14.2 五元杂环化合物
一、吡咯、呋喃和噻吩的结构与芳香性
吡咯
呋喃
噻吩
休克尔规则:环状共轭多烯分子所有原子处于同平面,且π电子数等于4n+2.
14.2 五元杂环化合物
一、吡咯、呋喃和噻吩的结构与芳香性
四:氧化与还原
N
CH3 KMnO4
COOH N
用过酸氧化,生成氧化吡啶
N
CH3COOOH N O
H2/Ni
N
N
H
14.3 六元杂环化合物
五、甲基取代吡啶甲基H的活性
N
CH3 + OHC
KOH,DMF N
CC H
H
α, γ位的甲基活泼,能被抜氢形成碳负离子,具有亲核性。 β 位没有该性质
14.2 五元杂环化合物
课堂习题
1、 命名下列化合物
3-甲基吡啶 2、 完成下列反应
(1)
3-吡啶甲酸 3,5-二甲基喹啉 2-吲哚甲醛
(2)
(3)
(4) (5)
14.2 五元杂环化合物
课堂习题
3、 解释吡咯、呋喃具有芳香性的原因
4、 解释吡咯、呋喃、噻吩亲电取代位点在α位的原因
14.2 五元杂环化合物
1. 对于单环化合物,编号都从杂原子开始编,取代基的编号尽量小。当环
里含有两个或两个以上杂原子时,要以O>S>NH>N的顺序。
43
5
2
1
2-甲基呋喃 或者α-甲基呋喃
4
5
3
6
2
1
3-溴吡啶 或者β-溴吡啶
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-杂环化合物【圣才出品】

(2)物理性质 ①噻唑是无色、有吡啶臭味的液体,沸点 117℃,易与水互溶,有弱碱性。 ②咪唑是无色固体,熔点 90℃,易溶于水。 (3)酸碱性 噻唑具有弱碱性,咪唑同时具有酸碱性,且其碱性较噻唑强。 (4)亲电反应 咪唑环比噻唑环较容易发生亲电取代反应,如卤代、硝化和磺化等。
(2)噻吩的制法 从 C4 馏分制备:丁烷与硫、丁烯与二氧化硫,在高温下反应得噻吩,如:
6 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)吡咯的制法 ①呋喃与氨在高温下反应得吡咯,如:
②吡咯还可从乙炔与甲醛经由丁炔二醇合成,如:
5.噻唑和咪唑 (1)定义 ①噻唑是含有一个硫原子和一个氮原子的五元杂环化合物。
2 / 34
圣才电子书 十万种考研考证电子书、题库视频学习平台
吡咯、呋喃和噻吩在 3077~3003cm-1 区域出现 C—H 键伸缩振动吸收峰。 b.N—H 键伸缩振动 含有 N—H 基团的杂环在 3500~3200cm-1 区域出现 N-H 键伸缩振动吸收。 吡咯在非极性溶剂的稀溶液中于近 3495cm-1 处出现一条尖锐的峰,而在浓溶液中则于 近 3400cml-1 处出现一条宽峰,在浓和稀的中间浓度时两种峰都有。 c.环伸缩振动(骨架谱带) 环伸缩振动出现于 1600~1300cml-1 区域。 呋喃、吡咯和噻吩在这一区域里出现 2~4 个峰。 ②1HNMR 在吡咯的 1H NMR 中,α-H 的化学位移(δ值)为 6.68,而β-H 为 6.22,约在 8.0 出现 N —H 键的信号。 (4)亲电取代反应 ①亲电取代活性 a.反应速率 呋喃、吡咯、噻吩的反应速率比苯快得多,主要在于环上的五个原子共有 6 个π电子, 其π电子云密度比苯大。 b.反应活性 吡咯和呋喃比较活泼,与苯胺或苯酚相当,而噻吩则是三者中活性最差的。 ②亲电取代的定位原则 呋喃进行亲电取代反应时,亲电基团进入呋喃环的 2 位(即α位)上,若 2、5(即α及α') 两个位置已有基团存在,则进入 3 位。 ③亲电取代的条件
有机化学:17-3.杂环化合物

β Nα
H
吡咯
S
噻吩
4
N3 4
N3 4
N3
O
5 N1 2
5S 2
1
5 O1
2
H
呋喃
咪唑
噻唑
噁唑
N
N
吡啶
N
嘧啶
O
吡喃
4 5
5 36
4
5
36
4
6
7
3
1
N
5N
8
6 7
27
N1
8
H
N 27 8
1
N2 2
1
N 4 N9
3
H
吲哚
喹啉
异喹啉
嘌呤
§17.1.2 结构和芳香性
杂环芳香族化合物的芳香性:
• 符合Hückel规则(1. 环状, 2. 共平面, 3. 垂直平面的p轨道, 4. 4n+2 电子)
H+
O COONa 糠酸钠
O CH2 O CH2 n O CH2OH
糠醛树脂
呋喃的芳香性比较弱, 除进行亲电取代反应 外;还容易进行亲电加成和Diels-Alder反应。
O
OO
O+
O 30oC
S+
O
O O
O
100 oC 1500MPa
顺丁烯二酸酐
O
HO H
90%
SO O
47%
HO H
+ Br2 CH3COOK H
• 共振能:16~29 千卡/mol • 均能发生芳香族化合物的典型反应——亲电取代反应 • 1H NMR在 d=6~9ppm处有芳香族化合物的特征吸收
N
有机化学学习笔记:第十一章杂环化合物

CH3 CN N CH3
Ar ArCHO, n-C3H7OH N H 回流 Ar
Cl CH3 O N S CH3C O O Br N OH CH3 CHO CH3 O N S CH3C O O
NC N
CN
Ar =
N
Ar
Cl N OH Br
(CH3CO)2O
CH2CH3 CH3 NaOCH N
3
CHCH3 CH3 N
NaNH2 N Na O
pKb=13.6
说明吡咯N上的H具有酸性。
RMgX N H -RH N MgX
O Cl
O Cl
O + N H
N
K N H N K
O N + N H
O
B. 活泼芳环的性质
a. 与重氮盐偶联
N H + N NCl N H N N
b. Reimer-Tiemann反应
CHCl3 N NaOH N H
H3+O N H
CHO
c. Kolbe反应
(NH4)2CO3 N H 高温
H
N H
COONH4
COOH
d. 吲哚、咔唑及噻吩的Vilsmeier反应
CHO POCl3 / DMF N C6H13 ClCH2CH2Cl N C6H13
CHO N CH3 DMF / POCl3 N CH3
S S
DMF / POCl3 CH2Cl2 室温 S
O NH NH3 CH3CCH2COOC2H5 CH3CCH2COOC2H5 亲核加成生成亚胺
C2H5OOC CH3 CH3 NH2 O H COOC2H5 CH3 C2H5OOC CH3
CH3 H2N C=C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H NaNH2 N
O Cl
Na O
N
O +N
O Cl
O N
H
O +N
H
B. 活泼芳环的性质
a. 与重氮盐偶联
+ N
N NCl
H
b. Reimer-Tiemann反应
N NN H
N H
c. Kolbe反应
N H
CHCl3 NaOH
N CHO H
(NH4)2CO3 高温
H3+O N COONH4 H
N COOH H
E H
Z
只有进攻4-位时方可避开这种 情况,所以,当2-位为吸电子 基团时,后续基团进入4-位。
G
EE
E
E
Z G H Z G H Z G HZ G
G为第一类定位基 Z=N,S
E ZG
E H
ZG
E
EH
ZG
ZG
EE Z G HZG
E H
ZG E
虽然亲电试剂进攻3-位和5-位均 能产生正碳离子与推电子基团相 连的情况,但是,进攻5-位时产 生三个共振式,而且5-位的反应 活性比3-位高。
Z
G E
G
EG
EH
Z
Z
G
Z
E H
亲电试剂进攻2-位,则导致正碳离 子直接与吸电子基团相连,不稳定。
E H
Z
G 如果进攻4-位,不仅其本身活性 低,而且也不如进攻5-位时产生 的共振式多。
G
G
G
EE
Z
HZ
E HZ
G E HZ
进攻5-位最有利。
G为第一类定位基 Z=N,O,S
G E
Z
G
E ZH
G
E ZH
S
00C
CH3COONO2
O
-5~300C
S NO2 60%
O NO2 35%
B. 卤代
氯化硫酰
SO2Cl2/(C2H5)2O
N Cl H
00C
N
H
Br2/C2H5OH Br
Br
00C
Br N Br
H
氯化硫酰是一种 温和的氯代试剂
Cl2 O Cl -400C
Br2/ O O
O
00C
O Br
I2/H2O
如果以苯的硝化反应速率为1,噻吩的位硝化速 率为1.9104,位为3.2107
11.2 吡咯、呋喃、噻吩的性质与合成
亲电取代反应活性:
>
>
>
>
N
O
S
N
H
1.五元杂环化合物的亲电取代反应机理
亲电试剂进攻3,4-位
E
Z
E H
Z
E
H 两个共振式
Z
Z=N,O,S
-H+
E
杂原子利用其孤对电子
来稳定正碳离子 Z
OH OH
O OH
Cr2O3
O CHO ZnO
O
CH CH 2HCHO CuCl/NH4Cl
H
ZG
E
E
H Z G HZ G
4.五元杂环化合物的加成反应
O
+
O
O O
O
N+
O
H
O
O O
O
O
O
N
O
O
O
N+
O
R
O
R N
O
O O
O S O
O O
O
O
H2O2
O
S
S
O
O O
O 不反应
5.吡咯的特殊反应
A. 酸性
pKb=2.89 N H
RMgX N -RH H
N MgX
K
N
N
H
K
pKb=13.6 说明吡咯N上的H具有酸性。 N
+ H2SO4 S
D. Friedel-Crafts酰基化
(CH3CO)2O N 150~2000C H
(CH3CO)2O
S
SnCl4
(CH3CO)2O
O
BF3
O N C-CH3 H
O S C-CH3
O O C-CH3
五元杂环化合物的 亲电取代反应活性 高,所以,一般选 用弱的亲电试剂、 在低温条件下、采 用溶剂稀释时反应, 以防止五元杂环化
Br CH3COOH
Z NO2 Br2
Z NO2
位有第二类定位基, 后续基团进入不相邻 的位;
CH3COONO2
Z Br
O2N Z Br
位有第一类定位基, 则后续基团进入另一 位。
解释:
G为第二类定位基 Z=N,S
E ZG
E H
ZG
E
EH
ZG
ZG
亲电试剂进攻3-位,则导致正碳离子直接与 吸电子基团相连,这样的正碳离子不稳定。
亲电试剂进攻2,5-位
E
Z
E ZH
E ZH
E ZH
Z=N,O,S
-H+
产生三个共振式,
Z E 正碳离子更稳定
2.五元杂环化合物的亲电取代反应
A. 硝化
硝化试剂为温和的硝酸乙酰酯 (CH3CO)2O + HNO3 CH3COONO2
CH3COONO2
N
-100C
H
N NO2 H 51%
CH3COONO2
合物氧化或聚合。
3.基团定位效应
A. 位有取代基
COOH
CH3COOH
Z
Br2 Br
Z=N,O,S
COOH Z
Br CH3COONO2
Z Z=N,O,S
Br Z NO2
位有第二类定位基, 后续基团进入不相 邻的位;
位有第一类定位基, 后续基团进入相邻 的位。
解释:
G为第二类定位基 Z=N,O,S
S I 00C
苯不能直接与碘反应 但噻吩可以,说明其 亲电取代活性远远高 于苯
Br2/CH3COOH
S
00C
S Br
C. 磺化
温和的磺化试剂
N SO3
N H
N SO3
O
N SO3 NΒιβλιοθήκη HClHO SO3 N
HCl
H2SO4
S
室温
S SO3H
H2O
苯中含有少量噻吩可以用浓硫酸萃取除去
N SO3H H
O SO3H
五元杂环
S 噻吩
N 吡啶 六元杂环
N
N
喹啉
异喹啉
稠杂环
2.结构
NH
O
S
键长0.1383nm 键长0.1371nm 键长0.1429nm
键长0.1362nm 键长0.1361nm
键长0.1431nm
键长0.1741nm 键长0.1370nm 键长0.1423nm
形成 56大键,整体电子云密度升高,使亲电取 代反应更为容易;键长并未完全平均化,电荷密 度分布不均匀,使得亲电取代反应发生的位置具 有选择性。其中2,5-位称为位;3,4-位称为位。
第十一章 杂环化合物
五元杂环亲电取代反应及基团定位效应 六元杂环亲电取代反应和亲核取代反应
五元杂环的合成 喹啉的反应 喹啉的合成
11.1 结构
1.分类 非芳香性杂环化合物
O
S
四氢呋喃 四氢噻吩 (醚类) (硫醚类)
N
H 四氢吡咯
(仲胺)
N
H 哌啶 (仲胺)
芳香性杂环化合物
34
2 O5
1
呋喃
N
H 吡咯
d. 吲哚、咔唑及噻吩的Vilsmeier反应
POCl3 / DMF
N
ClCH2CH2Cl
C6H13
CHO
N C6H13
DMF / POCl3 N
CH3
CHO
N CH3
S DMF / POCl3
S CHO
S
CH2Cl2 室温
S
6.五元杂环化合物的合成
A. 无取代基的五元杂环的合成
(C5H8O4)n H3+O HO 多聚戊糖
G 亲电试剂进攻2E 位,则导致正碳 Z H 离子直接与推电
子基团相连,这 样正碳离子稳定。
G
EG
EH
Z
Z
G
G
EE
Z
HZ
EG H
Z G
E HZ
亲电试剂进攻这两
G
个位置时则无此共 振式。
E
HZ
B. 位有取代基 (当Z=O时)
不论呋喃的位是何种类型定位基,则后续基团均 进入另一位。
B. 位有取代基 (当Z=N,S时)
