博舒替尼片-美国说明书
博舒替尼片-日本说明书

2.重要な基本的注意 ⑴AST(GOT)、ALT(GPT)、γ-GTP、ビリルビン等の上昇を
伴う肝機能障害があらわれることがあるので、投与 3 ヵ月目は 1 回、また、患者の状態
に応じて肝機能検査を行い、患者の状態を十分に観察すること。
⑵白血球減少、好中球減少、顆粒球減少、血小板減少、貧血等の
に不耐容の患者に本剤を投与する際には、投与中止の原因と
なった副作用と同様の副作用が起こるおそれがあるので、前治
療の副作用の内容を確認してから投与すること。
⑹浮動性めまい、疲労、視力障害等があらわれることがあるので、
このような場合には自動車の運転等危険を伴う機械の操作に従
事させないよう注意させること。
( ク ラ リ ス ロ マ イ シ ン、 併用する際には本剤の減量
エリスロマイシン等) を考慮するとともに、患者
HIVプロテアーゼ阻害剤 の状態を慎重に観察し、副
(リトナビル等)
作用発現に十分注意するこ
カルシウム拮抗薬(ジル と。
チアゼム、ベラパミル等)
抗がん剤(イマチニブ等)
アプレピタント、トフィ
アゾール系抗真菌剤(イ 副作用の発現頻度及び重症 の代謝活性を阻害するた
トラコナゾール、ケトコ 度が増加するおそれがある め、本剤の血中濃度が上
ナゾール、フルコナゾー ので、CYP3A阻害作用のな 昇する可能性がある。
ル、ボリコナゾール等) い又は弱い薬剤への代替を
マクロライド系抗生物質 考慮すること。やむを得ず
1
⑶心疾患又はその既往歴のある患者[心疾患が悪化することがあ
る。]
⑷QT間隔延長のおそれ又はその既往歴のある患者[QT間隔延長
が起こるおそれがある。]
沃瑞沙-赛沃替尼片说明书

核准日期:2021年06月22日修改日期:2021年11月24日修改日期:2022年03月17日赛沃替尼片说明书本品为附条件批准,请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:赛沃替尼片商品名称:沃瑞沙®/ORPATHYS®英文名称:Savolitinib Tablets汉语拼音:Saiwotini Pian【成份】本品主要成分为赛沃替尼。
化学名称:1-[(1S)-1-(咪唑并[1,2-a]吡啶-6-基)乙基]-6-(1-甲基-1H-吡唑-4-基)-1H-[1,2,3]三唑并[4,5-b]吡嗪化学结构式:分子式:C17H15N9分子量:345.36【性状】薄膜衣片,除去包衣后显白色至黄色。
【适应症】本品用于含铂化疗后疾病进展或不耐受标准含铂化疗的、具有间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性非小细胞肺癌成人患者。
本适应症是基于一项单臂临床试验的客观缓解率和缓解持续时间结果给予的附条件批准。
本适应症的完全批准将取决于后续开展的确证性试验的临床获益。
【规格】(1)100 mg;(2)200 mg。
【用法用量】本品需在有肿瘤治疗经验的医生指导下使用。
使用本品治疗前必须明确有经充分验证的检测方法检测到MET外显子14跳变阳性。
推荐剂量和服用方法对于体重≥50公斤的患者,建议起始剂量为600 mg,每日一次口服,直到疾病进展或出现不可耐受的毒性。
对于体重<50公斤的患者,建议起始剂量为400 mg,每日一次口服,直到疾病进展或出现不可耐受的毒性。
建议每日相同时段在餐后即刻服用本品。
剂量调整医生应在患者用药过程中密切监测,根据患者个体的安全性和耐受性调整用药,包括暂停本品、降低剂量或永久停用本品。
本品的剂量调整建议参见表 1,不良反应导致治疗调整的建议参见表 2。
表 1 赛沃替尼剂量调整建议表 2 赛沃替尼不良反应导致治疗调整的建议表 2 赛沃替尼不良反应导致治疗调整的建议国际标准化比率;TBIL = 总胆红素;ULN = 正常值上限。
马昔腾坦片说明书

核准日期:2017年09月29日修改日期:2020年05月09日2020年09月10日马昔腾坦片说明书请仔细阅读说明书并在医师指导下使用胚胎-胎儿毒性本品因具有胎毒性,禁止用于妊娠女性。
育龄女性在治疗开始前、治疗期间的每月和停止治疗后1个月都需排除妊娠的可能性,在治疗期间和停止治疗后1个月都应采取可靠避孕措施。
【药品名称】通用名称:马昔腾坦片商品名称:傲朴舒®(OPSUMIT®)英文名称:Macitentan Tablets汉语拼音:Maxitengtan Pian【成份】本品活性成份:马昔腾坦化学名称:N-[5-(4-溴苯基)-6-[2-[(5-溴代嘧啶-2-基)氧基]乙氧基]-嘧啶-4-基]-N'-丙基磺酰二胺化学结构式:分子式:C19H20Br2N6O4S分子量:588.27【性状】本品为白色或类白色双面凸起的圆形薄膜衣片,双面均刻有“10”字样,除去包衣后显白色或类白色。
【适应症】本品是一种内皮素受体拮抗剂(ERA),用于治疗肺动脉高压(PAH,WHO第1组),以延缓疾病进展。
疾病进展包括:死亡、静脉(IV)或皮下给予前列腺素类药物,或PAH 临床恶化(6分钟步行距离降低,PAH症状恶化并需要其他的PAH治疗)。
本品也降低了PAH患者住院治疗。
本品的有效性研究是一项在WHO功能分级II级-III级的PAH患者中平均治疗2年的长期研究。
患者用本品单药治疗,或与磷酸二酯酶-5抑制剂、吸入性前列腺素类药物合用。
患者包括特发性或遗传性PAH(57%),与结缔组织病相关的PAH(31%),与修复分流的先天性心脏病相关的PAH(8%)。
【规格】10mg【用法用量】应该由在肺动脉高压治疗方面具有经验的医生启动治疗,并对治疗进行监测。
剂量本品的推荐剂量是10mg,每日一次口服。
可随餐或空腹服用。
不建议患者将药片掰半、压碎或咀嚼服用。
尚未在PAH患者中进行过高于10mg,每日一次剂量的研究,故不建议使用。
2019年fda批准新药简介

卡博替尼(Caቤተ መጻሕፍቲ ባይዱozantinib)
商品名: Cometriq(Orphan) 上市公司: Exelixis 给药方式:口服 适应症:治疗转移性甲状腺髓样癌 特点:多靶点酪氨酸激酶(VEGFR-2、cMet)抑制剂,卡博替尼是过去2年中
获批用于治疗甲状腺髓样癌的第2种药物,另一种药物为阿斯利康的Caprelsa。
2019年fda批准新药简介
2019 年美国 FDA批准了 39 个新药上市, 其中有 33 个新分子实体创 2019 年以来批准数的新高 。 首轮审评通过率将近 80% ,超过往年任何时 候。 首轮通过率高的可能原因包括: ① 药物研发过程中监管者和研发企业之
间的沟通更为密切; ② 新药的适应证填补了未满足的疾病需求; ③ 追踪性
伐卡托有效改善 CF 患者的肺功能,延缓肺功能恶化。2019销售额13亿美元
托法替尼 (tofacitinib ,Xeljanz )
商品名: Xeljanz 上市公司: 辉瑞 给药方式:口服(片剂) 适应症:疗成人患者的对甲氨喋呤应答不充分或不耐受的中度至重度活动性
类风湿性关节炎。 背景: JAK-STAT信号通路功能广泛,参与细胞的增殖、分化、凋亡以免疫
IP、TP五种亚型),促进房水经葡萄膜巩膜流出,降低眼内压。他氟前列腺素 是首个不含防腐剂的前列腺素类似物的滴眼药,药效与拉坦前列腺素类似,但持 续时间更长。
阿伐那非(Avanafil)
商品名: Stendra 上市公司: Vivus 给药方式:口服 适应症:勃起功能障碍(ED)。 特点: PDE5抑制剂,用于治疗男性勃起功能障碍。同类药物还有西地那非
帕妥珠单抗 (pertuzumab ,Perjeta )
商品名:Perjeta 上市公司:罗氏 给药方式:注射 适应症:乳腺癌 背景:帕妥珠单抗是第一种可抑制人表皮生长因子受体 2(HER2)二聚化的人
卡博替尼(Cometriq,Cabozantinib)FDA官方说明书

卡博替尼(Cometriq,Cabozantinib)FDA官方说明书1 适应症和用途COMETRIQ适用于治疗有进展性,转移甲状腺髓样癌(MTC)患者。
2 剂量和给药方法2.1 推荐剂量COMETRIQ的推荐剂量为每天140 mg(1剂80-mg和3剂20-mg胶囊)。
不要与食物给予COMETRIQ。
指导患者服用COMETRIQ前至少2小时,后至少1小时不要进食。
继续治疗直至疾病进展或不接受毒性。
整个吞服COMETRIQ胶囊。
不要打开COMETRIQ胶囊。
在下1剂12小时内不要服用丢失剂量。
COMETRIQ期间不要摄取已知抑制细胞色素P450食物(如,葡萄柚,葡萄柚汁)或营养补充物。
2.2 剂量调整对不良反应对NCI CTCAE 4级出血不良反应,3级或更大非出血性不良反应或不能耐受2级不良反应不给COMETRIQ。
对不良反应的解决/改善(即,返回基线或解决至1级),减低剂量如下:● 如既往接受140 mg每天给药,恢复治疗在100 mg每天(1粒80-mg和1粒20-mg胶囊)● 如既往接受100 mg每天给药,恢复治疗在60 mg每天(3粒20-mg胶囊)● 如既往接受60 mg每天给药,恢复在60 mg如耐受,否则,终止COMETRIQ对任何以下情况永远终止COMETRIQ:● 发生内脏穿孔或瘘管形成● 严重出血● 严重动脉血栓栓塞事件(如,心肌梗死,脑梗死)●肾病综合征● 恶性高血压,高血压危象,尽管最优化医学处理持久不能控制高血压● 颌骨骨坏死● 可逆性后部白质脑病综合征有肝受损患者中有中度和严重肝受损患者建议不使用COMETRIQ[见警告和注意事项(5.11)和特殊人群中使用(8.6)]。
用CYP3A4抑制剂患者接受COMETRIQ患者避免同时使用强CYP3A4抑制剂(如,酮康唑[ketoconazole],伊曲康唑[itraconazole],克拉霉素[clarithromycin],阿扎那韦[atazanavir],奈法唑酮[nefazodone],沙奎那韦[saquinavir],泰利霉素[telithromycin],利托那韦[ritonavir],印地那韦[indinavir],奈非那韦[nelfinavir], 伏立康唑[voriconazole])[见警告和注意事项(5.10)和药物相互作用(7.1)]。
卡博替尼说明书、XL184卡博替尼靶点、服用剂量、价格

RET 融合:总体客观有效率 28%,中位无进展生存期为 7 个月;肺癌 EGFR 野生型:单药卡博替尼 vs 卡博替尼联用特罗凯中位无进展生存 期为 4.3 个月:4.7 个月,总生存期为 9.2 个月:13.3 个月。
XL184 卡博替尼靶点:ROS1、MET、VEGFR1 2 3、AXL、NTRK、 KIT、RET。 卡博替尼服用剂量 卡博替尼对于不同的适应症所服用的剂量也是有区别的,在卡博 替尼说明书中推荐的治疗基因检测 C-met 扩增突变的肺癌患者的剂 量是每天吞服 60mg,甲状腺髓样癌的用法用量是 120mg 每天。 印度 XL184 卡博替尼价格 印度属于与众不同的国度,在原研药经过美国 FDA 批准上市的 3 个月之内,印度可以不接受专利控制以非常迅速的时间将药品仿制完 成,而印度仿制方不考虑专利费用和研发费用,所以,廉价成为了仿 制药的优势。据了解,印度 XL184 卡博替尼价格相当于原价的 替尼靶点| 服用剂量|价格
维耐健康编辑,如有不足之处,可指正。wndg91 微信 卡博替尼胶囊属于美国 Exelixis 研发的针对多靶点的小分子抑制 剂,卡博替尼因为治疗疾病广泛,抑制多种癌症骨转移效果敏感,被 称之为“万能靶向药”,研发代号 XL184。 卡博替尼适应症:非小细胞肺癌、软组织肉瘤、肾癌、乳腺癌、 卵巢癌、甲状腺癌等。经过美国 FDA 批准的适应症是肾癌和甲状腺癌, 不过,在肝癌、肺癌等多种癌症骨转移都有相关研究。 卡博替尼的临床试验研究: ①一组名为 II 期的临床试验中,一共有 157 名晚期中等或者低 等的肾癌患者按照 1:1 比例接受每天 60mg 卡博替尼或者 50mg(服用 4 周停用 2 周)舒尼替尼治疗。这次研究的目标是无进展生存期。最 后发现:卡博替尼和舒尼替尼中位无进展生存期分别是 8.6 个月和 5.3 个月,中位中生存期为 26.6 个月 VS 21.2 个月,客观反映率为 20% VS 9%。 ②卡博替尼在髓样甲状腺癌 III 期临床实验中和安慰剂相比,卡 博替尼 XL184 无进展生存期延长了 75%,卡博替尼组中位无进展生存 期达 11.2 个月 VS 安慰剂组 4 个月。 ③EGFR 抑制剂耐药的肺癌患者,卡博替尼联合特罗凯的治疗控 制率达到 67.6%,可喜的是有 33 名患者的肿瘤缩小的比例超过 30%;
myrbetriq(mirabegron)缓释片使用说明书第一版

()缓释片使用说明书年第一版批准日期: 年月日;公司:美国药物评价和研究中心药物评价室主任,说“估计美国有千百万患膀胱过度活动症(),是一种不舒适的,破坏和潜在严重的,”“今天的批准为有这种失能情况患者提供一种新治疗选择“。
处方资料:处方资料重点这些重点不包括安全和有效使用所需所有资料。
请参阅下文为的完整处方资料(),为口服使用美国初次批准:适应证和用途是一种β肾上腺能激动剂适用于有急迫性尿失禁,急迫,和尿频症状膀胱过度活动症()的治疗()剂量和给药方法()推荐起始剂量是每天次,有或无食物。
()()是在周内有效。
根据个体疗效和耐受性,可增加剂量至每天次。
(,)()与水完整吞咽,不要咀嚼,分开或压碎。
()()患者有严重肾受损或有中度肝受损患者,最大剂量为每天次。
(,,,)()有终末肾病()或患者有严重肝受损患者。
不建议使用。
(,,,)剂量和规格缓释片:和()禁忌证无()警告和注意事项()血压增加:可增加血压。
建议定期测定血压,特别在高血压患者。
在严重未控制高血压患者中建议不使用。
().()有膀胱出口阻塞尿潴留患者和对膀胱过度活动症用抗胆碱药物患者:因为尿潴留风险在这些患者中谨慎给药。
().()用被代谢药物的患者:是一种中度抑制剂。
建议适当监视和对治疗指数狭窄的底物可能需要调整剂量。
(,,)不良反应报道的最常见不良反应(> 和> 安慰剂)是高血压,鼻咽炎,尿道感染和头痛。
()报告怀疑不良反应,联系美国,. 公司电话或电话或药物相互作用()被代谢药物(如美托洛尔[]和地昔帕明[]): 是抑制剂和当同时与被代谢药物使用时,特别治疗指数窄药物,适当监视和可能需要调整这些药物的剂量。
(,,).()地高辛[]: 当开始和地高辛联用时,处方用最低剂量的地高辛;监视血清地高辛浓度点滴逐步调整地高辛剂量至需要的临床效应。
(,).特殊人群中使用()妊娠:只有如对母亲的获益胜过对胎儿的潜在风险时才使用。
() •()哺乳母亲: 被预计在人乳汁中排泄和不建议哺乳母亲使用。
矽肺肺纤维化治疗药物的研究进展

矽肺肺纤维化治疗药物的研究进展矽肺是一种慢性病,是我国的法定职业病,其致病原因为长期吸入含有游离二氧化硅的粉尘,与其所在环境(诸如:铁矿工作人员等)状况息息相关,能够导致肺组织弥漫性纤维化,影响肺功能。
矽肺病不同于其他吸入性肺疾病,即使在消除接触源后,肺损伤也可能发展为肺纤维化,不仅严重影响个人的身体健康、降低其生活质量,也给社会造成沉重的负担。
目前针对矽肺的主要治疗措施为肺灌洗、抗肺纤维化、提高机体的抵抗力等,虽已采用各种药物和非药物干预,但现有的治疗方法仍然不能有效地缓解病情的发展和使肺纤维化逆转,迫切需要新的治疗药物减缓矽肺纤维化进展。
标签:矽肺;肺纤维化;治疗药物引言矽肺是一种长期暴露于二氧化硅粉尘导致的慢性间质性肺疾病,其主要特征为肺部炎症和进行性肺纤维化。
随着肺纤维化的发展,矽肺病情进一步加重,严重影响着人们的身体健康与生活质量。
随着国内外科研人员对矽肺肺纤维化发病机制和病理生理变化的深入研究,针对矽肺肺纤维化治疗药物的研究也取得了一定进展。
1天然药物1.1黄芩苷黄芩苷属于黄酮类化合物,主要是从黄芩的干燥根中分离出来。
研究表明,黄芩苷具有抗氧化、抗炎和抗过敏等多种药理活性。
采用黄芩苷治疗实验性矽肺小鼠,研究发现黄芩苷具有以下作用:(1)显著降低肺组织中维甲酸孤儿核受体γt和TGF-β的mRNA水平;(2)早期炎症阶段,可减少辅助性T细胞1(Th1)的含量,下调肺组织、脾脏中γ-干扰素(IFN-γ)mRNA的表达,降低BALF中肿瘤坏死因子-α(TNF-α)的浓度;(3)肺纤维化阶段,黄芩苷通过降低肺中转录因子GATA-3mRNA水平及BALF中白细胞介素4(IL-4)的浓度减轻Th2反应。
黄芩苷可减轻二氧化硅诱导小鼠的肺部炎症和纤维化。
1.2新藤黄酸新藤黄酸是一种衍生自藤黄树的传统药物。
使用新藤黄酸处理二氧化硅染毒的小鼠巨噬细胞,结果显示新藤黄酸可通过抑制高迁移率族蛋白1的表达减少二氧化硅诱导的巨噬细胞凋亡和成纤维细胞的活化,通过下调单核细胞趋化诱导蛋白1的表达发挥抗矽肺肺纤维化作用。
波生坦片Bosentan-详细说明书与重点

波生坦片Bosentan警示语:肝功能:波生坦伴随可逆性、剂量相关的天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)增加,在某些病例中还伴随胆红素升高。
肝酶升高通常在开始治疗前16周内出现,然后在数天至9周内恢复到治疗前水平,或者减少剂量或者停药后自动恢复。
在治疗前需检测肝脏转氨酶水平,随后初12个月内每个月检测1次,以后4个月1次。
先前存在肝脏损伤:在以下病人中,中度或严重肝损伤和/或肝脏转氨酶即天冬氨酸转氨酶(AST)和/或丙氨酸转氨酶(ALT)的基线值高于正常值上限的3倍(ULN),尤其当总胆红素增加超过正常值上限2倍,禁用全可利。
成份:化学名称:4-叔丁基-N-[6-(2-羟基-乙氧基)-5-(2-甲基-苯氧基)-[2,2’]二嘧啶-4-基]苯璜酰胺-水化合物;化学结构式:分子式:C27H29N5O6S·H2O分子量:569.64适应症:本品适用于治疗WHO功能分级II级-IV级的肺动脉高压(PAH)(WHO第1组)的患者,以改善患者的运动能力和减少临床恶化。
支持本品有效性的研究主要包括WHO功能分级II级-IV级的特发性或遗传性PAH(60%)、与结缔组织病相关的PAH(21%)及与左向右分流先天性心脏病相关的PAH(18%)患者。
使用注意事项:WHO功能分级II级的患者显示出临床恶化率下降和步行距离的改善趋势。
医生应充分考虑这些益处是否足够抵消对于WHO功能分级II级患者的肝损伤风险,随着疾病进展,该风险可能导致将来无法使用本品。
规格:62.5 mg,125 mg(以C27H29N5O6S计)用法用量:本品应由有治疗肺动脉高压丰富经验的医生决定是否开始本药治疗,并对治疗过程中进行严格监测。
推荐剂量和剂量调整:本品初始剂量为一天2次、每次62.5mg,持续4周,随后增加至维持剂量125mg,一天2次。
高于一天2次、一次125mg的剂量不会带来足以抵消肝毒性风险增加的额外益处。
卡博替尼中文使用说明书

请仔细阅读说明书,并在医生的指导下用药【药物名】cabozantinib【商品名】Cabometyx【通用名】卡博替尼【初次获批时间】2012年【类别】小分子激酶抑制剂【靶点】VEGFR2,MET,RET【分子结构】分子式:C28H24FN3O5·C4H6O5分子量为:635.6【生产公司】Exelixis制药公司【适应症】CABOMETYX是激酶抑制剂适用为有晚期肾细胞癌(RCC)曽接受以前抗-血管生成治疗患者的治疗。
【剂量和药物管理】1 推荐剂量不要用卡赞替尼胶囊替代CABOMETYX片。
CABOMETYX推荐的每天剂量是60 mg,不要与食物给予CABOMETYX。
指导患者服用CABOMETYX前和至少1小时后共至少2小时不要进食。
继续治疗直至患者再也不经历临床获益或经受不可接受毒性。
整吞CABOMETYX片。
不要压碎CABOMETYX片。
下一剂量12小时内不要服用缺失剂量。
CABOMETYX 治疗期间不要摄取食物(如,柚子,柚子汁)或营养补充物已知抑制细胞色素P450。
2 剂量调整对正在进行手术患者计划安排的手术前至少28天停止治疗用CABOMETYX,包括牙科手术。
对不良反应对美国国家癌症研究所不良事件常用名词[NCI CTCAE] 4级不良反应,和对3级或不能耐受的2级不良反应,当不能用一个剂量减低或支持医护处理时不给CABOMETYX。
在一个不良反应解决/改善时(即,返回至基线或解决至1级),减低剂量如下:如以前地接受60 mg每天剂量,在40 mg每天恢复治疗如以前地接受40 mg每天剂量,在20 mg每天恢复治疗如以前地接受20 mg每天剂量,如耐受在20 mg恢复,否则,终止CABOMETYX因以下任何情况永久地终止CABOMETYX:发生不能处理的瘘管或GI穿孔严重出血动脉血栓栓塞事件(如,心肌梗死,脑梗塞)高血压危象或严重高血压尽管最佳医学处理肾病综合征可逆性后部白质脑病综合征在当前地服用一个强CYP3A4抑制剂患者减低每天CABOMETYX剂量20 mg(例如,从60 mg至40 mg每天或从40 mg至20 mg每天)。
215501259_博舒替尼对甲状腺乳头状癌B-CPAP细胞恶性行为的影响及其机制

博舒替尼对甲状腺乳头状癌B CPAP细胞恶性行为的影响及其机制夏湖斌1,万文臖1,王 羽2,张一帆1,曹文卓1,李 曙1△,吴 超1△(1.皖南医学院病理生理学教研室,安徽芜湖241002;2.皖南医学院第二附属医院肾内科,安徽芜湖241002)【摘要】 目的:探讨博舒替尼对甲状腺乳头状癌B CPAP细胞恶性行为的影响及其可能的作用机制。
方法:体外培养甲状腺乳头状癌BCPAP细胞系,加入浓度梯度(1、2、3、4和5μmol/L)博舒替尼干预24h,用DMSO作为对照组,每组设5个平行复孔。
采用CCK 8法检测细胞增殖能力,Transwell实验和划痕修复实验检测细胞侵袭和迁移能力,TUNEL染色实验和流式细胞术检测细胞凋亡情况,蛋白质印迹法检测自噬蛋白(Beclin 1、LC3、p62)表达情况和信号通路蛋白(SIK2,p mTOR、mTOR、p ULK1、ULK1)表达情况。
结果:与对照组比较,博舒替尼2、3、4和5μmol/L浓度组细胞增殖活性、迁移能力和侵袭能力均降低(P<0.01)而细胞凋亡率均增加(P<0.01),博舒替尼4和5μmol/L浓度组Beclin 1(P<0.05)、LC3 Ⅱ/LC3 Ⅰ(P<0.05)、SIK2(P<0.01)和p ULK1(P<0.01)蛋白表达量均减少而p62(P<0.05)和p mTOR(P<0.01)蛋白表达量增加。
结论:博舒替尼可能通过SIK2 mTOR ULK1通路抑制甲状腺乳头状癌细胞自噬,来抑制其增殖、侵袭和迁移能力并促进凋亡,从而减弱其恶性行为。
【关键词】 甲状腺乳头状癌;博舒替尼;自噬;恶性行为;细胞培养【中图分类号】R736.1 【文献标识码】A 【文章编号】1000 6834(2022)06 730 006【DOI】10.12047/j.cjap.6373.2022.133 EffectsofbosutinibonthemalignantbehaviorofthyroidpapillarycarcinomaB CPAPcellsanditsmechanismsXIAHu bin1,WANWen jun1,WANGYu2,ZHANGYi fan1,CAOWen zhuo1,LIShu1△,WUChao1△(1.DepartmentofPathophysiology,WannanMedicalCollege,Wuhu241002;2.DepartmentofNephrology,theSecondAffiliatedHospitalofWannanMedicalCollege,Wuhu241002,China)【ABSTRACT】Objective:ToinvestigatetheeffectsofbosutinibonthemalignantbehaviorofthyroidpapillarycarcinomaB CPAPcellsanditspossiblemechanisms.Methods:ThyroidpapillarycarcinomaB CPAPcellswereculturedinvitrowithaconcentrationgradientof(1、2、3、4and5μmol/L)bosutinibintervenedfor24hours,DMSOwasusedasthecontrolgroup.Fiveparallelcompoundholesweresetineachgroup.Cellcountingkit(CCK 8method)methodwasusedtodetectcellproliferation.Transwellassayandcellwoundhealingassaywereusedtodetectcellinvasionandmigration.TUNELstainingassayandflowcytometrywereusedtodetectcellapoptosis.Westernblotwasusedtodetecttheexpressionsofautophagicproteins(Beclin 1,LC3,p62)andsignalpathwayproteins(SIK2,p mTOR,mTOR,p ULK1,ULK1).Results:Comparedwiththecontrolgroup,thecellproliferationactivity,migrationabil ityandinvasionabilityweredecreased(P<0.01),whilethecellapoptosisratewasincreased(P<0.01)inthebosutinibconcentra tiongroupsof2,3,4and5μmol/L.Intheconcentrationgroupsof4and5μmol/L,theexpressionofBeclin 1(P<0.05),LC3 Ⅱ/LC3 Ⅰ(P<0.05),SIK2(P<0.01)andp ULK1(P<0.01)proteinwasdecreased,whiletheexpressionofp62(P<0.05)andp mTOR(P<0.01)proteinwasincreased.Conclusion:BosutinibmayinhibittheautophagyofthyroidpapillarycarcinomacellsthroughSIK2 mTOR ULK1signalingpathwaytoinhibittheirproliferation,invasionandmigrationandpromoteapoptosis,therebyweakeningtheirmalignantbehavior.【KEYWORDS】 thyroidpapillarycarcinoma; Bosutinib; autophagy; malignantbehavior; cellculture 【基金项目】 安徽省高校科学研究重大项目(KJ2020ZD55);安徽省高校科学研究重点项目(KJ2020A0604);安徽省重点研究与开发计划项目(S202104j07020117);国家级大学生创新训练计划项目(202110368031);皖南医学院横向科研项目(22050123004)【收稿日期】2022 10 18【修回日期】2022 11 25 △【通讯作者】Tel:0553 3932616;E mail:wylishu@wnmc.edu.cn,15656078923@163.com 甲状腺乳头状癌(papillarythyroidcarcinoma,PTC)是临床最常见的甲状腺肿瘤,尽管多数PTC预后较好,但长期死亡率仍达到10%[1,2]。
靶向药物的整理

摘要:在2012年,FDA一共批准上市39种新药,其中11种抗肿瘤药,有6种为小分子靶向药物;在2013年,FDA一共批准上市27种新药,有4种为小分子靶向药物,另外增加了索拉菲尼和瑞戈非尼的新适应症;在2014年,FDA一共批准上市41种新药,其中9种抗肿瘤药,有4种为小分子靶向药物。
本文对15种小分子靶向药物作了简要论述。
关键词:FDA、小分子靶向药物、新药正文:靶向药物(也称作靶向制剂)是指被赋予了靶向能力的药物或其制剂。
其目的是使药物或其载体能瞄准特定的病变部位,并在目标部位蓄积或释放有效成分。
靶向制剂可以使药物在目标局部形成相对较高的浓度,从而在提高药效的同时抑制毒副作用,减少对正常组织、细胞的伤害。
主要有小分子靶向药物和单克隆抗体两大类。
由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,称为单克隆抗体。
通常采用杂交瘤技术来制备,杂交瘤抗体技术是在细胞融合技术的基础上,将具有分泌特异性抗体能力的致敏B细胞和具有无限繁殖能力的骨髓瘤细胞融合为B细胞杂交瘤。
用具备这种特性的单个杂交瘤细胞培养成细胞群,可制备针对一种抗原表位的特异性抗体即单克隆抗体。
小分子靶向药物通常是穿过细胞膜,作用于细胞内的靶点,干扰靶蛋白的酶活性,是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖过程中所必需的信号传导通路,从而达到治疗的目的。
下面将近三年FDA批准上市的小分子靶向药物一一进行说明。
1. Bosutinib (Bosulif) 博舒替尼:以ABL为靶点,在2012年获批,它是Bcr-Abl酪氨酸激酶抑制剂,用于治疗慢性粒细胞白血病。
慢性粒细胞白血病是一种相对少见的恶性肿瘤,大约占所有癌症的0.3%,占成人白血病的20%,大约有90至95%的病人出现费城染色体,表达Bcr-Abl蛋白。
2. Cabozantinib (Cometriq)卡博替尼:以FLT3, KIT, MET, RET, VEGFR2为靶点,在2012年获批,是多靶点酪氨酸激酶(VEGFR-2、cMet)抑制剂,用于治疗转移性甲状腺髓样癌,不良反应为可能导致结肠严重出血和穿孔。
波舒替尼杂质
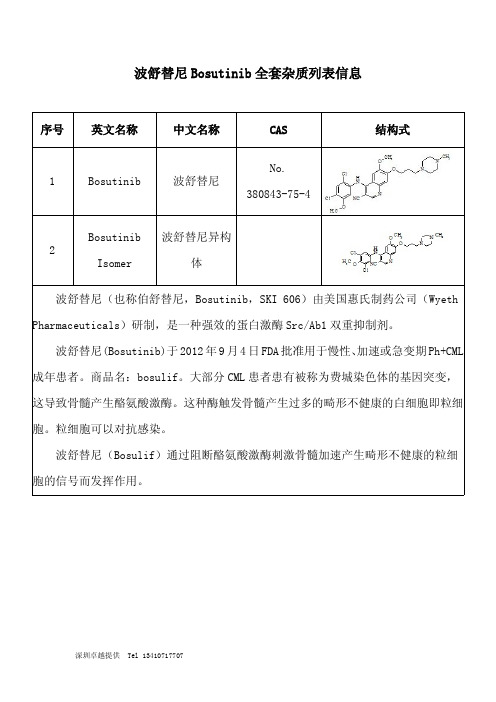
波舒替尼Bosutinib全套杂质列表信息
序号英文名称中文名称CAS结构式1Bosutinib波舒替尼
No.
380843-75-4
2
Bosutinib
Isomer 波舒替尼异构
体
波舒替尼(也称伯舒替尼,Bosutinib,SKI606)由美国惠氏制药公司(Wyeth Pharmaceuticals)研制,是一种强效的蛋白激酶Src/Ab1双重抑制剂。
波舒替尼(Bosutinib)于2012年9月4日FDA批准用于慢性、加速或急变期Ph+CML 成年患者。
商品名:bosulif。
大部分CML患者患有被称为费城染色体的基因突变,这导致骨髓产生酪氨酸激酶。
这种酶触发骨髓产生过多的畸形不健康的白细胞即粒细胞。
粒细胞可以对抗感染。
波舒替尼(Bosulif)通过阻断酪氨酸激酶刺激骨髓加速产生畸形不健康的粒细胞的信号而发挥作用。
深圳卓越提供Tel134********。
曲美替尼片说明书

d 包括腹痛、下腹痛、上腹痛和腹部压痛。
e 包括淋巴水肿、水肿和外周水肿。
f 包括鼻衄、牙龈出血、便血、直肠出血、黑便、阴道出血、痔出血、血尿和结膜出血。
应用本品治疗患者(N=329)中≤ 10%患者观察到的其他临床重要不良反应为:
心脏:心动过缓
胃肠道:口干
感染:毛囊炎、脓疱疹、蜂窝织炎
肌肉骨骼和结缔组织:横纹肌溶解
暂停本品 3 周。 如有改善,则恢复至较低剂量水平。 如果未改善,则永久停药。
暂停本品。 如果改善至 0-1 级,则恢复至较低剂量水平。 如果未改善,则永久停药。 暂停本品,直至不良反应改善到 0-1 级。然后,
恢复至较低剂量水平。 或 永久停用。 永久停用本品。
4 / 29
a 美国国家癌症研究所不良事件通用术语标准(NCI CTCAE)4.0 版。 b 有关推荐的曲美替尼剂量减少方法,参见表 1。
剂量调整 可能需要减少剂量、中断治疗或停止治疗以管控不良反应(参见表 1 和表 2)。 对于皮肤鳞状细胞癌(cuSCC)或新的原发性黑色素瘤的不良反应,不建议进行剂量调整。 在给予甲磺酸达拉非尼联合应用本品治疗时,如果出现治疗相关的毒性,则两种治疗应同
时进行剂量减少、中断或停止。对于主要与甲磺酸达拉非尼相关的不良反应(葡萄膜炎、非皮 肤恶性肿瘤),以及主要与曲美替尼相关的不良反应(视网膜静脉阻塞(RVO)、视网膜色素 上皮脱离(RPED)、间质性肺病(ILD)/肺炎和单纯性静脉血栓栓塞),仅需对其中一种治 疗进行剂量调整。
暂停本品 4 周。 如果改善至正常 LVEF 值,则恢复至较低剂量
水平。 如果未改善至正常的 LVEF 值,则永久停药。 永久停用本品。
暂停本品 3 周。 如有改善,则以相同或更低的剂量水平恢复本
肿瘤靶向治疗相关的毒性反应

肿瘤靶向治疗相关的毒性反应全球疾病负担研究数据显示,在发达国家由恶性肿瘤导致的患者死亡人数已位居全部死亡原因的第二位,在发展中国家位居第三位。
2020 年全世界约有1 930 万新发恶性肿瘤病例,其中1 000 万患者死于恶性肿瘤。
目前针对恶性肿瘤的治疗方法包括手术、放疗、化疗及生物治疗,由于化疗药物存在细胞毒性及不良反应较多,因此临床上需要靶向性更强、不良反应更小的治疗手段来提高肿瘤的治疗效果。
分子靶向治疗是指使用靶向特定分子( 分子靶点) 的药物或其他物质来阻止肿瘤细胞的生长和扩散,其具有较强的靶向性、疗效性,近年来作为临床治疗肿瘤的主要手段逐渐被应用于临床,但分子靶向抗肿瘤药物在临床应用过程中同样会出现一些毒性反应,限制了其临床应用和发展。
一、皮肤毒性反应皮肤毒性反应是众多靶向药物治疗中最常见的不良反应,发生率高达79% ~88% ,皮肤毒性反应的出现可能会降低患者的用药依从性,影响后续治疗甚至导致治疗计划中断。
此外,严重的皮肤毒性反应还会增加患者感染的风险,降低生活质量,同时还会增加额外的医疗负担。
由于表皮生长因子受体存在于皮肤组织当中,因此使用表皮生长因子相关药物的患者最易出现皮肤毒性,如表皮生长因子抑制剂,包括厄落替尼、拉索菲尼、西妥昔单抗等。
以上药物会对皮肤、指甲、毛发等有特殊的不良反应,常见的毒性反应包括黏膜炎和皮疹。
1.黏膜炎靶向治疗药物引发的黏膜炎症往往易出现在口腔黏膜上,形成口腔黏膜炎,溃疡部位相对较浅,其周围会有异常疼痛,中央部分呈灰色,周围伴有红斑,常始发于治疗后5 天。
Reyes-Habito 等研究结果显示患者服用表皮生长因子受体( EGFR) -酪氨酸激酶抑制剂( TKI) 后出现口腔黏膜炎,表现为口干、口腔溃疡等。
Sonis 等通过给78 例实体肿瘤患者应用雷帕霉素进行治疗后发现,66% 的患者出现口腔黏膜溃疡。
针对此类靶向抗肿瘤药引起的黏膜炎症,临床上通常采取减少给药剂量、延长给药周期甚至是停药处理等措施以减轻毒性反应,但无论是减量或停药均会影响药物作用,而目前有研究使用氨磷汀、谷氨酰胺、口服抗氧化剂( 如锌剂、维生素E 等) 、盐酸苯海拉明、己酮可可碱、水杨酸盐等药物治疗皮肤毒性,其效果还需进行临床试验进一步验证。
Zelboraf(vemurafenib)片使用说明书

[转载]Zelboraf(vemurafenib)片使用说明书2011年8月第一版(2011-08-31 22:37:11)转载▼标签:转载原文地址:Zelboraf(vemurafenib)片使用说明书2011年8月第一版作者:tangzhongming Zelboraf(vemurafenib)片使用说明书2011年8月第一版批准日期:2011年8月17日;公司:Plexxikon Inc. HOFFMAN-LA ROCHEFDA的药物评价和研究中心肿瘤药品办公室主任Richard Pazdur, M.D.说“"对有后期黑色素瘤患者今年是重要一年。
Zelboraf是证实改善总生存的第二个被批准新抗癌药物” “3月我们批准了Yervoy(ipilimumab),为后期黑色素瘤另一个新治疗,接受药物后也显示延长患者生存。
”FDA的设备和放射健康部中的在体外诊断设备评价和安全性办公室主任Alberto Gutierrez, Ph.D说:“今天批准的Zelboraf和cobas检验是发展伴随诊断和使用以保证患者以安全方式被暴露至高度有效,更个体化治疗一个大实例。
”译自:/drugsatfda_docs/label/2011/202429s000lbl.pdf处方资料重点这些重点不包括安全和有效使用ZELBORAF所需所有资料。
请参阅下文为ZELBORAF的完整处方资料ZELBORAF™ (vemurafenib)口服片美国初始批准:2011适应证和用途ZELBORAF™是一种激酶抑制剂适用于有不可切除或转移黑色素瘤有用FDA-批准的检验检测BRAFV600E突变患者的治疗。
(1, 5.10)使用限制:有野生型BRAF黑色素瘤患者中建议不使用ZELBORAF。
(5.10, 14)剂量和给药方法(1)推荐剂量:960 mg口服bid。
(2.1)(2)接近12小时间隔给予ZELBORAF有或无进餐。
奥布替尼片说明书

核准日期:XXXX年XX月XX日奥布替尼片说明书请仔细阅读说明书并在医生指导下使用【药品名称】通用名称:奥布替尼片商品名称:宜诺凯英文名称:Orelabrutinib Tablets汉语拼音:Aobutini Pian【成分】本品活性成份为奥布替尼化学名称:2-(4-苯氧基苯基)-6-[1-(丙-2-烯酰)哌啶-4-基]吡啶-3-甲酰胺化学结构式:分子式:C26H25N3O3分子量:427.5【性状】本品为白色或类白色片。
【适应症】本品适用于治疗:1)既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。
2)既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
上述适应症分别基于一项单臂临床试验的客观缓解率结果给予的附条件批准。
本品的完全批准将取决于正在开展中的确证性随机对照临床试验结果。
【规格】50 mg【用法用量】本品需在有肿瘤治疗经验的医生指导下使用。
本品应口服给药,每天的用药时间尽量固定。
应用水送服整片药片,不可掰开、压碎或咀嚼药片。
可在饭前或饭后服用。
推荐剂量为每次150 mg(3片50 mg的片剂),口服,每日一次,直至疾病进展或出现不可耐受的毒性。
漏服剂量如果未在计划时间服用本品,应在距下次用药至少8小时的前提下尽快服用,第二天继续在正常计划时间服药。
请勿额外服用本品以弥补漏服剂量。
出现不良反应时的剂量调整剂量调整建议见表1。
*通过口服药物得到充分控制的高血压或无症状的实验室检查异常除外;提示存在肝或肾功能障碍的实验室检查异常不视为无症状的实验室检查异常。
无症状的淋巴细胞增多通常不应视为不良反应,出现此事件的患者可在医师指导下继续服用本品。
与CYP3A4抑制剂或诱导剂联合使用本品尚未开展药物相互作用临床研究。
联用CYP3A4抑制剂或诱导剂时应当谨慎。
应避免与强和中度CYP3A4抑制剂或诱导剂联用。
特殊人群用药肝功能不全轻度肝功能不全患者不建议进行剂量调整。
Cobimetinib中文说明书

Cobimetinib 中文说明书【药物名】Cobimetinib【商品名】Cotellic【美国初次批准】2015年11月10日【类别】蛋白激酶抑制剂【靶点】MEK【分子结构】分子式:C46H46F6I2N6O8 (2C21H21F3IN3O2 ·C4H4O4) 分子量为:1178.71【生产公司】罗氏子公司基因泰克【适应症】Cotellic联合威罗菲尼用于BRAF V600E或V600K突变的不可切除或转移性的黑色素瘤患者的治疗。
使用限制:不适用于野生型BRAF黑色素瘤患者的治疗。
【剂量和药物管理】(1)患者选择:患者存在BRAF V600E或V600K突变。
(2)推荐剂量:Cotellic的推荐剂量是在28天-疗程的第1-21天每天1次60 mg(3片,20mg/片)口服给药给药,直至疾病进展或不耐受;可与食物同时服用或不与食物同时服用;当丢失一剂量或因为呕吐丢失一剂量,则再当天无需服用额外剂量,下一剂量照常服用。
(3)与CYP3A抑制剂同时给药的剂量调整:避免中度/强度CYP3A抑制剂和Cotellic同时给药。
如对正在服用Cotellic 60 mg患者不可避免短期(14天或更短)内与中度CYP3A抑制剂同时服用,则减少Cotellic剂量至20 mg。
当停止中度CYP3A抑制剂给药后,可Cotellic剂量到60 mg。
使用另一种中度/强度CYP3A抑制剂时,减少Cotellic剂量至40 mg 或20 mg。
(4)根据不良反应进行剂量调整。
【剂型和规格】口服片剂:20 mg(每瓶63片),白色圆形的膜包衣片剂,在一侧凹陷处标记有“COB”;NDC 50242-717-01【禁忌症】无。
【警告和注意事项】(1)原发恶性肿瘤:Cotellic可引发皮肤恶性肿瘤和非皮肤恶性肿瘤。
密切监测患者的症状。
对皮肤恶性肿瘤:在治疗开始前和治疗中每2个月进行一次皮肤学评价并及时处理;当与威罗菲尼联合给药时,暂停Cotellic给药,并进行皮肤学监测6个月。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 4 56 7 来自* Sections or subsections omitted from the Full Prescribing Information are not listed.
_______________________________________________________________________________________________________________________________________
HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use BOSULIF safely and effectively. See full prescribing information for BOSULIF. BOSULIF® (bosutinib) tablets, for oral use Initial U.S. Approval: 2012 ----------------------------RECENT MAJOR CHANGES------------------------Dosage and Administration, Recommended Starting Dosage with Hepatic Impairment or Renal Impairment (2.7) 11/2014 Warnings and Precautions, Renal Toxicity (5.5) 11/2014 ----------------------------INDICATIONS AND USAGE-------------------------BOSULIF is a kinase inhibitor indicated for the treatment of adult patients with chronic, accelerated, or blast phase Ph+ chronic myelogenous leukemia (CML) with resistance or intolerance to prior therapy. (1) ----------------------DOSAGE AND ADMINISTRATION--------------------- Recommended Dose: 500 mg orally once daily with food. (2.1) Consider dose escalation to 600 mg daily in patients who do not reach complete hematologic response by week 8 or complete cytogenetic response by week 12 and do not have Grade 3 or greater adverse reactions. (2.2) Adjust dosage for hematologic and non-hematologic toxicity. (2.3, 2.4) Adjust dosage for hepatic and renal impairment. (2.7) ---------------------DOSAGE FORMS AND STRENGTHS--------------------Tablets: 100 mg and 500 mg. (3) -------------------------------CONTRAINDICATIONS---------------------------Hypersensitivity to BOSULIF. (4)
----------------------WARNINGS AND PRECAUTIONS----------------------- Gastrointestinal Toxicity: Monitor and manage as necessary. Withhold, dose reduce, or discontinue BOSULIF. (2.3, 5.1) Myelosuppression: Monitor blood counts and manage as necessary. (2.4, 5.2) Hepatic Toxicity: Monitor liver enzymes at least monthly for the first three months and as needed. Withhold, dose reduce, or discontinue BOSULIF. (2.3, 5.3) Fluid Retention: Monitor patients and manage using standard of care treatment. Withhold, dose reduce, or discontinue BOSULIF. (2.3, 5.4) Renal Toxicity Monitor patients for renal function at baseline and during therapy with BOSULIF (5.5) Embryofetal Toxicity: May cause fetal harm. Females of reproductive potential should avoid becoming pregnant while being treated with BOSULIF. (5.6) ------------------------------ADVERSE REACTIONS-----------------------------Most common adverse reactions (incidence greater than 20%) are diarrhea, nausea, thrombocytopenia, vomiting, abdominal pain, rash, anemia, pyrexia, and fatigue. (6) To report SUSPECTED ADVERSE REACTIONS, contact Pfizer Inc. at 1 800-438-1985 or FDA at 1-800-FDA-1088 or /medwatch. ------------------------------DRUG INTERACTIONS------------------------------ CYP3A Inhibitors and Inducers: Avoid concurrent use of BOSULIF with strong or moderate CYP3A inhibitors and inducers. (2.5, 2.6, 7.1, 7.2) Proton Pump Inhibitors: May decrease bosutinib drug levels. Consider short-acting antacids in place of proton pump inhibitors. (7.2) See 17 for PATIENT COUNSELING INFORMATION and FDAapproved patient labeling Revised: 11/2014
1
Reference ID: 3664292
FULL PRESCRIBING INFORMATION
1 INDICATIONS AND USAGE BOSULIF is indicated for the treatment of adult patients with chronic, accelerated, or blast phase Philadelphia chromosome-positive (Ph+) chronic myelogenous leukemia (CML) with resistance or intolerance to prior therapy. DOSAGE AND ADMINISTRATION 2.1 Recommended Dosing The recommended dose and schedule of BOSULIF is 500 mg orally once daily with food. Continue treatment with BOSULIF until disease progression or patient intolerance. If a dose is missed beyond 12 hours, the patient should skip the dose and take the usual prescribed dose on the following day. 2.2 Dose Escalation Consider dose escalation to 600 mg once daily with food in patients who do not reach complete hematological response (CHR) by week 8 or a complete cytogenetic response (CCyR) by week 12, who did not have Grade 3 or higher adverse reactions, and who are currently taking 500 mg daily. 2.3 Dose Adjustments for Non-Hematologic Adverse Reactions Elevated liver transaminases: If elevations in liver transaminases greater than 5×institutional upper limit of normal (ULN) occur, withhold BOSULIF until recovery to less than or equal to 2.5×ULN and resume at 400 mg once daily thereafter. If recovery takes longer than 4 weeks, discontinue BOSULIF. If transaminase elevations greater than or equal to 3×ULN occur concurrently with bilirubin elevations greater than 2×ULN and alkaline phosphatase less than 2×ULN (Hy’s law case definition), discontinue BOSULIF [see Warnings and Precautions (5.3)]. Diarrhea: For NCI CTCAE Grade 3-4 diarrhea (increase of greater than or equal to 7 stools/day over baseline/pretreatment), withhold BOSULIF until recovery to Grade less than or equal to 1. BOSULIF may be resumed at 400 mg once daily [see Warnings and Precautions (5.1)]. For other clinically significant, moderate or severe non-hematological toxicity, withhold BOSULIF until the toxicity has resolved, then consider resuming BOSULIF at 400 mg once daily. If clinically appropriate, consider reescalating the dose of BOSULIF to 500 mg once daily. 2.4 Dose Adjustments for Myelosuppression Dose reductions for severe or persistent neutropenia and thrombocytopenia are described below (Table 1). Table 1:
