人教版九年级上册化学 第三单元 物质构成的奥秘 知识点复习总结
人教版九年级上册化学第三单元知识点汇总

第三单元物质构成的奥秘一、分子与原子1、分子与原子的定义:分子:保持物质化学性质的最小粒子原子:化学变化中的最小粒子2、分子与原子的性质(1)质量和体积都很小(2)都在不停地做无规则运动(3)粒子之间都存在间隔(4)同种粒子化学性质相同3、区别与联系本质区别:在化学变化中,分子可分,原子不可分联系:分子由原子构成,分子和原子都是构成物质的粒子4、分子运动探究实验(1) 实验原理酚酞溶液遇碱变红;浓氨水具有挥发性(2)实验操作如下图所示,在A 、B 两个小烧杯中分别倒入适量的酚酞溶液,在C 小烧杯中加入适量的浓氨水,再用一个大烧杯把A 、C 两个小烧杯罩住,B 小烧杯置于大烧杯外,观察实验现象。
(3)实验现象A 烧杯中的酚酞溶液自上而下逐渐变红。
(4)实验结论分子在不停地运动。
5、从微观角度分析现象(物质、元素用于宏观角度;分子、原子、离子用于微观角度)(1) 物理变化与化学变化物理变化:没有新分子生成的变化化学变化:有新分子生成的变化(2) 纯净物与化合物纯净物:由同一种分子构成化合物:由不同种分子构成(3) 化学变化的本质在化学变化中,分子裂变成原子,原子再重新组合,形成新的分子。
二、原子的构成1、原子结构核电荷数=质子数=核外电子数=原子序数2、相对原子质量121)kg ()kg (⨯=标准碳原子的质量一个原子的实际质量相对原子质量原子的质量集中在原子核上,核外电子的质量几乎可以忽略不计;所以 中子数质子数相对原子质量+≈三、元素1、元素的定义具有相同核电荷数(质子数)的一类原子的总称2、元素分类元素可分为金属元素和非金属元素金属元素:最外层电子数一般少于4,容易失去电子(氢除外)形成阳离子非金属元素:最外层电子数一般大于4,容易得到电子形成阴离子稀有气体元素:最外层电子数等于8(氦的最外层电子数为2),化学性质稳定。
(1) 地壳中含量最高的非金属元素:氧(2) 地壳中含量最高的金属元素:铝(3) 生物细胞中含量最高的非金属元素:氧(4) 人体中含量最高的金属元素:钙3、元素符号(1)元素符号的由来元素符号用元素的拉丁文名字的第一个字母表示,如果第一个字母相同,则再附加一个小写字母加以区分。
九年级化学第三单元《物质构成奥秘》知识点(人教版)

第三单元《物质构成奥秘》知识点一、分子与原子化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
二、原子的结构1、原子的构成(1)原子是化学变化中的最小粒子。
(2)原子由带正电的原子核和带负电的电子构成,原子核由带正电的质子和不带电的中子构成,核电荷数=核内质子数=原子序数=核外电子数(在原子中)。
(3)原子的质量、体积很小,原子在不断地运动,原子间存在一定的间隔(和分子性质一样)。
(4)相对原子质量:以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所等到的比。
原子的质量主要集中在原子核上。
相对原子质量≈质子数+中子数。
2、元素(1)元素:具有相同核电荷数(即核内质子数)的一类原子的总称。
(决定元素种类的是核电荷数或核内质子数。
)地壳中含量最多的元素:氧、硅、铝、铁、钙;生物细胞中含量最多元素:氧、碳(2)元素的分类。
金属元素、非金属元素、稀有气体元素。
(3)元素符号①每种元素都用一个国际通用的符号来表示,这种符号叫做元素符号。
②元素符号表示的意义:表示一种元素、表示这种元素的一个原子。
(由原子直接构成的物质元素符号可以表示一种物质。
)比如:N 表示氮元素(宏观),也可以表示一个氮原子(微观)而Fe 表示铁元素,也可以表示一个铁原子;还可以表示铁这种物质如果表示几个原子或者分子、离子就在符号左边加个数字:5N 表示5个氮原子这时候就只有一个微观意义了由原子直接构成的物质:金属元素,稀有气体;非金属固体(4)元素周期表①根据元素的原子结构和性质,把它们科学有序地排列起来就得到了元素周期表。
②元素周期表有7个横行,18个纵行,7个周期,16个簇。
3、离子(1)离子是带电的原子或离子团,离子也是构成物质的一种粒子。
(2)核外电子的排布。
金属元素原子最外层电子一般少于4个,化学反应中很容易失去电子,从而带正电形成阳离子;非金属元素原子最外层电子一般多于4个,化学反应中很容易得到电子,从而带负电形成阴离子;稀有气体原子最外层具有8个(He为2个电子)的相对稳定结构。
第三单元物质构成的奥秘知识点总结---2024-2025学年九年级化学人教版上册

第三单元物质构成的奥秘课题1、分子和原子一、基本概念1、分子:由分子构成的物质,分子是保持其化学性质的最小粒子2、原子:原子是化学变化中的最小粒子二、分子的性质⒈通常,分子的质量和体积都很小。
(但真实存在)⒉分子总是在不断运动着。
(加热时,分子能量大,运动速率越快)⒊分子间是有间隔的。
(通常,相同质量的同一种物质的间隔气态>液态>固态,但冰中分子间隔>水中分子间隔;物质的热胀冷缩指的就是分子间间隔受热增大,遇冷减小)4. 同种物质的分子化学性质相同,不同种物质的分子化学性质不同* 分子运动实验(P49页)解释A中烧杯现象原因:分子是不断运动的,浓氨水具有挥发性,C烧杯中的氨分子运动到A烧杯,与水结合成氨水,氨水显碱性,氨水使酚酞变红三、从分子角度分析解释生活中现象1、水蒸发为水蒸气,所占体积变大水蒸发过程中,水分子间隔变大2、墙内开花墙外可闻到花香分子在不断运动3、香水,汽油密封保存原因分子在不断运动4、湿衣服在夏天比在冬天干得快分子在不断运动,温度越高,分子能量大,运动的速率越快5、6000L氧气加压到40L的钢瓶中分子间有间隔,压强越大,间隔越小※考点原子间间隔:水银温度计,钢轨,电线四、分子可以分成原子1、用分子的观点解释物质的分类(1)纯净物:物质由同种分子构成(2)混合物:物质由不同种分子构成2、物质和分子的构成(1)构成物质的粒子有:分子,原子,离子注意:由原子直接构成的:金属、稀有气体、固态非金属硫,磷,碳,硅分子是由原子构成:水分子是由氢原子和氧原子构成;一个水分子是由一个氧原子和两个氢原子构成注意:分子前有个数,原子前必有个数,分子前无个数,原子前也无个数。
3、从分子角度解释物理变化和化学变化物理变化:由分子构成的物质,分子本身没有发生变化化学变化:由分子构成的物质,一种物质的分子变成其他物质的分子4、化学变化的微观实质及相关问题(1)从微观角度解释化学变化的实质:在化学变化中分子可以分成原子,原子又可以重新结合成新的分子。
人教版九年级化学初中化学第三单元物质构成的奥秘知识点总结

6、元素符号的书写:记住常用元素的元素符号。
7、元素的分类
(1)金属元素:组成的物质常温下基本全部为固态,Hg常温下为液态。
(2)非金属元素:组成的物质常温下有液态、固态、气态三种状态。
(3)稀有气体元素:组成的物质常温下都为气态。
8、元素周期表:七个周期,十六个族。同个周期电子层数相同;同个族最外层电子数相同,化学性质也相似。
3、元素、原子的区别和联系:
元素
原子
概念
具有相同核电荷数的一类原子的总称。
化学变化中的最小粒子。
区分
只讲种类,不讲个数,没有数量多少的意义。
既讲种类,又讲个数,有数量多少的含义。
使用范围
应用于描述物质的宏观组成。
应用于描述物质的微观构成。
举例
水中含有氢元素和氧元素。即水是由氢元素和氧元素组成的。
如一个水分子是由两个氢原子和一个氧原子构成的。
第三单元 物质构成的奥妙
一、分子
1、定义:由分子构成的物质,分子是保持物质化学性质的最小粒子。
2、分子的特征:
(1)分子的质量பைடு நூலகம்体积都很小。
(2)分子总是在不停地做运动。温度越高,分子的运动速率就越快。
(3)分子间有间隔。气态分子间的间隔较大。
二、原子
1、定义:原子是化学变化中的最小粒子。
2、化学变化的实质:分子的破裂和原子的重新组合。
无数多个同种分子构成物质,构成物质的粒子有几种?(三种:分子、原子、离子)
三、原子的结构:原子由原子核和核外电子构成。
原子核(带+电荷)包括质子(1个质子带1个单位正电荷)和中子(不带电)
九年级化学上册《物质构成的奥秘》知识点

第三单元 《物质构成的奥秘》知识点一、分子和原子1、分子(1)物质分别是由分子、原子、离子三种微粒构成的,其中分子又是由原子构成的。
物质由元素组成。
如:水分子是由氢原子、氧原子组成;而水分子构成了水;(2)分子的特点:① 分子在不断地运动;如:在厨房炒菜,在其他地方可以闻到香味。
② 分子之间有间隙;如:100ml 酒精加100ml 水得到的溶液小于200ml 。
③ 分子的体积和质量都非常小;如:1ml 水中大约有1.67×1021 个水分子。
注:说明分子在运动的离子很多,比如能闻到的各种香味,就是各种分子在空气中不停的运动造成。
分子间有间隔的例子有:气体可以压缩存于钢瓶中,气体热胀冷缩的额现象。
2、原子分子可以分为原子。
由此我们便知道原子的性质和分子很相似。
(1)原子:原子是化学变化中的最小粒子。
(2)原子的性质:① 原子的质量和体积都很小;这点和分子很相似。
② 原子总是不停的运动着;和分子一样。
③ 原子之间有间隔。
和分子一样。
3、分子和原子的区别与联系(1)分子是有原子构成。
所以如果论等级,分子是原子的“上司”(2)分子和原子的根本区别:在化学变化中,分子可以再分,而原子不能再分。
(3)化学变化的实质是:分子破裂成原子,原子不破裂,但可以重新组合成新的分子。
(4)物质的温度越高,分子运动的程度越剧烈。
同种物质,一般情况下气态时分子之间的间隙最大,固态时分子之间的间隙最小。
(5)化学反应前后,元素的种类不变,原子的种类不变,各种原子的原子个数不变。
二、原子的结构(1)原子结构示意图的认识(2)在原子中核电荷数=质子数=核外电子数决定元素种类 质子数(核电荷数)(3)原子的质量主要集中在 原子核 上 (4)三决定 决定元素化学性质 最外层电子数(4)相对原子质量≈质子数+中子数 决定原子的质量 原子核 说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)(5)离子:带电的原子或原子团a. 表示方法及意义:如Fe 3+ :一个铁离子带3个单位正电荷b. 离子结构示意图的认识*原子数≠电子数为离子结构示意图c. 同种元素的原子与离子比较:① 质子数相等② 电子数及最外层电子数不同,③ 电子层数可能相同三、元素(1)定义:具有相同核电荷数(质子数)的一类原子的总称一种元素与另一种元素的本质区别:质子数不同注意:由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
人教版九年级化学上册 第三单元《物质构成的奥秘》知识点归纳

1 一、构成物质的微粒:分子、原子、离子1、由原子直接构成的物质:金属单质:如:铁、铜、银 等 固态非金属单质(碘除外):如:碳(C )、硅(Si )、硫(S )、磷(P )稀有气体:如:氦气(He )、氖气(Ne )、氩气(Ar ) 等2、由分子直接构成的物质:水、过氧化氢和大部分的气体(稀有气体除外)3、由离子直接构成的物质:例如:氯化钠 NaCl 、氯化镁MgCl 2、 硫酸铜 CuSO 4 等二、分子1、 定义:由分子构成的物质,分子是保持物质化学性质的最小粒子。
2、 分子的性质: (1)分子的质量和体积都很小。
(2)分子在永不停息的做无规则运动,且温度越高,运动速率越快。
(3)分子之间有间隔,气态物质的分子间隔大,液态、固态物质的分子间隔小。
(4)分子可直接构成物质,同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
3、 分子观点解释物理变化和化学变化——是否生成新分子(1)发生物理变化时,分子本身没有变化,只是分子间的间隔发生变化。
(2)发生化学变化时,分子破裂成原子,原子重新组合成新的分子或物质。
(分子种类变了,原子种类不变。
)4、 分子观点解释纯净物和混合物纯净物:同种分子构成 混合物:不同种分子构成三、原子1、 定义:原子是化学变化中的最小粒子。
(化学变化中,分子可分,原子不可再分)2、 原子的性质:小、动、间、同。
3、 原子可以构成分子,也可以直接构成物质。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子或物质。
(分子的再分,原子的重新组合)四、原子的结构1、 原子的构成质子(+)原子核(+) 原子 中子(不带电)(不显电性) 核外电子2、原子结构规律: (1)不是所有原子都有中子(氢原子无中子)。
(2)原子中质子数和中子数不一定相等。
(3)不同种类的原子,质子数不同。
(4)同一原子中:核电荷数=质子数=核外电子数(=原子序数)(5)原子不显电性。
(质子数=核外电子数)3 、原子核体积小,却集中了几乎整个原子的质量。
最新人教版_九年级化学上册_第三单元_物质构成的奥秘_知识点总结

第三单元物质构成的奥秘考点1分子1、概念:分子是保持物质化学性质最小的粒子。
1“最小粒子”是指构成这种物质的最小粒子,而不是粒子最小。
因为分子还可以分解成原子,原子还可以再分。
2分子只能保持物质的化学性质,不能保持其物理性质。
因为一些物理性质是由大量分子聚集表现出来的,单个分子不能表现其物理性质。
2、分子的特点:①分子总是在不停的运动,且温度越高,分子运动越快。
②分子的质量、体积都很小。
③分子间有间隔,且分子间隔受热增大,遇冷缩小。
一般地,同种物质不同状态的分子间间隔大小:气态>液态>固态利用①③两条特点可以解释:热胀冷缩、分子扩散、蒸发、物质三态间的变化、气体压缩等。
3、同种物质的分子化学性质相同,不同种物质的分子化学性质不同。
考点2原子1、概念:原子是化学变化中最小的粒子。
1这里的最小粒子是指原子在化学变化中不能再分2、化学变化的实质:在化学变化中,分子分裂成原子,原子重新组合成新的分子或物质。
3、分子与原子的比较分子原子概念保持物质化学性质最小的粒子化学变化中最小的粒子特点1分子、原子的体积、质量都很小2分子、原子总是在不停的运动3分子间、原子间有一定的间隔实例水H2O、氢气H2铁Fe、硅Si、金刚石C、汞Hg主要区别在化学变化中分子还可以再分,原子不可以再分相互联系分子是由原子构成的,在化学变化中,分子分裂成原子,原子重新组合成新的分子。
考点3运用分子、原子观点解释有关现象1、物理变化和化学变化物质变化概念主要特征微观结构举例物理变化没有生成其他物质的变化没有其他物质生成分子、原子都不变水蒸发变成水蒸汽化学变化生成其他物质的变化有其他物质生成分子种类改变、原子种类不变水电解生成氧气和氢气2、纯净物和混合物1同种分子构成的物质叫纯净物。
纯净物的组成、性质固定。
2由不同种分子构成的物质叫混合物。
混合物的组成不固定,混合物中各物质保持各自的性质。
3、注意:物质的宏观组成用元素来描述,物质的微观构成用粒子(分子、原子、离子)来描述。
人教版2023初中化学九年级化学上册第三单元物质构成的奥秘知识点总结(超全)

人教版2023初中化学九年级化学上册第三单元物质构成的奥秘知识点总结(超全)单选题1、从分子的角度分析,下列解释不合理的是A.品红在水中扩散,说明分子在不断运动B.水受热变为水蒸气体积变大,说明分子的大小随温度的升高而增大C.将氧气压缩贮存于钢瓶中,说明分子之间有间隔D.H2在Cl2中燃烧生成HCl,说明化学变化中分子发生改变答案:BA. 品红在水中扩散,是因为水分子和品红分子均在不断运动,可以说明分子在不断运动,正确。
B. 水受热变为水蒸气体积变大,说明分子的间隔随温度的升高而增大,错误。
C. 将氧气压缩贮存于钢瓶中说明分子之间有间隔,气体分子间间隔较大易于压缩。
正确。
D. H2在Cl2中燃烧生成HCl,反应前后分子发生了改变,说明化学变化中分子发生改变,正确。
故选:B。
2、“化学”一词最早出于清朝的《化学鉴原》一书,该书把地壳中含量第二的元素翻译成“矽(xi)”,如今把这种“矽”元素命名为A.硒B.硅C.铝D.锡答案:B地壳中元素含量由多到少依次为:氧、硅、铝、铁,地壳中含量第二的元素是硅,翻译成“矽(xi)”,如今把这种“矽”元素命名为硅;故选:B。
3、如图是几种微粒的结构示意图,根据图示判断以下说法不正确的是A.B元素属于金属元素B.A与C元素具有相似的化学性质C.C原子在化学反应中容易失去两个电子形成阳离子D.B、C、D元素位于同一周期答案:BA、B质子数为11,属于钠元素,属于金属元素,A正确。
B、A为稀有气体氦原子结构示意图,化学性质稳定,C最外层2个电子,容易失去两个电子,A与C元素不具有相似的化学性质,B错误。
C、C原子最外层2个电子,在化学反应中容易失去两个电子形成阳离子,C正确。
D、B、C、D元素原子都是核外三个电子层,位于同一周期,D正确。
故选:B。
4、制造北斗三号卫星使用了钛合金材料,钛原子的质子数为22,相对原子质量为48,则钛原子的核外电子数为A.22B.48C.70D.26答案:A质子数=原子的核外电子数=22。
人教版九年级化学上册 第三单元:《物质构成的奥秘》知识点总结
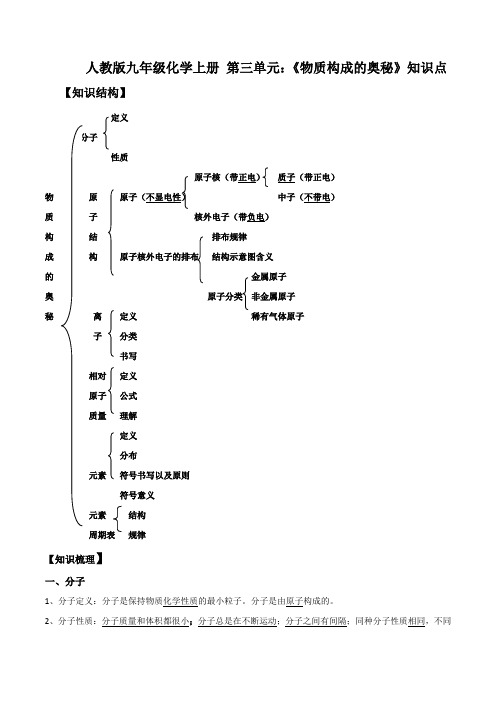
人教版九年级化学上册第三单元:《物质构成的奥秘》知识点【知识结构】定义性质原子核(带正电)质子(带正电)物原中子(不带电)质子核外电子(带负电)构结排布规律成构结构示意图含义的金属原子奥非金属原子秘离定义稀有气体原子子分类书写相对定义原子公式质量理解定义分布元素符号书写以及原则符号意义元素结构规律【知识梳理】一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子本身没有发生变化,分子的化学性质不变。
化学变化:分子本身发生变化,生成了新的分子,不再保持原分子的化学性质。
典例1 建立宏观和微观之间的联系对学习化学十分重要。
下列宏观事实的微观解释错误的是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mL H2O与10mL C2H5OH混合后体积小于20mL﹣﹣分子间有间隔【答案】B【解析】A、品红在水中扩散,是因为品红分子是在不断的运动的,运动到水分子中间去了,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,故选项解释错误。
C、NO与NO2化学性质不同,是因为它们分子的构成不同,不同种的分子化学性质不同,故选项解释正确。
D、10mL H2O与10mL C2H5OH混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确。
故选:B。
典例2下列关于分子和原子的说法,错误的是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子可以分成原子,原子又可以结合成新的分子D.分子和原子之间都有间隔,分子之间间隔较大,原子之间间隔较小【答案】D【解析】A、分子、原子和离子都是构成物质的微粒,故A正确;B、由分子构成的物质,分子是保持其化学性质的最小微粒,故B正确;C、在化学变化中,分子分成原子,原子再重新结合成新的分子,原子是在化学变化中不能再分的最小微粒,故正确.D、分子和原子之间都有间隔,分子之间的间隔不一定比原子间的间隔大,故D错误;故选D。
初中九年级《化学》第三单元物质构成的奥秘重要知识点梳理

第三单元物质构成的奥秘1.分子(1)概念:分子是保持物质化学性质的最小粒子。
分子只能保持物质的化学性质,不能保持物理性质。
如冰、水、水蒸气的构成粒子都是H2O分子,它们的物理性质不同,但化学性质相同。
(2)性质:①分子很小(质量小、体积小);②分子在不停地运动(温度越高,分子能量越大,分子运动越快);③分子间有间隔[其他条件相同时,温度越高分子间隔越大(热胀冷缩的原因);压强越大分子间隔越小]。
物质挥发、扩散、溶解等现象说明分子在不停地运动。
酒精与水混合后的总体积比两者体积之和略小、气体易被压缩等现象说明分子间有间隔。
(3)构成:分子是由原子构成的(描述具体分子的构成时原子要具体化。
如果指明一个(或每个)分子,则后面原子也要根据化学式说明相应原子的个数)。
如水(H2O)可以描述为:“水分子是由氢原子和氧原子构成的”或“一个水分子是由两个氢原子和一个氧原子构成的”。
过氧化氢(H2O2)可以描述为:“过氧化氢分子是由氢原子和氧原子构成的”或“每个过氧化氢分子是由2个氢原子和2个氧原子构成的”。
(4)应用:由同种分子构成的物质是纯净物(如冰水共存物都是由H2O分子构成的,是纯净物);由不同种分子构成的物质是混合物(如空气是由氮分子、氧分子、二氧化碳分子等构成的,是混合物)。
2.原子(1)概念:原子是化学变化中的最小粒子。
(2)化学变化(即化学反应)的本质是原子的重新组合。
在化学反应前后,原子的种类和数目都不变,元素的种类也不变(即元素守恒),但分子的种类一定发生改变(生成新物质)。
分子在化学反应中发生变化的过程为:分子(3)结构:①原子由原子核与核外电子构成,原子核由质子和中子构成(有一种氢原子没有中子)。
1个质子带1个单位正电荷,1个电子带1个单位负电荷,中子不带电。
核电荷数=质子数=原子的核外电子数=原子序数②相对原子质量:以1个碳12原子质量的1/12为标准,其他原子的质量与它相比较所得到的比,单位为1。
人教版九年级上册化学第三单元物质构成的奥秘总结

物质构成的奥秘课题1 分子和原子1.物质由微观粒子构成(1)物质是由分子、原子、离子等微观粒子构成的。
微观粒子都是真实存在的。
现在通过先进的科学仪器能够观察到一些分子和原子,还能移动原子。
(2)分子的性质①分子的质量和体积都很小。
例如,1个水分子的质量约为3×10-26 kg,一滴水(以20滴水为1 mL计)中大约有1.67×1021个水分子;①分子总是在不断地运动。
例如,花香在空气中扩散、湿衣服中的水在晾晒下的挥发、品红在水中扩散都是分子运动的结果;①分子之间有间隔。
例如,气体可压缩在钢瓶中、物质的“热胀冷缩”现象、相同质量的同种物质在固态、液态和气态时所占的体积不同。
2.分子可以分为原子(1)用分子观点解释化学变化和物理变化物理变化:在物理变化中,分子本身没有发生改变,只是分子间的间隔发生变化;化学变化:在化学变化中,物质的分子发生了改变,变成其他物质的分子。
(2)由分子构成的物质,分子是保持其化学性质的最小粒子。
(3)分子由原子构成。
有些分子由同种原子构成,如1个氧分子由2个氧原子构成;大多数分子由两种或两种以上原子构成,如1个二氧化碳分子由1个碳原子和2个氧原子构成。
(4)化学变化的实质:由分子构成的物质在发生化学变化时,分子可以分成原子,原子又可以结合成新的分子。
(5)根据化学变化的实质可知,原子是化学变化中的最小粒子,,即在化学变化中原子不可再分。
(6)分子与原子的关系课题2 原子的结构1.原子的构成(1)原子的构成:原子是由位于原子中心的原子核和核外电子构成的。
原子核是由质子和中子构成的。
每个质子带1个单位的正电荷,每个电子带1个单位的负电荷,中子不带电。
{⎧⎪⎨⎪⎩质子(每个质子带1个单位的正电荷)原子核原子中子(不带电)核外电子(每个电子带1个单位的负电荷) (2)质子数、 核电荷数和核外电子数之间的关系:原子核内质子所带电荷与核外电子的电荷数量相等,但电性相反,因此,原子不显电性。
人教版九年级上册 第三单 物质构成的奥秘 单元复习知识点总结归纳

第三单元物质构成的奥秘课题1 分子和原子构成物质的微粒有:分子、原子、离子一、分子定义:分子是保持物质化学性质的最小粒子。
1、基本性质(也叫特征或者特点):⑴质量、体积都很小;⑵分子在不断地运动。
(且与温度有关。
温度越高,运动速率越快)⑶分子间存在间隔。
同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
注意:同种物质间分子的性质相同,不同物质间分子的性质不同。
2、分子的构成:分子由原子构成。
3、从分子和原子角度来区别下列几组概念⑴物理变化与化学变化由分子构成的物质,发生物理变化时,只是分子间间隔发生变化,分子种类不变。
发生化学变化时,分子种类发生了改变。
⑵纯净物与混合物由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。
⑶单质与化合物单质的分子由同种原子构成;化合物的分子由不同种原子构成。
二、原子1、定义:原子是化学变化中最小的微粒。
例:氢原子、氧原子是电解水中的最小粒子3、化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
课题2 原子的结构一、原子的构成(1)原子结构(2)在原子中由于原子核所带的正电荷数与核外电子带的负电荷数(数值上等于核外电子数)相等,但电性相反,所以原子不显电性。
因此: 在原子中 :质子数 = 核电荷数 = 核外电子数 (原子核所带的正电荷数叫核电荷数) (3)原子的质量主要集中在原子核上 注意:①原子中质子数不一定等于中子数②并不是所有原子的原子核中都有中子。
例如:氢原子核中无中子 2、相对原子质量: ⑴⑵相对原子质量与原子核内微粒的关系:相对原子质量 = 质子数 + 中子数 二、核外电子的排布 原子结构图:①圆圈内的数字:表示原子的质子数 ②+:表示原子核的电性 ③弧线:表示电子层④弧线上的数字:表示该电子层上的电子数 三、离子1、概念:带电的原子或原子团2、分类及形成:阳离子(由于原子失去电子而形成)带正电阴离子(由于原子得到电子而形成)带负电3、表示方法:在元素符号右上角标明电性和电荷数,数字在前,符号在后。
人教版九年级上册化学 第三单元 物质构成的奥秘 知识点总结

课题一分子和原子一、物质由微观粒子构成1.物质是由分子、原子等微观粒子构成的。
2.分子的性质:(微观粒子均有以下几点性质)①分子的质量和体积很小。
②分子总是在不断运动的。
(温度越高,分子能量越高,分子运动速率越快)③分子间有间隔。
物质三态:固—液—气分子间隔:小→大(热胀冷缩)物质的三态变化,只是分子间间隔发生了改变,分子本身不变,分子本身的质量、大小均不变。
④同种分子性质相同,不同种分子性质不同。
3.用分子观点解释纯净物与混合物。
(例如:该物质由分子构成)纯净物:由一种分子构成的物质。
混合物:由两种或两种以上分子构成的物质。
二、分子可以分为原子1.分子、原子的定义及关系:⑴分子是保持物质化学性质的最小粒子。
(该物质由分子构成)注:①最小:不可再分,发生化学变化时可分。
②当物质由原子构成,原子保持该物质的化学性质。
⑵原子是化学变化中的最小粒子。
注:①最小:化学变化中不可再分,物理变化时可分。
⑶分子是由原子构成的。
原子可以构成分子,原子也可以直接构成物质。
①有些分子由同种原子构成。
②大多数分子由两种或两种以上原子构成。
③不同的分子、原子的质量和大小不能直接拿来比较。
同一分子中原子的质量和大小小于该分子。
④分子、原子的本质区别:在化学变化中,分子可分,原子不可再分。
⑤化学变化的实质:分子破裂成原子,原子重新组合构成新的分子。
2.用分子观点来解释物理变化与化学变化。
(该物质由分子构成)物理变化的实质:分子本身不变、分子间隔改变。
化学变化的实质:分子本身改变,分子间隔改变。
同:分子间隔都改变。
异:物理变化中分子不变。
物质在发生化学变化的过程中,会同时发生物理变化。
3.物质的构成:⑴⑵分子、原子都是构成物质的粒子。
4.物质构成分分类⑴分子构成的物质①常见气体(除稀有气体):氮气、氧气、氢气、氯气、二氧化碳、氯化氢、氨气、甲烷。
②某些液体:水、过氧化氢、乙醇③某些固体:五氧化二磷⑵原子构成的物质①金属:铜、铁、铝、银、汞②常温下呈固态的某些固态非金属:碳、磷、硫、硅③稀有气体:氦、氖、氩、氪、氙、氡。
人教版九年级化学上册第三单元物质构成的奥秘知识总结

二、分子可以分为原子
1.保持化学性质的是分子。
(分子是保持化学性质的最小粒子)
2.化学变化中分子可再分,而原子不可再分。
(原子是化学变化中的最小粒子)
层……第七层,离核越近的电子能量越低。
3.每层容纳的电子是有限的最多为:2·n2(n为电子层)
4.只有一个电子层的第一层就是最外层,不能超过2个电子。
有多个电子层的最外层不能超过8个电子、倒数第二层不能超过18个电子、倒数第三层不能超过32个电子。
1.同一族最外层电子数相同
2.周期数=电子层数
3.金属的原子最外层电子数一般少于4,化学变化中容易失去电子,有几个失几个。
4.非金属的原子最外层电子数一般大于4,化学变化中容易得到电子达到8电子稳定结构。
5.稳定结构:只有一个电子层的最外层电子数为2是稳定结构,有多个电子层的最外层电子数为8是稳定结构。
原子在化学变化中得失电子就是它的化学性质,原子的化学性质取决于最外层电子数.
化学性质相似,得失电子能力要相同。
人教版九年级化学上册第三单元:《物质构成的奥秘》知识点总结

人教版九年级化学上册第三单元:《物质构成的奥秘》知识点总结人教版九年级化学上册第三单元:《物质构成的奥秘》知识点【知识结构】定义分子性质原子核(带正电)质子(带正电)物原原子(不显电性)中子(不带电)质子核外电子(带负电)构结排布规律成构原子核外电子的排布结构示意图含义的金属原子奥原子分类非金属原子XXX定义稀有气体原子XXX分类书写相对定义原子公式质量理解定义分布元素符号书写以及原则符号意义元素结构周期表规律【知识梳理】一、分子1、分子定义:分子是保持物质化学性质的最小粒子。
分子是由原子构成的。
2、分子性质:分子质量和体积都很小;分子总是在不断运动;分子之间有间隔;同种分子性质相同,不同种分子性质不同。
3、物理变化:分子自己没有产生变化,分子的化学性质不乱。
化学变化:分子自己产生变化,天生了新的分子,不再保持原分子的化学性质。
典例1树立宏观和微观之间的接洽对研究化学十分重要。
下列宏观究竟的微观解释错误的选项是()A.品红在水中扩散﹣﹣分子在不断运动B.水蒸发由液态变成气态﹣﹣水分子发生改变C.NO与NO2化学性质不同﹣﹣构成物质的分子不同D.10mL H2O与10mL C2H5OH夹杂后体积小于20mL﹣﹣分子间有距离【答案】B【解析】A、XXX在水中扩散,是因为品红分子是在不断的运动的,运动到水分子中间去了,故选项解释正确。
B、水蒸发由液态变成气态,是因为水分子间的间隔发生了改变,故选项解释错误。
C、NO与NO 2化学性质不同,是因为它们分子的构成不同,不同种的分子化学性质不同,故选项解释正确。
D、10mL H2O与10mL C2H5OH混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释正确。
故选:B。
典例2下列关于分子和原子的说法,错误的选项是()A.分子和原子都可以构成物质B.由分子构成的物质,分子是保持其化学性质的最小粒子C.在化学变化中,分子能够分成原子,原子又能够结分解新的分子D.分子和原子之间都有距离,分子之间距离较大,原子之间距离较小【答案】D【解析】A、分子、原子和离子都是构成物质的微粒,故A正确;B、由分子构成的物质,分子是保持其化学性质的最小微粒,故B精确;C、在化学变化中,分子分成原子,原子再重新结合成新的分子,原子是在化学变化中不能再分的最小微粒,故精确.D、分子和原子之间都有间隔,分子之间的间隔不一定比原子间的间隔大,故D错误;故选D。
人教版初三化学上册第三单元物质构成的奥秘知识点总结

人教版初三化学上册第三单元物质构成的奥秘
知识点总结
化学物质包括元素、化合物(含其中添加剂,杂质),副产物,反应中间体和聚合物。
但不包括混合物、制品(剂),物品,下面是初中频道整理的物质构成的奥秘知识点,希望对大家有帮助。
一、分子和原子
分子原子区别在化学反应中可再分,构成分子中的原子重新组合成新物质的分子在化学反应中不可再分,化学反应前后并没有变成其它原子相似点
(1)都是构成物质的基本粒子
(2)质量、体积都非常小,彼此间均有一定间隔,处于永恒的运动中
想要了解更多详细知识点请点击人教版初三化学上册分子和原子知识点
二、原子的构成
1. 原子的构成
原子由原子核和电子构成,原子核由质子和中子构成。
2. 每个质子带一个单位正电荷,每一个电子带一个单位负电荷,中子不带电。
原子核所带的正电荷数为核电荷数。
电子的质量很小,可忽略不计,原子的质量主要集中在原子核上。
想要了解更多详细知识点请点击人教版初三化学上册原子的结构知识点
三、元素
(1)定义:具有相同核电荷数(质子数)的一类原子的总称
*一种元素与另一种元素的本质区别:质子数不同
注意:
*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
想要了解更多详细知识点请点击人教版九年级化学上册元素知识点
物质构成的奥秘知识点的全部内容就是这些,更多的精彩内容请点击初三化学知识点栏目了解详情,预祝大家在新学期可以更好的学习。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题一分子和原子
一、物质由微观粒子构成
1.物质是由分子、原子等微观粒子构成的。
2.分子的性质:(微观粒子均有以下几点性质)
①分子的质量和体积很小。
②分子总是在不断运动的。
(温度越高,分子能量越高,分子运动速率越快)
③分子间有间隔。
物质三态:固—液—气
分子间隔:小→大(热胀冷缩)
物质的三态变化,只是分子间间隔发生了改变,分子本身不变,分子本身的质量、大小均不变。
④同种分子性质相同,不同种分子性质不同。
3.用分子观点解释纯净物与混合物。
(例如:该物质由分子构成)
纯净物:由一种分子构成的物质。
混合物:由两种或两种以上分子构成的物质。
二、分子可以分为原子
1.分子、原子的定义及关系:
⑴分子是保持物质化学性质的最小粒子。
(该物质由分子构成)
注:①最小:不可再分,发生化学变化时可分。
②当物质由原子构成,原子保持该物质的化学性质。
⑵原子是化学变化中的最小粒子。
注:①最小:化学变化中不可再分,物理变化时可分。
⑶分子是由原子构成的。
原子可以构成分子,原子也可以直接构成物质。
①有些分子由同种原子构成。
②大多数分子由两种或两种以上原子构成。
③不同的分子、原子的质量和大小不能直接拿来比较。
同一分子中原子的质量和大小小于该分子。
④分子、原子的本质区别:在化学变化中,分子可分,原子不可再分。
⑤化学变化的实质:分子破裂成原子,原子重新组合构成新的分子。
2.用分子观点来解释物理变化与化学变化。
(该物质由分子构成)
物理变化的实质:分子本身不变、分子间隔改变。
化学变化的实质:分子本身改变,分子间隔改变。
同:分子间隔都改变。
异:物理变化中分子不变。
物质在发生化学变化的过程中,会同时发生物理变化。
3.物质的构成:
⑴
⑵分子、原子都是构成物质的粒子。
4.物质构成分分类
⑴分子构成的物质
①常见气体(除稀有气体):氮气、氧气、氢气、氯气、二氧化碳、氯化氢、氨气、甲烷。
②某些液体:水、过氧化氢、乙醇
③某些固体:五氧化二磷
⑵原子构成的物质
①金属:铜、铁、铝、银、汞
②常温下呈固态的某些固态非金属:碳、磷、硫、硅
③稀有气体:氦、氖、氩、氪、氙、氡。
课题二原子的结构
一、原子的构成
1.核电荷数:原子核所带的正电荷数。
2.原子不显电性的原因:原子核内质子所带正电荷数与核外电子所带负电荷数电量相同,电性相反。
在原子中:核电荷数 = 质子数 = 核外电子数 = 原子序数
3.原子的质量主要集中在原子核上。
电子质量很小忽略不计。
4.质子数决定了原子的种类。
5.不是所有的原子中都含有中子。
氢原子中无中子。
二、原子核外的电子排布
1.电子层:核外电子的运动空间。
最少一层,最多七层。
2.排布规律:
①电子总是先排在能量最低的电子层,然后再往能量较高的电子层排。
由内向外依次排布。
②各层电子最多容纳2n2个电子。
n为电子层数
③最外层电子数不能超过8个。
(第一层为最外层,则不超过2个)
3.原子结构示意图
4.1—18号元素的原子结构示意图
三、元素的性质与原子结构的关系
1.元素的分类:金属元素、非金属元素、稀有气体元素
2.相对稳定的结构:最外层达8个电子,只有一个电子层达2个电子的结构。
元素的种类原子最外层电子数得失电子倾向化学性质稀有气体元素8个(He为2个)不易得失相对稳定金属元素一般<4个易失去最外层电子活泼非金属元素一般≥4个最外层易得到电子活泼4.元素、原子性质与原子核外电子的排布,特别是与最外层电子数密切相关。
5.最外层电子数决定元素原子的化学性质。
(结构决定性质)
6.最外层电子数相同,化学性质相似。
不绝对(氦与镁)
四、离子
1.定义:带电的原子或原子团叫做离子。
常见的原子团OH-、NH4+、NO3-、SO42-、CO32-
2.离子的形成
3.阴阳离子的定义
阳离子:带正电荷的原子。
核电荷数>核外电子数
阴离子:带负电荷的原子。
核电荷数<核外电子数
4.原子与离子的关系
5.离子的表示方法:在元素符号的右上角标明离子所带的电荷,且数
值在前,正负号在后,带一个单位正电荷或负电荷时“1”省略不写,如阳离子:Na+、Mg2+、Ca2+、Al3+阴离子:F-、Cl-、O2-、S2-。
离子符号右上角的数字表示一个离子所带的电荷数。
6.物质的构成
离子构成的物质(在化合物中如果有金属元素或铵根离子则该物质由离子构成)例如:氯化钠、硫酸铜、硝酸铵
五、相对原子质量(符号Ar)
1.定义:以一种碳原子(碳12)质量的1/12为标准,其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量。
单位是“1”省略不写,单位不是g。
计算结果取整数。
特例:氯35.5、铜64
碳原子的质量 1.993×10-26kg
碳原子质量的1/12 1.66×10-27kg ——标准
氧原子的质量2.657×10-26kg,求氧原子的相对原子质量?
氢原子的质量1.674×10-27kg,求氢原子的相对原子质量?
质子的质量1.6726×10-27kg,求质子的相对原子质量?
中子的质量1.6749×10-27kg,求中子的相对原子质量?
3.相对原子质量=质子数 + 中子数
4.某离子R m-,有n个中子,a个电子,则其相对原子质量是。
5.已知A3+的核电荷数数a,与B2-的核外电子排布相同,求B2-的核内质子数为。
课题三元素
一、元素
1.定义:质子数(即核电荷数)相同的一类原子的总称。
2.元素的种类由质子数(即核电荷数)决定。
3.元素是一个宏观概念。
只讲种类,不讲个数。
4.元素用于描述物质的组成。
5.在化学反应前后原子的种类不变,元素也不会改变。
6.元素的分类:①金属元素②非金属元素③稀有气体元素
7.元素的含量
①目前发现的元素有一百多种。
②地壳中含量前五位:氧O、硅Si、铝Al、铁Fe、钙Ca
地壳中含量最多的非金属元素是氧O, 地壳中含量最多的金属元素是铝Al,他们组成的物质叫做三氧化二铝,它的化学式Al2O3。
③生物细胞中含量前五位:氧O、碳C、氢H、氮N、钙Ca
④空气中含量前两位:氮N、氧O
8.元素的化学性质由最外层电子数决定。
9.物质的组成、构成
二、元素符号
1.书写原则:一大二小。
2.记住一些常见的元素符号
⑴1—20号元素
氢H、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca ⑵常见金属元素
钾K、钙 Ca、钠 Na、镁 Mg、铝 Al、锌Zn、铁Fe、锡Sn、铅Pb、铜Cu、汞Hg、银Ag、铂Pt、金 Au
3.元素符号的意义:
①表示一种元素。
宏观意义。
②表示这种元素的一个原子。
微观意义。
元素符号均有①、②两点意义。
③表示某物质(该物质由原子构成)。
宏观意义。
★金属、稀有气体、碳C磷P硫S硅Si等还有第③点意义。
N的意义:①氮元素、②(一个)氮原子。
Fe的意义:①铁元素、②(一个)铁原子、③铁。
4.元素符号前添加数字,只有微观意义,表示几个某原子。
2H:两个氢原子。
2Fe:两个铁原子。
5.离子符号前面的数字,表示离子的个数。
离子符号右上角的数字,表示一个离子所带的电荷数。
2Mg2+ 前面2的意义:两个镁离子。
右上角2的意义:一个镁离子带两个单位的正电荷。
一、元素周期表
1.按元素原子核电荷数递增的顺序给元素编号,叫原子序数,原子序数在数值上等于核电荷数。
2.每一横行叫做一个周期,共七个横行,七个周期。
①元素原子核外电子层数,决定元素所在周期数。
②同一周期元素原子核外电子层数相同,原子最外层电子数呈周期性变化。
从1增加到8。
第二周期的有第三周期的有
3.每一纵行叫做一个族,共18个纵行,16个族,其中8、9、10纵行合为一个族。
①元素原子核外最外层电子数决定元素所在族数。
②同一族元素原子最外层电子数相同,原子核外电子层数依次递增。
4.元素周期表的一格相对原子质量。
