血液病中的融合基因
PCR融合基因跟BCR关系

PCR融合基因跟BCR关系引言PCR(聚合酶链式反应)融合基因是一种常见的分子生物学技术,用于将两个或多个DNA片段连接在一起形成一个融合基因序列。
BCR(白血病融合基因)是一类与白血病相关的融合基因。
本文旨在探讨PCR融合基因与BCR之间的关系,以及其在白血病研究中的应用。
PCR融合基因与BCR之间的关系PCR融合基因是通过PCR技术将两个或多个DNA片段连接起来形成一个融合基因。
这种融合基因可以起源于不同的DNA分子,也可以是同一分子的两个不同区域。
BCR是一类与白血病相关的融合基因,其中最为常见的是Ph染色体的t(9;22)转座产生的BCR-ABL融合基因。
这个融合基因是慢性髓性白血病(CML)和一部分急性淋巴细胞白血病(ALL)的主要致病因子。
在Ph染色体的t(9;22)转座事件中,BCR基因位于染色体22上,ABL基因位于染色体9上。
转座事件导致BCR和ABL基因融合在一起,形成BCR-ABL融合基因。
BCR-ABL融合基因产生的转录产物具有激活ABL酪氨酸激酶活性的能力,进而促进细胞无限增殖和抑制凋亡。
这种异常的信号通路激活促进了白血病细胞的生长和存活,并最终导致白血病的发展。
PCR融合基因与BCR在白血病研究中的应用PCR融合基因的检测方法,特别是BCR-ABL融合基因的检测方法,在白血病的诊断和治疗中起到了重要的作用。
1. 白血病诊断通过对患者样本中的DNA进行PCR扩增,可以检测到BCR-ABL融合基因的存在与否。
这种检测方法通常用于白血病的早期诊断和鉴别诊断。
通过检测BCR-ABL融合基因的存在,可以确定是否存在Ph染色体的t(9;22)转座事件,从而确诊患者是否患有白血病。
2. 白血病治疗BCR-ABL融合基因是白血病的致病因子,因此针对BCR-ABL基因的治疗是白血病治疗的重要策略之一。
靶向BCR-ABL基因的药物,例如伊马替尼等酪氨酸激酶抑制剂,可以抑制BCR-ABL基因产生的异常的信号通路,从而抑制白血病细胞的增殖和生存。
白血病融合基因检测项目

白血病融合基因检测项目白血病融合基因检测项目是一项重要的检测手段,用于帮助医生确定白血病患者的疾病类型和治疗方案。
白血病是一种常见的血液肿瘤,其病因复杂,其中一种重要的机制是融合基因的形成。
融合基因是指在白血病发生过程中,由于染色体重排等基因突变导致两个或多个基因片段融合在一起形成新的基因。
这些融合基因的形成会改变正常的基因调控机制,进而导致异常的细胞增殖和分化,从而促进白血病的发生和发展。
白血病融合基因检测项目通过检测白血病患者体内的基因片段融合情况,可以帮助医生做出精准的诊断和治疗方案选择。
该检测项目主要包括以下几个方面:1. 基因片段融合检测:通过采集白血病患者的血液样本,提取其中的DNA或RNA,然后利用特定的实验方法,检测样本中是否存在融合基因的形成。
这项检测可以通过PCR、FISH、RT-PCR等多种技术手段进行。
2. 融合基因类型分析:一旦检测到融合基因的存在,进一步需要确定具体的融合基因类型。
不同类型的融合基因与不同的白血病亚型相关,对应的治疗方案也不同。
通过基因测序等技术手段,可以对融合基因进行全面的分析,从而为后续的治疗决策提供依据。
3. 预后评估:融合基因的存在与白血病的预后密切相关。
一些融合基因具有较好的预后,而另一些融合基因则预示着不良的疾病进展。
通过对融合基因的检测,可以帮助医生预测患者的预后,从而指导后续的治疗方案的选择和调整。
白血病融合基因检测项目的临床应用已经取得了显著的进展和成果。
它不仅可以帮助医生进行白血病的精确诊断,还可以为个体化治疗提供重要的指导。
通过对融合基因的检测,医生可以更好地了解患者的疾病特点,为患者制定个体化的治疗方案,提高治疗效果,减少不必要的治疗风险和费用。
然而,白血病融合基因检测项目也存在一些挑战和限制。
首先,该检测项目的准确性和灵敏度仍然需要进一步提高,以便更好地发现融合基因的存在。
其次,目前的检测方法仍然存在一定的技术难度和复杂性,需要专业的实验室和技术人员支持。
白血病为什么要做融合基因检测呢

白血病为什么要做融合基因检测呢白血病是一种由于造血系统恶性克隆细胞不受控制地增殖和积累,导致正常造血受到抑制的恶性肿瘤性疾病。
白血病的确切病因尚不清楚,但许多研究表明,融合基因的存在与白血病的发生密切相关。
因此,在诊断和治疗白血病过程中,进行融合基因检测具有重要意义。
融合基因是由两个或多个基因通过染色体易位、倒位或插入等结构异常产生的新基因,通常通过改变原基因的结构和功能来促进细胞增殖和存活。
在白血病中,大多数融合基因是由两个基因融合而成,其中一个基因常常与白血病相关,而另一个基因通常涉及到染色体易位或倒位。
融合基因检测通过检测白血病患者体内的融合基因,可以帮助医生进行白血病的准确诊断和分类。
根据不同的融合基因类型,白血病可以被划分为不同的亚型,给出更具针对性的治疗方案,提高治疗效果。
例如,早期诊断急性淋巴细胞白血病(ALL)中的TEL-AML1融合基因亚型,可以预测更好的预后,对这类患者可以采取更温和的治疗方案,以减少治疗所带来的副作用。
此外,融合基因检测还可以用于监测白血病的治疗效果和预测复发风险。
在白血病的治疗过程中,融合基因的表达水平和融合基因的类型可以作为监测指标。
如果融合基因表达水平下降或消失,通常提示治疗有效。
相反,如果融合基因表达水平持续高或复发时再次上升,可能预示着白血病的复发风险。
由于融合基因与白血病的发生和发展密切相关,因此对融合基因进行监测可以帮助医生及时调整治疗方案,提高白血病的治疗效果。
最近几十年来,随着分子生物学技术的快速发展,融合基因检测在白血病的诊断和治疗中得到了广泛应用。
通过PCR、FISH、RT-PCR等技术,可以快速准确地检测白血病患者体内的融合基因。
融合基因的检测不仅可以提高白血病的诊断准确性和分类准确性,还可以帮助医生制定更合理的治疗方案,提高治疗效果。
此外,融合基因的检测还可以用于监测治疗效果,预测复发风险。
总之,融合基因检测在白血病的诊断和治疗中扮演着至关重要的角色。
bcr-abl 融合基因临床入组标准

bcr-abl 融合基因临床入组标准在临床医学研究中,bcr-abl 融合基因临床入组标准被广泛应用于白血病等疾病的诊断和治疗。
bcr-abl 融合基因是慢性粒细胞白血病(CML)和部分急性淋巴细胞白血病(ALL)患者中的一种典型基因突变,它的存在提示着一种预后不良的情况。
通过对bcr-abl 融合基因临床入组标准的全面评估,我们可以更好地了解这一基因突变在疾病发展和治疗中的作用,为临床医学研究提供有力的依据。
1. bcr-abl 融合基因的作用bcr-abl 融合基因是由两个不同染色体的基因融合而成的产物,在CML和部分ALL患者中发现。
它的存在导致了细胞异常增殖和抗凋亡能力增强,从而促进了白血病的发展和进展。
bcr-abl 融合基因可以作为一种重要的生物标志物,用于诊断和预后评估。
2. bcr-abl 融合基因临床入组标准的意义临床入组标准是指在临床研究中,对参与者的合格性进行界定的一组标准。
对于患有CML和部分ALL的患者,bcr-abl 融合基因的检测结果往往成为其是否符合临床入组标准的重要依据。
通过对 bcr-abl 融合基因临床入组标准的全面评估,医生和研究人员可以更准确地确定患者的病情和预后,从而为个体化治疗和临床试验的设计提供指导。
3. 个人观点和理解对于bcr-abl 融合基因临床入组标准,我认为其在白血病研究和临床实践中具有重要的意义。
通过该标准,我们可以更加精准地筛选患者,并为其提供个体化的治疗方案。
bcr-abl 融合基因在白血病发病机制中的作用也值得深入研究,以寻找更好的治疗方法和药物靶点。
bcr-abl 融合基因临床入组标准在白血病研究和临床实践中具有重要的意义,它为诊断、预后评估和治疗提供了重要依据。
未来,我们需要更深入地探讨该标准的应用范围和临床意义,为白血病患者的治疗带来更多的可能性。
以上所述仅代表个人观点,希望对您有所帮助。
bcr-abl融合基因作为白血病的重要生物标志物,在临床医学研究和实践中扮演着重要的角色。
白血病经典融合基因检测

白血病经典融合基因检测(一)bcr/abl融合基因abl为一原癌基因,位于9号染色体q34,基因产物是一种非受体型酪氨酸蛋白激酶;bcr基因位于22号染色体q11,正常的bcr基因产物为160kD的胞质磷酸蛋白,由于t(9;22)(q34;q11)的易位,形成bcr/abl融合基因,该易位产生bcr/abl嵌合基因,基因产物为210kD的融合蛋白,它的表达激活了酪氨酸蛋白激酶,改变了细胞的蛋白酪氨酸水平和肌动蛋白结合能力,扰乱了正常的信号传导途径,抑制了凋亡的发生。
bcr基因断裂点集中在三个区域:主要(major bcr,M-bcr)、次要(minor bcr,m-bcr)和μ(μ-bcr)。
abl基因断裂位于第1或第2内含子。
因断裂点不一,bcr-abl融合基因及其mRNA和蛋白产物呈多样性。
根据bcr基因断裂点的不同,主要有下述几种类型的bcr/abl融合形式:①在典型的CML中,大部分融合基因是在主要断裂点簇集区(M-bcr)内断裂融合而成,由此形成的bcr/abl融合mRNA是由b3a2或b2a2转录而成,其最终产物是相对分子质量210×103的胞浆蛋白P210,这种癌蛋白是绝大多数慢性期CML表型异常的根源所在。
②当bcr基因断裂点发生在上游的一段长约54.4 kb的内含子,也称m-bcr区,产生一个e1a2接头的杂合mRNA,编码P190融合蛋白。
③bcr断裂点也可在M-bcr区的下游,即μ-bcr,产生e19a2融合,编码P230融合蛋白。
【我个人认为P230CML其特征主要是成熟中性粒细胞增生为主,表现为隐匿,良性的临床过程,患者生存期长的特点。
】bcr/abl融合基因存在于95%以上的慢性粒细胞白血病患者,是CML最重要的分标志,是疾病状态的决定性因素。
在一部分成人急性淋巴细胞性白血病(20%-30%)、儿童急性淋巴细胞白血病(2%-10%)和急性粒细胞性白血病的患者中也可表达bcr/abl融合基因。
p210融合基因转阴标准

p210融合基因转阴标准
p210融合基因是一种与慢性髓性白血病(CML)相关的遗传异常。
该基因是由BCR(Breakpoint Cluster Region)基因和ABL(Abelson gene)基因融合而成的。
根据国际慢性髓性白血病研究组(International Chronic Myeloid Leukemia Study Group)的定义,当在患者的骨髓或外周血
中检测到BCR-ABL融合基因的p210转录产物,并且达到一定的水平时,可以认定为CML的转阴标准。
具体而言,根据目前的指导标准,如果连续两个或更多时间点的
骨髓或外周血中,BCR-ABL转录产物的数量低于参考值(通常是与国际标准品进行比较),并且不再检测到BCR-ABL转录产物,就可以判定
为达到了p210融合基因转阴。
需要注意的是,转阴的标准可能会因实验室方法的不同而有所差异,因此在评估转阴标准时应参考相应的实验室指引。
此外,患者达
到p210融合基因转阴并不一定意味着完全治愈,因为仍有可能存在残
留的白血病干细胞。
因此,长期的随访和监测仍然是必要的。
pmlrara融合基因名词解释

一、概述随着生物技术和基因工程的发展,基因名词在生物学领域中扮演着重要的角色。
PMLRARA基因就是其中之一,本文将对PMLRARA基因进行解释和探讨。
二、PMLRARA基因的含义1. PMLRARA是由PML和RARA两个基因融合而成的复合基因。
2. 其中,PML基因属于PML基因家族,编码一个核蛋白,而RARA基因编码一个核受体。
3. PMLRARA基因多见于急性早幼粒细胞白血病患者中,是一种特定的致癌基因。
三、PMLRARA基因的作用机制1. PMLRARA基因融合后产生的蛋白会干扰正常的细胞分化和凋亡过程,导致白血病细胞的异常增殖和存活。
2. 该蛋白也会影响细胞内其他基因的表达,从而参与白血病细胞的发生和发展。
3. 通过研究PMLRARA基因的作用机制,可以为治疗白血病提供新的靶点和方法。
四、PMLRARA基因与疾病的关系1. PMLRARA基因与急性早幼粒细胞白血病紧密相关,是该疾病的典型致癌基因之一。
2. 检测和研究PMLRARA基因的变异和表达水平,可以帮助医生进行白血病的诊断和预后评估。
3. 通过干预PMLRARA基因的表达或功能,可以为白血病的治疗提供新的方向和手段。
五、PMLRARA基因的研究现状1. 目前,关于PMLRARA基因的研究主要集中在其作用机制、参与的信号通路、药物靶点等方面。
2. 一些研究已经发现了特定的化合物或药物可以干扰PMLRARA蛋白的功能,为白血病的治疗提供了新的可能性。
3. 一些临床试验已经开始探索针对PMLRARA基因的治疗策略,希望为白血病患者带来新的希望。
六、结论通过对PMLRARA基因的深入研究和解析,可以更好地理解白血病的发病机制和进展过程。
针对PMLRARA基因的治疗策略也有望为白血病患者带来更有效的治疗方案。
期待在未来的研究和临床实践中,能够取得更多关于PMLRARA基因的重要发现,并将其应用于临床实践中,造福于病患者。
七、PMLRARA基因与靶向治疗随着对PMLRARA基因的深入研究,科学家们逐渐认识到针对该基因的靶向治疗具有重要的临床意义。
白血病融合基因

白血病融合基因白血病是一种由于体内某些细胞发生异常而引起的恶性肿瘤性疾病。
融合基因是白血病中一种重要的遗传变异形式,它在白血病的发展过程中起着重要的作用。
本文将从白血病融合基因的定义、发生机制、与白血病发病的关系以及研究进展等方面进行讨论。
白血病融合基因是指由两个或多个基因的融合所产生的新基因。
这种融合基因通常由染色体上的基因断裂并重新排列而形成。
白血病融合基因往往具有异常的功能,它可以改变细胞的生长、分化、凋亡等生命活动过程,从而导致白血病的发展。
白血病融合基因的发生机制非常复杂,目前尚不完全清楚。
然而,研究表明,染色体异常是白血病融合基因发生的重要原因之一。
在白血病细胞中,常常存在染色体断裂、重排等异常现象,这些异常可以导致基因融合事件的发生。
此外,一些环境因素和遗传因素也可能与白血病融合基因的发生有关。
白血病融合基因与白血病的发病密切相关。
研究发现,白血病融合基因在白血病细胞中广泛存在,并且与白血病的发展、预后等有关。
一些白血病融合基因与白血病的亚型和预后密切相关,可以作为白血病的分子标记物,用于疾病的分型和预后评估。
此外,一些白血病融合基因也是靶向治疗的重要标的,通过针对融合基因的抑制剂可以达到治疗白血病的效果。
近年来,对白血病融合基因的研究取得了一系列重要进展。
通过对白血病融合基因的特征和功能进行深入研究,揭示了白血病融合基因在白血病发病机制中的重要作用。
同时,研究人员还通过开发新的技术手段,如基因编辑技术、蛋白质组学等,为白血病融合基因的研究提供了新的方法和途径。
然而,白血病融合基因的研究仍然面临一些挑战。
一方面,由于白血病融合基因的多样性和复杂性,研究人员需要对不同的融合基因进行深入研究,以揭示其在白血病发病机制中的具体作用。
另一方面,白血病融合基因的治疗潜力尚未完全发掘,需要进一步的研究和临床验证。
白血病融合基因是白血病发病机制中的重要因素之一。
对白血病融合基因的研究不仅可以深入了解白血病的发病机制,还能为白血病的预后评估和治疗提供重要依据。
mds中的白血病融合基因分型

mds中的白血病融合基因分型
白血病是一种造血系统恶性疾病,其中涉及到许多不同的融合基因。
以下是一些常见的白血病融合基因分型:
1. 急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL): - BCR-ABL1:在Ph染色体阳性的ALL中常见,主要涉及
t(9;22)(q34;q11)染色体易位。
- MLL融合基因:涉及11q23异常,包括MLL-AF4、MLL-AF9、MLL-ENL等融合基因。
2. 急性髓系白血病(acute myeloid leukemia, AML):
- AML1-ETO:涉及t(8;21)(q22;q22)染色体易位。
- PML-RARA:在急性早幼粒细胞白血病(acute promyelocytic leukemia, APL)中常见,涉及t(15;17)(q22;q12)
染色体易位。
- CBF融合基因:包括inv(16)(p13q22)/t(16;16)(p13;q22)染色
体易位的CBFβ-MYH11和t(8;21)(q22;q22)染色体易位的
AML1-ETO。
3. 慢性髓细胞白血病(chronic myeloid leukemia, CML):
- BCR-ABL1:CML的特征性融合基因,涉及
t(9;22)(q34;q11)染色体易位。
这些融合基因分型对于白血病的诊断、治疗和预后评估都具有重要意义,并且为靶向治疗提供了一些潜在的治疗靶点。
但需要注意的是,不同的融合基因类型在不同的白血病亚型中可能有重叠,且某些亚型可能存在多种不同的融合基因。
因此,准
确的分型需要基于综合的病理学、细胞学和分子遗传学特征进行综合诊断。
融合基因aml1eto标准值

融合基因aml1eto标准值
融合基因AML1-ETO的标准值
概述
AML1-ETO融合基因是白血病患者中发现的一种染色体易位,涉
及1号和21号染色体的异常。
这种融合基因导致AML1和ETO基因
的融合,产生一种异常的融合蛋白,干扰正常造血过程。
检测方法
AML1-ETO融合基因的检测通常通过分子遗传学方法进行,如:荧光原位杂交(FISH):检查染色体易位是否存在。
聚合酶链反应(PCR):检测融合基因的分子特征。
标准值
AML1-ETO融合基因的标准值因检测方法的灵敏度和特异性而异。
然而,一般而言:
FISH:正常个体为阴性,白血病患者为阳性。
PCR:阴性(<0.1%)
临床意义
AML1-ETO融合基因的存在对于白血病诊断和预后具有重要意义:诊断:阳性结果强烈提示急性髓系白血病(AML)的M2亚型。
预后:阳性患者通常预后不良,复发率较高。
其他考虑因素
融合基因的表达水平和拷贝数可能会影响预后。
一些患者可能存在非典型的AML1-ETO融合基因,需要进一步
的分子分析。
融合基因的检测结果应结合患者的临床表现和其他实验室检查
综合考虑。
结论
AML1-ETO融合基因的标准值为阴性(FISH)和<0.1%(PCR)。
阳性结果提示AML的M2亚型,预后通常不良。
融合基因检测对于白血病的诊断和预后评估具有重要意义。
66例血液病患者bcr/abl融合基因、Ph染色体结果分析

[ ] eprt n 19 ,4 1 : 0 — 7 J .R si i ,9 7 6 ( ) 121 . ao 0 [ ] uaiM,Th aY,L ag ta.A ssmeto eulc ・ 4 M rk od w aT,e 1 ses n f8rl Y n l F A 1li n  ̄crJ .C cr 19 7 ( ) 17 — 7 . R 2 一 nl gcl e[ ] a e, 9 6,7 7 :241 7 u l n 2 [] 5 朱元钰 , 陈文彬 .呼 吸病学 [ .第 1版 .北京 : 民卫生 出版 M] 人
其 对 N C C诊 断敏 感 性 为 3 .8 。 SL 89 %
( S L ) N C C包 括 鳞 癌 、 癌 和 大 细 胞 癌 , N C C ,SL 腺 占肺 癌 比 例 7 % 一8% 左 右 J 0 0 。肺 癌 的 临 床表 现多 样 ,0 一8 % 的 患 7% 0
者就诊时 已属 Ⅲ、 Ⅳ期 病变 , 丧失 了根治 的机会
C A是 富含 多 糖 的 蛋 白复 合 物 , 临 床应 用 较 多 的 肿 瘤 E 是
诊断的敏感性可达 9 .0 , 45 % 大大提 高了 N C C的阳性检 出 SL
率。
标志物 , 其对 由内胚层分化来 的肿瘤特别 是消化道腺 癌 , 其 有较高的阳性检 出率 , 对早期的肿瘤诊 断并 不理想。本 文结
肿瘤标
本 文表 明 , S L N C C患 者 四种 肿瘤 标 志物 含 量 均 明 显 高 于 对 照 组 , 明 此 四 种 肿 瘤 标 志 物 对 N C C的 辅 助 诊 断 有 一 表 SL
定 的临 床 意 义 。联 检 结 果 显 示 , 项 指 标 联 检 时 对 N C C 四 SL
白血病融合基因分型

白血病融合基因分型白血病融合基因分型作为一种慢性血液系统疾病,白血病是造成包括体内免疫机制破坏、产生许多不同类型细胞将带来严重副作用甚至是致命危害的疾病。
根据白血病患者的临床表现、真菌学和术语,白血病分为克罗恩病 (CML)、急性髓系白血病 (AML)、慢性髓系白血病 (CLL)、急性淋巴细胞白血病 (ALL) 和慢性淋巴细胞白血病 (CLL) 等多种子类。
近年来,人们对白血病的研究有了相当大的进步。
融合基因分型就是其中重要的一种技术,它利用疾病相关基因单位(gene unit)中发生重新排列,交叉或互换、有序组合在一起而形成一种特定的融合(fusion)基因类型來诊断白血病。
比如,已知在慢性髓细胞白血病患者体内发现的是“philadelphia 遗传标记”(Ph),那么就说明这种白血病是由融合基因“philin-Abl”所导致的。
融合基因分型的关键在于如何准确的检测到融合基因的存在。
目前相关的技术和设备有“杂交-逆转录-聚合酶链反应”(hybridization-reverse transcription-polymerase chain reaction, hRET-PCR)、芯片证明(chipProove)、FISH 和 SAGE 等,由于其灵敏度高、质量可靠,运用这些技术能够更加准确的检测,为准确诊断和治疗白血病患者提供有效的协助。
与传统的细胞学定量和分子病理检查方法相比,融合基因分型技术相对简单,有效,宲量快速,且不需要大量细胞,可大大提高实验质量,准确准确的识别疾病患者的融合基因类型,根据融合基因分型结果,及时采取合适的治疗方式,提高病人治疗的成功率。
综上所述,融合基因分型已经在白血病的诊断和治疗中发挥了重要的作用:准确测定病人的融合基因,给出准确的诊断以及合适的治疗措施,帮助病人更快更有效地恢复健康。
白血病融合基因分型检查结果 拷贝个数

白血病融合基因分型检查结果拷贝个数白血病融合基因分型检查结果拷贝个数1. 背景介绍白血病是一种由于骨髓中异常增生的白细胞而引起的恶性肿瘤。
在白血病的治疗中,融合基因检测是非常重要的一项检查。
融合基因是白血病细胞中常见的一种基因异常,通常由染色体易位或基因重排所致。
融合基因的存在可以帮助医生诊断白血病的类型,并指导后续的治疗方案。
而在融合基因检测中,拷贝个数的结果也是非常重要的信息之一。
2. 融合基因分型检查结果拷贝个数的意义融合基因分型检查通常会给出拷贝个数的结果,这个结果可以告诉我们在白血病细胞中特定融合基因的拷贝数量。
拷贝个数的变化可能会影响白血病的临床表现和预后。
通常情况下,融合基因的拷贝个数越多,白血病的进展和治疗的难度可能会越大。
准确评估融合基因的拷贝个数对于白血病患者的治疗和预后具有重要意义。
3. 如何理解融合基因分型检查结果拷贝个数在理解融合基因分型检查结果拷贝个数时,我们需要考虑几个方面。
需要了解不同融合基因的拷贝个数的正常范围,以及与白血病进展和治疗的关系。
需要结合患者的临床症状和其他检查结果,综合判断融合基因拷贝个数的重要性和影响程度。
需要根据融合基因分型检查结果拷贝个数,制定合理的治疗方案,包括化疗药物的选择和使用剂量等。
4. 个人观点与理解在我看来,融合基因分型检查结果拷贝个数对于白血病患者的治疗非常重要。
通过准确评估融合基因的拷贝个数,可以更好地了解白血病的临床特征,指导治疗方案的制定,并评估患者的预后。
患者和医生都应该重视融合基因分型检查结果拷贝个数,将其纳入临床决策的重要因素之一。
5. 总结和回顾在本文中,我们探讨了白血病融合基因分型检查结果拷贝个数的重要性和意义,以及如何理解和应用这些检查结果。
融合基因分型检查结果拷贝个数的准确评估对白血病患者的治疗和预后具有重要意义,需要与患者的临床表现和其他检查结果相结合,制定个性化的治疗方案。
希望通过本文的阐述,读者能够更深入地了解融合基因分型检查结果拷贝个数在白血病治疗中的重要性,为临床实践提供一定的参考价值。
血液病中的融合基因

一、Ph染色体相关白血病的检测Ph染色体最初在慢性粒细胞性白血病(CML)中发现,其发生率达到90%以上,成为慢粒的细胞遗传学标志。
该染色体是由于第9号染色体长臂3区4带(9q34)和22号染色体长臂1区1带(22q11)相互易位所致,其后果使位于9q34的原癌基因C-ABL和位于22q11的BCR基因发生融合,形成BCR-ABL融合基因,并表达为BCR-ABL融合mRNA,翻译成融合蛋白质。
20世纪70年代以来,在部分急性淋巴细胞白血病(ALL)中也发现有Ph染色体,占ALL的5%(儿童)~25%(成人)。
近年来由于PCR技术的不断发展,对Ph染色体阳性白血病的诊断和残留白血病细胞的检测有了很大的进展。
应用筑巢式逆转录酶/多聚酶链反应技术(RT/PCR)检测BCR—ABL融合基因转录本,发现了3种BCR-ABL异构体,这种异构体的形成是由于BCR基因断裂点的位置不同所致。
慢粒患者在BCR基因的断裂点主要集中于经典的bcr区域,即M-BCR区域,而伴有Ph染色体急性白血病中,约50%的患者BCR基因断裂点与慢粒患者相同,而另50%患者的断裂点位于BCR 基因的第1个内含子,ABL基因的断裂点主要位于第1或第2个内含子,第22号染色体的断裂点位于M-BCR2内含子,即M-BCR第二外显子与ABL基因第二个外显子相融合(简称b2a2转录本)。
如果断裂点于M-BCR第三外显子即形成b3a2转录本,如果BCR基因的断裂点位于基因的第一内含子,则形成e1a2转录本,后者主要见于Ph染色体阳性的急性白血病患者。
二、急性早幼粒细胞性白血病的检测急性早幼粒细胞白血病(APL)患者中95%以上具有特异的染色体易位t(15;17)(q22;q21),易位的结果使第15号染色体长臂2区2带的早幼粒细胞白血病基因(PML)和第17号染色体长臂2区1带的维A酸受体α(RARα)基因形成PML-RARα融合基因转录本。
由于该融合基因对APL具有高度特异性,因此可以作为APL诊断的分子标志。
慢性粒细胞白血病融合基因P210

慢性粒细胞白血病融合基因P210慢性粒细胞白血病(CML)是一种慢性血液疾病,主要由于白血病染色体融合(BCR-ABL)基因的体外转录而引起的。
融合基因P210(BCR-ABL P210)是一种慢性粒细胞白血病的特定类型,在CML中占主要比例。
一般来说,融合基因P210是由致病基因位点(BCR和ABL)连接在一起形成的,其中BCR编码BCR蛋白,而ABL 编码ABL蛋白。
也就是说,当这两个基因位点被连接在一起时,它们会形成一个新基因,称为P210基因。
融合基因P210可能是由病原体侵入而引起的,如病毒或细菌等。
此外,它还有可能是由基因突变所致,从而导致BCR和ABL两个基因位点的体外转录。
尽管融合基因P210会由于突变而产生,但这种突变通常是罕见的。
融合基因P210的发病机制有很多不同的方面。
其中一个最重要的方面是融合基因产生的蛋白质异常活性。
因此,这种活性会干扰血细胞内正常细胞凋亡的过程,从而导致白血细胞的增多,进而引发CML疾病。
此外,融合基因P210还能增强细胞增殖,抑制正常凋亡,改变细胞增殖和分化,以及影响细胞膜受体结构,进而破坏细胞正常功能。
融合基因P210的临床表现也与它的发病机制有关。
典型的CML 病人会表现出慢性血液系统紊乱,如淋巴细胞增多、血小板减少和白细胞减少等,这些都和融合基因P210有关。
还有,融合基因P210还可能会诱发免疫系统紊乱,并导致血管破裂和出血。
由于融合基因P210暴露了CML疾病的发病机制,因此它提供了临床治疗的新机会。
临床治疗的重要组成部分是抗癌药物,这些药物能够直接作用于融合基因P210,从而抑制它的活性,使其无法正常地影响细胞的功能。
此外,如果需要的话,有时会给患者进行细胞移植治疗,以替换患者身体中的融合基因细胞。
总之,融合基因P210是CML疾病的特定类型,由于它暴露了CML疾病的发病机制,因此也为临床治疗提供了新的机会。
尽管目前已经取得了不错的进展,但融合基因P210还是一个有待深入研究的方面,希望能够有更多的突破和发现,以对CML提供更好的治疗。
bcr-abl融合基因检测报告解读

bcr-abl融合基因检测报告解读内容如下:
BCR-ABL 是一种融合基因,常见于慢性粒细胞白血病(CML)和一些急性淋巴细胞白血病(ALL)患者中。
以下是一份可能包含的BCR-ABL 融合基因检测报告解读:
1.样本信息:包括样本编号、样本类型、采样日期等信息。
2.试验方法:列出使用的实验方法和设备。
3.检测结果:列出BCR-ABL 融合基因的检测结果,通常包括定量和定性两个方面。
•定量:BCR-ABL 融合基因定量通常以百分比或比率的形式报告。
百分比是指白血细胞中BCR-ABL 融合基因所占的百分比,而比率是指BCR-ABL 融
合基因与正常基因的比值。
这些数字通常与参考值一起给出。
•定性:BCR-ABL 融合基因定性通常指是否检测到该基因。
如果检测到了,通常会给出检测到的融合点位置信息。
4.解释和建议:根据检测结果,可能提供相应的解释和建议,例如进一步检查、治疗
方案等。
对于CML 患者,检测结果通常用于评估治疗的疗效。
如果治疗后BCR-ABL 融合基因的定量结果低于特定的阈值,通常认为治疗有效。
需要注意的是,每个实验室可能会使用不同的检测方法和报告格式,因此具体的报告解读可能会有所不同。
如果您有任何疑问或需要进一步解释,应咨询医生或检测实验室的专业人员。
一文读懂:融合基因到底是什么鬼
一文读懂:融合基因到底是什么鬼融合基因为何物?人类基因组上大约有2.5万个不同的基因,各自执行不同的功能。
在肿瘤发生时,经常会发生基因组水平的断裂和重新拼接。
当两个基因分别断成两半,并且发生了错误拼接时,就有可能形成新的基因片段,这就叫做融合基因。
大多数情况下,融合基因可以导致异常序列或功能的蛋白质的产生,或者某些基因表达的失调,从而导致或促进肿瘤的发生。
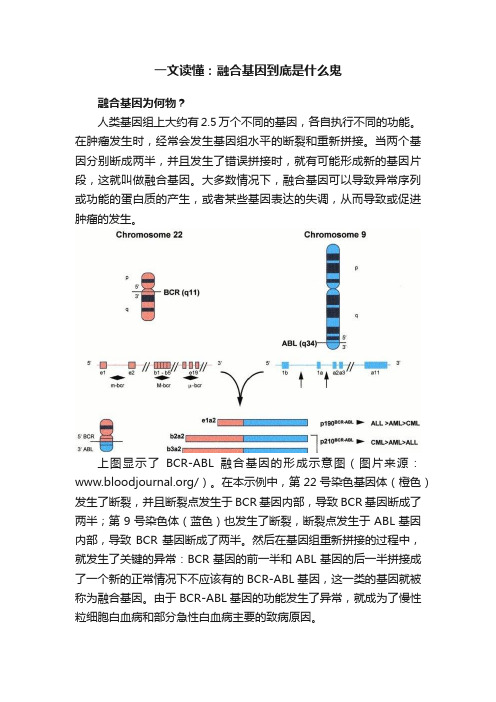
上图显示了BCR-ABL融合基因的形成示意图(图片来源:/)。
在本示例中,第22号染色基因体(橙色)发生了断裂,并且断裂点发生于BCR基因内部,导致BCR基因断成了两半;第9号染色体(蓝色)也发生了断裂,断裂点发生于ABL基因内部,导致BCR基因断成了两半。
然后在基因组重新拼接的过程中,就发生了关键的异常:BCR基因的前一半和ABL基因的后一半拼接成了一个新的正常情况下不应该有的BCR-ABL基因,这一类的基因就被称为融合基因。
由于BCR-ABL基因的功能发生了异常,就成为了慢性粒细胞白血病和部分急性白血病主要的致病原因。
血液病融合基因家族有哪些成员?血液病融合基因是其分子生物学特异性标志,目前已明确的较为常见的融合基因有数十种,常见的有AML1-ETO;BCR-ABL(亚型:ela2、b2a2、b3a2);CBFb-MYH11(亚型:A-J型);E2A-PBX1(亚型:1、1a);MLL-AF4(亚型:MLLex8-11 AF4ex4-7);PML-RARα(亚型:S、L 、V 型);SIL-TAL1(亚型:Ⅰ、Ⅱ、Ⅲ型);TEL-AML1 (亚型:ex5-ex2、ex5-ex3)等等。
这些常见的融合基因,有时还会是因非常见的断裂位点导致的变异型基因序列,经常是导致检测假阴性的原因。
还有一些融合基因的伙伴不固定,如MLL基因的伙伴基因已经报道有数百种。
还有的融合基因本身很少见,全世界仅报道了几例甚至一例。
这些都为有效检测带来了困难。
哪些人群需要检测融合基因?疑似白血病的人群;确诊为急性髓系白血病、急性淋巴细胞白血病、慢性粒细胞性白血病、慢性粒细胞单核细胞性白血病、骨髓增生异常综合征且初诊检测到相关融合基因,经治疗后定期复查或做微小残留病灶监控的人群;有血液肿瘤家族史的高危人群;接触化学品或放射源的高危人群。
mll enl融合基因

mll enl融合基因
MLL(Myeloid/lymphoid leukemia,髓系/淋巴系白血病)融合基因是指在白血病患者的骨髓细胞中,MLL基因与其他基因发生异常融合,导致细胞失去正常功能,从而引发白血病。
ENL(Enhancer of nuclear factor-κB ligand)融合基因是一种常见的MLL融合基因,它与MLL 基因的融合会导致白血病的发生。
ENL融合基因的白血病类型主要集中在急性髓系白血病(AML)和急性淋巴细胞白血病(ALL)两种。
其中,AML占比较高,约为80%。
这种白血病的治疗效果受到多种因素影响,如患者年龄、病情严重程度、融合基因类型等。
一般来说,针对ENL融合基因的白血病治疗措施包括化疗、靶向治疗、移植等。
治疗方案需要根据患者具体情况制定,以确保最佳治疗效果。
在诊断过程中,医生会通过染色体、融合基因和免疫分型等方法来确定白血病的类型和病情。
对于ENL融合基因的白血病,染色体检查和融合基因检测是确诊的关键。
在治疗过程中,缓解后考虑使用阿糖胞苷进行巩固治疗,或者进行移植治疗。
值得注意的是,经过规范治疗,80%以上的ENL融合基因白血病患者可以获得治愈。
总之,ENL融合基因是导致白血病的一种重要因素,治疗方案需要根
据患者具体情况制定。
通过合理的治疗,大部分ENL融合基因白血病患者可以获得良好的治疗效果。
mll融合基因的形成机制

mll融合基因的形成机制mll融合基因是一种在肿瘤中常见的染色体异常,它在多种白血病中起着重要的作用。
本文将探讨mll融合基因的形成机制,并解释其在肿瘤发生中的重要性。
我们需要了解mll融合基因是如何形成的。
mll基因是人类体细胞中的一个重要基因,它位于染色体11q23区域。
正常情况下,mll 基因负责编码一种叫做mll蛋白的转录因子,该蛋白在细胞分化和基因表达调控中起着重要作用。
然而,在某些情况下,mll基因会与其他基因发生融合,形成mll融合基因。
mll融合基因的形成主要是由于染色体的异常重排事件所致。
这些重排事件可以是染色体间的互换、删除或重复,导致了mll基因与其他基因的融合。
这种融合基因的形成通常发生在白血病细胞中,特别是儿童急性淋巴细胞白血病和急性髓系白血病中。
融合基因的形成使得mll蛋白失去正常的功能,并且导致了白血病细胞的不受控制增殖。
mll融合基因的形成机制还不完全清楚,但已经有一些重要的进展。
研究表明,mll基因与其他基因的融合主要是由于DNA断裂和重组事件所致。
这些事件可能与DNA损伤修复过程中的错误修复有关。
具体来说,当DNA双链断裂发生时,细胞会启动DNA损伤修复机制,其中一个重要的修复途径是非同源末端连接。
在这个过程中,两个不同染色体上的DNA断裂末端可能会错误地连接在一起,导致mll基因与其他基因的融合。
一些研究还发现,与mll融合基因形成相关的还有一些特定的DNA 序列,这些序列可能在染色体重排事件中起着重要的作用。
这些DNA序列可能具有某些结构或功能特征,使得mll基因在重排过程中更容易与其他基因发生融合。
mll融合基因在肿瘤中的重要性不言而喻。
由于mll融合基因的形成,mll蛋白的正常功能被破坏,导致细胞分化和基因表达调控的紊乱。
这些变化使得白血病细胞能够无限增殖,并且逃避正常的细胞凋亡机制。
此外,mll融合基因还可以改变其他基因的表达,进一步促进肿瘤的发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、Ph染色体相关白血病的检测
Ph染色体最初在慢性粒细胞性白血病(CML)中发现,其发生率达到90%以上,成为慢粒的细胞遗传学标志。
该染色体是由于第9号染色体长臂3区4带(9q34)和22号染色体长臂1区1带(22q11)相互易位所致,其后果使位于9q34的原癌基因C-ABL和位于22q11的BCR基因发生融合,形成BCR-ABL融合基因,并表达为BCR-ABL融合mRNA,翻译成融合蛋白质。
20世纪70年代以来,在部分急性淋巴细胞白血病(ALL)中也发现有Ph染色体,占ALL的5%(儿童)~25%(成人)。
近年来由于PCR技术的不断发展,对Ph染色体阳性白血病的诊断和残留白血病细胞的检测有了很大的进展。
应用筑巢式逆转录酶/多聚酶链反应技术(RT/PCR)检测BCR—ABL融合基因转录本,发现了3种BCR-ABL异构体,这种异构体的形成是由于BCR基因断裂点的位置不同所致。
慢粒患者在BCR基因的断裂点主要集中于经典的bcr区域,即M-BCR区域,而伴有Ph染色体急性白血病中,约50%的患者BCR基因断裂点与慢粒患者相同,而另50%患者的断裂点位于BCR 基因的第1个内含子,ABL基因的断裂点主要位于第1或第2个内含子,第22号染色体的断裂点位于M-BCR2内含子,即M-BCR第二外显子与ABL基因第二个外显子相融合(简称b2a2转录本)。
如果断裂点于M-BCR第三外显子即形成b3a2转录本,如果BCR基因的断裂点位于基因的第一内含子,则形成e1a2转录本,后者主要见于Ph染色体阳性的急性白血病患者。
二、急性早幼粒细胞性白血病的检测
急性早幼粒细胞白血病(APL)患者中95%以上具有特异的染色体易位t(15;17)(q22;q21),易位的结果使第15号染色体长臂2区2带的早幼粒细胞白血病基因(PML)和第17号染色体长臂2区1带的维A酸受体α(RARα)基因形成PML-RARα融合基因转录本。
由于该融合基因对APL具有高度特异性,因此可以作为APL诊断的分子标志。
近年来各国科学家有在少数APL患者中陆续发现了变异型染色体易位t(5;7)、t(11;17)、dup(17)形成的NPM-RARα、PLZF-RARα、NμMA-RARα、STATSB-RARα融合基因,这对进一步研究APL的发生机制具有重要意义。
同时在APL患者的鉴别诊断和治疗上具有积极的意义。
三、急性粒细胞性白血病(M2b)的检测
急性粒细胞性白血病(M2b)型患者中90%存在特异的t(8;21)(q22;q22)染色体易位,伴该染色体易位的白血病细胞具有一定程度的分化能力,能分化至较成熟的嗜中性和嗜酸性细胞,且对化疗反应较敏感。
目前已经发现该染色体易位使8号染色体的ETO/MTG基因和21号染色体的AML1基因融合形成AML1-ETO融合基因,从而导致产生AML1-ETO嵌合转录子,这种异常转录因子有可能参与造血系统恶性肿瘤的发生,因此检测该融合基因转录本对急性粒细胞性白血病(M2b)型患者的诊断、微小残留病变监测等具有重要意义。
四、AML-M4伴嗜酸性细胞增多症中inv(16)导致CBF-MHY11融合基因的检测
近年来的研究发现在AML-M4伴嗜酸性细胞增多症中inv(16)(p13;q22)的结果使16号染色体长臂的CBF(核心结合因子)β链基因和短臂的MYH11基因发生融合,形成两种形式的融合基因,即CBFβ-MHY11和MHY11-CBFβ融合基因,其中前者对M4Eo的致病可能更为重要。
研究结果提示CBFβ基因的断裂点恒定于靠近3′端编码区的17个氨基酸处,而MYH11基因的断裂点存在着至少3种不同的方式,同进这些重排仍然保持融合基因转录本的开放阅读框架。
与其他类型的白血病发生的分子机制相似,CBFβ-MYH11融合蛋白的产生将促使白血病的发生。
特别有意义的是,本型白血病中的inv(16)与急性粒细胞性白血病(M2b)型中的t(8;21)(q22;q22)染色体易位分别累及CBFα和β链,进一步说明了转录因子异常在白血病发病机制中的特殊地位。
与用PCR检测CBFβ-MYH11融合基因时,必须检测所有可能的CBFβ-MYH11融合基因转录
本,这样才可以预防假阴性的结果。
研究表明该融合基因在患者经治疗缓解后可以消失,所以该基因可以用于微小残留病变监测和预后判断。
五、t(6;9)与DEK-CAN基因
t(6;9)(p23;q34)染色体易位主要见于ANLL-M2或M4亚型中,也见于M1亚型,且常是惟一存在的核型,在ANLL中的发生率为0.5%~4%,这种异常也存在于骨髓增生异常综合征(MDS)的难治性贫血伴原始细胞增多型(RAEB)中。
伴有这种染色体异常的患者的年龄一般较轻,且预后较差。
1990年Von Lindern等研究发现t(6;9)易位分别累计6p23上的DEK基因和9q34上的CAN 基因。
6号染色体上的DEK基因长约40kb,而9号染色体上的CAN基因长约130kb。
通过对伴有t(6;9)患者的Southern分析显示,6号染色体上的断裂点主要集中于DEK基因一个9kb的内含子中,称为icb-6(intron containing breakpoint on chromosome),9号染色体上断裂点丛集于CAN基因中部一个7.5kb内含子中,称为icb-9。
正常情况下,CAN基因转录成一个6.6kb mRNA。
由于t(6;9)易位,CAN基因的3′部分与DEK基因的5′部分发生融合,在6号染色体短臂上产生DEK-CAN融合基因,转录成一个异常的5.5kb mRNA,该异常融合转录本可以通过PCR的方法进行检测。
六、11号染色体长臂(11q23)异常和白血病的关系
许多造血系统恶性肿瘤如急性白血病(尤其是起源于粒-单核细胞者)、骨髓增生异常综合征、恶性淋巴瘤等都与11号染色体长臂11q23的重排有关,重排包括部分缺失以及断裂点累计1、2、4、6、9、10、17、19号染色体的各种非随机染色体易位。
在ANLL和ALL中均有11q23的受累提示存在着一种影响粒-单系和淋巴系方向分化的重要基因。
Rowley、Cimino等研究将11q23的断裂点丛集区定位于CD3的PBGD之间一个被称为ALL-1(又称HRX)的新基因上。
伴有t(4;11)染色体易位的白血病常见于儿童ALL患者,该易位导致产生HRX基因和4号染色体上受累的基因(AF-4)发生融合,形成两种嵌合蛋白质,AF-4-HRX和HRX-AF-4,目前还不清楚其中哪一个融合基因的作用更为重要。
而在t(11;19)易位的白血病患者中,HRX基因可与一个位于19号染色体上富含编码丝氨酸/脯氨酸的ENL基因相融合,形成HRX-ENL融合基因,该基因编码的嵌合蛋白也是一种重要的致病物质。
目前HRX基因相关的融合基因都可以用PCR进行检测。
