第一章 蛋白质的结构
第一章蛋白质的结构与功能蛋白质的...

第一章蛋白质的结构与功能一.蛋白质的分子组成组成蛋白质的元素主要:C、H、O、N、S,各种蛋白质的含氮量很接近,平均为16%人体蛋白质的氨基酸仅有20种,且均属L-α-氨基酸(甘氨酸除外)氨基酸等电点:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH称为该氨基酸的等电点(pI)。
色氨酸、酪氨酸的最大吸收峰在280nm附近氨基酸与茚三酮水合物共热,可生成蓝紫色化合物肽键:由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键谷胱甘肽(GSH)是由谷氨酸,半胱氨酸,甘氨酸组成的三肽。
第一个肽键与一般的不同,甘氨酸的γ-羧基与半胱氨酸的氨基组成,分子中半胱氨酸的巯基是主要功能基团。
GSH的巯基有还原性,可作为体内重要的还原剂,保护体内蛋白质或酶分子中巯基免遭氧化,使蛋白质和酶保持活性状态。
二.蛋白质的分子结构α-螺旋的结构特点:1.多个肽键平面通过α-碳原子旋转,相互之间紧密盘曲成稳固的右手螺旋2.主链呈螺旋上升,每3.6个氨基酸残基上升一圈,相当于0.54nm,这与X线衍射图符合3.相邻两圈螺旋之间借肽键中C=O和NH形成许多链内氢健,这是稳定α-螺旋的主要键4.肽链中氨基酸侧链R分布在螺旋外侧,其形状、大小及电荷影响α-螺旋的形成基团影响α-螺旋的稳定性包括以下三个方面:1.酸性或碱性氨基酸集中区域(两种电荷相互排斥)2.脯氨酸不利于α-螺旋的形成3.较大R基团侧链集中区域(空间位阻效应)β-折叠要点:1.是肽链相当伸展的结构,肽链平面之间折叠成锯齿状2.依靠两条肽链或一条肽链内的两段肽链间的C=O与H形成氢键,使构象稳定3.氨基酸残基的R侧链伸出在锯齿的上方或下方4.两段肽链可以是平行的,也可以是反平行的超二级结构有三种基本形式:1.α-螺旋组合(αα)2.β-折叠组合(ββ)3.α-螺旋β-折叠组合(βαβ)三.蛋白质结构与功能的关系镰刀形红细胞贫血:血红蛋白有2个α亚基和2个β亚基组成,其中β亚基的第六个氨基酸谷氨酸突变成缬氨酸。
生物化学 第一章 蛋白质的结构与功能

蛋白质的结构与功能
Structure and Function of Protein
第一节 蛋白质的分子组成
The Molecular Component of Protein
概述
什么是蛋白质(protein)
是 由 许 多 氨 基 酸 (amino acids) 通 过 肽 键 (peptide bond)相连形成的高分子含氮化合 物。
芳香族氨基酸的紫外吸收
(三)氨基酸与茚三酮反应生成蓝紫色化合物
氨基酸与茚三酮水合物共热,可生成蓝 紫色化合物,其最大吸收峰在570nm处。
由于此吸收峰值与氨基酸的含量存在正 比关系,因此可作为氨基酸定量分析方法。
四、蛋白质是由许多氨基酸残基组成的 多肽链
(一)氨基酸通过肽键连接而形成肽 (peptide)
+NH3
+NH3
二硫键
•胱氨酸
三、20种氨基酸具有共同或特异的理化 性质
(一)氨基酸具有两性解离的性质
两性解离
氨基酸是两性电解质,其解离程度取决于所 处溶液的酸碱度。
等电点(isoelectric point, pI)
在某一pH的溶液中,氨基酸解离成阳离子 和阴离子的趋势及程度相等,成为兼性离子,呈 电中性。此时溶液的pH值称为该氨基酸的等电 点。
问题
对碱性氨基酸而言,要使溶液的pH达 到pI,则必须加‗‗‗(酸,碱);因此, 碱性氨基酸的pI ‗‗‗(>7,<7)。
(二)含共轭双键的氨基酸具有紫外吸收性质
色氨酸、酪氨酸的 最大吸收峰在 280 nm 附近。
大多数蛋白质含有 这两种氨基酸残基,所 以测定蛋白质溶液 280nm的光吸收值是分 析溶液中蛋白质含量的 快速简便的方法。
蛋白质的结构与功能

第一章蛋白质的结构与功能一级结构:指多肽链中氨基酸的排列顺序,即它的化学结构。
二级结构:指借助主链(不包括侧链)的氢键形成的具有周期性的构象。
三级结构:指1条肽链(包括主链和侧链)完整折叠而形成的构象。
四级结构:指含有多条肽链的寡聚蛋白质分子中各亚基间相互作用,形成的构象。
超二级结构和结构域是在蛋白质二级和三级结构之间的两个层次。
超二级结构:指相邻的二级结构单元,在侧链基团次级键的作用下彼此靠近而形成的规则的聚集结构。
结构域:指在1条肽链内折叠成的局部结构紧密的区域。
组成四级结构的多肽链称为蛋白质的亚基,多个亚基组成的蛋白质为寡聚蛋白质1 维持蛋白质分子构象的作用力,主要包括氢键、疏水性相互作用、范德华引力、离子键和二硫键。
2 二级结构主要包括下面几种基本类型 (一) α—螺旋 (二)β折叠(三)转角 (四) β突起 (五)卷曲 (六)无序结构3 β折叠有两种类型,1种是平行式,1种是反平行式。
反平行折叠在能量上更稳定。
4 转角主要分两类:β转角和γ转角。
转角结构通常负责各种二级结构单元之间的连接作用。
5 常见的3种超二级结构单元为:αα ββ,βαβ。
6 结构域不仅仅是折叠单位和有一定功能的结构单位,还是一个遗传单位7结构域可以分为4种类型:反平行α,平行α/β,反平行β,不规则的小结构1、多肽链的折叠过程天然蛋白质是多肽链合成后经折叠而形成的热力学上稳定的构象。
多肽链的折叠是一自发过程..人们现已提出了一些多肽链的折叠模型,大致可以分为二类。
一种模型认为多肽链的折叠是逐步进行的,先形成一种稳定的二级结构作为核心,然后二级结构的氨基酸侧链进一步发生交互作用,扩大成天然三维结构;另一种模型提出,多肽链可能由于其疏水侧链的疏水交互作用而突然自发折叠,形成一种含二级结构的紧密状态,最后调整成天然结构。
这两种模型看来不是排斥的,有些多肽链的折叠可能以其中之一为主,有些多肽链的折叠兼而有之。
在这两种情况下,超二级结构的形成都可能起着导引作用,弱键则做最后的热力学上的调整。
生化第一章蛋白质的结构和功能
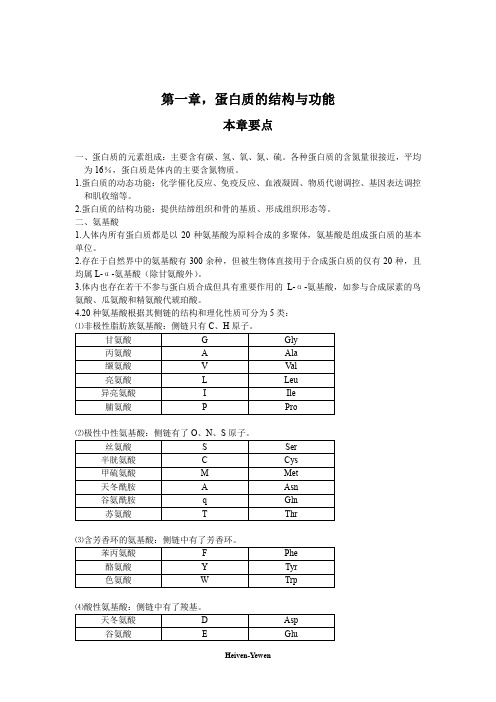
第一章,蛋白质的结构与功能本章要点一、蛋白质的元素组成:主要含有碳、氢、氧、氮、硫。
各种蛋白质的含氮量很接近,平均为16%,蛋白质是体内的主要含氮物质。
1.蛋白质的动态功能:化学催化反应、免疫反应、血液凝固、物质代谢调控、基因表达调控和肌收缩等。
2.蛋白质的结构功能:提供结缔组织和骨的基质、形成组织形态等。
二、氨基酸1.人体内所有蛋白质都是以20种氨基酸为原料合成的多聚体,氨基酸是组成蛋白质的基本单位。
2.存在于自然界中的氨基酸有300余种,但被生物体直接用于合成蛋白质的仅有20种,且均属L-α-氨基酸(除甘氨酸外)。
3.体内也存在若干不参与蛋白质合成但具有重要作用的L-α-氨基酸,如参与合成尿素的鸟氨酸、瓜氨酸和精氨酸代琥珀酸。
4.20种氨基酸根据其侧链的结构和理化性质可分为5类:⑴非极性脂肪族氨基酸:侧链只有C、H原子。
⑶含芳香环的氨基酸:侧链中有了芳香环。
⑷酸性氨基酸:侧链中有了羧基。
芳香族氨基酸中苯基的疏水性较强,酚基和吲哚基在一定条件下可解离;酸性氨基酸的侧链都含有羧基;而碱性氨基酸的侧链分别含有氨基、胍基或咪唑基。
5.20种氨基酸具有共同或特异的理化性质:⑴氨基酸具有两性解离的性质。
①所有氨基酸都含有碱性的α-氨基和酸性的α-羧基,可在酸性溶液中与质子(H+)结合呈带正电荷的阳离子(),也可在碱性溶液中与(OH-)结合,失去质子变成带负电荷的阴离子()。
②氨基酸是一种两性电解质,具有两性解离的特性。
③在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
④取兼性离子两边的pK值的平均值,即为此氨基酸的pI值:pI=1/2(pK1+pK2)⑵含共轭双键的氨基酸具有紫外线吸收性质①含有共轭双键的色氨酸、酪氨酸的最大吸收峰在280nm波长附近。
②由于大多数蛋白质含有酪氨酸和色氨酸残基,所以测定蛋白质溶液280nm的光吸收值,是分析溶液中蛋白质含量的快速简便的方法。
第一章 蛋白质的结构和功能

Ve logM=a-b V
M=
SRT
D(1-υρ)
M:分子量,υ:蛋白质偏微比容,ρ:溶剂 密度,D:扩散系数,S:沉降系数,R:气体 常数,T:绝对温度。
二、蛋白质的变性:在某些物理和 化学的因素作用下,使蛋白质分子 的空间构象发生改变或破坏,导致 其理化性质的改变及生物活性的丧 失的现象称蛋白质的变性。 1、变性的本质 (1)蛋白质变性后分子从规则的紧密 结构变为无规则的松散状态 (2)变性只涉及次级键的断裂
Hb
Myoglobin
O2
Hemoglobin
O2
0毛细 血管中的PO2
肺泡中的PO2
血红蛋白和肌红蛋白的氧合曲线
三、蛋白质的结构与生物进化
第五节 蛋白质的性质 一、蛋白质分子的大小、形状及分子 量的测定 蛋白质分子量一般在1×104~ 1×106Da范围或更大。 凝胶过滤法 SDS聚丙烯酰胺凝胶电泳法 超速离心法 质谱法
(2)β-折叠( β-片层β-pleated sheet structure) β-片层的结构要点: ①肽链相对伸展成锯齿状,侧链基团 伸在肽链的上下两侧。 ②两条以上肽链(或同一条多肽链的不 同部分)平行排列,相邻肽键相互交替 形成许多氢键。氢键是维持β-片层的 主要次级键。 ③肽链平行的走向有顺式和反式两种, 肽链的N端在同侧为顺式,N端不在同 侧称反式。
(五)蛋白质的三级结构(tertiary structure): 多肽链在二级结构的基础上所进行的折 叠和盘旋。或多肽链中个元素在空间的 相对位置。
N
Lys41 His119 His12
C
细胞色素c分子的空间结构
不变的AA残基
(六)蛋白质的四级结构(quarternary structure):两条或两条以上肽链构成 的蛋白质,其中每条多肽链均具有独 立的三级结构,每条多肽链称为一个 亚基。由亚基相互聚合而成的结构称 四级结构。
第一章蛋白质结构基础全篇

39
蛋白质工程
活性位置
无生物活性
40
蛋白质工程
(5)复杂模体(complex motif)
两个相邻的β发夹型模体通过环链相连,构成更加复杂 的模体。组合方式有24种,只有8种被观察到。
41
蛋白质工程
4. 结构域(domain)
结构域:二级结构和结构模体以特定的方式组合连接,在 蛋白质分子中形成 2 个或多个在空间上可以明显 区分的三级折叠实体,称为结构域。
半胱氨酸
Cys
C
glutarmine 谷氨酰胺
Gln Glx
Q
glutarmic acid 谷氨酸
Gln Glx
E
glycine
甘氨酸
Gly
G
histidine
组氨酸
His
H
isoleucine 异亮氨酸
Ile
I
leucine
亮氨酸
Leu
L
lysine
赖氨酸
Lys
K
methionine 甲硫氨酸
Met
可用来鉴定蛋白质构象是否合理。
⑴实线封闭区域
一般允许区,非键合原子间的距离大于一般允许距离,此区域内任何二面角确定的构象都是允许 的,且构象稳定。
⑵虚线封闭区域
是最大允许区,非键合原子间的距离介于最小允许距离和一般允许距离之间,立体化学允许,但 构象不够稳定。
⑶虚线外区域
16 是不允许区,该区域内任何二面角确定的肽链构象,都是不允许的,此构象中非键合原子间距离
构象:组成分子的原子或基团绕单键旋转而形成的不同空 间排布。构象改变,无共价键的断裂和重新形成, 化学上难于区分和分离。
生化第一章

第一章蛋白质的结构与功能——L.D.G一、蛋白质的基本组成单位和平均含氮量基本组成为氨基酸。
组成蛋白质的元素:主要有C、H、O、N和S。
有些蛋白质还含有少量的P、Fe、Cu、Mu、Zn、Se、I等。
各种蛋白质的含氮量很接近,平均16%二、氨基酸的理化性质。
①氨基酸具有两性解离的性质:等电点:在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的PH值称为该氨基酸的等电点。
②含共轭双键的氨基酸具有紫外线吸收性质,测定蛋白质溶液280nm的光吸收值是分析溶液中蛋白质含量的快速简便的方法。
③氨基酸与茚三酮反应生成蓝紫色化合物,最大吸收峰在570nm处。
三、蛋白质的分子结构。
①蛋白质一级结构:在蛋白质分子中,从N-端至C-端的氨基酸排列顺序称为蛋白质的一级结构。
一级结构主要的化学键:肽键。
此外还有二硫键也属于一级结构的范畴。
②蛋白质的二级结构:是指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构像。
维持力:氢键肽单元:参与肽键的6个原子Ca1、C、O、N、H、Ca2位于同一平面,Ca1和Ca2在平面上所处的位置为反式构建,此同一平面上的6个原子构成了所谓的肽单元。
a-螺旋:1、右手螺旋(顺时针),氨基酸侧链向外。
2、每3.6个氨基酸残基上升一圈,螺距0.54nm3、每个肽键的N-H和N端方向第四个肽键的羰基氧形成氢键(隔三个氨基酸残基)4、氢键方向与螺旋长轴平行。
B-折叠的片层结构:肽键平面成近似平行但略呈锯齿状的空间结构。
两段以上肽链或一条肽链的两肽段平行或反向平行排布,以链间氢键相连所形成的结构称为B-片层或B-折叠层。
B-片层可分为顺向平行(肽键的走向相同,即N、C端的方向一致)和逆向平行(两肽段走向相反)结构。
B-折叠的片层结构特点:1、肽键片层比较舒展。
2、氢键方向与肽链长轴垂直。
3、氨基酸残基的侧链分布在片层上下方。
第一章 蛋白质的结构与功能

第一章蛋白质的结构与功能蛋白质组成元素的特点;基本结构单位-----氨基酸(识记)P4肽键:(识记)P7是由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的化合键多肽链:(识记)P7肽链分子中的氨基酸相互衍接,形成的长链,称为多肽链一级结构:(识记)P8是指蛋白质多肽链中从N-端至C-端的氨基酸排列顺序.主要化学键为肽键二级结构:(识记)P8是指多肽链中主链原子的局部空间排布即构象,不涉及侧链部分的构象。
主要的化学键是氢键---主要有α-螺旋、β-折叠、β-转角、无规卷曲等多种形式。
三级结构:(识记)P10整条肽链中全部氨基酸残基的相对空间位置。
即肽链中所有原子在三维空间的排布位置。
四级结构:(识记)P11蛋白质的四级结构是指由多条亚基通过非共价键(主要是氢键和离子键)连接起来的结构形式。
蛋白质是生命物质的重要基础、蛋白质的重要生理工功能(领会)P131、作为生物催化剂(酶)2、代谢调节作用3、免疫保护作用4、物质的转运和存储5、运动与支持作用6、参于细胞间的信息传递蛋白质的二级结构:a-螺旋、β-折叠(应用)P9a-螺旋特点:⑴为一右手螺旋;⑵螺旋每圈包含3.6个氨基酸残基,螺距为0.54 nm;⑶螺旋以氢键维系(第1个aa的NH与第4个aa的 CO 形成氢键),氢键是稳定α-螺旋的主要化学键β-折叠特点1、多肽链充分伸展,肽链主链呈锯齿状折叠构象。
2、Cα总是处于折叠的角上(以Cα为旋转点)3、AA的R基团交替处于锯齿状结构的上下方并与之垂直4、氢键是稳定β-折叠的主要化学键空间结构与功能关系(识记)P14空间结构是蛋白质正确发挥生物学功能的基础一级结构与功能关系(应用)P14(一)一级结构是空间构象和功能的基础蛋白质特定的空间结构是以氨基酸顺序为基础的。
(二)一级结构相似的多肽或蛋白质,其空间构象以及功能也相似(三)一级结构可提供重要的生物进化信息(四)重要蛋白质的氨基酸序列改变可引起疾病蛋白质分子中起关键作用的氨基酸残基缺失或被替代,都会严重影响空间构象乃至生理功能,如分子病。
第一章 蛋白质的结构与功能

蛋白质分子中的非共价键(次级键)
1. 氢键: 氢键 (hydrogen bond) 的形成常见于连接在一电负 性很强的原子上的氢原子,与另一电负性很强的 原子之间。 氢键在维系蛋白质的空间结构稳定上起着重要的 作用。 氢键的键能较低(~12kJ/mol),因而易被破坏。
19
蛋白质分子中氢键的形成
(三) 三级结构
蛋白质的三级结构是 指在二级结构、超二级 结构和结构域基础上, 肽链进一步盘绕、折叠 形成的包括主链和侧链 构象在内的三维结构。 二硫键 —— 共价键 疏水键(主要) 氢键 离子键 范德华力 非共价键(次级键)
36
肌红蛋白 三级结构
维持三级 结构的力
(二)球状蛋白的三级结构特怔
26
(一) 二级结构
定义:肽链主链的空间折叠和盘绕方式。
-螺旋 -折叠 -转角 无规则卷曲
类型
27
1 -螺旋
1950年美国Pauling等人提出
结构特点:
①天然蛋白质几乎所有的α-螺 旋都是右手螺旋,在嗜热菌蛋白 酶中发现了一段左手螺旋。 ②螺旋的每圈有3.6个氨基酸, 螺旋间距离为0.54nm ,每个残 基沿轴旋转100°。 ③氨基酸残基的侧链伸向外侧, 每个氨基酸残基NH上的氢与前
结构特点:
① ② ③ ④ 通常是几个超二级结构的组合 一般由100-200个氨基酸残基组成 结构域之间常形成裂隙,比较松散 酶的活性中心往往位于两个结构域 的界面上 ⑤ 结构域之间有一定的柔性,通过相 对运动,实现一定的生物功能 ⑥ 水解出来后仍能维持稳定的结构, 甚至保留某些生物活性
两个结构域
35
O H2N OH
5
2.氨基酸的光吸收
构成蛋白质的20种氨基酸
第一章 蛋白质结构与功能

第三节 蛋白质结构与功能的关系
一、一级结构与功能关系; 二、空间结构与功能关系;
一、一级结构与功能关系
(一)一级结构是空间结构的基础 上世纪60年代,C.Anfinsen对核糖核 酸酶(RNase)空间构象拆分和复原 实验:
细胞色素C的一级结构与物 种进化间的关系-----物种进 化树(phylogenetic tree)
空间结构(高级结 构):二、三、四级 结构
一、一级结构
1、定义: 蛋白质多肽链中的氨基酸种类、数目 和特定排列顺序,还包括肽链数目和二 硫键位置等 2、稳定作用力-肽键
胰岛素的一级结构: 两条肽链,A链和B链
NH3+
51个氨基酸残基
COO-
3 个二硫键
COO-
二、蛋白质的空间结构
二级结构 三级结构 四级结构
DNA 异常 mRNA
Hbs (亚基)N … —Thr — Pro—Val — Glu—Lys—…
两种最重要的生物大分子比较
蛋白质 组成单位 种 类 氨基酸 20种 核酸 核苷酸
A、C 、G 、T (DNA) A、C 、G 、U (RNA)
(二)氨基酸的理化性质
两性电离及等电点 紫外吸收 显色反应(印三酮反应等)
1、两性电离及等电点
两性电离
兼性离子(zwitterion)
等电点 (isoelectric point,pI)
2、紫外吸收
芳香族氨基酸的紫外吸收 芳香族氨基酸在波长约为280nm处有最大光吸收峰 吸收强度比较:色氨酸>酪氨酸>苯丙氨酸 应用:测定生物样品中蛋白质的含量
α-螺旋的要点:
一般为右手螺旋
每圈含3.6个氨基酸残基 氢键 维持结构稳定 侧链位于螺旋外侧
蛋白质的结构与功能

第一章蛋白质的结构与功能一名词解释别构效应别构效应又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,导致蛋白质生物活性改变的现象。
蛋白质变性由于稳定蛋白质构象的化学键被破坏,造成其四级结构、三级结构甚至二级结构被破坏,导致其天然构象部分或完全破坏,理化性质改变,活性丧失。
等电点在某一PH的溶液中,氨基酸解离成阳离子和阴离子的程度和趋势相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。
氨基酸残基:肽键中的氨基酸分子因脱水缩合而基团不全被称为氨基酸残基。
亚基在体内有许多蛋白质含有2条或2条以上多肽链,才能全面地执行功能.没一条多肽链都有其完完整的三级结构,称为亚基(subunit)。
二蛋白质平均含氮量是多少?有何意义?蛋白质的元素组成为C,H,O,N,S等含氮量为16% 其意义是蛋白质含量=含氮量/16%=含氮量*6.25三如何对氨基酸进行分类?氨基酸根据理化性质分为非极性脂肪族氨基酸极性中性氨基酸碱性侧链氨基酸(精氨酸,赖氨酸,组氨酸)酸性侧链氨基酸(天冬氨酸,谷氨酸)芳香族氨基酸(苯丙氨酸,酪氨酸,色氨酸)四何谓蛋白质一至四级结构?维持其稳定的化学键分别是什么?蛋白质分子的一级结构:蛋白质分子中,从N-端到C-端的氨基酸排列顺序氢键和二硫键蛋白质分子的二级结构:指蛋白质分子中某一肽链的局部主链空间结构。
氢键上下两册一个氨基酸残基的C=O与第四个残基的N-H之间形成氢键,从而使结构稳定蛋白质的三级结构:指整条肽链中全部氨基酸残基的相对空间位置。
疏水键,离子键,氢键,van der waals力蛋白质的四级结构:亚基与亚基之间呈特定的三维空间分布,并以非共价键相链接,这种蛋白质分子中各亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
在体内有许多蛋白质含有2条或2条以上多肽链,才能全面地执行功能.没一条多肽链都有其完完整的三级结构,称为亚基(subunit)。
氢键盐键五举例论证蛋白质结构和功能之间有何关系?蛋白质的一级结构是高级结构与功能的基础1一级结构是空间构象的基础蛋白质以及结构决定蛋白质的空间结构或构象,蛋白质的空间结构或构想决定蛋白质的功能由于血红蛋白分子的构象可以发生一定程度的变化,从而影响了血红蛋白与氧的结合能力。
第一章蛋白质的结构与功能

变性的本质: —— 破坏非共价键和二硫键,不改变蛋 白质的一级结构。
造成变性的因素: 如加热、乙醇等有机溶剂、强酸、强碱、
重金属离子及生物碱试剂等 。
蛋白质变性后的性质改变: 溶解度降低、粘度增加、结晶能力消失、
生物活性丧失及易受蛋白酶水解。
应用举例:
临床医学上,变性因素常被应用来消毒及 灭菌。
防止蛋白质变性也是有效保存蛋白质制剂 (如疫苗等)的必要条件。
复性(renaturation)
若蛋白质变性程度较轻,去除变性因素 后,蛋白质仍可恢复或部分恢复其原有的构 象和功能,称为复性。
去除尿素、 β-巯基乙醇
天然状态, 有催化活性
由于此吸收峰值与氨基酸的含量存在 正比关系,因此可作为氨基酸定量分析方 法。
(三)氨基酸的临床应用
1.作为营养补剂 2儿童过早断奶) 吸收障碍(慢性胃肠炎、胆道阻塞) 蛋白质分解增加(糖尿病、晚期肿瘤、烧伤) 在农村也可见于严重蛔虫、钩虫感染等
多肽链
(二) 生物活性肽
1. 谷胱甘肽(glutathione, GSH) 结构:
• 谷氨酸、半胱氨酸和甘氨酸组成的三肽 • 谷氨酸的-羧基形成肽键 • -SH为活性基团 • 为酸性肽 • 是体内重要的还原剂
主要功能:
H2O2
2GSH
NADP+
GSH过氧 化物酶
GSH还原酶
2H2O
GSSG
氨基酸趣味记忆法
氨基酸真难记 要记先记疏水侧 亮亮缬丙甘, 苯丙脯色蛋; 中极侧链氨基酸 丝苏酪半双酰胺; 酸性天冬谷,碱性赖精组; 芳香酪苯色,羟基酪丝苏; 含硫半胱蛋,要问营养必需酸? 笨蛋!来宿舍晾一晾鞋。 (苯丙、蛋、赖、苏、色、亮、异亮、缬) 苯丙缬异亮,苏亮赖蛋色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.1.5.2 球状蛋白质的分类
(1)全Ϊ-结构(反平行Ϊ-螺旋)蛋白质
(2)Ϊ/Ϋ-结构(平行或混合型Ϋ-折叠股)蛋白 质
A
B
绿色荧光蛋白
图1.28 富含二硫键蛋白质(A)和富含金属蛋白质(B)的实例
蛋白质以模体为基础的结构系统
主要的蛋白质序列和结构数据库
1.1.6
• 球状蛋白分子结构的不同水平
1.1.1 蛋白质的一级结构
1.1.1.1
蛋白质氨基酸
蛋白质一级结构研究进展
见 表1.1
1.1.1.2
( 1 )Edman降解试剂和方法的改进 (2)序列仪的改进与创新 (3)质谱法在蛋白质测序中的应用 (4)核酸测序与蛋白质测序有机结合,相互 印证,仍是当前的最佳选择。
1.1.2.2 肽键的性质
肽键具有部分双键的性质,肽键两端有关原子(羰 基C、羰基O、羰基C连接的CΪ、氨基N、氨基H和氨 基N连接的CΪ)必须处于同一平面,称为肽平面。 绕C-CΪ单键转动的为Ψ角,绕N-CΪ单键转动的为
Φ角,相邻的肽平面通过CΪ彼此连接(图1.5)。 Ψ角以CΪ-C对N-H键呈反式时为0°,Φ角以N-CΪ
1.1.4.2
结构域的运动:
1.1.4.3 结构域的分类:
1.1.5
球形蛋白质的三级结构
多肽链在手性效应的驱动下,遵循尽量减小 表面的原则,折叠、卷曲形成二级结构、超二级 结构和结构域等局部三维结构。为了获得整体上 能量较低的天然构象,这些局部三维结构还需进 一步调整,形成三级结构。三级结构反映了蛋白 质分子或亚基内所有原子的空间排布,但不涉及 亚基间或分子间的空间排列关系。
(2)细胞内特有的微环境(pH、离子强度、水、 温度等)是多肽链折叠成天然构象的重要环境因素。 (3)维持蛋白质三维结构的作用力: 蛋白质中的二硫键和几种次级键的键能
表1.2
键
二硫键 盐 键 氢 键 疏水作用 Van der Waals 力
键 能( kj /lom)
210 12~30 13~30 12~20 4~8
三级结构(tertiary structure)则指整个肽链 的氨基酸残基侧链基团互相作用以及与环境间的 相互作用下形成的三维结构。 寡聚体内亚基的空间排列称为四级结构 (quaternary structure)。
相邻的二级结构往往形成某种有规律的、空间上 可辩认的、更高层次的折叠单元,称为超二级结 构(super-secondary structure)或折叠单元 (folding unit),主要涉及这些构象元件在空 间上如何聚集。与此同时,Wetlaufer观察到蛋白 质分子中存在相对稳定的球状亚结构,其间由单 肽链相互连接,命名为结构域(structural domain)。
第一章
蛋白质的结 构与功能
第一章 蛋白质的结构与功能
蛋白质是活细胞中含量最丰富、功能最复杂的生物大分 子,是各种生物功能主要的体现者。以核酸-蛋白质的 结构、功能及其相互关系为中心,逐渐形成了分子生物 学,成为带领生命科学进入新时代的龙头。
蛋白质的功能与其特殊的结构有着十分密切的内在联系, 结构是特定功能的内在依据,功能则是特定结构的外在
木瓜蛋白酶碱1
木瓜蛋白酶碱2
图1.21 弹性蛋白酶结构示意图
图1.22 木瓜蛋白酶结构示意图
弹性蛋白酶结构示意图
The cell surface protein CD4 consists of four similar domains
甘油醛3—磷 酸脱氢酶的一 个亚基含有两 个不同的结构 域:底物结合 域(绿色)和 NAD结合域 (红色)
细胞内渗透压。 (5)节约误差造成的浪费。遗传信息, 减少生物合成中的 除了少数情况,寡聚蛋白分子中的 亚基在空间上呈对称排布,主要的排布方 式见图1.29。
(6)可将大小、种类有限的亚基组装成
具有特殊几何形状的超分子复合物
图1.29 亚基排布方式 A 烟草花叶病毒的外壳蛋白亚基绕中心轴成螺旋状排列;B C2对称的二聚体,每个亚基绕中 心轴旋转180°好可与另一亚基重合;C C3对称的三聚体,每个亚基绕中心轴旋转120°可与 另一亚基重合;D 四聚体;E 六聚体;F 八聚体。
*46种蛋白质共 5436个残基中各种氨基酸残基所占百分比为总频率;在分子内部 每种残基总数被内部残基总数(1396)除所得百分比为在内部的频率;在分子 表面每种残基总数除以表面残基总数(4040)得到的百分比为在表面的频率。
1.1.2 蛋白质的二级结构
1.1.2.1 素
决定蛋白质高级结构的因
(1)肽链的折叠模式取决于其特定的 氨基酸序列 多肽链中氨基酸序列包含着决定 其三维结构的信息,称为蛋白质卷 曲密码( code of protein folding ) 或 立 体 化 学 密 码 (stereochemistry code),至今尚未完全破译。
对C-O键呈反式时为0°。从CΪ看,CΪ-C键或NCΪ键顺时针方向旋转用“+”号表示,沿反时针方 向旋转用“-”号表示。
肽键的基本 肽键的基本量纲
肽键的部分双键性质
肽平面与二面角
Ramachandran 构象图
1.1.2.3 蛋白质的二级结构
(1)螺旋(helix): ; ②310R螺旋 ; ③π-螺旋:4.416R (2)Ϋ-片层(Ϋ-pleated sheet):
球状蛋白质的四级结构
四级结构的形式具有以下优越性:
(1)四级结构赋予蛋白质更加复杂的结构, 以便执行更为复杂的功能。 (2)通过亚基间的协同效应,可以对酶活 性进行别构调节。
(3)中间代谢途径中有关的酶分子以亚基 的形式组装成结构化多酶复合物,可避 免中间产物的浪费,提高了催化效率。
(4)寡聚体的形成在一定程度上降低了
(3)Ϋ-迂回(Ϋ-meander):
(4)Ϋ-折叠筒(Ϋ-sheet barrel):
1.1.3.3 一些已知功能的超二级结构
(1)螺旋-回折-螺旋(helix-turn-helix, HTH):
(2)锌指(Zine fenger, ZF):
(3)亮氨酸拉链(Leucine Zipper, LZ):
(4)螺旋-环-螺旋(helix-loop-helix, HLH):
(5)EF手(EFhand):
1.1.4 结构域
1.1.4.1 结构域的概念:
球蛋白分子内存在紧密的球状亚结构,称为结构 域。
结构域的概念具有三种不同而又相互联系的涵义: 即独立的结构单位、独立的功能单位和独立的折叠单 位。
表现,涉及其生物学意义、分子功能和亚细胞定位。 因此,阐明蛋白质的分子结构及其与功能的关系是现代 生物化学的基本命题,是揭示生命运动规律的必由之路。
1.1 蛋白质分子的结构
根 据结构特点可将天然蛋白质分为:球形蛋白质
(glosular protein)、 纤维状蛋白质(fibrous protein)、膜蛋白(membrane protein)和 天然无 序蛋白质(intrinsically disordered protein),其中, 研究得最深入的是球形蛋白质,将 其分子结构划分成 一、二、三、四级四个结构层次:
①Ϊ-螺旋:3.613R
(3)回折(reverse turn):
①Ϋ-回折 ; ② ά-回折: (4)Ω环(Ωloop):
(5)连接条带:
(6)无序结构:
α—螺旋的各种图示 α
β—片层示意图
Ⅰ型β—回折
Ⅱ型β—回折
Ω—环
各种二级结构元件的二面角
二级结构的可变性
1.1.3 超二级结构
1.1.5.1
球状蛋白质三维结构的特征
(1)球状蛋白质分子含有多种二级结构元件
见表1.4
(2)球状蛋白质三维结构具有明显的折叠层次
(3)球状蛋白质分子是紧密的球状或椭球状实体
(4)球状蛋白质具有疏水的内核和亲水的表面
(5)球状蛋白质分子表面有一空穴
Lactoferrin Lactoferrin
表1.1 蛋白质氨基酸的某些特性
氨基酸 缩写符号 Ala (A) Arg (R) Asn (N) Asp (D) Cys (C) Gln (Q) Glu (E) Gly (G) His (H) Ile (I) Leu (L) Lys (K) Met (M) Phe (F) Pro (P) Ser (S) Thr (T) Trp (W) Tyr (Y) Val (V) 分子量 (Da) 71.08 156.20 114.11 115.05 103.13 128.14 129.12 57.06 137.15 113.17 113.17 128.18 131.21 147.18 97.12 87.08 101.11 186.21 163.18 99.14 体积 (Å3) 88.6 173.4 117.7 111.1 108.5 143.9 138.4 60.1 153.2 166.7 166.7 168.7 162.9 189.9 122.7 89.0 116.1 227.8 193.6 140.0 可接触面积 (Å2) 115 225 160 150 135 180 190 75 195 175 170 200 185 210 145 115 140 255 230 155 疏水性 (K-D法相) 1.8 (7) -4.0 (20) -3.5 (15) -3.5 (15) 2.5 (5) -3.5 (15) -3.5 (15) 0.4 (8) -3.2 (14) 4.5 (1) 3.8 (3) -3.9 (19) 1.9 (6) 2.8 (4) -1.6 (13) -0.8 (10) -0.7 (9) -0.9 (11) -1.3 (12) 4.2 (2) 总频率* (%) 8.7 3.1 5.2 6.1 2.7 3.6 4.9 9.0 2.2 4.9 6.5 6.7 1.5 3.8 4.0 7.0 6.4 1.6 4.4 6.6 在内部 的频率 (%) 11.0 0.4 2.0 2.2 5.4 1.3 1.0 9.7 2.4 10.5 12.8 0.3 3.0 7.7 2.2 5.0 4.6 2.7 3.3 12.7 在外部的频 率(%) 7.9 4.0 6.3 7.4 1.8 4.5 6.2 8.8 2.2 3.0 4.3 8.9 0.9 2.5 4.7 8.9 7.1 1.3 4.8 4.6 转移自由能 (kcal· mol-1) 0.20 -1.34 -0.69 -0.72 0.67 -0.74 -1.09 0.06 0.04 0.74 0.65 -2.00 0.71 0.67 -0.44 -0.34 -0.26 0.45 -0.22 0.61
