DP103--离心柱型--质粒小提试剂盒
质粒小提sop
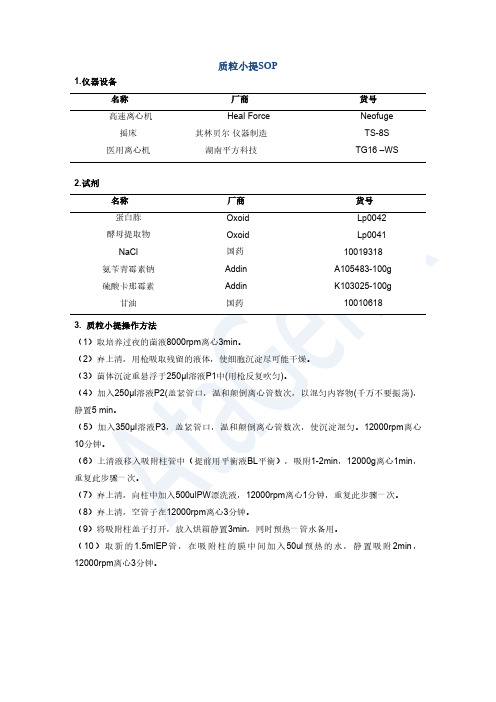
1.仪器设备 名称Heal Force 其林贝尔 仪器制造 湖南平方科技
货号 Neofuge TS-8S TG16 –WS
2.试剂 名称 蛋白胨 酵母提取物 NaCl
氨苄青霉素钠 硫酸卡那霉素
甘油
厂商 Oxoid Oxoid 国药 Addin Addin 国药
货号 Lp0042 Lp0041 10019318 A105483-100g K103025-100g 10010618
3. 质粒小提操作方法 (1)取培养过夜的菌液8000rpm离心3min。 (2)弃上清,用枪吸取残留的液体,使细胞沉淀尽可能干燥。 (3)菌体沉淀重悬浮于250μl溶液P1中(用枪反复吹匀)。 (4)加入250μl溶液P2(盖紧管口,温和颠倒离心管数次,以混匀内容物(千万不要振荡), 静置5 min。 (5)加入350μl溶液P3,盖紧管口,温和颠倒离心管数次,使沉淀混匀。12000rpm离心 10分钟。 (6)上清液移入吸附柱管中(提前用平衡液BL平衡),吸附1-2min,12000g离心1min, 重复此步骤一次。 (7)弃上清,向柱中加入500ulPW漂洗液,12000rpm离心1分钟,重复此步骤一次。 (8)弃上清,空管子在12000rpm离心3分钟。 (9)将吸附柱盖子打开,放入烘箱静置3min,同时预热一管水备用。 ( 10 ) 取 新 的 1.5mlEP 管 , 在 吸 附 柱 的 膜 中 间 加 入 50ul 预 热 的 水 , 静 置 吸 附 2min , 12000rpm离心3分钟。
高纯质粒小量提取试剂盒(柱离心型)

高纯质粒小量提取试剂盒(柱离心型)(Plasmid Minispin HP Kit Ver.2)产品说明:本试剂盒在常规柱离心质粒提取技术的基础上,改进了硅基质膜材料和试剂配方,使质粒DNA获得高效、专一吸附。
经过两步洗涤,可清除蛋白质、基因组DNA、RNA和其他杂质。
新增基质平衡液处理步骤,可进一步提高硅胶膜的DNA吸附能力,获得稳定的质粒产量。
适合于从1~3 ml培养液中提取质粒DNA。
高拷贝菌液可获得质粒DNA约5~30 μg,可应用于各种常规实验如酶切、PCR、测序、连接、转化和体外转录等操作,并可用于细胞转染工作。
产品内容与储存方法:名称数量保存条件Buffer P1(重悬液)20 ml RTBuffer P2(裂解液)20 ml RTBuffer P3(结合液)30 ml RTBuffer PE(平衡液)30 ml RTBuffer PWT (洗涤液T)* 30 ml RTBuffer PW (洗涤液)** 20 ml RTElution Buffer(洗脱液)10 ml RT离心柱及套管100套RTRNase A 20 mg/ml 0.1 ml -20℃试剂盒可作100次质粒小量提取。
常温运输,室温保存。
RNase A于-20℃保存,首次使用时加入Buffer P1中混匀,置4℃保存。
*Buffer PWT(洗涤液T)在首次使用时加入异丙醇30 ml混匀。
**Buffer PW(洗涤液)在首次使用时加入无水乙醇80 ml混匀。
有效期1年。
所需其它试剂:使用者需准备加入洗涤液的无水乙醇和异丙醇。
操作方法:1)收菌:取过夜培养菌1~3 ml菌液,装入1.5ml 或2ml离心管中,12,000 x g于室温离心2 min沉淀菌体,完全弃除上清。
2)重悬:加入200 µl Buffer P1,充分混悬震荡菌体沉淀10~15 sec,使其完全分散开,至无絮块存在。
3)裂解:加入200 µl Buffer P2,轻轻颠倒离心管3~5次,室温放置2~3 min,使细菌完全裂解,溶液透明。
高纯度质粒小提试剂盒使用说明书

高纯度质粒小提试剂盒 Pure Mini Plasmid Kit(目录号:HS0103)产品包装试剂盒成分 50 preps Buffer P1 15 ml Buffer P2 15 ml Buffer P3 20 ml Buffer PD 30 ml RNase A(10 mg/ml)150 ul Buffer PW 60 ml Buffer EB 10 ml Spin Columns PA 50个 Collection Tubes (2 ml)50个(注意:使用前将全部RNase A 溶液加到Buffer P1中混合均匀,2 ~ 8℃保存)保存条件本试剂盒在室温(15 ~ 25℃)干燥条件下,可保存12个月;更长时间的保存可置于2 ~ 8℃。
若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。
单独包装的RNase A 在室温可稳定保存12个月。
加入RNase A 后的Buffer P1应置于2 ~ 8℃保存,可稳定保存6个月。
产品简介本试剂盒用于高纯度质粒DNA 的小量制备与纯化。
菌体经碱裂解、高盐、低pH 处理,质粒可从菌体中释放出来,并特异、高效地被离心柱硅胶膜(Spin Columns PA )吸附。
通过去蛋白液(Buffer PD )和漂洗液(Buffer PW )的清洗可去除蛋白及其他杂质,在低盐、高pH 条件下洗脱,最后得到高纯度的质粒DNA 。
北京厚生博泰科技有限公司Beijing Hooseen Biotech Co., Ltd.使用本试剂盒可从1 ~ 5 ml过夜培养的菌液中纯化得到高达20 ug的高纯度质粒DNA,可在30 min之内完成提取任务。
所得质粒可直接用于酶切、转化、PCR、测序、低敏感细胞株的转染等各种常规分子生物学操作。
产品特点1. 快速:步骤少,操作简便,节约时间。
2. 简便:离心吸附柱不需要预平衡,漂洗液Buffer PW 和去蛋白液Buffer PD不需要另加乙醇,即开即用。
树脂型质粒DNA小量提取试剂盒操作说明

树脂型™质粒DNA小量提取试剂盒操作方法1. 将3~5ml菌液13,000rpm离心30秒收集沉淀(菌体)。
如果用1.5ml或2ml离心管则需反复离心2~3次。
2. 倒掉上清,将沉淀(菌体)完全悬浮于100µl悬浮液(溶液I)中。
上清要尽可能去除干净,可用滤纸吸干。
沉淀要用混旋器完全悬浮,否则将直接导致下一步的裂解不彻底,进而影响质粒DNA的产量和纯度。
3. 加入150µl裂解液(溶液II),轻柔地颠倒混匀10次左右,溶液逐渐变得粘稠、清亮。
不可用混旋器剧烈振荡,否则会使质粒DNA断裂;裂解时间不宜超过5分钟,否则会造成染色体DNA的污染及质粒DNA的产率降低。
4.加入150µl中和液(溶液III),轻柔地颠倒混匀10次左右。
此时可见到白色絮状的染色体DNA及细菌碎片。
5. 13,000rpm离心8~10分钟,将上清液小心转入一个新的1.5ml离心管中,加入0.4ml纯化树脂(使用前充分混匀),颠倒混匀3分钟。
此步是通过离心去除染色体DNA及细菌碎片,并使处于高盐状态下的质粒DNA与纯化树脂结合。
6.将纯化树脂及上清液的混和物吸入离心纯化柱中,13,000rpm离心30秒,倒掉收集管中的废液。
7.将离心纯化柱重新套入废液收集管中,加入600µl 80%异丙醇(或80%乙醇),13,000rpm离心1分钟,倒掉收集管中的废液。
如果离心纯化柱底部残留有异丙醇(或乙醇),可用滤纸吸干,否则将影响以后的酶促反应。
此步是洗涤质粒DNA中混有的杂质及盐类。
8.重复第7步1~2次,尽可能将杂质去除。
9.取出离心纯化柱,将其套入一个干净的1.5ml离心管,开盖放置2~3分钟,将残留的异丙醇或乙醇挥发干净。
加入50µl TE缓冲液(若用于测序,则加50µl超纯水)于纯化树脂上,不能粘在管壁上。
室温下放置3分钟后,13,000rpm离心1分钟。
此步是将纯化树脂上的DNA洗脱下来。
质粒小量提取试剂盒说明书

质粒小量提取试剂盒说明书货号:D1100规格:50T/100T保存:常温保存,复检期一年。
(注:RNase A以附件形式发货,收到未使用前请-20℃保存)试剂盒内容:试剂盒组成D1100-50T D1100-100TRNase A300ul500ul溶液Ⅰ15ml30ml溶液Ⅱ15ml30ml溶液Ⅲ20ml40ml漂洗液15ml15ml×2洗脱液15ml30ml吸附柱50个100个收集管50个100个说明书1份1份产品说明:本试剂盒采用碱裂解法裂解细胞,根据离心吸附柱在高盐状态下特异性地结合溶液中的DNA的原理特异性提取质粒DNA。
离心吸附柱中采用的硅基质材料能高效、专一地吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。
使用本试剂盒提取的质粒DNA可适用于各种常规操作,包括酶切、PCR、测序、连接和转化等试验。
使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶体上的标签。
溶液Ⅰ在使用前先加入RNaseA (将试剂盒中提供的RNaseA全部加入),混匀,置于2-8℃保存。
如非指明,所有离心步骤均为使用台式离心机在室温下离心。
操作步骤:1、取1-5ml细菌培养物,12000rpm离心1min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
2、向留有菌体沉淀的离心管中加入250ul溶液Ⅰ(请先检查是否已加入RNaseA),使用移液器或旋涡振荡器彻底悬浮细菌细胞沉淀。
注意:如果菌块未彻底混匀,会影响裂解导致质粒提取量和纯度偏低。
3、向离心管中加入250ul溶液Ⅱ,温和地上下翻转6-8次使菌体充分裂解。
注意:混匀一定要温和,以免污染细菌基因组DNA,此时菌液应变得清亮粘稠,作用时间不要超过5min,以免质粒受到破坏。
4、向离心管中加入350ul溶液Ⅲ,立即温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。
12000rpm离心10min,用移液器小心地将上清转移到另一个干净的离心管中,尽量不要吸出沉淀。
质粒大量提取试剂盒(离心柱型)操作方法及步骤说明书

杭州昊鑫生物科技股份有限公司 htpp://Plasmid Maxi Kit质粒大量快速提取试剂盒目录号:PL11试剂盒组成、储存、稳定性:试剂盒组成保存10次(PL1101)RNaseA(10mg/ml)-20℃750µl溶液P1 4℃77 ml溶液P2 室温77 ml溶液N3 室温77 ml漂洗液WB 室温25 ml X 2第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温20 ml吸附柱DC 室温10个收集管(50ml)室温10个本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.第一次使用时,将试剂盒所带全部的RNase A加入溶液P1后(终浓度100μg/ml)置于4℃保存。
如果溶液P1中RNase A失活,提取的质粒可能会有微量RNA残留,在溶液P1中补加RNase A即可。
2.环境温度低时溶液P2中SDS可能会析出出现浑浊或者沉淀,可在37℃水浴加热几分钟,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:本试剂盒采用改进SDS-碱裂解法裂解细胞,离心吸附柱内的硅基质膜在高盐、低pH值状态下选择性地结合溶液中的质粒DNA,再通过去蛋白液和漂洗液将杂质和其它细菌成分去除,最后低盐、高pH值的洗脱缓冲液将纯净质粒DNA从硅基质膜上洗脱。
产品特点:1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
克服了国产试剂盒膜质量不稳定的弊端。
2.不需要使用有毒的苯酚、氯仿等试剂,也不需要乙醇沉淀。
快速、方便,从150-300ml大肠杆菌LB((Luria-Bertani)培养液中,可快速提取0.2-1.5mg纯净的高拷贝质粒DNA,提取率达80 %左右。
3.获得的质粒产量高、超螺旋比例高、纯度好,可以直接用于酶切、转化、PCR、体外转录、测序等各种分子生物学实验。
质粒小提试剂盒提取质粒

质粒小提试剂盒提取质粒
(1)柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μL的平衡液BL,12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1分钟,尽量吸除上清;
(3)向留有菌体沉淀的离心管中加入250μL溶液P1(先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
(4)向离心管中加入250μL溶液P2,温和地上下翻转6-8次使菌体充分裂解;
(5)向离心管中加入350μL溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀。
12,000rpm离心10分钟,此时在离心管中底部形成沉淀;
(6)将上一步收集的上清液用移液器转移到吸附柱CP3中,注意尽量不要吸出沉淀。
12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(7)向吸附柱CP3中加入600μL漂洗液PW(先检查是否已加入无水乙醇),12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(8)重复操作步骤(8);
(9)将吸附柱CP3放入收集管中,12,000rpm离心2分钟,目的是将吸附柱中残余的漂洗液除去;
(10)将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50-100μL洗脱缓冲液EB,室温放置2分钟,12,000rpm离心2分钟将质粒溶液收集到离心管中。
高纯度质粒小量提取试剂盒 说明书

大班数学活动教案:拼图教案1. 教学背景学生年龄:4-5岁学生已具备的知识和技能:会数数、认识一到十的数字、知道形状与颜色的区别2. 教学目标2.1 知识目标1.学生能把简单的拼图拼好,并准确地说出拼图所属的几何形状。
2.学生能通过拼图,巩固对一到十个数字的认识。
2.2 技能目标1.提升学生的动手能力,能够按照图示,拼好拼图。
2.培养学生的观察能力,能够观察拼图的几何形状和数字,准确地做出判断。
2.3 情感目标1.养成学生对数学活动的兴趣,让学生体验到学习数学的快乐。
2.培养学生的合作意识,学生能够在小组内合作完成拼图。
3. 教学过程3.1 导入环节教师问学生:“你们在家里会玩拼图吗?”学生回答时,教师让学生展示一下自己的拼图,然后教师说:“好的,今天我们就来学习大一点的拼图,准备好了吗?”3.2 活动环节一:拼图过程1.分组:教师将学生分成小组,每组三到四名学生。
2.活动准备:教师为每个小组提供一份数字拼图图纸,和相应的拼图,每张图纸上有一到十个数字和图形,学生需要根据图纸上的数字和图形拼出对应的图片。
3.活动过程:教师告诉学生,现在开始拼图,让学生自由组合句子,优美表达以及敢于发言。
学生在拼图过程中,要注意拼图的位置和相互之间的关系,有效进行小组合作,完成自己的任务。
3.3 活动环节二:讲解数字与形状教师在学生完成拼图后,根据每个组完成拼图的情况,问学生完成拼图的过程,并带学生回顾每个数字都对应的几何形状,如数字一对应的图形是直线,数字五对应的图形是五边形等。
3.4 活动环节三:游戏比赛教师让每个小组选一名代表出来,分别进行拼图比赛,以时间最短和完成度最高的小组为胜者,并为获胜小组颁发奖励。
4. 教学反思这次的数学活动,让学生在拼图的过程中,不仅锻炼了学生的动手能力和观察力,还让学生对数字和几何形状有了更深刻的认识。
同时,我们也培养了学生的合作意识,让他们感受到集体的力量。
在今后的数学活动中,我们将进一步发扬数学活动的魅力,让学生在活动中感受到更多的乐趣。
质粒小量提取质粒小量提取试剂盒

质粒小质粒小量提取量提取量提取试剂盒试剂盒(Plasmid Miniprep Kit )目录号目录号::ZP101 版本版本::2014-10-15 试剂盒内容: 试剂盒组成ZP101-1 (50次) ZP101-2 (100次) ZP101-3 (200次) RNaseA (10 mg/ml) 150 μl 300 μl 600 μl 溶液1 15 ml 30 ml 60ml 溶液2 15 ml 30 ml 60 ml 溶液3 20 ml 40 ml 80 ml去蛋白液W1 30 ml 60 ml 120 ml 漂洗液W2 15 ml 2X15 ml 2X30 ml 洗脱缓冲液TE 15 ml 15 ml 30ml 吸附柱 50个 100个 200个 收集管(2 ml) 50个 100个 200个 说明书 1份 1份 1份 储存条件: 本试剂盒在室温(15-25℃)干燥条件下,可保存1年;更长时间的保存可置于2-8℃。
若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。
单独包装的RNase A 在-20℃可稳定保存1年以上。
加入RNase A 后的溶液1应置于2–8℃保存,可稳定保存半年。
产品简介: 本试剂盒采用碱裂解法裂解细菌,再通过离心吸附柱在高盐状态下特异性地结合溶液中的DNA。
离心吸附柱中采用的硅基质材料为本公司特有新型材料,高效、专一吸附DNA。
本说明书操作步骤适用于从1-5 ml过夜培养的大肠杆菌LB(Luria-Bertani) 培养液中,快速提取多至40 μg纯净的高拷贝质粒DNA。
使用本试剂盒提取的质粒DNA 可适用于各种常规操作,包括酶切、PCR、测序、连接、转化、文库筛选、体外翻译等。
注意事项:请务必在使用本试剂盒之前阅读此注意事项。
1. 按1:100的比例向溶液1中加入RNaseA,混匀,置于2–8℃保存。
2. 第一次使用前应按照试剂瓶标签的说明先在漂洗液W2中加入无水乙醇。
康为世纪 质粒小提试剂盒
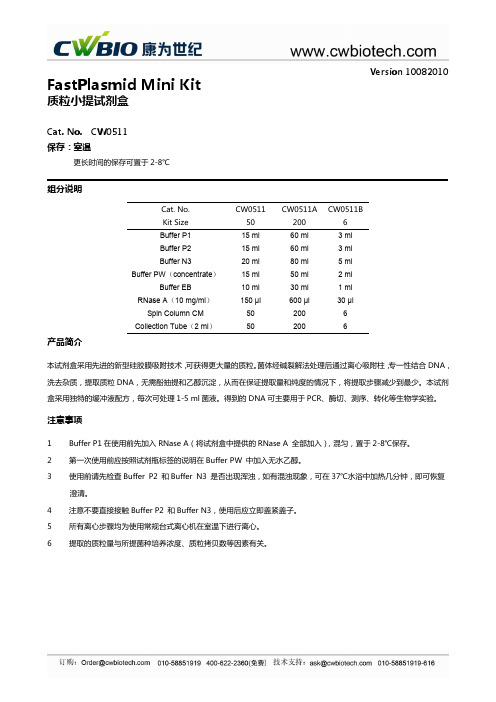
Version 10082010FastPlasmid Mini Kit质粒小提试剂盒Cat. No. CW0511 保存:室温更长时间的保存可置于2-8℃组分说明Cat. No. CW0511 CW0511A CW0511BKit Size 50 200 6 Buffer P1 15 ml 60 ml 3 ml Buffer P2 15 ml 60 ml 3 ml Buffer N320 ml 80 ml 5 ml Buffer PW (concentrate )15 ml 50 ml 2 ml Buffer EB 10 ml 30 ml 1 ml RNase A (10 mg/ml ) 150 μl 600 μl 30 μl Spin Column CM 502006Collection Tube (2 ml )50 200 6产品简介本试剂盒采用先进的新型硅胶膜吸附技术,可获得更大量的质粒。
菌体经碱裂解法处理后通过离心吸附柱,专一性结合DNA,洗去杂质,提取质粒DNA,无需酚抽提和乙醇沉淀,从而在保证提取量和纯度的情况下,将提取步骤减少到最少。
本试剂盒采用独特的缓冲液配方,每次可处理1-5 ml 菌液。
得到的DNA 可主要用于PCR、酶切、测序、转化等生物学实验。
注意事项1 Buffer P1在使用前先加入RNase A(将试剂盒中提供的RNase A 全部加入),混匀,置于2-8℃保存。
2 第一次使用前应按照试剂瓶标签的说明在Buffer PW 中加入无水乙醇。
3使用前请先检查Buffer P2 和Buffer N3 是否出现浑浊,如有混浊现象,可在37℃水浴中加热几分钟,即可恢复澄清。
4 注意不要直接接触Buffer P2 和Buffer N3,使用后应立即盖紧盖子。
5 所有离心步骤均为使用常规台式离心机在室温下进行离心。
6提取的质粒量与所提菌种培养浓度、质粒拷贝数等因素有关。
操作步骤1.取1-5 ml 过夜培养的菌液,加入离心管中,>8000 rpm(~6800 x g)离心3分钟,尽量吸弃上清。
质粒小提试剂盒使用说明书

质粒小提试剂盒I 简明步骤(PD1211)(详细内容请参考英文说明书)I.实验前准备 II. 注意事项RNase A: 使用前将提供的所有RNase A 瞬时离心后加入Buffer A1, 使用后将Buffer A1/RNase A 置于4o C 保存。
质粒拷贝数:纯化中低拷贝的质粒时,使用2倍的菌液体积,2倍的Buffer A1,B1,N1, 相同体积的Wash Buffer 和Elution Buffer.转化菌:若为-70o C 甘油冻存的菌,请先涂布平板培养后,再重新挑选新的单个菌落进行培养。
切勿直接取冻存的菌种进行培养。
DNA Wash Buffer*: 使用前请将8 mL (PD1211-00)或48 mL (PD1211-01)或216 mL (PD1211-02) or 90 mL (PD1211-03) 96-100% 乙醇加入DNA Wash Buffer 。
Buffer B1: 在低于室温时会沉淀,请于50o C 左右水浴加热至沉淀完全溶解,溶液澄清,使用后保证Buffer B1瓶盖旋紧。
在室温下(22-25o C )进行所有离心操作。
III. 操作步骤1. 接种新鲜的单个菌落到1-5 mL 的LB 培养基(含适量抗生素),37o C 震荡培养14-16小时。
室温下10,000 x g 离心1分钟,收集菌体,并尽可能的吸去上清。
注:残留的液体培养基容易导致菌液裂解不充分,第5步离心后沉淀较松,不能有效吸取上清。
注:本说明书中的操作程序适用于标准LB (Luria Bertani )培养基培养12-16 小时后,OD 600(细菌密度)在2.0-3.0之间的菌液。
若采用的是富集培养基,例如TB 或2×YT,请注意保证OD 600不超过3.0。
2. 加入250 µL Buffer A1(确保已加入RNase A ),用移液枪或涡流震荡充分悬浮细菌细胞。
高纯质粒小量制备试剂盒(升级版离心柱型)

试剂盒组成Components GK2002-100GK2002-200Plasmid Recovery Column100个200个2-mL Collection Tube100个200个Buffer CBS25mL50mlSolution I30mL60mlSolution II30mL60mlSolution III42mL90mlW1solution60mL125mlWash Solution*24mL24ml+60mlElution Buffer20mL25mlRNase A(10mg/mL)240µl500µl注:1、Buffer CBS用于质粒提取前柱子的平衡处理,可以活化硅胶膜,有利于提高质粒的产量。
2、*Wash Solution在使用前应按要求加入乙醇:使用后及时盖紧瓶盖,防止乙醇挥发。
3、Wash solution分两瓶,大瓶用于配制工作液(已预装24ml母液),小瓶为母液,当大瓶工作液用完时,可从小瓶中取24ml用于配制工作液。
4、独立包装的RNase A收货后请于-20℃保存;初次使用本试剂盒时,请将RNase A全部加入Solution I中,均匀混合后,4℃保存,表明日期,如长时间不用,请于-20度冻存。
5、Solution II:SolutionⅢ:室温保存。
6、试剂盒其余组分于室温(15℃~25℃)可以稳定存放1.5年而使用活性无明显衰减。
室温过高或需要更长期保存,请放置于2~8℃。
◆产品特点:●本试剂盒所提取的质粒DNA可用于多种常规实验,包括酶切、测序、转化等。
●本试剂盒采用常规碱裂解法分离质粒DNA,并结合膜吸附技术特异性吸附质粒DNA,具有高效、快速、方便的特点。
◆实验前准备:●第一次使用产品前,请仔细阅读该说明书。
●确认Solution I中已经加入RNase A,并做好标记。
●检查Washing Solution是否按照要求加入乙醇。
Axygenmini-prepare质粒提取试剂盒说明书

Axygenmini-prepare质粒提取试剂盒说明书AxyPrep质粒DNA⼩量试剂盒本试剂盒采⽤改进的SDS碱裂解法,结合DNA制备膜选择性地吸附DNA的⽅法达到快速纯化质粒DNA的⽬的。
适合于从1-4 ml细菌培养物中提取多⾄20 µg⾼纯的质粒DNA,⽤于测序、体外转录与翻译、限制性内切酶消化、细菌转化等分⼦⽣物学实验。
⼀、试剂盒组成、贮存、稳定性Cat. No. AP-MN-P-4 AP-MN-P-50 AP-MN-P-250制备次数 4 preps 50 preps 250 preps250 制备管 4 502502 ml离⼼管 4 502501.5 ml离⼼管 4 50RNase A 10µl30µl150µlBuffer S1 2 ml 15 ml 75 mlBuffer S2 2 ml 15 ml 75 mlBuffer S3 2.5 ml 21 ml 105 mlBuffer W1 2.8 ml 28 ml 135 mlBuffer W2 concentrate 2.4 ml 24 ml 2×72 mlEluent 1 ml 5 ml 25 ml说明书 1 1 1 RNase A:50 mg/ml,室温可贮存6个⽉,长期贮存于-20°C。
Buffer S1:细菌悬浮液。
加⼊RNase A后,混合均匀,4°C贮存。
Buffer S2:细菌裂解液(含SDS/NaOH),室温密闭贮存。
Buffer S3:中和液,室温密闭贮存。
Buffer W1:洗涤液,室温密闭贮存。
Buffer W2 concentrate:去盐液。
使⽤前,按试剂瓶上指定的体积加⼊⽆⽔⼄醇(可⽤100%⼄醇或95%⼄醇)。
混合均匀,室温密闭贮存。
Eluent:2.5 mM Tris-HCl,pH 8.5,室温密闭贮存。
⼆、注意事项Buffer S2、Buffer S3和Buffer W1含刺激性化合物,操作时要戴乳胶⼿套和眼镜,避免沾染⽪肤、眼睛和⾐服,谨防吸⼊⼝⿐。
天根质粒小提试剂盒说明书(DP103)

天根质粒小提试剂盒说明书(DP103)注意事项1.请务必在使用本试剂盒之前阅读此注意事项2.溶液P1在使用前先加入RNaseA(将试剂盒中提供的RNaseA全部加入),混匀,置于2-8°C保存。
3.使用前请先检查平衡液BL、溶液P2和P3是否出现浑浊,如有混浊现象,可在37°C水浴中加热几分钟,即可恢复澄清。
4.注意不要直接接触溶液P2和P3,使用后应立即盖紧盖子。
5.所有离心步骤均为使用常规台式离心机室温下进行离心,速度为12,000rpm(~13,400g)。
6.提取的质粒量与细菌培养浓度、质粒拷贝数等因素有关。
7.实验前使用平衡液BL处理吸附柱,可以最大限度激活硅基质膜,提高得率。
8.用平衡液BL处理过的柱子最好当天使用,放置时间过长会影响效果。
9.去蛋白液PD可以有效去除残留的蛋白污染,当宿主菌为endA+(TG1、BL21、HB101、ET12567、JM系列)等核酸酶含量较高的菌株时,强烈推荐使用去蛋白液PD。
操作步骤使用前请先在漂洗液PW中加入无水乙醇,加入体积请参照瓶上的标签。
1.柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μI的平衡液BL,12,000rpm(~13,400g)离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
(请使用当天处理过的柱子)2.取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm(~13,400g)离心1min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
3.向留有菌体沉淀的离心管中加入250μI溶液P1(请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀注意如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。
4.向离心管中加入250μl溶液P2,温和地上下翻转6-8次使菌体充分裂解。
注意:温和地混合,不要剧烈震荡,以免打断基因组DNA,造成提取的质粒中混有基因组DNA片断此时菌液应变得清亮粘稠,所用时间不应超过5min,以免质粒受到破坏。
质粒小量提取纯化试剂盒 说明书

质粒小量提取纯化试剂盒使用说明书产品简介GBpure Plasmid试剂盒是质粒DNA提取领域中的突破性进展,它有效结合了细胞裂解,杂质去除,及质粒纯化等功能。
无需过柱,不用酚氯仿抽提,直接获得高质量的质粒DNA。
我们独特的试剂系统能确保所提质粒DNA高产量,高质量。
本试剂纯度高,采用人性化设计,可按用户需求灵活制定容量大小。
产品特色●简单:添加GBpure Plasmid使细胞裂解,释放DNA,及杂质去除有效结合起来。
●方便:无需过柱,无需过滤,无需高效液相色谱法,无需超速离心机,无需特殊设备。
●无毒性:无酚、氯仿,无饱和正丁醇,无溴化乙锭,无氯化铯,无盐酸胍。
●快速:一分钟完成菌体沉淀,五分钟完成颗粒细菌碎片,10分钟完成沉淀质粒DNA,从培养细菌到提取质粒DNA只需30分钟。
●高纯度:A260/A280 = 1.7-1.8. 所得质粒DNA无任何抑制剂,可应用于所有分子生物学的操作。
●延展性: 一盒GBpure Plasmid试剂盒可以进行:miniprep, midiprep,或maxiprep;无需购买额外的试剂盒。
●高产量: 您可以从1 (mini), 10 (midi), 100 (maxi) ml的过夜培养基中获得大约5μg, 50 μg, 500 μg的DNA质粒。
●实惠:一盒GBpure Plasmid 售价 RMB 500/ 50 minipreps,即 RMB10/miniprep ,质优价廉。
产品内容与储存条件室温保存。
有效期12个月。
操作方法1.取1 ml过夜培养菌液,装入1.5 ml离心管中,室温12,000 × g离心1 min沉淀菌体,完全弃除上清。
2.加入300 μl Buffer P1,充分混匀震荡菌体沉淀10-15 sec,使其完全分散开,至无絮块存在。
3.加入300 μl Buffer P2,轻轻颠倒离心管3-5次,室温放置1 min,使细菌完全裂解,此时溶液应呈透明。
传染性肌肉坏死病毒快速检测方法的建立

传染性肌肉坏死病毒快速检测方法的建立作者:杨苗,林华,董新燕,陈世界,方智,张婧,安微,薛昌华,张妙来源:《畜牧兽医科学》 2019年第4期杨苗1,林华1,董新燕2,陈世界1,方智1,张婧1,安微1,薛昌华1,张妙1(1.成都海关技术中心,成都 610041;2.四川大学华西医学院,成都 610013)摘要:为建立一种检测传染性肌肉坏死病毒的荧光定量RT-PCR方法,利用GenBank中收录的该病毒的全基因序列,设计特异性的引物与TaqMan探针,并构建包含目的序列的质粒作为标准品,经过优化反应参数建立检测传染性肌肉坏死病毒的荧光定量RT-PCR方法。
结果显示,建立的方法特异性良好,对其他8种病毒核酸无扩增,扩增总时长90 min。
该方法的灵敏度达到220 copies/μL。
重复性好,批内变异系数为0.3%~0.7%。
外标法定量所需的标准曲线方程为y=﹣3.404x+37.21,相关系数R2=0.997,扩增效率为96.7%。
应用建立的方法对15批南美白对虾样品进行检测,未检出阳性。
试验结果表明,所建立的实时荧光定量RT-PCR方法特异、灵敏、可定量,适用于对虾样品中传染性肌肉坏死病毒的检测。
关键词:传染性肌肉坏死病毒;检测方法;荧光定量RT-PCR中图分类号:S945.46文献标识码:Bdoi:10.3969/j.issn.2096-3637.2019.04.0030 引言传染性肌肉坏死病毒(Infectious Myonecrosis virus,IMNV)是对虾传染性肌肉坏死病的病原体。
IMNV为双链RNA病毒,主要侵染南美白对虾的横纹肌组织,感染IMNV的对虾,累积死亡率高达70%[1]。
传染性肌肉坏死病毒,属于整体病毒科[2]。
南美白对虾是已知IMNV的最易感虾种,在生长的各个阶段均可被感染。
该病第一次在2002年出现于巴西的凡纳滨对虾养殖场,2006年传入印度尼西亚[2],感染虾出现体色发白、腹节发红、尾部肌肉组织呈点状或扩散状,体表有不规则黑斑的症状,死亡率在40%~70%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 向留有菌体沉淀的离心管中加入 250 µl 溶液 P1(请先检查是否已加入 RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀。 注意:如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。
蛋白液 PD。
技术支持:010-59822661/2665
操作步骤:
1. 柱平衡步骤:向吸附柱 CP3 中(吸附柱放入收集管中)加入 500µl 的平衡液 BL,12,000 rpm (~13,400×g ) 离心 1 分钟,倒掉收集管中的废液,将吸附柱 重新放回收集管中。(请使用当天处理过的柱子)
5. 向离心管中加入 350 µl 溶液 P3,立即温和地上下翻转 6–8 次,充分混匀,此 时将出现白色絮状沉淀。12,000 rpm (~13,400×g )离心 10 分钟,此时在离心 管底部形成沉淀。 注意:P3 加入后应立即混合,避免产生局部沉淀。如果上清中还有微小白色 沉淀,可再次离心后取上清。
1-5ml
6-30ug
pTZ,pUC, pBS, pGM-T
注意事项:请务必在使用本试剂盒之前阅读此注意事项。
1. 溶液 P1 在使用前先加入 RNaseA(将试剂盒中提供的 RNaseA 全部加入), 混匀,置于 2–8℃保存。
2. 第一次使用前应按照试剂瓶标签的说明先在漂洗液 PW 中加入无水乙醇。
DP103-03 (200 次) 600 µl 120ml
60 ml 60 ml 80 ml 120ml 50 ml 30 ml 200 个 200 个 1份
储存条件:
本试剂盒在室温(15-25℃)干燥条件下,可保存 1 年;更长时间的保存可置于 2-8℃。若溶液产生沉淀,应在使用前置于 37℃下溶解沉淀。单独包装的 RNase A 在室温可稳定保存 1 年以上。加入 RNase A 后的溶液 P1 应置于 2–8℃保存,可 稳定保存半年。
4. 向离心管中加入 250 µl 溶液 P2,温和地上下翻转 6-8 次使菌体充分裂解。 注意:温和地混合,不要剧烈震荡,以免打断基因组 DNA,造成提取的质粒 中混有基因组 DNA 片断。此时菌液应变得清亮粘稠,所用时间不应超过 5 分 钟,以免质粒受到破坏。如果未变得清亮,可能由于菌体过多,裂解不彻底, 应减少菌体量。
使用本试剂盒提取的质粒 DNA 可适用于各种常规操作,包括。
提取得率:
质粒类型 菌液量
得率
质粒
pBR322, pACYC 及其衍生载体,
低拷贝
1-5ml
3-12ug pSC101 及其衍生载体,SuperCos,
pWE15
高拷贝
11. 将吸附柱 CP3 置于一个干净的离心管中,向吸附膜的中间部位滴加 50-100 µl 洗脱缓冲液 EB,室温放置 2 分钟,12,000 rpm (~13,400×g) 离心 1 分钟将 质粒溶液收集到离心管中。 注意: 洗脱液的 pH 值对于洗脱效率有很大影响。若用水做洗脱液,应保证其 pH 值 在 7.0-8.5 范围内(可以用 NaOH 将水的 pH 值调到此范围),pH 值低于 7.0 会降低洗脱效率。 洗脱缓冲液体积不应少于 50 µl,体积过小影响回收效率。且 DNA 产物应保 存在-20℃,以防 DNA 降解。
低拷贝或大质粒(>10 kb)提取
如果所提质粒为低拷贝质粒或大于 10kb 的大质粒,应加大菌体使用量,使用 5-10 ml 过夜培养物,同时按照比例增加 P1、P2、P3 的用量,洗脱缓冲液 EB 应 在 65-70℃水浴预热,在吸附和洗脱时可以适当的延长时间,以增加提取效率。 其它步骤相同。
本产品仅供科研使用。请勿用于医药、临床治疗、食品及化妆品等用途。
(离心柱型) 目录号:DP103 试剂盒内容:
试剂盒组成
RNaseA (10 mg/ml) 平衡液 BL 溶液 P1 溶液 P2 溶液 P3
去蛋白液 PD 漂洗液 PW 洗脱缓冲液 EB 吸附柱 CP3 收集管(2 ml)
说明书
DP103-02 (50 次) 150 µl 30ml 15 ml 15 ml 20 ml 30 ml 15 ml 15 ml 50 个 50 个 1份
TIANGEN BIOTECH (BEIJING) CO., LTD. Order: 010-59822688 Technical: 010-59822661/2665 Toll-free: 800-990-6057
版本号: PP080822
TIANprep Байду номын сангаасini Plasmid Kit 质粒小提试剂盒
3. 使用前请先检查平衡液 BL、溶液 P2 和 P3 是否出现浑浊,如有混浊现象, 可在 37℃水浴中加热几分钟,即可恢复澄清。
4. 注意不要直接接触溶液 P2 和 P3,使用后应立即盖紧盖子。
5. 所有离心步骤均为使用常规台式离心机室温下进行离心,速度为 12,000 rpm (~13,400×g )。
产品简介:
本试剂盒采用碱裂解法裂解细菌,再通过离心吸附柱在高盐状态下特异性地
结合溶液中的DNA。离心吸附柱中采用的硅基质材料为本公司特有新型材料,高
效、专一吸附DNA。以下操作步骤适用于提取1-5 ml过夜培养的大肠杆菌,质粒提
取得率和质量与宿主菌的种类和培养条件,细胞的裂解,质粒拷贝数,质粒的稳
定性,抗生素等因素有关。
10. 将吸附柱 CP3 放入收集管中, 12,000 rpm (~13,400×g) 离心 2 分钟,目的是 将吸附柱中残余的漂洗液去除。 注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切、PCR 等)实验。为 确保下游实验不受残留乙醇的影响,建议将吸附柱 CP3 开盖,置于室温放置 数分钟,以彻底晾干吸附材料中残余的漂洗液。
6. 提取的质粒量与细菌培养浓度、质粒拷贝数等因素有关。
7. 实验前使用平衡液处理吸附柱,可以最大限度激活硅基质膜,提高得率。 8. 用平衡液处理过的柱子最好当天使用,放置时间过长会影响效果。 9. 去蛋白液 PD 可以有效去除残留的蛋白污染,当宿主菌为 endA(+ TG1、BL21、
HB101、ET12567、JM 系列)等核酸酶含量较高的菌株时,强烈推荐使用去
6. 将上一步收集的上清液用移液器转移到吸附柱 CP3 中 (吸附柱放入收集管 中),注意尽量不要吸出沉淀。12,000 rpm (~13,400×g)离心 30-60 秒,倒掉 收集管中的废液,将吸附柱 CP3 放入收集管中。
7. 可 选 步 骤 : 向 吸 附 柱 CP3 中 加 入 500 µl 去 蛋 白液 PD , 12,000 rpm (~13,400×g )离心 30–60 秒,倒掉收集管中的废液,将吸附柱 CP3 重新放回 收集管中。 如果宿主菌是 end A+宿主菌(TG1,BL21, HB101,JM 系列, ET12567 等),这些宿主菌含有大量的核酸酶,易降解质粒 DNA,推荐采用此步。 如果宿主菌是 endA-宿主菌(DH5α,TOP10 等),这步可省略。
订货电话:010-59822688
8. 向吸附柱 CP3 中加入 600 µl 漂洗液 PW(请先检查是否已加入无水乙醇), 12,000 rpm (~13,400×g )离心 30-60 秒,倒掉收集管中的废液,将吸附柱 CP3 放入收集管中。
9. 向吸附柱 CP3 中加入 600 µl 漂洗液 PW,12,000 rpm (~13,400×g) 离心 30-60 秒,倒掉收集管中的废液。
