耐碳青霉烯类铜绿假单胞菌的耐药机制
食品动物源碳青霉烯耐药革兰阴性菌的流行特征及传播机制

关键词:耐药机制、铜绿假单胞 菌、碳青霉烯类抗生素
研究现状
目前,耐碳青霉烯类铜绿假单胞菌的耐药机制研究已经取得了一定的进展。主 要包括以下几个方面:
1、产生碳青霉烯酶:耐碳青霉烯类铜绿假单胞菌能够产生一种碳青霉烯酶, 这种酶可以分解碳青霉烯类抗生素,使其失去抗菌活性。
2、药物外排:耐碳青霉烯类铜绿假单胞菌可以通过药物外排系统将抗生素排 出细胞外,降低药物在细胞内的浓度,从而逃避抗生素的杀菌作用。
3、细胞壁屏障:铜绿假单胞菌的细胞壁具有很高的屏障作用,可以阻止抗生 素进入细胞内,从而降低抗生素的治疗效果。
4、基因突变:耐碳青霉烯类铜绿假单胞菌的基因突变可以导致抗生素作用靶 位的改变,从而逃避抗生素的杀菌作用。
3、缺乏新型抗菌药物:目前对 于耐碳青霉烯类铜绿假单胞菌的 治疗
1、加强耐药机制研究:深入探究耐碳青霉烯类铜绿假单胞菌的耐药机制,了 解各因素之间的相互作用,为寻找新型抗菌药物和制定有效的治疗方案提供理 论支持。
五、结论
食品动物源碳青霉烯耐药革兰阴性菌的流行和传播是一个复杂的问题,需要采 取多种措施进行控制。通过严格执行兽药使用规定、加强卫生管理、实施生物 安全措施、加强抗菌药物使用培训、开展耐药性监测以及研发新型抗菌药物等 措施,可以有效地控制食品动物源碳青霉烯耐药革兰阴性菌的流行和传播,保 障公众的健康安全。
参考内容
近年来,碳青霉烯耐药革兰阴性杆菌(CR-GNB)感染在全球范围内日益增多, 成为医院内感染和社区感染的重要病原菌。由于碳青霉烯类抗生素的滥用,导 致细菌耐药性不断增强,给临床治疗带来极大困难。为了有效预防与控制碳青 霉烯耐药革兰阴性杆菌感染的传播,中国政府制定了相应的预防与控制技术指 引。
食品动物源碳青霉烯耐药革兰 阴性菌的流行特征及传播机制
碳青霉烯类抗生素耐药菌的耐药机制

shockwave lithotripsy in lower caliceal calcium oxalate
urolithiasis:a randomized controlled trial[J]. Journal of
类、B 类和 D 类,而 C 类酶主要指染色体编码的头孢菌素酶
(AmpC 酶)。
2.1.1 A 类酶。A 类酶是一种超广谱β-内酰胺酶(ESBLs),介
导细菌对青霉素和头孢菌素以及单环内酰胺类抗生素耐药,
然而近年来不断有介导碳青霉烯类抗生素耐药,主要见于大
肠埃希菌和肠杆菌属耐药机制的研究,尤其是有关肺炎克雷
蛋白(PBPs),从而阻碍细胞壁黏肽合成,使细菌胞壁缺损,菌
体膨胀致使细菌胞浆渗透压改变和细胞溶解而杀灭细菌。哺
乳动物无细胞壁,不受此类药物的影响,因而本类药具有对细
菌的选择性杀菌作用,对宿主毒性小。近十多年来已证实细
菌胞浆膜上特殊蛋白 PBPs 是此药的作用靶位,比如亚胺培南
与 PBP 结合,尤其是与 PBP-1 的亲和力很强,阻碍细胞壁的合
citrate on blood pressure in hypertensives[J]. Hypertension,2005,45(4):571.
张惠琴,李大强,ቤተ መጻሕፍቲ ባይዱ家明,等.枸橼酸钾对高血压患者血压
的影响[J].河北医学,
2006,12(11):
1 125.
Soygür T,Akbay A,Küpeli S. Effect of potassium citrate
碳青霉烯类抗生素耐药菌的耐药机制
细菌的耐药性与多重耐药菌

• ②代谢缓慢:抗菌药物往往对处于代谢旺盛期的细菌敏感。细菌形成BF后处于
营养限制状态,细菌生物被膜下细菌代谢低下,对抗菌药物敏感性降低
• ③免疫逃逸:生物被膜的存在阻止了机体对细菌的免疫力,使之产生免疫逃逸
现象,减弱机体免疫力与抗菌药物的协同杀菌作用 。
• ④诱导耐药基因的产生等。
耐药菌增加的原因
• 获得性耐药是由质粒介导的耐药。某些菌株通过耐药因子产生大量β-内
酰胺酶,使耐酶青霉素缓慢失活,表现出耐药性。
对金葡菌有活性的抗菌药物
• 抗葡萄球菌的β-内酰胺类:甲氧西林、苯唑西林、头孢西丁 • 氨基糖苷类:庆大霉素 • 喹诺酮类:左氧氟沙星、环丙沙星 • 磺胺类:复方磺胺甲恶唑 • 大环内酯类及林可霉素类:红霉素、阿奇霉素、克林霉素 • 四环素类:米诺环素、替加环素 • 糖肽类:万古霉素、替考拉宁 • 噁唑烷酮类:利奈唑胺
• 耐药菌产生增加(抗生素选择性压力):由于过多地使用抗
生素(医疗、畜牧业等),造成对基因突变及耐药基因转移的耐 药菌进行了筛选
• 耐药菌传播增加:通过医护人员尤其手的接触,细菌在病人
间交叉寄生造成耐药菌株在医院内的传播,以及随后通过宿 主病人的转移,耐药菌在医院间甚至社区进行传播
多重耐药菌
由于许多细菌有多种耐药机制同时存在,对多种抗菌药物产生耐药性,因 此产生了多重耐药菌。
• 多重耐药菌(Multidrug-Resistant Bacteria,MDR),是指细菌对临床常
用的三类或三类以上敏感抗菌药物产生耐药。
• 广泛耐药菌(Extensive Drug Resistant Bacteria,XDR),是指细粘 菌素和替加环素敏感,G+球菌仅对糖肽类和利奈唑胺敏感。
细菌耐药机理及其耐药细菌的

定 义:耐甲氧西林、耐苯唑西林且多重耐药的葡萄球 菌。 • 耐药机理:MecA编码PBP2a及PBPs改变。 • 意义:对目前所有的β-内酰胺类耐药,通常对氨基 甙类、大环内酯类、克林霉素和四环素多重耐药。 • 治疗:1.MRS轻度感染:利福平 ,SMZ- TMP,环丙 沙星;
2.MRS严重全身感染:首选万古霉素
1.克拉维酸、舒巴坦、他唑巴坦. 2.对TEM型 三种均有抑制作用,作用相仿 3.对SHV型 他唑巴坦、克拉维酸强于舒巴坦
1.TEM-1产量过多 2.外膜蛋白改变 3.1型酶(AmpC) 4.1 2 型酶并存 5.2br(IRT) 6.2d(OXA-11)
产生机制 :染色体上的Amp(通常处于被抑 制状态)突变,去阻遏,活化编码产生AmpC 酶。
细菌耐药机理及其耐药细菌的
产生灭活酶 靶位改变 低通性屏障作用(膜通透性下降及生物被膜) 主动外运 细胞缺乏自溶酶,对抗菌药物产生耐受性
• 抗菌药物
耐药机制
• β-内酰胺类 细胞壁通性降低,与PBPs亲和力与结 合力
降低,产β-内酰胺酶,自溶
• 氨基甙类 摄入减少,产钝化酶,核糖体30S亚基改变,
已报告17种,其中出现最多、分布最广的是 CMY-2。
往往在抗生素治疗过程中诱导产生,并有可能 选择出持续、大量产酶的耐药菌株(去阻遏突 变株)
AMP是许多潜在的酶诱导剂之一,但没有选 择去阻遏突变株的作用。
许多3-ceph是弱诱导剂,但有选择去阻遏突 变株的作用。
随着新型头孢菌素的使用特点增加,能产生TYPE 1 β-Lac,导致对β-内酰胺类多重耐药的菌株迅速出现并 成为医院感染的重要病原菌。
在72小时菌血症期间,在适当治疗和无适当治疗的对头孢他啶耐 药的病人的结果.很多情况下我们很难证实细菌的MIC值与所选用 抗生素疗效之间具有明确的关系。
耐碳青霉烯类铜绿假单胞菌的耐药性检测

耐碳青霉烯类铜绿假单胞菌的耐药性检测摘要:目的:分析探讨耐碳青霉烯类铜绿假单胞菌对其他抗菌药物的耐药性。
方法:对我院2020年1月至2020年8月收集的187株铜绿假单胞菌进行回顾性分析,均采用全自动微生物鉴定系统开展细菌鉴定和药敏试验,评定铜绿假单胞菌对碳青霉烯类抗菌药物耐药的菌株数。
结果:铜绿假单胞菌对碳青霉烯类抗菌药物耐药的菌株数可以达到121株,占比64.71%,其中以美罗培南和亚胺培南同时耐药为主。
改良Hodge试验的阳性菌株检出率达到52株,阳性率为42.95%。
结论:铜绿假单胞菌对碳青霉烯类抗菌药物耐药的机制较为复杂,为减少耐药菌株的产生可以加强抗菌药物的合理应用,以此减少医院感染暴发流行事件。
关键词:铜绿假单胞菌;碳青霉烯酶;耐药性;微生物铜绿假单胞菌是临床一种常见的条件性致病菌,极易导致医院发生感染事件。
作为一种假单胞菌属,革兰阴性杆菌,铜绿假单胞菌会导致免疫力低下和重症监护室患者感染,成为威胁重症治疗患者生命安全的主要感染病菌[1]。
更为不利的一点是,随着近年来铜绿假单胞菌抗菌药物的广泛使用,所出现的耐碳青霉烯类铜绿假单胞菌越来越多,已经成为医院感染防控的棘手问题之一,因而明确耐碳青霉烯类铜绿假单胞菌对其他抗菌药物的耐药性尤为关键[2]。
本文对我院2020年1月至2020年8月收集的187株铜绿假单胞菌进行回顾性分析,现将本次研究成果作如下的分析论述。
1资料与方法1.1.一般资料对我院2020年1月至2020年8月收集的187株铜绿假单胞菌进行回顾性分析,药敏试验质控菌株ATCC27853。
1.1.方法本次试验选用由法国梅里埃公司所生产的Vitek-2 Compact 全自动微生物鉴定系统,操作过程中严格遵循相关规范,以美国临床实验室标准化研究所作出的解释标准来评定药敏结果。
在改良Hodge试验中,在无菌状态下制备大肠杆菌0.5麦氏浊度菌悬液并10倍稀释,而后用棉签蘸取菌液涂布MH平皿,在MH平皿上常规放置厄他培南纸片。
铜绿假单胞菌感染和耐药机制

铜绿假单胞菌感染和耐药机制铜绿假单胞菌是革兰氏阴性杆菌,是条件致病菌,它对健康的机体几乎不会引起感染,但是对免疫受损的机体可以引起严重的感染,免疫受损的机体包括囊性纤维化患者,癌症病人,艾滋病毒感染者,严重烧伤病人[1] 。
由于传统的抗生素治疗,使铜绿假单胞菌对许多抗生素产生了严重的耐药性,它可以产生各种灭活酶或修饰酶, 如内酰胺酶等; 菌体蛋白结构和功能改变逃避抗菌药物作用; 膜屏障与主动排外; 形成生物保护膜等[4] ,来抵制抗生素的作用。
这也是在临床上很棘手的问题,使铜绿假单胞菌不仅成为难以治疗的病原菌,也使其成为众多研究细菌致病性和耐药性的对象。
首先来了解一下铜绿假单胞菌引起的常见的感染和疾病。
1、铜绿假单胞菌引起的常见的感染和疾病在临床上发现呼吸科和烧伤科铜绿假单胞菌感染率和检出率较高。
1.1 铜绿假单胞菌相关性肺炎它包括慢性阻塞性肺疾病(COPD),医院获得性肺炎(CAP,呼吸机相关性肺炎(VAP), 气管镜相关性肺炎,囊性纤维变性(CF等。
慢性阻塞性肺疾病( COPD) 慢性阻塞性肺疾病( COPD) 是以感染为主要表现的疾病, 由于其呼吸道防御功能下降, 支气管清除能力减弱, 故能引起多种细菌的感染,铜绿假单胞菌感染是COPD病人急性加重的主要原因。
铜绿假单胞菌一开始就被认为是引起慢性阻塞性肺疾病(COPD的重要的致病菌[10] , Laura的研究证明铜绿假单胞菌引起COP爾人的慢性感染[11]。
医院获得性肺炎( CAP) 铜绿假单胞菌在社区获得性肺炎中不常见,但在医院获得性肺炎(CAP中较常见的病原菌之一[2]。
CAP是COPD常见并发症和重要死亡原因之一,近年来国内关于COPD患者合并CAP 方面的研究得到广泛关注。
同时由于社会人口的老龄化、免疫损害宿主增加、病原菌变迁和抗菌药物耐药率上升等原因, 其致病菌的组成和耐药特性在不同国家、不同地区之间存在着明显差异而且随着时间的推移而不断变迁[6] 。
世界卫生组织医疗机构耐碳青霉烯的 肠杆菌科细菌铜绿假

·指南解读·世界卫生组织《医疗机构耐碳青霉烯的肠杆菌科细菌、铜绿假单胞菌和鲍曼不动杆菌防控指南》介绍乔甫1,宗志勇1, 21. 四川大学华西医院医院感染管理部(成都 610041)2. 四川大学华西医院感染性疾病中心(成都 610041)宗志勇:四川大学华西医院感染性疾病中心教授、博士生导师,四川大学华西医院医院感染管理部部长。
本科毕业于华西医大临床医学专业,毕业后留华西医院感染性疾病中心工作,历任住院医师、住院总医师、讲师、副主任医师和教授。
2006年获澳大利亚政府全额奖学金到澳大利亚悉尼大学感染与微生物中心攻读博士,2009年获博士学位回国。
现主要从事重症感染的诊治、细菌耐药性研究和医院感染防控。
已发表SCI收录文章80多篇。
获国家自然科学基金优青、英国皇家学会牛顿高级学者。
【摘要】 耐碳青霉烯肠杆菌科细菌、铜绿假单胞菌和鲍曼不动杆菌是医院感染的重要病原体,并在最近几年内广泛扩散。
为预防和控制该耐药菌在医疗机构内传播,2017 年世界卫生组织组织编写了《医疗机构耐碳青霉烯的肠杆菌科细菌、鲍曼不动杆菌和铜绿假单胞菌防控指南》。
该文将从指南编写的背景、编写过程、主要防控措施、优缺点等方面进行介绍,希望能帮助广大感控从业人员落实指南,切实降低这些多重耐药菌的医院感染。
【关键词】 耐碳青霉烯肠杆菌科细菌;耐碳青霉烯铜绿假单胞菌;耐碳青霉烯鲍曼不动杆菌;世界卫生组织;防控指南Interpretation of Guidelines for the Prevention and Control of Carbapenem-resistant Enterobacteriaceae, Acinetobacter baumannii and Pseudomonas aeruginosa in healthcare facilitiesQIAO Fu1, ZONG Zhiyong1, 21. Infection Prevention and Control Department, West China Hospital, Sichuan University, Chengdu, Sichuan 610041, P. R. China2. Department of Infectious Diseases, West China Hospital, Sichuan University, Chengdu, Sichuan 610041, P. R. ChinaCorresponding author: ZONG Zhiyong, Email: zongzhiyong@【Abstract】 There is a worldwide consensus that urgent action is needed to prevent and control multi-drug resistant organisms in health care settings, especially Carbapenem-resistant Enterobacteriaceae(CRE), Carbapenem-resistant Acinetobacter baumannii (CRAB) and Carbapenem-resistant Pseudomonas aeruginosa (CRPsA). In 2017, tofocus on this topic, world health organization organized experts worldwide to develop guidelines for the prevention andcontrol of CRE, CRPsA and CRAB. In this paper, we introduced the background, development process, main measures, advantages and disadvantages of the guidelines to help infection prevention and control practitioners take actions properlybased on the guidelines.【Key words】 Carbapenem-resistant Enterobacteriaceae; Carbapenem-resistant Acinetobacter baumannii; Carbapenem-resistant Pseudomonas aeruginosa; World Health Organization; GuidelinesDOI:10.7507/1002-0179.201803013通信作者:宗志勇,Email:zongzhiyong@1 背景近年,耐碳青霉烯革兰阴性菌引起的医院感染不断增加,特别是耐碳青霉烯的肠杆菌科细菌(Carbapenem-resistant Enterobacteriaceae,CRE)、耐碳青霉烯的鲍曼不动杆菌(Carbapenem-resistant Acinetobacter baumannii,CRAB)和耐碳青霉烯的铜绿假单胞菌(Carbapenem-resistant Pseudomonas aeruginosa,CRPsA)。
3-新耐药机制

三、靶位改变
药 β -内酰胺类 大环内酯和林可霉素类 喹诺酮类 氨基糖苷类 碘胺类 TMP 物 耐 药 机 理 PBPs 亲和力下降或产生 PBP2a 核糖体 50S 亚基的 23S RNA 片段受影响 DNA 旋转酶 A 亚单位改变 核糖体 30S 亚基改变 生成新的二氢叶酸合成酶 生成新的二氢叶酸还原酶
如铜绿假单胞菌的细胞外膜上没有大多数革兰阴性细菌
所具有的典型的高渗透性孔蛋白,它的孔蛋白通道对小 分子物质的渗透速度仅为典型孔蛋白通道的1%。
“后天培养”
一些具有高渗透性外膜且对抗菌药物敏感的细菌可以通过 降低外膜的渗透性而发展成为耐药菌,即原有的孔蛋白通 道由于细菌发生突变而使该孔蛋白通道关闭或消失,则细
87Kda——PBP1—— 80 ——PBP2—— 78 ——PBP2a 75 ——PBP3’—— 70 ——PBP3—— 41 ——PBP4——
耐万古霉素的肠球菌(VRE)
糖肽类抗生素包括万古霉素、替考拉宁等,是高分 子量的疏水性化合物。
主要耐药机制:
VRE的细胞壁肽糖前体末端的D-丙氨酰-D-丙氨酸发 生了改变,万古霉素不能与之相结合,因此不能抑 制VRE的细胞壁合成。
碳青霉烯酶
指所有能明显水解亚胺培南或美罗培南等碳青 霉烯类抗生素的一类β内酰胺酶 分别属于Ambler分子分类中的A类、B类、D类 酶。
碳青霉烯酶按其来源可分为
天然来源碳青霉烯酶
嗜麦芽寡养单胞菌的L1酶
获得性碳青霉烯酶(Ambler分子分类)
B类酶(金属酶):IMP、VIM类及SPM-1
Bush-Jacoby-Med eiros group 1 2a 2b 2be 2br 2c 2d 2e 2f 3 4
1989 Bush group 1(头孢菌素酶) 2a(青霉素酶) 2b(广谱酶) 2b’(超广谱酶) Not included Not included 2d 2e Not included 3(金属酶) Not included
《中国铜绿假单胞菌下呼吸道感染诊治专家共识(2022 版)》更新解读

《中国铜绿假单胞菌下呼吸道感染诊治专家共识(2022 版)》更新解读一、新共识在 PA 下呼吸道流行病学和耐药性变迁方面的更新新共识分析了疾病流行病学、病原菌流行病学和耐药性变迁。
主要包括以下几方面:•PA 的分离率近年来有下降趋势,占呼吸道标本分离菌的第 3~4 位;•但在支气管肺泡灌洗液(BALF)标本分离菌中 PA 占第 1 位,而构成比有下降趋势;•医院获得性肺炎(HAP)中 MDR-PA 比例较高,呼吸机相关性肺炎(VAP)中 MDR-PA 比例更高;•下呼吸道感染中碳青霉烯类耐药 PA(CRPA)的比例上升明显,已经成为当前临床抗感染治疗的难题。
▶ DTR-PA 的概念在所有的革兰氏阴性菌中,PA 的耐药表现形式复杂多样。
过去,大家对铜绿多重耐药(MDR-PA)、泛耐药(XDR-PA)、全耐药(PDR-PA),包括碳青霉烯类耐药(CR-PA)的概念比较清晰,但是根据新的形势,共识提出了 DTR-PA——难治耐药性铜绿假单胞菌,这个新的概念。
这一次新共识里面,对于耐药的新形式:DTR-PA 做了重点介绍。
DTR-PA 这个概念最早是在 2015 年由美国 CDC 提出,并做了简单的定义,2018 年,通过一项回顾性队列分析正式阐述了 DTR-PA 的概念及其对于临床治疗的影响。
首先,DTR 是不同于传统的 MDR、XDR,因为 DTR 更加关注一线治疗药物的耐药性,如果出现 DTR 则意味着我们失去了高效、低毒性的治疗药物选择,因此这个概念的区分是更加贴近临床的。
其实 DTR 菌株完全符合 CDC 定义的 MDR、XDR 的概念,但是和 PDR 比较,DTR 提供了更符合临床实际应用的概念,因为 DTR 关注点是细菌是否对所有一线药物产生耐药性,而无需扩展到所有的抗菌药物。
▶适应性耐药其次,新共识关注了 PA 复杂的耐药机制。
在新的耐药机制中特别强调了两点:第一是生物被膜的形成,第二是群体感知系统。
碳青霉烯类抗生素耐药机制介绍

碳青霉烯类抗生素耐药机制介绍碳青霉烯类抗生素一种非典型beta-内酰胺类抗生素,具有抗菌谱广、抗菌活性强以及对beta-内酰胺酶稳定以及毒性低等特点,对控制耐药菌、产酶菌感染及免疫缺陷者感染发挥着重要作用。
其结构与青霉素类的青霉环相似,不同之处在于噻唑环上的硫原子为碳所替代,且C2与C3之间存在不饱和双键;另外,其6位羟乙基侧链为反式构象。
研究证明,正是这个构型特殊的基团,使该类化合物与通常青霉烯的顺式构象显著不同,具有超广谱的、极强的抗菌活性,以及对beta-内酰胺酶高度的稳定性。
碳青霉烯类抗生素作用方式都是抑制胞壁粘肽合成酶,即青霉素结合蛋白(PBPs),从而阻碍细胞壁粘肽合成,使细菌胞壁缺损,菌体膨胀致使细菌胞浆渗透压改变和细胞溶解而杀灭细菌。
哺乳动物无细胞壁,不受此类药物的影响,因而本类药具有对细菌的选择性杀菌作用,对宿主毒性小。
青霉素结合蛋白(PBPs)是存在于细胞浆膜上的蛋白,分两类,一类具有转肽酶和转糖基酶的活性,参与细胞壁的合成,另一类具有羧肽酶活性,与细菌细胞分裂和维持形态有关。
近十多年来已证实细菌胞浆膜上特殊蛋白PBPs是此药的作用靶位,亚胺培南与PBP2的亲和力很强,结合后阻碍细胞壁的合成,可使细菌迅速肿胀、溶解,而且其作用很少受接种菌量(PH5.5~8.5)的影响。
美罗培南能迅速渗透入肠杆菌科和铜绿假单孢菌靶位,主要是与PBP2和PBP3紧密结合。
国内已经上市的品种有亚胺培南,美罗培南,帕尼培南,法罗培南,厄他培南,比阿培南。
抗菌药物出现,总是伴随着细菌耐药性的产生,碳青霉烯类抗生素虽然刚开始使用时,细菌的耐药性相当低,对常见病原菌的敏感率很高,但碳青霉烯类与其他抗菌药物一样,在临床应用后即出现耐药菌株。
目前临床上已出现亚胺培南、美罗培南等碳青霉烯类药物的耐药菌株。
细菌对碳青霉烯类抗菌药物耐药的机制主要有以下几种:1.外膜孔蛋白减少或丢失伴高水平beta-内酰胺酶的持续产生外膜的通透性对药物进入菌体至关重要,抗生素可以通过通道蛋白直接扩散进入胞内,并到达菌体内的相应作用部位,从而达到抑菌或杀菌的作用。
碳青霉烯类抗生素耐药及治疗挑战

碳青霉烯类抗生素耐药及治疗挑战聂署萍;陆学东【摘要】碳青霉烯类抗生素曾被认为是临床治疗革兰阴性杆菌感染的最后一道防线。
随着一系列碳青霉烯酶的出现,临床分离的碳青霉烯类抗生素耐药菌日益增多,并且这些病原菌常同时携带其他多种耐药基因,几乎对所有抗生素耐药,其所引起的感染有很高的病死率。
本文对碳青霉烯类抗生素耐药现状、耐药机制及相关感染的治疗进行综述。
%Carbapenems were once considered the last line of defense against serious infections with gram-negative pathogens. As carbapenemases are spreading, the incidence of carbapenem-resistant isolates is increasing. The rise of carbapenem resistance in these pathogens carrying additional resistance genes to multiple antibiotic classes has created a generation of organisms nearly resis-tant to all available therapy and the infections caused by these pathogens have been associated with high mortality rates. This review focuses on the current status and mechanisms of carbapenem resistance, and the treatment of related infections.【期刊名称】《传染病信息》【年(卷),期】2014(000)003【总页数】5页(P134-138)【关键词】青霉属;抗菌药;药物耐受性;治疗学【作者】聂署萍;陆学东【作者单位】518033 深圳,广东医学院附属福田医院检验医学部;518033 深圳,广东医学院附属福田医院检验医学部【正文语种】中文【中图分类】R379碳青霉烯类抗生素是目前抗菌谱最广的一类非典型β-内酰胺抗生素,通过抑制细胞壁粘肽合成酶即青霉素结合蛋白合成细胞壁粘肽,导致细菌胞壁缺损、胞内渗透压改变和细菌溶解,从而发挥抗菌作用。
耐碳青霉烯肺炎克雷伯菌耐药机制及治疗策略

耐碳青霉烯肠杆菌科细菌(carbapenem resistantEnterobacteriaceae ,CRE )被美国疾病控制与预防中心(Centers for Disease Control and Prevention ,CDC )和世界卫生组织(World Health Organization ,WHO )列为最“紧急”和“关键优先”的公共卫生威胁之一[1]。
耐碳青霉烯肺炎克雷伯菌(carbapenem resistant Klebsiellapneumoniae ,CRKP )是造成全球疾病负担急剧增加的最常见的CRE [2]。
1997年MACKENZIE 等首次发现CRKP [3],此后CRKP 迅速在全球广泛传播[4]。
来自中国抗微生物药物监测网(China Antimicrobial SurveillanceNetwork ,CHINET )的数据显示,2009年肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别为4.9%和4.8%[5],而在2022年达到20.4%和21.9%,13年时间耐药率增加约4倍。
来自欧洲疾病预防和控制中心(European Centre for Dissease Prevention and Control ,ECDC )的数据显示欧洲的状况也不容乐观,尤其是希腊、意大利和罗马尼亚[6]。
在意大利,由CRKP 引起的血液感染30d 死亡率达到41.6%[7]。
在美国纽约,CRKP 感染患者的住院死亡率为48%,显著高于碳青霉烯类抗菌药物敏感肺炎克雷伯菌感染患者[8]。
可以说CRKP 已成为重要的医院病原体,其引起的严重感耐碳青霉烯肺炎克雷伯菌耐药机制及治疗策略袁吉吉1,2,钱克莉2,王忠杰21.重庆医科大学附属第一医院感染科重庆市传染病寄生虫病学重点实验室(重庆400016);2.重庆医科大学附属第一医院医院感染管理科(重庆400016)【摘要】随着碳青霉烯类抗菌药物的广泛使用,耐碳青霉烯肺炎克雷伯菌(carbapenem resistant klebsiella pneumoniae,CRKP )已成为全球公共卫生的“紧急”优先事项。
四种碳青霉烯类药物的比较
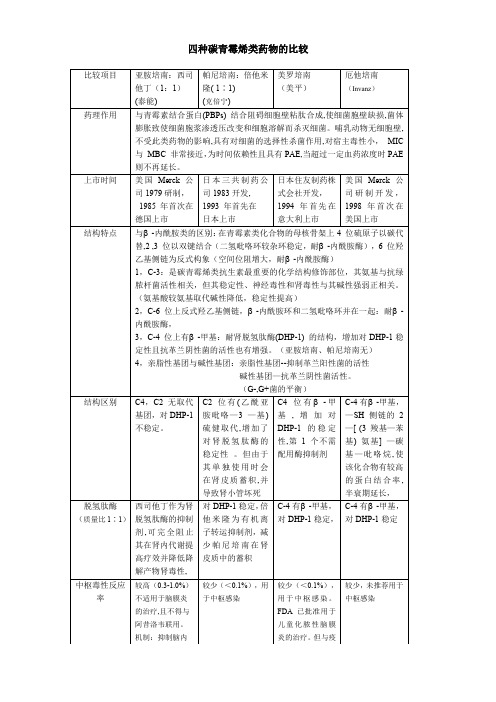
++++
(强于克倍宁)
+++
+
++
G+球菌(MSSA)
+++
++++
(强于泰能)
+
++
肠杆菌
+
++
++++
பைடு நூலகம்较强
+++
厌氧菌
(强于甲、克林、氯霉素)
+++
+++
+++
+++
肠球菌
耐药
铜绿
(AMP-c除外)
++
+
++++
无效
嗜麦芽
耐药
非典型病原体
无效
MRSA/MRSE
对酶不稳定,不敏感
ESBLs
稳定,为产ESBLs菌株的首选药
内毒素诱导
较弱
强
强
强
T1/2
1 h左右
1 h左右
1 h左右
4 ~5小时,Qd
临床特点
针对产ESBL s菌感染的治疗,临床主要推荐使用碳青霉烯类药物,除了针对泌尿系感染,而且对喹诺酮类敏感,一线治疗首选喹诺酮类,而对菌血症、HAP及腹腔内感染,则首选碳青霉烯类药物,亚胺培南起效较快,患者体温下降明显,而美罗培南起效较慢。
C-4有β-甲基,对DHP-1稳定,
C-4有β-甲基,对DHP-1稳定
细菌的主要耐药机制

氨基糖苷类抗生素对非发酵菌、肠杆菌科及一些革兰氏阳性球菌均有很好的抗菌活性,与β—内酰胺类抗生素联用有协同抗菌作用,在感染治疗中占有重要地位。但由于以上耐药机制的存在,细菌耐药问题也日趋严重,应该引起重视,可喜的是阿米卡星等对MRSA和产ESBLs菌株仍保持17%-40%的敏感率。
2 改变药物作用靶位
2.1.1耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus arueus,MRSA)
MRSA是20世纪60年代英国首先报道的一种严重的临床耐药致病菌,20世纪80年代以来,世界各地都相继发生MRSA医院感染的暴发流行,并逐年增多。MRSA耐药分为固有耐药和获得性耐药,固有耐药是由染色体介导的,其耐药性的产生是因为细菌产生一种特殊的青霉素结合蛋白PBP2a(或PBP2’),分子量为78000的蛋白质,与β内酰胺类抗生素的亲和力减低,从而导致细菌对β-内酰胺类抗生素耐药。PBP2a由mecA基因编码,95%以上的MRSA菌株能检测到mecA基因,而敏感株则无。获得性耐药是由质粒介导的,细菌获得耐药基因后,产生大量β-内酰胺酶(而不是PBPs),使耐酶青霉素缓慢失活,表现出耐药性,多为临界耐药。
2.2 DNA拓扑异构酶的改变引起喹诺酮类抗生素耐药
喹诺酮类药物的作用机制主要是通过抑制DNA拓扑异构酶而抑制DNA的合成,从而发挥抑菌和杀菌作用。细菌DNA拓扑异构酶有I、Ⅱ、Ⅲ、Ⅳ,喹诺酮类药物的主要作用靶位是拓扑异构酶Ⅱ和拓扑异构酶Ⅳ。拓扑异构酶Ⅱ又称DNA促旋酶,参与DNA超螺旋的形成,拓扑异构酶Ⅳ则参与细菌子代染色质分配到子代细菌中。革兰氏阴性菌中DNA促旋酶是喹诺酮类的第一靶位,而革兰氏阳性菌中拓扑异构酶Ⅳ是第一靶位。
2.1.2 耐青霉素肺炎链球菌 (Penicillin resistant Streptococcus pneumoniae,PRSP)
多重耐药菌感染预防与控制制度

多重耐药菌感染预防与控制制度1.目的:多重耐药菌感染预防与控制是医疗质量管理的重要内容。
为进一步加强多重耐药菌感染防控等要求,指导各科室预防控制多重耐药菌感染发生,根据国家法规要求结合医院实际制定多重耐药菌感染预防控制基本制度。
2.使用范围:本制度是医院各科室必须遵守和严格执行的基本要求,具有“底线性”、“强制性”,适用于医院各科室。
3.定义:无4.内容4.1 含义:是医院为预防和控制多重耐药菌引发的感染及其传播,根据本机构多重耐药菌流行趋势和特点开展的监测、预防与控制等活动的规范性要求。
目前要求纳入目标防控的多重耐药菌包括但不限于:如产超广谱β-内酰胺酶的革兰氏阴性细菌(ESBLs)、耐碳青霉烯类抗菌药物肠杆菌科细菌(CRE)、耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素肠球菌(VRE)、泛耐药的鲍曼不动杆菌(PDR-AB)、耐碳青霉烯鲍曼不动杆菌(CRABA)、泛耐药的铜绿假单胞菌(PDR-PA)、耐碳青霉烯铜绿假单胞菌(CRPAE)等。
4.2 基本要求。
4.2.1 制订并落实多重耐药菌感染预防与控制规范,明确各责任部门和岗位的分工、职责和工作范围等。
4.2.2 依据本机构和所在地区多重耐药菌流行趋势和特点,确定多重耐药菌监控范围,加强信息化监测,采取有效措施预防和控制重点部门和易感者的多重耐药菌感染。
4.2.3 加强感染防控、感染病学、临床微生物学、重症医学和临床药学等相关学科的多部门协作机制,提升专业能力。
4.2.4 加强针对本机构相关工作人员的多重耐药菌感染预防与控制知识培训。
4.2.5 严格执行多重耐药菌感染预防与控制核心措施,核心措施包括但不限于:手卫生、接触隔离、环境清洁消毒、可复用器械与物品的清洁消毒灭菌、抗菌药物合理使用、无菌技术操作、标准预防、减少侵入性操作,以及必要的针对环境和患者的主动监测和干预等。
4.2.6 规范病原微生物标本送检,严格执行《抗菌药物临床应用指导原则》,合理选择并规范使用抗菌药物。
细菌的主要耐药机制

细菌的主要耐药机制细菌的主要耐药机制1.产生灭活抗生素的各种酶1.1β—内酰胺酶(β-lactamase)β—内酰胺类抗生素都共同具有一个核心β—内酰胺环,其基本作用机制是与细菌的青霉素结合蛋白结合,从而抑制细菌细胞壁的合成。
产生β—内酰胺酶是细菌对β-内酰胺类抗菌药物产生耐药的主要原因。
细菌产生的β-内酰胺酶,可借助其分子中的丝氨酸活性位点,与β—内酰胺环结合并打开β—内酰胺环,导致药物失活。
迄今为止报道的β—内酰胺酶已超过300种,1995年Bush等将其分为四型:第1型为不被克拉维酸抑制的头孢菌素酶;第2型为能被克拉维酸抑制的β-内酰胺酶;第3型为不被所有β—内酰胺酶抑制剂抑制的金属β-内酰胺酶(需Zn2+活化)。
可被乙二胺四乙酸和P-chloromercuribenzate所抑制;第4型为不被克拉维酸抑制的青霉素酶。
临床常见的β—内酰胺酶有超广谱β—内酰胺酶、头孢菌素酶(AmpC酶)和金属酶。
1.1.1超广谱β-内酰胺酶(Extended-Spectrumβ-lactamases,ESBLs)ESBLs是一类能够水解青霉素类、头孢菌素类及单环类抗生素的β—内酰胺酶,属Bush分型中的2型β—内酰胺酶,其活性能被某些β—内酰胺酶抑制剂(棒酸、舒巴坦、他唑巴坦)所抑制。
ESBLs主要由普通β-内酰胺酶基因(TEM—1,TEM—2和SHV—1等)突变而来,其耐药性多由质粒介导。
自1983年在德国首次发现ESBLs以来,目前已报道的TEM类ESBIs已有90多种,SHV类ESBLs 多于25种。
TEM型和SHV型ESBLs主要发现于肺炎克雷伯菌和大肠埃希菌,亦发现于变形杆菌属、普罗威登斯菌属和其他肠杆菌科细菌。
国内近年来随着三代头孢菌素的广泛使用,产ESBLs菌的检出率逐年增加。
NCCLs规定,凡临床分离的大肠埃希氏菌和克雷伯氏菌均应监测是否为产ESBLs菌株;若产生,无论体外对第三代头抱菌素、氨曲南的药敏结果如何,均应报告对三代头孢菌素及氨曲南耐药。
碳青霉烯类抗菌药物的比较与选用-文献报告可编辑全文

+
+
+
大肠埃希菌
+
+
+
克雷伯菌
+
+
+
大肠杆菌/克雷伯菌ESBL+
+
+
+
大肠杆菌/克雷伯菌KPC+
0
0
0
肠 沙杆雷碳菌菌 青酶烯类抗菌药++物的抗菌++ 谱比较++
沙门菌
+
+
+
志贺菌
+
+
+
美罗培南 + + + + + + + 0 + + + +
碳青酶烯类抗菌药物的抗菌谱比较
微生物 奇异变形杆菌 普通变形杆菌 普罗非登斯菌 摩根菌 柠檬酸杆菌 气单胞菌 不动杆菌 铜绿假单胞菌 洋葱伯克霍尔德菌 嗜麦芽窄食单胞菌 小肠结肠炎耶尔森菌 军团菌 多杀巴斯德菌
革兰阴性菌(热病)
多尼培南 厄他培南
+
+
+
+
+
+
+
+
+
+
+
+
±
0
+
0
±
0
0
0
+
0
0
+
+
亚胺培南 + + + + + + ± + 0 0 + 0 +
