不典型腺瘤样增生(AAH)
肺部结节的CT鉴别诊断-肺部磨玻璃样病变

中分化腺癌与BAC混合亚型
23
46/F 右肺癌术后发现左上肺结节
腺癌与BAC混合亚型
2022/2/7
24
44/F 发现肺内多发结节
2022/2/7
右中肺粘液型BAC、右下肺AAH
25
66/F 发现肺内多发结节
2022/2/7
两上肺多发BAC、左下肺AAH
26
57/F 因发热10天CT检查发现左上肺结节
BAC(炎症型)
2022/2/7
38
65/F 痰血1周
BAC (炎症
型)
2022/2/7
39
52/M
BAC
2022/2/7
40
47/F,乳癌术后
抗炎治疗后消失
2022/2/7
另一例FGGO抗炎 治疗后消失
41
57/F
腺癌与BAC 混合亚型
2022/2/7
42
53/M 食管癌术后发现左上肺结节
AAH
18
54/M 体检发现右上肺结节
中分化腺癌与BAC混合亚型
2022/2/7
19
50/M 发现左上肺结节
2022/2/7
腺癌与BAC混合亚型
20
50/M 咳嗽一周。
2022/2/7
炎性GGO
抗炎治疗后
21
45/F 体检发现左下肺结节
腺癌与BAC混合亚型
2022/2/7
22
20d
2022/2/7
左上肺球形 肺炎
2022/2/7
抗炎治疗后
27
41/F 发现右肺占位一周
2022/2/7
细支气管肺泡癌
28
41/F 发现右肺占位一周
腺体非典型增生的介绍

腺体非典型增生的介绍我们大家知道非典型性增生是病理学的名词,主要指上皮细胞异乎常态的增生,表现为增生的细胞大小不一,形态多样,核大而浓染,核浆比例增大,核分裂可增多但多呈正常核分裂像。
细胞排列较乱,细胞层次增多,极向消失。
但一般不见病理性核分裂;可发生于皮肤或粘膜表面的被覆上皮,也可发生于腺体上皮。
1.概念一般认为,从正常细胞发展到肿瘤细胞,都要经历一个这样的过程,即:正常──增生──非典型增生──原位癌──浸润癌,而非典型增生则是从良性改变到恶性改变的中间站,是由量变到质变的关键点,因此,将非典型增生称之为“癌前病变”。
非典型性增生是癌前病变的形态学改变。
增生的上皮细胞形态和结构出现一定程度的异型性,但还不足以诊断为癌。
2非典型性增生分级非典型性增生多发生于鳞状上皮,也可发生于腺上皮。
鳞状上皮的非典型性增生,根据其异型性程度和或累及范围可分为轻、中、重度三级。
若这种改变累及上皮下部的 l/3,为轻度非典型增生;如累及超过上皮下部1/3---2/3处,为重度非典型增生;若累及上皮全层,则已成为原位癌。
轻、中度非典型性增生,在病因消除后可恢复正常。
而重度非典型性增生则很难逆转,常转变为癌。
上皮内瘤变包括非典型增生和原位癌。
将轻、中、重度非典型性增生分别称为上皮内瘤变Ⅰ、Ⅱ、Ⅲ级,并将原位癌也列入上皮内瘤变Ⅲ级。
上述癌前疾病和病变多通过非典型增生而发生癌变的。
3非典型性增生症状非典型增生一般没有明显症状。
如果出现明显症状,有可能病变已经进展到癌。
常见的有以下几种表现:(1)黏膜白斑病。
常发生在口腔、食管、外阴等处黏膜,病变肉眼观呈白色斑块,镜下见鳞状上皮过度增生和角化,并有一定异型性,病变有可能发展为鳞状细胞癌。
(2)子宫颈糜烂。
指子宫颈阴道部的鳞状上皮被来自子宫颈管的柱状上皮取代。
在糜烂愈合中,储备细胞增生并化生为鳞状上皮。
由于慢性炎症过程可导致不完全鳞化和异型增生,少数演变为宫颈鳞状细胞癌。
(3)乳腺增生症。
基于附壁生长病理特征的肺腺癌研究进展

㊃专题笔谈㊃基于附壁生长病理特征的肺腺癌研究进展周慈航1何帆2樊剑1胡珍丽2韩一平21海军军医大学附属长海医院全科,上海200433;2海军军医大学附属长海医院呼吸内科,上海200433;3中国人民解放军73021部队,杭州310007通信作者:韩一平,E m a i l y p h a n2006@163c o mʌ摘要ɔ肺癌是人类癌症死亡的首要原因,腺癌是主要的组织学类型㊂其中,原位腺癌㊁微浸润性腺癌和附壁型腺癌呈附壁生长方式㊂临床工作中发现这种类型肺腺癌具有独特的临床病理特征,预后也与其他类型的肺腺癌截然不同㊂本文基于肺腺癌的附壁生长方式,从肺腺癌独特的影像学表现㊁病理特点和分子基因表达出发,系统介绍了肺腺癌的临床病理特征及其预后意义,并就目前研究进展和面临的相关挑战作一综述,以期为临床医师的工作提供帮助㊂ʌ关键词ɔ肺腺癌;肿瘤侵润;D N A突变分析;附壁生长基金项目:上海市科委2019年度医学引导类科技支撑项目(19411970600)D O I103760c m a j c n131368-20200922-00858R e s e a r c h p r o g r e s s o f l u n g a d e n o c a r c i n o m ab a s e do n l e p i d i c g r o w t h p a t t e r nZ h o uC i h a n g1H eF a n2F a nJ i a n1H uZ h e n l i2H a nY i p i n g21D e p a r t m e n t o f G e n e r a lP r a c t i c e t h eF i r s tA f f i l i a t e d H o s p i t a lo f N a v a l M e d i c a lU n i v e r s i t yS h a n g h a i200433C h i b a2D e p a r t m e n t o f R e s p i r a t o r y D i s e a s e s t h eF i r s tA f f i l i a t e d H o s p i t a l o fN a v a l M e d i c a l U n i v e r s i t y S h a n g h a i200433C h i n a3N o73021o f t h e C h i n e s e P e o p l e'sL i b e r a t i o nA r m y H a n g z h o u310007C h i n aC o r r e s p o n d i n g a u t h o r H a nY i p i n g E m a i l y p h a n2006@163c o mʌA b s t r a c tɔL u n g c a n c e rr e m a i n st h et o p c a u s e o fc a n c e r-r e l a t e d d e a t h s w o r l d w i d e a n da d e n o c a r c i n o m ai st h e m a i n h i s t o l o g i ct y p e A m o n g t h e m a d e n o c a r c i n o m ai n s i t u m i n i m a l l yi n v a s i v ea d e n o c a r c i n o m aa n dl e p i d i ca d e n o c a r c i n o m as h o w l e p i d i c g r o w t h p a t t e r n C l i n i c a l w o r kc o n f i r m ed t h a t l u n g a de n o c a r c i n o m a w i t h l e p i d i c g r o w t h h a s u n i q u e c l i n i c o p a t h o l o g i c a lc h a r a c t e r i s t i c s a n dt h e p r o g n o s i si sa l s od i f fe r e n tf r o m o t h e rt y p e s T h i sr e v i e w p r e s e n t st h er a d i o l o g y f e a t u r e s p a t h o l o g i c a l c h a r a c t e r i s t i c s a n d m o l e c u l a r b i o l o g i c a l b e h a v i o u r o f l u n ga d e n o c a r c i n o m aw i t h l e p i d i c g r o w t ha n d i t s p r o g n o s t i c i m p l i c a t i o n sʌK e y w o r d sɔA d e n o c a r c i n o m ao fl u n g N e o p l a s m i n v a s i v e n e s s D N A m u t a t i o n a la n a l y s i sL e p i d i c g r o w t hF u n d p r o g r a m S h a n g h a iM u n i c i p a l S c i e n c e a n dT e c h n o l o g y C o mm i s s i o n2019M e d i c a lG u i d a n c eS c i e n c e a n dT e c h n o l o g y S u p p o r tP r o j e c t19411970600D O I103760c m a j c n131368-20200922-00858肺癌不仅是全球最常见的恶性肿瘤之一,也是癌症死亡的首要原因[1]㊂2020年全球肺癌死亡180万例(18%),远超其他癌症类型[2]㊂腺癌是非小细胞肺癌(n o n-s m a l l-c e l l l u n g c a n c e r, N S C L C)中最常见亚型,在分子生物学㊁病理学㊁放射学和外科学等领域都取得飞速进展,这些研究需要转化并整合到临床中,以改善患者预后㊂普遍认为,附壁生长模式的腺癌细胞是非侵袭性成分[3],生物学行为与其他肺腺癌迥然不同㊂本文结合2021年WHO最新公布的第5版肺肿瘤分类,对肺腺癌的附壁生长特征做一综述,为临床选择合理的诊疗策略提供借鉴和帮助㊂一㊁病理分类附壁生长是指肿瘤细胞沿着完整的肺泡壁表面增殖,没有间质㊁血管或胸膜侵犯[4](图1)㊂ l e p i d i c 源于拉丁语,意指衬覆在肺泡壁上,呈㊃7401㊃国际呼吸杂志2021年7月第41卷第14期I n t JR e s p i r,J u l y2021,V o l.41,N o.14Copyright©博看网. All Rights Reserved.贴壁状 外观㊂附壁生长可被分为不典型腺瘤样增生(a t y p i c a l a d e n o m a t o u sh y p e r pl a s i a ,A A H )㊁原位腺癌(a d e n o c a r c i n o m a i n s i t u ,A I S)㊁微浸润性腺癌(m i n i m a l l y in v a s i v e a d e n o c a r c i n o m a ,M I A )以及附壁型腺癌(l e pi d i ca d e n o c a r c i n o m a ,L A )(表1)㊂图1 附壁生长 H E ˑ200表1 肺腺癌附壁生长病理类型及特点类型缩略词大小(mm )浸润灶其他特征细胞核5年无瘤生存率(%)不典型腺瘤样增生A AH ɤ5无无血管侵犯无胸膜侵犯无肿瘤坏死轻度多形性中度深染100原位腺癌A I S>5(非强制)ɤ30无无血管侵犯无胸膜侵犯无肿瘤坏死中度多形性不同程度深染100微浸润性腺癌M I A >5(非强制)ɤ30一个或多个病灶每个浸润ɤ5mm无血管侵犯无胸膜侵犯无肿瘤坏死中度多形性不同程度深染100附壁型腺癌L A/>5mm 含无浸润/微浸润病灶直径>30mm ,任何大小伴胸膜/血管浸润或坏死中至重度多形性不均匀强深染ʈ90注:/为不确定(一)肺腺癌分类发展简史 l e p i d i c 一词的起源,人们已经进行了广泛讨论㊂L i e b o w [5]于1960年命名细支气管肺泡癌(b r o n c h i o l o a l v e o l a r c a r c i n o m a ,B A C ) 一词,用来描述一种分化良好的腺癌㊂但他的定义仍然过于模糊,对于B A C 的病理诊断容易引起混淆㊂2004年,WHO 发布指南[6],将B A C 定义为沿肺泡壁呈附壁生长的腺癌,无间质㊁血管或胸膜侵犯,包括黏液性和非黏液性亚型㊂此外,他们详细描绘了混合型肺腺癌,即腺癌同时伴有细支气管肺泡癌和间质浸润性成分㊂随着影像学㊁组织学和免疫组织化学的不断发展,明确非小细胞肺癌亚型越来越重要㊂然而,侵袭性成分的范围不明确,使肺腺癌的亚分类一直很困难㊂在这种背景下,2011年国际肺癌研究协会㊁美国胸科学会和欧洲呼吸学会(I A S L C /A T S/E R S)联合提出新的肺腺癌分类系统[7],为多学科管理提供了统一的术语和诊断标准,得到2015年WHO 肺腺癌分类的采纳[8]㊂然而,该分类不再使用 B A C 的名称[9],无法体现出附壁生长的良性生物学行为特点㊂因此,第5版肺肿瘤分类[10]进行了重大调整,把A A H 和A I S 与腺癌分开大类列出㊂此次WH O 将肺原位腺癌剔除出肺恶性肿瘤,从基础研究到临床诊疗都必将产生一系列深远影响㊂(二)组织形态学目前,肺腺癌的发病率已经明显超出鳞癌而成为肺癌中发病率最高的类型,肺腺癌的组织学类型包括附壁型㊁腺泡型㊁乳头状型㊁实体型及变异型(黏液腺癌㊁胶样癌㊁胚胎性癌㊁肠型腺癌)㊂附壁生长的腺癌在所有N S C L C 中发病率为15%~20%[11]㊂越来越多的证据表明,肺腺癌的组织学不均一性意味着肿瘤个体的预后也存在差异[12-13]㊂例如,具有微乳头状或实体型的混合亚型肿瘤的预后明显比其他亚型差[14-15]㊂1㊁不典型腺瘤样增生与原位腺癌第5版肺肿瘤新分类将A A H 和A I S 共同列入腺体前驱病变,而不再称为浸润前病变㊂这里一并作述㊂A A H 是一种局限性的㊁通常ɤ0 5c m ㊁轻度到中度的非典型增生,Ⅱ型肺细胞和/或C l a r a 细胞排列在肺泡壁上呈附壁生长,替代呼吸终末单位的正常细支气管肺泡上皮㊂A I S 是一种小到中等直径(ɤ3c m ),单纯附壁生长的孤立性肿瘤病变,最接近原来的非黏液性B A C ㊂A I S 典型细胞学特征呈立方状或柱状,相对一致,轻至中度异型,细胞核淡㊁小㊁单形,染色质细,核仁不明显㊂肿瘤细胞排列整齐的条带和小的扁平单层细胞沿着肺泡壁 钉突样 生长也是A I S 的一个特征[16]㊂在A A H 和A I S 之间存在连续的形态学变化,使得这两种实体的鉴别具有一定的挑战性㊂总的来㊃8401㊃国际呼吸杂志2021年7月第41卷第14期 I n t JR e s p i r ,J u l y 2021,V o l .41,N o .14Copyright ©博看网. All Rights Reserved.说,细胞密度㊁多型性和细胞大小有助于区分㊂在A I S 中,细胞异型性可能比A A H 更明显㊂A I S 病变通常>0 5c m ,细胞异型性通常比A A H 更明显㊂A I S 又分为黏液性和非黏液性两种,虽然大多数A I S 病变是非黏液性A I S ,但也有一些黏液性A I S 病例报道[17]㊂多项研究表明,A I S 的5年无病生存率为100%[3,16]㊂此外,A A H 须与反应性肺细胞增生相鉴别㊂2㊁微浸润性腺癌M I A 是一个中等大小的孤立性病变(ɤ3c m ),浸润灶直径ɤ5mm ,呈附壁生长和局限性侵袭㊂侵袭性病灶可以是单灶或多灶性的[17]㊂浸润性成分包括除附壁生长以外的任何组织学模式(即腺泡状㊁乳头状㊁微乳头状或实性等),或由浸润肌纤维母细胞间质的单个肿瘤细胞巢构成[18]㊂M I A 不适用于侵犯淋巴管㊁血管或胸膜的肿瘤或含有坏死的肿瘤㊂当有多个独立的肿瘤存在时,A I S 和M I A 只有在病变为同步原发灶而不是肺内转移时才应该被诊断㊂大约1/3的肺腺癌具有明显的附壁生长成分,其中近1/3被认为是M I A [19]㊂多个研究中M I A 已经被证明拥有100%的5年无病生存率[16,19-20]㊂3㊁附壁型腺癌L A 是指在附壁生长的腺癌中浸润灶ȡ5mm ,或有血管㊁胸膜或淋巴管浸润或坏死的间质浸润迹象㊂如存在多个浸润灶,则采用浸润灶的百分比之和乘以肿瘤最大径,如其数值>5mm 即可诊断[21]㊂L A 的诊断仅适用于非黏液性腺癌㊂如果肌纤维母细胞间质含有侵袭性肿瘤细胞,则诊断为L A 而不是M I A ㊂L A 中附壁生长成分比例的范围从40%~85%,平均约50%[22]㊂多项回顾性研究报道,L A 的5年无病生存率介于85 7%和100%之间[22-24]㊂从A AH ㊁A I S 发展到M I A ,再发展为L A 的附壁生长模式在腺癌中最具典型(图2),其生长缓慢,预后好于其他浸润性腺癌㊂注:A A H 为不典型腺瘤样增生;A I S 为原位腺癌;M I A 为微浸润性腺癌;L A 为附壁型腺癌图2 附壁生长(A A HңA I S ңM I AңL A )二㊁临床症状㊁影像学表现临床研究发现,肺腺癌以女性或非吸烟者多见,且显示出逐渐年轻化趋势㊂高达2/3的肺腺癌患者就诊时无明显临床症状,而是影像学检查偶然发现;咳嗽是最常见的症状,出现在25%~30%的患者中[24-25];当疾病发展到一定阶段可出现刺激性干咳㊁胸痛与胸部不适㊁咳痰与咯血㊁发热等㊂凭借图像清晰㊁分辨率高㊁后处理功能强大等优点,电子计算机断层扫描(c o m pu t e d t o m o g r a p h y,C T )逐渐成为肺癌检查的 金标准 [26]㊂许多研究报道了腺癌的组织病理学和C T 表现之间的相关性[16,27-29]㊂附壁生长模式的腺癌在高分辨率C T 上多显示肺磨玻璃样影[17,29],即边界清楚或不清楚的云雾状密度增高影,其中走形的血管及支气管隐约可见㊂相反,乳头状㊁腺泡状和实体腺癌在C T 上通常表现为实性结节[28,30]㊂因此,C T 影像在一定程度上可以预测附壁生长模式㊂与肿瘤生物学行为相关的影像学特征可能具有临床转化的意义,有助于诊断和判断预后㊂例如,与实性或微乳头状为主的腺癌相比,附壁生长型腺癌的预后更好,且较少淋巴结转移[31]㊂三㊁分子遗传学近年来肺腺癌分子生物学领域的进展突飞猛进,生物标志物检测为肺癌分层治疗带来革命性变化,以表皮生长因子受体(e pi d e r m a l g r o w t h f a c t o r r e c e p t o r ,E G F R )㊁鼠类肉瘤病毒癌基因(k i r s t e n r a t s a r c o m a v i r a l o n c o ge n e ,K R A S )和间变性淋巴瘤激酶(a n a p l a s t i cl y m ph o m ak i n a s e ,A L K )突变为代表的单基因改变是部分肺腺癌最显著的分子学特征[32]㊂这些基因突变是治疗干预的特定分子靶标,具有重要的临床价值㊂(一)E G F RE GF R 是一种具有酪氨酸激酶活性的跨膜受体[33],具有多种特异性配体,表皮生长因子与E G F R 结合,启动涉及细胞凋亡㊁血管生成和细胞增殖的信号通路,从而可能促进与癌变相关的特性[34]㊂2004年以来,E G F R 突变被广泛研究,并已确定在女性㊁从不吸烟和亚裔人群中更为普遍[35]㊂我国人群中E G F R 基因的突变率为40%~60%,以19号外显子缺失(E x 19)和21号外显子L 858R 点突变(E x 21)最为常见,占85%~90%[34]㊂在过去的研究中E G F R 突变阳性肺腺癌具有附壁生长模式[33,36],但也有研究指出E G F R突变阳性肺腺癌与腺泡状㊁乳头状或微乳头状生长相关[24,37]㊂Y o s h i z a w a 等[36]研究发现附壁生长的㊃9401㊃国际呼吸杂志2021年7月第41卷第14期 I n t JR e s p i r ,J u l y 2021,V o l .41,N o .14Copyright ©博看网. All Rights Reserved.腺癌在E x21突变中更为常见㊂多数研究都表明E G F R突变型肺腺癌相关预后优于E G F R野生型[38]㊂I P A S S㊁W J T O G3405和N E J002等大规模随机对照研究,奠定了吉非替尼等酪氨酸激酶抑制剂(t y r o s i n e k i n a s e i n h i b i t o r s,T K I)在晚期E G F R阳性N S C L C中一线治疗的地位,拉开了肺癌靶向治疗的序幕,从此靶向药物如雨后春笋㊁日新月异,肺癌进入精准治疗时代㊂(二)间变性淋巴瘤激酶(a n a p l a s t i c l y m p h o m ak i n a s e,A L K)棘皮动物微管相关蛋白样4(e c h i n o d e r m m i c r o t u b u l ea s s o c i a t e d p r o t e i n-l i k e4,E M L4)与A L K形成的融合基因,通常称为A L K融合基因, 2007年S o d a等[39]首次发现㊂A L K融合阳性的N S C L C占所有肺癌的2%~5%[40],肺腺癌患者中A L K融合基因的总发生率为52%~112%[41]㊂实体型或腺泡状㊁筛网状结构㊁黏液细胞(如印戒细胞或杯状细胞)在A L K阳性腺癌中更为常见[33],而较少出现附壁生长模式[37]㊂随着克唑替尼㊁阿来替尼和劳拉替尼等被批准上市,A L K突变腺癌的预后得到显著地改善㊂A L K-T K I s显著延长了无进展生存期和总生存期,极大地改变了N S C L C的临床实践㊂(三)K R A SK R A S是一种鼠类肉瘤病毒癌基因,突变型K R A S导致蛋白功能异常,在无E G F R活化信号刺激下仍处于激活状态,使细胞内信号传导紊乱,细胞增殖失控而癌变[24,34]㊂K R A S突变在肺腺癌中发生率较高(20%~30%)[42]㊂目前,K R A S突变临床和遗传特征尚无定论,与组织学亚型的关联仍然存在争议㊂d e M e l o等[43]发现K R A S突变与腺泡亚型显著相关㊂有研究报道[44],浸润性黏液腺癌与K R A S突变显著相关㊂J i a n g等[45]荟萃分析发现,K R A S突变在浸润性黏液腺癌中更为常见,而在附壁生长和腺泡为主的亚型中较少见㊂K a d o t a等[46]发现K R A S突变是总生存期的独立预后因素,可能与预后较差相关㊂2项M e t a分析认为K R A S突变为E G F R-T K I s反应的负性预测生物标记物[41]㊂K R A S突变可能预示着对E G F R靶向治疗的耐药性,成为N S C L C患者的不良预后因素㊂不同类型的K R A S突变其预后价值不尽相同,需要未来的进一步研究来证实㊂(四)其他随着新一代测序和全外显子组测序等技术的出现,更多的新颖突变和融合伴侣基因被发现㊂R O S1重排在1%~2%的N S C L C中报告[47],相比于西方国家,R O S1基因融合在亚洲(中国㊁日本和韩国)患者中出现频率较高[48]㊂少数研究中C-R O S癌基因1(C-R o s o n c o g e n e1,R O S1)重排的肺腺癌被描述为具有附壁生长模式[49]㊂E R B B2突变在2%~4%的N S C L C中被发现[50-51],而在E G F R/K R A S/A L K均野生型的腺癌中可达到6%[52]㊂D i n g等[53]检测到一些罕见突变,如B R A F㊁M E T以及R E T,F G F R1和A L K融合伴侣等㊂然而,这些少见突变和新型融合伴侣的临床意义仍有待进一步研究㊂分子途径及相关机制的研究深入,必将有助于了解肺腺癌的分子生物学特征并为临床决策提供依据㊂四㊁治疗与预后目前外科手术切除仍是早期N S C L C的标准治疗手段[54]㊂肺癌手术方式首选解剖性肺叶切除和淋巴结清扫,但由于肿瘤或患者耐受性等因素,又有扩大切除和局部切除㊂研究证实,附壁生长型腺癌术后预后良好,A I S术后5年无病生存率为100%,M I A接近100%,远高于浸润性腺癌的5年无病生存率40%~85%[20,55-56]㊂多项研究表明,附壁状生长模式的高百分比与低复发风险相关, L A中附壁生长成分的比例具有较高的预后价值[57]㊂临床预后的差异为制定个体化治疗方案提供重要依据㊂一项大型试验[58]发现,C T检查直径ɤ10mm或体积ɤ500mm3的纯G G O可考虑进行密切随访,而不是立即切除㊂第5版WHO肺肿瘤分类并未再将肺原位癌归类于肺腺癌,可能会改变临床医生对这类病变的处理方式[59],至少需要重新斟酌㊁考虑是否手术,仍有待探讨㊂然而,肿瘤异质性可能是预测预后和治疗反应的限制因素㊂其中一些病变能否通过有限切除治疗是一个普遍存在的问题,需要深入研究㊂尽管大多数A I S或M I A病例可通过完全切除治愈,但仍有一小部分L A会复发[23]㊂因此,在多学科背景下进一步认识这些病变潜在的特征显得尤为重要㊂尽管近十年中肺癌的诊断和治疗取得许多进展,但它仍然是全世界最常见的癌症死亡原因;我国肺癌患者的5年生存率仍然只有10%~ 20%[20,41]㊂同时,肺癌是一个异质性的疾病,其细胞类型㊁分子生物学特征㊁病理特征复杂多样,给临床诊断和治疗带来一定挑战㊂本文综述了对附壁生长这一病理亚型肺腺癌的认识过程和研究现状,重点介绍了其临床病理特征及其与驱动突变(E G F R㊁A L K和K R A S等)的关系㊂虽然肺腺癌㊃0501㊃国际呼吸杂志2021年7月第41卷第14期I n t JR e s p i r,J u l y2021,V o l.41,N o.14Copyright©博看网. All Rights Reserved.的发生机制尚不清楚,但更好地了解此类病例中的肿瘤发生和进展可能有助于全方位解析肺癌的不同的生物学特征,并制定相应的预防㊁筛查和治疗策略㊂利益冲突所有作者均声明不存在利益冲突参考文献1 X u Y Z h u C Q i a n W e t a l C o m p r e h e n s i v e s t u d y o fm u t a t i o n a l a n d c l i n i c o p a t h o l o g i c c h a r a c t e r i s t i c s o fa d e n o c a r c i n o m aw i t h l e p i d i c p a t t e r n i ns u r g i c a l r e s e c t e d l u n ga d e n o c a r c i n o m a J C a n c e rR e sC l i n O n c o l20171431181-186D O I101007s00432-016-2255-82S u n g H F e r l a y J S i e g e lR L e ta l G l o b a lC a n c e rS t a t i s t i c s2020G L O B O C A N E s t i m a t e s o fI n c i d e n c e a n d M o r t a l i t yW o r l d w i d e f o r36C a n c e r s i n185C o u n t r i e s J C A C a n c e r JC l i n2021713209-249D O I103322c a a c216603 K a t s u m a t a S A o k a g e K M i y o s h i T e ta l D i f f e r e n c e so ft u m o r m i c r o e n v i r o n m e n tb e t w e e n s t a g eⅠl e p i d i c-p o s i t i v ea n dl e p i d i c-n e g a t i v e l u n g a d e n o c a r c i n o m a s J J T h o r a cC a r d i o v a s c S u r g201815641679-1688e2D O I101016j j t c v s2018050534J o n e s K D W h e n c e l e p i d i c t h e h i s t o r y o f a C a n a d i a nn e o l o g i s m J A r c hP a t h o lL a b M e d2013137121822-1824D O I105858a r p a2013-0144-H P5 L i e b o w A A B r o n c h i o l o-a l v e o l a rc a r c i n o m a J A d vI n t e r nM e d196010329-358D O I101378c h e s t114156 T r a v i s WD M u l l e r-H e r m e l i n k H K H a r r i sC C e ta l W o r l dh e a l t ho r g a n i z a t i o nc l a s s i f i c a t i o no ft u m o u r s p a t h o l o g y a n dg e n e t i c so ft u m o u r so ft h el u n g p l e u r a t h y m u sa n d h e a r tM L y o n I A R CP r e s s20047 T r a v i s WD B r a m b i l l a E N o g u c h i M e t a l I n t e r n a t i o n a lA s s o c i a t i o n f o r t h e S t u d y o f L u n g C a n c e r A m e r i c a nT h o r a c i cS o c i e t y E u r o p e a n R e s p i r a t o r y S o c i e t y I n t e r n a t i o n a lM u l t i d i s c i p l i n a r y C l a s s i f i c a t i o no fL u n g A d e n o c a r c i n o m a JT h o r a c O n c o l201162244-285D O I101097J T O 0b013e318206a2218 T r a v i sWD B r a m b i l l aE B u r k eA P e t a l WHOc l a s s i f i c a t i o no f t u m o u r so f l u n g p l e u r a t h y m u sa n dh e a r t M4t he dL y o n I A R CP r e s s20159闫利娟易祥华肺腺癌I A S L C A T S E R S国际多学科分类以及临床实践中应注意的问题J中国肺癌杂志2013167333-338D O I103779j i s s n1009-341920130701Y a n L J Y i X H T h e i n t e r n a t i o n a l m u l t i d i s c i p l i n a r yc l a s s i f i c a t i o no f l u n g ade n o c a r c i n o m af r o mI A S L C A T S E R Sa n d p r ob l e m s i nc l i n i c a l p r a c t i c e J Z h o n g g u oF e i A i Z a Z h i2013167333-338D O I103779j i s s n1009-34192013070110WHO C l a s s i f i c a t i o n o f t u m o u r s e d i t o r i a l b o a r d WH Oc l a s s i f i c a t i o no ft u m o u r s T h o r a c i ct u m o u r s M5t h e dL y o n I A R CP r e s s202111 P r u i t t A A E p i d e m i o l o g y t r e a t m e n t a n d c o m p l i c a t i o n s o fc e n t r a l n e r v o u s s y s t e m m e t a s t a s e s J C o n t i n u u m M i n n e a pM i n n2017236N e u r o-o n c o l o g y1580-1600D O I101212C O N 000000000000055112 Y i m J Z h u L C C h i r i b o g a L e ta l H i s t o l o g i cf e a t u r e sa r ei m p o r t a n t p r o g n o s t i c i n d i c a t o r s i n e a r l y s t a g e s l u n ga d e n o c a r c i n o m a s J M o d P a t h o l2007202233-241D O I101038m o d p a t h o l380073413 K o b a y a s h i N T o y o o k a S I c h i m u r a K e t a l N o n-B A Cc o m p o n e n tb u tn o te p ide r m a l g r o w t hf a c t o rr e c e p t o rg e n em u t a t i o n i s a s s o c i a t e d w i t h p o o r o u t c o m e s i n s m a l la d e n o c a r c i n o m a o f t h e l u n g J T h o r a cO n c o l200837704-710D O I101097J T O 0b013e31817c608014 B a r l e t t a J A Y e a p B Y C h i r i e a cL R P r o g n o s t i c s i g n i f i c a n c eo fg r a d i n g i nl u n g a d e n o c a r c i n o m a J C a n c e r20101163659-669D O I101002c n c r2483115 S i c aG Y o s h i z a w a A S i m a C S e ta l A g r a d i n g s y s t e m o fl u n g a d e n o c a r c i n o m a s b a s e d o nh i s t o l o g i c p a t t e r n i s p r e d i c t i v e o fd i s e a s er e c u r r e n c ei ns t a g eⅠt u m o r s J A m J S u r g P a t h o l20103481155-1162 D O I101097P A S0b013e3181e4e e3216刘丽伟张龙江钱斌Ⅰ期浸润性肺腺癌磨玻璃影及附壁样生长三维C T值定量分析J C T理论与应用研究2018271115-121D O I1015953j1004-41402018270115L i uL W Z h a n g L J Q i a nB3D C Tv a l u ea n a l y s i so f g r o u n dg l a s s s h a d o wa n dc o e l e n t e r e o u s g r o w t hi ns t a g eⅠi n v a s i v el u n g a d e n o c a r c i n o m a J C TL i L u nY uY i n g Y o n g Y a nJ i u2018271115-121D O I1015953j1004-4140201827011517 C h a k r a b o r t y R K S h a r m aS C a n c e r B r o n c h o a l v e o l a r MT r e a s u r e I s l a n d F L S t a t P e a r l sP u b l i s h i n g202018W e i c h e r tW W a r t hA E a r l y l u n g c a n c e rw i t h l e p i d i c p a t t e r na d e n o c a r c i n o m a i ns i t u m i n i m a l l y i n v a s i v ea d e n o c a r c i n o m aa n d l e p i d i c p r e d o m i n a n t a d e n o c a r c i n o m a J C u r rO p i nP u l mM e d 2014 204 309-316D O I 10 1097M C P000000000000006519 X uL T a v o r aF B a t t a f a r a n oR e t a l A d e n o c a r c i n o m a sw i t hp r o m i n e n t l e p i d i cs p r e a d r e t r o s p e c t i v er e v i e w a p p l y i n g n e wc l a s s i f i c a t i o no f t h eA m e r i c a nT h o r a c i c S o c i e t y J A mJ S u r gP a t h o l201236273-282D O I101097P A S0b013e31823b3e e b20伍建林王云华吴宁肺癌综合影像诊断学M北京科学出版社20191821 T s u t a K K a w a g o M I n o u e E e t a l T h e u t i l i t y o ft h ep r o p o s e dI A S L C A T S E R Sl u n g a d e n o c a r c i n o m as u b t y p e sf o r d i s e a s e p r og n o s i s a n d c o r r e l a t i o n o f d r i v e r g e n e a l t e r a t i o n sJ L u n g C a n c e r201381371-376D O I101016jl u n g c a n20130601222 K a d o t aK V i l l e n a-V a r g a sJ Y o s h i z a w a A e ta l P r o g n o s t i c㊃1501㊃国际呼吸杂志2021年7月第41卷第14期I n t JR e s p i r,J u l y2021,V o l.41,N o.14Copyright©博看网. All Rights Reserved.s i g n i f i c a n c eo fa d e n o c a r c i n o m ai n s i t u m i n i m a l l y i n v a s i v ea d e n o c a r c i n o m a a n d n o n-m u c i n o u s l e p i d i c p r e d o m i n a n ti n v a s i v e a d e n o c a r c i n o m ao f t h e l u n g i n p a t i e n t sw i t h s t a g eⅠd i se a s e J A mJ S u r g P a t h o l2014384448-460D O I101097P A S000000000000013423 Y o s h i z a w aA M o t o iN R i e l y G J e ta l I m p a c to f p r o p o s e dI A S L C A T S E R S c l a s s i f i c a t i o n o f l u n g a d e n o c a r c i n o m ap r o g n o s t i c s u b g r o u p s a n d i m p l i c a-t i o n s f o r f u r t h e r r e v i s i o no f s t a g i n g b a s e d o na n a l y s i so f514s t a g eⅠc a s e s J M o d P a t h o l201124653-664D O I101038m o d p a t h o l201023224 Y o s h i z a w aA S u m i y o s h i S S o n o b eM e t a l V a l i d a t i o no f t h eI A S L C A T S E R S l u n g a d e n o c a r c i n o m a c l a s s i f i c a t i o n f o rp r o g n o s i s a n d a s s o c i a t i o n w i t h E G F R a n d K R A S g e n e m u t a t i o n s a n a l y s i so f440J a p a n e s e p a t i e n t s J J T h o r a c O n c o l2013852-61D O I101097J T O0b013e3182769a a8 25 D e t t e r b e c k F C J o n e s D R F u n k h o u s e r WK J r B r o n c h i-o l o a l v e o l a r c a r c i n o m a D i a g n o s i s a n d t r e a t m e n t o f l u n gc a n c e r a n e v ide n c e-b a s e d g u i d ef o rt h e p r a c t i c i ng c l i n i c i a nM P h i l a d e l p h i a W BS a u n d e r s2000394-40726中华医学会放射学分会心胸学组2015低剂量螺旋C T肺癌筛查专家共识J中华放射学杂志495328-335D O I103760c m a j i s s n1005-120120150500327陈颖胡春洪林盪等多排螺旋C T薄层重组和高分辨率C T靶扫对肺微小结节的价值比较J临床放射学杂志201736111617-1622D O I C N K I S U N L C F S02017-11-018C h e nY H uC H L i nD e t a lE v a l u a t i o n o f p u l m o n a r y m i c r o-n o d u l e s a c o m p a r i s o n o ft h i n-s e c t i o n M S C T a n d H R C T t a r g e t s c a n n i n g J L i nC h u a n g F a n g S h eX u eZ aZ h i201736111617-1622D O I C N K I S U N L C F S02017-11-018 28W a n g H S c h a b a t h M B L i u Y e t a l S e m i q u a n t i t a t i v ec o m p u t ed t o m o g r a p h y c h a r a c te r i s t i c sf o r l u n ga d e n o c a r c i n o m a a n d t h e i r a s s o c i a t i o n w i t h l u n g c a n c e rs u r v i v a l J C l i nL u n g C a n c e r2015166e141-e163D O I101016j c l l c20150500729 H a s h i z u m e T Y a m a d a K O k a m o t o N e t a l P r o g n o s t i cs i g n i f i c a n c eo ft h i n-s e c t i o n C T s c a nf i n d i n g si ns m a l l-s i z e d l u n g a d e n o c a r c i n o m a J C h e s t2008133441-447D O I101378c h e s t07-153330 L e d e r l i n M P u d e r b a c hM M u l e y T e t a l C o r r e l a t i o no f r a d i oa n d h i s t o m o r p h o-l o g i c a l p a t t e r n o f p u l m o n a r ya d e n o c a r c i n o m a J E u rR e s p i r J201341943-951D O I101183090319360005661231 S a s a d aS N a k a y a m a H M i y a t a Y e t a l C o m p a r i s o n o fm a l i g n a n t g r a d eb e t w e e n p u r e a n d p a r t i a l l y i n v a s i v e t y p e so fe a r l y l u n g a d e n o c a r c i n o m a J A n n T h o r a cS u r g2015993956-960D O I101016j a t h o r a c s u r201410041 32刘标时姗姗王璇等2011年肺腺癌新分类在评估组织学类型与分子学改变相关性中的意义J中华病理学杂志2012418505-510D O I103760c m a j i s s n0529-5807201208001L i u B S h i S S W a n g X e t a l R e l e v a n c e o f m o l e c u l a ra l t e r a t i o n s i n h i s t o p a t h o l o g i c s ub t y p i n g o f l u n ga d e n o c a r c i n o m ab a s e d o n2011I n t e r n a t i o n a lM u l t i d i sc i p l i n a r yL u n g A d e n o c a r c i n o m a C l a s s i f i c a t i o n J Z h o n g h u a B i n g L i X u eZ aZ h i2012418505-510D O I103760c m a j i s s n0529-580720120800133 T u f m a nA K a h n e r tK D u e l lT e t a l F r e q u e n c y a n dc l i n i c a lr e l e v a n c e o fE G F R m u t a t i o n s a n dE M L4-A L Kt r a n s l o c a t i o n si no c t o g e n a r i a n s w i t hn o n-s m a l lc e l l l u n g c a n c e r J O n c oT a r g e t s T h e r2017105179-86 D O I102147O T T S14047234I s a k aT Y o k o s e T I t o H e ta l C o r r e l a t i o n sb e t w e e nt h eE GF R m u t a t i o n s t a t u s a n d c l i n i c o p a t h o l o g i c a lf e a t u r e s o fc l i n i c a l s t a g eⅠl u n g ade n o c a r c i n o m a J M e d i c i n eB a l t i m o r e20159442e1784D O I101097M D000000000000178435 K o s a k aT Y a t a b eY O n o z a t oR e t a l P r o g n o s t i c i m p l i c a t i o no fE G F R K R A S a n dT P53g e n em u t a t i o n s i na l a r g e c o h o r t o f J a p a n e s e p a t i e n t s w i t h s u r g i c a l l y t r e a t e d l u n ga d e n o c a r c i n o m a J T h o r a c O n c o l20094122-29D O I101097J T O 0b013e318191411136 Y o s h i z a w aA S u m i y o s h i S S o n o b eM e t a l V a l i d a t i o no f t h eI A S L C A T S E R S l u n g a d e n o c a r c i n o m a c l a s s i f i c a t i o n f o rp r o g n o s i s a n d a s s o c i a t i o n w i t h E G F R a n d K R A S g e n em u t a t i o n s a n a l y s i s o f440J a p a n e s e p a t i e n t s J T h o r a c O n c o l2013852-61D O I101097J T O 0b013e3182769a a837 L i P G a oQ J i a n g X e t a l C o m p a r i s o no f c l i n i c o p a t h o l o g i c a lf e a t u r e sa n d p r og n o s i s b e t w e e n A L K r e a r r a n g e m e n t s a n dE GF R m u t a t i o n s i n s u r g i c a l l y r e s e c t e d e a r l y-s t a g e l u n ga d e n o c a r c i n o m a J C a n c e r201910161-71D O I107150j c a2694738 N i s h i i T Y o k o s e T M i y a g i Y e t a l C l i n i c o p a t h o l o g i c a lf e a t u r e s a n dE G F Rg e n e m u t a t i o ns t a t u s i ne l d e r l yp a t i e n t sw i t hr e s e c t e dn o n-s m a l l-c e l l l u n g c a n c e r J B M C C a n c e r201414610D O I1011861471-2407-14-61039 S o d a M C h o iY L E n o m o t o M e ta l I d e n t i f i c a t i o n o ft h et r a n s f o r m i n g E M L4-A L Kf u s i o n g e n e i nn o n-s m a l l-c e l l l u n gc a n c e r J N a t u r e2007448561-566D O I101038n a t u r e0594540 C a m i d g e D R D o e b e l e R C T r e a t i n g A L K-p o s i t i v e l u n gc a n c e r--e a r l y s u c c e s s e sa n df u t u r ec h a l l e n g e s J N a t R e vC l i n O n c o l201295268-277D O I101038n r c l i n o n c20124341 P e t e r sS B e s s eB N e wt h e r a p e u t i c s t r a t e g i e s i n l u n g c a n c e r sM胡坚主译北京科学出版社201712642 R o d e n h u i sS S l e b o sR J T h er a so n c o g e n e si nh u m a nl u n gc a n c e r J A m R e vR e s p i rD i s1*******P t2S27-S30㊃2501㊃国际呼吸杂志2021年7月第41卷第14期I n t JR e s p i r,J u l y2021,V o l.41,N o.14Copyright©博看网. All Rights Reserved.D O I101164a j r c c m1426_P t_2S2743 d eM e l oA C d eSáV K S t e r n b e r g C e t a l M u t a t i o n a l p r o f i l ea n dn e w I A S L C A T S E R Sc l a s s i f i c a t i o n p r o v i d ea d d i t i o n a lp r o g n o s t i c i n f o r m a t i o n a b o u t l u n g a d e n o c a r c i n o m a a s t u d y o f 125p a t i e n t s f r o m B r a z i l J O n c o l o g y2015893175-186D O I10115900037655244 K a d o t aK Y e hY C D'A n g e l oS P e t a l A s s o c i a t i o n s b e t w e e nm u t a t i o n s a n d h i s t o l o g i c p a t t e r n s o f m u c i n i n l u n ga d e n o c a r c i n o m a i n v a s i v e m u c i n o u s p a t t e r na n de x t r a c e l l u l a rm u c i na r ea s s o c i a t e d w i t h K R A S m u t a t i o n J A m JS u r g P a t h o l2014 388 1118e27 D O I 10 1097P A S000000000000024645J i a n g L M i n o-K e n u d s o n M R o d e n A C e ta l A s s o c i a t i o nb e t w e e n t h e n o v e lc l a s s i f i c a t i o n o f l u n g ade n o c a r c i n o m as u b t y p e sa n d E G F R K R A S m u t a t i o n s t a t u s a s y s t e m a t i c l i t e r a t u r er e v i e w a n d p o o l e d-d a t aa n a l y s i s J E u rJ S u r g O n c o l2019455870-876D O I101016j e j s o20190200646 K a d o t aK S i m aC S A r c i l a M E e ta l K R A S m u t a t i o ni sas i g n i f i c a n t p r o g n o s t i c f a c t o r i n e a r l y-s t a g e l u n ga d e n o c a r c i n o m a J A m J S u r g P a t h o l201640121579e90D O I101097P A S000000000000074447 T a k e u c h iK S o d aM T o g a s h iY e t a l R E T R O S1a n dA L Kf u s i o n s i n l u ng c a n c e r J N a tM e d201218378-381D O I101038n m 265848 S t u m p f o v aM J a n n eP A Z e r o i n g i no nR O S1r e a r r a n g e m e n t si nn o n-s m a l l c e l l l u n g c a n c e r J C l i n C a n c e rR e s2012184222-4224D O I1011581078-0432C C R-12-181249 S h o l l L M S u n H B u t a n e y M e t a l R O S1i mm u n o h i s t o c h e m i s t r y f o r d e t e c t i o n o f R O S1-r e a r r a n g e d l u n ga d e n o c a r c i n o m a s J A mJS u r g P a t h o l2013371441-1449D O I101097P A S0b013e3182960f a750 A r c i l a M E C h a f t J E N a f a K e t a l P r e v a l e n c ec l i n i c o p a t h o l o g i c a s s o c i a t i o n s a nd m o le c u l a r s p e c t r u m o fE R B B2H E R2t y r o s i n e k i n a s e m u t a t i o n s i n l u n ga d e n o c a r c i n o m a s J C l i n C a n c e rR e s2012184910-4918D O I1011581078-0432C C R-12-091251 H i r s c h F R S u d a K W i e n s J e t a l N e w a n d e m e r g i n gt a r g e t e dt r e a t m e n t si na d v a n c e d n o n-s m a l l-c e l l l u n g c a n c e rJ L a n c e t20163881012-1024D O I101016S0140-67361631473-852 Z h a o J C h e n X Z h e n g J e t a l A g e n o m i c a n dc l i n i c o p a t h o l o g i c a l s t ud y o fn o n-s m a l l-ce l l l u n g c a n c e r sw i t hd i s c o r d a n t R O S1ge n e s t a t u s b yf l u o r e s c e n c e i n-s i t uh y b r i d i z a t i o n a n d i mm u n o h i s t o c h e m i c a l a n a l y s i s JH i s t o p a t h o l o g y201873119-28D O I101111h i s1349253 D i n g Y Z h a n g L G u o L e ta l C o m p a r a t i v es t u d y o nt h em u t a t i o n a l p r o f i l e o f a d e n o c a r c i n o m a a n d s q u a m o u s c e l lc a r c i n o m a p r ed o m i n a n th i s t o l o g i cs u b t y pe si n C h i n e s en o n-s m a l l c e l l l u n g c a n c e r p a t i e n t s J T h o r a cC a n c e r2020111103-112D O I1011111759-77141320854 L iM W uN Z h a n g L e t a l S o l i d c o m p o n e n t p r o p o r t i o n i s a ni m p o r t a n t p r e d i c t o ro ft u m o ri n v a s i v e n e s si nc l i n i c a ls t a g eT1N0M0c T1N0M0l u n g a d e n o c a r c i n o m a J C a n c e rI m a g i n g201818118D O I101186s40644-018-0147-755 B o r c z u kA C Q i a n F K a z e r o s A e ta l I n v a s i v eS i z ei sa nI n d e p e n d e n t P r e d i c t o r o f S u r v i v a l i n P u l m o n a r yA d e n o c a r c i n o m a J A m JS u r g P a t h o l2009333462-469D O I101097P A S0b013e318190157c56 S t r a n dT E R o s t a d H S t røm E H e ta l T h e p e r c e n t a g eo fl e p i d i c g r o w t h i s a n i n d e p e n d e n t p r o g n o s t i c f a c t o r i n i n v a s i v ea d e n o c a r c i n o m ao f t h e l u n g J D i a g nP a t h o l20151094D O I101186s13000-015-0335-857 N a k a m u r aS F u k u iT K a w a g u c h iK e t a l D o e s g r o u n d g l a s so p a c i t y-d o m i n a n t f e a t u r eh a v ea p r o g n o s t i cs i g n i f i c a n c ee v e ni n c l i n i c a l T2a N0M0l u n g a d e n o c a r c i n o m a J L u n gC a n c e r201589138-42D O I101016j l u n g c a n20150401158 v a nK l a v e r e nR J O u d k e r k M P r o k o p M e t a l M a n a g e m e n to f l u n g n o d u l e s d e t e c t e d b y v o l u m eC Ts c a n n i n g J NE n g l J M e d20093612221-2229D O I101056N E J M o a0906085 59张杰肺肿瘤诊断病理学若干问题的认识和思考J中华病理学杂志2021505431-436D O I103760c m a jc n112151-20210119-00057Z h a n g J I s s u e so n p a t h o l o g i c a l d i a g n o s i so f l u n g t u m o r JZ h o n g h u aB i n g L iX u eZ aZ h i2021505431-436D O I103760c m a j c n112151-20210119-00057收稿日期2020-09-22㊃3501㊃国际呼吸杂志2021年7月第41卷第14期I n t JR e s p i r,J u l y2021,V o l.41,N o.14Copyright©博看网. All Rights Reserved.。
关于非典型性腺瘤

如对您有帮助,可购买打赏,谢谢关于非典型性腺瘤导语:目前疾病患病率非常高,很多患者都饱受其困扰。
很多疾病不分年龄,因此生活中大家需要积极预防,早发现早治疗,以免耽误治疗。
下面我们来看目前疾病患病率非常高,很多患者都饱受其困扰。
很多疾病不分年龄,因此生活中大家需要积极预防,早发现早治疗,以免耽误治疗。
下面我们来看看肺部不典型腺瘤样增生的内容,让您对自身身体状况加以重视,一旦发现异常,就需要尽快到正规医院进行检查。
非典型鳞状上皮细胞是病理学专业名词,指不能肯定其形态特征及病变性质的形态异常的鳞状上皮细胞.对此类患者应注意复查.建议您下一步做个阴道镜活检,因肠郸斑肝职菲办十暴姜为细胞病理学诊断不是最终诊断的标准。
前列腺上皮内新生物(PIN)是公认的前列腺癌癌前病变[1,2 ] 。
而前列腺非典型性腺瘤样增生(AAH)与癌的关系则有争议[1,3 ] 。
本文重点探讨PIN和AAH与前列腺癌的关系及鉴别。
1 材料和方法:自1994年10月~1999年9月,我院共接收前列腺穿刺活检标本2 5 0例,经耻骨上剔除或经尿道前列腺电切标本2 71例。
经全面复查,选择其中含PIN,AAH和腺癌的病例作为本次研究对象。
所有PIN和AAH均作高分子量细胞角蛋白(34BE12 )标记。
对PIN和AAH与前列腺癌的关系和形态学差异作对比分析。
2 结果:2 5 0例穿刺活检标本中共检出前列腺癌10 0例(40 % ) ,PIN46例(18.4% ) ,其中高级别PIN(图 1,2 ) 2 4例 (2 3例伴有前列腺癌 ) ,低级别PIN 2 2例 (10例伴有前列腺癌 )。
检出AAH 5例 (2 % ) ,均不伴有癌。
预防疾病常识分享,对您有帮助可购买打赏。
肺非典型腺瘤样增生是什么

如对您有帮助,可购买打赏,谢谢
生活常识分享肺非典型腺瘤样增生是什么
导语:肺非典型腺瘤样增生对于很多人来说都是一个陌生的名词,在平常生活中我们也并不常见。
但是,它却是一个恐怖的疾病,也是一个健康的杀手。
为
肺非典型腺瘤样增生对于很多人来说都是一个陌生的名词,在平常生活中我们也并不常见。
但是,它却是一个恐怖的疾病,也是一个健康的杀手。
为了让大家更好的了解相关病症和情况,今天就为大家详细介绍肺非典型腺瘤样增生到底是什么。
肺部不典型腺瘤样增生是癌前病变,癌前病变是恶性肿瘤发生前的一个特殊阶段,癌前病变本身并非恶性,而且并非所有癌前病变都会变成恶性肿瘤,但这种病变在某些因素作用下,很容易变为癌或肉瘤。
您的不典型腺瘤样增生不是一定会发展成为肺癌的,但您在生活需要注意减少接触引起癌变的因素。
癌前病变本身没有恶心,所以手术摘除没有什么特殊要求,切干净就行了。
建议一定要戒烟,要下决心。
做好食品的防霉去毒、改变不良饮食习惯,不吃或少吃烤肉、烟熏食品,合理调配饮食,适量多吃富含维生素A、C、E及β-胡萝卜素的食品,多吃新鲜蔬菜和水果,避免或减少接触职业致癌因素、积极治疗癌前病变等。
以上就是今天为大家介绍的关于肺非典型腺瘤样增生的情况,每个人在乎自己身体健康的心情可以理解,但是也不用过于紧张。
最好还是平日多多锻炼身体,注意身体变化,定期体检。
一旦发生问题,建议还是尽快去医院寻求更为专业的帮助。
肺癌新分类解读

郑州大学第一附属医院病理科 李晟磊
关于活检
• 1.请病理科医生不要太相信自己的眼睛; • 2.请临床医生不要太相信活检病例的分化程度; • 3.鼓励穿刺活检,一次不行两次,两次不行N次; • 4.大力发展细胞学检查,重视细胞学结果; • 5.活检病理报癌的病理大多足以EGFR检测; • 6.活检标本应标注是否进行IHC或特染; • 7.活检标本原则上不诊断不典型增生、原位腺癌等; • 8.废弃“细支气管肺泡癌”的诊断; • 9.尽量避免NSCLC的诊断; • 10.巧妇难为无米之炊。
• 五、镜下观HE染色特点:4结构2细胞。有裂隙,多形。
• 六、IHC特点:①CK、CK7表面上皮着色;②Vimentin间质细胞着色; ③TTF-1、EMA、β-catenin均匀弥漫着色。④Ki-67增殖指数极低,通 常<5%。
浸润性肺癌的免疫学表型
• 腺癌:Napsin-A、TTF-1、SPA、 CK8/18;
现在最新的肺癌基本分类
• 1.腺癌:a腺瘤样不典型增生,b原位腺癌,c微 浸润性腺癌,d浸润性腺癌,f少见腺癌
• 2.鳞癌:a鳞状上皮不典型增生,b原位鳞癌,c 乳头状鳞状细胞癌,d鳞癌
• 3.神经内分泌癌:a特发性神经内分泌细胞增 生b类癌c不典型类癌d大细胞神经内分泌癌e小 细胞癌(复小)
• 4.少见类型:粘表、腺样囊性癌、肌上皮癌、 肉瘤样癌、腺鳞癌、巨细胞癌、腺棘皮癌
2011国际肺癌新分类
• 浸润前病变:
• 非典型腺瘤样增生:
• 原位腺癌:原来的BAC,直径≤3cm。
• 微浸润腺癌:
• 直径≤3cm,以贴壁为主的,浸润灶≤5mm。
• 浸润性腺癌:
• 贴壁样生长:高分化
肺部结节8年病例分析
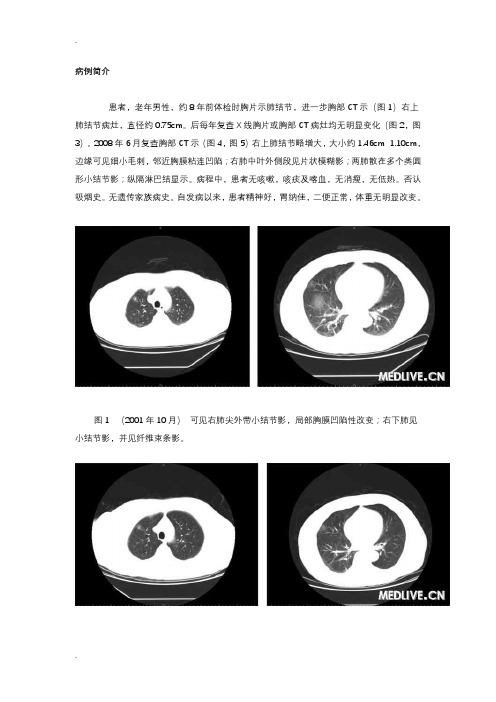
病例简介患者,老年男性,约8年前体检时胸片示肺结节,进一步胸部CT示(图1)右上肺结节病灶,直径约0.75cm。
后每年复查X线胸片或胸部CT病灶均无明显变化(图2,图3)。
2008年6月复查胸部CT示(图4,图5)右上肺结节略增大,大小约1.46cm×1.10cm,边缘可见细小毛刺,邻近胸膜粘连凹陷;右肺中叶外侧段见片状模糊影;两肺散在多个类圆形小结节影;纵隔淋巴结显示。
病程中,患者无咳嗽,咳痰及喀血,无消瘦,无低热。
否认吸烟史。
无遗传家族病史。
自发病以来,患者精神好,胃纳佳,二便正常,体重无明显改变。
图1(2001年10月)可见右肺尖外带小结节影,局部胸膜凹陷性改变;右下肺见小结节影,并见纤维束条影。
图2(2004年4月)右肺尖外带见小结节,斑片状高密度影,邻近胸膜凹陷性改变;右下肺见小结节密度增高影及斑片状,索条状高密度影。
图3(2007年11月)右肺上叶、中叶多发斑片影,两下肺纤维索条影,右肺下叶后基底段结节影,邻近胸膜增厚粘连。
图4(2008年6月)右肺上叶前段见一结节影,大小约1.25×1.10cm,边缘可见细小毛刺,邻近胸膜粘连凹陷;右肺中叶外侧段见片状模糊影。
右肺尖少量条索影,两肺散在多个类圆形小结节影。
图5(2009年1月)右肺上叶前段见一结节影,大小约1.46×1.10cm,边缘可见细小毛刺,邻近胸膜粘连凹陷;右肺中叶外侧段见片状模糊影;两肺散在多个类圆形小结节影。
体检:血压:160/80mmHg,T:36.5°C。
神清,对答切题,全身皮肤黏膜未见黄染及出血点,浅表淋巴结无肿大,颈软,气管居中,心率72次/min,律齐,杂音未闻。
腹软,全腹无明显压痛,无反跳痛,肝肋下未及,脾肋下一指,质软,移动性浊音(-),双下肢无浮肿,NS(-)。
有高血压20余年,最高160/95mmHg,服用缬沙坦、氨氯地平、比索洛尔降压,患者血压控制良好。
2型糖尿病约3年,服用瑞格列萘,血糖控制可。
肺腺癌新分类

肺腺癌新分类
肺腺癌新分类
4.浸润性腺癌的变异型
浸润性黏液腺癌(原来的黏液性BAC)
胶质样腺癌
胎儿型腺癌(低和高分化)
肠腺癌
肺腺癌新分类
浸润性黏液腺癌
肿瘤由含有粘液的杯状细胞或柱状细胞组 成,细胞异型性不明显,肺泡腔隙常充满 黏液。瘤细胞可呈贴壁生长、腺泡、乳头、 微乳头、以及实性结构等混合。
大多数胎儿型腺癌为低级别,预后较好, 少数病例为高级别。
肺腺癌新分类
肠型腺癌
肺原发性肠型腺癌为新增加的一种肺癌变 型,具有结直肠腺癌的一些形态学和免疫 组化特征,肿瘤细胞呈高柱状、假复层排 列,形成腺样、乳头状、或筛状结构。
免疫组化染色至少表达1种肠型分化标记 (如CDX-2、CK20、MUC2)。但半数病例 同时表达CK7和TTF-1(可与转移癌鉴别)。
AIS 全部切除后预后很好,5年无病生 存率达100%。
肺腺癌新分类
肺腺癌新分类
肺腺癌新分类
2.微浸润腺癌(Minimally invasive adenocarcinoma,缩写为MIA)
是指一类小的( ≤3 cm) 、局限性腺癌,癌细 胞以贴壁生长方式为主,任一视野下间质 浸润的最大径≤5mm。
肺腺癌新分类
新分类主要变化
1.将肺腺癌分列为4类 2.提出原位腺癌(AIS)和微浸润性腺癌
(MIA)的新概念 3.弃用BAC 及混合型腺癌诊断术语 4.增加贴壁状为主型腺癌、微乳头状为主型
腺癌、肠型腺癌 5. 取消黏液性囊腺癌、印戒细胞癌、透明 细胞癌
肺腺癌新分类
2004年WHO肺腺癌组织学分类
与AIS和MIA的区别:肿瘤直径>3cm、浸 润灶直径>0.5cm、多个癌结节、肿瘤界限 不清楚,以及周围肺组织内粟粒状播散。
肺癌的分类及病理学

肺癌的分类以与病理学一、肺癌的临床大体分型(一)肺癌分为周围型肺癌与中心型肺癌。
肺癌可发生于两肺的任何肺叶,但右肺多于左肺,上叶多于下叶,中叶最少,上叶前段最多。
1.中心型肺癌(20%~40%)(1)发生于主支气管、叶支气管,即段支气管开口近肺门侧者称中心型肺癌。
(2)以鳞癌或小细胞癌多见。
(3)生长在气管或其分叉处的为气管癌;中心型肺癌早期,瘤体很小时局限于气管内者为管内型;以浸润管壁为主时称管壁浸润型;以浸润管壁外为主,并与管壁外转移淋巴结融合者称为腔外型。
(4)中心型肺癌之肿瘤发展至局部晚期时,肿瘤原发灶与其转移的肺门与(或)、淋巴结融合并将肺门血管包裹其中,形成大块,则成为肺门巨块型肺癌。
2.周围型肺癌(60%~80%)(1)发生于段支气管开口以远的支气管或肺泡的肺癌称周围型肺癌。
(2)以腺癌或肺泡细胞癌多见。
(3)弥漫型肺癌:肺癌发生于细支气管或肺泡,常常累与双侧,亦可发生于单侧,散在的数不清的球状病灶分布于整个肺野称为弥漫型肺癌。
此型应注意与粟粒性肺结核、肺平滑肌瘤病、肺淋巴管癌、肺真菌感染、肺多发小脓肿相鉴别。
(4)肺炎型肺癌:胸片与CT显示整个大叶性肺炎的浸润型改变,但发热、寒战、周围血象白血球升高的中毒症状均不严重、不典型。
纤维支气管镜也可能无特殊发现,纵膈淋巴结常无明显转移,故术前诊断很为难。
术中发现叶裂完好处病灶界限清楚,叶裂发育不良处病变界限也不清楚,应切除部分健康肺组织。
病人能耐受时应考虑全肺切除术,此型称为肺炎型肺癌,病理诊断常为细支气管肺泡癌。
(5)纵膈型肺癌:病灶起源于贴近纵膈处的肺组织边缘,原发灶不太大,却与纵膈胸膜粘连并浸润纵膈胸膜,且转移至纵膈淋巴结,继而融合成团,常引起纵膈内血管或心包或椎体受侵。
一些病人以上腔静脉受压为第一临床表现,但病变并无远隔转移,手术切除后部分病人可获得长期存活,此型称为纵膈型肺癌。
(6)胸膜型肺癌:当周围型肺癌病灶起源于肺组织边缘,原发灶不大,很难确认,甚至胸片和CT仅显示为胸膜下的纤维条索增厚。
国际多学科肺癌组织病理新分类解读

国际多学科肺癌组织病理新分类解读林冬梅【期刊名称】《中国肺癌杂志》【年(卷),期】2013(016)006【总页数】5页(P277-281)【作者】林冬梅【作者单位】100021 北京,中国医学科学院,北京协和医学院肿瘤研究所肿瘤医院病理科【正文语种】中文肺癌组织学分类主要有非小细胞癌和小细胞癌两大类.1999年以及2004年两版的国际卫生组织(World Health Organization, WHO)/国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)肺癌组织学分类之间无太大变化[1].随着肺癌分子病理及靶向治疗研究的进展,2011年IASLC、美国胸科协会(American Thoracic Society, ATS)和欧洲呼吸协会(European Respiratory Society, ERS)等国际肺癌研究机构主要对其中肺腺癌分类进行了较为详细的修订以适应目前临床诊治的需求[2].本文针对国际多学科肺癌组织病理新分类中的概念更新及相关诊断要点,并结合临床治疗、肿瘤预后或研究进展等内涵进行解读说明.1 癌前病变肺癌癌前病变主要有三种:鳞状上皮不典型增生和原位癌、非典型性腺瘤样增生和原位癌、弥漫性特发性肺神经内分泌细胞增生,分别对应的是鳞癌癌前病变、腺癌癌前病变以及类癌癌前病变.到目前为止,对于小细胞癌的癌前病变,尚未见任何报道及相关线索.1.1 鳞状上皮不典型增生(squamous dysplasia, SD)和原位癌(carcinoma in situ, CIS) 1999年版WHO肺癌分类已经将鳞状上皮原位癌归入癌前病变,因此鳞状上皮癌前病变包括鳞状上皮非典型增生和原位癌.由于原位癌中的异型细胞没有突破上皮基底膜,尚未发展到浸润和转移的程度,从严格意义上来讲并不属于癌.因此,对于原位癌切忌按照真正意义上的癌过度治疗.近年来,为了与真正意义上的癌鉴别,WHO在许多器官组织学分类中已经废弃原位癌的概念,而代替为高级别上皮内瘤变.高级别上皮内瘤变的概念已经在许多器官肿瘤诊断中被广泛应用.所以,在规范病理诊断术语中,轻度、中度以及重度不典型增生等癌前病变的概念将逐渐被淘汰而取代为低级别和高级别上皮内瘤变等相关名称.1.2 非典型性腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位癌AAH是目前比较明确的肺腺癌癌前病变,在肺癌外科切除标本中,AAH占到2.4%-5.7%.病变结节往往边界不清,直径通常<0.5 cm,少数情况下直径可以超过0.5 cm,偶尔,也有可能达到1.0 cm.随着影像学技术的发展,体积较小的AAH病变逐渐被发现,影像以"毛沙状"改变为特点.镜下组织学表现为肺泡结构完好,肺泡上皮增生呈一致的立方形或矮柱状,有轻度非典型性,核仁缺乏或模糊.从细胞形态到组织结构有时难以与既往所谓细支气管肺泡癌(bronchioloalveolar carcinoma, BAC)鉴别,并可出现与BAC成分的过渡移行状态[1,3,4].AAH和所谓的BAC或肺腺癌存在一些相似的分子异常改变,包括克隆性、KせS突变及多态性、EGFR突变、p53表达及杂合性丢失和甲基化等[5,6].1.3 原位腺癌(adenocarcinoma in situ, AIS) 2011年多学科肺腺癌组织学分类对肺腺癌癌前病变概念做了进一步延伸与调整,建议废弃BAC的名称,将病灶≤3 cm,瘤细胞局限于正常肺泡结构内(贴壁式生长),并且缺乏间质、脉管或肺膜浸润的病变定义为AIS.AIS主要是1999年和2004年版WHO分类中病灶≤3 cm的BAC,分为粘液型和非粘液型.AIS以非粘液型多见,由II型肺泡上皮和/或Clara细胞组成.粘液型AIS比较罕见,几乎均由高柱状细胞组成,其细胞核位于基底,胞浆富于粘液,有时类似于杯状细胞.AIS细胞核异型性不明显,常见肺泡间隔增宽伴纤维化,尤其多见于非粘液型.AIS手术切除无病生存率为100%.1.4 弥漫性特发性肺神经内分泌细胞增生(diffuse idiopathic pulmonary neuroendocrine cell hyperplasia,DIPNECH) 该病变逐渐证明是一种少见的与肺类癌和不典型类癌有关的癌前病理改变.DIPNECH主要位于支气管壁内或周围,体积<0.5 cm.主要表现为散在瘤样增生的细胞结节(神经内分泌小体)或岛状细胞团,细胞大小一致、核深染、核仁不明显、染色质细腻,核分裂像罕见且无坏死.当该增生区域>0.5 cm时即可诊断为类癌.作为最常见的肺神经内分泌癌类型,小细胞癌很可能直接发生于弥散神经内分泌细胞上皮,而不经过复杂的癌变病理过程.2 肺癌2.1 腺癌(adenocarcinoma, AC)腺癌组织亚型取消BAC类型肺癌 1999年版国际肺癌分类对BAC类型的诊断制定了明确而严格的标准:当全部的肿瘤成分均表现为沿肺泡壁结构生长(lepidic pattern),且无间质浸润、胸膜侵犯及脉管瘤栓,因此BAC类型只有在手术切除的标本中才得以诊断,并且从理论上讲应该处在原位癌阶段,这也就不难解释BAC类型的肺癌患者5年甚至10生存率可达到100%,因此细支气管肺泡癌有别于其它类型的肺腺癌,而且有关临床III期或IV期BAC、肺内转移性BAC等说法应该是错误的.2011年IASLC等机构出台的肺腺癌新分类建议废除BAC类型,将大部分BAC明确归入原位腺癌的范畴,具体如下:腺癌癌前病变AAH原位腺癌(既往≤3 cm的BAC): 包括非粘液性、粘液性、混合粘液与非粘液性微小浸润性腺癌:≤3 cm的BAC,浸润范围≤5 mm浸润性腺癌:附壁结构为主型(lepidic predominant):非粘液性BAC,浸润范围>5 mm腺泡为主型乳头为主型微乳头为主型实体伴粘液分泌型浸润癌变异型浸润性粘液腺癌:既往粘液性BAC胶样癌胎儿性腺癌肠型腺癌微小浸润性腺癌(minimally invasive adenocarcinoma, MIA) 作为肺腺癌混合类型中最为常见的成分之一,BAC成分常常出现在癌灶的外围部分.多年来国际肺癌病理分类并未包含对其含量比例的临床意义及指导治疗等有重要价值的信息.不断有研究[7-9]显示肺腺癌BAC成分含量有一定的预后意义,故新分类中单独列出微小浸润腺癌的类型.MIA定义为≤3 cm以贴壁式生长为主的单发腺癌,包括非粘液型及粘液型,以非粘液型多见.界限清楚,浸润间质最大径≤5 mm.肺内多灶发生的腺癌也可适用于MIA的诊断.MIA浸润成分判定如下:①贴壁式生长之外的组织学亚型(即腺泡型、乳头型、微乳头型和/或实性型),或②肿瘤细胞浸润纤维母细胞性间质.如果肿瘤侵犯脉管或胸膜或者有坏死,则不能诊断为MIA.MIA病灶经完整切除后,总体5年生存率为100%.浸润性腺癌亚型(subtype of invasive adenocarcinoma) 肺腺癌是一类异质性非常大的肺癌亚型,以往分类通常分为以下五种类型:腺泡型、乳头型、细支气管肺泡癌(BAC)、伴有粘液分泌的实体性腺癌、混合型, 实际上80%以上肺腺癌为前四种类型(至少两种以上)的混合型,而这种混合成分种类及含量多少在很大程度上影响了病理诊断的差异性,同时也增加了患者病理类型与治疗或预后判断对比的评价难度.IASLC/ATS/ERS多学科国际协作新分类提出取消2004年版WHO分类中"混合型腺癌"亚型,可以改为半定量方式提示各亚型含量,以优势成分命名并提供各类型含量的百分比[2].至于具体亚型仍保留原分类中的腺泡型、乳头型以及粘液分泌的实体性腺癌三个亚型,增加了附壁为主型[(lepidic predominant, LP)既往≥3 cm的BAC类型腺癌,或≤3 cm的BAC类型腺癌但浸润范围≥5 mm]及微乳头型.注意如果肿瘤形态类似MIA,但出现侵犯淋巴管/血管/胸膜,或出现坏死时,应诊断LP,因此准确判断局部胸膜是否受累显得尤为重要.因为原来BAC类型的腺癌沿肺泡壁达胸膜下时,病理医师常常认为累及脏层胸膜.其实大多数情况下胸膜没有真正受侵,国际肺癌组织建议行弹力纤维染色观察胸膜是否存在弹力纤维断裂来确定胸膜是否受累.另外LP类型中的附壁结构特指非粘液性成分,因此不要出现以附壁结构为主的浸润性粘液性肺腺的诊断术语.至于微乳头型腺癌类型则是与临床关系比较密切,即使少到只有5%的含量,它的出现预示着肿瘤有较强的侵袭性和转移能力.目前所有研究[10,11]均表明该亚型为主的早期肺癌预后不良,但在肿瘤晚期由于受临床分期的影响,该结构不是独立的预后因素.浸润性腺癌变异型(variation of invasive adenocarcinoma) 分为四个变异型:浸润性粘液腺癌、胶样癌、胎儿型腺癌、肠型腺癌,前三个类型保留了原分类类型,只是浸润性粘液腺癌原分类称之为粘液性囊腺癌,实际病理改变为>3 cm,或浸润范围>5 mm的粘液性BAC类型;而肠型腺癌是本次新分类中增加的一个亚型,指形态上类似肠道腺癌即高柱状管状或筛状腺癌,且可以表达CDX-2蛋白,与肠癌肺转移难以鉴别,TTF-1、Napsin-A的阳性表达可以将二者区分.此新分类在病理形态与预后关系方面进一步细化,提出了和临床治疗、判断预后密切相关的亚型分类,与原分类相比显示其良好临床应用价值[12,13].病理医师诊断时应严格掌握并按照国际标准进行分类以尽可能保证结果的一致性,但也确实存在一些目前尚难以解决的问题,比如肿瘤间质纤维化不甚明显时,如何判断附壁结构有无浸润?因为还没有类似检测乳腺导管内癌或前列腺腺体基底膜是否完整的相关标记物来判断附壁结构的完整或受侵状态,诊断时只能依靠病理医师的经验或主观判断,势必会造成诊断亚型的分歧;另外冰冻诊断时由于取材有限,如何恰当提示肿瘤的类型,这种情况下可以借鉴小标本的处理原则,提示肿瘤主要表现为附壁型结构,需石蜡标本充分取材观察后明确亚型.2.2 鳞状细胞癌(squamous cell carcinoma, SCC)肺鳞癌是非小细胞肺癌主要组织学类型之一,多年来无形态学亚型变化.主要变异型有:乳头状细胞型、透明细胞型、小细胞型、基底细胞型.其中小细胞型鳞癌需要与小细胞癌鉴别,有时仅凭形态对两者进行诊断鉴别非常困难,但由于两者的治疗方案差别较大,所以在活检诊断时,应尽量将二者区分,可以借助免疫组织化学染色技术鉴别诊断,但有些情况下不能保证可以将其完全明确区分,比如肿瘤成分太少、免疫组化检测结果有交叉或不满意等情况[14-16].1999年版到2004年版WHO明确规定在小活检标本,当分化较差很难区分低分化鳞癌和低分化腺癌时,可以笼统归为非小细胞肺癌(non-small cell lung cancer no specific, NSCLC NOS).随着肺癌靶向治疗研究的不断进展,非小细胞肺癌的诊断名称已经不能满足临床的需要.2011年新分类则要求在小活检标本中,应借助于免疫组化检测尽可能提示腺癌或鳞状细胞癌类型[2],只有当形态学或免疫表型结果不典型或两者有矛盾时,才可使用NSCLC NOS的诊断.病理报告中不要使用非鳞状细胞癌的诊断名词,该名词是仅限于临床医师为决定治疗方案所使用的一个术语.对于临床医师而言应当了解病理诊断借助免疫组织化学检测免疫表型对肿瘤亚型分类有很大帮助,但不能保证100%可以明确分型.在诊断不肯定、类型不明确或诊断与临床有不符之处时应注意与病理医师之间的沟通和交流.2.3 大细胞癌(large cell carcinoma, LCC)大细胞癌为分化差的非小细胞癌一种独立类型,LCC占到所有肺癌的9%,在光镜下看不到任何腺或鳞的分化特征,只是电镜下有腺或鳞的分化迹象,所以该类型肺癌也只有在手术切除的标本中才能诊断,且不能借助于免疫组化来辅助判断LCC.但由于对该类型肿瘤诊断标准掌握的不严格,国内LCC的诊断并未达到9%的比例,而是将有些病例错误地划入了低分化腺鳞癌的范畴.2.4 腺鳞癌(adenosquamous cell carcinoma)腺鳞癌只占据所有肺癌的0.6%-2.3%,属少见肺癌类型.当癌组织中同时含有腺癌和鳞状细胞癌成分,且每种成分至少占10%以上时才可诊断为腺鳞癌,故该类型肺癌也是只能出现在手术切除的大标本病理报告中.诊断时切忌将似有腺或鳞状分化、但分化证据又不足的大细胞癌亚型误归入低分化腺鳞癌类型.2.5 肉瘤样癌(sarcomatoid carcinoma)肉瘤样癌为一类分化差的非小细胞癌,其亚类包括:多型癌、梭形细胞癌、巨细胞癌、癌肉瘤、肺母细胞瘤.其中多型癌的定义为任何一种非小细胞癌类型(腺癌、鳞癌、大细胞癌)混合肉瘤样成分如梭形细胞或巨细胞成分等;肺母细胞瘤好发于成人,由胚胎性间质和上皮成分组成.2.6 神经内分泌癌(neuroendocrine carcinoma)按照分化程度,神经内分泌癌分为高、中、低分化,具体对应的肿瘤类型为类癌、不典型类癌、小细胞癌/大细胞神经内分泌癌,对各类型的病理诊断均有明确指标要求.从组织发生、分子异常改变、组织形态学、免疫表现检测、临床治疗及预后等方面,小细胞癌与大细胞神经内分泌癌有很大的相似性.2.6.1 小细胞癌小细胞癌的演变很复杂,目前只保留小细胞癌和复合型小细胞癌两个亚型,后者亚型是指小细胞癌混合非小细胞癌成分.该亚型提示临床其治疗效果可能不如单纯小细胞癌敏感.2.6.2 大细胞癌神经内分泌癌与小细胞癌相似,有大细胞神经内分泌癌和复合型大细胞癌神经内分泌癌两个亚型.与小细胞癌的主要区别在于瘤细胞大小和形态,大小应大于3个正常淋巴细胞体积,形态显示瘤胞浆丰富,更具有上皮分化特征,核仁明显是其主要病理特点.同一肿瘤中也可出现大细胞神经内分泌癌与小细胞癌的混合成分,目前WHO分类认为此时可看作小细胞癌的亚型之一.2.6.3 类癌和不典型类癌前者为低度恶性而后者恶性度稍高.两者之间的区别在于每10个高倍视野2个核分裂像为界,另外,小灶坏死的有无也是其鉴别诊断指标之一.与类癌相比,不典型类癌常发生于外周,转移率增加,预后相对较差.目前研究结果[17]表明10%-15%的典型类癌和40%-50%的不典型类癌发生区域淋巴结转移和5%-20%的远处器官,如骨或肝脏等的转移.类癌和其它肺癌不同,该肿瘤与吸烟无关,但在分子病理方面与其它类型的肺癌有许多相似之处.总的来说典型类癌和不典型类癌分子生物学方面的改变基本一致,不同的是3p和位于13p14的RB基因的等位基因缺失很少发生在类癌,但可发生于20%和40%不典型类癌中.类癌独有的改变特征是经常出现MEN1基因的突变但缺乏蛋白表达[18],这种MEN1基因的等位缺失发生于11P13.与其它肺癌相比,除了RASFF1A (位于3p21.3)和caspase-8基因外,类癌中很少有基因发生甲基化.2.7 涎腺源性癌(carcinoma of the salivary glands)该类型肺癌来源于支气管粘膜腺体,与发生于涎腺内的相同类型癌一致,主要类型有腺样囊性癌、粘液表皮样癌、肌上皮癌、恶性多形性腺瘤等.3 总结总之,国际多学科肺腺癌新的组织学分类在提示肺腺癌预后及指导治疗方面提供了更加详细准确的病理信息.建议废除BAC类型,拓展了腺癌癌前的范畴,增加了MIA、LP亚型及肠型腺癌变异型;对于多种腺癌形态的病例,建议不再使用混合型腺癌类型,而代之于优势亚型为主并注明各成分含量的病理诊断报告模式;为满足晚期肺癌患者靶向治疗或个体化治疗的需求,建议在活检标本中尽可能区分腺癌、鳞状细胞癌亚型,必要时需进行免疫表型检测,尽量不使用NSCLC NOS的诊断名词.腺癌以外其它类型或亚型肺癌则仍保留2004年WHO肺肿瘤分类原则.参考文献【相关文献】1 Travis WD, Brambilla E, Muller-Hermelink HK, et al. Tumours of the lung. In: Travis WD, Brambilla E, Muller-Hermelink HK, Harris cc (eds.)Pathology and Genetics: Tumours of the Lung, Pleura, Thymus and Heart. IARC Press, Lyon, 2004; 2.2 Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society international multidisciplinary classif i cation of lung adenocarcinoma. J Thorac Oncol, 2011, 6(2): 244-285.3 Mori M, Rao SK, Popper HH, et al. Atypical adenomatous hyperplasia of the lung: a probable forerunner in the development of adenocarcinoma of the lung. Mod Pathol, 2001, 14(2): 72-84.4 Kitamura H, Kameda Y, Ito T, et al. Atypical adenomatous hyperpalsia of the lung. Implication for the pahtolgenesis of peripheral lung adenocarcinoma. Am J Clin Pathol, 1999, 111(5): 610-622.5 Sakamoto H, Shimizu J, Horio Y, et al. Disproportionate representation of KRAS gene mutation in atypical adenomatous hyperplasia, but even distribution of EGFR gene mutation from preinvasive to invasive adenocarcinomas. J Pathol, 2007, 212(3): 287-294.6 Kohno T, Kunitoh H, Suzuki K, et al. Association of KせS polymorphisms with risk for lung adenocarcinoma accompanied by atypical adenomatous hyperplasias. Carcinogenesis, 2008, 29(5): 957-963.7 Borczuk AC, Qian F, Kazeros A, et al. Invasive size is an independent predictor of survival in pulmonary adenocarcinoma. Am J Surg Pathol,2009, 33(3): 462-469.8 Yokose T, Suzuki K, Nagai K, et al. Favorable and unfavorable morphological prognostic factors in peripheral adenocarcinoma of the lung 3 cm of less in diameter. Lung Cancer, 2000, 29(3): 179-188.9 Lin DM, Ma Y, Zheng S, et al. Porgnostic value of bronchioloalveolar carcinoma component in lung adenocarcinoma. Histol Histopathol,2006, 21(6): 627-632.10 Roh MS, Lee JI, Choi PJ, et al. Relationship between micropapillary component and micrometastasis in the regional lymph nodes of patients with stage I lung adenocarcinoma. Histopahtology, 2004, 45(6):580-586.11 Sanchez-Mora N, Presmanes MC, Monroy V, et al. Micorpapillary lung adenocarcinoma:a distinctive histologic subtype with prognostic signif i cance. Case series. Hum Pathol, 2008, 39(3): 324-330.12 Maeshima AM, Tochigi N, Yoshida A, et al. Histological scoring for small lung adenocarcinomas 2 cm or less in diameter: a reliable prognostic indicator. J Thorac Oncol, 2010, 5(3): 333-339.13 Yoshizawa A, Motoi N, Riely GJ, et al. Prognostic significance of the proposedIASLC/ATS/ERS revised classification of lung adenocarcinoma in 514 stage I lung adenocarcinomas. Mod Pathol, 2011,24(5): 653-664.14 Niolson AG, Gionzalez D, Shah P, et al. Refining diagnosis and EGFR status of non-small cell lung carcinoma in biopsy and cytologic material,using a panel of mucin staining, ヰF-1, cytokeratin 5/6, and P63. J Thorac Oncol, 2010, 5(4): 436-441.15 Au NH, Gow CH, Cheang M, et al. P63 expression in lung carcinoma:a tissue microarray study of 408 cases. Appl Immunohitochem Mol Morphol, 2004, 12(3): 240-247.16 Ang DC, Ghaffar H, Zakowski MF, et al. Expression of squamous markers in lung adenocarcinoma (AD): clinicopathologic and molecular correlates, and implications for differentiation from squamous cell carcinoma (SqCC). Mod Pathol, 2010, 23(Suppl): 397A.17 Tsuta K, Raso MG, Kalhor N, et al. Histologic features of low- and intermediate-grade neuroendocrine carcinoma (typical and atypical carcinoid tumors) of the lung. Lung Cancer, 2011, 71(1): 34-41.18 Cakir M, Grossman A. The molecular pathogesis and management of bronchial carcinoids. Expert Opin Ther Targets, 2011, 15(4): 457-491.。
两种肺CT磨玻璃结节的特点与肺腺癌病理分型的关系

两种肺CT磨玻璃结节的特点与肺腺癌病理分型的关系褚志慧;牛放;牛玉军【摘要】目的探讨两种类型肺CT磨玻璃结节(ground glass nodule,GGN)与肺腺癌病理分型的关系。
方法对锦州医科大学附属第一医院76例同时有病理结果及CT单发肺磨玻璃结节的病例进行回顾性分析,其中纯磨玻璃结节(pure ground glass nodule,p GGN)36例,混合密度磨玻璃结节(mixed ground glass nodule,m GGN)40例,比较两类结节的形状、分叶征、毛刺征、边缘清晰情况、空泡征、胸膜凹陷征、血管集束征、大小与病理分型的差异。
结果 p GGN 在空泡征、结节大小及微浸润癌(minimally invasive adenocarcinoma,MIA)方面与m GGN无明显区别(P〉0.05)。
p GGN以类圆形多见(χ2=10.294,P 〈0.05),边缘多光滑清晰(χ2=7.465,P〈0.05)。
m GGN多具有分叶征(χ2=38.551,P〈0.05)、毛刺征(χ2=24.945,P〈0.05)、胸膜凹陷征(χ2=24.282,P〈0.05)及血管集束征(χ2=38.393,P〈0.05)。
p GGN和m GGN在病理分型方面具有显著差异(χ2=45.182,P〈0.05),p GGN以良性病变及浸润前病变(preinvasive lesion,PIL)为主(91.67%,P〈0.05),而m GGN以浸润性病变(invasive pulmonary adenocarcinoma,IPA)为主(45%,P 〈0.05)。
结论两种类型肺CT磨玻璃结节特点具有显著差异,p GGN以良性病变为主,m GGN以恶性病变为主。
【期刊名称】《解放军医学院学报》【年(卷),期】2016(037)012【总页数】4页(P1267-1269,1300)【关键词】肺腺癌;磨玻璃结节;体层摄影术;病理学【作者】褚志慧;牛放;牛玉军【作者单位】[1]锦州医科大学附属第一医院放射科,辽宁锦州121000;[2]贵州医科大学,贵州贵阳550000【正文语种】中文【中图分类】R734.2肺部磨玻璃结节与早期肺癌关系密切[1]。
肺癌的综合影像学诊断

左侧锁骨上淋巴结活检腺癌
肿块与局部转移 的淋巴结融合为 纵隔肿块
男,82岁,声音嘶哑2年,无何不适。
诊断:主动脉假性动脉瘤
肺上沟癌
将发生在肺尖部的癌肿称为肺上沟癌(大多为鳞癌),由Pancoast首先在1932年报道。 因肺上沟癌处于肺尖特殊解剖部位,一旦外侵,就直接涉及臂丛神经、交感神经节及第1-3肋骨,随之产生相应临床 症状。如侵犯臂丛就可出现肩部疼痛;压迫颈交感神经节时,则出现其所支配的组织器官的功能障碍,表现为同侧瞳 孔缩小、眼睑下垂(眼裂变小)、眼球内陷、眼压降低、眼部血管充血、额部汗少等症状。这些症状称为霍纳综合征。
过去认为多结节癌灶是气道或淋巴道肺内播散的结果。近年有文献报道,部分病例结节是多克隆起源,提示多结 节型不一定都是肺内转移,也可能是多中心发生,多结节型可以发展成为弥漫型。
肺癌:弥漫型
溺水后感染
甲状腺癌肺转移瘤
软骨肉瘤肺转移灶,在下叶肺动脉内广泛形成瘤栓(虚箭)
急性粟粒性肺结核
特殊类型肺癌
• 肿瘤缺乏间质、血管或胸膜浸润;
thickened alveolar septa without disruption of the alveolar structures.
肺磨玻璃结节到底严不严重,如何妥善处理?

肺磨玻璃结节到底严不严重,如何妥善处理?发布时间:2023-06-12T05:29:59.137Z 来源:《医师在线》2023年2月4期作者:辜强[导读]肺磨玻璃结节到底严不严重,如何妥善处理?辜强(仁寿县人民医院;四川眉山620500)肺磨玻璃结节(GGN)属于影像学检查中肺部常见的征象,通过薄层CT检查可发现局灶性云雾状密度增高影,在阴影中支气管和血管清晰。
结合其成分的差异,又可以将其分为纯磨玻璃结节和伴实行成分的混合性磨玻璃结节。
在病理上也可以将其分为恶性和良性。
目前,肺癌作为临床中发生率较高的恶性肿瘤,其疾病特点在于高发生率、高死亡率,而早期明确诊断肺癌是早期治疗的可靠依据,也是改善患者预后的有效措施。
随着现代医疗技术的发展,医学影像学技术的普及和应用,在薄层CT检查中GGN的情况并不少见,而肺部GGN和肺癌的联系成为了当下的研究重点。
一、肺部磨玻璃影和肺磨玻璃结节的定义在我国的专家共识中,将肺部磨玻璃影(GGO)定义为:经薄层CT检查直径≤30mm,边界清楚或不清楚的肺内密度增高影,但病变密度无法掩盖其中的血管和支气管影。
若为局限病变,可将其称为局灶性磨玻璃影(fGGO),若病灶边界清晰且为圆形,同时以结节状为主即为肺磨玻璃结节(GGN)。
而GGO和GGN还可以分为纯磨玻璃影或结节(pGGO,pGGN)以及伴实性成分混合的磨玻璃影或结节(mGGO,mGGN),其中pGGN、mGGN统称为亚实性结节。
在我国,GGN主要以直径<15mm的小结节为主,并且GGN的检出率随着受检者年龄的上升而上升,尤其是在60~80岁年龄的群体中。
在性别分布方面,GGN多发生在女性群体中,至今尚不明确原因,但总体可知,正常人群的健康体检中,薄层CT检出的GGN的人群逐年增多,且女性居多,高龄患者检出率更高。
二、GGN和肺癌的关系在亚实性结节中,如果是潜在恶性或恶性病变,其病理可分为肺泡上皮不典型腺瘤样增生(AAH)、原位腺癌(AIS)、微浸润性腺癌(MIA)、浸润性腺癌(IAC)等多个腺癌演进阶段。
肺腺癌病理诊断及鉴别诊断

定义:具有腺样分化或有黏液产生,表现为腺泡样、乳头样、贴壁样、微乳头样、实巢状或片状,具有黏液形成的实性巢或以这些形式混合生长的恶性上皮性肿瘤。
ICD-O编码:8140/3同义词:无命名历史:2015版WHO肺肿瘤组织学分类吸收了2011年国际肺癌多学科分类的内容,对2004版WH0肺腺癌的组织亚型分类做了根本性的改动,对肺腺癌的亚型按癌细胞的生长方式分类,具体内容如下:①摒弃了WH0(2004)中细支气管肺泡癌和混合性亚型腺癌的名称;②将原位腺癌与非典型性腺瘤样增生一同列入浸润前病变;③增加了微小浸润性腺癌;④将浸润性腺癌根据其主要亚型与全部病变的比例以半定量方式表述出来,以5%的量递增,故浸润性腺癌包括伏壁型、腺泡型、乳头型、微乳头型、实性型生长方式以及浸润性黏液腺癌、胶样型、胎儿型、肠型腺癌。
不同生长方式的腺癌预后不同,以伏壁型生长方式为的主腺癌预后较好,以腺泡型和乳头型生长方式的腺癌次之,浸润性腺癌中实性和微乳头型腺癌预后较差。
⑤使用伏壁型生长方式表述浸润性腺癌中的非浸润成分(以前被分为细支气管肺泡癌)。
⑥引入浸润性黏液腺癌,取代黏液性细支气管肺泡癌,去除此处的原位癌和微小浸润癌。
⑦不再使用透明细胞癌和印戒细胞癌亚型名称,只是在它们出现时加以描述,无论数量多少。
⑧不用囊腺癌的名称,将其归入胶样癌。
临床表现:肺腺癌多为周围型,早期无明显特殊症状,一般以发热、咳血、胸痛、气急等呼吸系统症状为主,或无症状,故很容易被忽略。
也有患者早期存在肺外表现(骨关节疼痛、肩背痛甚至脑转移等相关症状)。
晚期症状则因患者体质不一存在差异,常见症状有疼痛、声音嘶哑、头颈部水肿、胸腔积液等。
近年来,肺腺癌在女性、非吸烟者或从不吸烟者,甚至是年轻的成年人中越来越普遍。
细胞学:细胞学诊断腺癌是基于单个细胞形态和细胞团的结构特点。
腺癌细胞可能是单个或排列成三维的桑葚样、腺泡样、假乳头样、伴有纤维血管轴心的真乳头和(或)细胞团片。
肺不典型腺瘤样增生的影像学表现

有学者根据HRCT的特征,将肺内孤立性结节分为三型,纯磨玻璃密度(pure GGO pGGO),均一半透明密度内无实性结节,条状、片状致密影;混合型磨玻璃密度(mixed GGO mGGO),磨玻璃密度中伴有中央结节,或条状、片状致密影;实性结节。
肺不典型腺瘤样增生在HRCT图像中表现为局灶性纯磨玻璃密度,但是局灶性纯磨玻璃密度通常被认为是局灶性细支气管肺泡癌(BAC),仅有不到1/3的纯磨玻璃密度是肺不典型腺瘤样增生。
局灶性肺内磨玻璃密度良恶性鉴 别困难,以下方面可供参考
细支气管肺泡癌的磨玻璃密度内可见支气管气象。
定期随访是有效的方法,炎性病灶在最初的3-6月内逐渐消失,若磨玻璃密度病变在随访中逐渐增大、密度增高或出现实性成分,要考虑恶性病变。不过即使磨玻璃密度在随访中长期稳定,也不能排除恶性病变,细支气管肺泡癌的倍增时间可长达2-4年,应特别注意。
局灶性混合型磨玻璃密度要警惕是肺腺癌或细支气管肺泡癌。周围型实性结节要警惕是肺腺癌。
有研究提示:≤10mm有磨玻璃密度成分的结节与恶性有明显的相关性; ≤20mm周围型局限性磨玻璃密度腺癌明显多于肺不典型腺瘤样增生; ≤20mm局限性磨玻璃密度病灶中纯磨玻璃密度≤50%,警惕细支气管肺泡癌或肺不典型腺瘤样增生, ≤20mm局限性磨玻璃密度病灶中纯磨玻璃密度≥50%,警惕腺癌。
1
2
肺不典型腺瘤样增生的影像学表现
X线表现:胸部X线片对肺不典型腺瘤样增生的显示不敏感,检出率与病灶的大小有关,有研究表明,仅有20%的结节影胸片可以发现,因此用X线胸片来检出肺不典型腺瘤样增生是不合适的。较大的肺不典型腺瘤样增生在胸片上表现为边缘不清的结节或阴影。
常规CT:仅见边缘模糊的片状影,病灶较小时常会漏诊,发现病灶后,需做2mm以下的薄层重建,或HRCT进一步观察。
肺泡上皮不典型腺瘤样增生

复发与转移风险
复发风险
肺泡上皮不典型腺瘤样增生的复发风险较低,但仍有复发的可能。复发的可能原因包括手术切除不彻 底、病变本身的恶性潜能等。
转移风险
肺泡上皮不典型腺瘤样增生的转移风险相对较低,但也有转移的可能。转移的风险因素包括病变的恶 性潜能、病变大小和位置等。
感谢您的观看
THANKS
胸膜摩擦音 肺部听诊
杵状指
诊断标准
病史采集
了解患者的吸烟史、职业暴露史、家族史等。
影像学检查
胸部X线或CT扫描显示肺部结节或肿块,边 缘模糊或分叶状。
组织病理学诊断
通过支气管镜或穿刺活检获取组织样本,进 行病理学检查,是确诊的金标准。
03 病理学特征
组织学特征
1 2
肺泡上皮细胞形态和排列异常
肺泡上皮细胞出现大小、形状和排列的异常,可 能呈现腺瘤样或乳头状生长。
与机化性肺炎鉴别
机化性肺炎的影像学表现与肺泡上皮不典型腺瘤样增生有所不同,机化性肺炎通 常表现为斑片状或大片状实变影,且抗感染治疗有效。而肺泡上皮不典型腺瘤样 增生则无这些表现。
05 治疗与预型腺瘤样增生,首 选的治疗方法是手术切除病变部位。 手术方式包括肺叶切除、肺段切除或 楔形切除等,具体手术方式需根据病 变范围和位置确定。
与肺鳞癌鉴别
肺鳞癌的影像学表现与肺泡上皮不典型腺瘤样增生有所不同,鳞癌通常表现为 中央型肿块,有支气管阻塞和肺不张等表现。而肺泡上皮不典型腺瘤样增生则 多表现为周围型结节或肿块。
与肺部炎症的鉴别
与慢性肺炎鉴别
慢性肺炎的影像学表现与肺泡上皮不典型腺瘤样增生相似,但慢性肺炎通常有长 期咳嗽、咳痰等病史,且抗感染治疗有效。而肺泡上皮不典型腺瘤样增生则无这 些症状和体征。
前列腺非典型腺瘤样增生的病理形态学特征与鉴别诊断

前列腺非典型腺瘤样增生的病理形态学特征与鉴别诊断
黎辉
【期刊名称】《临床合理用药杂志》
【年(卷),期】2017(10)11
【摘要】非典型腺瘤样增生(AAH),称为微腺泡增生,在病症类型上归属于瘤样病变。
世界卫生组织2002年在对泌尿系统肿瘤分类上明确指出,该症主要出现在良性结节周围单一成分的小腺体。
单从形态上,AAH与临床常见高分化腺癌存在着较大的相似性。
基于上述特点,临床对于该症的诊断效率在很长时间未能得到提高。
为此,本文主要针对前列腺非典型腺瘤样增生(AAH)的病理形态学特征和鉴别诊断进行分析,现报道如下。
【总页数】2页(P174-175)
【作者】黎辉
【作者单位】福建省南平市第一医院
【正文语种】中文
【中图分类】R737.33
【相关文献】
1.前列腺增生,非典型性腺瘤性增生和腺癌的AgNOR研究
2.前列腺增生,非典型腺瘤性增生及前列腺癌中PCNA和AgNOR表达
3.前列腺非典型腺瘤性增生的诊断和鉴别诊断
4.对前列腺非典型腺瘤样增生病变病理特征的分析
5.多层螺旋CT特征对肿块样胸腺增生和低危胸腺瘤的鉴别诊断
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不典型腺瘤样增生(AAH)
高分辨CT对于AAH的检出具有独到的优势;AAH的影像学特点为呈类圆形小病灶,边界清楚,淡至中等密度均匀的毛玻璃或磨砂玻璃阴影,不遮蔽其下的肺实质,多数在5 mm以下;对于单个AAH建议定期随访,有怀疑可手术切除,如果肺癌患者合并有此类病灶,建议同期手术切除,但AAH切除范围宜小不宜大,术后需长期随访。
肺癌的发病率近年仍在增长中。
2002年中国男性肿瘤发病率以肺癌为首位,占20.4%,女性中肺癌发病率仅次于胃癌,占14.8%。
2005年有文献报告,中国肺癌的发病率居全球第四位,男女性发病率分别为42.4/10万和19/10万,实际发病数居全世界之首。
认识肺癌侵袭前期病变对临床研究有重要意义。
肺癌中最多见的类型为鳞癌与腺癌。
不论中国或北美,肺腺癌发病率均见上升,已列各类型首位,如上海市2002-2004年发生的肺癌中58.9%为腺癌,女性更甚,达86.1%。
鳞状上皮不典型增生已被视为肺鳞癌的前期病变,世界卫生组织(WHO)提出,肺腺癌的前期病变为不典型腺瘤样增生(AAH)。
肺腺癌多见于肺野周围,日渐普及的胸部CT提高了周围型肺部病灶的发现率,定期随访已经成为肺内小结节的常用诊断策略,这为提高侵袭前期肺腺癌的检出率提供了可能性。
但是,目前无论是病理还是临床,对AAH的认识均有不足。
为此,对近年来有关AAH的文献加以综述,以供同道们参考,并希望能引起临床、病理、科研工作者的注意。
AAH的定义
AAH常常于手术切除的肺癌标本中发现,其定义主要从病理学角度考虑。
AAH指不和原发肺癌病灶相连的病灶,呈单排非侵袭性的不典型上皮细胞衬覆于肺泡壁,属于轻度到中度不典型细胞局限性增生,累及呼吸性细支气管时可导致外周肺泡的局灶性病变,一般≤5 mm,并且无间质性炎症和纤维化改变。
早在1965年,迈耶(Meyer)和利褒(Liebow)等学者就提出了不典型肺泡增生或细支气管肺泡增生的概念。
数十年来该病有很多同义词出现,
包括不典型肺泡立方状细胞增生、肺泡上皮增生、不典型肺泡增生、不典型细支气管肺泡细胞增生和细支气管肺泡细胞腺瘤。
上世纪90年代初,有学者认为该病可能为肺腺癌的前驱病变,是腺瘤-细支气管肺泡癌-侵袭性腺癌发展过程中的初始阶段表现。
1999年WHO肿瘤分类中将其定名为AAH。
AAH发生的相关因素
统计表明,不同标本AAH发生率不同:肺癌切除标本中的AAH发生率在9.3%~21.4%之间,因其他原因切除的肺标本中AAH的发生率为4.4%~9.6%。
AAH的发生还与肺癌类型相关,腺癌中AAH的发生率为15.6%~35.5%,高于其他类型,鳞癌中发生率为3.0%~11.0%,大细胞癌中发生率为10.0%~25.0%,转移性肺癌中也可偶见AAH。
女性AAH发病率高于男性。
多发性肺癌中AAH 发生多于单发性肺癌。
有研究报告,AAH可能与既往恶性肿瘤史相关,如直肠癌、肝癌、乳腺癌、甲状腺癌、头颈部癌和恶性淋巴瘤。
另外,AAH与吸烟史、家族肿瘤史相关性仍无定论,有待进一步研究。
AAH的大体及镜下病理表现
肺切面上有时可看到分散、柔软、苍白或黄色的AAH病灶,病变内肺泡间隙呈斑点状凹陷,常位于近胸膜处(图1)。
AAH多见于肺周围,仅2%为中央型病变。
51%的AAH位于上叶,下叶次之,占37%,右中叶比例明显较低,为11%。
每例肺癌患者的AAH病灶多寡不等,约1~13处,平均3.5处,但这些AAH病灶均取自切除的肿瘤标本,很可能遗漏其他部位病灶,有统计过低之嫌。
病灶较小,往往不大于5 mm,多数≤3 mm,很少>10 mm。
镜下看,AAH是一种肺实质病变,常发生在中央肺泡接近呼吸性细支气
管处。
AAH的组织学诊断标准为:①病变边缘清晰,为单层不典型上皮细胞,中心无萎陷或疤痕形成;②细胞浆丰富,细胞呈圆形或穹隆状,类似肺泡Ⅱ
型上皮细胞;③细胞核深染,核仁显著,不典型性不如腺癌明显;④肺泡隔上衬覆以不典型立方形或柱状细胞,肺泡隔可见轻度纤维增厚(图2)。
需要指出的是,AAH不能由细胞学作出诊断。
AAH的分子生物学改变
P53基因的蛋白产物在增殖细胞和正常细胞的平衡调控中起重要
作用,可作为恶性病变的生物标志物,C-erbB2为腺癌的前抗癌基因,两者
的表达均可用免疫组化方法检测。
有研究报告,肺癌中P53的中/重度阳性率、灶性/弱阳性率和阴性率分别为53%、35%和12%,而AAH病灶中阳性率较低,上述比率分别为28%、30%和42%。
肺癌中C-erbB2细胞膜阳性率为65%(有些病例同时显示胞浆阳性),仅见胞浆强阳性率为12%,胞浆染色灶
性/弱阳性率为17%,阴性率为6%,AAH病灶分别为7%、34%、25%和33%。
这些结果提示,AAH与肺癌一样有恶性相关的某些遗传学改变,但发生率低,这也支持AAH为癌前病变。
KRAS基因突变,尤其是12密码子突变,在周围型肺癌中具有特异性,这与支气管原发性肺癌不同,提示周围型肺癌的发生有不同的通路。
单独AAH的KRAS基因12密码子突变率为15%~50%,合并腺癌者约为22%~42%,
细支气管肺泡癌(24%~33%)也高于AAH,提示周围型腺癌发展过程中KRAS基因12密码子突变可能为早期事件。
近来关于表皮生长因子受体(EGFR)的研究较多。
日本的吉田(Yoshida)等报告,从AAH到浸润性腺癌中均有EGFR阳性表达,并呈递增趋
势。
他们认为EGFR在AAH和腺癌的发展过程中均扮演重要角色,其表达提示促进AAH发展为腺癌;EGFR在终末呼吸单位型肺腺癌中有94%的阳性表达率,在AAH中阳性表达率为40%(2/5例)。
临床和影像学诊断
AAH无明显临床症状和体征,通过肺癌手术切除标本或胸部CT检查发现,组织学诊断为唯一确诊方法。
AAH多见于肺腺癌,尤其是多发性腺癌,多发性腺癌者的影像学检查是发现“可疑”AAH的唯一方法。
X线胸片较难发现AAH,胸部高分辨率CT显示为类圆形小病灶,边界清楚,密度淡-中等,呈均匀的毛玻璃或磨砂玻璃阴影(GGO),低度透光,不遮蔽其下的肺实质,大小多数在5 mm以下(图3)。
GGO不是AAH的特殊影像学表现,GGO手术标本中30%为良性病变,10%~77%为AAH,50%为细支气管肺泡癌,10%~25%为侵袭性腺癌。
若为肺癌,则除了GGO表现外还伴有其他肺癌特征,如毛刺、胸膜牵曳,其中可有实性颗粒,形态可呈花苞、桑葚、昆虫状。
值得注意的是,多数AAH和肺癌同期发生(91.7%),少数为异期,这提示系列读片、手术时仔细探查具有重要意义。
对于周围型肺腺癌,其他部位上的细结节应作为手术探查及术后随访的靶灶。
AAH的治疗及预后
AAH通常发现于肺癌手术切除标本中,加以切除有可能免于发生肺癌。
肺腺癌手术前要详细地系列阅读胸部CT,除癌灶之外,应注意其他部位有无GGO或细结节。
对于术中探查可及之处,鼓励作局部活检。
AAH切除范围宜小不宜大,对探查不能及的GGO或细结节,应术后长期随访,动态观察变化。
日本的关(Seki)等报告了1例多发性腺癌,在3年零8个月内进行了2次手术,共切除了13处肿瘤样病变,其中10处为ⅠA期原发性肺癌,3处为AAH。
病理及分子生物学检查显示,第二次手术标本中,不论肺癌或AAH 细胞,其不典型变均较第一次更为明显,第一次手术标本P53均为阴性,第二次手术标本则部分P53阳性,且癌胚抗原(CEA)均为阳性。
其后2年零6个月该患者无复发。
作者提出,该病例2次手术的病理、基因变化支持AAH为癌前病变之说,认为对多发性肺腺癌不要任意放弃手术,应在安全条件下(年龄、体质、并存病、心肺功能等允许)进行手术。
AAH的存在不影响肺癌手术预后。
1997年铃木(Suzuki)等报告的1360例手术切除肺癌病例内,137例伴有AAH,未见AAH对各期肺癌的5年生存率有显著影响(见表)。
野口(Noguchi)等报告,236例手术切除的肺部小腺癌(≤2 cm)患者的5年生存率为74.6%。
根据肿瘤生长模式进行组织学分类,发现A、B两型预后最佳(100%)。
A型为局限性细支气管肺泡癌,孤立肺泡衬覆细胞生长,肺泡隔增厚;B型为除A型表现外还伴有瘤内肺泡萎陷造成的纤维灶。
这些描述近似AAH,提示切除AAH有望避免病灶癌变。
近年外科小切口手术以及胸腔镜手术的发展,减少了手术创伤。
对于微创手术可及的近胸壁小病灶,经检查不能除外肺癌时,可据此决定治疗方法,对改善预后可能会有所裨益。
至于非肺癌的孤立AAH是否应手术切除,目前虽无明确结论,但如患者伴有肺癌高危因素,不能除外癌症时,微创手术值得进行。
