《中国药典》2020版—人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)
人类免疫缺陷病毒(酶联免疫法)SOP

[结果判断]
1,阴阳性对照和被检样本的OD值减去空白对照OD值即为计算值.
2,若阴性对照OD均值小于0.02按0.02计算.
3,临界值(cut off值)的设定:
cut off值=阳性对照均值X 0.10+阴性对照OD均值
4,被检样本的OD值>=临界值应判为HIV抗体阳性反应,<临界值为阴性反应.
[试剂厂家]
北京万泰生物药业有限公司。
[试剂组成]
1.HIV微孔板4.HIV阴阳对照
2.HIV酶标抗原5.底物液A.B
3.浓缩洗涤液6.终止液
[试剂的稳定性与贮存]
试剂自生产日起避光贮存于2-8℃,有效期内(六个月)稳定。
[标本的收集与处理]
标本为新鲜无溶血血清或血浆。
[操作步骤]
1.取出试剂盒平衡至室温,将浓缩洗涤液用蒸溜水或去离子水按1:19稀释后备用。
待测样本的OD值>=临界值判为HIV抗体阳性,应重新取样双孔复试,复试阳性者应按照"全国HIV检测管理规范"送"HIV确认实验室"进行确认实验.
[质量控制]
为确保测试结果准确可靠,每批测试均应放置阳性质控血清与被检样品同时测试,用以检查试剂性能。
[临床意义]
人体受到免疫缺损病毒(HIV)感染后,试验呈阳性反应,如男性同性恋、静脉药瘾者(吸毒者)、血友病患者、艾滋病人的配偶。个别献血员中也有阳性反应的报告。
5.每孔加入底物液A.B各50ul,轻拍混匀,置37 C避光显色20分钟.
6.显色完毕后,每孔加入终止液50ul,轻拍混匀,立即以空白孔调零,置酶标仪450nm波长测BCD-SOP-01-40
人类免疫缺陷病毒(HIV)1+2型抗体(ELISA)
HIV实验室ELISA检测方法

人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)1 试剂信息试剂厂家:北京万泰生物药业股份有限公司2 样本要求2.1 本试剂使用样品为人血清或血浆,含有EDTA、柠檬酸钠或肝素等抗凝剂的样品可用于本实验。
2.2 不能检测含悬浮纤维蛋白或聚集物,重度溶血的样品。
2.3 样品中应无微生物,可在2-8℃储存1周,长期储存应低温冻存,避免反复冻融。
2.4 使用前请将样品室温平衡30分钟以上,冷冻样品实验前需混匀。
3 检测步骤3.1 配液:将浓缩洗涤液用蒸馏水或去离子水20倍稀释。
3.2 编号:将样品对应微孔板按序编号,每板应设阴性对照3孔,阳性对照1型、2型各1孔、空白对照1孔。
3.3 加样:分别在相应孔中加入待测样品或阴、阳性对照100μL。
3.4 温育:用封板膜封板后,置37±1℃温育60±2分钟。
3.5 洗板:小心揭掉封板膜,用洗板机洗涤5遍,最后一次尽量扣干。
3.6 加酶:每孔加入酶标试剂100μL,空白孔除外。
3.7 温育:用封板膜封板后,置37±1℃温育60±2分钟。
3.8 洗板:操作同步骤5。
3.9 显色:每孔加入显色剂A、B液各50μL,轻轻震荡混匀,37±1℃避光显色30±1分钟。
3.10 测定:每孔加入终止液50μL,轻轻振荡混匀,10分钟内测定结果。
4 参考值临界值(CUTOFF)计算:临界值=阴性对照A均值+0.12.5 检验结果的解释5.1 阴性对照孔A值≦0.10,阳性对照A值≧0.80,否则试验无效。
5.2 若有1孔阴性对照A值大于0.1应舍弃,若两孔或两孔以上阴性对照A值大于0.1,应重复试验。
5.3 阴性判定:样品A值<临界值(CUTOFF)者为HIV抗体阴性。
5.4 阳性判定:样品A值≧临界值(CUTOFF)者为HIV抗体阳性。
(注意:初试阳性应重新取样双孔复试。
复试阳性者应按《全国艾滋病检测技术规范》送HIV确证实验室进行确证实验。
人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)

人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)人类免疫缺陷病毒(Human Immunodeficiency Virus HIV)是导致人类获得性免疫缺陷综合征(Acquired Immunodeficiency Syndrome AIDS)的病原体。
HIV通过血液传播、性传播和母婴传播三种途径在人群中流行和扩散。
1981年美国报道第一例艾滋病病例,至2009年年底,全球有存活的HIV感染者大约3330万例。
我国1985年报告第一例艾滋病传入病例,截止2009年12月,估计有存活的HIV感染者74万人。
HIV进入人体以后,感染和破坏人体的CD4+T淋巴细胞,快速复制繁殖,病毒数量迅速增加。
在感染的初期,病毒载量的水平很高,传染的危险大,急性期以后,病毒载量下降到相对稳定的定点(Set point)水平,在长达5~10年的临床潜伏期内,病毒载量和CD4+T淋巴细胞数量都保持相对稳定,这实际上是一种动态平衡,身体内每天有上亿个病毒被清除,也有相同数量的病毒产生,同样也有大约上亿个CD4+T淋巴细胞被破坏,有相同数量的细胞再生。
到了病程晚期,免疫细胞被耗竭,病毒大量复制,病毒载量升高,免疫功能崩溃,病人因发生各种机会性感染或肿瘤而死亡。
人类免疫缺陷病毒抗体诊断试剂盒是艾滋病防治的有力工具,广泛应用于献血员筛选、临床诊断和流行病学调查。
1985年3月美国FDA批准了第一种人类免疫缺陷病毒抗体诊断试剂盒,这是艾滋病防治进程中重要的里程碑、开启了科学防治艾滋病的时代。
一、人类免疫缺陷病毒(Human Immunodeficiency Virus HIV)HIV在分类上属于逆转录病毒科、慢病毒属、灵长类慢病毒群。
病毒呈球形颗粒,被来自宿主细胞膜的脂质双层膜包裹,基因组结构大致是5’LTR,gag,pro,pol,env,3’LTR,5’端有帽状(cap)结构,3’端有多聚腺苷酸Poly (A) 序列,如果去掉Poly (A),基因组全长9100bp。
人类免疫缺陷病毒(HIV 1+2)抗体诊断试剂盒(酶联免疫法)

人类免疫缺陷病毒(HIV 1+2)抗体诊断试剂盒(酶联免疫法)说明书批准文号:国药准字S2*******本品系用HIV特异性抗原gp160和gp36等包被酶标反应板,用gp160和gp36标记辣根过氧化物酶,应用双抗原夹心法原理(ELISA)检测人血清或血浆中的HIV-1/HIV-2抗体。
【样本要求】人血清和血浆。
【使用方法】1、每次试验设阴性、阳性对照各两孔,分别加入阴性、阳性对照血清100μl,再设一孔空白对照,其余孔加入100μl被测样本,置37℃孵育30分钟。
弃去孔内样本,扣干。
2、用洗涤液注满每孔(至少300μl洗涤液/孔),勿溢出,静置5秒钟后扣干,重复5次。
3、每孔加酶结合物100μl(空白对照孔不加),置37℃孵育30分钟,同上法洗反应板5次。
4、每孔加显色剂A液、B液各50μl,轻轻振荡后,37℃避光静置15分钟。
5、每孔加入终止液50μl终止反应,以空白调零,在酶标仪中读取各孔OD450。
【结果判定】1、 实验设计要求阳性对照平均值大于1.20,阴性对照平均值小于0.10,阳性、阴性对照OD值之差应大于1.20,否则本次实验无效。
2、 若阴性对照读数小于0.05时,按0.05计算。
3、 临界值(Cut off value)=阴性对照平均值+0.10。
4、 测试样本的计算值小于Cut off value则为HIV抗体阴性。
5、 测试样本的计算值等于或大于Cut off value则为HIV抗体阳性。
(注意:初试阳性标本应重新取样进行双孔复试,复试阳性者应按“全国艾滋病检测管理规范”送HIV确认实验室进行确认实验)。
【注意事项】1、 本试剂的使用单位必须是经当地卫生行政部门批准的HIV初筛实验室。
2、 整个HIV检测必须符合《HIV实验管理规范和生物安全守则规定》,严格防止交叉感染。
操作时必须戴手套、穿工作衣,严格健全和执行消毒隔离制度。
3、 HIV抗体测定结果的判定必须以酶标仪读数为准。
《中国药典》2020—乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)国家标准修 订公示稿
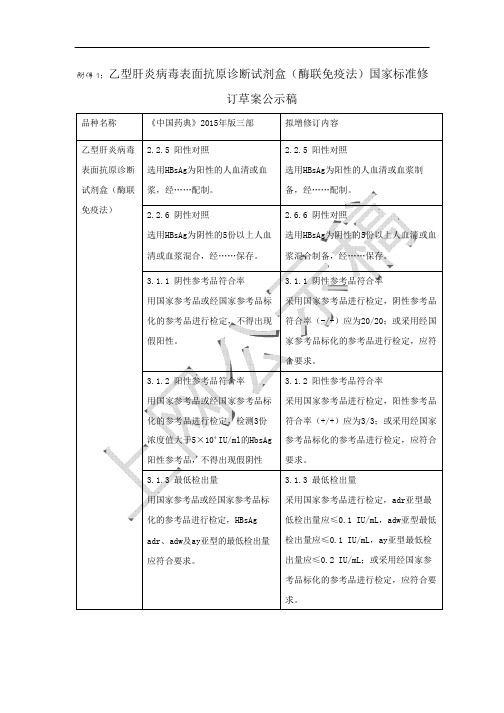
附件 1:乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)国家标准修
订草案公示稿
备,经……配制。
份以上人血2.6.6 阴性对照
选用HBsAg为阴性的5份以上人血清或血浆混合制备,经……保存。
用国家参考品或经国家参考品标化的参考品进行检定,不得出现假阳性。
3.1.1 阴性参考品符合率
采用国家参考品进行检定,阴性参考品符合率(-/-)应为20/20;或采用经国家参考品标化的参考品进行检定,应符合要求。
3.1.2 阳性参考品符合率
用国家参考品或经国家参考品标化的参考品进行检定,检测3份浓度值大于5×104 IU/ml的HbsAg 阳性参考品,不得出现假阴性3.1.2 阳性参考品符合率
采用国家参考品进行检定,阳性参考品符合率(+/+)应为3/3;或采用经国家参考品标化的参考品进行检定,应符合要求。
3.1.3 最低检出量
用国家参考品或经国家参考品标化的参考品进行检定,HBsAg adr、adw及ay亚型的最低检出量应符合要求。
3.1.3
采用国家参考品进行检定,
低检出量应≤0.1 IU/mL,
检出量应≤0.1 IU/mL,
出量应≤0.2 IU/
考品标化的参考品进行检定,应符合要求。
人体免疫缺陷病毒抗体诊断试剂盒酶联免疫法

人类免疫缺陷病毒抗体诊断试剂盒酶联免疫法试剂厂家:检验原理:本产品系用纯化基因工程人类免疫缺陷病“1”型和“2”型(HIV-1/HIV-2)抗原包被的微孔板和酶标记的HIV-1/HIV-2抗原及其它试剂组成,应用双抗原夹心法原理检测人血清或血浆中的HIV-1/HIV-2抗体。
检验方法:1.加样:将预包被板条固定于板架。
每次检验设阴性对照3孔,抗-HIV-1阳性对照2孔,抗-HIV-2阳性对照2孔,分别加入阴性,阳性对照各50ul;设空白对照1孔,不加样品。
其余孔加入待测样品50ul.2.温育:置37±1℃温育60分钟。
3.洗涤:弃去孔内液体,将稀释后的洗液注满各孔,静置30-60秒,弃去孔内洗液。
重复洗6次后拍干。
4.加酶:空白对照孔不加酶标记物,其余孔加入酶标记物50ul.5.温育:置37±1℃温育30分钟。
6.洗涤:弃去孔内液体,将稀释后的洗液注满各孔,静置30-60秒,弃去孔内洗液。
重复洗6次后拍干。
7.显色:每孔加入底物缓冲液50ul,振荡混匀,置37±1℃温育30分钟。
8.终止:每孔加入终止液50ul,轻拍混匀。
9.读值“用酶标仪读值,在单波长450nm(须以空白对照孔校零)或双波长450nm/620nm-700nm下读取各孔A值。
参考值:1.试剂空白标准:试剂空白A值应﹤0.08(空白校零前)2.阴性对照标准:阴性对照A值应≤0.123.阳性对照标准:抗-HIV-1阳性对照A值应≥0.8抗-HIV-2阳性对照A值应≥0.8临界值(C.O.)计算:临界值(C.O.)=阴性对照平均A值+0.15备注:阴性对照平均A值小于0.08按0.08计算,大于0.08按实际值计算。
结果解释:样品A值≥临界值(C.O.)为HIV抗体阳性样品A值≤临界值(C.O.)为HIV抗体阴性备注:初次检验阳性者应重新取样进行双孔复试,如果复试中任何一孔为阳性样品视为HIV抗体阳性,对复试结果为阳性的样本请按《全国艾滋病检测技术规范》处理。
2020版药典新增及变化全汇总

新增制剂:116个,具体清单如下:
二部化学药收载2712种,其中新增117种、修订2387种。
在药品安全性控制方面,要求进一步完善杂质和有关物质的分析方法,推广先进检测技术的应用,重点强化了对有毒有害杂质(特别是基因毒性杂质)的控制,加强了对药品安全性相关控制项目和限度标准的研究制定。
2020年版《中国药典》新增品种319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。
一部中药收载2711种,其中新增117种、修订452种。
在中药安全性控制方面,新版药典要求有效控制外源性污染物的影响,并有效控制内源性有毒成分对中药安全性产生的影响。
在中药有效性控制方面,要求强化标准的专属性和整体性,重点开展了基于中医临床疗效的生物评价和测定方法研究。
65.枸橼酸坦度螺酮
66.枸橼酸坦度螺酮胶囊
67.抗凝血用枸橼酸钠溶液[曾用名:(1)输血用枸橼酸钠注射液(适应症为仅用于单采原料血浆的体外抗凝血)K2)枸橼酸钠抗凝剂]
68.枸橡酸钾颗粒
69.氟尿苷(曾用名:氟脲苷)
70.复方氨基酸(15)双肽(2)注射液
71.美司钠
72.美司钠注射液
73.盐酸乙哌立松
48.更昔洛韦胶囊
49.来曲唑
50.来曲唑片
51.吲哚美辛片
52.佐米曲普坦分散片
53.阿托伐他汀钙
54.阿利沙坦酯
55.阿利沙坦酯片
56.阿那曲唑片
57.苯磺酸左氨氯地平
58.苯磺酸左氨氯地平片
59.拉西地平
60.拉西地平片
61.依巴斯汀
62.依巴斯汀片
63.草酸艾司西酞普兰
64.草酸艾司西酞普兰片
人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)标准操作规程

1、 检验申请单独检验项目申请:人类免疫缺陷病毒抗体{缩写抗HIV (1+2)]测定。
临床医生根据需要提出检验申请。
2、 标本采集与处理2.1标本采集2.1.1常规静脉采血约2ml ,不抗凝,置普通试管中,或采用含分离胶的真空采血管。
也可采集血浆,用肝素、EDTA 或枸橼酸盐抗凝。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml 的全血标本,或少于0.1ml 的血清或血浆。
2.1.5.2对检测结果可能有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在置1-2h 后将标本离心分离出血清或血浆,避免溶血。
离心必须达到3000rpm 15min ,离心后的血清中不能含有颗粒物和微量纤维蛋白。
2.2.2标本保存时间:室温(15-25℃)下可稳定48h ,普通冰箱中(2-8℃)稳定7d ,在-20℃最多可保存4周。
避免反复冻融。
不可使用热灭活的标本。
2.2.3已完成测试的标本保持完整的识别号,置4-8℃冰箱内保存7d 。
2.3标本采集的注意事项采血前使受检者保持平静、松弛,避免剧烈活动。
医院检验科免疫室 体诊断试剂盒(酶联免疫法)标准操作规程 生效日期: 年 月 日版本:第1版第 页,共 页3.方法原理本实验采用HIV 特异性抗原gp160和gp36等包被微孔反应板,用gp36、gp41标记辣根过氧化物酶。
当待测标本中存在HIV 抗体时,该抗体和固化的抗原结合于反应板上,并进一步与酶结合物相结合,在TMB 底物参与反应的情况下,产生显色反应。
人类免疫缺陷病毒抗体诊断试剂盒 说明书

人类免疫缺陷病毒抗体诊断试剂盒(胶体金法)【药品名称】通用名:人类免疫缺陷病毒抗体诊断剂盒(胶体金法) 商品名:无英文名:Human Immunodeficiency Virus antibodies Diagnostic Kit 汉语拼音:REN LEI MIAN YI QUE XIAN BING DU KANG TI ZHEN DUAN SHI JI HE【使用目的】用于检测人血清或者血浆中的HIV(1+2)抗体 【试验原理】本试剂盒应用双抗原夹心胶体金免疫层析法检测血清/血浆中的HIV(1+2)抗体。
将通过基因工程技术制备的针对不同结合位点的两组HIV 重组抗原gp41、gp36分别用于标记和包被。
用纯化的兔抗gp41、gp36抗体作为质控线。
当样本通过层析作用在试纸条上迁移时,样本中如果含有HIV-1或HIV-2抗体,则在检测线区域将生成Ag-Ab-Ag-AU 复合物从而形成一条明显的红色线条。
无论样本中是否含有HIV 抗体,在质控线区域都将生成Ab-Ag-AU 复合物,从而形成另一条明显的红色线条。
【主要组成成分】 1)50人份/盒 1. 检测试纸条50个2. 说明书 1份 2)1人份/盒试剂条,稀释液,采血针,采血管,消毒棉球,说明书各一份。
【适用仪器】不需要任何仪器。
【标本要求】血清/血浆 【试验方法】1、试剂盒如从冰箱中取出后应平衡到室温后再从铝塑袋中取出检测卡,水平放置;2、向圆形加样孔中滴加待检样本;3、样本用量为50微升;4、在30分钟内读取椭圆形观察窗内结果 【对试验结果的解释】【该试验方法的局限性】本品仅适用于HIV (1+2)抗体的体外检测。
【产品性能指标】质控线区域的红色条带必须出现否则实验不成立。
【注意事项】 1、 全部检测工作必须符合生物安全守则规定,严格防止交叉感染。
2、 操作时须戴手套,穿工作衣,严格执行消毒隔离制度。
3、 使用前请检查本产品是否在有效期内,以及铝塑袋的密封状况; 4、 样本使用量多于200微升有可能导致溢出、流速缓慢、高背景、假阳性等结果;5、 如果样本过于粘稠有可能导致质控线暗淡甚至缺失;6、试纸条如从寒冷环境(冰箱)中取出后应平衡到室温后再使用;7、请使用新鲜的检测样本; 8、无论检测结果如何必须按照HIV 阳性污染物处理检测卡。
人类免疫缺陷病毒抗体检测试剂盒

人类免疫缺陷病毒抗体检测试剂盒(胶体金法)
生产厂家:美艾利尔(上海)医疗器械销售有限公司
储存条件:1℃-30℃保存
操作步骤
1.从原包装铝箔袋中取出检测板,放于水平、干燥的平面上
2.滴加10μl待检血清/血浆标本或20μl全血标本于样品孔(S)内
3.随后滴加4滴(约120μl)试验用稀释液垂直加到样品孔(S)内
4.当检测开始时,检测板中央可看到紫色液体流过结果窗口,
5.在10—20分钟内判读结果,在加入稀释液后,10分钟后读取结果不要超过
20分钟
结果判读
1.阳性结果:(1)出现质控线C和测试线1,表示HIV—1阳性结果
(2)出现质控线C和测试线2,表示HIV—2阳性结果
(3)出现质控线C、测试线1和测试线2,表示HIV—1和HIV —2阳性结果
2.阴性结果:仅质控线(C)出现一条紫色条带
3.无效结果:结果窗口没有质控线C
注意事项
1.本试剂仅用于体外诊断
2.在处理样本时不能吸烟、吃食物
3.在处理样本时应戴防护手套,事后充分清洗双手
4.避免标本出现喷洒或形成气溶胶
5.使用合适的消毒剂彻底清洁溢出物
6.使用后的试剂和样本等废弃物应按国家相关规定妥善处理
7.请不要混合和交换不同的待检样本
8.抗凝剂如:肝素、EDTA、柠檬酸钠不会影响实验结果
9.使用溶血标本、含类风湿因子的样本和高血脂、黄疸样本可能导致减弱实验
结果的显示。
《中国药典》2020—免疫化学法国家药品标准公示稿

免疫化学法免疫化学法是利用抗原抗体在适宜条件下发生特异性、可逆性和非共价结合形成抗原-抗体复合物的原理,采用不同技术对抗原或抗体待测物进行定性、定量或定位检测的一种分析方法。
该法可广泛用于生物原料药或制剂的鉴别试验、纯度与杂质分析、含量或生物活性/效价测定及稳定性等质量属性的监测。
根据对抗原或抗体是否进行标记,免疫化学法可分为标记免疫化学法和非标记免疫化学法。
标记免疫化学法可采用酶、荧光基团、发光基团或放射性核素等作为标记物,常见方法有酶联免疫吸附法、免疫印迹法、免疫荧光分析法、发光免疫分析法、放射免疫分析法等。
非标记免疫化学法常见方法有免疫沉淀法、免疫电泳法、凝集反应等。
各类方法的优缺点和典型用途见附表。
在免疫化学法的方法开发阶段,可使用不同的实验设计(DOE)考察多种因素和各因素之间的相互作用对实验结果的影响,还可设定适宜的系统适用性要求以判定实验结果的有效性。
免疫化学法开发时的主要问题为交叉反应,应通过严格筛选试剂来控制交叉反应,实验中使用的试剂一般有关键试剂和非关键试剂:关键试剂是特定免疫化学法中所特有和专用的,其成分或稳定性有细小变化即会影响实验结果;非关键试剂是指成分上有一定改变也不影响免疫化学法检测性能的试剂。
免疫化学法的建立既可采用自制试剂,也可采用商品化的试剂盒。
对于采用自制试剂的,抗体的选择至关重要,其决定了方法的特异性和灵敏度,应根据实验的预期用途来选择合适的抗体;另外还需关注自建方法的检测范围、定量区间、检测稀释液的选择、试剂不同批次间的差异性和标准化的操作等。
对于采用商品化试剂盒的,需考察供试品的适用性,如用于供试品中低浓度杂质残留等检测时,尤其要关注高浓度制品本身的组分是否会对残留杂质的检测产生干扰;同时还需考察试剂盒推荐的数据拟合模型的适用性,并关注检测稀释液的适宜性和试剂盒不同批次间的一致性。
对新建立的免疫化学法进行验证时,应系统地拟定实验方案、分析步骤和可接受标准,还需对系统适用性要求进行进一步确认。
2020版《中华人民共和国药典》螨变应原制品总论解读

•公众号文章精选•2020版《中华人民共和国药典》螨变应原制品总论解读张影作者单位:102629北京,中国食品药品检定研究院结核病疫苗与过敏原产品室E-mail:zhangyingblue@为了完善对我国变态反应原制品的质量控制,2020版《中华人民共和国药典》新增了“螨变应原制品总论”。
该总论是我国针对变应原类制品建立的首个通用技术要求。
为方便大家更好地理解该总论,本文对其要点进行提炼和解读。
1明确了螨变应原制品的概念及适用范围螨变应原制品系以灭活的特定螨虫纯种培养物(螨虫虫体、虫体碎片、螨虫排泄物、幼虫、虫卵等)为原材料制备而成的含有螨变应原活性物质的制品,用于尘螨变应原引起的变态反应性疾病的体内诊断和脱敏治疗。
因为螨变应原制品是目前中国唯一批准上市的变应原类生物制品,该总论仅限于螨变应原制品,适用范围是人用螨变应原体内诊断制品和治疗制品。
2规定了螨变应原制品的生产制造基本要求(1)生产工艺应经过验证,并依据制品关键质量属性,确定关键工艺步骤、参数和范围。
(2)应按照经批准的生产工艺进行生产,以保证产品的活性和稳定性。
(3)标准物质是螨变应原制品质量控制的关键要素之一,企业应针对不同螨种,建立适用于不同检定用途的同质参考品。
3重点突出了螨虫虫种管理的要求(1)生产用螨虫(屋尘螨、粉尘螨等)背景清晰,来源明确,具备稳定的生物学和遗传学特性。
螨虫培养收获物是制造螨变应原制品原料,因此应对螨虫虫种进行质控。
(2)应建立虫种管理系统。
由于螨虫虫种不能被冷冻保存,严格的种子库概念不适用于螨虫。
因此总论规定参照“生物制品生产检定用菌毒种管理规程”的相关要求建立螨虫虫种管理系统。
生产企业应规定虫种的制备方法,包括培养条件和保存方法,监测和控制培养温度、湿度、与虫种密度等关键参数。
通过这些手段保证虫种质量、批间一致性和可追溯性。
除此之外,还需采取适当的手段避免外来杂螨污染,以及意外事件对螨虫虫种的损害。
4描述了生产工艺流程及关键环节质控要求螨变应原制品的生产制造从螨虫培养开始,采用经批准的生产用培养基培养特定纯种螨虫。
《中国药典》2020年版(三部)增修订概述

《中国药典》2020年版(三部)增修订概述《中华人民共和国药典》(以下简称《中国药典》)2020年版三部的编制工作进一步强化了以科学为基础,以建立“最严谨的标准”为指导,结合生物制品特点,围绕《中国药典》2020年版编制大纲,以临床需求为导向,提高与淘汰相结合,扩大了品种收载范围,强化了质量标准的科学性和先进性,完善了国家药品标准体系,进一步加强了生物制品全过程质量控制的相关要求,推动了现代先进检测技术的应用。
本部药典收载的内容包括凡例、生物制品通用技术要求、总论、各论、通则(检测方法)。
各部分内容增修订情况见表1。
1 增修订情况1.1 生物制品通用性技术要求1.1.1 新增生物制品通用技术要求本部药典新增“生物制品通用名称命名原则”,“生物制品分包装及贮运管理”和“生物制品病毒安全性控制”通用技术要求。
“生物制品病毒安全性控制”是在风险评估基础上结合生物制品各类产品特点,对病毒安全性的综合技术要求,同时兼顾了生产工艺和上市后监测的需求,从生物制品生产全过程质量控制保证生物制品全生命周期的病毒安全性。
此外,为规范生物制品通用名称的使用,保证临床使用和流通过程中对生物制品的准确识别,以及对上市药品全生命周期追溯和药物警戒监管,根据我国生物制品实际情况,参照国际通用原则制定了“生物制品通用名称命名原则”。
表1 2020年版《中国药典》三部收载情况汇总Tab.1 Summary of the Chinese Pharmacopoeia 2020(Volume Ⅲ)注:**2020年版的治疗类制品中有4个重组细胞因子品种系由2015年版9个不同表达载体的品种合并而成;另有从药典二部转来4个胰岛素类品种,未作为新增品种统计。
Note:**Four recombinant cytokine varieties of the ChP 2020 are merged from 9 different expression vector varieties of the ChP 2015 in addition,4 insulin varieties transferred from the ChP Vol Ⅱare not regarded as a new monograph.1.1.2 修订生物制品通用技术要求情况本部药典收载的“生物制品分包装及贮运管理”是对已收载多年的生物制品分批、分装和冻干、包装以及贮藏和运输规程进行整合、统一和增修订而形成,保持了与现行药品法规变化发展的一致性,同时增强通用性技术要求的系统性、规范性以及与各论的关联。
《中国药典》2020版—人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)国家药品标准公示稿

附件 3:人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)国家标
准修订草案公示稿
备,或经相应抗原……保存。
份以上人血清或血浆混合,经……保2.2.6 阴性对照
选用HIV抗体检测为阴性的5份以上人血清或血浆混合制备,经……保存。
用国家参考品或经国家参考品标化的参考品进行检定,应符合要求。
3.1.1 阴性参考品符合率
采用国家参考品进行检定,阴性参考品符合率(-/-)应≥18/20;或采用经国家参考品标化的参考品进行检定,应符合要求。
3.1.2 阳性参考品符合率
用国家参考品或经国家参考品标化的参考品进行检定,应符合要求。
3.1.2 阳性参考品符合率
采用国家参考品进行检定,不得出现假阴性,HIV-1抗体阳性参考品符合率(+/+)应为18/18,HIV-2抗体阳性参
3.1.3 最低检出限
用国家参考品或经国家参考品标化的参考品进行检定,应符合要求。
人类免疫缺陷病毒抗体检测作业指导书

人类免疫缺陷病毒抗体检测作业指导书
1. 原理
采用双抗原夹心两步法检测人血清或血浆样本中的(HIV1/2)型抗体。
采用多种HIV-1和HIV-2的特异性抗原制作预包被板及酶结合物。
当待检样本中存在HIV抗体时,在反应过程中形成“固相HIV抗原-HIV 抗体-酶标记HIV抗原”的免疫复合物,加入底物后形成显色反应。
2. 标本采集
2.1 采集前病人准备:受检者应空腹
2.2 标本种类:血清或血浆
2.3 标本要求:采集病人静脉血3ml(可用EDTA抗凝),室温放置不超过4小时,分离血清备用。
3. 标本储存:2-8℃保存不应超过1周,-20℃不应超。
《中国药典》2020—丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)国家药品标准公示稿

附件 2:丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)国家标准修订
草案公示稿
及其他试剂制成,应用间接酶联免疫法原理检测人
抗体。
或生物素化HCV抗原及其他试剂制成,应用间接酶联免疫法或双抗原
夹心法原理检测人血清或血浆样品
中的HCV抗体。
2.2.3 酶标记抗体或抗原的制备
抗体纯化及检定方法同 2.2.2 项,采用常规过碘酸钠-乙二醇或其他适宜方法进行辣根过氧化物酶或其他酶标记,生物素标记的 HCV
可采用 N-羟基丁二酰亚胺酯(BNHS
活化生物素法或其他适宜的方法制
备。
酶标记抗体应符合 3.1.1〜3.1.4 项和 3.1.7 项要求,加入适当的保护剂后于低温下保存。
2.2.2
乙二醇
或其他适宜方法进行辣根过氧化
物酶或其他酶标记,酶标记抗体
应符合3.1.1〜3.1.4项和3.1.7
项要求,加入适当的保护剂后于
低温下保存。
2.2.6 阳性对照 2.2.6 阳性对照
选用HCV抗体检测为阳性的5份以选用HCV抗体检测为阳性的5份以上上人血清或血浆混合,经……保
存。
2.2.7 阴性对照
选用HCV抗体检测为阴性的5份以
上人血清或血浆混合,经……保
存。
3.1.1 阴性参考品符合率
用国家参考品或经国家参考品标
化的参考品进行检定,应符合要。
人类免疫缺陷病毒抗体诊断试剂盒酶联免疫法

人类免疫缺陷病毒抗体诊断试剂盒酶联免疫法试剂厂家:英科新创(厦门)科技有限公司本试剂盒采用抗原夹心两步法检测人血清或血浆中的HIV1/HIV2型抗体。
在微孔板预包被基因重组HIV(1+2)抗原,当加入的待检测样本中存在HIV抗体时,将反应形成抗原抗体复合物,再与加入的酶标记基因工程HIV(1+2)抗原反应,最后形成“固相HIV抗原-HIV抗体-酶标记HIV 抗原”的免疫,复合物,加入底物后形成显色反应。
标本要求;1采用血清或血浆样本,血浆样本可以使用常规用量的肝素,枸橼酸钠或者EDTA抗凝。
2样本不能用叠氮钠防腐,以免抑制酶的活性。
3样本保存在2-8C。
如需长期保存,需置-15-20C冻存,并避免样本反复冻融。
4高血脂,高胆红素及溶血样本可能会影响试验结果的准确性,建议不使用。
检验方法:1.平衡:将试剂合各组分从盒中取出,平衡至室温(18-25℃),微孔板开封后,余者即时以自封袋封存。
2配液:浓缩洗涤液配前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
3.编号:取所需数量微孔条固定于支架,按序编号。
4.加样:按顺序分别在相应孔中加入50ul待测样本及阴.阳性对照。
5.温育:覆上封板膜,置37℃温育60分钟。
6.洗涤:用洗涤液充分洗涤5次,洗涤后扣干(每次应保持30-60秒的浸泡时间)。
7.加酶:分别在每孔中加酶标抗原30分钟。
8.温育:覆上封板膜,置37℃温育30分钟。
9.洗涤:用洗涤液充分洗涤5次,洗涤后扣干(每次应保持30-60秒的浸泡时间)。
10.显色:每孔加底物A,B和50ul,轻拍混匀,37℃暗置30分钟。
11.终止:每孔加入终止液50ul,混匀。
12测定:用酶标仪单波长450nm或双波长450/630nm测定各孔OD值(用单波长测定时,需用空白对照孔调零),并记录结果。
结果判定;1.样本OD值S/CO≧1者为HIV抗体反应初筛阳性样本OD值<1者,为HIV抗体反应阴性。
2020年版《中国药典》目录三部

附件32020年版《中国药典》目录三部目录生物制品通则目次1生物制品通用名称命名原则2生物制品生产用原材料及辅料质量控制3生物制品生产检定用菌毒种管理及质量控制4生物制品生产检定用动物细胞基质制备及质量控制5血液制品生产用人血浆6生物制品国家标准物质制备和标定7生物制品病毒安全性控制8生物制品分包装及贮运管理总论目次9人用疫苗总论10人用重组DNA蛋白制品总论11人用重组单克隆抗体制品总论12人用聚乙二醇化重组蛋白及多肽制品总论13人用基因治疗制品总论14螨变应原制品总论15人用马免疫血清制品总论16微生态活菌制品总论各论目次Ⅰ预防类17伤寒疫苗18伤寒甲型副伤寒联合疫苗19伤寒甲型乙型副伤寒联合疫苗20伤寒Vi多糖疫苗21重组B亚单位/菌体霍乱疫苗(肠溶胶囊)22A群脑膜炎球菌多糖疫苗23A群C群脑膜炎球菌多糖疫苗24A群C群脑膜炎球菌多糖结合疫苗25ACYW135群脑膜炎球菌多糖疫苗2623价肺炎球菌多糖疫苗27b型流感嗜血杆菌结合疫苗28吸附白喉疫苗29吸附白喉疫苗(成人及青少年用)30吸附破伤风疫苗31吸附白喉破伤风联合疫苗32吸附白喉破伤风联合疫苗(成人及青少年用)33吸附百日咳白喉联合疫苗34吸附百白破联合疫苗35吸附无细胞百白破联合疫苗36无细胞百白破b型流感嗜血杆菌联合疫苗37皮上划痕用鼠疫活疫苗38皮上划痕人用炭疽活疫苗39皮上划痕人用布氏菌活疫苗40皮内注射用卡介苗41钩端螺旋体疫苗42乙型脑炎减毒活疫苗43冻干乙型脑炎灭活疫苗(Vero细胞)44森林脑炎灭活疫苗45双价肾综合征出血热灭活疫苗(Vero细胞)46双价肾综合征出血热灭活疫苗(地鼠肾细胞)47双价肾综合征出血热灭活疫苗(沙鼠肾细胞)48黄热减毒活疫苗49冻干人用狂犬病疫苗(Vero细胞)50冻干人用狂犬病疫苗(人二倍体细胞)51冻干甲型肝炎减毒活疫苗52甲型肝炎灭活疫苗(人二倍体细胞)53重组乙型肝炎疫苗(酿酒酵母)54重组乙型肝炎疫苗(汉逊酵母)55重组乙型肝炎疫苗(CHO细胞)56甲型乙型肝炎联合疫苗57麻疹减毒活疫苗58腮腺炎减毒活疫苗59风疹减毒活疫苗(人二倍体细胞)60水痘减毒活疫苗61麻疹腮腺炎联合减毒活疫苗62麻疹风疹联合减毒活疫苗63麻腮风联合减毒活疫苗64流感全病毒灭活疫苗65流感病毒裂解疫苗66口服脊髓灰质炎减毒活疫苗(猴肾细胞)67脊髓灰质炎减毒活疫苗糖丸(人二倍体细胞)68脊髓灰质炎减毒活疫苗糖丸(猴肾细胞)69Sabin株脊髓灰质炎灭活疫苗(Vero细胞)70口服Ⅰ型Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)Ⅱ治疗类71白喉抗毒素72冻干白喉抗毒素73破伤风抗毒素74冻干破伤风抗毒素75马破伤风免疫球蛋白F(ab')2 76多价气性坏疽抗毒素77冻干多价气性坏疽抗毒素78肉毒抗毒素79冻干肉毒抗毒素80抗蝮蛇毒血清81冻干抗蝮蛇毒血清82抗五步蛇毒血清83冻干抗五步蛇毒血清84抗银环蛇毒血清85冻干抗银环蛇毒血清86抗眼镜蛇毒血清87冻干抗眼镜蛇毒血清88抗炭疽血清89抗狂犬病血清90人血白蛋白91冻干人血白蛋白92人免疫球蛋白93冻干人免疫球蛋白94乙型肝炎人免疫球蛋白95冻干乙型肝炎人免疫球蛋白96静注乙型肝炎人免疫球蛋白(pH4)97冻干静注乙型肝炎人免疫球蛋白(pH4)98狂犬病人免疫球蛋白99冻干狂犬病人免疫球蛋白100破伤风人免疫球蛋白101冻干破伤风人免疫球蛋白102静注人免疫球蛋白(pH4)103冻干静注人免疫球蛋白(pH4)104人凝血因子Ⅷ105人纤维蛋白原106人纤维蛋白粘合剂107人凝血酶108人凝血酶原复合物109抗人T细胞猪免疫球蛋白110抗人T细胞兔免疫球蛋白111注射用人促红素112人促红素注射液113注射用人干扰素α1b114人干扰素α1b注射液115人干扰素α1b滴眼液116注射用人干扰素α2a117人干扰素α2a注射液118人干扰素α2a栓119注射用人干扰素α2b120人干扰素α2b注射液121人干扰素α2b滴眼液122人干扰素α2b栓123人干扰素α2b乳膏124人干扰素α2b凝胶125人干扰素α2b喷雾剂126人干扰素α2b软膏127人干扰素α2b阴道泡腾片128注射用人干扰素γ129注射用人白介素-2130人白介素-2注射液131注射用人白介素-2(Ⅰ)132注射用人白介素-11133人粒细胞刺激因子注射液134注射用人粒细胞巨噬细胞刺激因子135外用人粒细胞巨噬细胞刺激因子凝胶136牛碱性成纤维细胞生长因子外用溶液137外用牛碱性成纤维细胞生长因子138牛碱性成纤维细胞生长因子凝胶139牛碱性成纤维细胞生长因子滴眼液140外用人表皮生长因子141人表皮生长因子外用溶液(Ⅰ)142人表皮生长因子凝胶143人表皮生长因子滴眼液144尼妥珠单抗注射液145康柏西普眼用注射液146人胰岛素147人胰岛素注射液148精蛋白人胰岛素注射液149精蛋白人胰岛素混合注射液(30R)150精蛋白人胰岛素混合注射液(50R)151甘精胰岛素152甘精胰岛素注射液153赖脯胰岛素154赖脯胰岛素注射液155注射用人生长激素156注射用鼠神经生长因子157注射用A型肉毒毒素158治疗用卡介苗Ⅲ体内诊断类159结核菌素纯蛋白衍生物160卡介菌纯蛋白衍生物161布氏菌纯蛋白衍生物162锡克试验毒素Ⅳ体外诊断类163乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)164丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)165人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)166人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)167乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒Ⅰ型核酸检测试剂盒168梅毒螺旋体抗体诊断试剂盒(酶联免疫法)169抗A抗B血型定型试剂(单克隆抗体)通则和指导原则制剂通则1片剂2注射剂3胶囊剂4颗粒剂5眼用制剂6鼻用制剂7栓剂8软膏剂乳膏剂9喷雾剂10凝胶剂11散剂12涂剂分光光度法13紫外-可见分光光度法14荧光分光光度法15原子吸收分光光度法16火焰光度法色谱法17纸色谱法18高效液相色谱法19离子色谱法20分子排阻色谱法21气相色谱法电泳法22电泳法23毛细管电泳法物理检查法24pH值测定法25渗透压摩尔浓度测定法26溶液颜色检查法27澄清度检查法28不溶性微粒检查法29可见异物检查法30崩解时限检查法31融变时限检查法32片剂脆碎度检查法33最低装量检查法34粒度和粒度分布测定法含量测定法35氮测定法36蛋白质含量测定法37干燥失重测定法38固体总量测定法39唾液酸测定法40磷测定法41硫酸铵测定法42亚硫酸氢钠测定法43氢氧化铝(或磷酸铝)测定法44氯化钠测定法45枸橼酸离子测定法46钾离子测定法47钠离子测定法48辛酸钠测定法49乙酰色氨酸测定法50苯酚测定法51间甲酚测定法52硫柳汞测定法53对羟基苯甲酸甲酯、对羟基苯甲酸丙酯含量测定法54O-乙酰基测定法55已二酰肼含量测定法56高分子结合物含量测定法57人血液制品中糖及糖醇测定法58人血白蛋白多聚体测定法59人免疫球蛋白类制品lgG单体加二聚体测定法60人免疫球蛋白中甘氨酸含量测定法61人粒细胞刺激因子蛋白质含量测定法62组胺人免疫球蛋白中游离磷酸组胺测定法63lgG含量测定法64单抗分子大小变异体测定法65抗毒素/抗血清制品分子大小分布测定法66单抗电荷变异体测定法67单抗N糖谱测定法化学残留物测定法68氰化物检查法69水分测定法70炽灼残渣检查法71残留溶剂测定法72乙醇残留量测定法73聚乙二醇残留量测定法74聚山梨酯80残留量测定法75戊二醛残留量测定法76磷酸三丁酯残留量测定法77碳二亚胺残留量测定法78游离甲醛测定法79人血白蛋白铝残留量测定法80羟胺残留量测定法微生物检查法81无菌检查法82非无菌产品微生物限度检查:微生物计数法83非无菌产品微生物限度检查:控制菌检查法84非无菌药品微生物限度标准85抑菌效力检查法86异常毒性检查法87热原检查法88细菌内毒素检查法89支原体检查法90外源病毒因子检查法91鼠源性病毒检查法92SV40核酸序列检查法93猴体神经毒力试验94血液制品生产用人血浆病毒核酸检测技术要求95黄热减毒活疫苗猴体试验96禽源性病毒荧光定量PCR(Q-PCR)检查法生物测定法97免疫印迹法98免疫斑点法99免疫双扩散法100免疫电泳法101肽图检查法102质粒丢失率检查法103外源性DNA残留量测定法104抗生素残留量检查法105激肽释放酶原激活剂测定法106抗补体活性测定法107牛血清白蛋白残留量测定法108大肠埃希菌菌体蛋白质残留量检测法109假单胞菌菌体蛋白质残留量测定法110酵母工程菌菌体蛋白质残留量测定法111类A血型物质测定法112鼠lgG残留量测定法113无细胞百日咳疫苗鉴别试验114抗毒素、抗血清制品鉴别试验115A群脑膜炎球菌多糖分子大小测定法116伤寒Vi多糖分子大小测定法117b型流感嗜血杆菌结合疫苗多糖含量测定法118人凝血酶活性检查法119活化的凝血因子活性检查法120肝素含量测定法121抗A、抗B血凝素测定法122人红细胞抗体测定法123人血小板抗体测定法124人免疫球蛋白类制品lgA残留量测定法125免疫化学法生物活性/效价测定法126胰岛素生物测定法127生长激素生物测定法128重组乙型肝炎疫苗(酵母)体外相对效力检查法129甲型肝炎灭活疫苗体外相对效力检查法130人用狂犬病疫苗效价测定法131吸附破伤风疫苗效价测定法132吸附白喉疫苗效价测定法133类毒素絮状单位测定法134白喉抗毒素效价测定法135破伤风抗毒素效价测定法136气性坏疽抗毒素效价测定法137肉素抗毒素效价测定法138抗蛇毒血清效价测定法139狂犬病免疫球蛋白效价测定法140人免疫球蛋白中白喉抗体效价测定法141人免疫球蛋白Fc段生物学活性测定法142抗人T细胞免疫球蛋白效价测定法(E玫瑰花环形成抑制试验)143抗人T细胞免疫球蛋白效价测定法(淋巴细胞毒试验)144人凝血因子Ⅱ效价测定法145人凝血因子Ⅶ效价测定法146人凝血因子Ⅸ效价测定法147人凝血因子Ⅹ效价测定法148人凝血因子Ⅷ效价测定法149人促红素体内生物学活性测定法150干扰素生物学活性测定法151人白介素-2生物学活性测定法152人粒细胞刺激因子生物学活性测定法153人粒细胞巨噬细胞刺激因子生物学活性测定法154牛碱性成纤维细胞生长因子生物学活性测定法155人表皮生长因子生物学活性测定法156鼠神经生长因子生物学活性测定法157尼妥珠单抗生物学活性测定法158人白介素-11生物学活性测定法159A型肉毒毒素效价测定法160Sabin株脊髓灰质炎灭活疫苗效力试验161康柏西普生物学活性测定法特定生物原材料/动物及辅料162生物制品生产及检定用实验动物质量控制163重组胰蛋白酶164新生牛血清165细菌生化反应培养基166氢氧化铝佐剂试剂试液标准品167试药168试液169试纸170缓冲液171指示剂与指示液172滴定液173生物制品国家标准物质目录其他174灭菌法175生物检定统计法指导原则176分析方法验证指导原则177药品微生物检验替代方法验证指导原则178药品微生物实验室质量管理指导原则179生物制品生物活性/效价测定方法验证指导原则180生物制品稳定性实验指导原则生物制品术语附表181原子量表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
剂分装后,对留样进行无菌检
防腐剂分装后,对留样进行微生物
查,采用直接接种法,应符合规
限度检查,需氧菌总数应不高于
定。
102cfu/ml, 霉菌和酵母菌总数应不
高于10 cfu/ml。
1
附件 2:人类免疫缺陷病毒抗原抗体诊断试盒(酶联免疫法)
品种名称
原公示稿内容(2019年5月)
拟修订内容
人类免疫缺陷病
3.1.3 无菌检查
3.1.3 微生物限度检查
毒抗原抗体诊断
依法检查(通则1101)含有蛋白
依法检查(通则1105 通则1106)含
试剂盒(酶联免
成分的液体组分,半成品加防腐
有蛋白成分的液体组分,半成品加
