医疗器械经营企业飞行检查情况汇总表
核查中心 2023年第三批医疗器械飞行检查情况汇总

2023
序号被检查
单位
品种省份检查发现问题备注
1 湖南海普
明科技有
限公司
软性亲
水接触
镜
湖南
检查发现一般不符合项12项。
一、机构和人员方面
1.进入十万级洁净车间的人员更衣流程未明确是否需要戴手套,实际对
进入车间的检查组人员要求不一致,从女更进入人员要求戴手套,从男更进
入人员未要求。
二、设备方面
2.提纯车间旋转蒸发器清洗记录中未记录设备编号;PP杯包装机的硅胶
管未规定更换周期,未建立更换记录;萃取车间的萃取柜舱门不严密,工作
时有蒸汽漏出。
3.旋转蒸发器的真空表未计量检定,检验室使用的滴定管没有检定标
识。
提纯车间的电子计重秤的操作规程中未规定使用前校验。
三、文件管理方面
不符合
项目整
改已完
成。
医疗器械飞行检查情况汇总表
七、不合格品控制方面
10.企业未制定报废产品处置制度。
限期
整改
4
滁州国康医疗仪器有限公司
高电位治疗仪
安徽
检查发现一般缺陷12项。
一、厂房与设施方面
1.辅料仓库中电解电容货位卡记录的结存数量为31个,现场清点实际存放的电解电容为62个,记录与实际不符。
7.2019年3月15日《物料采购申请表》(编号QWGSMKJ-4/SOR-CG-007)中,关键物料A和B未明确验收准则、规则等内容。
五、生产管理方面
8.现场运行中的立式注塑机,正在进行滤网注塑成型,注塑机操作屏幕显示实际注塑时间为4秒,企业操作人员记录为5秒,记录与实际运行时间不符。
六、销售和售后服务方面
六、质量控制方面
10.医用泄漏电流测试仪(规格型号:MS2621G-1)检定证书显示该设备2017年检定有效期为2017年11月21日至2018年11月20日,2018年检定有效期为2018年12月4日至2019年12月3日,查该设备使用记录,曾于2018年11月22日被使用。
附件
医疗器械飞行检查情况汇总表
序号
被检查
单位
品种
省份
检查发现问题
检查结果
备注
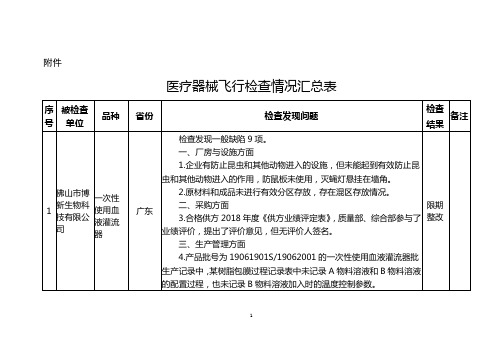
1
佛山市博新生物科技有限公司
一次性使用血液灌流器
广东
检查发现一般缺陷9项。
一、厂房与设施方面
1.企业有防止昆虫和其他动物进入的设施,但未能起到有效防止昆虫和其他动物进入的作用,防鼠板未使用,灭蝇灯悬挂在墙角。
2.原材料和成品未进行有效分区存放,存在混区存放情况。
2017年(下半年)四川省医疗器械飞行检查结果统计表

检查中发现该院购进验收记录中个别品种记录事项不全,记录中缺少产品注册证号,规格等。
第八条
该院对冷链产品的验收中存在缺陷,验收记录中未记录冷链产品的起运温度、在途温度和到达温度。
成都顺雅医疗用品有限公司
《医疗器械生产质量管理规范》
第六条
未查见管理评审资料和记录,参会人员未签到。
第十一条
抽查5人健康体检证明已于2017年3月21日到期后,至检查之日未进行健康体检。
成都华信高科医疗器械有限责任公司
《医疗器械生产质量管理规范》及相关附录
第八条
查看了质量部部长冉定君的培训记录,未见YY/T0316-2016、YY/T 0287-2017及国家新颁布实施的相关法律法规的学习记录。
无菌附录(2.1.4)
在洁净区女二更发现已使用和未使用洁净服混放,无法有效区分。
无菌附录(2.2.16)
第三十二条
发热丝绕圈工艺更改,作业指导书未体现变更后的操作示例。
第六十二条
销售记录全,销售出库单上发货人,审核人未签字。
第六十六条
对顾客反馈的信息收集不全,统计表数据与收集记录数据相差明显,如9月份收集顾客反馈信息记录60例,而统计表数据为269例。
第六十九条
2015年湖北省、辽宁省2批次省级抽验不合格,企业收集到有不合格品报告,但未及时按体系文件要求进行整改。
第十七条
原料库未设置不合格品区(证据见照片),原材料仓库内设置的待检区,实为保管员办公区,摆放有办公桌、电脑、文件等物品。
第四十七条
未对义齿中间品超声清洁做验证。
第五十七条
该企业检验使用的卡尺无检定标识。
第六十九条
销售到医疗机构发现产品不合格时,企业未采取召回措施。
医疗器械经营企业飞行检查现场记录表

医疗器械供货方的随货同行单信息不全。现场抽查医疗器械“一次 性末梢采血针”,未能提供有该医疗器械信息的配送单。
※5.38.1 药店未对到货医疗器械(主要是连锁门店间调剂医疗器械)进行逐
批验收。现场抽查医疗器械“一次性末梢采血针”,未对该产品进行
5.38.2
验收直接上柜销售。 未如实查验医疗器械的检验报告及其他证明文件。现场抽查医疗器
主要缺陷和问题及其判断依据
本表中所列出的缺陷和问题,只是本次飞行检查的发现,不代表企业缺陷
和问题的全部。建立与本企业生产/经营产品特点相适应的质量管理体系并保持
其有效运行,是医疗器械生产、经营企业的法定责任。
依据条款
缺陷和问题描述
规范现场 指导原则
检查发现以下一般缺陷 2 项,严重缺陷 1 项:
5.36.2
——
检查目的和范围 飞行检查
检查依据
《药品医疗器械飞行检查办法》 、 《医疗器械经营质量管理规范》
姓名
单
位
பைடு நூலகம்
观察员
龚泽洪
江川区市场监督管理局
企业主要现场 配合人员
姓 名 职务 刘雪娇 店长
余艳华 企业质量
负责人
职称 无
执业药师
所在部门
云南鸿翔一心堂药业(集团) 股份有限公司江川湖滨路连 锁店 云南鸿翔一心堂药业(集团) 股份有限公司江川湖滨路连 锁店
械“一次性末梢采血针”,现场无配送单、无检验报告、无注册证。
检查组成员 签字 企业
负责人或其 授权人签字
组员 组长
观察员
企业负责人签字(盖章) 年月日
医疗器械经营企业飞行检查现场记录表
企业名称 经营地址 仓库地址 检查日期 经营方式
医疗器械飞行检查情况汇总表【模板】

七、不合格品控制方面
10.企业未制定报废产品处置制度。
限期
整改
4
滁州国康医疗仪器有限公司
高电位治疗仪
安徽
检查发现一般缺陷12项。
一、厂房与设施方面
1.辅料仓库中电解电容货位卡记录的结存数量为31个,现场清点实际存放的电解电容为62个,记录与实际不符。
六、质量控制方面
10.医用泄漏电流测试仪(规格型号:MS2621G-1)检定证书显示该设备2017年检定有效期为2017年11月21日至2018年11月20日,2018年检定有效期为2018年12月4日至2019年12月3日,查该设备使用记录,曾于2018年11月22日被使用。
二、文件管理方面
2.《文件控制程序》(编号GK/CX-001-2016)未对部分体系文件的保存期限进行规定。
3.企业未能提供成品库温湿度记录。
三、设计开发方面
4.《设计和开发控制程序》(编号GK/CX-008-2016)中无风险管理要求内容。
5.针对2018年度国抽不合格情况,企业对产品进行了设计更改,但未提供设计更改记录。
9.企业未按照公司制定的《不良事件控制程序》要求对2018年全年度的医疗器械不良事件监测情况进行数据分析。
限期
整改
2
**市西耐德医疗器械有限公司
牙科光固化机
广东
检查发现一般缺陷12项。
一、机构与人员方面
1.个别接触产品的生产工人无健康档案。
二、厂房与设施方面
2.公司物品贮存记录中的锂电池记录数量与库房中实际贮存数量不一致。
三、文件管理方面
核查中心2020年第一批医疗器械飞行检查情况汇总
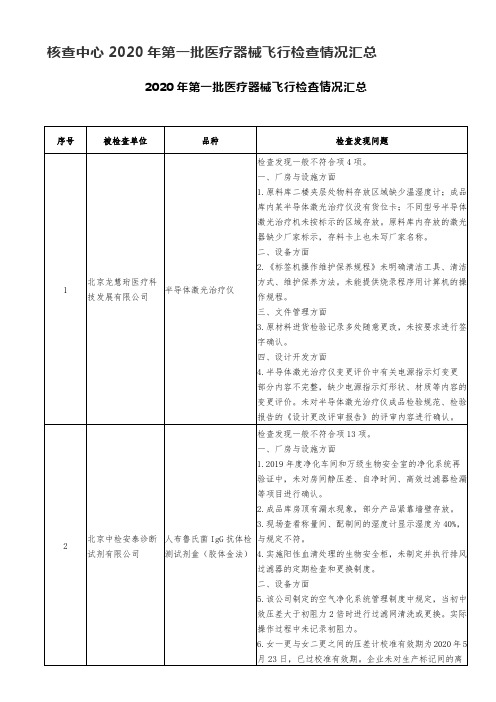
2.企业成品仓库内的空调架上堆放有“警示标签”等辅料,与货位不符。
3.十万级净化车间内洗衣房内洗衣机下水槽及地漏敞开,有潜在污染的风险。
三、设备方面
4.验证主计划中未对连续点膜机的再验证周期做出规定。
5.企业对灭菌锅的压力表进行了校准,未见针对温度的校准证书。
四、文件管理方面
6.《人类免疫缺陷病毒(HIV1/2)抗体检测试剂盒(乳胶法)(全血/血清/血浆)生产工艺规程》从A00版改为B00版,编制日期、批准日期、生效日期均为2020年5月28日,新文件通过电子邮件发放,发送时间为2020年5月30日,查文件变更审批单和新版文件,存在多处条款序号错误,文件管理未按照规程操作;对该文件培训记录过于简单,培训对象均为企业运营部人员,没有生产部门相关人员。
9.企业与关键原材料供应商签订的采购质量协议中规定:质量标准应符合需方的验收质量标准,而企业进货验收标准中仅含外观项目,采购信息不明确。
六、生产管理方面
10.连续封口机的封口确认文件中封口速度以片/小时为单位,但现场封口机仅设置有1-13档速度档位,过程确认时未确定封口速度与速度档位的对应关系,所确认控制参数无法有效指导生产,确认文件不完整。
5
江苏迪沃生物制品有限公司
壳聚糖止血海绵敷料
检查发现一般不符合项16项。
一、机构与人员方面
1.企业洁净车间生产操作工人均超过1年未体检。
二、厂房与设施方面
2.产品某零件需粗洗后进入净化车间再行精洗,但企业未相应设置粗洗间(目前产品粗洗工序设置于制水间中进行)。
3.现场查见洁净车间原料暂存间及中检室部分地面有开裂现象,未及时维护修补。
二、设备方面
2.《标签机操作维护保养规程》未明确清洁工具、清洁方式、维护保养方法。未能提供烧录程序用计算机的操作规程。
医疗器械经营企业飞行检查情况190424_-给企业(1)

医疗器械经营企业飞行检查情况2019年4月目录CONTENTSPART ONE经营飞行检查总体情况PART TWO飞行检查发现的主要问题医疗器械飞行检查第二条本办法所称药品医疗器械飞行检查,是指食品药品监督管理部门针对药品和医疗器械研制、生产、经营、使用等环节开展的不预先告知的监督检查。
启动条件《医疗器械经营监督管理办法》第五十条对投诉举报或者其他信息显示以及日常监督检查发现可能存在产品安全隐患的医疗器械经营企业,或者有不良行为记录的医疗器械经营企业,食品药品监督管理部门可以实施飞行检查。
《药品医疗器械飞行检查办法》第八条有下列情形之一的,食品药品监督管理部门可以开展药品医疗器械飞行检查:(一)投诉举报或者其他来源的线索表明可能存在质量安全风险的;(二)检验发现存在质量安全风险的;(三)药品不良反应或者医疗器械不良事件监测提示可能存在质量安全风险的;(四)对申报资料真实性有疑问的;(五)涉嫌严重违反质量管理规范要求的;(六)企业有严重不守信记录的;(七)其他需要开展飞行检查的情形。
《广东省医疗器械经营飞行检查工作制度》检查依据——《医疗器械经营质量管理规范》(2014年第58号公告)——《医疗器械经营质量管理规范现场检查指导原则》(食药监械监〔2015〕239号)——《医疗器械冷链(运输、贮存)管理指南》(2016年第154号公告)检查结果公开《药品医疗器械飞行检查办法》第六条食品药品监督管理部门应当按照政府信息公开的要求公开检查结果,对重大或者典型案件,可以采取新闻发布等方式向社会公开。
近三年医疗器械经营企业飞行检查总体情况广东飞检数量全国飞检数量2016年70家其中:限期整改58家13家其中:立案查处8家,限期整改5家90家30家2017年其中:限期整改68家,移送稽查部门6家其中:停业整改4家,限期整改24家2018年102家其中:限期整改89家,移送稽查部门4家,注销9家8101214161820检查缺陷项分布246条款总数缺陷项关键项缺陷TOP10条款号次数涉及内容1*2.8.123次制度2*4.3020次计算机系统3*7.48.1、*7.48.218次销售记录内容4*5.32.115次首营审核5*5.3914次冷链验收6*4.23、*5.38.111次冷链设施设备、验收记录7*2.6、*2.78次质量负责人、质量管理人员职责8*2.8.2、*5.356次制度、采购记录内容9*7.47.25次购货者资质审核10*2.9.6、*4.16.1、*7.554次记录保存期限、场所、冷链设备一般项缺陷TOP10条款号次数涉及内容1 3.1494次培训2 3.15、4.19.161次健康档案、库房分区3 4.2157次库房设施4 6.4255次合理储存5 4.28、5.36.252次计量器具校准检定、随货同行单6 5.38.249次验收记录内容7 4.2947次冷链验证8 5.3342次采购合同9 6.4441次定期检查10 2.9.134次质量管理记录条款解析1、*2.8.1(23次)企业应当依据本规范建立覆盖医疗器械经营全过程的质量管理制度,并保存相关记录或者档案,包括以下内容:(一)质量管理机构或者质量管理人员的职责;(二)质量管理的规定;(三)采购、收货、验收的规定(包括采购记录、验收记录、随货同行单等);(四)供货者资格审核的规定(包括供货者及产品合法性审核的相关证明文件等);(五)库房贮存、出入库管理的规定(包括温度记录、入库记录、定期检查记录、出库记录等);(六)销售和售后服务的规定(包括销售人员授权书、购货者档案、销售记录等);(七)不合格医疗器械管理的规定(包括销毁记录等);(八)医疗器械退、换货的规定;(九)医疗器械不良事件监测和报告规定(包括停止经营和通知记录等);(十)医疗器械召回规定(包括医疗器械召回记录等);(十一)设施设备维护及验证和校准的规定(包括设施设备相关记录和档案等);(十二)卫生和人员健康状况的规定(包括员工健康档案等);(十三)质量管理培训及考核的规定(包括培训记录等);(十四)医疗器械质量投诉、事故调查和处理报告的规定(包括质量投诉、事故调查和处理报告相应的记录及档案等);条款解析2、*4.30(20次)经营第三类医疗器械的企业,应当具有符合医疗器械经营质量管理要求的计算机信息管理系统,保证经营的产品可追溯。
2017年医疗器械经营企业飞行检查情况汇总表

1、产品进货出货的记录未设计产品编号内容;
2、现场提问企业负责人吴桂花不熟悉医疗器械监督管理的法律法规等于有关知识;
3、开展了有关培训,但未制定年度培训计划和无医疗器械相关知识方面培训;
4、随货通行单无产品编号;
5、出库复核,无产品编号。
限期整改
17.
武汉赛尔利斯科技贸易有限公司
青山区38街特一号康答大厦2单元1101室
2、冷藏的医疗器械未在冷库待验、验收;
3、冷库和保温箱的温湿度监测记录可更改。
限期整改
10.
武汉思扬开拓商贸有限公司
武汉市洪山区北港村武昌府二期西区5号商业幢B单元九层十三十四十五十六号
武汉市洪山区北港村武昌府二期西区五号商业幢b单元九层十三十四十五十六号
吕露
1、进货查验记录不准确,不规范
2、从业人员健康体检证明仅见2015年度
2、医疗器械采购记录未列明注册证号,备案凭证号和规格型号;
3、无医疗器械验收记录和销售记录。
限期整改
8.
武汉市易欣医疗器械有限公司
武汉市新洲区阳逻街新光小区军安路
武汉市新洲区阳逻街新光小区军安路
屈万鹏
1、该公司医疗器械经营许可证,标示的住所经营场所和库房地址均为武汉市新洲区阳逻街新光小区军安路,但该地址不存在该公司;
肖文
1、采购记录未记录产品规格型号;
2、验收记录未记录产品规格型号;
3、年度健康体检已过期;
4、企业法人负责人及质量负责人对医疗器械法规规章有关知识熟悉度不够。
限期整改
武汉万锦康鸿科技有限公司
武汉市青山区冶金大道(中国一冶高新技术产业园)七号办公楼栋1-6层,203
武汉市青山区冶金大道(中国一冶高新技术产业园)七号办公楼栋1-6层,203
019年于都药品医疗器械经营使用单位双随机飞行检

整改
22
于都县段屋乡卫生院
1.未建立、履行医疗器械进货查验制度。
2.部分药品未按包装标识温度要求储存。3.中药饮片未做维护保养记录。
限期
整改
23
于都县段屋民康大药房
1.处方药、非处方药混放。
2.部分药品未按包装标识温度要求储存。
3.阴凉区空调未开,温度不达标。
4.药品计算机系统出现问题,销售无法开具小票。
2.未能提供重点检查记录表。
限期
整改
35
赣州市昌盛大药房连锁有限公司于都红旗大道店
1.未严格按照“四品一械”分区摆放。
2.部分处方单存在处方审核员未签字现象。
3.处方单登记有他人替审方员代签现象。
4.培训档案不完全,签到记录不规范不完整。
限期
整改
36
于都县仙下乡中心卫生院
1.药房药品未按剂型分类摆放,未贴标识。
2
于都森达大药房
1、未按贮存要求贮放药品;
2、处方药开架销售;
3、西药审方员曾红英不在岗。
限期整改
3
于都县德仁堂大药房
1.*16101少部分药品未按要求贮存于阴凉柜中;
2.2位药品从业人员未体检;
3.*13501中药饮片处方审核员未签字;
4.*16106部分处方药开架陈列和销售;
5.*16105存在处方药与非处方药混放现象
7.西药审方员未在岗在职。
立案调查
26
江西黄庆仁栈华氏大药房有限公司于都县总店
1.企业质量管理岗位、处方审核岗职责由他人代为履行签字。
2.部分药品未按包装标识温度要求储存。
3.处方药位于开架自选区域陈列销售。
限期
整改
27
医疗器械飞行检查情况汇总表(2019第3批)

11.化学药液灭菌验证及再验证未考虑YY0970中5.3.6、5.4.2中“筛选 试验”、“液体化学灭菌剂溶液中无活菌的方法”等要求,灭菌验证也未将菌 株引入到组织载体生长,同时实际操作存在化学药液超有效期使用的情况, 企业反馈已在内审中发现存在缺陷,并于2019年3月12日启动了新的灭菌 验证方案,目前尚未完成验证。
3.未对洁净车间的配液间和清洗间的沉降菌进行监测。
二、设备方面
限期 整改
/
4.蒸馏设备无使用记录。 三、文件管理方面
5.检片室存放已作废的《直径基弧检测操作规程》文件。
6.企业的培训记录、批生产记录、检验报告均为印章,无人员手签字。 四、设计开发方面
7.未对原材料NVP提纯更改进行识别。
五、采购方面
8.与主要原材料(HEM、A NVP、GMM等A)某供方签订的质量保证协议书无 签署日期、质量标准。
六、生产管理方面
9.原材料NVP提纯前后采用同一批号且无其他标识,不能有效区分。
10.未明确生产批号和灭菌批号的关系。 八、质量控制方面
11.镜片直径检验应在20℃±0.5℃的盐溶液条件下操作,但企业未配备相应温度控制和显示设备,未对以往检验结果进行评价,无验证记录。
附件
核查中心
序 号
被检查
单位
品种
省份
检查发现问题
处理 意见
备注
1
杭州启明 医疗器械 股份有限 公司
国家医疗器械飞行检查不合格项汇总

国家医疗器械飞行检查不合格项汇总一、背景介绍1. 我国是世界上最大的医疗器械市场之一,医疗器械的质量安全直接关系到民众的健康和生命安全。
为保障医疗器械的质量安全,国家对医疗器械进行了严格的监管,其中医疗器械飞行检查就是一种重要的监管方式。
2. 医疗器械飞行检查即国家食品药品监督管理总局组织的医疗器械监管人员对医疗器械生产、经营单位进行突击检查,以发现和排查医疗器械质量安全隐患,维护公共健康和安全。
二、飞行检查不合格项汇总1. 检查对象特点分析a. 医疗器械生产企业b. 医疗器械经营企业c. 监管部门2. 检查过程及不合格项a. 对医疗器械生产企业的检查不合格项汇总1) 生产环境不符合要求2) 生产设备不合格3) 质量管理体系存在缺陷4) 生产记录不完整5) 产品标识不符合标准b. 对医疗器械经营企业的检查不合格项汇总1) 进货渠道不明确2) 购进医疗器械未经许可3) 销售医疗器械未按规定进行备案4) 经营场所卫生条件不达标5) 无资质销售高风险医疗器械c. 对监管部门的检查不合格项汇总1) 监管措施不力2) 监管不到位3) 对不合格医疗器械处罚不力4) 监管信息公开不及时5) 监管人员素质不高三、飞行检查不合格项原因分析1. 企业自身原因a. 缺乏质量管理意识b. 无资质生产、经营c. 投机取巧,追求利润d. 忽视法律法规2. 监管部门原因a. 缺乏有效监管手段b. 监管资源不足c. 监管责任不落实d. 监管信息不对称四、飞行检查不合格项整改措施建议1. 加强企业自身管理a. 完善质量管理体系b. 强化员工培训c. 提高生产设备和环境管理水平2. 强化监管措施a. 完善监管法规b. 加大监管力度c. 提高监管部门素质和能力五、结语1. 医疗器械飞行检查不合格项的汇总对于整个医疗器械行业来说,是一种警示和教育,也为相关企业提供了改进的契机。
希望医疗器械生产企业、经营企业及监管部门引以为戒,积极改进,共同维护医疗器械的质量安全,保障广大患者的健康。
医疗器械经营企业飞行检查现场记录表

医疗器械经营企业飞行检查现场记录表企业名称云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店经营地址云南省玉溪市江川区大街街道五岔路口以西德馨苑延街组团11幢2单元102室仓库地址无检查日期2018年6月8日经营方式□批发□批零兼营□专营 药店兼营经营范围I、II类医疗器械许可证号及备案证号无(多证合一改革,未在备案)发证日期——检查目的和范围飞行检查检查依据《药品医疗器械飞行检查办法》、《医疗器械经营质量管理规范》观察员姓名单位龚泽洪江川区市场监督管理局企业主要现场配合人员姓名职务职称所在部门曹菠店长无云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店李丽企业质量负责人执业药师云南鸿翔一心堂药业(集团)股份有限公司江川德馨苑小区连锁店主要缺陷和问题及其判断依据本表中所列出的缺陷和问题,只是本次飞行检查的发现,不代表企业缺陷和问题的全部。
建立与本企业生产/经营产品特点相适应的质量管理体系并保持其有效运行,是医疗器械生产、经营企业的法定责任。
依据条款缺陷和问题描述规范现场指导原则5.36.2※5.38.1检查发现以下一般缺陷1项,严重缺陷1项:医疗器械供货方的销售单据信息不全。
现场抽查医疗器械“一次性末梢采血针”,未能提供有该医疗器械信息的配送单。
药店未对到货医疗器械(主要是连锁门店间调剂医疗器械)进行逐批验收。
现场检查发现“精油贴”生产厂家:山东生物科技有限公司,批号:20170301,为同区域内连锁门店间调剂商品,但该医疗器械调剂至该店后,未进行验收直接上柜销售。
检查组成员签字组员组长观察员企业负责人或其授权人签字企业负责人签字(盖章)年月日。
核查中心2021年第一批医疗器械飞行检查情况汇总

2021
序号被检查
单位
品种省份检查发现问题备注
1 江西国康
实业有限
公司
医用一
次性防
护服、红
外额温
计
江西
检查发现一般不符合项4项。
一、机构与人员方面
1.查看质量部负责人任职资格要求并现场询问,质量部经理晏某兼任销
售市场相关工作,不熟悉医疗器械相关法律法规和标准以及质量体系管理工
作。
二、文件管理方面
2.部分文件未及时修订。
如《医用一次性防护服成品检验规程》中规定
逐批检验项目未包括无菌检验项目,而成品检验报告里有无菌检验项目,检
验规程与检验报告不符;手提式不锈钢压力蒸汽消毒器的使用与《手提式不
锈钢压力蒸汽消毒器操作规程》的操作说明不符;未及时修订或更新《质量
手册》,企业提供了两份《管理者代表任命书》。
其中先任命的王某任命书收
录在现行版本《质量手册》中,但后任命的陈某任命书未收录。
三、设计开发方面
3.医用一次性防护服贴条工序的工艺参数温度、速率,红外额温计关键
工序校准调试的温度发生变更,企业未对设计开发更改(工艺参数变更)进
行识别并保持记录。
四、生产管理方面。
2022年第三批医疗器械飞行检查情况汇总

2022年第三批医疗器械飞行检查情况汇总机构与人员1.企业阳性对照间的一更内仅有一个洗手池,无干手设备,在二更内亦无干手设备,与企业洁净车间管理规程不一致。
2.未查见无菌工作服管理规定。
厂房与设施✦1.企业生产第一车间的人流通道一更与二更间未安装压差表。
2.原料和成品仓储区未明确具体的温湿度要求。
3.产品留样库、半成品库中记录产品生产批次、规格等追溯信息为双面胶,现场发现多次覆盖、脱落等情况,易混淆,不便于检查和监控。
4.企业原二级反渗透预处理净水车间流量计及观察窗有水垢。
5. 生产环境杂乱,原材料、中间品堆放在生产车间。
6. 生产环境仅仅开展静态检测,未开展动态监测,不能保证符合企业控制的十万级标准。
7.洁净车间人流物流存在交叉,部分物料由缓冲间经人流通道直接进入洁净生产车间。
8.现场查见洗衣间湿度超标。
9.企业召回的产品随意堆放,未放置在成品仓库。
10.企业洁净生产车间的一更与二更之间,物流通道,洁净车间与外包装间未安装压差表。
11.企业洁净生产车间安全门无安全通道标识。
12. 原材料库的物料未按照划分的区域存放,有70 多卷不同规格的验证合格的无纺布存放在不合格品区和待验区。
包材库存放的一次性手术衣内包材纸塑袋外包装手写标有规格、数量,无生产企业名称、批号等信息,无货位卡。
设备1.企业制水系统紫外灯消毒处的管道过低,停产时,管道的纯化水不能排净。
2.企业未对计时器、恒温箱和搅拌器的计时精度进行校准;聚合单体混合物配制室仅配备精度为0.01g 的天平,不能满足某物料的称量要求。
3.无菌、微生物限度和阳性对照检测用洁净室共用一套空气净化系统,但未对阳性对照室空气直排效果进行确认。
4.洁净区内有一台划膜喷金机停用后没有停用标识。
5.现场检查发现洁净区内部分功能间之间未安装压差监视装置,仅洁净区走廊有温湿度记录,有一台温湿度记录仪校验日期过期,十万级洁净车间和万级阳性间的两个空调压力表没有校验。
6.洁净区内纯水机停止使用后水箱和管道仍然留存水,无法排干;金标配液间超纯水系统旁的工艺用水贮存桶内留存1/3 的水,未明确水质保证措施,且现场没有定期清洗和消毒的记录。
2018年上半年四川省医疗器械飞行检查结果统计表

附件被检查单位2018 年上半年四川省医疗器械飞行检查结果统计表检查依据违反条款(序号)名称第十四条第十五条现场检查发现的问题原材料及成品库的现场及温湿度记录表上均未标明允许的温湿度范围。
输液器厂房搬入了新的大型生产设备,搬入后恢复生产前的验证资料不全。
《医疗器械第十七条成品库未标明合格区,成品库设置的待检区空置,实际放在解析区。
在输液器生产现场看到“穿刺器护套检验记录03”记录中时,间为 4.25,实际生产时间为 4.24 18:00成都市新津事丰医疗器械有限公司查特生物医疗(成都)有限公司生产质量管理规范》及附录无菌医疗器械《医疗器械生产质量管理规范》第五十条第五十一条第五十七条第六十一条第十二条第二十五条第五十五条第六十三条开始,未按实际生产时间进行记录。
一次性使用注射器“料粒使用记录” ,实施人员记录为“粉料工” ,未记录实施人员的姓名。
在输液器生产车间现场发现一件批号为180326 的输液管软管货位卡上的信息(有规格)与货箱上的信息(无规格)不完全一致。
检验中心的天平(编号JLA-080-P)放置在平滑的硬质台面上,随着开门容易移动,可能导致称量结果不稳定;高压蒸汽灭菌器与高温干燥器同放一室,可能影响干燥结果。
现场抽查的“ 一次性使用输液器” (批号为070311)留样记录的台账信息与留样盒上标示信息不完全一致。
D 生产车间制氧机生产线与办公场所未有效隔离。
未按照《文件控制程序》(GP/QP-01)的规定对文件进行管理。
现场检查发现 E 车间漏电测试岗位无绝缘地垫。
公司对制氧机经营企业“广州润之健医疗科技有限公司”资质未按规定进行审核:广州润之健医疗科技有限公司有第二类医疗器械经营备案凭证,但工商营业执照经营范围无医疗器械。
-1-四川省广元市《医疗器械生产质量管第十七条第二十七条仓储区未按照待验、合格、不合格、退货或召回等进行有序、分区存放各类材料和产品,以便于检查和监控。
在灭菌环节的原始记录中,使用热敏纸作为原始数据载体,不符合法规要求的“记录保存期限至少相当于生产企业规定的医疗器械的寿命期”的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年医疗器械经营企业飞行检查情况汇总表
世界很大,风景很美;人生苦短,不要让自己在阴影里蜷缩和爬行。
应该淡然镇定,用心灵的阳光驱散迷
雾,走出阴影,微笑而行,勇敢地走出自己人生的风景!
人们在成长与成功的路途中,往往由于心理的阴影,导致两种不同的结果:有些人可能会因生活的不顺畅怨天尤人,烦恼重重,精神萎靡不振,人生黯淡无光;有人可能会在逆境中顽强
的拼搏和成长,历练出若谷的胸怀,搏取到骄人的成就。
只有在磨难中成长和成功的人们,才更懂得生活,才更能体味出世态的炎凉甘苦,才更能闯出精彩的人生。
阴影是人生的一部分。
在人生的阳光背后,有阴影不一定都是坏事。
我们应该感激伤害过自己的人,是他们让你的人生与众不同;感激为难你的人,是他们磨炼了你的心志;感激绊倒你
的人,是他们强化了你的双腿;感激欺骗你的人,是他们增强了你的智慧;感激蔑视你的人,是他们警醒了你的自尊;感激遗弃你的人,是他们教会了你该独立。
人生若要走向成功,有好多的阴影需要消除。
限公司神农架松柏第一连锁店
芳堂医药科技股份有限公司、鄂汉械备20140105号)均需阴凉贮存,实际放置在常温条件下。
必须消除自卑的阴影:自卑,是人生的一大阴影。
我们要以一种平和的心态对待自己。
不要总把注意力始终停留在自己的短处上,你停留的时间越长,自卑心就越重,灰色的阴影就越多、越浓。
必须消除受挫的阴影:真正的强者,不但要学会在顺境中稳步前行,更重要的是学会消除逆境中的阴影。
真正的强者,不会因幸运而沾沾自喜,固步自封,也不会因厄运而一蹶不振,昏昏庸庸,而应该从逆境中找到光亮,时时校准自己前进的目标和方向,一往直前,从从容容。
必须消除贪婪的阴影:知足者常乐,不知足者能进取,知足与不知足都蕴涵着辩证法的哲理。
贪婪的人永不知足,寡欲的人一身轻松。
人世间,凡事都想求全,但凡事不可能求全;凡事都应知足,因为只有知足,才能开开心心,才能挣脱贪婪的缰绳。
假如过于贪婪,只会加重人们的心理负担,使自己永远处于无尽的烦恼之中!
必须消除无事生非的阴影:本来已经身家百万,你却奢求千万;本来已经儿女双全,你却奢求千金一对,成双儿男;本来已经事业有成,你还依然好高骛远。
你贪欲无尽,你奢求无限;本是众人眼中的佼佼者,你却忧郁连连;本来圆圆满满,你却无事生非,庸人自扰,画牢自钻圈。
你为何不能快快乐乐,阳光一点?!
四季更替,不可改变;花开花落,顺其自然;月缺月圆,规律使然。
若遇人生之阴影,要勇敢面对,积极消除。
拥抱阳光,微笑向暖,你一定会快乐无限!
著名专栏作家哈理斯和朋友在报摊上买报纸,朋友礼貌地对报贩说了声“谢谢”,但报贩却冷口冷脸,没发一言。
“这家伙态度很差,是不是?”
他们继续前行时,哈理斯问道。
“他每天都是这样的。
”朋友说。
“那么你为什么还是对他那么客气?”哈理斯问。
朋友答:“为什么我要让他决定我的行为?”
每个人心中都有把“快乐的钥匙”,但我们却常在不知不觉中把它交给别人掌管。
一位女士抱怨道:“我活得很不快乐,因为先生常出差不在家。
”她把快乐的钥匙放在先生手里。
一位妈妈说:“我的孩子不听话,让我很生气!”她把钥匙交在孩子手中。
男人可能说:“上司不赏识我,所以我情绪低落。
”这把快乐钥匙又被塞在老板手里。
婆婆说:“我的媳妇不孝顺,我真命苦!”
这些人都做了相同的决定,就是让别人来控制自己的心情。
当我们容许别人掌控我们的情绪时,我们便觉得自己是受害者,于是,抱怨与愤怒成为我们唯一的选择。
我们开始怪罪他人,并且传达一个信息:“我这样痛苦,都是你造成的,你要为我的痛苦负责!”
这样的人使别人不喜欢接近,甚至望而生畏。
一个成熟的人能握住自己快乐的钥匙,他不期待别人使他快乐,反而能将自己的快乐与幸福带给周围的人。
生活,就是一种苦苦撑下去的历程,没有谁的生活一帆风顺,也没有谁的红尘一直岁月静好,有的是一路坎坷,一路磨难,和一路的成长。
只是当你撑不下去的时候,请保留内心最真实的温柔。
想起看过的一幅漫画,一个人从十楼跳下,当她经过每一层邻居的窗口,她看见了每一家、每个人不为人知的那一面,也看见了别人的不易和自己生活的幸福。
可是,当她坠地,她又成了所有不幸之人深思自己幸福的模板。
只是她的幸福已经完结,别人照样经历着各种生活的不堪和不幸。
这个世界就是这样,你以为的幸福从来都是在别人的眼睛里,而每个人真正的幸福或者不幸,往往都藏在心里。
或许,我们在外人面前光鲜靓丽,却在某个时候,会被一句话或一首歌打动了心扉,触动了自己内心深处的柔软,让你再也控制不住情绪的波动。
或许,生活的艰难在某一刻让你泪流满面,却也会让你在哭过痛过之后,擦干眼泪依旧前行。
人活在这世上,没有人能够真正体会你经历了怎样的生活、心灵的折磨,他们看到的只是一个人的表面。
而生活的真实,却让你不得不一边崩溃着大哭,一边拼命地活着。
是的,就是活着。
一个人只有经历了生死之间的纠缠和折磨,才会懂得:活着,才是一种苦苦撑下去的坚持。
没有人可以帮到你,只有你自己才是自己躲雨的那个屋檐。
所以最难熬的日子里,你要学会一个人扛起所有的艰辛,一个人去面对生活所有的刁难,哪怕路途遥远,哪怕是一个个漆黑的长夜,你也要咬紧牙关地走下去,不负初心,不忘自己最初的本真……
你知道吗?有时候当你以为生活走到尽头的时候,总是会峰回路转;当你孤苦无依的时候,总有一个人默默地帮助你,帮你走出生命的关口,帮你走过那些泥泞的路途。
所以,千万不要放弃,只要活着,一切皆有可能。
疲于奔命的时候,多想想那些比你还困难的人;情感失意的时候,多想可能会遇上的幸福,曾经得到的温暖和爱;走投无路的时候,多想到这是人生另一种方式的拐弯……
人生没有重来的机会,生活却有让你重新选择活法的机缘。
拨开乌云见太阳,最重要的是你要有坚持下来的信心、勇气和执着。
其实,你只要有一颗坚持不懈的灵魂,你的脚下就有一片坚实的土地。
那些难捱的时光,生活里过不下去的艰难,情感里滋生出来的失望,工作上无法摆脱的困顿,无论你怎样想放弃,你都要坚持走下去,走出生命的低谷,塑造出独一无二的自己。
哪怕多年后提及,也要变成风轻云淡地过去。
其实,人这一生的所有,都是一种坚持。
坚持让自己快乐,坚持让生活变好,坚持让自己不断地提升,坚持让生命变得丰富,让心灵变得富足……。
