高一化学 海带提碘与海水提溴
从海水中提取溴、从海带中提取碘 2023-2024学年高一上学期化学苏教版(2019)必修第一册

_3_H_2_S_O__4+__5_N__aB__r+__N__aB__rO__3=_=_=__3N__a_2S_O__4+__3_B__r2_+__ 。 用 硫 酸 而 不 用 盐 酸 酸 化 的原3H因2O可能是B__rO__3−_能__将__氯__离_子__氧__化__成__氯__气。步骤②的产品有时运输到目的 地后再酸化,主要是因为_单__质__溴__具__有__强__氧__化__性__(或__强__腐__蚀_。性)
2.已知溴易挥发,碘易升华,向含有NaBr和KI的混合溶液中通入
过量氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体
是( )
A.NaCl和KI C.KCl和NaBr
B.NaCl、KCl和I2 D.KCl和NaCl
答案:D
3.溴又称为海洋元素,主要用于制取溴化物,并作为普通分析试 剂和有机合成试剂用于医药、农药、染料、香料、摄影材料、灭火剂、 选矿、冶金、鞣革、净水等方面。从海水中可以提取溴,主要反应之 一为2KBr+Cl2===2KCl+Br2,下列说法中正确的是( )
4.波力海苔以深海紫菜为原料,经烤熟之后质地脆嫩,入口即化, 是一种富含碘的海洋食品。某化学兴趣小组从紫菜中提取碘的流程如 下图:
(1)实验室灼烧紫菜,需要下列仪器中的___c_d_e_f__(填字母)。
a.试管
b.烧杯
c.坩埚
d.泥三角 e.铁三脚架 f.酒精灯
(2)实验操作②中若改用稀硫酸酸化的H2O2(少量)氧化NaI也能得到 I2 , 同 时 有 水 和 硫 酸 盐 生 成 , 写 出 该 反 应 的 化 学 方 程 式 : _2_N__aI_+__H_2_S_O__4+__H_2_O_2_=_=_=_N__a_2S_O__4+__I_2+__2_H_。2O
高一化学(鲁科版)-第一章 微项目 海带提碘与海水提溴-1教案
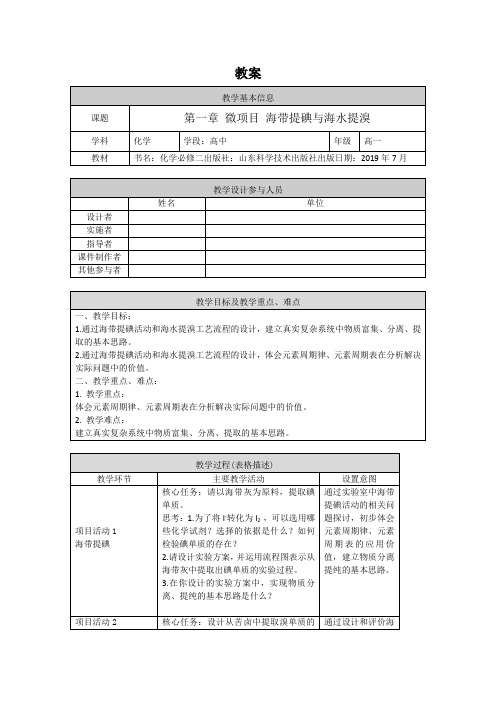
海水提溴
核心任务:设计从苦卤中提取溴单质的实验方案,并用流程图来表示。
思考:
4.你选择何种试剂使Br-转化为Br2?为什么?
5.该实验方案能否将碘单质提取出来?为什么?
工业流程中哪几步操作与富集溴元素有关?每一步操作的目的是什么?结合化学用语简述富集的原理。
7.工业上常用电解饱和食盐水的方法制取氯气,本项目利用氧化剂来制取碘单质和溴单质。请运用元素周期律的知识解释采用不同方法制取氯、溴、碘单质的原因。
项目活动1
海带提碘
核心任务:请以海带灰为原料,提取碘单质。
思考:1.为了将I-转化为I2,可以选用哪些化学试剂?选择的依据是什么?如何检验碘单质的存在?
2.请设计实验方案,并运用流程图表示从海带灰中提取出碘单质的实验过程。
3.在你设计的实验方案中,实现物质分离、提纯的基本思路是什么?
通过实验室中海带提碘活动的相关问题探讨,初步体会 元素周期律、元素周期表的应用价值,建立物质分离提纯的基本思路。
教案
教学基本信息
课题
第一章微项目海带提碘与海水提溴
学科
化学
学段:高中
年级
高一
教材
书名:化学必修二出版社:山东科学技术出版社出版日期:2019年7月
教学设计参与人员
姓名
单位
设计者
实施者
指导者
课件制作者
其他参与者
教学目标及教学重点、难点
一、教学目标:
1.通过海带提碘活动和海水提溴工艺流程的设计,建立真实复杂系统中物质富集、分离、提取的基本思路。
2.通过海带提碘活动和海水提溴工艺流程的设计,体会元素周期律、元素周期表在分析解决实际问题中的价值。
二、教学重点、难点:
高一化学复习——海带提碘与海水提溴

专题二海带提碘与海水提溴知识梳理一、海带提碘1.海带中碘元素的检验(1)检验原理①2I-+Cl2===I2+2Cl-或2I-+H2O2+2H+===I2+2H2O(填离子方程式)。
②碘单质遇淀粉变蓝。
(2)实验流程步骤2.从海带中提取碘的原理及实验流程(1)原理①选取氧化剂(氯水)将I-氧化为碘单质,离子方程式:2I-+Cl2===I2+2Cl-。
②溶液中的碘单质用苯或CCl4萃取、分液提取。
(2)实验流程3.萃取与分液(1)萃取:利用某种溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂将其从原溶剂中提取出来的方法。
加入的溶剂称为萃取剂。
(2)分液:利用分液漏斗把互不相溶的两种液体分开的操作。
分液操作一般与萃取结合使用。
(3)操作方法(4)注意事项①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下,防止液体飞溅。
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出。
④上层液体要从上口倒出,保证上层液体尽量少地沾附下层液体。
海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流程如下,思考解答下列问题:(1)碘在海带中的存在形式是________。
(2)实验操作③的名称是________。
(3)根据元素周期表中元素性质的递变规律,实验操作④可选用的氧化剂是______________,反应的离子方程式是__________________________________________________________________________________________________________________________________。
(4)实验操作⑤中可选用的有机试剂为________(填字母),说明未选取的理由:___________________________________________________________________________________。
高一化学复习——海带提碘与海水提溴

专题二海带提碘与海水提漠知识梳理一、海带提碘1.海带中碘元素的检验(1)检验原理①2I-+Cl2===!+2Cl-或2I-+H2O2+2H+===!+2H2O(填离子方程式)。
②碘单质遇淀粉变蓝。
(2)实验流程步骤2.从海带中提取碘的原理及实验流程⑴原理①选取氧化剂(氯水)将1-氧化为碘单质,离子方程式:2I-+Cl2===2+2Cl-o②溶液中的碘单质用苯或CCl4萃取、分液提取。
(2)实验流程3.萃取与分液(1)萃取:利用某种溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂将其从原溶剂中提取出来的方法。
加入的溶剂称为萃取剂。
(2)分液:利用分液漏斗把互不相溶的两种液体分开的操作。
分液操作一般与萃取结合使用。
⑶操作方法川量简量艰川ml.做的他利水洛 液,倒入登遗蛆中,然后再注 入4 1nL 四冢化«(,盖好玻璃塞, 溶液分层,四狐化碳在下层 用右手■压住分液漏斗岐迪寒,左手 握住适塞部分.把分俄漏斗倒封 过来藏林.使附神液体充分接触 将分液漏斗放在铁梁台上静置, 捕体分"层,」:层为忒层।无色; F 层为根的四氢化独房,显熊色待液体分层后.将分液漏斗的破 斶塞打开(使联匕的凹槽或d 守L 对掂漏斗的小孔k 再将分液漏斗下 面的活塞柠开一使卜一层液体制烧坯壁流下,待下层液体淹尽时. 及时关闺活塞,上层液体从分液 漏斗上旦倒出(4)注意事项①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下,防止液体飞溅。
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出。
④上层液体要从上口倒出,保证上层液体尽量少地沾附下层液体。
「理解应用」海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流程如下,思考解答下列问题:⑴碘在海带中的存在形式是一(2)实验操作③的名称是 ______⑶根据元素周期表中元素性质的 程式是(4)实验操作⑤中可选用的有机试剂为______ (填字母),说明未选取的理由:。
高一化学海水提溴和海带提碘

C.溴水、四氯化碳
刺激性气味 液
D.碘水、四氯化碳
2.单质溴在常温下是________,具有________气味,呈____态.苯是一种不溶于水 且比水轻的有机溶剂,溴_______ 易 溶于苯,现要把溴水从水中除去,加入苯充分 振荡后,再用_______ (仪器名称)分离得到溴和苯的混合液,这一实验方法称 分液漏斗 为_______ 萃取 。
5.向氯化钙、溴化钠、碘化钾混合溶液中通入氯气后,若溶液中含有Br2, 则一定不含有 A.Cl2 B.I- C.Br- D.Cl-
( B)
新开石器时代 / 新开石器时代
vgd81wjw
小娉娉!”孟婆抱着陆婉娉的一支胳膊就是一顿猛啃。“嗯嗯嗯„„”为了解救自己可怜的胳膊,陆娉儿忙不迭地应答着,顺 手将一块鱼肉放进嘴里,咦,鱼肉,自己家的冰箱里没准备鱼肉啊,要知道从来她所准备的此类东西都是人造的,可这嚼起来 还有滋有味儿的鱼肉孟婆是从哪里弄来的?陆婉娉大张着嘴,一脸疑惑的凝视着孟婆„„第004章 福利穿越鱼肉?这入口新鲜 的让人几乎要怀疑的,这个世纪根本不会有的鱼肉一下子引起了陆婉娉的警觉?“孟婆大人,你刚才给本姑娘吃的什么东 西?”“嘎嘎嘎,放心了小娉娉,老姐害别人也就罢了,岂能害你?”孟婆笑起来的时候,那声音跟猫头鹰的叫声无异,在这 夜半的独居小屋子里反复的回音着,显得那么阴森恐怖。“别别别,咱俩这关系,有事儿好商量啊!”“说什么呢?老姐有好 事儿的时候自然第一时间想到的就是小娉娉我啊!”孟婆凑近一步,笑的让人感觉怎么看怎么邪恶。“好嘞,小娉娉,老姐正 琢磨送你啥么生日礼物呢,这下好了,老姐这就让你穿越到你喜欢的古代去,做为福利之一的好处就是,顺便去看你的时候, 也不用再吃这么难吃的食物,喝这么难喝的茶水了„„”这哪里是在商量啊?这分明就是有预谋的,而且不知道预谋了多少次 的好不好,陆娉儿正在和一块鱼肉奋力搏斗的时候,孟婆一个响指,尼玛自己就穿越了„„啊,啊,啊,是尼玛货真价实的穿 越了,没有电视剧中的自杀或是撞墙亦或是跳水,更没有惊天动地的壮举,连个poss都没顾上摆。陆婉娉就这么赤果果的穿越 了,前一秒还舒服地坐在自己家里的沙发上喝茶吃鱼肉和孟婆大人聊理解聊人生。后一秒钟自己就穿越到了放眼望去,四周围 乌漆麻黑的古代,更悲催的是,自己还穿着拖鞋穿着夏天的小吊带睡衣,四周这小风这么一吹阴森森,冷深深,麻麻啊!俺不 玩儿了,俺想回家„„娉儿冲着高空骂道:“死孟婆,不带这么玩儿姐的,老娘还光着呢!”“唉哟,人老了就是糊涂了,冷 不丁还把这茬给忽略了,亲爱的报歉啊报歉啊!”半空中刷啦一声就扔下来自己的行礼箱以及各种各样的衣服,孟婆这整个是 一搬家公司中,连平时盖着的被子都没有落下,零零散散的飘了一地。“尼玛,孟婆你个男不男女不女的死变态,真当我怕你 啊,这身无分纹的想把老娘给折腾死啊!”笑话,这可不是从南方到北方出差,没现金还可以套现信用卡,这可是被孟婆扔到 了古代啊——古代,难不成你给古人说:“老兄,买个烧饼可不可以刷信用卡啊!”那不是没事找事的找人追着打吗?话音刚 落,半空中传来孟婆忙不迭的声音,“失误,失误!”啪搭一声,一袋东西落在了身旁,“省着点儿花啊,小败家子,五十两 银子老娘一年的薪水,权当老娘预借给你的茶水
微项目 海带提碘与海水提溴 第2课时【新教材】高一化学必修第二册

还原性
②易挥发性
2.1 海水提溴
3、如何由粗溴制备溴单质? Br2 + SO2 + 2H2O = 2HBr + H2SO4 Cl2 + 2HBr = Br2 + 2HCl
2.1 海水提溴
浓缩
氧化
提取
2.1海水提溴
浓缩 氧化 :2NaCl + 2H2O 通电 2NaOH + H2↑ + Cl2↑
练习题组三
P25:10
P25 10
10. 【济南历城二中月考(20,4)17】下面是海水资源利用的流程图,请 据图回答问题: (1)淡化海水的方法有 _蒸__馏__法__(写一种方法即可), 由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子, 需 要 依 次 加 入 稍 过 量 的 NaOH 、 BaCl2 、 _N__a_2C__O_3_ ( 填 化 学 式 ) , 之 后 _过__滤__(填操作名称),再加入适量__盐__酸__(填试剂名称)。将所得溶液 加热浓缩、冷却结晶,得到精盐。
③生产过程所得的镁蒸气在特定的环境里冷却后可得固态的金属镁,下
列物质中可以用作镁蒸气的冷却剂的是__B__C__(填写代号);
A. 空气
B. Ar
C. H2
D. CO2
P24 9
9. (3)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形 成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质。 ①生成溴单质的化学反应的化学方程式是__C__l2_+__N__aB__r_=__B_r_2 _+_2_N__a_C_l__, 从溴苯混合物中分离出溴单质应采用___蒸__馏____(填实验方法)。
化工生产-海水提溴和海带提碘教案(含知识点+习题+答案)

化工生产——海水提溴和海带提碘考点一 海水提溴1.流程图海水 蒸发浓缩 → 富含Br -的海水 酸化,通氯气氧化 → 含Br 2的溶液 通空气、水蒸气吹出→ Br 2方法一:SO 2吸收法Br 2 二氧化硫吸收→ 吸收液 氯气氧化→ 含Br 2的溶液 控温80−90℃蒸馏→ 液溴方法二:浓碳酸钠吸收法Br 2 浓Na2CO3吸收→ NaBr 、NaBrO 3混合液 硫酸→ 含Br 2的溶液 80−90℃蒸馏→ 液溴2.注意事项:① 处酸化的目的是 海水为弱碱性,抑制氯气与海水反应 ③处溴可用空气吹出的原因 液溴的沸点低,易挥发 ④处发生的反应为 SO 2 + 2H 2O + Br 2 →2 HBr + H 2SO 4⑥处蒸馏时需控制温度在 80℃—90℃的原因是 温度过高,水蒸气会随Br 2 排出,纯度低;温度过低,Br 2 不能完全蒸出,产率低。
⑦处浓碳酸钠吸收的化学方程式为 3Na 2CO 3 + 3Br 2 → 5NaBr +NaBrO 3 + 3CO 2 ,此处不用盐酸酸化的原因是 HCl 会被溴酸钠氧化⑧处硫酸酸化的化学方程式为 5NaBr + NaBrO 3 + 3H 2 SO 4 → 3Br 2 + 3Na 2 SO 4 +3H 2O① ② ③④ ⑤ ⑥⑦⑧【例题】空气吹出法工艺,是目前“海水提溴”的最主要方法之一。
其工艺流程如下:(1)步骤③的离子方程式:_________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。
分离仪器的名称是__________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过__________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。
温度过高或过低都不利于生产,请解释原因:_______________________________________________________________。
微项目 海带提碘与海水提溴-2024-2025学年高考化学总复习(配鲁科版)

微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用内容说明教材中本项目通过海带提碘活动和海水提溴工艺流程的设计,建立真实复杂系统中物质富集、分离、提取的基本思路,体会元素周期律、元素周期表在分析、解决实际问题中的价值。
一轮复习中重点掌握卤素单质提取的化工流程。
项目活动一碘的提取工艺海带提碘(1)流程(2)发生反应的离子方程式①含I-的溶液通入Cl2:Cl2+2I-===I2+2Cl-。
②碘与浓NaOH溶液反应:3I2+6OH-===5I-+IO-3+3H2O。
③反萃取后的水层与硫酸反应:5I-+IO-3+6H+===3I2+3H2O。
1.用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到的是()选项实验步骤实验用品A步骤1:将海带灼烧灰化B步骤2:将海带灰溶解、过滤C步骤3:氧化滤液中的I-D步骤4:检验碘元素答案C解析氧化滤液中的I-用不到容量瓶,故选C。
2.(2023·烟台期末)碘是人体不可缺少的微量元素,采用离子交换法从卤水(富含I-)中提取碘的工艺流程如下。
下列说法错误的是()A.“氧化1”的主要离子方程式为2I-+Cl2===2Cl-+I2B.离子交换树脂的作用是富集碘元素C.理论上参加反应的n(Cl2)∶n(Na2SO3)=1∶1D.“吹碘”鼓入热空气是利用了I2易升华的性质答案A解析卤水中的碘离子在硫酸酸性条件下,被氯气氧化成I-n,用交换树脂吸附后,用亚硫酸钠将I-n还原成碘离子,然后树脂在氯化钠和HCl通入后再次发生离子交换,将碘离子转移到水溶液中,溶液中碘离子被加入的氯酸钾氧化成碘单质,最后用热空气吹出,得到碘单质,据此分析解答。
A.氧化1”中生成I-n,氯气被还原成氯离子,根据化合价升降总数相等配平反应,其反应的离子方程式为2n I-+(n-1)Cl2===2I-n+2(n-1)Cl-,A错误;B.据分析,离子交换树脂的作用是富集碘元素,B正确;C.氧化1”中2n I-+(n-1)Cl2===2I-n+2(n-1)Cl-,碘离子转变为I-n,氯气被还原成氯离子,氯元素化合价从0价降低到-1价,亚硫酸钠又将I-n还原成碘离子,硫元素从+4价升高到+6价,则存在关系式Cl2~2e-~Na2SO3,故理论上参加反应的n(Cl2)∶n(Na2SO3)=1∶1,C正确;D.“吹碘”中通入热空气,使碘成为气体从溶液中逸出,则“吹碘”鼓入热空气是利用了I2易升华的性质,D正确。
第1章微项目海带提碘与海水提溴体验元素性质递变规律的实际应用讲义高一下学期化学

微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用学习目标1.通过海带提碘活动和海水提溴工艺流程的设计,建立真实复杂系统中物质富集、分离、提取的基本思路。
2.通过海带提碘活动和海水提溴工艺流程的设计,体会元素周期律、元素周期表在分析、解决实际问题中的价值。
项目活动1 海带提碘【思考】1.如何证明海带灰溶液中含有I ?为了将 I 转化成I2,可用选用哪些化学试剂?选择的依据是什么?2.设计实验方案,并用流程图表示从海带灰中提取碘单质得到含碘单质溶液的实验流程。
实验步骤实验现象实验结论【知识基础】1、 Br2、I2的物理性质2、卤族元素化学性质的递变规律(F→I)3、萃取与分液(1)萃取剂的选择萃取剂必须具备的三个条件:①萃取剂和原溶剂互不相溶、不反应;②萃取剂和溶质不发生反应;③溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
(2)分液操作的注意问题①分液漏斗使用前要检验是否漏水。
②倒转分液漏斗时,应关闭活塞,盖上玻璃塞,防止液体流出,并且要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险。
③分液时要将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,保证漏斗内与外界大气相通,同时漏斗下端要紧贴烧杯内壁,从而使液体顺利流下。
④下层液体要从下口放出,上层液体要从上口倒出。
结合以上知识小组讨论解决问题1、21、根据元素周期表中元素性质的递变规律可知,同主族元素从上到下,非金属性逐渐减弱,则相应单质的氧化性逐渐减弱,所以氯水、溴水均可用作提取碘单质的氧化剂。
反应的离子方程式为Cl2+2I===2Cl+I2、Br2+2I===2Br+I2。
取反应后的溶液,向其中滴加淀粉溶液,如果溶液显蓝色,说明生成碘单质。
2、实验室里,从海带灰中提取碘单质包括浸取、过滤、氧化、萃取四个步骤。
其中,将I氧化为I2是提取的关键步骤。
实验步骤实验现象解释1.将海带冲洗干净,用剪刀将海带剪成块状,用酒精润湿(便于灼烧)后,放在坩埚中。
高三无机实验物质分类:海带提碘、海水提溴

学员编号: 年 级:高三 课 时 数:3学员姓名: 辅导科目:化学 学科教师:课程主题: 海带中提碘、海水中提溴 授课时间:学习目标1.了解海水提溴、提碘的流程。
2. 学习提取过程中的实验操作及原理。
教学内容一、实验背景碘不仅是重要的工业原料,而且是动物和人体必需的元素,碘在人体内用于合成甲状腺素,调节新陈代谢。
碘在地壳中的含量为3×10-5%。
自然界中并不存在游离态的碘,独立的矿物也很少,只有碘酸钙矿。
碘的主要来源:智利硝石中含有%碘酸钠,智利硝石在提取硝酸钠以后,其母液中约含有3%碘酸钠。
海水中碘的浓度尽管很低,只有一亿分之五,但是总量却很大,特别是海带、马尾藻的那个藻类植物有很高的的富集碘的本领。
一般干海带里含碘%~%,有的可高达1%,比海水中含碘的浓度高出十几万倍。
所以通常从海带或马尾藻中提取碘。
工业制备碘的方法空气吹出法、碘化亚铜沉淀法、活性炭吸附法、淀粉吸附法、硝酸银或硫酸铜沉淀法、离子交换树脂法等二、实验用品试管、100 mL 烧杯(2只)、瓷坩埚(或铁坩埚)、漏斗、分液漏斗、铁架台(带铁圈)、酒精灯(或酒精喷灯、煤气灯)、坩埚钳、托盘天平、泥三角、玻璃棒、滤纸、剪刀、火柴。
氯水(新制)、1%淀粉溶液、四氯化碳、蒸馏水、干海带。
三、实验内容1.准备 用布擦掉干海带表面的泥沙等杂质,用剪刀将海带剪碎(便于灼烧)。
2.称量 称取约5 g 干海带,放入瓷坩埚内,在铁架台的铁圈上放置泥三角,再将坩埚放在泥三角上。
知识精讲物质的分离:海带中提取碘H 2O2价格相对较贵双氧水的量不容易控制,容易过量:5H2O2+ I2→ 2HIO3+ 4H2O,而高锰酸钾做氧化剂因为颜色较深,不便于后期的观察和提纯,所以实验室一般选择的是氯水2.用分液漏斗来进行萃取或分液时要注意些什么?为什么能用四氯化碳来萃取碘水中的碘,其作用是什么?漏斗内加入的液体量不能超过容积的3/4。
为防止杂质落入漏斗内,应盖上漏斗口上的塞子。
项目式学习——海带提碘与海水提溴

项目式学习——海带提碘与海水提溴——体验元素性质递变规律的实际应用[核心素养发展目标] 1.以海带提碘和海水提溴为例,体会元素周期律、元素周期表在分析、解决实际问题中的价值。
2.以海带提碘和海水提溴为例,形成物质分离、富集、提取的基本思路,体会绿色化学观念在生产实际中的应用。
一、海带提碘1.海带中碘元素的检验(1)检验原理①2I-+Cl2===I2+2Cl-或2I-+H2O2+2H+===I2+2H2O(填离子方程式)。
②碘单质遇淀粉变蓝。
(2)实验流程步骤2.从海带中提取碘的原理及实验流程(1)原理①选取氧化剂(氯水)将I-氧化为碘单质,离子方程式:2I-+Cl2===I2+2Cl-。
②溶液中的碘单质用苯或CCl4萃取、分液提取。
(2)实验流程3.萃取与分液(1)萃取:利用某种溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂将其从原溶剂中提取出来的方法。
加入的溶剂称为萃取剂。
(2)分液:利用分液漏斗把互不相溶的两种液体分开的操作。
分液操作一般与萃取结合使用。
(3)操作方法(4)注意事项①振荡时,要不时的旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,要将漏斗下端管口紧贴烧杯内壁,使液体顺利流下,防止液体飞溅。
③下层液体要从下口放出,恰好流尽时及时关闭活塞,防止上层液体流出。
④上层液体要从上口倒出,保证上层液体尽量少地沾附下层液体。
海带、紫菜中均含有丰富的碘元素,从海带中提取碘单质的流程如下,思考解答下列问题:(1)碘在海带中的存在形式是________。
(2)实验操作③的名称是________。
(3)根据元素周期表中元素性质的递变规律,实验操作④可选用的氧化剂是______________,反应的离子方程式是__________________________________________________________________________________________________________________________________。
高中化学 海带提碘与海水提溴

1微项目海带提碘与海水提漠应应体验元素性质递变规律的实际应用一、海带提碘海带、紫菜等藻类植物中含有丰富的碘元素,燃烧的灰烬中碘元素以碘化物的形式存在。
实验室里从海带灰中提取碘单质的流程如下:问题探究:1 .第①步灼烧海带用到哪些仪器?提示:坩埚、坩埚钳、泥三角、三脚架、酒精灯、玻璃棒。
2 .第③步获取含I 7溶液的操作名称是什么?提示:过滤。
3.书写第④步反应的离子方程式,并分析还可选取哪些物质作为此反应的氧化剂,其依据是什么? 提示:Cl 2+2I -===I 2+2Cl -;由元素周期表中元素性质的递变规律知:氧 化性Cl 2>Br 2>I 2,因为氯水、溴水均可作提取碘的氧化剂;从氧化性强弱角度分析:FeCl 3、H 2O 2也可用作提取碘的氧化剂。
4.第⑤步实验操作的名称是什么?选择萃取剂的条件是什么?本实验的萃取剂可选用什么物质? 提示:萃取分液。
萃取剂的条件是萃取剂和原溶剂互不相溶,二者是溶质在 ②浸泡+海带灰悬浊液 固态«残渣期理亏处萃取剂中的溶解度大于在原溶剂中的溶解度。
本实验可选用苯、四氧化碳、汽油作萃取剂,不用酒精作萃取剂。
5.如何将碘单质从四氯化碳溶液中提取出来?提示:⑴根据12和CJ熔沸点不同,可用蒸储的方法得到碘单质。
⑵反萃取法:具体步骤如下二、海水提漠问题探究:1.为什么选晒盐后的苦卤而不是海水作为提取溴单质的原料?提示:苦卤中Br-的浓度比海水大得多。
2.向苦卤中通入Cl2继而通入热空气可得粗溴,在此过程中体现了溴的哪些性质?提示:⑴溴的氧化性不如氯气强,可用置换法制备溴单质;(2)溴易挥发,因此可用热空气从溶液中分离出来。
3.如何由粗溴制备高纯度溴?提示:吹出的溴蒸气和吸收剂SO2、H2O发生反应,转化为HBr,然后再用氯气将其氧化得到溴单质。
拓展升华1.物质分离与提纯的基本思路是什么?常见的物质分离方法有哪些?提示:分析被提纯物质与其他物质性质(包括物理性质和化学性质)的差异、选择适宜的分离方法。
微项目海带提碘与海水提溴

微项目海带提碘与海水提溴--体验元素性质递变规律的实际应用新知预习1.卤族元素化学性质的递变规律(F-I)(1)相似性。
卤素原子最外层电子数都为7,都能形成气态氢化物(通式为HX),最高价氧化物对应的水化物化学式为HXO(F除外),单质具有氧化性。
4(2)递变性。
①单质氧化性逐渐减弱。
②卤素离子还原性逐渐增强。
③气态氢化物稳定性逐渐减弱。
④单质与氢气反应的能力逐渐减弱。
(3)溴、碘单质物理性质比较2.卤素单质的氧化性:F>Cl>Br>1。
22223.萃取与分液(1)萃取原理。
利用某溶质在两种互不相溶的溶剂里溶解能力的不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的方法叫作萃取。
将萃取后两种互不相溶的液体分开的操作,叫作分液。
(2)实验步骤。
加萃取剂(如图I)——振荡萃取(如图II)——静置分层(如图III)——分液(如图W):微思考2】灼烧海带时用到哪些仪器? 圈£4灼烧海芾项目活动一 1.从海带中提取碘问题探究(1)海带中的碘元素主要以I -的形式存在,提取时用适当的氧化剂将其氧化成12,再萃取出来。
可用什么氧化剂?UI 阳.makepdikM澳水和〔:0|的渥命物(】)加苓取郝⑵監藹萃血时)恭最外恳外液 4.分离和提纯的一般方法(1) 物理方法:过滤、蒸发结晶、蒸馏或分馏、萃取、分液、升华等。
(2) 化学方法:沉淀法、洗气法、转化法等。
6.海水提溴从海水中提取溴,一般要经历浓缩、氧化和提取三个步骤。
在海水提溴的化工生产中,常选用氯气作为氧化剂,反应原理为Cl 2+2Br -=2Cl -+Br 2。
【微思考1】可否用酒精萃取溴水中的溴?(3)若要分离碘的CC14溶液分别得到碘和CC14,应采用什么方法?(已知四氯化碳的沸点是77°C,碘单质的沸点是184.35°C)【归纳小结】实验室里,从海带灰中提取碘单质包括浸取、过滤、氧化、萃取四个步骤。
高中化学-海水提溴,海带提碘【学生版】

海水提溴,海带提碘知识梳理一、海水提溴1.溴单质的氧化性介于氯和碘之间,因此海水提溴可以选取氯气作氧化剂。
大体分为三个步骤:浓缩、氧化、提取。
(1)浓缩(富集):蒸发浓缩,制取海盐所得苦卤中,溴离子浓度可达6g/L。
(2)氧化:通入氯气,使溴离子氧化成单质。
Cl2+2Br-→2Cl-+Br2(3)提取粗溴:向苦卤中吹入热空气,使溴挥发,冷凝后即得粗溴。
(4)粗溴提纯:Br2→Br-→Br2。
通入SO2:Br2+SO2+2H2O→2HBr +H2SO4;再次用Cl2氧化,吹入热空气或水蒸气,使溴逸出,即可得高纯液溴。
2.溴的性质(1)溴的物理性质:常温下是_____________色、密度比水大、易挥发的液体,具有刺激性气味,溴的蒸气有毒,且具有强烈的腐蚀性。
(2)实验室里保存液溴时应注意的问题:放在_________中,加少许______以防止溴的挥发,试剂瓶塞不能用橡皮塞,而用玻璃塞,密闭。
(3)溴的用途:溴的用途很广,主要用于制药工业。
医院里普通使用的镇静剂,有一类就是用溴的化合物制成的,如溴化钾、溴化钠、溴化锂等,通常用于配成“三溴片”,可以治疗神经衰弱和歇斯底里症。
大家熟悉的红药水就是溴与汞的有机化合物,氯霉素、四环素等也都少不了溴,溴还可以制成熏蒸剂、杀虫剂、抗爆剂等。
二、海带提碘1.通常从海带或马尾藻中提取碘。
具体流程如下:(1)从海洋植物中得到碘离子:将海带晒干,灼烧成灰,用水溶液浸泡,使I-进入水中,过滤,除灰渣。
(2)氧化:通入氯气,使I-转化为I2。
(3)提取碘:用四氯化碳(CCl4)萃取,得到碘的四氯化碳溶液,再蒸馏除去四氯化碳得到粗碘,利用升华法得到纯净的碘单质。
2.碘的性质(1)碘的物理性质主要有:单质碘是__________固体,在水中溶解度很小,几乎不溶于水,但能溶于酒精(所得溶液俗称碘酒)、氯仿、四氯化碳等有机溶剂中。
单质碘加热时,不经过熔化直接变成__________蒸气,这种由固态不经液态直接变成气态的现象叫做升华。
高一化学(鲁科版)-第一章 微项目 海带提碘与海水提溴

35
I- 氧化剂 I2 氧化反应
Br
79.90
常见氧化剂:Cl2、HNO3、KMnO4、H2O2
53
I
126.9
思考
17
Cl 1.如何将碘离子转化为碘单质?
35.45
35
I- 氧化剂 I2 氧化反应
Br
79.90
常见氧化剂:Cl2、HNO3、KMnO4、H2O2
53
I
126.9
思考
2. 如何检验碘单质的存在?
过滤
含I-溶液 Cl2 氧化 含I2 溶液
萃取
I2的 CCl4溶液
目标物
待分 离体
分析
系
性 质 差 异
其他物质
物理
选择
分离 提纯
方法
化学
海带 灼烧
海带灰
H2O 浸取
海带灰 悬浊液
过滤 含I-溶液 Cl2 氧化 含I2 溶液
萃取
I2的 CCl4溶液
目标物
待分 离体
分析
系
性 质 差 异
其他物质
物理
选择
萃取
I2的 CCl4溶液
目标物
待分 离体
分析
系
性 质 差 异
其他物质
选择
分离 提纯
方法
海带 灼烧
海带灰
H2O 浸取
海带灰 悬浊液
过滤
含I-溶液 Cl2 氧化 含I2 溶液
萃取
I2的 CCl4溶液
目标物
待分 离体
分析
系
性 质 差 异
其他物质
物理
选择
分离 提纯
方法
化学
海带
灼烧
海带提碘与海水提溴知识点

海带提碘与海水提溴知识点海带是一种常见的海藻,被广泛用于食品加工和药物制备中。
海带含有丰富的碘元素,而海水中含有丰富的溴元素。
本文将分别介绍海带提碘和海水提溴的相关知识点。
一、海带提碘1. 海带中的碘含量海带是一种富含碘的食物,每100克海带中的碘含量约为1000微克。
碘是人体必需的微量元素,对于人体的正常生长发育和代谢具有重要作用。
2. 碘的作用碘在人体内主要参与甲状腺激素的合成,对于人体的代谢、生长发育、神经系统的正常功能具有重要作用。
碘缺乏会导致甲状腺功能减退、甲状腺肿大等疾病。
3. 海带提碘的方法海带中的碘主要以有机碘形式存在,需要将其提取出来。
一种常用的方法是将海带浸泡在含有碘的溶液中,使得溶液中的碘与海带中的有机物发生反应,形成可溶性的碘化物,然后通过蒸馏、浓缩等工艺步骤,最终得到碘化物。
4. 碘的应用提取的碘可以用于药物制备、食品加工、化学试剂等领域。
在药物制备中,碘可以用于制备抗菌药物、消毒剂等;在食品加工中,碘可以用于防止食品变质、增加食品的营养价值等。
二、海水提溴1. 海水中的溴含量海水中溴的含量较少,每升海水中溴的含量约为65毫克。
溴是一种重要的无机元素,对于人体的正常生理功能具有一定影响。
2. 溴的作用溴在人体内主要参与甲状腺激素的合成,对于神经系统的正常功能也有一定影响。
溴也具有镇静、抗焦虑等作用,常被用于药物的制备。
3. 海水提溴的方法海水中的溴主要以无机形式存在,需要将其提取出来。
一种常用的方法是将海水进行浓缩,通过蒸发、结晶等工艺步骤,最终得到溴化物。
提取溴的过程需要严格控制温度、压力等条件,以确保提取的溴的纯度和质量。
4. 溴的应用提取的溴可以用于药物制备、化学工业等领域。
在药物制备中,溴可以用于制备镇静剂、抗焦虑药物等;在化学工业中,溴可以用于制备有机溴化合物,如阻燃剂等。
总结:海带提碘和海水提溴是利用海洋资源中的碘和溴元素,通过提取和加工的方法,得到可应用于药物制备、食品加工等领域的化学物质。
海带提碘与海水提溴

顺序是
。
27
[解析] (1)读懂流程图,可以写出 2Br-+Cl2===Br2+2Cl-,SO2 +Br2+2H2O===2HBr+H2SO4。(2)只从理论上考虑,NaOH 具有强 碱性,能吸收 Br2,Fe2+、SO23-具有还原性也能吸收 Br2,但 Br2 在水 中的溶解度较小,不能充分吸收。(3)Br2+SO2+2H2O===H2SO4+ 2HBr,该反应中氧化剂为 Br2,还原剂为 SO2,反应中每生成 2 mol HBr,则消耗 1 mol SO2。(4)最后再向含 HBr 的溶液中通入适量 Cl2, 蒸 馏 得 到 Br2。 经 过 上 述 反 应 过 程 知 氧 化 性 由 强 到 弱 的 顺序 为 Cl2>Br2>SO2。
步骤③反应的化学方程式是
(2)从理论上考虑,下列物质也能吸收 Br2的是
A.NaOH
B.FeCl2
C.Na2SO3
D.H2O
, 。 (填序号)。
26
(3)步骤③中氧化剂是
,若反应中生成 2 mol HBr,则消
耗
mol SO2。
(4)根据上述反应判断 SO2、Cl2、Br2 三种物质氧化性由强到弱的
10
2.使用反萃取法分离和提纯物质的操作过程要求是什么? 提示:(1)除杂试剂必须过量;(2)过量试剂必须除尽(因过量试剂 会形成新的杂质);(3)除杂途径必须选最佳。
11
3.实验室如何制备溴单质?请比较实验室提取溴单质与工业提 取溴的异同?
提 示 : 实 验 室 制 备 溴 的 原 理 : MnO2 + 2NaBr + 3H2SO4 2NaHSO4+MnSO4+2H2O+Br2↑。实验室制备溴和工业制备溴 的相同点:都是 Br-被氧化得 Br2;不同点:工业提取溴需经过复杂 的富集、分离、提纯等生产工艺流程。
高一化学海水提溴和海带提碘

1. 下列哪组溶液混合后,振荡,静置,上层液体为无色,下层为橙色( C )
A.溴水、酒精
B.碘水、汽油
深红棕色
C.溴水、四氯化碳
刺激性气味 液
D.碘水、四氯化碳
2.单质溴在常温下是________,具有________气味,呈____态.苯是一种不溶于水 且比水轻的有机溶剂,溴_______ 易 溶于苯,现要把溴水从水中除去,加入苯充分 振荡后,再用_______ (仪器名称)分离得到溴和苯的混合液,这一实验方法称 分液漏斗 为_______ 萃取 。
A氯气通入碘化钠溶液中 C碘水加入溴化钠溶液中 中
B氟气通入氯化钠溶液 D溴水加入氯化钠溶液
2. 关于卤族元素的说法不正确的是 A.单质的熔、沸点随核电荷数的增加而逐渐升高 B.单质的颜色随核电荷数的增加而逐渐加深 C.单质跟H2的反应随核电荷数的增加而越来越难 D.氢化物的稳定性随核电荷数的增加而逐渐增强
四氯化碳不溶于水,且碘在其中的溶解度大于在水中的 选用该液体做实验的原因是________________________________。 碘易升华 说明书中的贮藏方法,是因为________________________________ 而提出的。
知识点2:氯、溴、碘单质活泼性比较
1.下列各组物质之间能发生置换反应的是 ( A )
3.从海水中提取溴的过程如图表示:
海水 酸化
酸
氧化
吹出
吸收
氧化
溴
氧化剂
热空气
ห้องสมุดไป่ตู้
氧化剂
(1)为什么要在酸性条件下,而不能在碱性条件下氧化溴离子? 答:氧化剂使用的是氯水,所以要在酸性条件下,因为Cl2+NaOH==NaCl+NaClO+H2O Cl2+2Br-→Br2+2Cl(2)写出用氯气氧化溴离子的离子方程式______________ B 和_____. D (3)氧化后用热空气将生成的单质溴吹出,选用他的原因是_____
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问题1:碘是从哪种物质中提取的呢?
海带、紫菜
问题2:如何提取碘?
灼烧海带—海带灰(存在可溶性碘化物)
问题3:如何证明溶液中含有I- ?
①AgNO3溶液和稀HNO3 ②氯水和淀粉溶液
③氯水和CCl4溶液
9
【活动探究】将I-转化为I2
1.实验药品 KI溶液、氯水、溴水、CCl4
2.实验方案: (1)在一支试管中加入2~3 mL KI溶液,滴加少量新制 氯水,再滴加少量CCl4,振荡,静置。
1
高中化学一年级
微项目海带提碘与海水提溴
——体验元素性质递变规律的实际应用
2
1.同周期同主族元素性质的递变规律。 (1)同周期元素从左到右,金属性逐渐_减__弱__,非金属性 逐渐增__强___。 (2)同主族元素从上到下,金属性逐渐_增__强__,非金属性 逐渐__减__弱_。
2.Br2、I2的性质。 (1)Br2、I2的物理性质
②在水溶液中,溴离子能与银离子反应,生成难溶于水 和稀硝酸的_浅__黄__色溴化银沉淀。反应的离子方程式为 ___B_r_-_+_A_g_+_=_=_A_g_B_r_↓_,实验室常用硝酸银溶液和稀硝酸 来检验Br-。
③在水溶液中,碘离子能与银离子反应,生成难溶于水 和稀硝酸的_黄__色碘化银沉淀。反应的离子方程式为 ________I_-+_A_g_+_=_=_A_g_I_↓______,实验室常用硝酸银溶液 和稀硝酸来检验I-。 ④淀粉遇I2变__蓝__色_,该性质可用于检验I2。
现象及结论:液体分层, 上层为无色溶液,下层为 紫红色液体。反应的化 学方程式为 Cl2+2KI==2KCl+I2
10
(2)在一支试管中加入2~3 mL KI溶液,滴加少量新制 溴水,再滴加少量CCl4,振荡,静置。
现象及结论:液体分 层,上层为无色溶液, 下层为紫红色液体。 反应的化学方程式 为Br2+2KI==2KBr+I2
5I- +IO3- +6H+ ==3I2+3H2O
14
溴及其化合物可被用来作为阻燃剂、净水剂、杀虫剂、 染料等。常用消毒药剂的红药水中含有溴和汞。在照 相技术中,溴和碘与银的化合物担任感光剂的角色。
溴又被称之为“海洋元素”,海水中含有大量的溴,请 根据元素周期律的相关知识设计实验探究从海水中提 取溴的主要流程
4
3.物质分离的一种方法:萃取和分液。 (1)萃取 ①利用某种溶质在两种__互__不__相__溶_的溶剂里溶解能力的 不同,用一种溶剂(萃取剂)将其从原溶剂中提取出来的 方法叫萃取。 ②萃取后,可以用分液漏斗把__互__不__相__溶_的两种液体分 开,从而达到分离的目的。
5
(2)操作步骤
(3)注意事项
(2)从海水中提取溴的过程中,为什么往溴水中鼓入热 空气或水蒸气可获得粗溴?在实验室中怎样从溴水中提 取溴?
溴具有很强的挥发性,往溴水中鼓入热空气或水蒸气, 溴即可挥发出来,符合工业生产的可操作性、经济性 原则。 在实验室中可以采用萃取的方法提取溴。
18
【探究总结】海水提溴提取流程
19
【课堂小结】
和
过程中关键的一步就
是选取合适氧化剂把I-和Br-转化为相应的单质,在实
际生产中,我们利用了同主族元素性质递变规律,选
取氯气作为氧化剂,实现了对海洋资源的开发利用,
降低了生产成本,提高了经济效益。
元素性质递变规律在实际生产和生活中的使用也是
非常广泛的,大家可以慢慢去感受。
20
(3)实验结论: 非金属性:Cl2>I2,Br2>I2 符合同主族元素自上而下,非金属性逐渐减弱的递变规 律,从海带中提取碘单质,可选用氯水、溴水作氧化剂11
【探究总结】
海带提碘的流程如下
12
物质分离提纯的基本思路 过滤法、萃取法、 升华法、化学转化法
除杂或转化试剂
13
【拓展视野】反萃取法:将富集在有机溶剂中的单质利 用化学方法重新富集在水中的方法。
色、态 密度
溶解性
溴 碘
_深__红__棕__ 色液体
_紫__黑__ 色固体
均比水 的_大__
水中:微溶; 有机溶剂 中:___易_溶
特性 易__挥__发__ 易__升__华__ 3
(2)溴、碘及其化合物的性质
①溴单质具有氧化性,能将碘化钾溶液中的碘置换出来, 反应的化学方程式为______B_r_2+_2_K_I_=_=_2_K_B_r_+。I2
①萃取剂必须具备的三个条件:
萃取剂和原溶剂互不相溶、不反应;
萃取剂和溶质互不发生反应;
溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度。
②萃取和分液的主要仪器是分液漏斗。
6
【情境·思考】 很多家庭都有如图这样的瓶子,这是把人参、枸杞、灵 芝、鹿茸等中药材放在酒中进行泡制,一段时间以后倒 出饮用,有舒筋活血之功效,你知道药材放在酒中泡制 的原理吗?
提示:泡制药酒从化学上解释实际上属于固液萃取,中 药材中的有效成分在泡制过程中转移到酒精中,通过饮 用药酒达到一定药效。
7
碘单质在日常生产和生活中有非常重要的应用,其中碘 酒、碘伏等均是应用广泛的消毒剂。碘酒的主要成分 是碘、乙醇、碘化钾,是一种外用的药,可以对皮肤进 行消毒处理。碘伏的主要成分是单质碘与聚乙烯吡咯酮 (Povidone)的不定型结合物,能够杀灭芽孢、原虫、病 毒、真菌、细菌,挫伤、擦伤、切割伤、冻伤、烧伤等 各种外伤都可以利用碘伏进行处理。
15
【活动探究】将Br-转化为Br2
【实验用品】 NaBr溶液、氯水、四氯化碳 【实验步骤】 在一支试管中加入2~3 mL NaBr溶液,滴加少量新 制氯水,再滴加少量CCl4,振荡,静置。
现象及结论:液体分层, 上层为无色溶液,下层 为橙红色液体。反应 的化学方程式为 Cl2+2NaBr==2NaCl+Br2
16
海水中提取溴的原理分析
根据以上实验和同主族元素性质递变规律可知,由于氧 化性Cl2>Br2,所以可以用氯气氧化法得到溴单质然后再 用有机溶剂萃取的方式从海水中提取溴单质。
17
【思考讨论】
(1)从海水中提取溴、碘和海水中提取食盐的原理相同 吗?为什么?
不同。海水提取食盐为物理变化,而 溴、碘的提取为化学变化。
