高三化学专题复习之强弱电解质电离平衡
高三化学总复习课时1 弱电解质的电离

高三总复习专题八 ----- 水溶液中的离子平衡课时1 弱电解质的电离考点一 弱电解质的电离1.强、弱电解质(1)概念(2)与化合物类型的关系 强电解质主要是大部分离子化合物及某些共价化合物。
弱电解质主要是某些共价化合物。
2.弱电解质的电离平衡 (1)电离平衡的建立 在一定条件下(如温度、压强等),当弱电解质电离成离子的速率和离子结合成分子的速率相等时,就达到了电离平衡状态。
(2)电离平衡的特征(3)外界条件对电离平衡的影响①内因:弱电解质本身的性质。
②外因:a .温度:升高温度,电离平衡向电离方向移动,电离程度增大,原因是电离过程吸热。
b .浓度:加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。
c .同离子效应:例如向CH 3COOH 溶液中加入CH 3COONa 固体,溶液中c (CH 3COO -)增大,CH 3COOH 的电离平衡向左(填“左”或“右”)移动,电离程度减小,c (H +)减小,pH 增大。
一元强酸与一元弱酸的比较 比较项目酸 c (H +) pH 中和碱的能力 与足量活泼金属反应产生H 2的量 与金属反应的起始速率 一元强酸大 小 相同 大一元弱酸 小 大 相同 小探究思考1.判断下列电离方程式的书写是否正确,如有错误请改正。
(1)熔融状态下NaHSO 4的电离:NaHSO 4 === Na ++ H ++ SO 42- ( )(2)H 2CO 3的电离: H 2CO 3 ⇋ 2H ++ CO 32- ( )(3)Fe(OH)3的电离:Fe(OH)3 ⇋ Fe 3++ 3OH - ( )(4)水溶液中NaHSO 4的电离: NaHSO 4=== Na ++ HSO 4- ( ) 2.以0.1 mol·L -1CH 3COOH 溶液为例:探究外界条件对电离平衡的影响,请完成表格:实例(稀溶液) CH 3COOH H ++CH 3COO - ΔH >0改变条件 平衡移动方向 n (H +) c (H +) 导电能力 K a 加水稀释 加入少量冰醋酸 通HCl(g) 加NaOH(s) 加入镁粉 升高温度【示例1】 (2013·福建,8)室温下,对于0.10 mol·L -1的氨水,下列判断正确的是( )。
化学电离平衡与浓度的关系

化学电离平衡与浓度的关系电离平衡是高中化学必考的一个专题,电离平衡与浓度的关系是比较难理解的学问点,复习强电解质还简单一些,弱电解质会给大家带来许多困惑,下面就强电解质和弱电解质及其电离平衡加以系统梳理,关心大家更好地学懂电离平衡学问。
强电解质和弱电解质(1)电离平衡在肯定条件下(如温度、浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,叫电离平衡。
(2)电离平衡特点①动态平衡:电离过程和分子化过程并未停止。
②固定不变:在肯定条件下平衡建立后,溶液中弱电解质分子及其电离出的各离子浓度都将保持不变。
③相对性:平衡建立在特定的条件下,当条件发生转变时,平衡发生相应的移动(3)影响弱电解质电离程度大小的因素a、打算因素:弱电解质的相对强弱弱电解质的相对强弱;(打算)电离程度的大小(推断) 弱电解质的相对强弱与弱电解质分子结构有关,取决于其分子中共价键的极性强弱,是该电解质分子的“本性”。
b、环境因素①浓度的影响:对于同一弱电解质,通常溶液越稀,电离程度越大;将溶液稀释时,电离平衡向着电离方向移动,电离程度变大,溶液中各离子物质的量变大,但离子浓度变小(溶液体积变大的原因)②温度影响:弱电解质的电离过程一般是吸热的,△H0.上升温度电离平衡向着电离方向移动,即电离程度增大。
(讲到电离度时必需指明条件(温度、浓度),温度若不注明,一般为25△)③加入具有相同离子物质(同离子效应)在弱电解质中加入与弱电解质相同离子的强电解质,电离平衡逆向移动④化学反应(4)电离平衡常数在弱电解质溶液中加入能与弱电解质电离产生的某种离子发生反应的物质,可使电离平衡向电离的方向移动。
a、定义:在肯定条件下,弱电解质的电离达到平衡时,溶液中电离所生成的各种离子浓度乘积跟溶液中未电离的分子浓度的比是一个常数,这个常数叫电离平衡常数,简称电离常数,用K表示(酸用Ka表示,碱用Kb表示)b、电离常数的影响因素①电离常数随温度变化而变化,但由于电离过程中热效应较小,温度转变对电离常数影响不大,其数量及一般不变,所以室温范围内可忽视温度对电离常数的影响。
高考化学弱电解质的电离平衡

2.电离平衡常数的应用 (1)判断弱酸(碱)的相对强弱。电离常数越⑥ 大 ,酸性(或碱性)越 强。 (2)判断盐溶液的酸(碱)性强弱。电离常数越大,对应盐的水解程度越⑦
小 ,盐溶液的碱(酸)性越⑧ 弱 。 (3)判断复分解反应能否发生。一般遵循“强酸制弱酸”规律。 (4)判断粒子浓度比值的变化。 (5)判断电离平衡的移动方向。当Qc>K时,平衡⑨ 逆向 移动;当Qc=K 时,达到平衡状态;当Qc<K时,平衡⑩ 正向 移动。
自主测评 1.判断正误(正确的画“√”,错误的画“✕”)。
(1)电离常数受溶液浓度的影响 ( ✕ ) (2)电离常数可以表示弱电解质的相对强弱 ( √ )
(3)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大
(✕ )
(4)H2CO3的电离常数表达式:Ka= c2 (H ) c(CO32 ) ( ✕ ) c(H2CO3 )
2.弱电解质的电离平衡
(1)电离平衡的建立
(2)电离平衡的特征
(3)影响电离平衡的外界条件
外界条件
温度
升高温度
浓度
稀释溶液
加入含有与弱电解质相 同离子的强电解质
加入能与弱电解质电离出的离子反应的物质
电离平衡 移动方向 向⑨ 右 移动 向 右 移动 向 左 移动
向 右 移动
电离程 度变化 ⑩ 增大 增大 减小
7.已知:NH3·H2O NH 4 +OH- ΔH>0,对于0.1 mol·L-1的氨水,改变条件 时,请将正确结果填入下表空白处:
改变的条件
平衡移 动方向
n(OH-)
c(OH-)
导电能力
Kb
加NaOH固体
高考化学复习专题训练—弱电解质的电离平衡(含解析)

高考化学复习专题训练—弱电解质的电离平衡(含解析)A组基础必做题1.下列说法正确的一组是(B)①不溶于水的盐都是弱电解质②可溶于水的盐都是强电解质③0.5mol·L-1一元酸溶液中H+浓度为0.5mol·L-1④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子⑥熔融的电解质都能导电A.①③⑤⑥B.只有④⑤C.②④⑤⑥D.只有③⑥[解析]①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅是易溶于水的弱电解质,故②错误;③0.5mol·L-1一元酸溶液中H+浓度不一定为0.5mol·L-1,如醋酸不完全电离,H+浓度小于0.5 mol·L-1,故③错误;④H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,所以强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,故④正确;⑤电解质溶液中的自由移动的阴阳离子在外加电场的作用下定向移动而导电,故⑤正确;⑥酸为共价化合物,在熔融态时均以分子形式存在,不能电离,没有自由移动的离子,均不导电;只有溶于水时才电离出离子而导电,故⑥错误。
2.(2022·河南南阳模拟)下列实验事实能说明HNO2是弱电解质的是(B)①HNO2溶液能与NaHCO3溶液反应,放出气体②用HNO2溶液做导电性实验,灯泡很暗③HNO2溶液不与Na2SO4溶液反应④0.1mol·L-1HNO2溶液中,c(H+)=0.015mol·L-1⑤相同浓度时,HNO2溶液的导电能力比盐酸弱⑥取0.1mol·L-1HNO2溶液200mL,加水至体积为2L,pH<2A.②④③B.④⑤⑥C.①③④D.①④⑤⑥[解析]①HNO2溶液能与NaHCO3溶液反应,放出气体,说明亚硝酸酸性大于碳酸,但是不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱酸,故错误;②用HNO2溶液做导电性实验,灯泡很暗,说明溶液中离子浓度很小,但是不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱酸,故错误;③HNO2溶液不与Na2SO4溶液反应,但不能说明亚硝酸为弱酸,只能说明二者不具备复分解反应条件,故错误;④0.1mol·L-1HNO2溶液中,c(H+)=0.015mol·L-1,则亚硝酸部分电离,为弱电解质,故正确;⑤相同浓度时,HNO2溶液的导电能力比盐酸弱,HCl是强电解质,则亚硝酸电离程度小于HCl,所以亚硝酸为弱电解质,故正确;⑥取0.1mol·L-1HNO2溶液200mL,加水至体积为2L,pH<2,说明亚硝酸存在电离平衡,为弱酸,故正确。
2022年高考化学总复习:弱电解质的电离平衡

2022年高考化学总复习:弱电解质的电离平衡复习目标 1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。
考点一弱电解质的电离平衡1.弱电解质(1)概念(2)与化合物类型的关系强电解质主要是大部分离子化合物及某些共价化合物;弱电解质主要是某些共价化合物。
2.弱电解质的电离概念(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征①开始时,v(电离)最大,而v(结合)为0。
②平衡的建立过程中,v(电离)>v(结合)。
③当v(电离)=v(结合)时,电离过程达到平衡状态。
3.外因对电离平衡的影响以0.1mol·L-1CH3COOH溶液为例,填写外界条件对CH3COOH CH3COO-+H+ΔH>0的影响。
改变条件平衡移动方向n(H+)c(H+)导电能力K a加水稀释向右增大减小减弱不变加入少量冰醋酸向右增大增大增强不变通入HCl(g)向左增大增大增强不变加NaOH(s)向右减小减小增强不变加CH3COONa(s)向左减小减小增强不变升高温度向右增大增大增强增大(1)当氨水电离处于平衡状态时,c(NH3·H2O)=c(NH+4)(×)错因:弱电解质的电离程度很小,只有少部分电离。
(2)强电解质都是离子化合物(×)错因:许多共价化合物如强酸、氯化铝等都是强电解质。
(3)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大(×)错因:0.1mol·L-1CH3COOH加水稀释,醋酸分子浓度、醋酸根离子浓度、氢离子浓度均减小。
(4)电离平衡向右移动,弱电解质的电离程度一定增大(×)错因:温度不变时,向溶液中加入弱电解质,电离平衡向右移动,弱电解质的电离程度减小。
弱电解质的电离平衡---专题复习

【学习目标】1、会判断强弱电解质、会书写电离方程式。
2、说出电离常数的意义和影响因素,会书写其表达式。
3、说出影响电离平衡的外界条件,并会判断移动方向。
【知识点一】强弱电解质的比较和判断1、为什么0.1mol/L的盐酸比0.1mol/L的醋酸的导电能力强?2、强电解质和弱电解质的本质区别是什么?电解质电离的条件是溶于水或熔融状态,为什么区别强弱电解质不根据熔融状态呢?在溶液中强弱电解质的成分有什么区别?弱电解质的溶液中主要的微粒是什么?3、强电解质的溶解度、溶液的导电能力一定比弱电解质强吗?4、哪些类别的物质是强电解质?哪些类别的物质是弱电解质?5、写出下列物质的电离方程式①CH3COOH②NH3•H2O③Fe(OH)3④AlCl3⑤(NH4)2SO4⑥H2CO3⑦H3PO4 【由此可总结】1、强电解质一定比弱电解质强,不一定强。
2、电离方程式书写注意事项:【知识点二】弱电解质的电离平衡在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:1、“O”点为什么不导电?2、在a点溶液中存在什么过程?3、为什么从0→a溶液的导电能力增强?b点导电能力最强?从b点到c点导电能力减弱?从b点到c点溶液中所有离子的浓度都减小吗?4、画出v--t图像【由此归纳】电离平衡过程的建立和特征【知识点三】影响电离平衡的因素1、举例说明影响弱电解质电离平衡的因素。
2、平衡移动方向和电离程度的关系。
【知识点四】电离常数1、书写“知识点一”中①②⑥⑦弱电解质的电离常数表达式,2、影响因素【难点突破】1、常温下,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3·H2O的电离常数bK=mol·L-1。
2、常温下,CH3COO-的水解常数Kh=5.9×10-10,求CH3COOH 的电离常数Ka?【当堂达标】1、下列物质的分类组合全部正确的是()。
高三化学 电解质溶液(一)——电离平衡 知识精讲 通用版
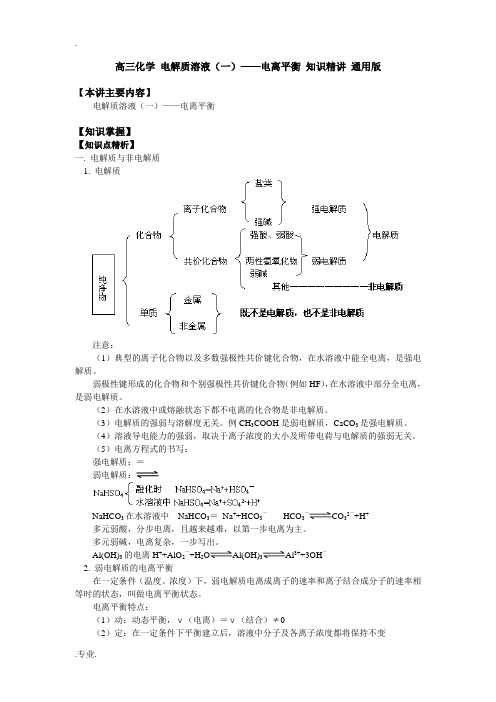
高三化学电解质溶液(一)——电离平衡知识精讲通用版【本讲主要内容】电解质溶液(一)——电离平衡【知识掌握】【知识点精析】一. 电解质与非电解质1. 电解质注意:(1)典型的离子化合物以及多数强极性共价键化合物,在水溶液中能全电离,是强电解质。
弱极性键形成的化合物和个别强极性共价键化合物(例如HF),在水溶液中部分全电离,是弱电解质。
(2)在水溶液中或熔融状态下都不电离的化合物是非电解质。
(3)电解质的强弱与溶解度无关。
例CH3COOH是弱电解质,CaCO3是强电解质。
(4)溶液导电能力的强弱,取决于离子浓度的大小及所带电荷与电解质的强弱无关。
(5)电离方程式的书写:强电解质:=弱电解质:NaHCO3在水溶液中NaHCO3=Na++HCO3-HCO3-CO32-+H+多元弱酸,分步电离,且越来越难,以第一步电离为主。
多元弱碱,电离复杂,一步写出。
Al(OH)3的电离H++AlO2-+H2O Al(OH)3Al3++3OH-2. 弱电解质的电离平衡在一定条件(温度、浓度)下,弱电解质电离成离子的速率和离子结合成分子的速率相等时的状态,叫做电离平衡状态。
电离平衡特点:(1)动:动态平衡,ν(电离)=ν(结合)≠0(2)定:在一定条件下平衡建立后,溶液中分子及各离子浓度都将保持不变(3)变:平衡建立在特定条件下,当条件发生改变时,平衡发生相应的移动影响电离平衡的因素:电离平衡是化学平衡的一种,化学平衡的所有原理都适合于电离平衡。
电离平衡的移动,符合勒夏特列原理。
(1)温度的影响:弱电解质的电离是吸热过程,升高温度,会促进电离(2)浓度的影响:溶液浓度越小,越有利于电离。
如加水稀释,会促进电离(3)同离子效应:加入与弱电解质具有相同离子的强电解质,会抑制弱电解质的电离(4)能反应的离子:加入与弱电解质电离出的离子能反应的离子,会促进弱电解质的电离3. 水的电离和溶液的pH(1)水的电离水是极弱的电解质H2O H++OH-或2H2O H3O++OH-25℃时纯水中c(H+)=c(OH-)=10-7mol/L(2)水的离子积常数25℃时,K W=c(H+)·c(OH-)=10-14K W叫做水的离子积常数,简称水的离子积。
考点42 弱电解质的电离平衡-备战2020年高考化学考点一遍过

专题42 弱电解质的电离平衡一、强、弱电解质的相关判断1.概念和种类2.电离、电解质、非电解质、强电解质和弱电解质的相互关系3.强、弱电解质与化合物类型的关系强电解质主要是大部分的离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
分类举例强电解质①强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI等②强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2等③大多数盐:钠盐、钾盐、硝酸盐等弱电解质①弱酸:CH 3COOH 、H 2CO 3、HF 、HCN 、HClO 、H 2S 等;H 3PO 4、H 2SO 3是中强酸,也属于弱电解质②弱碱:NH 3·H 2O ,多数不溶性的碱[如Fe(OH)3、Cu(OH)2等]、两性氢氧化物[如Al(OH)3等] ③水:是极弱的电解质注意:电解质的强弱是由物质的内部结构决定的,与外界因素无关,关键是看在水溶液中是否完全电离。
(1)与溶解性无关。
如BaSO 4等虽难溶于水,但溶于水的部分却能完全电离,是强电解质。
醋酸能与水互溶但不能完全电离,是弱电解质。
(2)与溶液的导电性无必然联系,溶液的导电性与溶液中的离子浓度、离子所带电荷的多少有关,强电解质溶液的导电能力不一定强,如饱和的BaSO 4溶液,弱电解质溶液的导电能力不一定弱,如较浓的CH 3COOH 溶液。
4.电离方程式的书写①弱电解质a .多元弱酸分步电离,且第一步电离程度远远大于第二步,如H 2CO 3电离方程式:H 2CO 3H ++3HCO -,3HCO -H ++23CO -。
b .多元弱碱电离方程式一步写成,如Fe(OH)3电离方程式:Fe(OH)3Fe 3++3OH -。
②酸式盐a .强酸的酸式盐完全电离,如NaHSO 4电离方程式:NaHSO 4===Na ++H ++24SO -。
b .弱酸的酸式盐中酸式酸根不能完全电离,如NaHCO 3电离方程式:NaHCO 3===Na ++3HCO -,3HCO -H ++23CO -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题六:强弱电解质、电离平衡
【考纲要求】
1.能力要求:
◆会判断、比较常见的强弱电解质;能运用弱电解质的电离平衡知识判断电离平衡移动的方向;能进行溶液酸碱性的判断及有关溶液PH值的计算。
2.知识要求
◆了解电解质和非电解质、强电解质和弱电解质的概念。
◆了解水的电离、溶液pH等概念。
◆了解强酸强碱中和滴定的原理。
◆理解弱电解质的电离平衡概念。
◆能正确书写电离方程式。
【基础知识】
1.强弱电解质的判断及其导电能力
在能导电的叫电解质,在
叫非电解质;在叫强电解质,在叫弱电解质,溶液的导电能力与
有关,强电解质溶液的导电能力(填“一定”或“不一定”)比弱电解质溶液的导电能力强。
2.弱电解质的电离平衡
只有才能在一定条件下建立电离平衡,如
电离平衡的移动符合化学平衡移动原理(勒夏特列原理)。
决定电解质电离程度大小的因素是,影响平衡移动的因素主要有。
加水稀释电离平衡移动,电离程度;升高温度电离平衡移动(电离过程吸热)。
如加入与弱电解质具有相同离子的强电解质,会由于同离子效应而使平衡移动,弱电解质的电离程度。
3.水的电离、溶液pH值
(1)水是一种极弱电解质,它的电离方程式为,在25℃时,纯水中H+和OH-的浓度各等于1×10-7mol·L-1,则Kw= ,Kw只与有关。
影响水的电离平衡的主要因素有。
(2)溶液pH= ,溶液的酸碱性与pH关系:
任何温度下温度为25℃时
()+H c> ()-
c酸性()+H c> L
OH
107-pH< 7
mol/
()+H c= ()-
c中性()+H c= L
OH
107-pH= 7
mol/
()+H c< ()-
c碱性()+H c< L
OH
107-pH> 7
mol/
4.强酸强碱中和滴定的原理:
用的方法叫做酸碱中和滴定,原理(用计算公式表示),中和滴定的两条关键:用准确量取;用准确判断。
5.写出下列物质的电离方程式
NaHCO3NH3·H2O
CH3COOH NaHSO4
【典型例题】
【例1】(20XX年高考理综天津卷)25 ℃时,水的电离达到平衡:H 2O H++OH-;∆H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
[答案]B
【例2】(20XX年全国卷)将纯水加热至较高温度,下列叙述正确的是()A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
答案:D
【方法与技巧】
1.强弱电解质与物质类别关系:
(1)强电解质:强碱、盐等离子化合物(低价金属氧化物),
强酸等某些极性共价化合物;
(2)弱电解质:弱酸、弱碱、水等具有极性共价键的共价化合物。
2.溶液酸碱性判定规律
(1) pH相同的酸(或碱),酸(或碱)性越弱,其物质的量浓度越大。
(2) pH相同的强酸和弱酸溶液,加水稀释相同的倍数,则强酸溶液pH变化大;碱也如此。
(3) 酸与碱的pH之和为14,等体积混合
①若为强酸与强碱则pH=7;
②若为强酸与弱碱则pH>7;
③若为弱酸与强碱则pH<7。
(4) 等体积强酸和强碱混合
①若二者pH之和为14,则溶液呈中性,pH=7;
②若二者pH之和大于14,则溶液呈碱性;
③若二者pH 之和小于14,则溶液呈酸性。
【巩固提高】
1
2. 下列不能证明乙酸是弱酸的事实是 ( )
A .L mol /1.0乙酸溶液的pH 约为7.2
B .L mol /1的COONa CH 3溶液的pH 约为9
C . 乙酸溶液的导电能力比盐酸弱
D . 将L mol /1.0COOH CH 3稀释100倍,测其pH 变化不到2个单位
3.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A .再通入少量氯气,c (H +)/c (ClO -)减小
B .通入少量SO 2,溶液漂白性增强
C .加入少量固体NaOH ,一定有c (Na +)=c (Cl -)+c (ClO -)
D .加入少量水,水的电离平衡向正反应方向移动
4.下列叙述正确的是 ( )
A .95 ℃纯水的pH <7,说明加热可导致水呈酸性
B .pH = 3的醋酸溶液,稀释至10倍后pH = 4
C .0.2 mol·L -1的盐酸,与等体积水混合后pH = 1
D .pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
5.甲酸和乙酸都是弱酸,当它们的浓度均为0.01mol•L -1时,甲酸中的c (H +)约为乙酸中的3倍。
现有两种浓度不等的甲酸溶液a 和b ,以及0.01mol•L -1的乙酸,经测定它们的pH 从大到小依次为a 、乙酸、b 。
由此可知:( )
A .a 的浓度必小于乙酸的浓度
B .a 的浓度必大于乙酸的浓度
C .b 的浓度必小于乙酸的浓度
D .b 的浓度必大于乙酸的浓度
6.室温下,下列溶液等体积混合后,所得溶液的pH 一定大于7的是( )
A .0.1mol/L 的盐酸和0.1mol/L 的氢氧化钠溶液
B . 0.1mol/L 的盐酸和0.1mol/L 的氢氧化钡溶液
C . pH =4的醋酸溶液和pH =10的氢氧化钠溶液
D . pH =4的盐酸和pH =l0的氨水
7.等体积混合L mol /1.0盐酸和L mol /06.0()2OH Ba 溶液后,溶液的pH 等于( )
A . 2
B . 2.3
C .6
D .12
8.某溶液中由水电离产生的C(H +)=1×10-10mol/L ,该溶液的溶质不可能是( )
A .KOH
B .Na 2CO 3
C .HClO 4
D .MgSO 4
9.25℃时,某溶液中由水电离产生的C (H +)和C (OH -
)的乘积为1×10-20,下列说法正确的是
A .该溶液的pH 一定是10
B .该溶液的pH 一定是4
C .该溶液的pH 不可能是7
D .不会有这样的溶液
10.等量的NaOH 分别与pH=2和pH=3的醋酸恰好中和,消耗二者的体积依次为V 1和V 2,则V 1、V 2的关系为( )
A . V 1=10V 2
B .V 1<10V 2
C .V 1>V 2
D .V 2>10V 1
11.两人用同一瓶标准盐酸滴定同一瓶NaOH 溶液,甲将锥形瓶用NaOH 待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中。
乙则用甲用过的碱式滴定管取碱液于刚用水洗过且存有蒸馏水的锥形瓶中,其它操作及读数全部正确,下列说法正确的是 ( )
A .甲操作有错
B .乙操作有错
C .甲测定数值一定比乙小
D .甲测定数值一定比乙大 12.下列说法中正确的是( )
A .100 mL pH=3的盐酸和醋酸溶液,与足量锌反应时,起始时二者产生氢气的速率基 本相等.
B .100 mL 1 mol·L -1的盐酸和50 mL 2 mol·L -1的盐酸分别与足量的锌反应,两者放出氢气
的速率和质量均相等.
C .100 mL pH=3的盐酸和醋酸溶液,与足量锌反应后,所得氢气的质量相等.
D .100 mL pH=1的硫酸和盐酸溶液,与足量锌反应后,前者放出氢气的质量是后者放出氢气质量的2倍.
13.准确称量2.0g 硫酸铵样品放入烧杯中,加入足量的碱液,高温加热至沸腾,将逸出的氨气吸收在100ml 0.25mol/L 的硫酸溶液中,然后用0.50mol/LNaOH 溶液进行滴定,当滴入40.00ml 时恰好完全中和。
则原硫酸铵样品的纯度是 .
14.现有pH=2的HCl 溶液100ml ,要使它的pH=3,如果加入蒸馏水,需加水 ml ;如果加入PH=4的HCl 溶液,需加入此HCl 溶液_______mL 。
