第三章 消除反应
消除反应

化学术语
01 内容简介
03 反应速率 05 反应机理
目录
02 分类 04 消除规则
消除反应又称脱去反应或是消去反应,是指一种有机化合物分子和其他物质反应,失去部分原子或官能基 (称为离去基)的有机反应。消除反应发生后,生成反应的分子会产生多键,为不饱和有机化合物。消除反应可 使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度。
内容简介
消除反应 (elimination reaction)又称脱去反应或消去反应,是一种有机反应,一般为一有机化合物分子 和其他物质反应,失去部分原子或官能团(称为离去基)。反应后的分子会产生多键,为不饱和有机化合物。消 除反应分为下列两种:β消除反应:较常见,一般生成烯类。α消除反应:生成卡宾类化合物。离去基所接的碳 为α碳,其上的氢为α氢,而隔壁相邻接的碳及氢则为β碳及β氢。化合物会失去β氢原子的称为 β消除反应, 会失去α氢原子的称为α消除反应。
有些反应物在 β碳原子上连有比氢更容易被路易斯碱(见酸碱理论)作用的基团或者根本没有 β氢,它们 就有可能发生不涉及失去 β氢的消除。连二卤代烷在碘离子或锌的作用下发生的脱卤反应和 α,α-二烷基β -卤代酸的脱羧反应都属于这种情况。
谢谢观看
在E1C和E1CB中,反应均分两步进行,各自的活性中间体碳正离子和碳负离子都具平面结构,一般不存在立 体选择性问题。但在E2中,只有离去基团、α和β碳及β氢四者处于共平面的空间位置,才有利于协同反应的进 行,而符合这种要求的空间排列有两种:离去基团和β氢在α、β碳同一边时,发生顺式消除;离去基团和β氢在 α、β碳的两边时,发生反式消除。在大多数情况下,E2为反式消除,但不排除顺式消除的可能性,甚至有些反 应物由于结构的限制,只能发生顺式消除。
第章卤代烃消除反应
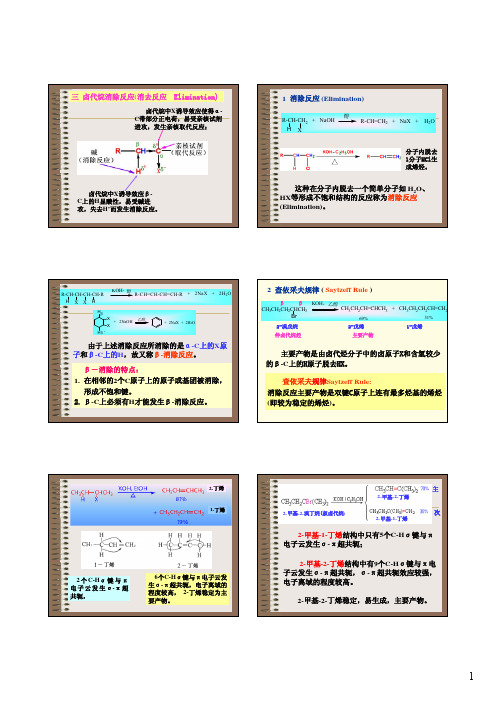
2-丁烯 1-丁烯
2 个 C-Hσ 键 与 π 电 子 云 发 生 σ-π 超 共轭,
6个C-Hσ键与π电子ቤተ መጻሕፍቲ ባይዱ发 生σ-π超共轭,电子离域的 程度较高, 2-丁烯稳定为主
要产物。
主
2-甲基-2-丁烯
2-甲基-2-溴丁烷(叔卤代烷)
次
2-甲基-1-丁烯
2-甲基-1-丁烯结构中只有5个C-Hσ键与π 电子云发生σ-π超共轭;
生成新的化合物。
3
小结 对E1反应而言,碳正离子的稳定性 叔碳正离子 > 仲碳正离子 > 伯碳正离子
对E2反应而言,生成的烯烃稳定性: 叔卤代烷 > 仲卤代烷 > 伯卤代烷
不论是E1机制和E2机制,不同卤代烷的消 除反应活性次序相同:
叔卤代烷 > 仲卤代烷 >伯卤代烷
五、卤烷的亲核取代反应与消除反应的关系
三 卤代烷消除反应(消去反应 Elimination)
卤代烷中X诱导效应使得αC带部分正电荷,易受亲核试剂 进攻,发生亲核取代反应;
卤代烷中X诱导效应βC上的H显酸性,易受碱进 攻,失去H+而发生消除反应。
1 消除反应 (Elimination)
R-CH-CH2 + NaOH 醇 HX
R-CH=CH2 + NaX + H2O
CH3CH2CH=CHCH3 + CH3CH2CH2CH=CH2
Br
69%
31%
2-溴戊烷
2-戊烯
1-戊烯
仲卤代烷烃
主要产物
主要产物是由卤代烃分子中的卤原子X和含氢较少 的β-C上的H原子脱去HX。
查依采夫规律Saytzeff Rule: 消除反应主要产物是双键C原子上连有最多烃基的烯烃 (即较为稳定的烯烃)。
消除反应

主要
与例2底物相同
KOH为强碱
可能经过E2 + E1 机理
®山东农业大学化学学院
例4:解释下列消除产物的生成机理
CH3 EtOH CH CH3 CH3 H3C C C CH3 CH3 + CH3 H2C C CH CH3 CH3
H3C
C
CH3 Br
E1机理+ 正碳离子重排
a
Br CH3 H3C C H3C CH Br CH3 - Br H3 C CH3 C CH3
CH3 (H3C)2HC CH3 CH3
C2H5O (H3C)2HC
+
Cl I CH3 Cl (H3C)2HC II
(H3C)2HC
25%
75%
C2H5O (H3C)2HC
CH3
消除速率
I : II = 200 : 1
唯一产物
®山东农业大学化学学院
化合物I的反应解释
稳定的构象
a CH3 C2H5O H H b
Ph
H
为E2反式消除机理
Ph H3C Br
b a
EtO H H
H
Ph H Br
EtO Ph Ph
H H CH3 Br Ph C H3C C H Ph
Ph
Ph H3C
伞形式
Newman投影式
转变为H和Br反式共平面构象
®山东农业大学化学学院
例:解释下列两个异构体在相同反应条件下的不同反应结果
(环状化合物的E2消除)
(89.2%)
Ar +
(10.8%)
Ar
Ha OTs
Ha与芳环同碳相连,其活泼性比Hb高, ®山东农业大学化学学院 故发生顺式消除。
消除反应的概念

消除反应的概念1. 哎呀,小伙伴们!今天咱们来聊个听起来挺高大上的话题——消除反应。
别被这名字唬住啦,其实它就像是化学界的"和事佬",专门调解那些闹别扭的化学反应。
咱们一起来瞧瞧这个有意思的概念吧!2. 说到消除反应,咱们得先搞清楚它是干啥的。
简单来说,就是让两个原本要打架的化学物质变得和和气气的。
就像是化学界的"和平使者",把两个剑拔弩张的家伙拉到一起,说:"来来来,都别吵了,握个手言和吧!"3. 这消除反应啊,说白了就是在一个反应里同时进行两个相反的过程。
听起来有点绕口是不是?别着急,咱们打个比方。
就像是你左手拿着个苹果,右手拿着个梨,然后两只手同时往嘴里塞。
结果呢?你嘴里既有苹果味儿又有梨味儿,但是谁也不压倒谁,就这么和谐共处了。
4. 在化学反应中,消除反应就像是两个小朋友在玩跷跷板。
一个上去,另一个就下来,反反复复,谁也不让谁。
最后呢?两个小朋友都玩得开心,谁也不吃亏。
这就是消除反应的妙处,让两个本来要打架的反应和平相处,谁也不欺负谁。
5. 咱们再举个例子。
想象一下,你有一瓶可乐和一包曼妥思。
正常情况下,把曼妥思丢进可乐里,那场面,啧啧,简直就是小型喷泉啊!但是如果咱们来个消除反应,就好比在可乐里加了个"定心丸",曼妥思进去了,可乐连个泡都不冒。
这就是消除反应的魔力!6. 说到这儿,有小伙伴可能要问了:"这消除反应听起来挺神奇的,那它在实际生活中有啥用啊?"哎呀,这问题问得好!消除反应在工业生产中可是大有用处。
比如说,在制造某些化学品的时候,如果反应太猛烈,可能会把设备给炸飞喽。
这时候,消除反应就像是一个温柔的刹车,让整个过程变得平稳又安全。
7. 再给大家举个有意思的例子。
想象一下,你在泡澡,水温刚刚好。
这时候你想加点热水,但又怕水变太烫。
这时候,你一边放热水,一边放冷水,保持水温不变。
这不就是生活中的消除反应吗?两个相反的过程同时进行,最后达到一个平衡。
消除反应

+
主产ffmann消除 主产物
(CH3)3COK
(CH3)3COH
+
次产物
一般消除反应服从Saytzeff规则,原因为: 对E1反应,在反应第二步(由正碳离子到烯烃),考察过渡 态的活化能,双键碳上连有烷基较多的烯烃,其过渡态的 活化能较低,反应速率较快,故产物较多。
CH3CH=CH2 + (CH3)2CHOC2H5
3.2 消除反应的区域选择性
卤代烷分子中含有两种或几种β-氢,其消除反应可在不 同方向进行,生成不同的烯烃:其中一种是生成取代基 多的烯烃(Saytzeff消除);另一种是生成取代基少的烯烃 (Hoffmann消除)。如:
C2H5ONa
Br Br
C2H5OH
过渡态 正碳离子 反应物 Hoffmann产物
能 量
Saytzeff产物
反应进程
在E2反应过渡态中,π键已部分形成,因此,影响烯烃稳 定性的因素在一定程度上也影响生成它的过渡态,一般双 键碳上烷基取代多的烯烃较稳定,生成它的过渡态也稳定, 相应的活化能较低,反应速度较快,产物中所占比例也较 大。
过渡态 能 量
反应物
Hoffmann产物 Saytzeff产物
反应进程
若用体积较大的强碱作试剂,则有利于末端双键的形成, 即以Hoffmann消除为主。如:
C2H5O-
29%
CH3CHCH2CH3 Br
(CH3)3CO-
CH2=CH-CH2-CH3
66%
由于仲或叔碳上的烷基对体积大的碱接近仲或叔氢有 位阻作用,因此试剂优先进攻没有位阻的伯氢。
如下氯代烷进行溶剂解所得产物比例:
CH3
CH3CH2-C-Cl CH3 CH3 CH3 CH3 CH3 CH3 CH3 Cl CH3 CH3
消去反应

卤代烃(主要是卤代烷烃)和醇的消去反应规律(1)查依采夫规则:卤代烃、醇在消去HX、H2O等小分子时,氢原子总是从含氢较少的碳原子上脱去;(2)与卤原子连接的碳原子相邻的碳原子上没有氢原子的卤代烃,与羟基连接的碳原子相邻的碳原子上没有氢原子的醇,不能发生消去反应,且主链碳为2个。
消除反应又称脱去反应或消去反应[1],是一种有机反应。
是指一有机化合物分子和其他物质反应,失去部分原子或官能团(称为离去基)。
反应后的分子会产生多键,为不饱和有机化合物。
消除反应分为下列两种:β脱去反应:较常见,一般生成烯类。
α脱去反应:生成卡宾类化合物。
离去基所接的碳为α碳,其上的氢为α氢,而隔壁相邻接的碳及氢则为β碳及β氢。
化合物会失去β氢原子的称为β脱去反应,会失去α氢原子的称为α脱去反应。
消除反应使反应物分子失去两个基团(见基)或原子,从而提高其不饱和度的反应。
[编辑本段]分类按失去的两个基团在分子中的相对位置进行分类。
1,2-消除(β-消除)为处于相邻原子上的两个基团失去后在这两个原子之间生成π键(见共价键)的反应。
两个原子都是碳原子时就发生成烯消除反应:1,1-消除(α-消除)为同一原子上的两个基团失去后该原子形成不带电荷的低价结构(如卡宾或氮烯)的反应(式中R为烃基):1,3-消除等为分别连在1,3-或更远的相对位置上的两个基团消除后得到环状产物的反应。
这些反应也可看为分子内取代反应。
[编辑本段]反应速率在离子型1,2-消除反应中,带着成键电子对一起从反应物分子的1位或a碳原子上断裂下来的基团称为离去基团(L),另一个失去基团往往是连在2位或β碳原子上的氢,称为β氢原子。
例如,1-溴丁烷与氢氧化钾在乙醇中共热,溴带着键合电子对断裂下来成为溴负离子,β氢原子以质子形式断裂下来与碱中和,同时在1和2位之间形成烯键:这类消除反应的速率与卤代烷结构有关,在相同的条件下以三级卤代烷最快,二级卤代烷次之,一级卤代烷最慢。
第三章消除反应

CHMe2 HH 100% 1 2 3 (IV) 4
氯化萜
Me
CHMe2
1 2 3 (V)
4
CHMe2
(3)通常反式消除占优势,但碱的状态(即以游离状态或是
以离子对存在)能影响顺式与反式作用。 (I)弱电离的溶剂促进不带电荷的离去原子团的顺式消除。
C H R O M X
R O H + M +X C +
第三章
1、消除反应的分类
消除反应
消除反应(Elimination Reaction) 是指从有机分子中排 除去一个小分子或两个原子或基团,生成双键、叁键或环状 结构化合物的反应。 (1)α-消除(或1,1-消除)反应
H R C X R
R C R
(2)β-消除(或1,2-消除)反应
HX R C HC H R H X + R C C R
又如氯代反丁烯二酸脱氯化氢的反应速度比顺式二酸快48倍, 反式消除作用比顺式消除作用占优势。
C l C C H O C 2 H C O H 2 碱 C O H 2 C C +H C l C l C ; C C O H 2 C O H 2 碱 C O H 2 C C C O H 2 +H C l
H C O H 2 反 式 比 顺 式 快 4 8 倍
2、 E1消除反应的立体化学
与E2历程相比, E1历程的反应立体选择性较差。
因为在E1反应中,首先生成具有平面构型的碳正离
子,此时反式消除和顺式消除的几率应该一样。但 是,与SN1反应的立体化学类似,假如,离去基团 尚未充分远离,即碳正离子尚未能形成平面构型之 前,而消除反应已经完成,则优先生成反式消除产
消除反应机理(课堂PPT)

.
2
-消除反应
-消除反应有E1、E2 、E1cb三种反应机制
.
3
E1反应机理
进攻-H
慢
快
E代表消除反应,E1表示单分子消除反应。1代表单分子过程
E1反应分两步进行:
第一步是中心碳原子与离去基团的键异裂,产生活性中间体碳正离子。
这是速控步。 第二步是碱提供一对孤电子,与碳正离子中的氢结合,碳正离子消除一个 质子形成烯。这是快的一步。
CH3
100~200o C
RCH=CH2 + (CH3)3N + H2O
季铵碱在加热条件下(100~200C)发生热分解 生成烯烃的反应称为霍夫曼消除反应。霍夫曼消除反 应遵循霍夫曼规则。
.
13
Hofmann(霍夫曼)规则
四级铵碱热消除时,若有两个-H可以发生 消除,总是优先消去取代较少的碳上的-H。
CH3 CH3C CHCH3 Br
H
C H 3 C H 3C C H C H 3
H
C H 3
O H
C H 3C C H C H 3
H
.
C H 3 C H 3 CC H C H 3
9
RO H
a b
卤代烷E2反应的消除机理
RO-
c
H
c
d
d
X
a b
X
a
c
+ ROH + X-
b
d
反应机理表明 *1 E2机理的反应遵循二级动力学。 *2 卤代烷E2反应必须在碱性条件下进行。 *3 两个消除基团必须处于反式共平面位置。 *4 在E2反应中,不会有重排产物产生。
生成取代较多的稳定烯烃,这称为札依采夫规则。大 多数卤代烷的消除反应遵循札依采夫规则。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-H ,快
+
C
C
反应速度=K[R-L] 与SN1反应类似,都是分两步进行,中间体都是碳正离子, 因此两者常为竞争反应。碳正离子形成后,如果进攻试剂是 亲核试剂,作用于带正电荷的α-碳原子,反应结果为取代反 应;如果进攻试剂是碱,作用于β-氢原子,则反应结果为消 除反应。所以,较强的碱有利于E1反应。
(4)位于β碳原子上的吸电子基,不仅能增加氢原子的酸性, 又能使碳负离子稳定;但若吸电子基团处于α位则几乎没有 影响,除非与双键共轭。 例如Br、Cl、CF3、CN、OTs、NO2、C=O、SR等基 团处于β位都会增加E2消除反应的速率, CF3、 NO2的强吸 电子作用甚至可能将反应移向E1cb历程。 (5) 对于双分子反应(SN2和E2),α碳原子上的支链增多有 利于消除反应;若β碳原子上的烷基多或体积大,因位阻原 因对取代反应(SN2历程)不利,消除反应产物的比例增加。
3、共轭碱单分子消除反应历程(E1cb)
第一步 H k1,慢 B + 第二步 C C X k2 C C + X C C X k-1 C C X + BH
反应速度=K[R-L][B-] 和E1历程相似,E1cb也是两步反应,所不同的是后者的中间 体是碳负离子,前者的中间体是碳正离子。 简单的卤代烷和烷基磺酸酯一般不发生E1cb反应,只有在β -碳原子上连有-NO2 、-C=O 、-CN等吸电子基团时, 有利于按E1cb历程进行反应,因为吸电子的原子团位于β- 碳原子上时,有利于质子转移给碱,并使形成的碳负离子稳 定。
OAc Ph H NO2
OAc
+ CH3O
-
Ph :_ NO2
- CH3COONO2
Ph
3.1.2 消除反应的择向
R R CH R CH X R CH3 R R CH CH CH2 + HX (霍夫曼定则) C CH CH3 + HX (扎依采夫定则)
1、E1历程
决定消除反应的方向,主要是生成的烯类的稳定性,在 此情况下遵从扎依采夫定则,形成在不饱和碳原子上有烃基 最多的烯烃(超共轭来解释)。
δ SN 2
H B +H C C X B C C
δ
X
E2
δ
B
H
C
C
δ
X
δ +B SN1 δ
H
C
C
B
H
C
C
X
- X
H
C
C
+B E1 δ
B
H
C
δ C
(3)在E1反应的过渡态中电荷分散程度比在SN1的过渡态中 大,因此,溶剂极性增大时,E1和SN1均减速,且E1反应减速 更多。因此,总的结果是提高溶剂极性时,所生成烯烃量减少。
(1) 好的离去基团有利于E1历程,而弱的离去基团和带正
电荷,使反应向E2方向转移。 +-
3、试剂的影响(碱的影响)
(1)在单分子反应里,反应速度与碱的强弱和浓度无关。但 增加碱的浓度或使用更强的碱则使反应向E1-E2-E1cb历程转 变; 正常的E2历程可用下列碱来完成:H-,NR3,OH-,-OCOCH3 RO-,ArO-,NH2-,CO32-,I-,CN-,LiAlH4和有机碱。在有机合成中 重要且常用的碱为OH-、RO-和NH2-,通常用它们的共轭酸 H2O、ROH、NH3作溶剂。 (2)强碱对β氢原子和α碳原子作用都很强; 如伯卤代烷与NaOH/H2O反应,取代和消除同时发生。 弱碱和α碳作用较易,难于或甚至不能进攻β氢原子。
EtOH/NaOEt (CH3)2CHBr EtOH/NaOEt CH3CH2Br CH3CH CH2 78% H2C CH2 1% 取代产物 22% CH3CH2OCH2CH3 99%
(6) 对于单分子反应,α碳原子上支链增多时也会增加消 除反应的倾向,这是由于立体效应造成的。
2、离去基团的影响
CHMe2 H H H Me (I) Cl H H Me H 氯化新萜 Me H H (III) H H H Cl CHMe2 Me (II) H H CHMe2 Cl 2 HH 100% 1 3 (IV) 4
氯化萜
Me
CHMe2
25 %
1 2 3 (V)
4
CHMe2
(3)通常反式消除占优势,但碱的状态(即以游离状态或是
CH3 CH3 H3C 较大酸性 H3C C CH CH2 H 霍夫曼产物 86% CH3 C CH CH3
β β ' α C CH CH3 H S(CH3)2
H3C
较小酸性
查依采夫产物 14%
(2)如果β` 碳原子上连有强有力的吸电子原子团,如COR,-NO2,-SO2R,-CN,-C6H5等,遵从扎依采夫法则;
Ph β ' CH2 α CH β CH3 Ph CH 主要 CH2 C H CH2 CH CH3
N(CH3)2
(3)被消除的原子或原子团为电中性时,遵从扎依采夫法 则;
CH3 CH3 H3C β ' CH2 C Br β CH3 H3C H3C CH C CH3
查依采夫产物 81% CH3 CH2 C CH2
X C R RCH CHR HX
R
C
C
H H
R C
通过β-消除不仅可以形成碳碳双键、碳碳叁键,而且还 可以形成碳氧双键、碳硫双键、碳氮双键、氮氮双键和碳氮 三键。 (3)γ—消除(或1,3-消除)反应
H R
X R
R
R +HX
另外还有1,4-消除和1,5-消除反应等等。 本章重点讨论β-消除反应。
热解得到55%~62%的1-丁烯和38%~45%的2-丁烯,这 个比例接近于可利用的氢原子数比3:2。
2、按热裂消除机理的化合物主要有:黄原酸酯、羧酸酯、硫 代羧酸酯、叔胺的N-氧化物。 习题: 写出反应物
1、
2、
例如:1-溴-1,2-二苯丙烷按E2历程进行消除反应时,其中 一对对映体只生成顺式-1,2-二苯丙烯。
B H CH3 Br C6H5 H H C6H5 CH3 H Br C6H5 C6H5 CH3 C6H5 H C6H5
(1R,2R)
又如氯代反丁烯二酸脱氯化氢的反应速度比顺式二酸快48倍, 反式消除作用比顺式消除作用占优势。
CH3 O H CH R O CHR 400~600℃ O H CH R CH3 O CHR O CH3C OH2 RCH CHR
H H H COOC2H5 H OCOCH3 435℃ COOC2H5
1、热消除反应遵从Hofmann规则,反应的取向决定于可利用 的β-H原子数,例如
CH3CH2 CHCH3 OCOCH3
Cl C C HO2C H CO2H 碱 CO2H C + HCl C ; C CO2H Cl C CO2H 碱 CO2H C + HCl C CO2H
H CO2H 反式比顺式快48倍
(2)在六员环中相邻的处于反式的原子或原子团可为直立键 或平伏键,离去原子团的反式交叉构象要求这两个消除的原 子或原子团为直立键,即使这种构象具有较高的能量。
2、双分子消除反应历程(E2)
H C L C + B
-
H C L C
B C C + BH + L
-
反应速度=K[R-L][B-] E2和SN2常为竞争反应,两者的区别在于:带孤对电子 的试剂,如作为亲核试剂进攻α-碳原子时发生SN2反应;如 作为碱进攻β-氢原子时,则发生E2反应。 离去基团(L)可为:X = +NR3, +PR3, +SR2, SO2R, Cl, Br, I, OSO2R, OCOR等; 常用的碱( B- )有:NR3, CH3COO-, HO-, -OR, -NH2和 CO32-等。
5、温度的影响
消除反应活化过程需要拉长C-H键,通常比取代反应 所需活化能大,且活化能越大,温度系数也越大,越容易 受温度的影响。无论是E1还是E2历程,升高温度都有利于 消除反应,因此要得到烯烃常在较高温度下进行反应。
3.1.5 热裂消除反应
在没有酸碱催化情况下,仅籍加热而进行消除,以生成 烯类的反应为热裂消除反应。
3.1 β-消除反应
3.1.1 β -消除反应的历程
β -消除反应既可以在液相中发生,也能在气相中进行 (指热消除反应,后面将要介绍)。在液相中进行的消除反应一 般为离子历程,根据共价键断裂和生成的次序,可分为以下 三种机理。
1、单分子消除反应历程(E1)
- L-, 慢 H C C L H C C
霍夫曼产物 19%
(4)难离去的原子团有利于按霍夫曼定则进行;
t-BuOCH3CH2CH2CH2CHCH3 F CH3CH2CH2CH2CH CH2
(5)如果发生消除反应的化合物的分子中已有双键(C=C或 C=O)存在,并且和新形成的双键共轭,此种共轭产物占优势。
Hale Waihona Puke 3.1.3 消除反应的立体化学
第三章 消除反应
消除反应(Elimination Reaction) 是指从有机分子中排 除去一个小分子或两个原子或基团,生成双键、叁键或环状 结构化合物的反应。
1、消除反应的分类
(1)α-消除(或1,1-消除)反应
H R C R X R C R
(2)β-消除(或1,2-消除)反应
H X
H
R RCH CHR + HX
以离子对存在)能影响顺式与反式作用。 (I)弱电离的溶剂促进不带电荷的离去原子团的顺式消除。
C H RO M X
C
+ ROH + M + X
