第4章缩合反应分析
酮缩合反应
Chapter 4 Condensation Reaction
第四章 缩合反应
本章主要讨论内容: 具有活泼氢的化合物与羰基化合物之间的缩合反应
用途:形成新的碳-碳键或碳-杂键
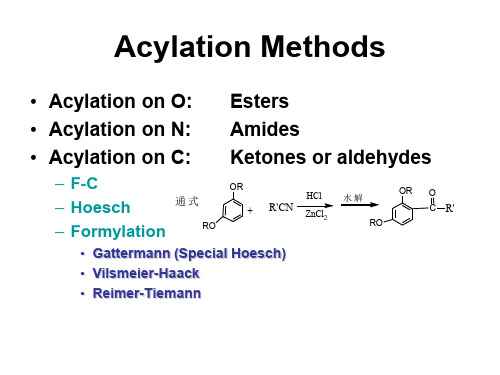
Definition of Condensation Reaction
A condensation reaction is a chemical reaction in which two molecules or moieties (functional groups) combine to form one single molecule, together with the loss of a small molecule.
OR
O
C R'
• Gattermann (Special Hoesch)
• Vilsmeier-Haack
• Reimer-Tiemann
Gattermann reaction
• The Gattermann reaction refers to a reaction of hydrocyanic acid with an aromatic compound, in this case benzene, under catalysis with Friedel-Crafts catalyst (aluminum chloride). The reaction is similar to the Friedel-Crafts reaction.
两个及两个以上有机化合物分子通过反应,失 去一个小分子,形成一个新的较大分子;或同一分 子发生分子内反应,失去一个小分子,形成新分子 的反应,也称为缩合反应。
Intermolecular and intramolecular
第四章:缩合反应(1节)-1

CH3OCH2Cl + ZnCl2 ArH + CH2Cl
H3C
O
CH2Cl
CH3 OZnCl2 + CH2Cl
ZnCl2 ArCH2Cl H3 C
O H ZnCl2
+ H CH3OH + ZnCl2
CH3OZnCl2 + H
芳环上有释电子基,有利于反应进行;吸电子基 芳环上有释电子基,有利于反应进行; 则不利于反应进行。 则不利于反应进行。
4).分子内的醇醛缩合反应 4).分子内的醇醛缩合反应
具有α 具有α活性氢的二羰基化合物在催化剂碱的 作用下,发生分子内的醇醛缩合反应 作用下,发生分子内的醇醛缩合反应 ,生产五 六元环状化合物。 元、六元环状化合物。
O LDA O O O O HO O
H 3O
O
LDA : lithium diisopropylmide(二异丙胺锂) 二异丙胺锂) 二异丙胺锂
CH3 .HCl RCOCH3 + HCHO + HN CH3 H2O CH3 RCOCH2CH2N .HCl CH3
• 含活泼氢原子的化合物有:酮、醛、酸、酯、腈、硝基烷、 含活泼氢原子的化合物有: 硝基烷、 炔、酚及杂环化合物 • 醛可以是:甲醛、三聚甲醛、多聚甲醛及活性大的脂肪醛和 醛可以是:甲醛、三聚甲醛、 芳香醛 • 胺可以是:仲胺、伯胺及氨 胺可以是:仲胺、
芳醛的α 羟烷基化(安息香缩合) 2. 芳醛的α-羟烷基化(安息香缩合)
芳醛在含水乙醇中,以氰化钠为催化剂, 芳醛在含水乙醇中,以氰化钠为催化剂,加热后 发生双分子缩合生成α 羟基酮的反应。 发生双分子缩合生成α-羟基酮的反应。
2 C6H5CHO NaCN / EtOH / H2 O pH 7~8, C6H5C O CHC6 H5 OH 96%
第四章 缩合反应(简单版)

Cannizzaro 反应
CH2OH
有机金属化合物的α−羟烷基化反应
(1) Reformatsky reaction: 醛、酮与α−卤代酸酯在锌粉的 存在下缩合而得β−羟基酸酯或脱水得α,β−不饱和酸酯。
O R1 R2 + X H C CO2R H R
1 2
1) Zn 2) H3O+ R
1 2
OH H C C CO2R H -H2O
+
C6H5 C6H5COCH2CHCH2CO2H
O CO2Et + CH CCOCH3
K2CO3/Acetone
O CO2Et COCH3
KOH/EtOH CHCN Et + CH2 CHCN
CN C CH2CH2CN Et
O CO2Et + Yb(OTf)3 CH2 CHCOCH3
O CO2Et COCH3 (95%)
O O HO NH2 CN HO O NH CN Cl OCH3 HO O N
O OCH3 CN
化合物Ⅰ
化合物Ⅱ
O O Ni/H2 HO N OCH3 NH2 NaOH/ref HO O N O NH
化合物Ⅲ(VAM水溶液)
化合物Ⅳ(Wing-B)
2.有机金属化合物的β−羰烷基化反应
有机金属化合物对α,β−不饱和羰基化合物的1,4− 加成−β−位引入烷基。
O R C CH3 + 3NH3 + 3HCHO
O R C C(CH2NH2)3
NH3
+
HCHO
CH2
NH2
Imine (亚胺)
2.Streck反应- a-氨基酸的制备
醛、酮类化合物与ΗCΝ和氨(胺类化合物)反应生成 α−氨基腈,再经酸或碱水解得到α−氨基酸的反应。
《工业催化(第3版)》教学课件—04络合催化与聚合催化

• 4.4.4 羰基合成与氢甲酰化
• 4.4.5 甲醇络合羰化合成乙酸
• 这是20世纪70年代工业催化开发中最突出的成就之一。它 使基本有机原料合成工业从石油化工向一碳化工的领域转 化打开了大门。催化剂可用羰基钴,也可用铑的络合物。 以CH3I为促进剂。铑催化剂的反应条件相对来说要温和得 多。温度约175℃,压力为1~12MPa,反应物的转化率 高。总反应式为
• 它们都是亲核的碳烯。引发了新的催化反应。
• (1)缩合反应 Knoevenagel缩合,是一个以哌啶 剂的缩合反应。
• (2)其他类型反应 包括加成反应、酰化反应、开环反 应等。
4.8 聚合催化
图4-8 聚烯烃配位聚 合催化剂的变迁
• 4.8.1 Ziegler-Natta催化剂
• 其组成是由周期表中第Ⅳ类过渡金属的其中之一和第Ⅰ到第 Ⅲ类碱性金属烷基化合物共同组成。后者作为助催剂或称 活化剂,是供过渡金属变成活性中心前先还原和烷基化所 必需的。助催化剂为烷基铝,可以是三甲基铝(TMA)、 三乙基铝(TEA)或者二乙基铝的氯化物(DEAC)。该催 化体系可以是均相、反应介质可溶,也可以是负载型多相 体系。Natta是在Ziegler工作的基础上创建了丙烯 合反应体系。
• NHC能加速化学反应,是一种不含金属原子的逊量有机化 合物,故谓之Organocata-lyst。这类催化剂是 H、O、N、S和P原子组成的小分子。这类分子与金属络合 物相比较具有以下优点:①便宜易得,不像过渡金属消 耗多;②在空气中、水介质中稳定;③反应完成后无需 分离回收;④属环境友好的,不像过渡金属有毒,易污 染环境。
第4章 络合催化与聚合催化
4.1 概述
• 络合催化,是指催化剂在反应过程中对反应物起络合作用 ,并且使之在配位空间进行催化的过程。催化剂可以是溶 解状态,也可以是固态;可以是普通的化合物,也可以是 络合物,包括均相络合催化和非均相络合催化。
第四章煤的有机质的结构

第四章煤的有机质的结构第四章煤的有机质的结构对煤的分子结构研究一直是煤化学的中心五环节,受到了广泛的重视,但是,由于煤炭组成的复杂多样性和不均一性,所以难于分离简单的物质进行结构和性质的研究分析,如利用溶剂法处理煤,仍得不到满意的结果,其主要原因是无法找到一种完全溶解煤的溶剂,而溶于溶剂只有煤中的一小部分,经抽提出来的的仍然是一个复杂的混合物。
不溶物的相对分子质量抽出物更大化学结构仍是很复杂、所以,无法用抽提的方法来观察煤结构的真相,然而,要合理利用煤炭,测定煤的结构是十分重要的。
目前煤结构的研究方法有三种方法:物理研究法,如红外光谱。
物理化学研究方法,如溶剂抽提和吸附能研究等;化学研究方法,如氧化分析法。
长期以来,对煤的结构研究,始终未能获得突破性的结论,只是根据实验结果分析推测,提出若干煤种的结构模型——化学结构模型和物理结构模型,近年来,对煤的结构研究到得了一定进展。
一般采用煤的镜质组作为研究对象,其原因是镜质组在成煤过程中变化比较均匀以及矿物质含量低。
第一节能煤结构单元核心部分的结构一、煤的基本结构单元煤是以有机体为主,并具有不同的相对分子质量、不同的化学结构的一组“相似化合物”的混合物。
它不像一般的聚合物,是由相同的化学结构的单体聚合而成的。
因此,构成煤的大分子聚合物的“相似化合物”被称作基本结构单元,也就是说,煤是许许多多的基本结构单元组合而成的大分子结构。
基本结构单元包括规则部分和不规则部分。
规则部分为结构单元的核心部分。
由几个或十几个苯环、脂环、氢化芳环及杂环所组成。
随着煤化程度的增大,苯环逐渐增多。
二、煤的结构参数由于不能准确表示煤的基本结构单元,为了描述煤的基本结构单元的情况,常采用四个“结构参数”如芳碳率、芳氢率、芳环率、环缩合指数等加以说明(1)芳碳率指煤的基本单元中,属于芳香族的碳原子数与总的碳原子数之比。
(2)芳氢率属于芳香族结构的氢原子数与总的氢原子数之比。
(3)芳环率芳香环数与总环数之比。
第四章碱催化缩合和烃基化反应.

碱 - EtOH
RCOOC2H5 +
O COR'' R C CH R'
R、R′可以是H、烃基、芳基或杂环基;R″可以是任意有 机基团。该缩合反应在RONa、NaNH2、NaH等强碱催化剂作 用下进行 。
4.1 羰基化合物的缩合反应
以乙酸乙酯在乙醇钠作用下生成乙酰乙酸乙酯为例,反应机理
CH2CO2Et (CH3)2C=C CO2Et
H+
(CH3)2C=O +
CH2CO2Et CH2CO2Et
CH2CO2H (CH3)2C=C CO2Et
NaOC2H5
Ph2CO +
CH2CO2Et CH2CO2Et
① t-C4H9OK, t-C4H9OH
② H+
Ph2C=C CH2CO2H CO2Et 90%~94%
离子交换树脂 或CH3COONH4
NH3OCOCH3
+
4.1 羰基化合物的缩合反应
反应机理:类似于Stobbe缩合,利用含有活泼亚甲基的化合 物在有机碱催化下形成碳负离子,然后与醛或酮的羰基发生 亲核加成反应。 对于以叔胺为催化剂:
CH2(COOEt)2 + B OH B + RCHCH(COOEt)2 BH+ + CH(COOEt)2
乙二酸二乙酯、苯甲酸乙酯,得到单一的β-酮酸酯
4.1 羰基化合物的缩合反应
CH3COOC2H5 + CH3COCH3 PhCOOC2H5 + CH3COPh
NaOC2H5 NaOC2H5
CH3COCH2COCH3 PhCOCH2COPh 62%~71% O CHO
第四章--逐步聚合反应1

(Xn )2
2c
2 0
kt
1
7—16
式7—16表白,自催化缩聚反应旳聚合度随聚合时间变化较缓慢。
试验表白,当P<0.8时,式7—16不符合。这可能与聚合早期酸性逐渐降低 有关。当P>0.8后来,式7—16符合得很好。这时才是真正大分子形成旳过程。
24
第四章 逐步聚合反应
2)外加酸催化缩聚 自催化缩聚反应旳酯化速率太低。实用中往往采用外加
间时旳浓度为c,则形成旳酯旳浓度为1-c,体系中残留旳 小分子旳浓度为nw。
t=0 t=t
k1 COOH + OH
k1
1
1
c
c
OCO 0
1c
+ H2O 0 nw
27
第四章 逐步聚合反应
聚合总速率方程为:
dc dt
= k1c2
k-1(1 c)nw
7—21
由平衡常数K = k1/k-1和式7—1,可将式7—21变为:
d[COOH] k[COOH][OH][H ] dt
7—11
反应体系中旳氢离子能够来自于单体羧酸本身,也可外
加。这两种情况旳动力学过程不同。
1)自催化缩聚
当二元酸和二元醇中两种基团数量相同,又无外加酸,
则氢离子来自于二元酸本身。所以氢离子浓度等于羧基数
量,也等于羟基数量。式7—5可写成:
22
第四章 逐步聚合反应
9
第四章 逐步聚合反应
单官能度旳丁醇和二官能度旳邻苯二甲酸酐进行酯与三官能度旳甘油进行酯化反应,产物 为低分子旳三醋酸甘油酯,副产物为水。
只要反应体系中有一种原料是单官能度 物质,不论其他原料旳官能度为多少,都只 能得到低分子产物。
药物合成反应(全)

O
O
C2H5 C2H5
NH ONa
HCl
C2H5
NH
C2H5
NH O
NH
O
O
盐酸普鲁卡因(ProcaineHydrochloride)的合成
➢ 盐酸普鲁卡因为局部麻醉药,作用强,毒性低 ➢ 临床上主要用于浸润、脊椎及传导麻醉 ➢ 化学名为对氨基苯甲酸2-二乙胺基乙酯盐酸盐 ➢ 化学结构式为:
H2N
化学选择性 化学选择性
区域选择性
化学选择性
我国抗癌药物紫杉醇合成成功
文章来源: 健康报
第四军医大学化学教研室张生勇教授课题组经过9年攻关, 在国内首次利用手性催化技术合成出抗癌药物紫杉醇。
紫杉醇和多烯紫杉醇是高效、低毒、广谱的抗癌药,广 泛用于治疗乳腺癌、卵巢癌、子宫癌等妇科肿瘤,对于某些 晚期肿瘤也有明显疗效。
Br2 CH3 COOH
P
O BrCH2 C-Br
X
溴乙酰溴
Br2 PCl3
BrCH2COOH
NH3 NH2-CH2COOH
第三节 醇、醚的卤素置换反应
一、醇的卤素置换反应
1 与HX反应 HI﹥HBr﹥HCl﹥HF 叔﹥仲﹥伯
2 与氯化亚砜、氯化砜的反应
S O2Cl
o C2O H H P y
o C2C H l
1S,2S (+)
仅1R,2R(-)型有抗菌活性, 临床使用
合成路线如下
O2N
Br2 , C6H5Cl COCH3
O2N
COCH2Br (CH2)6N4 , C6H5Cl O2N
COCH2Br(CH2)6N4
C2H5OH HCl , H2O O2N
(CH3CO)2O COCH2NH2 . HCl CH3COONa O2N
药物合成第四章酰化及缩合反应习答案

9、 Cl
CH3 O C COOH +
CH3
EtOH
H2SO4
CH3
Cl
O C COOEt
CH3
10、
CH3 (CH2)5COCl
AlCl3
ClCH2CH2Cl, 0 oC
CH3
CH3
CH3 O
11、
CH3 + C6H5NCHO
POCl3 90-95 oC
CHO
12、 O
CH3C
H2 O CC
OC2H5+ HO
O
H2 CH3C C C O
140 oC 4~5hr
13、
14、
OH
BCl3 Cl3CCN
H2O
OH COCCl3
三、1. 写出羧酸与醇反应生成酯的反应机理 (通式)。
HOR'
R C OH H R C OH R'OH R C OH
O
OH
OH
OR' R C OH
OH2
OH
R C OH
CH3 O + CH2=CH COOCH3 KOC(CH3)3
O CH3 O CH2CH2CHOCH3
9、
10、
O
O
+
H3PO4
O
Al(t-BuO)4
OH
O
11、
O
CH3 +
NO2 OH /H2O
CHO
O2N
O CH3
12、
O
> 2mol
Ph3P=CHCH3
O
H3CHC
CHCH3
13、
O
ClCH2CO2CH3 CH3ONa
第4章 4.1-4.2缩聚反应的概论和单体的官能度

H-(HNRNH-OCR’CO)n-Cl + (2n-1) HCl d. 聚硅氧烷化反应:硅醇之间聚合 n HO-SiR1R2-OH + n HO-SiR1’R2’-OH
H-(OSiR1’R2’-OSiR1R2)n-OH + (2n-1) H2O
a. 两官能团相同并可相互反应:如二元醇聚合生成聚醚
n HO-R-OH
H-(OR)n-OH + (n-1) H2O
b. 两官能团相同, 但相互不能反应,聚合反应只能在不同单体 间进行:如二元胺和二元羧酸聚合生成聚酰胺
n H2N-R-NH2 + n HOOC-R’-COOH
H-(HNRNH-OCR’CO)n-OH + (2n-1) H2O c. 两官能团不同并可相互反应:如羟基酸聚合生成聚酯
HO ( OC-R-CO O-R'-O )nH + (2n-1) H2O
19
4.1 概 述
(ii) 不平衡线型逐步聚合反应 聚合反应过程中生成的聚合物分子之间不会发生交换反 应,单体分子与聚合物分子之间不存在可逆平衡,即不 存在化学平衡。
不平衡逐步聚合反应概括起来有三种: (i) 热力学不平衡反应:聚合反应的基本化学反应本身为 不可逆反应;
OH
OH
+ CH2O
CH2
30
4.2 官 能 度
4.2.2 平均官能度( )f 用于含有两种或两种以上不同 f 的单体的聚合反应体系。 可分两种情况来定义和计算。假设体系含A、B两种官能团:
(1)nA = nB, f 定义为体系中官能团总数相对于单体分子数的 平均值。 即 f =∑Ni fi /∑Ni (Ni:官能度为 fi 的单体分子数, 下同) (2)nA ≠ nB, f 定义为量少的官能团总数乘2再除以全部的 单体分子总数。假设nA < nB, 则
第四章:缩合反应(2,3节)-1
H3CO
CH2CH2COOC2H5
H3CO
2. Perkin 反应
芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合, 芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成 芳基丙烯酸类化合物的反应。 β-芳基丙烯酸类化合物的反应。
O H3C C6H5CHO + H3C C O C O CH3COO C6H5 H C H COOH
O R C O R C C R2 R2 O R C R1 C R2 H2 C C X + BH R O C R1 C R2 H2 C X CH + B CH R2 R1 + C C X R O C O R1 + B R C C R2 R1 C H2 C C X R1 + BH
供电体: 供电体的酸度越大, Michael 供电体: 供电体的酸度越大,越容易 形成碳负离子,活性越大。 形成碳负离子,活性越大。 受电体: Michael 受电体: α,β-不饱和键上所连接的官 能团的吸电子能力越强, 能团的吸电子能力越强,使β-碳原子的电子云密度 降低的越多,其活性亦越大。 降低的越多,其活性亦越大。
R3 C R4 O
+
R1 (C6H5)3P C R2
R3 C R4 C
R1
+ (C6H 5)3P
O
R2
R1 R1 (C6H5)3P C R2
+
R1 (C6H5) 3P C R2 R4 R3
R3 C R4 O
(C6H5) 3P O
C
R2 R4
CR2 C
+ (C6H5)3P
O
R4
R3
硫和磷与碳结合时,碳带负电荷,硫或磷带正电荷彼此相邻,这种结构的化 合物称为Ylide(叶立德)。由磷形成的Ylide称为磷Ylide,又称为Wittig试剂, 其结构可表示如下:
药物合成反应(第三版 闻韧)第四章课后答案
10
O
O O
Eur. J. Org. Chem., 2001, 21, 4009.
11
O N N
Tetrahedron Lett. 2001, 42: 6049.
12
O
O
CO2Et
13
O OC2H5 HO N Ph CO2Et CN
NO2
Tetrahedron Lett. 2000, 41: 8011.
J. Org. Chem., 2007, 72: 5244.
4
O
J. Am. Chem. Soc., 1963, 85: 207. 1. pyrrolidine, p-TsOH, xylene; 2.
5
R Hห้องสมุดไป่ตู้
CN CO2Et
Eur. J. Org. Chem., 2004, 3: 546.
6
PhHC
*反应机理提示:安息香缩合 (2)参考答案: 反应式:
*反应机理提示:氯甲基化反应
4
根据以下指定原料试剂和反应条件写出其合成反应的主要产物参考答案题号答案1o注释benzalacetophenone2phch3ch3ohoj
《药物合成反应》 (第三版) 闻韧主编
习题及答案
第四章 缩合反应习题及答案
1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物 NaOH/H2O/EtOH (1) C6H5CHO + CH3COC6H5 15~30oC CH3 OTBDMS BF3 (2) PhCHCH=O + H2C CH3
O (3) Ar H + Ph3P
o
H2O COCH3 20 C或90oC, 5min~2h
有机合成课件第4章稳定化碳负离子的缩合反应

REPORTING
• 引言 • 稳定化碳负离子 • 缩合反应 • 稳定化碳负离子的缩合反应 • 实验操作与注意事项 • 课程总结与展望目录源自PART 01引言
REPORTING
课程背景
有机合成是化学领域中的重要分 支,涉及到复杂有机化合物的合
成和制备。
酯化反应
羧酸中的羧基与醇中的羟基发生质子转移,生成酯和水。
烯醇化反应
烯醇中的碳碳双键与另一分子醇中的羟基发生加成反应, 生成β-羟基酮。
PART 04
稳定化碳负离子的缩合反 应
REPORTING
稳定化碳负离子在缩合反应中的应用
碳负离子作为重要的中间体, 在有机合成中广泛应用于缩合 反应。
稳定化碳负离子能够降低碳负 离子的反应活性,使其在缩合 反应中更加可控,提高反应的 选择性和产率。
步骤一
在干燥的烧杯中加入稳定化碳 负离子和适量的溶剂,搅拌均
匀。
步骤二
缓慢滴加催化剂,观察反应变 化。
步骤三
在恒温水浴中加热反应混合物 ,保持温度恒定。
步骤四
反应结束后,冷却至室温,进 行后处理。
实验注意事项与安全
安全警示
避免直接接触化学试剂,穿戴实验服和化学 防护眼镜。
环境保护
废液应妥善处理,避免对环境造成污染。
稳定化碳负离子的形成通常涉及离去基团(如卤素、烷基等)的离去, 这有助于提高碳负离子的稳定性。
PART 05
实验操作与注意事项
REPORTING
实验前的准备
实验材料
稳定化碳负离子、反应溶剂、催 化剂等。
实验设备
搅拌器、恒温水浴、滴定管、称量 纸等。
药物合成反应复习题

第一章卤化反应1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围?3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。
(1)卤素对双键的离子型加成(2)芳香环上的取代(3)方向化合物侧链上的取代(4)卤化氢对醇羟基的置换(5)NBS 的取代反应4 比较X2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。
怎样判断加成方向5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何?6 预测Br2/CCl4 于下列各种烯烃进行溴化反应的相对速度的次序。
CH2=CH2 (CH3)2C=CH2 HOOC-CH=CH-COOH (CH3)2C=C(CH3)2 CH3CH2=CH2 CH2=CH-CN7 对比下列反应的条件有何不同?结合反应机理加以说明:H3C CH2 CH 2Br(1)H3C CH CH 2H3C CHBr CH 3CH 3Cl CH 3(2)CH 2ClRH 2C CH CH 2(3) R H 2C CH CH 2BrRH 2C C CH 2OH8 下列反应选用何种氯化剂为好?说明原因。
(1) H3C C CH CH3 H3CC CH CH 2BrCH 3 CH 3(2)H3 C HC CH COOH H3C HC CH COCl(3) HO (CH 2 )6 OH IH2C(CH 2)4 CH 2 OH(4) H3CCO C H 2CH 2 COOH H3 CCO CH2CHCOBrBr(5) H3 CO CH2 OHH3CO CH 2 ClH2C C (CH 2 )6 COOHCl(6)H2 C HC (CH 2)6 COOHBr H2C (CH 2)6 COOHCOOHCOOHCOCl(7)Cl Cl HO OHNCl Cl NNCOClHO OHN9 完成下列反应,写出主要的试剂及反应条件:OHOH(1)COOH COClCH 3 CF3(2)(3) CH3COOHFXH2COOH(4) O COOH O I10 完成下列反应,写出其主要生成物(1) H3C C CHCH3Ca(OCl) 2/HOAc/H 2OH3C(2)HC CH2NBS/H 2O(3) CH3 C CH 2HBr/Bz2O2(4) OH 48%HBr(5) C H 2CH=CHCH2CH=CHBrCH 2=CH-COO-CH-CH 2 1molBr2/CCl4(CH 3)2C=CHCH 2CH=CH 2第二章烃化反应一烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?二用卤代烃对氨基和羟基的烃化反应各有何特点?烃化剂及被烃化物的结构对反应有何影响?三用于制备较纯的伯胺的方法有那几种?四举例说明“还原烃化”、“羟乙基化”的机理、特点及反应中的注意事项。
第4章_自由基共聚合

17
4.3.1 理想共聚( r1r2 = 1 ) 把竞聚率 r1 和 r2 的乘积等于 1 时的共聚反应称为理想共聚。
(1) r1 = r2 = 1(理想恒比共聚)
r1 = r2 = 1,表示自由基的均聚和共聚增长几率完全相同, 在此条件下,两单体可视为一种单体,不管配料比和转化率如 何,共聚物组成和单体完全相同,F1 = f1,共聚物组成曲线为 一对角线,可称为理想恒比共聚。
0.80 1.5/0.0
0.70
0.60
1.0/0.0
0.01/0.01
0.50
0.40
0.30
0.20
0.10
0.00 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 f1
23
实际上,制备交替共 聚 物 时 , 多 是 在 r1≈0 或 r1<<1、r2 = 0的情况下进 行的,例如:苯乙烯(r1 = 0.01)-马来酸酐(r2 = 0)交替共聚物,此时 ,F1 > 50% 。
2
]
k 21[ M 1 ]
代入式(4-7),消去[M1· ]:
13
得到:
令:
r1
k11 k12
得到:
d[M1]
[M1]
( k11 k12
[M1] [M 2 ])
d[M 2 ]
[M 2 ]
(
k22 k21
[M
2
]
[ M 1 ])
r2
k22 k21
d[M1] [M1] (r1[M1] [M 2 ]) d[M 2 ] [M 2 ] (r2[M 2 ] [M1])
第四章 逐步聚合反应

特点:与缩聚反应不同,这些反应都没有小分子副 产物生成。 大部分缩聚属于逐步聚合机理,缩聚又占了逐步聚 合的大部分。本章就以缩聚反应为代表。
10
缩聚反应的分类
1)按反应热力学分类:
平衡缩聚(或可逆缩聚) K<103 如聚酯 K=4 不平衡缩聚(不可逆缩聚) K>103 如聚碳酸酯
2)按生成聚合物的结构分类:
7
聚加成
单体分子多次官能团间加成,聚合物形
成的过程中无小分子析出,就是含活泼氢功能基的亲
核化合物与含亲电不饱和功能基的亲电化合物之间的
聚合。如聚氨酯的合成。
8
9
Diels-Alder加成聚合
含共轭双烯的单体与另一烯类(或其它提供双键 的单体)发生1,4加成,制得梯形聚合物,即多烯 烃的环化聚合。
4
逐步聚合是高分子合成最基本的类型之一。 逐步聚合:是指具有两个或两个以上官能团的低分
子化合物相互反应而逐步生成高分子化合物的反应。 所谓逐步指一个时刻一步反应,反应的结果既可能 为反应的产物,也可以作为反应的中间体,或者说 每步反应的速率常数和活化能都基本相同。因此每 步反应的产物都有一定的稳定性。
35
线形缩聚物聚合度与反应程度的关系(等mol配比)
反应程度P 聚合度 0 0.5 1 2 0.67 0.8 3 5 0.95 20 0.99 100 0.995 200 0.999 1000 1 ∞
可见,聚合初期和中期反应程度的快速增加并 未使聚合度快速升高。
反应后期,反应程度的微小增加即导致聚合度
K较小:反应可逆,如聚酯化反应(K≈4),低分子 副产物的存在对分子量影响较大。 K中等:如聚酰胺反应(K≈300~500),低分子副产 物对分子量影响有所影响。 K很大:可看做不可逆反应。如聚砜、聚碳酸酯反应 (K>1000)。
第四章 缩合反应

ⅲ亚胺法
Li RCH2CHO R1 R2 C O R1 R2 C O Li LDA
+
R3NH2 R
RCH2CH
NR
3
RCHCH
NR3
CHCH NR3
H2 O
R1 R2 C
R C CHO
NH 2
想让哪位α-H活化就让它与
反应
NH2 CH3CHO +
CH3 CH 2CHO -H2O
H H3C C
N
LDA
H2/Cu
160℃
CH3CH2CH2CH2=CHCHO CH2CH3
-H2O
10%NaOH
2 CH3CH2CH2CHO
CH3 CH2CH2CH2-CHCHO OH CH2CH3
70-80℃
不同的醛酮之间的缩合
(2)芳醛与含α-H醛、酮的缩合 (Claisen-Schimidt))
反式产物
CHO O O C H O C H
H
H2 R C C
R' R C H
O C R'
- H2O -H
R'
O C C R CR'
OH2
RH2C
(1)自身缩合
2 R CH2 OH 或 H
C R' O ' H2 R R R C C C OH H O C R' - H2O R' RH2C C R C O CR'
A、影响反应的因素 a.反应温度的影响
_
N S
NH2 CH2
CH3
B
+
R'
HB
N
R
=
H3 C N
R'
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 α-羟烷基化、 卤烷基化、氨烷基化
第一部分 α-羟烷基化反应
一、羰基α位碳原子的α-羟烷基化(aldol
缩合)
含有α-活性氢的醛或酮,在碱或酸的催化 下发生自身缩合或不同分子间的缩合,使羰基 α-位C原子上引入羟烷基,即生成的β-羟基醛
或酮,一般可进一步脱水生成α,β-不饱和醛
核加成,脱水得α,β-不饱和酮。
H H 3 3 C C C H C H 2 C H O + C H 3 C O C H 3N 3 0 a O o C H H H 3 3 C C C H C H 2 C H C H C O C H 3
第4章缩合反应分析
(2)定向醛醇缩合 (Directed aldol condensation)
对于活性醛,反应温度 较高或催化剂的碱性较 强,有利于进行消除脱
水得α, β-不饱和醛 NaOH 25℃
CHO
2
OH CHO
NaOH 80℃
CHO
醛自身缩合应用较多,而酮的活性低于醛,酮 的自身缩合的速度较慢,需设法打破平衡,向反应 右边转化,如丙酮的缩合:
第4章缩合反应分析
2
O
Ba(OH)2
OH O
1) CH3CH2CH2CHO 2) H3O
C3H7
C3H7-n
O HO
第4章缩合反应分析
LDA 作用主要有两方面:
一是专一定向缩合,如上例产生一种主产品,收 率达65%;
二是立体选择性缩合,LDA与酮生成动力学的Z 和E型烯醇锂盐,在与醛反应时,一般地,Z型烯醇 锂盐主要生成赤型醛醇,而E型烯醇锂盐则生成以 苏型醛醇为主。其解释是,在缩合中,反应经历了 一个椅式六元环过渡态,两个处于间位的体积较大 的直立基团,必然能量较高,这种过渡态就形成较 少,使产品经由能量较低过渡态而产生,形成上述 规律.
位上取代基较少的C原子上,得β-羟基酮或α,β-不饱和酮;
e、具有特殊分子结构的多羰基(即多酮)化合物,也发生分 子内缩合反应(常为分子内环合)。
2、不同醛、酮分子间的缩合
情况比较复杂,产品为混合物。
第4章缩合反应分析
常发生交叉的醛酮缩合和自身缩合,可 能有四种产品,见下例:
RCH2CHO
OHR'CH2CHO
或酮。又称醛醇缩合(aldol缩合)。
第4章缩合反应分析
第4章缩合反应分析
1、含有α-活性氢的醛、酮的自身缩合
由于羰基的影响,在醛、酮中其羰基α位上都有活泼H,在酸或碱催
化下发生以下通式的反应:
2R
R' OH-/H+
R
R'
R
R' -H2O R
R R'
O
OH O
R' O
式中:R’=H,脂肪基或芳烃基
RCH2 CH CH CHO OH R'
R'CH2 CH CH CHO OH R
RCH2 CH CH CHO OH R
R'CH2 CH CH CHO OH R'
(1)反应规律
a、两个不同醛分子间发生缩合时,在碱催化下,一般是αC原子上含有较多取代基的醛形成碳负离子向α-C原子上含 有较少取代基的醛的羰基进行亲核加成,在室温下反应符 合上述规律;高温下则不然,见下例:
(1) 碱催化的反应机理:
前三步可逆,第一 步为限速反应。ຫໍສະໝຸດ C H3 C H3O
慢
C H + OH
O
O
CH CH2 C H
O
CH2 C H
快
+O
CH3 C H
+ 快
H2O
OH
O
CH3 CH CH2 C H + OH
H2O
O
CH3CH CH2 CH
第4章缩合反应分析
第4章缩合反应分析
第4章缩合反应分析
为克服醛酮间缩合时易发生醛自身缩合,人们应用封闭 基团,首先与醛或酮作用,以保证定向缩合。
a、烯醇盐法:先将某一种醛、酮与具位阻的碱(如LDA,二 异丙胺锂)作用,生成所谓动力学 烯醇盐,再与另一分子的 醛、酮反应,实现区域或立体选择性的缩合。
C3H7COCH3
LDA/THF
OLi
-78℃ C3H7 CH2
限速步骤
OH C R'
R H 2C
OH
OH
C HC C R'
R' R
R H 2C
OH
O
C HC C
R' + H
OH2
O
R H 2C C H C C R '
R' R
O
R' R
R' C
R H 2C
C R' C 第4章缩R合反应分析
-H 2O , -H
(3)反应结果的总结:
a、醛自身缩合,可发生在同一分子内部(烷二醛),生成环 状化合物; b、醛自身缩合,可得到多聚的环状物; c、酮自身缩合,若是对称酮,则缩合产品单一; d、酮自身缩合,若是不对称酮,则反应主要发生在羰基α-
I2 or H3PO4
O
弱酸性阳离子交换树脂 2
O
应用:
5%NaOH 2CH3CHO 15~18℃
10%NaOH 70~80℃
CHO
H2/Ni
140-150℃
CHO
H2/Cu
160℃
第4章缩合反应分析
O
79%
CHO CH2OH
丙酮自身缩合的仪器与过程
当下面烧瓶中丙酮沸腾时,蒸气 沿着图中提取器左侧玻璃管A上升, 被冷凝管冷凝成为液体,流入B管; B管中填充Ba(OH)2,蒸发上的丙酮 浸透在Ba(OH)2中,被催化发生自身 缩合,当提取器内液体液面C超过虹 吸管D的最高处时,即产生自动虹吸, 经虹吸管D将液体液流回到烧瓶中, 没反应的丙酮不断地蒸发上去,如此 循环,反应瓶中的缩合物浓度不断加 大,直至完成反应。
Soxhlet (索氏) 提取器
第4章缩合反应分析
(2) 酸催化的反应机理: (酸催化应用不多)
O R H 2C C R ' + H A
RH 2C
OH C R'
R H 2C
OH C R' + A
OH -H
R H 2C C R '
RHC
OH C R'
RHC
OH C R'
R H 2C
OH C R' + RHC
第4章缩合反应分析
CH3
CH3CH2CHO + (CH3)2CHCHO
NaOH 25 oC
H3CH2CHC
C
CHO
OH CH3
CH3CH2CHO + (CH3)2CHCHO
NaOH 80 oC
(H3C)2HCHC
C CHO CH3
b、醛酮缩合时,一般地说,易得醛自身缩合的产物;若是丙 酮与醛反应,只因丙酮易形成碳负离子,而与醛的羰基发生亲
第三章 缩合反应
Condensation Reaction
缩合反应:两个或多个有机化合物分子经反应组成一 个较大的新分子的反应,或分子内发生反应形成新分 子;一般地,缩合反应常通过脱去一些小分子,就位 形成新的C-C键(或C-杂键) 。
本章仅讨论: * 具有活泼氢的化合物(C负离子,即d-合成子)与羰 基(其C上有正电性,即a-合成子)化合物之间构成新 的C-C键的反应; * 分子内环合反应。
