乙醛教学ppt课件
合集下载
《乙醛》PPT课件(辽宁省市级优课)

03 乙烯氧化法反应机理
乙烯在催化剂作用下被氧化成乙醛,反应过程中 涉及碳碳双键的断裂和氧原子的插入。
03
乙醛的反应与性质
乙醛的氧化反应
01 与氧气反应
乙醛在铜或银的催化下,可被氧气氧化为乙酸。
02 与高锰酸钾反应
乙醛能被酸性高锰酸钾溶液氧化,使高锰酸钾溶 液褪色。
03 与重铬酸钾反应
乙醛与重铬酸钾在酸性条件下反应,生成乙酸和 二氧化碳。
取少量乙醛,加入银氨溶液,水浴加热, 观察现象。
实验数据分析与结果讨论
乙醛的制备实验结果分析
计算产率,分析影响产率 的因素。
通过测定生成物的红外光 谱和核磁共振氢谱,确认 生成物为乙醛。
实验数据分析与结果讨论
乙醛的性质实验结果分析 酸性高锰酸钾溶液褪色,说明乙醛具有还原性。
新制的氢氧化铜悬浊液加热煮沸后生成砖红色沉淀,说明乙醛具有氧化性。
乙烯氧化法
乙烯在催化剂作用下与空气或氧 气反应,生成乙醛。这种方法也 是工业上生产乙醛的重要方法之 一。
乙醛合成过程中的反应机理
01 乙醇氧化法反应机理
乙醇在催化剂作用下被氧化成乙醛,反应过程中 涉及醇羟基的氧化和氢原子的转移。
02 乙炔水化法反应机理
乙炔在催化剂作用下与水反应生成乙醛,反应过 程中涉及碳碳三键的加成和水分子的裂解。
实验数据分析与结果讨论
银氨溶液水浴加热后生成
01 光亮的银镜,说明乙醛具
有还原性。
结果讨论与改进建议
03
分析实验过程中可能存在
02
的误差来源及改进措施。
讨论实验结果与理论预测
04
之间的差异及可能原因。
THANKS
感谢观看
《乙醛》PPT课件( 辽宁省市级优课)
乙烯在催化剂作用下被氧化成乙醛,反应过程中 涉及碳碳双键的断裂和氧原子的插入。
03
乙醛的反应与性质
乙醛的氧化反应
01 与氧气反应
乙醛在铜或银的催化下,可被氧气氧化为乙酸。
02 与高锰酸钾反应
乙醛能被酸性高锰酸钾溶液氧化,使高锰酸钾溶 液褪色。
03 与重铬酸钾反应
乙醛与重铬酸钾在酸性条件下反应,生成乙酸和 二氧化碳。
取少量乙醛,加入银氨溶液,水浴加热, 观察现象。
实验数据分析与结果讨论
乙醛的制备实验结果分析
计算产率,分析影响产率 的因素。
通过测定生成物的红外光 谱和核磁共振氢谱,确认 生成物为乙醛。
实验数据分析与结果讨论
乙醛的性质实验结果分析 酸性高锰酸钾溶液褪色,说明乙醛具有还原性。
新制的氢氧化铜悬浊液加热煮沸后生成砖红色沉淀,说明乙醛具有氧化性。
乙烯氧化法
乙烯在催化剂作用下与空气或氧 气反应,生成乙醛。这种方法也 是工业上生产乙醛的重要方法之 一。
乙醛合成过程中的反应机理
01 乙醇氧化法反应机理
乙醇在催化剂作用下被氧化成乙醛,反应过程中 涉及醇羟基的氧化和氢原子的转移。
02 乙炔水化法反应机理
乙炔在催化剂作用下与水反应生成乙醛,反应过 程中涉及碳碳三键的加成和水分子的裂解。
实验数据分析与结果讨论
银氨溶液水浴加热后生成
01 光亮的银镜,说明乙醛具
有还原性。
结果讨论与改进建议
03
分析实验过程中可能存在
02
的误差来源及改进措施。
讨论实验结果与理论预测
04
之间的差异及可能原因。
THANKS
感谢观看
《乙醛》PPT课件( 辽宁省市级优课)
高中化学《乙醛》课件ppt

体内乙醛积累,导致血管扩张而脸红。
乙醛是一种无色液体, 有刺激性气味,密度小于 水,可与水和乙醇等有机 物互溶,沸点低,易挥发
HO HC C H
H 醛基
烃基
乙醛的结构
官能团:
O
醛基
CH
结构决定性质
HO
HC C H
H 醛基
烃基 1.从醛基的结构特点出发,预测乙醛可 能会有什么化学性质? 2.分析醛基上C的化合价,预测醛基可 能会有什么化学性质?
乙醛
在日常生活中 我们都会有这样的 疑问,为什么有的 人喝酒“千杯万杯 都不醉”,而有的 人喝一点酒后就面 红耳赤,甚至酩酊 大醉?酒量的大小 到底与什么有关呢?
原来如 此啊!
研究发现,饮酒后乙醇进入人体内, 首先在乙醇脱氢酶的作用下氧化为乙醛, 然后又在乙醛脱氢酶的作用下将乙醛氧化 为乙酸,并进一步转化为CO2和H2O。如果 人体内缺少乙醛脱氢酶,饮酒后就会引起
氧化
CH3CH2OH
氧化
CH3CHO
CH3COOH
CH3CH2OH 还原(加成)CH3CHO 氧化 CH3COOH
生成的砖红色沉淀可 能是什么物质? CuO? CuOH是黄色
或淡黄色固体,
CuOH?不溶于水 ,非
常不稳定
Cu2O?C溶u于2O水是的红固色体难
问题解决:
试管内壁 的银镜如 何清洗?
小结: 乙醛能被酸性高锰酸钾溶液 氧化吗?
乙醛能使溴水褪色吗?
问题解决:已知柠檬醛的结构简式为:
CH3
CH3 O
|
|
‖
CH3–C=CH–CH2–CH2–C=CH–C–H
柠檬酸中含C=C和醛基两个官能团, 实验操作中,先检验哪一个官能团? 用什么检验试剂?
乙醛是一种无色液体, 有刺激性气味,密度小于 水,可与水和乙醇等有机 物互溶,沸点低,易挥发
HO HC C H
H 醛基
烃基
乙醛的结构
官能团:
O
醛基
CH
结构决定性质
HO
HC C H
H 醛基
烃基 1.从醛基的结构特点出发,预测乙醛可 能会有什么化学性质? 2.分析醛基上C的化合价,预测醛基可 能会有什么化学性质?
乙醛
在日常生活中 我们都会有这样的 疑问,为什么有的 人喝酒“千杯万杯 都不醉”,而有的 人喝一点酒后就面 红耳赤,甚至酩酊 大醉?酒量的大小 到底与什么有关呢?
原来如 此啊!
研究发现,饮酒后乙醇进入人体内, 首先在乙醇脱氢酶的作用下氧化为乙醛, 然后又在乙醛脱氢酶的作用下将乙醛氧化 为乙酸,并进一步转化为CO2和H2O。如果 人体内缺少乙醛脱氢酶,饮酒后就会引起
氧化
CH3CH2OH
氧化
CH3CHO
CH3COOH
CH3CH2OH 还原(加成)CH3CHO 氧化 CH3COOH
生成的砖红色沉淀可 能是什么物质? CuO? CuOH是黄色
或淡黄色固体,
CuOH?不溶于水 ,非
常不稳定
Cu2O?C溶u于2O水是的红固色体难
问题解决:
试管内壁 的银镜如 何清洗?
小结: 乙醛能被酸性高锰酸钾溶液 氧化吗?
乙醛能使溴水褪色吗?
问题解决:已知柠檬醛的结构简式为:
CH3
CH3 O
|
|
‖
CH3–C=CH–CH2–CH2–C=CH–C–H
柠檬酸中含C=C和醛基两个官能团, 实验操作中,先检验哪一个官能团? 用什么检验试剂?
乙醛的教学课件ppt

乙醛可以发生加成反应 、氧化反应和还原反应
乙醛可以与羧酸发生酯 化反应
乙醛可以与醇发生酯化 反应
乙醛的用途
乙醛可以用于制造香料、医 药、农药等化工产品
乙醛可以用于合成树脂、橡 胶等高分子材料
乙醛可以用于制造醋酸、醋 酸盐等化学品
乙醛可以用于生产甲醛、乙 醇等其他有机化合物
02 乙醛的生产方法
乙炔水合法
在皮革加工中,乙醛也 被用作脱毛剂和鞣制剂 ,可以提高皮革的质量 和耐用性。
乙醛在科学Leabharlann 究中的应用在科学研究领域,乙醛作为一种重要 的有机化合物,被广泛用于合成和研 究各种复杂有机物和生物分子。
在生物学研究中,乙醛可以用于研究 生物分子的结构和功能,例如蛋白质 的修饰和基因的表达调控等。
乙醛可以作为反应中间体,用于研究 化学反应机理和合成方法学。
总结词
乙炔水合法是一种常用的生产乙醛的方法,通过将乙炔和水的反应来制备乙醛 。
详细描述
乙炔水合法通常在高温和催化剂的作用下进行,将乙炔气体和蒸气混合后通过 催化剂床层,反应生成乙醛和水。该方法具有较高的选择性,能够得到高纯度 的乙醛产品。
乙醇脱氢法
总结词
乙醇脱氢法是一种通过乙醇的脱氢反 应来制备乙醛的方法。
控制源头
加强生产过程中的密闭 和通风措施,减少乙醛 的逸散和排放。
定期检测
定期对工作环境进行乙 醛浓度检测,及时发现 和处理超标情况。
乙醛的未来发展
05
乙醛的生产技术的发展趋势
01
生物发酵技术
利用微生物发酵将糖类物质转化为乙醛,具有环保、高 效的特点,是未来发展的重要方向。
02
合成气直接转化技术
乙醛教学课件
(一)乙醛的结构(1)41页PPT
(防止生成易爆物质)
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) (2)新制Cu(OH)2悬浊液:[演示] 过量的NaOH溶液中滴加几滴CuSO4溶液。
Cu2++2OH-= Cu(OH)2↓ 红色沉淀反应-费林反应:
CH3CHO + 2Cu(OH)2 2CH3COOH +红Cu色2O沉↓淀+ 2H2O
• 福尔马林是质量分数含___________的甲 醛水溶液。
• 【思考】下列物质属于纯净物的是( ) • A.甲醛 B.福尔马林 C.石碳酸
D.沼气
3.列举甲醛的重要用途:
• 4.甲醛的化学性质(写出反应的化学方程 式):
• (1)与氢气加成____________________ • (2)银镜反应
(一)乙醛的结构(1)
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
乙醛 醛类
一、乙醛:
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
(3)乙炔水化法
• 用硫酸汞做催化剂 HC≡CH +H2O→CH3CHO
五、醛类
• (一)甲醛 • 1.甲醛的分子式_________,结构简式
________。 • 【思考】(1)从结构上看甲醛与其他醛
类,有什么区别? • (2)在甲醛中的两个氢原子有没有区别?
2.甲醛的物理性质
• 甲醛又叫________,_______色________ 气味的________体。溶解性_________。
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) (2)新制Cu(OH)2悬浊液:[演示] 过量的NaOH溶液中滴加几滴CuSO4溶液。
Cu2++2OH-= Cu(OH)2↓ 红色沉淀反应-费林反应:
CH3CHO + 2Cu(OH)2 2CH3COOH +红Cu色2O沉↓淀+ 2H2O
• 福尔马林是质量分数含___________的甲 醛水溶液。
• 【思考】下列物质属于纯净物的是( ) • A.甲醛 B.福尔马林 C.石碳酸
D.沼气
3.列举甲醛的重要用途:
• 4.甲醛的化学性质(写出反应的化学方程 式):
• (1)与氢气加成____________________ • (2)银镜反应
(一)乙醛的结构(1)
51、山气日夕佳,飞鸟相与还。 52、木欣欣以向荣,泉涓涓而始流。
53、富贵非吾愿,帝乡不可期。 54、雄发指危冠,猛气冲长缨。 55、土地平旷,屋舍俨然,有良田美 池桑竹 之属, 阡陌交 通,鸡 犬相闻 。
乙醛 醛类
一、乙醛:
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
(3)乙炔水化法
• 用硫酸汞做催化剂 HC≡CH +H2O→CH3CHO
五、醛类
• (一)甲醛 • 1.甲醛的分子式_________,结构简式
________。 • 【思考】(1)从结构上看甲醛与其他醛
类,有什么区别? • (2)在甲醛中的两个氢原子有没有区别?
2.甲醛的物理性质
• 甲醛又叫________,_______色________ 气味的________体。溶解性_________。
苏教版-乙醛ppt课件

乙醛
1
催化剂
2CH3CH2OH + O2
2CH3CHO + 2H2O
HH H—C—C—O—H
HH
-2H
乙醇
HH
H—C—C=O
H
乙醛
醛基 -CHO
R-CHO
烃基
2
醛类 O
H CH
甲醛
HH O
HO
由烃基与醛基相连而构成的 H C C H 有机化合物。简称RCHO
H
乙醛 R-CHO 或 O 醛基
R-C-H
因此乙醛能使高锰酸钾溶液溴水 褪色
21
O=
—C—H ,是既有氧化性,又有还原性,
其氧化还原关系为:
醇
氧化 还原
醛 氧化
羧酸
小
O=
结 ⑴ —C—H 氧化(得氧) ,断C—H键:
2CH3CHO + O2
Cu △
2CH3COOH
O= O=
⑵ —C—H 醛还原(加氢) ,断C=O键:
R—C—H + H2
Ni △
应用: a、检验醛基存在,确定醛基数目
b、医院里,利用这一反应原理
检查尿糖是否正常
(检查葡萄糖的醛基)
19
注意
1.Cu(OH)2应现配现用; 2.成功条件:碱性环境、加热.
20
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都O=
2. 氧化反应
(1)催化氧化
2CH3-C-H
+ O2
催化剂 △
乙酸 2CH3-C-OH
(2)燃烧
点燃
2CH3CHO+5O2
1
催化剂
2CH3CH2OH + O2
2CH3CHO + 2H2O
HH H—C—C—O—H
HH
-2H
乙醇
HH
H—C—C=O
H
乙醛
醛基 -CHO
R-CHO
烃基
2
醛类 O
H CH
甲醛
HH O
HO
由烃基与醛基相连而构成的 H C C H 有机化合物。简称RCHO
H
乙醛 R-CHO 或 O 醛基
R-C-H
因此乙醛能使高锰酸钾溶液溴水 褪色
21
O=
—C—H ,是既有氧化性,又有还原性,
其氧化还原关系为:
醇
氧化 还原
醛 氧化
羧酸
小
O=
结 ⑴ —C—H 氧化(得氧) ,断C—H键:
2CH3CHO + O2
Cu △
2CH3COOH
O= O=
⑵ —C—H 醛还原(加氢) ,断C=O键:
R—C—H + H2
Ni △
应用: a、检验醛基存在,确定醛基数目
b、医院里,利用这一反应原理
检查尿糖是否正常
(检查葡萄糖的醛基)
19
注意
1.Cu(OH)2应现配现用; 2.成功条件:碱性环境、加热.
20
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都O=
2. 氧化反应
(1)催化氧化
2CH3-C-H
+ O2
催化剂 △
乙酸 2CH3-C-OH
(2)燃烧
点燃
2CH3CHO+5O2
人教版化学选修五3.2.1乙醛 课件(共25张PPT)

②水浴加热生成银镜
在配好的上述银氨溶液中滴入三滴乙醛溶液,然后把试管 放在热水浴中静置。
现象: 试管内壁附着一层光亮的银镜。
CH3CHO+2Ag(NH3)2OH
还原剂
氧化剂
CH3COONH4+2Ag↓+3NH3+H2O
银镜反应实验的注意事项:
1.试管内壁应洁净。 2.必须用水浴加热,不能用酒精灯加热。 3.加热时不能振荡试管和摇动试管。 4.配制银氨溶液时,氨水不能过多或过少 (只能加到最初的沉淀刚好消失)。 5.乙醛用量不可太多。 6.实验后,银镜用稀HNO3浸泡,再用水洗。
6、“教学的艺术不在于传授本领,而在于激励、唤醒、鼓舞”。2021年11月下午1时43分21.11.913:43November 9, 2021 ❖ 7、“教师必须懂得什么该讲,什么该留着不讲,不该讲的东西就好比是学生思维的器,马上使学生在思维中出现问题。”“观
察是思考和识记之母。”2021年11月9日星期二1时43分9秒13:43:099 November 2021 ❖ 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午1时43
原因是( B )
A、乙醛溶液太少
B、氢氧化钠不够用
C、硫酸铜不够用
D、加热时间不够.
4、甲醛、乙醛、丙醛组成的混合物里,氢元素的质量分
数是9%,则氧元素的质量分数是( B )
A、16% B、37%
C、48% D、无法计算
银镜反应有什么应用
应用: (1)检验醛基的存在 (2)测定醛基的数目(1mol乙醛发生银 镜反应时最多可生成2molAg) (3)工业上用来制瓶胆和镜子
Ⅱ、与新制的氢氧化铜反应
《乙醛》课件

判断下列物质是否属于醛?
O
√ √ √ CH3CH2CHO H C H CH3
O
√ CH2 CH CH2 C H
O CH3C CH3
O CH
OCH3
√ CHO
O
√H C C H 3
O
√ CH3C CH2CHO
√O O
H CC H
二、乙醛
1、物性:
没有颜色、具有刺激性气味的液体,
比水轻,能跟水、乙醇等有机溶剂互溶,
请议一议:
弱氧化剂可将醛基 氧化,强氧化剂是 否可将醛基氧化
③与氧气反应
催化剂
2 C H 3 C H O + O 2
④与酸性高锰酸钾反应
2 C H 3 C O O H
C H 3 C H O + K M n O 4 + H 2 S O 4 C H 3 C O O H + K 2 S O 4 + M n S O 4 + H 2 O
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
乙醛PPT课件(上课用)
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
O C OH
①银氨溶液作氧化剂 —— 银镜反应
银氨溶液的配制
在洁净的试管里加1mL2%(质量分数)的硝酸银溶 液,然后一边摇动试管,一边逐渐滴入2%(质量分 数)的稀氨水,直到最初产生的沉淀溶解为止。
Ag++NH3·H2O=AgOH+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
请议一议:
弱氧化剂可将醛基 氧化,强氧化剂是 否可将醛基氧化
③与氧气反应
催化剂
2 C H 3 C H O + O 2
④与酸性高锰酸3 C H O + K M n O 4 + H 2 S O 4 C H 3 C O O H + K 2 S O 4 + M n S O 4 + H 2 O
B、加入乙醛太少
C、加入NaOH溶液的量不够
D、加入CuSO4溶液的量不够
练习二
已知:柠檬醛的结构为:
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
4、乙醛的制备
(1)乙醇氧化法:
2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC CH+H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
O C OH
①银氨溶液作氧化剂 —— 银镜反应
银氨溶液的配制
在洁净的试管里加1mL2%(质量分数)的硝酸银溶 液,然后一边摇动试管,一边逐渐滴入2%(质量分 数)的稀氨水,直到最初产生的沉淀溶解为止。
Ag++NH3·H2O=AgOH+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
请议一议:
弱氧化剂可将醛基 氧化,强氧化剂是 否可将醛基氧化
③与氧气反应
催化剂
2 C H 3 C H O + O 2
④与酸性高锰酸3 C H O + K M n O 4 + H 2 S O 4 C H 3 C O O H + K 2 S O 4 + M n S O 4 + H 2 O
B、加入乙醛太少
C、加入NaOH溶液的量不够
D、加入CuSO4溶液的量不够
练习二
已知:柠檬醛的结构为:
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
4、乙醛的制备
(1)乙醇氧化法:
2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC CH+H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
乙醛PPT课件(上课用)4

108.快乐和智能的区别在于:自认 最快乐 的人实 际上就 是最快 乐的, 但自认 为最明 智的人 一般而 言却是 最愚蠢 的。― ―[卡雷 贝·C·科 尔顿]
109.每个人皆有连自己都不清楚的 潜在能 力。无 论是谁 ,在千 钧一发 之际, 往往能 轻易解 决从前 认为极 不可能 解决的 事。― ―[戴尔·卡内基 ]
(2)化学性质 (与乙醛相似)
①还原反应
催化剂
R-CHO +H2 △
R-CH2 OH
②氧化反应
燃烧:
CnH2nO+
3
n 2
1
O2
点燃
nCO2+nH2O
催化氧化得羧酸:
催化剂
氧 化
镜2银R-反C应H:OR-+OCH2O△+2A2g(RN-H3C)2OOOH H△
反
R-COONH4+2Ag+3NH3+H2O
现有一化合物A,是由B、C两物质通过上述
物质的反应生成的。试根据A的结构式写出
B、C的结构式?
OH H
A:CH3-C-CH2-C=O
CH3
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
思考题
1、向乙醛溶液中滴入酸性KMnO4溶液,可观察到的现象是
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
109.每个人皆有连自己都不清楚的 潜在能 力。无 论是谁 ,在千 钧一发 之际, 往往能 轻易解 决从前 认为极 不可能 解决的 事。― ―[戴尔·卡内基 ]
(2)化学性质 (与乙醛相似)
①还原反应
催化剂
R-CHO +H2 △
R-CH2 OH
②氧化反应
燃烧:
CnH2nO+
3
n 2
1
O2
点燃
nCO2+nH2O
催化氧化得羧酸:
催化剂
氧 化
镜2银R-反C应H:OR-+OCH2O△+2A2g(RN-H3C)2OOOH H△
反
R-COONH4+2Ag+3NH3+H2O
现有一化合物A,是由B、C两物质通过上述
物质的反应生成的。试根据A的结构式写出
B、C的结构式?
OH H
A:CH3-C-CH2-C=O
CH3
3、醛基的定量分析
—CHO~2Ag n : 2n
-CHO~2Cu(OH)2~Cu2O n : 2n : n
思考题
1、向乙醛溶液中滴入酸性KMnO4溶液,可观察到的现象是
104.我们最容易不吝惜的是时间, 而我们 应该最 担心的 也是时 间;因 为没有 时间的 话,我 们在世 界上什 么也不 能做。 ――[威 廉·彭]
105.人类的悲剧,就是想延长自己 的寿命 。我们 往往只 憧憬地 平线那 端的神 奇【违 禁词, 被屏蔽 】,而 忘了去 欣赏今 天窗外 正在盛 开的玫 瑰花。 ――[戴 尔·卡内 基]
《乙醛》公开课课件

THANKS
感谢观看
常用催化剂为汞盐,如乙 酸汞等。
反应条件
反应通常在常温常压下进 行,但需注意控制乙炔和 水的比例及反应时间。
乙烯直接氧化法
原理
乙烯在催化剂作用下,与 氧气发生直接氧化反应, 生成乙醛。
催化剂选择
常用催化剂包括钯、铂等 贵金属及其氧化物。
反应条件
反应通常在高温高压下进 行,同时需控制氧气浓度 和反应时间,以避免过度 氧化生成二氧化碳和水。
03
乙醛的制备与合成
乙醇氧化法
01 原理
乙醇在催化剂作用下,与氧气发生氧化反应,生 成乙醛和水。
02 催化剂选择
常用催化剂包括铜、银等金属及其氧化物。
03 反应条件
反应通常在高温高压下进行,以提高反应速率和 产率。
乙炔水化法
01
02
03
原理
乙炔在催化剂作用下,与 水发生加成反应,生成乙 醛。
催化剂选择
乙醛的工业重要性
乙醛是合成乙酸乙酯、乙酸丙酯等酯类的重要原 01 料,这些酯类在涂料、油漆、油墨等领域有广泛
应用。
乙醛可用于生产多聚乙醛,进而合成聚乙烯醇等 02 高分子化合物,这些高分子化合物在纺织、造纸、
皮革等领域有重要作用。
乙醛还可用于合成季戊四醇等多元醇,这些多元 03 醇是生产聚氨酯泡沫塑料等的重要原料。
04
乙醛的反应与应用
乙醛的氧化反应
燃烧反应
乙醛在氧气中完全燃烧,生成二 氧化碳和水。
催化氧化
乙醛在催化剂(如铜)的作用下, 与氧气发生氧化反应,生成乙酸。
银镜反应
乙醛与银氨溶液反应,生成乙酸铵、 银、氨气和水,此反应可用于检验 醛基。
乙醛的还原反应
乙醛教学课件修改精制课件
医学上检验病人是否患糖尿病
精制课件
14
学与问
结合乙醛的结构,说明乙醛 的氧化反应和还原反应有什 么特点?
HO H C CH
H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
总结:CH3CH2OH
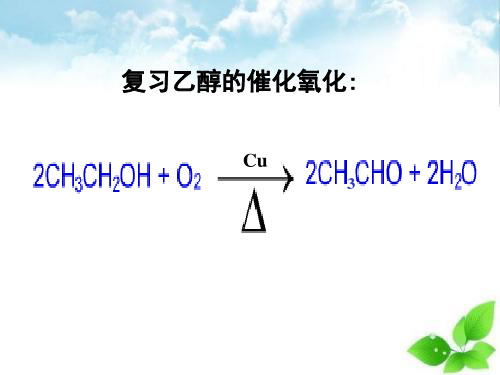
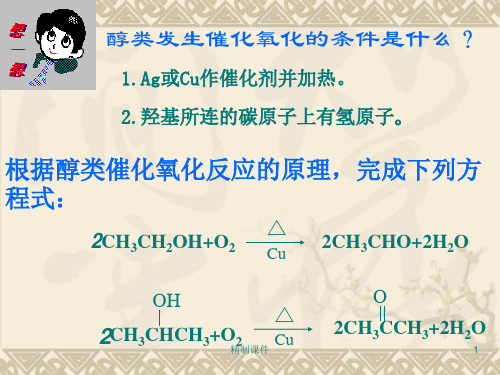
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方
程式:
△ 2CH3CH2OH+O2 Cu
2CH3CHO+2H2O
OH
△
2CH3CHCH3+O精2制课件 Cu
O
2CH3CCH3+2H2O
1
一、醛
醛的定义:
从结构上看,由烃基
氧化 还原
CH3CHO
氧化
CH3COOH
精制课件
15
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能
精制课件
16
乙醛性质的小结:
1、加成反应 醛+H2
醇
2、氧化反应
a 燃烧
b 催化氧化 c 被弱氧化剂氧化 (银氨溶液、新制的Cu(OH)2)
乙酸
d 使酸性高锰酸钾溶液、溴水褪色
精制课件
17
已知:柠檬醛的结构为:
R—C—R
分子式通式为 CnH2nO
官能团: O —C—精制课件
n≥3
29
3. 化学 性质
加氢还原为相应的醇;
不能发生银镜反应;
不与新制Cu(OH)2悬浊液 反应
(可用于鉴别酮与醛)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化 还原
CH3CHO
氧化
CH3COOH
编辑课件
16
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能
编辑课件
17
乙醛性质的小结:
1、加成反应 醛+H2
醇
2、氧化反应
a 燃烧
b 催化氧化 c 被弱氧化剂氧化 (银氨溶液、新制的Cu(OH)2)
乙酸
d 使酸性高锰酸钾溶液、溴水褪色
编辑课件
18
练习二 已知:柠檬醛的结构为:
通常C=O双键加成:H2、HCN C=C双键加成:H2、X2、HX、H2O
编辑课件
8
(2)氧化反应
a. 乙催化醛氧可化以被还原为乙醇, 能否被氧化?
催化剂
2CH3CHO+O2 △ 2CH3COOH
2、氧化反应
编辑课件
9
a.燃烧
点燃
2CH3CHO+5O2
4CO2+4H2O
b.在一定温度和催化剂条件下:
(C*1比原)较不子以互数上为多数同少据系来,物比你的较得有,出机在些物分什,子么熔量结沸接论点近或不时看能,法由通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。 编辑课件
7
(三)乙醛的化学性质
1、加成反应
根据加成反应的概念写出CH3CHO 和H2 加成反应的方程式。
CH3CHO+H2 Ni CH3CH2OH 学与问 这个反应属于氧化反应还是还原反应?为什么?
6. 特殊的醛——甲醛(蚁醛)
(1) 分子式:CH2O O
结构式: H—C—H; 结构简式:HCHO
特殊性:分子中有两个醛基
编辑课件
26
(2) 物性:
含有1-3个碳原子的醛能以任意比例和 水互溶。
编辑课件
24
5. 醛的化学性质
-H(氧化)
+ O(氧化)
醇
醛
酸
+H(还原) (氧化性)
(还原性)
① 与H2加成→醇
② 与O2催化氧化→酸
③ 与银氨溶液 、新制Cu(OH)2悬浊液→酸
④ 与溴水、KMnO4溶液 反应→能使之褪
色(反应式不要求)
编辑课件
25
医学上检验病人是否患糖尿病
编辑课件
15
学与问
结合乙醛的结构,说明乙醛 的氧化反应和还原反应有什 么特点?
HO H C CH
H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
总结:CH3CH2OH
醛的定义:
从结构上看,由烃基
R (或氢原子)跟醛基
(-CHO)相连而成的 化合物叫醛。
编辑课件
3
O
H C H 甲醛
O
CH3CH2 C H
O
CH3 C H 乙醛
丙醛
编辑课件
4
二、乙醛
(一).乙醛的
HO H C CH
H
结构简式 CH3CHO 官能团 醛基: CHO 或
友情 提示
2. 醛类通式: O R—C—H
饱和一元醛的通式为:
CnH2nO
编辑课件
n≥1
22
3. 醛的同分异构体
(1) 写出符合分子式C4H8O属于醛的同 分异构体的结构简式。
(2) 写出符合分子式C5H10O属于醛的同 分异构体的结构简式。
编辑课件
23
4. 物理通性
醛一般有特殊的刺激性气味,密度一 般比水小。
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
先加足量的银氨溶液(或新制的Cu(OH)2)使 醛基氧化。然后再用酸性KMnO4溶液(或溴水) 检验碳碳双键,碳碳双键能使酸性KMnO4溶液 (或溴水)褪色
编辑课件
19
三、乙醛的制备
(1)乙醇氧化法:
2CH3CH2OH+O2
乙醛 醛类
编辑课件
1
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方
程式:
△ 2CH3CH2OH+O2 Cu
2CH3CHO+2H2O
OH
△
2CH3CHCH3+O2 Cu
编辑课件
O 2CH3CCH3+2H2O
2
一、醛
Cu2++2OH-= Cu(OH)2
b、乙醛的氧化:在上述蓝色浊液中加入 0.5ml乙醛溶液,加热至沸腾。
编辑课件
14
现象:有红色(Cu2O)沉淀生成
2Cu(OH)2+CH3CHO+NaOH △ Cu2O↓+CH3COONa+3H2O
注意:氢氧化铜溶液一定要新制 碱一定要过量
应用: 检验醛基的存在
O
O
-C-H O
-C-O-H
2CH3CHO+O2 催化剂 2CH3COOH
编辑课件
10
c. 被弱氧化剂氧化 Ⅰ.银镜反应
配制银氨溶液 :取一洁净试管,加入 1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨 水,至生成的沉淀恰好溶解。
Ag++NH3·H2O→AgOH +NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
醛基的写法,不要写成
编辑课件
O CH COH
5
编辑课件
6
(二)乙醛的物理性质: 密度比水小,沸点20.8℃,易挥发,易燃烧,
能和水、乙醇、乙醚、氯仿等互溶。
名称 分子式 分子量 沸点 溶解性
丙烷 C3H8
44
-42.07 不溶于水
乙醇 C2H6O
46
78.5 与水以任
乙醛 C2H4O
44
20.8 意比互溶
(4)须用新配制的银氨溶液;
(5)配制银氨溶液时,氨水不能过量. (防止生成易爆物质)
(6)实验后,银镜用HNO3浸泡,再用水洗
编辑课件
12
银镜反应有什么应用, 有什么工业价值?
应用: 检验醛基的存在, 工业上用来制瓶胆和镜子
编辑课件
13
Ⅱ.与新制的氢氧化铜反应 [实验3-6 ]
a、配制新制的Cu(OH)2悬浊液:在试管里加入 2ml10%NaOH溶液,滴入2%CuSO4溶液4~6滴, 振荡。
水浴加热生成银镜
:在配好的上述银氨
溶液中滴入三滴乙醛溶液,然后把试管放在热
水浴中静置。
CH3CHO+2Ag(NH3)2OH
△
→CH3COONH4+2Ag↓+3NH3+H2O
由于生成的银附着在试管壁上形成银镜,所以叫银镜反应
编辑课件
11
注意点:
(1)试管内壁必须洁净;
(2)必须水浴;
(3)加热时不可振荡和摇动试管;
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC CH+H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
加压
编辑课件
20
四、乙醛的用途
主要用于生产乙酸、丁醇、乙酸乙酯等, 是有机合成的重要原料。
编辑课件
21
五、醛类
1. 醛的定义:
分子里由烃基(包括氢原子)跟醛基相连 而构成的化合物。
