稳定性品种项目表
原料药与药物制剂稳定性试验指导原则

附录ⅩⅠⅩ C原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用一批原料药或一批制剂进行。
加速试验与长期试验要求用三批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为10 000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的三批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
一、原料药原料药要进行以下试验。
(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用一批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚薄层,进行以下试验。
基于AMMI_模型的辽宁省水稻品种区域试验稳定性及适应性分析

基于AMMI 模型的辽宁省水稻品种区域试验稳定性及适应性分析姜秀英1,于永梅2,马作斌1,吕军1,王丽丽1,李跃东1,韩勇1,解文孝1*(1辽宁省水稻研究所,沈阳110101;2桓仁满族自治县农业综合服务中心,辽宁本溪117200)摘要:为评价辽宁省水稻品种的稳定性、丰产性、适应性及不同试验点的区分力,利用AMMI 模型对2019年辽宁省水稻区域试验中早熟组参试品种及试验点进行分析。
结果表明:基因型、环境、基因型与环境互作方差均达到极显著水平,三者平方和分别占总平方和的17.0%、49.72%、14.19%。
AMMI 模型中前2个主成分值达到极显著水平,共解释76.5%的交互作用,能有效地分析基因与环境互作效应。
源粳2号(g4)、美锋稻245(g2)、富禾稻258(g5)属高产稳产型品种,6个试验点中,区分力最强的是开原市示范繁殖农场(e1)。
关键词:AMMI 模型;水稻;稳定性;适应性水稻是辽宁省第二大粮食作物,在全省粮食生产和经济发展中占有重要地位,筛选适宜辽宁地区种植的水稻品种意义重大。
区域试验对品种丰产性、稳产性、适应性、抗逆性等进行鉴定,并进行品质分析、DNA 指纹检测等,为品种审定和加速良种推广与合理布局提供依据。
基因型与环境互作对作物品种的稳产性和区域适应性具有关键作用[1]。
品种评价必须考虑包括产量在内的多个性状。
进行多性状评价、选育高产稳产及广适型品种是育种家需要解决完成的重要课题。
以往对于区域试验数据的分析大多采用算术平均数、方差分析或线性回归分析等方法,然而这些方法在评价基因型与环境互作时具有较大的局基金项目:省水稻种植结构调整专项-优质高食味水稻新品种选育繁育示范推广;辽宁省应用基础研究计划项目,2022JH2/101300283;沈阳市科技特派团项目,22-319-2-48;中国博士后科学基金面上资助,2022MD713760。
收稿日期:2023-07-10作者简介:姜秀英(1973-),女,副研究员,硕士,主要从事常规水稻品种选育及区域试验工作。
附表12016年春小麦品种布局表

西汉水 流域
克新 2 号、陇薯 7 号、陇薯 6 号
天引薯 3 号、 天引薯 4 号、
克新 3 号、克新 8 号、天薯 12 号
嘉陵江 流域
克新 1 号、克新 2 号、克新 6 号、费乌 瑞它
早 大 白 、 LK99 、 中 薯 2 号、中薯 3 号
陇薯 7 号、荷兰 7 号、荷兰 15 号、 中薯 5 号
兰州 白银 定西 临夏
阴湿山区
陇春 23 号、定丰 17、陇春 32 号
宁春 11 号
高寒阴湿 区
高 原 437 、 高 原 412 、 临 农 20
临麦 32 号
临麦 36
附表 2:
2016 年春播玉米品种布局表
项目 生态类型
主栽品种 沈 单 16 、 东 单 11 号、东单 13 号、富 农 1 号 、 甘 鑫 2818、金凯 2 号、金 凯 3 号、金凯 5 号、 方 玉 36 、 丰 玉 2 号、玉源 7879 、晋 单 60、中地 77、隆 丰9号 金凯 2 号、金凯 5 号、沈单 16 、东单 11 号、东单 13 号、 方 玉 36 、 丰 玉 2 号、玉源 7879 、晋 单 60、 中地 77、富 农 1 号、隆丰 9 号、 豫 玉 22 号 、 正 德 305 、先玉 335 、甘 鑫 2818
示范品种
地区
阴湿山区
金穗 10 号、金穗 2 号、金穗 3 号、金穗 4 号、酒单 3 号
龙生 2 号、 玉源、 879 、 陇单 339、宁 玉 524、甘玉 801 德 美 亚 1 号、东科 502 福地 201、陇 源 961、大丰 30 、 隆 丰 9 号、兴达 4 号 、 宁 玉 524、方玉 36 富 友 968 、 宁 玉 524 、 高 玉 524 、 方 玉 36 、 金 科 2 号 东单 818、中 金 368、兴达 1 号、兴达 5 号、露新 23 号、大丰 30 兴达 1 号、 铁研 26 、铁 研 58 、五谷 704 、兴达 1 号 、 甘 玉 801 、 晋 单 73、华农 866
稳定性试验规定,稳定性指导原则,稳定性试验方法

FDA药物稳定性试验指导原则药品稳定性试验规定每年底制定下年度原料和制剂成品稳定性试验书面计划,内容包括:规格标准、检验方法、检验周期、每批数量、考查项目、考查频次、时间等。
经批准后执行,新开发的制剂品种在开发阶段应制定稳定性计划。
3 公司药品生产用原料稳定性试验可采用影响因素试验法:3.1 将一批供试品除去包装以后,平放在平皿中,在以下条件下按规定贮存,检测重点考查项目各项质量指标的变化情况。
重点考查项目包括:性状、熔点、含量、有关物质、吸湿性及根据药品性质选定的考查项目。
影响因素试验条件:3.1.1 暴露在常温空气中;3.1.2 高温试验,温度分别为60℃、40℃两个温度水平;3.1.3 高湿试验,湿度分别为90%±5%、75%±5%两个湿度水平;3.1.4 强光照射试验,照度为4500LX±500LX4 制剂稳定性试验:4.1 加速试验:取供试品三批,按市售包装,在温度40℃±2℃,相对温度75%±5%的条件下放置6个月,在第一个月、第二个月、第三个月、第六个月末取样检测各剂型规定的重点考查项目的质量指标变化情况。
片剂的重点考察项目为:性状、含量、有关物质、崩解时限或溶出度。
硬胶囊剂的重点考查项目为:外观、内容物色泽、含量、有关物质、崩解时限或溶出度、水份。
液体制剂的重点考察项目为:性状、相对密度、含量、pH值、微生物限度检查。
3个月后测试符合要求,有效期暂定为2年,6个月后测试符合要求有效期暂定为3年。
4.2 长期试验:取供试品三批,按市售包装,在规定保存条件下贮存,每年检测一次,重点考查项目的质量指标变化情况,观察3年的检验结果,以确定产品的贮存期或有效期。
5 严格按照批准的书面稳定性计划,做好试验记录,如发现异常情况,采取措施及时调整。
6 试验结束后,对试验结果进行数理统计后处理,评定并作出结论。
写出稳定性试验报告,所有资料归档保存。
社会稳定风险评估报告表(含维稳办)

盐城市基本建设项目社会稳定风险评估报告表
盐城市基本建设项目社会稳定
风险评估报告填写说明
一、项目基本情况
包括项目投资主体情况,建设地点,主要建设内容和规模,主要生产工艺、设备及数量,主要产品及生产能力,估算总投资和资金来源等
二、项目合法性、合理性、可行性说明
1、合法性。
项目审批、核准相关程序和内容是否合法规范,手续是否完备有效。
2、合理性。
项目建设是否符合大多数群众利益,是否兼顾群众的现实利益和长远利益。
是否尽最大可能维护了所涉及群众的合法权益,拟给予的补偿、安置等是否合理公平及时。
3、可行性。
项目实施是否与本地经济社会发展水平相适应,建设条件是否具备,决策过程是否科学,建设方案是否考虑了群众的接受程序、是否得到了大多数群众支持。
三、项目可控性分析。
工程项目是否存在公共安全隐患,是否会引发群体事件、集体上访,是否会引起社会负面舆论、恶意炒作以及其他影响社会稳定的问题。
可能引发的社会稳定风险是否可控,能否得到有效防范和化解,是否制定了相
应的应急处置预案,宣传解释和舆论引导工作是否充分;针对项目风险点所开展的咨询、公示、听证等情况及其结论;其他有关项目安全性方面的分析
四、项目风险防范措施
包括建立的风险防范组织机构和责任人员,针对可能引发各种社会不稳定因素的处置预案和化解措施
五、评估结论
该项目社会稳定风险等级为高风险、中风险还是低风险,项目方案是否可行,风险是否可控。
六、部门审查意见。
药物稳定性试验指导原则(2015版药典)

药物稳定性试验指导原则(2015版药典)目的:建立一个药物稳定性试验指导原则操作规程,保证稳定性试验顺利进行。
范围:药物制剂。
责任:检验员、QA监控员、化验室主任、质保科科长、质量部负责人。
内容:稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的。
供试品量相当于制剂稳定性实验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。
药物制剂的供试品应是放大试验的产品其处方与生产工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为10 000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊剂型、特殊品种所需数量,根据具体情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
1.原料药原料药要进行以下试验。
1.1影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件与建立降解产物的分析方法提供科学依据。
稳定性试验管理规程

建立完善的稳定性试验管理制度,为药品的生产、包装、储存、运输条件和有效期的确定提供科学依据,以保障药品的安全有效。
并且通过持续稳定性考察检测在有效期内药品的质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。
二、范围:适用于公司所有产品的稳定性试验。
三、职责:品质部:负责稳定性试验样品的取样、管理、检验、记录及报告。
质量受权人:及时掌握产品质量稳定性情况,对异常情况采取纠正预防措施,并组织实施。
四、内容:1. 稳定性试验管理员由品质部授权负责稳定性试验的管理工作,在做稳定性试验前必须先制定稳定性试验方案由品质部负责人批准后,按照方案进行稳定性的试验。
2. 稳定性类型及考察条件2.1药品稳定性分为:影响因素试验、加速试验、长期试验三种。
2.1.1影响因素试验2.1.1.1 高温试验:供试品开口后置于适宜的洁净容器中,于60C的试验条件下放置10天,分别于第5天和第10天取样,按稳定性考察项目进行检测。
如样品发生显著变化(含量低于规定限度)则在40 C条件下同法进行试验。
若60 C无明显变化,不再进行40 C试验。
2.1.1.2 高湿试验:供试品开口置恒湿密闭容器中,于25C、相对湿度90狀5%条件下放置10天,于第5天和第10天取样,按稳定性考察项目进行检测。
同时应准确称量实验前后样品的重量,以考察样品的吸湿潮解性能。
(若吸湿增重5%以上,则应在25C,相对湿度75%± 5%下同法进行试验;若吸湿增重5%以下,且其他考察项目符合要求,则不再进行此条件的试验。
)2.1.1.3 强光照射试验:供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500LX ± 500LX的条件下放置10天,于第5天和第10天取样,按稳定性考察项目进行检测,特别要注意供试品的外观变化。
2.1.2加速试验:供试品在温度40C±2 C,相对湿度75 ± 5%勺试验条件下放置,分别于0, 1, 2, 3, 6个月时取样,按稳定性考察项目进行检测。
食用农产品快检试剂统一参数及重点检测品种项目表
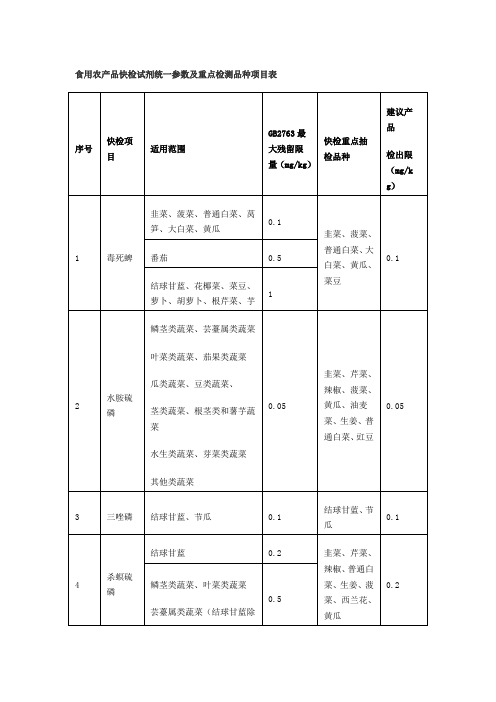
茎类蔬菜、根茎类和薯芋蔬菜
水生类蔬菜、芽菜类蔬菜
其它类蔬菜
1
韭菜、芹菜、普通白菜、油麦菜、辣椒、豇豆、菜豆、马铃薯、萝卜
1.0
结球甘蓝
2
9
甲氰菊酯
结球甘蓝、莴苣、萝卜
0.5
结球甘蓝、莴苣、菠菜、普通白菜、芹菜、大白菜、韭菜
0.5
番茄、椒、菠菜、普通白菜、芹菜、大白菜、韭菜
1
10
联苯菊酯
菠菜、芹菜、大白菜、普通白菜
3
水胺硫磷
豇豆、菠菜、菜薹(菜心)、芹菜、芥菜(叶芥菜)
4
克百威
豇豆、菠菜、菜薹(菜心)、芹菜、四季豆、柑橘、芥菜(叶芥菜)、大白菜、普通白菜
5
氟虫腈
豇豆、菠菜、菜薹(菜心)、芹菜、芥菜(叶芥菜)、大白菜、普通白菜
6
甲基异柳磷
豇豆、菠菜、菜薹(菜心)、芹菜、芥菜(叶芥菜)、大白菜、普通白菜
1
2
水胺硫磷
鳞茎类蔬菜、芸薹属类蔬菜
叶菜类蔬菜、茄果类蔬菜
瓜类蔬菜、豆类蔬菜、
茎类蔬菜、根茎类和薯芋蔬菜
水生类蔬菜、芽菜类蔬菜
其他类蔬菜
0.05
韭菜、芹菜、辣椒、菠菜、黄瓜、油麦菜、生姜、普通白菜、豇豆
0.05
3
三唑磷
结球甘蓝、节瓜
0.1
结球甘蓝、节瓜
0.1
4
杀螟硫磷
结球甘蓝
0.2
韭菜、芹菜、辣椒、普通白菜、生姜、菠菜、西兰花、黄瓜
食用农产品快检试剂统一参数及重点检测品种项目表
序号
快检项目
适用范围
GB2763最大残留限量(mg/kg)
快检重点抽检品种
建议产品
已上市中药制剂变更有效期与稳定性考察分析与探讨

已上市中药制剂变更有效期与稳定性考察分析与探讨摘要】目的:探讨已上市中药制剂变更有效期在稳定性研究方面的必要性和存在的问题。
方法:对已上市中药制剂变更有效期在稳定性考察研究中出现的问题进行分析研究。
结果与结论:通过探讨研究,以期对质量控制影响因素提供更完善的基础性参考依据。
【关键词】中药制剂;有效期变更;稳定性考察;分析与探讨【中图分类号】R92 【文献标识码】B 【文章编号】2095-1752(2018)13-0337-03药品有效期管理是质量管理的重要环节之一。
现行《药品注册管理办法》规定,已上市药品有效期变更由省级药品监督管理部门审批。
在有效期变更审评过程中,制剂质量的稳定性考察是审评一项主要内容。
本文对已上市中药制剂变更有效期在稳定性考察研究中出现的问题进行总结分析,为拟申报上市药品有效期变更的制药企业提供参考。
1.有效期的概述药品的有效期是指药品在规定的贮藏条件下质量能够符合规定要求的期限。
ICH Q1A(R2) “新原料药和制剂的稳定性试验指导原则”中给出有效日期(Expiration Date)的术语解释为:有效日期是印刷在药品容器标签上的一个日期,在此日期前,储存于规定条件下的某一批制剂能保持符合其批准的货架期标准要求,在此日期以后该药将一定不能使用[1]。
药品有效期的确定是依据产品的稳定性试验结果,通过设计试验获得制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此作为药品有效期的确定依据。
2.变更有效期的分类和影响因素国内变更药品的有效期有以下几种情况:(1)延长有效期;(2)缩短有效期;(3)严格贮藏条件;(4)放宽贮藏条件[2]。
一般多是延长有效期,多是为有利于临床品种使用、在市场上与同品种比较优势不明显或原有效期太短不能满足市场要求而变更。
主要有六大影响有效期的因素:处方的变更、工艺的变更、物料的变更、质控方法变更、储存条件的改变、包材的关联变更。
(整理)原料药与药物制剂稳定性试验指导原则

附录ⅪX C原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应足放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为10 000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
一、原料药原料药要进行以下试验。
(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能昀降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤lOmm厚的薄层,进行以下试验。
药物稳定性试验指导原则(2015版药典)
范围:药物制剂。
责任:检验员、QA监控员、化验室主任、质保科科长、质量部负责人。
内容:稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的。
供试品量相当于制剂稳定性实验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。
药物制剂的供试品应是放大试验的产品其处方与生产工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为10 000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊剂型、特殊品种所需数量,根据具体情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
1.原料药原料药要进行以下试验。
1.1影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件与建立降解产物的分析方法提供科学依据。
中药饮片稳定性考察计划.

中药饮片质量稳定性考察计划起草:日期:审核:日期:批准:日期:中药饮片质量稳定性考察计划一、概述药品的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学性质的能力。
中药饮片稳定性研究目的是考察饮片性质在中国药典等法规规定的温度、湿度等储存条件的下随时间变化的规律,为中药饮片的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障中药饮片的安全有效。
根据《稳定性试验考察管理制度》,结合2012年生产炮制类别和品种以及2010版GMP规定,本计划选取净制、切制、炮炙三种炮制类别的每个生产品种的一批产品作为中药饮片的稳定性考察对象,本计划中包括净制、切制、炮炙(炒、煅)的工艺流程图,试验方案、检验方法和检验周期及试验频次、考查项目、稳定性的评价以及对本计划执行过程中的记录和报告等内容。
如在生产过程中,有新增的炮制方法,则应根据生产炮制方法和品种制定补充计划,确保每一种炮制方法和每一生产品种都进行稳定性考察。
二、2013年中药饮片持续稳定性考察计划1继续完成2011-2012年正在进行的批次的稳定性考察,共计111批。
见表1、表2。
22013年样品选取2.1如生产品种为之前已生产过的产品,则选取一批作为稳定性考察样品。
2.2如生产品种为之前未生产的产品,则应选取三批作为稳定性考察样品,为确定贮存期积累稳定性数据。
2.32013年如有工艺验证批次,则应选取验证批次进行加速和长期稳定性考察。
2.4下列情况下,持续稳定性考察中应当额外增加批次数:如重大变更或生产和包装有重大偏差的药品应当列入持续稳定性考察。
此外,重新加工、返工或回收的批次,也应列入考察,除非已经过验证和持续稳定性考察。
2.5如待包装产品的贮存时间进行考察的,至少选取3批中间产品或待包装产品产品进行指定包装条件下放置时间的研究。
3取样量和取样计划3.1稳定性样品的取样量至少为持续稳定性考察周期的检验项目所需检验量的1.5倍量。
3.2取样计划原则上每年选取前三批作为稳定性考察对象;如有2.4项所列情况,则选取该批产品。
原料药与药物制剂持续稳定性考察计划方案
原料药与药物制剂持续稳定性考察计划为考察我公司所有生产品种的质量稳定性,决定对所有生产品种进行长期稳定性考察试验,为确保患者能够安全,有效的用药和对各品种有效期确定等提供有效的数据。
一、稳定性考察要点根据中国药典2010年版二部附录XIX C原料药与药物制剂稳定性试验指导原则、我公司持续稳定性考察主要有下列剂型:二、考察方案1、对每一品种不同包装规格的药品各取一批次产品进行稳定性考察。
2、如发生重大变更或生产和包装有重大偏差的药品应当列入稳定性考察。
3、重新加工、返工或回收的批次,也应当考虑列入考察,除非已经过验证和稳定性考察。
4、每个批次的稳定性试验需制定稳定性试验方案,包括下列内容:(一)每种规格、每个生产批量药品的考察批次数;(二)相关的物理、化学、微生物和生物学检验方法,可考虑采用稳定性考察专属的检验方法;(三)检验方法依据;(四)合格标准;(五)容器密封系统的描述;(六)试验间隔时间(测试时间点);(七)贮存条件(应当采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的长期稳定性试验标准条件);(八)检验项目,如检验项目少于成品质量标准所包含的项目,应当说明理由。
5、考察方法按市售包装,在药品标示的贮存条件下保存12个月,每3个月取样一次,分别于0个月、3个月、6个月、9个月、12个月取样,按各剂型品种具体的稳定性考察项目进行检测。
12个月后,仍需继续考察,分别于18个月、24个月、36个月取样进行检测。
将结果与0个月比较以确定药品有效期。
6、由于实测数据的分散性,按95%可信限进行统计分析,得出合理的有效期。
三、方案的实施本方案由质量管理部完成,记录上述所有数据,并对试验过程中不符合质量标准的结果或重要异常情况记录与调查。
对任何已经确认的不符合质量标准的结果或重大不良趋势,必要对产品实施并召回,并对调查结果和采取的措施报告当地药品监督管理部门。
四、考察结果的报告1、产品稳定性考察完毕后,根据所获得的全部数据资料,包括考察的阶段性结论,撰写总结报告并保存,并定期审核总结报告。
稳定性试验

9 0 0 1 原料药物与制剂稳定性试验指导原则稳定性试验的目的是考察原料药物或制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:( 1) 稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用 1 批原料药物或 1 批制剂进行。
加速试验与长期试验要求用 3 批供试品进行。
( 2)原料药物供试品应是一定规模生产的。
供试品量相当于制剂稳定性试验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为 10 000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3) 供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
( 4) 加速试验与长期试验所用供试品的包装应与上市产品一致。
( 5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检査方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
( 6) 由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转人规模生产时,对最初通过生产验证的3 批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药物,第二部分为药物制剂。
一、原料药物原料药物要进行以下试验。
(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解 >产物分析方法提供科学依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相对密度
酸碱度
微生物
--
6
聚山梨酯80
性状
颜色
水分
酸碱度
乙二醇与二甘醇、环氧乙烷与二氧六环、脂肪酸组成、内毒素
7
单、双硬脂酸甘油酯
性状
酸值
游离甘油
微生物
皂化值、碘值、水分、含量、脂肪酸组成
8
混合脂肪酸甘油酯
性状
酸值
熔点
微生物
--
9
八角茴香油
性状
含量
旋光度
凝点
微生物
10
精制玉米油
性状
相对密度
酸值
脂肪酸组成
附件一 稳定性试验检验项目表
原料药品种:
序号
名称
检验项目
1
甘油
性状
含量
颜色
二甘醇、乙二醇与其他杂质
内毒素、醛与还原性物质、水分
2
蓖麻油
性状
含量
酸值
--
--
3
醋酸
性状
含量
乙醛
--
--
4
稀盐酸
性状
含量
--
--
--
5
甲醛
性状
含量
酸度
--
--
6
松节油
性状
含量
微生物
--
--
7
浓氨溶液
性状
含量
吡啶与相关物质
--
性状
比旋度
溶液的颜色
内毒素
--
19
乙二胺
性状
含量
液体的颜色
--
--
20
磷酸
性状
含量
溶液的澄清度与颜色
--
21
苯甲醇
性状
含量
水分
有关物质
内毒素、酸度、 溶液的澄清度与颜色
22
二甲基亚砜
性状
含量
水分
酸度
有关物质、不挥发残留物
23
枸橼酸
性状
含量
水分
内毒素
溶液的澄清度与颜色
24
氢氧化钠
性状
含量
--
--
--
25
含量
干燥失重
酸碱度
溶液的澄清度与颜色
48
羟苯乙酯
性状
含量
熔点
干燥失重
有关物质、酸度、内毒素、溶液的澄清度与颜色
49
山梨酸
性状
水分
含量
熔点
乙醇溶液的澄清度与颜色
50
羧甲淀粉钠
性状
含量
干燥失重
酸碱度
51
硫酸钙
性状
含量
炽灼失重
酸碱度
--
52
甜菊素
性状
含量
干燥失重
比旋度
酸度、微生物
53
乳糖
性状
含量
有关物质
水分
硫酸铜
性状
含量
干燥失重
酸度
--
16
高锰酸钾
性状
含量
--
--
--
17
氨基己酸
性状
含量
干燥失重
有关物质
溶液的澄清度与颜色、碱度
18
咖啡因
性状
含量
熔点
干燥失重
有关物质
19
茶碱
性状
含量
干燥失重
有关物质
酸度
20
氨茶碱
性状
含量
有关物质
水分
溶液的澄清度
21
二羟丙茶碱
性状
含量
熔点
干燥失重
有关物质、酸碱度、 溶液的澄清度与颜色
44
聚乙二醇4000
性状
凝点
水分
乙二醇、二甘醇、三甘醇
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、微生物
45
聚乙二醇6000
性状
凝点
水分
乙二醇、二甘醇、三甘醇
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、
46
阿司帕坦
性状
含量
干燥失重
有关物质
比旋度、酸度、微生物
47
环拉酸钠
性状
无水亚硫酸钠
性状
含量
硫代硫酸盐
内毒素
溶液的澄清度与颜色
26
亚硫酸氢钠
性状
含量
硫代硫酸盐
内毒素
溶液的澄清度与颜色
27
焦亚硫酸钠
性状
含量
硫代硫酸盐
内毒素
溶液的澄清度与颜色、酸度
28
苯甲酸钠
性状
含量
干燥失重
酸碱度
溶液的澄清度与颜色
29
十二烷基硫酸钠
性状
总醇量
碱度
--
--
30
炉甘石粉(辅料)
性状
钙盐
--
--
性状
含量
干燥失重
酸碱度
溶液的澄清度与颜色、 微生物
59
十六醇
性状
熔点
含量
乙醇溶液的澄清度与颜色、微生物
--
31
硬脂酸
性状
酸值
水溶性酸
含量
凝点、溶液的颜色、微生物
32
硬脂酸镁
性状
干燥失重
含量
酸碱度
微生物
33
羊毛脂
性状
熔点
干燥失重
酸碱度
微生物
34
无水枸橼酸
性状
熔点
水分
含量
内毒素(≤0.25EU/mg)、 溶液的澄清度与颜色
35
枸橼酸钾
性状
水分
含量
酸碱度
微生物
36
依地酸二钠
性状
含量
络合力实验
酸度
溶液的澄清度与颜色
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、微生物
42
聚乙二醇1000
性状
凝点
水分
乙二醇、二甘醇、三甘醇
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、微生物
43
聚乙二醇1500
性状
凝点
水分
乙二醇、二甘醇、三甘醇
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、微生物
微生物
11
水杨酸甲酯
性状
含量
酸度
--
--
12
硫酸
性状
含量
--
--
溶液的澄清度与颜色
13
丁香油
性状
含量
旋光度
溶液的澄清度
--
14
肉桂油
性状
含量
--
--
--
15
大豆油
性状
酸值
水分
折光率
脂肪酸组成、过氧化物、 微生物、碱性杂质
16
三氯甲烷
性状
馏程
酸度与碳酰氯
--
--
17
盐酸
性状
含量
--
--
--
18
蔗糖(精糖)
37
蔗糖
性状
比旋度
溶液的颜色
--
--
38
氢氧化钾
性状
含量
溶液的澄清度
--
39
L-酒石酸
性状
含量
干燥失重
溶液的澄清度与颜色
比旋度、内毒素、微生物
40
聚乙二醇400
性状
凝点
水分
乙二醇、二甘醇、三甘醇
平均分子量、环氧乙烷与二氧六环、酸度、溶液的澄清度与颜色、内毒素
41
聚乙二醇600
性状
凝点
水分
乙二醇、二甘醇、三甘醇
微生物、比旋度、酸度、 溶液的澄清度与颜色
54
硬脂酸聚烃氧(40)酯
性状
酸值
熔点
碱度
溶液的澄清度与颜色、 脂肪酸组成、微生物
55
山梨酸钾
性状
含量
干燥失重
酸碱度
溶液的澄清度与颜色
56
胆固醇
性状
熔点
干燥失重
含量
比旋度、酸度
57
L-苹果酸
性状
水分
含量
有关物质
比旋度、溶液的澄清度与颜色、微生物
58
羧甲基纤维素钠
--
8
磺胺嘧啶银
性状
含量
干燥失重
有关物质
酸度
9
硝酸银
性状
含量
--
--
--
10
枸橼酸钠
性状
含量
干燥失重
内毒素
溶液的澄清度与颜色、碱度
11
无水碳酸钠
性状
含量
干燥失重
内毒素
溶液的澄清度与颜色
12
亚硝酸钠
性状
含量
干燥失重
溶液的颜色
--
13
弱蛋白银
性状
含量
--
--
--
14
硫酸锌
性状
含量
酸度
溶液的澄清度
--
15
27
硼砂
性状
含量
碱度
溶液的澄清度
--
28
硼酸
性状
含量
酸度
溶液的澄清度
乙醇溶液的澄清度
29
尿素
性状
含量
熔点
--
--
30
依地酸钙钠
性状
含量
水分
氨基三乙酸
酸碱度、溶液的澄清度与颜色、内毒素
31
炉甘石粉
性状
含量
