10-3固体吸附物理化学全解
天津大学物理化学第十章 界面现象

4. 亚稳态及新相生成
系统分散度增大、粒径减小引起液滴和固
体颗粒的饱和蒸气压大于普通液体、固体的情
况,只有在粒径很小时才需要考虑。 在蒸气冷凝、液体凝固和沸腾、溶液结晶 等过程中,新相从无到有,最初尺寸极其微小, 比表面积和表面吉布斯函数都很大,新相的产
生非常困难,会出现一些特殊的状态——亚稳
态(介安态)。
dG dA 8πr dr
pr 4πr 2 (dr ) pr dG (dn) RT ln RT ln p M p
dG dA 8πr dr
pr 2 M RT ln p r
开尔文公式
由Kelvin公式可知: 凸液面 r 越小pr 越大 p 2 M 对于凹液面: RT ln pr r 比较饱和蒸气压: p凸> p平> p凹
吸附等温线:
Va
Ⅰ
Va
Ⅱ
0
Va
Ⅲ
p/p*
Ⅳ
1
0 Va
p/p*
Ⅴ
1
Va
0p/p*ຫໍສະໝຸດ 10p/p*
1
0
p/p*
1
p: 达平衡时的吸附压力; p*: 该温度下吸附气体的饱和蒸气压。
2. 吸附经验式——弗罗因德利希公式
Freundlich用指数方程描述 型吸附等温线
V a kpn
n、k 是两个经验参数,均是 T 的函数。 k: 单位压力时的吸附量。一般T ,k; n :介于0~1之间,反映 p 对V a 影响的强弱。 直线式: lgV
§10.4 液 - 固界面
固体表面力场不对称,存在润湿和吸附 1. 接触角与杨氏方程
平衡时
cos
s ls lg
固体表面吸附和催化

稳定的表面团簇; 表面的台和阶:平台(Terrace)是指台阶的平坦晶面,
台阶(step)是指台阶平台之间的阶越部分; 空位(Vacancy):平台上尚未被填充的单原子空位; 扭折(Kink):指沿step拐折的内角;
• 如活性炭、氧化铝、硅胶、聚酰胺、硅酸 镁、滑石粉、氧化钙(镁)、淀粉、纤维 素和蔗糖等。
• 分类:吸附剂可按孔径大小、颗粒形状、化学成 分、表面极性等分类,如粗孔和细孔吸附剂,粉 状、粒状、条状吸附剂,碳质和氧化物吸附剂, 极性和非极性吸附剂等。
吸附剂的选择(制造困难,理论缺乏)
1、选择性高(如分子筛)(1)孔道(2)极性
催化剂
催化剂-反应物
产物
催化剂的特性
• 加快化学反应的速度,但不进入化学反应 计量
• 催化剂对反应有选择性 • 只能加速热力学上可能的反应 • 不改变化学平衡的位置 • 催化剂可使化学反应经由只需较少活化能
(activation energy)的路径来进行化学 反应。
固体催化剂的构成
• 载体(Al2O3 ) • 主催化剂(合成NH3中的Fe) • 助催化剂(合成NH3中的K2O) • 共催化剂(石油裂解SiO2-Al2O3)
13X分子筛除能吸附5A分子筛所 能吸附的物质外,还能吸附 CHCl3,CHBr3,CHI3,CCl4,CBr4,C6H6, N-C3F8,C(CH3)3OH,仲丁醇,环已 烷,异构烷烃,甲苯等。
由于具有很高的催化活性,可用 于催化剂的载体。
固体的应用(2)——催化剂
• 定义:根据IUPAC于1981年提出的定义, 催化剂是一种物质,它能够加速反应的速 率而不改变该反应的标准Gibbs自由焓变化。 这种作用称为催化作用。涉及催化剂的反 应为催化反应。
物理化学实验答案1

物理化学实验答案1一、溶液中的等温吸附五、注意事项1.溶液的浓度配制要准确,活性炭颗粒要均匀并干燥2.醋酸是一种有机弱酸,其离解常数Ka=1.76某,可用标准碱溶液直接滴定,化学计量点时反应产物是NaAc,是一种强碱弱酸盐,其溶液pH 在8.7左右,酚酞的颜色变化范围是8-10,滴定终点时溶液的pH正处于其内,因此采用酚酞做指示剂,而不用甲基橙和甲基红。
直到加入半滴NaOH标准溶液使试液呈现微红色,并保持半分钟内不褪色即为终点。
3.变红的溶液在空气中放置后,因吸收了空气中的CO2,又变为无色。
4.以标定的NaOH标准溶液在保存时若吸收了空气中的CO2,以它测定醋酸的浓度,用酚酞做为指示剂,则测定结果会偏高。
为使测定结果准确,应尽量避免长时间将NaOH溶液放置于空气中。
七、讨论1.测定固体比表面时所用溶液中溶质的浓度要选择适当,即初始溶液的浓度以及吸附平衡后的浓度都选择在合适的范围内。
既要防止初始浓度过高导致出现多分子层吸附,又要避免平衡后的浓度过低使吸附达不到饱和。
2.按朗格谬尔吸附等温线的要求,溶液吸附必须在等温条件下进行,使盛有样品的磨口锥形瓶置于恒温器中振荡,使之达到平衡。
本实验是在空气浴中将盛有样品的磨口锥形瓶置于振荡器上振荡。
实验过程中温度会有变化,这样会影响测定结果。
3.由实验结果可知,活性炭在醋酸溶液中的吸附为单分子层吸附,可用Langmuir吸附等温式表征其吸附特性。
用溶液吸附法测定活性炭比表面积,不需要特殊仪器,但测定过程中要防止溶剂挥发,以免引起测量误差。
此外,由于忽略界面上被溶剂占据部分,因此由这一方法所测得的比表面积一般偏小。
但由于方法简便,可以作为了解固体吸附剂特性的一种简便方法。
八、思考题(供参考)1.吸附作用与哪些因素有关?固体吸附剂吸附气体与从溶液中吸附溶质有何不同?答:吸附作用与温度、压力、溶剂、吸附质和吸附剂性质有关。
固体在溶液中的吸附,除了吸附溶质还有溶剂,液固吸附到达平衡时间更长;固体吸附剂吸附气体受温度、压力及吸附剂和吸附质性质影响:气体吸附是放热过程,温度升高吸附量减少;压力增大,吸附量和吸附速率增大;一般吸附质分子结构越复杂,被吸附能力越高。
天津大学物理化学课件 界面现象

3. 吸附经验式——弗罗因德利希公式
对I类吸附等温线:
lgV a nlgplgkk, n 经验常数, 与吸附体系及T 有关。
直线式:
bp
1
bp
lg(Va/[ V])
T1 <T2
斜率 n; 截距 k(p =1时的吸附量)
T,k
lg(p/[p])
方程的优点:(1) 形式简单、计算方便、应用广泛;
直径:1cm 表面积:3.1416 cm2
直径:10nm 表面积:314.16 m2
表面积是原来的106倍
界面相示意图
一些多孔物质如:硅胶、活性炭等,也具有很大的比表面积。
3
物质的分散度可用比表面积as来表示,其定义为 as = As/m
单位为m2kg-1。
小颗粒的分散系统往往具有很大的比表面积,因此 由界面特殊性引起的系统特殊性十分突出。
——过饱和蒸气,过热液体,过冷液体,过饱和溶液
27
§10-3 固体表面
在固体或液体表面,某物质的浓度与体相浓度不同 的现象称为吸附。
产生吸附的原因,也是由于表面分子受力不对称。
dG = dA+Ad
被吸附的物质—— 有吸附能力的物质——
28
1. 物理吸附与化学吸附:
性质 吸附力 吸附层数 吸附热 选择性 可逆性 吸附平衡
26
(4) 过饱和溶液
na
n m
溶液浓度已超过饱和 液体,但仍未析出晶体的 溶液称为过饱和溶液。
原因:小晶体为凸面, pr>p , 表明分子从固相中逸出的倾向大 , 这造成它的浓度大,即溶解度大, 由此产生过饱和现象。
由于小颗粒物质的表面特殊性,造成新相难以生成, 从而形成四种不稳定状态(亚稳态):
最全的物理化学名词解释

最全的物理化学名词解释材料人考学饱和蒸汽压:单位时间内有液体分子变为气体分子的数目与气体分子变为液体分子数目相同,宏观上说即液体的蒸发速度与气体的凝结速度相同的气体称为饱和蒸汽,饱和气体所具有的压力称为饱和蒸汽压。
敞开体系:体系与环境之间既有物质交换,又有能量交换。
封闭体系:体系与环境之间无物质交换,但有能量交换孤立体系:体系与环境之间既无物质交换,又无能量交换,故又称为隔离体系。
广度量和强度量:是指与物质的数量成正比的性质,如系统物质的量,体积,热力学能,熵等。
具有加和性,在数学上是一次齐函数,而是指与物质无关的性质,如温度压力等平衡态:系统内部处于热平衡、力平衡、相平衡、化学平衡状态函数:体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关;它的变化值仅取决于体系的始态和终态,而与变化的途径无关。
具有这种特性的物理量称为状态函数。
热:体系与环境之间由于温度的不同而传递的能量称为热。
功:体系与环境之间传递的除热以外的其它能量都称为功。
摩尔相变焓:是指单位物质的量的物质在恒定温度T及该温度平衡压力下发生相变时对应的焓变标准摩尔生成焓:在温度为T的标准态下,由稳定相态的单质生成化学计量数VB=1的β相态的化合物B 该生成反应的焓变称为该化合物B在温度T时的标准摩尔生成焓。
标准摩尔燃烧焓:在标准压力下,反应温度时,1摩尔反应物质B完全氧化成相同温度的指定产物时的标准摩尔反应焓。
可逆过程:我们把某一体系经过某一个过程,如果能使体系和环境都完全复原,则该过程称为“可逆过程”。
反应热当体系发生反应之后,使产物的温度回到反应前始态时的温度,体系放出或吸收的热量,称为该反应的热效应。
溶解热:在恒定的T、p下,单位物质的量的溶质B溶解与溶剂A中,形成B的摩尔分数xB=0.1的溶液时,过程的焓变。
稀释热:在恒定的T、p下,某溶剂中质量摩尔浓度b1的溶液用同样的溶剂稀释成为质量摩尔浓度b2的溶液时,所引起的每单位物质的量的溶质之焓变。
吸附(物理吸附与化学吸附)在催化中的应用

物理吸附与化学吸附在催化中的应用摘要:吸附过程与催化作用在国民经济和环境保护方面具有重要意义。
他们是化学工业,石油炼制以及国民经济其他领域最活跃的研究课题之一。
这两个领域涉及到的都是表面现象,使用的都是多孔固体。
吸附是催化反应得以发展的最关键步骤之一,通过它揭示催化本质和研究催化性质越来越受到人们的重视,因此许多在线原位动态测量技术得以快速发展。
关键词:物理化学吸附表征测定孔结构气体探针1. 吸附现象吸附:当流体与多孔固体接触时, 流体中某一组分或多个组分在固体表面处产生积蓄, 此现象称为吸附。
吸附也指物质(主要是固体物质)表面吸住周围介质(液体或气体)中的分子或离子现象[1,2]。
实际上,人们很早就发现并利用了吸附现象,如生活中用木炭脱湿和除臭等。
随着新型吸附剂的开发及吸附分离工艺条件等方面的研究,吸附分离过程显示出节能、产品纯度高、可除去痕量物质、操作温度低等突出特点,使这一过程在化工、医药、食品、轻工、环保等行业得到了广泛的应用,例如:(1)气体或液体的脱水及深度干燥,如将乙烯气体中的水分脱到痕量,再聚合。
(2)气体或溶液的脱臭、脱色及溶剂蒸气的回收,如在喷漆工业中,常有大量的有机溶剂逸出,采用活性炭处理排放的气体,既减少环境的污染,又可回收有价值的溶剂。
(3)气体中痕量物质的吸附分离,如纯氮、纯氧的制取。
(4)分离某些精馏难以分离的物系,如烷烃、烯烃、芳香烃馏分的分离。
(5)废气和废水的处理,如从高炉废气中回收一氧化碳和二氧化碳,从炼厂废水中脱除酚等有害物质。
1.1吸附吸附属于一种传质过程,物质内部的分子和周围分子有互相吸引的引力,但物质表面的分子,其中相对物质外部的作用力没有充分发挥,所以液体或固体物质的表面可以吸附其他的液体或气体,尤其是表面面积很大的情况下,这种吸附力能产生很大的作用,所以工业上经常利用大面积的物质进行吸附,如活性炭、水膜等。
当液体或气体混合物与吸附剂长时间充分接触后,系统达到平衡,吸附质的平衡吸附量(单位质量吸附剂在达到吸附平衡时所吸附的吸附质量),首先取决于吸附剂的化学组成和物理结构,同时与系统的温度和压力以及该组分和其他组分的浓度或分压有关。
物理化学知识点chap 10

Pa
2.356
103
kPa
【10.5】水蒸气迅速冷却至298.15K时可达到过饱和状态。已
知该温度下水的表面张力为71.97×10-3 N·m -1 ,密度为997
kg·m-3。 当过饱和水蒸气压力为平液面水的饱和蒸气压的4
倍时,计算: (1)开始形成水滴的半径;(2)每个水滴中
所含水分子的个数。
m
= 7.569 ? 10- 10m
(2)每个水滴的体积
( ) V 水滴=
4 3
pr
3
=
4 创3.14 3
7.569 ? 10- 10 3 m 3
1.815 ? 10- 27m 3
每个水分子的体积
V 水分子=
M rL
=
骣 琪 琪 琪 桫997
创
0.018 6.022
m 3 = 3.00 ? 10- 29m 3 1023
分析: 利用拉普拉斯方程
p 2
r
解: (1)和(2)两种情况下均只存在一个气-液界面, 其附加压力相同。根据拉普拉斯方程
p
2
r
2 58.91103 0.1106
Pa
1.178
103
kPa
(3)空气中存在的气泡,有两个气-液界面,其附加压力 为
p
4
r
4
58.91103 0.1106
•
pg
••
•
气
•
p
• •
pl
(a)
pg
• 气 p • •
液•
pl (b)
附加压力方向示意图
•
•
气•
•
•
• •
p=• 0
半导体材料(复习资料)

半导体材料(复习资料)半导体材料复习资料0:绪论1.半导体的主要特征:(1)电阻率在10-3 ~ 109 ??cm 范围(2)电阻率的温度系数是负的(3)通常具有很高的热电势(4)具有整流效应(5)对光具有敏感性,能产生光伏效应或光电导效应2.半导体的历史:第一代:20世纪初元素半导体如硅(Si)锗(Ge);第二代:20世纪50年代化合物半导体如砷化镓(GaAs)铟磷(InP);第三代:20世纪90年代宽禁带化合物半导体氮化镓(GaN)碳化硅(SiC)氧化锌(ZnO)。
第一章:硅和锗的化学制备第一节:硅和锗的物理化学性质1.硅和锗的物理化学性质1)物理性质硅和锗分别具有银白色和灰色金属光泽,其晶体硬而脆。
二者熔体密度比固体密度大,故熔化后会发生体积收缩(锗收缩5.5%,而硅收缩大约为10%)。
硅的禁带宽度比锗大,电阻率也比锗大4个数量级,并且工作温度也比锗高,因此它可以制作高压器件。
但锗的迁移率比硅大,它可做低压大电流和高频器件。
2)化学性质(1)硅和锗在室温下可以与卤素、卤化氢作用生成相应的卤化物。
这些卤化物具有强烈的水解性,在空气中吸水而冒烟,并随着分子中Si(Ge)?H键的增多其稳定性减弱。
(2)高温下,化学活性大,与氧,水,卤族(第七族),卤化氢,碳等很多物质起反应,生成相应的化合物。
注:与酸的反应(对多数酸来说硅比锗更稳定);与碱的反应(硅比锗更容易与碱起反应)。
2.二氧化硅(SiO2)的物理化学性质物理性质:坚硬、脆性、难熔的无色固体,1600℃以上熔化为黏稠液体,冷却后呈玻璃态存在形式:晶体(石英、水晶)、无定形(硅石、石英砂) 。
化学性质:常温下,十分稳定,只与HF、强碱反应3.二氧化锗(GeO2)的物理化学性质物理性质:不溶于水的白色粉末,是以酸性为主的两性氧化物。
两种晶型:正方晶系金红石型,熔点1086℃;六方晶系石英型,熔点为1116℃化学性质:不跟水反应,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。
中科院固体表面物理化学期末考试总结

表界面的分类:气-液;气-固;液-液;液-固;固-固✧表面浓度✧分散度✧表面形貌非均匀性原因:由于固体表面原子的组成、排列、振动状态和体相原子的不同,由于悬挂键导致的化学性质活泼,以及周期性的势场中断导致的表面电子状态差异,固体表面形成很多导致表面形貌非均匀性的元素。
✧位错密度✧表面粗糙度:✧原矢✧米勒指数(miller index)✧晶面间距d hkl✧✧✧表面自由能✧减小表面能的方法✧表面原子重排机理1:表面弛豫作用2:表面相转变3:吸附对纯净底物表面结构的影响层间距的变化;重组的表面结构的变化;吸附原子可以诱导表面重组✧内外表面内表面:多孔或多层材料,孔内或层间的表面比表面积:单位质量材料的表面积;用BET方法测量1.固体表面性质简介固体表面的性质结构特征:不同的位置有不同的性质表面运动:气体分子表面撞击速度;表面扩散系数(爱因斯坦方程):外延生长原子的运动流程:a沉积/吸附在平台上-deposition;b沉积在原子岛上;c 平台上扩散-diffusion;d脱附-desorption;e成核-nucleation;f交互扩散-interdifusion;g粘附在平台上-attachment;h从平台上脱离-detachment;i:粘附在台阶上化学性质:表面浓度依赖于气体分子撞击速度R相界面(Gibbs界面)表面热力学函数其他类推:S,G,G s比表面自由能与温度的关系; ;Van der Waals and Guggenheim Equation:Where: T c为临界温度;为0Kし的表面张力;固体表面能的理论估算金属表面张力估算;偏析作用来自晶体或固溶体中的杂质或溶质在界面聚集的现象表面偏析公式:正规溶液参数扩散扩散:由热运动引起杂质原子、基质原子或缺陷输运的过程原因:原子或离子分布不均匀,存在浓度梯度,产生定向扩散扩散机理:间隙扩散,空位扩散,环形扩散表面扩散靠吸附原子或平台空位的运动实现。
实验19固体在溶液中的吸附

物理化学实验备课材料 实验19 固体在溶液中的吸附当固体和溶液接触时,其表面总是被溶质和溶剂分子所占满,即溶液中的固相吸附是溶质和溶剂分子争夺表面的净结果。
溶质在固体表面或自然胶体表面上相对聚集的现象称为吸附。
另一方面,溶质在自然胶体或固体表面上浓度升高、在液相中浓度下降的现象也被称为吸附。
考虑到这种吸附是一种表观现象,所以又称为吸着或吸持。
吸持(或吸着)包括吸附、表面沉淀和聚合等。
吸附溶质的胶体或固体称为“吸附剂”,被吸附的溶质称为“吸附质”。
吸附的分类有多种。
归纳起来主要包括:(1)物理吸附(固体通过范德华引力的作用吸附周围分子)和化学吸附(固体通过化学键力的作用吸附周围分子);(2) 选择吸附(固体从溶液中选择吸附某种离子)、分子吸附(固体在溶液中等当量地吸附正离子和负离子)和交换吸附(固体从溶液中吸附了一种离子,同时又放出一种离子);(3)专性吸附(吸附剂和吸附质的结合力较强)和非专性吸附(吸附剂和吸附质的结合力较弱);(4)表面吸附(又称物理吸附)、离子交换吸附(固体对各种离子的吸附)和专属吸附(吸附过程中既有化学键的作用,也有加强的憎水键和范德华力作用)。
在各种分类中,物理吸附和化学吸附因充分考虑了吸附分子与表面固体分子或原子间的相互作用力性质而相对有助于揭示吸附机制。
固相表面的吸附过程和特征可用非线性吸附等温式来描述 ,其中常用的有Langmuir 和Freundlic 吸附等温式。
固体在溶液中的吸附是最常见的吸附现象之一,许多吸附剂、催化剂载体及粉状填料如硅胶、活性氧化铝、硅藻土以及各种吸附树脂等都是多孔性物质,具有高度发达的比表面,根据其组成和结构的差异,各有不同的吸附特性。
活性炭(activated carbon)是一种主要的吸附剂,用途广泛,气相吸附中可用于吸附各类有机蒸气、油品蒸气及许多有害气体,也可用于对溶液中某种物质的吸附。
活性炭在水溶液中对不同吸附质有着不同的吸附能力,根据这种吸附作用的选择性,在工业上有着广泛的应用,如各种水溶液的脱色、除臭,水的净化,食品、药物的精制提纯以及废水处理等。
物理化学知识点(全)
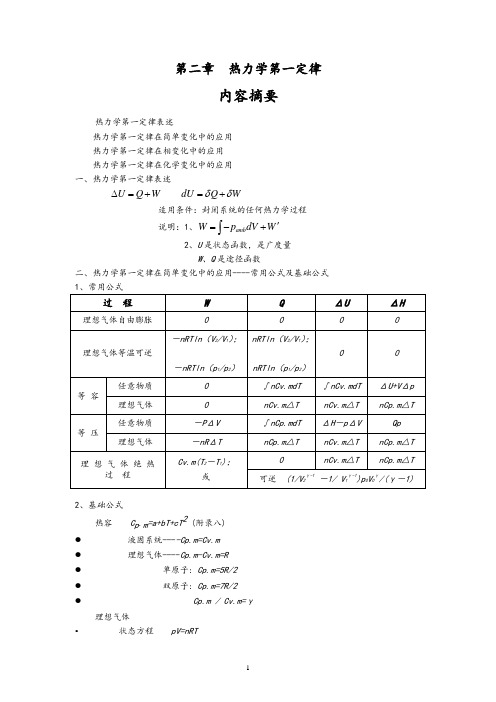
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
吸附热力学-吸附及吸附过程PPT课件

1.2 吸附热力学
✓气体混合吸附的Lngmuir等温式
两式联立解得qA,qB分别为:
A
apA
1apAa'
pB
B
apB
1apAa'
pB
对i种气体混合吸附的Lngmuir吸附公式为:
i
ai pi
i
1 a i p i
1
2024/1/9
2021
21
3)Langmuir吸附等温式
1.2 吸附热力学
Langmuir吸附等温式的缺点: ①假设吸附是单分子层的,与事实不符。 ②假设表面是均匀的,其实大部分表面是不均匀的。 ③在覆盖度q 较大时,Langmuir吸附等温式不适用。
✓它意味着吸附热与覆盖度无关。它适用于覆盖度不太大 的情况,
✓Langmuir公式只适用于固体表面的单分子层吸附,它仅 适用于Ⅰ型等温线的气体吸附。
✓Langmuir吸附等温式既适用于物理吸附又适用于化学吸附。
2024/1/9
2021
22
4)BET 吸附等温式
1.2 吸附热力学
为了解决更多的实验问题,1938年, Brunauer(布诺尔)、 Emmett (埃 米特)和Teller (特勒)三人在朗缪尔单分子层吸附理论基础上提出多分子层 吸附理论(公式),简称BET理论(公式)。
第一章 吸附及吸附过程
1.2 吸附热力学
(1) 吸附等温线 (2) 吸附等压线 (3) 吸附等量线 (4) 吸附等温方程 (5) 吸附热
2024/1/9
2021
1.2 吸附热力学
1
(2) 吸附等压线
1.2 吸附热力学
在吸附压力恒定时,吸附量随吸附温度的变化而变化,可
2-物理吸附

关于孔径分布
一般用脱附支来计算孔径分布,理由:
• 理想的圆柱形孔,吸附支和脱附支重合 • 对两端开口的圆柱形孔,吸附支对应的弯液面曲
率是圆柱面,脱附支对应的才是孔口出形成的弯 月面 • 平板孔和由片状粒子形成的狭缝型孔,吸附时不 发生毛细凝聚,只有脱附支才反应真实的孔隙 • 对墨水瓶型的孔,脱附支反应的是孔口的尺寸, 对催化研究最有意义
现代催化剂表征方法-辛勤主编,page16
吸附等温线形状分析
II型等温线反映的是非孔性材 料或者大孔吸附剂上的物理吸 附过程。BET公式最常说明的 对象!
现代催化剂表征方法-辛勤主编,page16
吸附等温线形状分析
III型等温线比较少见,没有拐 点,曲线下凹是由于吸附质分 子的相互作用比吸附质和吸附 剂之间的强造成的。 BET公式C小于2,可以描述这 种吸附等温线。
• 已知饱和吸附量Vml及每个被吸附分子的截 面积αm,便可以求算吸附剂的比面积αs αs = Vml/V0 L αm
V0:1mol气体在标准状况下的体积(0度,1atm) L:阿伏伽德罗常数 在实验上
比表面积的求算就变成吸附等温线的测量,
仪器测定的是吸附体积随着压力(p/p0)的变化
Langmuir只适用单层吸附,且吸附质没有相互作用的情况,复杂情况处理不了
以微孔为主的样品的比表面计算应该用Langmuir 方程, 但是……
选点和测试时,仪 器上可以调变的
复杂问题简单化,实际情况理想化,抽提 模型,再结合实际情况对模型进行修正, 是物理化学处理问题的主要哲学思想!如 朗格缪尔单分子吸附模型,理想气体状态
方程等
这些模型巧妙的排除了错综复杂的次要矛盾的干扰,突 出了事物的主要矛盾,揭示了事物的本质!因而是最简 单,最具有代表意义的科学模型
物理化学第五版课后习题答案

第十章 界面现象10-1 请回答下列问题:(1) 常见的亚稳定状态有哪些为什么产生亚稳态如何防止亚稳态的产生(2) 在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间放置后,会出现什么现象(3) 下雨时,液滴落在水面上形成一个大气泡,试说明气泡的形状和理由 (4) 物理吸附与化学吸附最本质的区别是什么(5) 在一定温度、压力下,为什么物理吸附都是放热过程答: (1) 常见的亚稳态有:过饱和蒸汽、过热液体、过冷液体、过饱和溶液。
产生这些状态的原因就是新相难以生成,要想防止这些亚稳状态的产生,只需向体系中预先加入新相的种子。
(2) 一断时间后,大液滴会越来越大,小液滴会越来越小,最终大液滴将小液滴“吃掉”, 根据开尔文公式,对于半径大于零的小液滴而言,半径愈小,相对应的饱和蒸汽压愈大,反之亦然,所以当大液滴蒸发达到饱和时,小液滴仍未达到饱和,继续蒸发,所以液滴会愈来愈小,而蒸汽会在大液滴上凝结,最终出现“大的愈大,小的愈小”的情况。
(3) 气泡为半球形,因为雨滴在降落的过程中,可以看作是恒温恒压过程,为了达到稳定状态而存在,小气泡就会使表面吉布斯函数处于最低,而此时只有通过减小表面积达到,球形的表面积最小,所以最终呈现为球形。
(4) 最本质区别是分子之间的作用力不同。
物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
(5) 由于物理吸附过程是自发进行的,所以ΔG <0,而ΔS <0,由ΔG =ΔH -T ΔS ,得 ΔH <0,即反应为放热反应。
10-2 在及下,把半径为1×10-3m 的汞滴分散成半径为1×10-9m 的汞滴,试求此过程系统表面吉布斯函数变(ΔG )为多少已知时汞的表面张力为 N ·m -1。
解: 3143r π=N×3243r π N =3132r rΔG =21A A dA γ⎰=(A 2-A 1)=4·( N 22r -21r )=4·(312r r -21r )=4××(339 (110)110--⨯⨯-10-6)=J10-3 计算时时,下列情况下弯曲液面承受的附加压力。
物理化学5.5-1 固体表面的吸附-物理吸附和化学吸附

应用举例:
石油加工,气体纯化, 催化合成,污水处理, 空气净化(防毒面具), 空气的变压吸附分离, 洁净能源(储氢材料) 。
物理吸附和化学吸附
——按吸附作用力性质的不同区分
表5.6 物理吸附与化学吸附的区别
吸附性质
物理吸附
化学吸附
吸附力
分子间力
化学键力
吸附热
小
大
吸附分子层
单层或多层Байду номын сангаас
单层
吸附选择性
的途径(需能量ED)
容易的多。
Cu上氢的吸附势能曲线
无
有
脱附温度
低
高
吸附平衡/可逆性 易达到/可逆
不易达到/不可逆
用吸收光谱可鉴别物理吸附、化学吸附
——在紫外-可见-红外光谱区,出现新的特征吸收带,说明存在化学吸附。
温度可改变吸附力的性质 物理吸附(aa线)在一定条件下可转变为化学吸附(bb线) 。
从能量上看, 先发生物理吸附而 后转变为化学吸附 的途径(需能量 Ea), 要比氢分子先解离 成原子再化学吸附
§5.5 固体表面对气体的吸附
产生吸附的热力学原因
物理吸附和化学吸附
兰缪尔吸附理论
两种吸附质(A和B)竞争同一种吸附位
吸附质的对称解离吸附
吸附过程示意
贵金属 表面吸附示意吸附漏油— 图片产生表面现象的热力学原因
在定温、定压、定组成下,有
dGT , p,nB dAs <0
为使表面能降低,固体表面会自发地利用其未饱和 的自由价来捕获气相或液相中的分子,使之在固体表面 上浓集,这一现象称为固体对气体或液体的吸咐。
例如在罗丹明B的水溶液中加入一些活性炭,溶液的 颜色将逐渐变浅,说明RhB逐渐富集于活性炭表面。
物理化学第五版课后习题答案

第十章 界面现象10-1 请回答下列问题:(1) 常见的亚稳定状态有哪些?为什么产生亚稳态?如何防止亚稳态的产生?(2) 在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间放置后,会出现什么现象?(3) 下雨时,液滴落在水面上形成一个大气泡,试说明气泡的形状和理由? (4) 物理吸附与化学吸附最本质的区别是什么?(5) 在一定温度、压力下,为什么物理吸附都是放热过程?答: (1) 常见的亚稳态有:过饱和蒸汽、过热液体、过冷液体、过饱和溶液。
产生这些状态的原因就是新相难以生成,要想防止这些亚稳状态的产生,只需向体系中预先加入新相的种子。
(2) 一断时间后,大液滴会越来越大,小液滴会越来越小,最终大液滴将小液滴“吃掉”, 根据开尔文公式,对于半径大于零的小液滴而言,半径愈小,相对应的饱和蒸汽压愈大,反之亦然,所以当大液滴蒸发达到饱和时,小液滴仍未达到饱和,继续蒸发,所以液滴会愈来愈小,而蒸汽会在大液滴上凝结,最终出现“大的愈大,小的愈小”的情况。
(3) 气泡为半球形,因为雨滴在降落的过程中,可以看作是恒温恒压过程,为了达到稳定状态而存在,小气泡就会使表面吉布斯函数处于最低,而此时只有通过减小表面积达到,球形的表面积最小,所以最终呈现为球形。
(4) 最本质区别是分子之间的作用力不同。
物理吸附是固体表面分子与气体分子间的作用力为范德华力,而化学吸附是固体表面分子与气体分子的作用力为化学键。
(5) 由于物理吸附过程是自发进行的,所以ΔG <0,而ΔS <0,由ΔG =ΔH -T ΔS ,得 ΔH <0,即反应为放热反应。
10-2 在293.15K 及101.325kPa 下,把半径为1×10-3m 的汞滴分散成半径为1×10-9m 的汞滴,试求此过程系统表面吉布斯函数变(ΔG )为多少?已知293.15K 时汞的表面张力为0.4865 N ·m -1。
解: 3143r π=N ×3243r π N =3132r rΔG =21A A dA γ⎰=γ(A 2-A 1)=4πγ·( N 22r -21r )=4πγ·(312r r -21r )=4π×0.47×(339(110)110--⨯⨯-10-6)=5.9062 J10-3 计算时373.15K 时,下列情况下弯曲液面承受的附加压力。
氧气在某固体表面上的吸附-概述说明以及解释

氧气在某固体表面上的吸附-概述说明以及解释1.引言1.1 概述氧气在固体表面上的吸附是一种重要的表面现象,它在很多领域都具有广泛的应用价值。
随着科技的发展,人们对氧气吸附的研究越来越深入,对其机理和影响因素有了更加清晰的认识。
氧气吸附是指氧气分子在固体表面上附着并与表面原子或分子发生作用。
这种吸附过程既可以是物理吸附,也可以是化学吸附。
在物理吸附中,氧气分子与固体表面发生弱相互作用,吸附强度较小;而化学吸附则是指氧气分子与固体表面发生一定的化学反应,吸附强度较大。
氧气吸附的机理复杂多样,与固体的化学性质、表面结构以及气体的温度、压力等因素密切相关。
在不同的条件下,氧气吸附的机制可能存在差异。
例如,在高温条件下,氧气分子可以与固体表面的活性位点发生氧化反应,形成氧化物;而在低温条件下,氧气分子则可能以物理吸附方式附着在固体表面。
氧气吸附的影响因素包括固体表面的化学性质、结构形貌、表面活性位点的密度等。
表面化学性质的不同会影响氧气与固体表面的相互作用方式,而表面结构的变化可能导致吸附能力的不同。
此外,温度、压力等环境条件也会对氧气吸附行为产生显著影响。
氧气吸附的重要性不言而喻。
不仅是物理、化学等学科的基础研究领域,氧气吸附还在工业生产、环境保护、能源开发等领域具有广泛的应用前景。
对氧气吸附的进一步研究可以帮助我们更好地理解表面科学中的吸附现象,并为相关领域的技术创新提供重要支持。
综上所述,本文将重点探讨氧气在固体表面上的吸附现象。
通过对氧气吸附的定义、机理以及影响因素的介绍,我们可以更全面地认识和理解氧气吸附的重要性。
进一步的研究和应用将使我们在相关领域取得更大的突破,并为社会发展做出更大的贡献。
1.2文章结构1.2 文章结构本文主要通过对氧气在某固体表面上的吸附现象进行研究和分析,旨在探讨氧气吸附的定义、机理以及影响因素。
文章将按照以下结构展开讨论:首先,文章将在引言部分概述研究的背景和意义,介绍氧气吸附在固体表面上的重要性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吸附等压线:
T
5
2. 等温吸附
p
N2在活性炭上的 N2在硅胶上的 吸附(-195 ℃) 吸附(-195 ℃) Br2在硅胶上 的吸附(79 ℃) 苯在氧化铁凝胶 水气在活性碳上 上的吸附(50 ℃) 的吸附(100 ℃)
(a)
(b)
(c)
(d)
(e)
几种类型的吸附等温线
6
类型的吸附等温线
例
常见的等温吸附线
量 EC) 要比氢分子先
解离成原子再化学吸 附的途径(需能量DHH)
H H
0.16 0.32
r (距表面镍核的距离,nm)
4
吸附的势能曲线
容易得多.
• 氢在镍上的吸附势能曲线
2. 等温吸附
1)吸附量
当吸附达平衡时, 单位质量吸附剂所吸附的气体 的物质的量或标准状况下的体积称为平衡吸附量. a def n a def V n 或 V 3/kg Va 单位 mol/kg , m m m 气体的吸附量与温度和压力有关: Va = f ( T, pB ) 吸附等温线: Va= f ( pB ) 吸附等压线: Va = f ( T ) Va 吸附等温线 p
吸附的分类 曲线P为物理吸附,C 为化学吸附, 两条曲线
E Ni C
吸附的势能曲线
过 渡 状 态 X EC - HP P -HC =125 kJmol-1 H
在X 点相交.
DHH=434 kJmol-1
从能量上看, 先发生
物理吸附而后转变为 化学吸附的途径(需能
0
H H DHH氢分子离解能 HC化学吸附热 HP物理吸附热 EC化学吸附活化能
物理吸附 吸附力 分子间力 吸附分子层 多分子层或单分子层 吸附温度 低 吸附热 小 ,冷凝热数量级 大 , 吸附速率 快 吸附选择性 无
化学吸附 化学键力 单分子层 高 反应热数量级 慢 有
B 1 A
1.吸附的分类
2
物理吸附和化学吸附往往可以同时发生
T • 钯对CO的吸附等压线 3
§ 10-3 固体表面
A (s) + B(g)
吸附
脱附
A-B(ad)
4. 单分子层吸附理论 9
4. 单分子层吸附理论 1)表面覆盖率被吸附质覆盖的固体表 面 固体总的表面积二维浓度
(1- ) (1 - )
代表固体空白表面的分数
A (s) + B(g)
p
A-B(ad)
v吸 k1 p(1 )N
k1 b 1 k
由1916年兰格缪尔提出. 基本假设如下:
1) 单分子层吸附: 固体表面上每个吸附位只能吸附一个分子, 气体
分子只有碰撞到固体的空白表面上才能被吸附;
2) 吸附平衡是动态平衡: 达吸附平衡时, 吸附和脱附过程同时进 行, 且速率相同.
3) 固体表面是均匀的: 表面上各个晶格位置的吸附能力相同;
4) 被吸附的气体分子间无相互作用力: 吸附或脱附的难易与邻近有无吸附分子无关;
v脱 k-1
吸附平衡是动态平衡:
称为吸附系数,
k1 p(1 )N=k-1 N
bp 1 bp
具有压力倒数的量纲,Pa-1 本质b 即为吸附平衡常数, 其大小表示吸附作用的强弱. 其大小与吸附剂、吸附质的本性及温 度有关 10
2)兰格缪尔吸附等温式的其他形式
bp Va a 1 bp Vm
V a 代表覆盖率为 时的平衡吸附量
a Vm 代表在足够高压力下的饱和吸附量( =1
bp a V Vm 1 bp
dG表 dAs Asd
Fe
Fe
Fe
一个在恒温恒压下自发的吸附过程 G < 0, H = G + T S < 0 放热过程. 吸附的分类 1. 物理吸附 2. 化学吸附
S < 0
按吸附作用力性质的不同分类
范德华力:分子间力(色散力、诱导力、取向力) 化学键力:化学吸附时可发生电子的转移、原子的 2 重排、 化学键的断裂与形成等微观过程.
1
§ 10-3 固体表面
在相界面上某种物质的浓度不同于体相浓度的现象称为吸附 H H 红棕 色气体溴被碳吸附 吸附现象 H H 吸附剂A:具有吸附能力的物质 Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe 吸附质B:被吸附的 物质 Fe Fe Fe Fe Fe 吸附原因 固体表面会自发地捕获气相或液相中的分子,使之在固体表 面上浓集,从而降低表面吉布斯函数。 吸附热
定压时, 温度愈高吸附量愈低.
定温时, 压力愈高吸附量愈大. 低压段吸附量随压力直线上升; 中压段 压力影响逐渐减弱
•不同温度下氨气在炭粒上的吸附等温线
高压段 压力几乎无影响, 吸附趋向饱和.
7
例
3. 吸附经验式 弗罗因德利希提出如下等温吸附经验式: Va = kpn 式中k和n为经验常数, k (单位压力时的吸附量)一般随温 度升高而减小; n 一般介于 0 ~ 1 之间. 该经验式只适用于中压范 围的吸附(I型吸附等温线). 取对数得 lgVa =nlg p +lgk
§10-3 固体表面
吸附的分类 范德华力 化学键力
H H H H H H Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe H H H H
1. 物理吸附 2. 化学吸附
Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe Fe
以lgVa对lg p 作图, 应得一条直 线, 可由斜率和截距分别求得 常数n和k.
优缺点:1、形式简单,计算方便, 应用广泛 • CO在椰子壳炭上的吸附 2、适用于固-液,气-固界面上的单分子吸附 3、仅适用于中压范围的吸附,k,n没有物理意义,不能解释吸 8 附作用的机理。 3. 吸附经验式
4. 单分子层吸附理论
• 固体表面上的原子或分子与液体一样,表面层 分子受力是不对称的,而且不同于液体表面分 子即固体表面分子几乎是不可以移动的 • 固体表面是不均匀的,即使从宏观上看似乎很 光滑,但从原子水平上看是凹凸不平的。 • 但固体可以从表面的外部空间吸引气体分子到 表面,以减小表面分子受力不对称的程度,降 低表面张力及表面吉布斯函数。 • 固体表面会自发地将气体富集到其表面, 使气体在固体表面的浓度(或密度)不同于气 相中的浓度(或密度)。
