第三章药物结构和代谢.
药物的体内过程完整版

药物的体内过程集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]第三章药物代谢动力学(药动学)药动学(pharmacokinetics)是研究机体对药物的处置过程的科学,即研究药物在体内的吸收、分布、代谢及排泄的过程和血药浓度随时间变化的规律的科学。
第一节药物体内过程体内过程即吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(excretion)的过程,又称ADME系统。
吸收、分布、排泄通称药物转运(tranportationofdrug)。
代谢变化也称生物转化(biotransformation)。
代谢和排泄合称为消除(elimination)图3-1药物体内过程示意图一、药物的跨膜转运1.被动转运(passivetransport)类型:1)脂溶扩散(lipiddiffusion;简单扩散)2)水溶扩散(aqueousdiffusion;滤过)3)易化扩散(facilitateddiffusion)(需载体,有饱和、竞争抑制)特点:顺差(浓度、电位),不耗能;不需载体,无饱和、竞争抑制。
2.主动转运(activetransport)特点:逆差(浓度、电位),耗能;需载体,有饱和、竞争抑制。
3.膜动转运(cytopsistransport)胞饮(pinocytosis)胞吐(exocytosis)整个体内过程都涉及药物体内跨膜转运。
大多数药物体内转运过程属于被动转运(脂溶扩散)。
分子量小,非解离型,脂溶性大,极性小的药物易被动转运。
二、吸收药物从给药部位进入血液循环的过程称为吸收。
吸收速度主要影响药物起效的快慢;吸收程度主要影响药物作用的强弱。
影响吸收速度和程度的因素:药物理化性质、剂型、剂量给药途径:起效:吸入>肌内注射>皮下注射>口服>直肠>皮肤吸收环境等。
1.消化道吸收1)口服(oraladministration,peros,p.o.)大多数药物常采用口服给药,以肠道(小肠)吸收为主。
第三章+化学结构与药物代谢Ⅱ相(四)(五)

谷胱甘肽和酰卤的反应是体内的解毒反应。 当多卤代烃如氯仿在体内代谢生成酰卤或光气时会对体
内生物大分子进行酰化产生毒性。谷胱甘肽通过和酰卤 代谢物反应后生成酰化谷胱甘肽,解除了这些代谢物对 人体的毒害。
五、乙酰化轭合
乙酰化反应是含伯胺基(包括脂肪胺和芳香胺),氨基酸, 磺酰胺,肼,酰肼等基团药物或代谢物的一条重要的代 谢途径,前面讨论的几类结合反应,都是使亲水性增加, 极性增加,而乙酰化反应是将体内亲水性的氨基结合形 成水溶性小的酰胺。
二甲氧嘧啶
硫吡腙
磺酰胺类抗菌药物磺胺二甲氧嘧啶(Sulfadimethoxine,3-96)经轭合 反应后生成水溶性较高的代谢物,不会出现在肾脏中结晶的危险。 C-葡萄糖醛酸苷化反应通常是发生在含有1,3-二羰基结构活性碳原 子上,如:保泰松及硫吡腙(Sulfinpyrazone,3-97)。
一、葡萄糖醛酸的轭合
和葡萄糖醛酸的轭合反应是药物代谢中最普遍的轭合反应,生成 的轭合产物含有可解离的羧基(pKa3.2)和多个羟基,无生物活性, 易溶于水和排出体外。
葡萄糖醛酸通常是以活化型的尿苷二磷酸葡萄糖醛酸(UDPGA)作 为辅酶存在,在转移酶的催化下,使葡萄糖醛酸和药物或代谢物 轭合。在UDPGA中葡萄糖醛酸以α -糖苷键与尿苷二磷酸相联,而 形成葡萄糖醛酸轭合物后,则以β -糖苷键结合。轭合反应是亲 核性取代反应。
在硫酸酯化轭合反应中,只有酚羟基化合物和胺类化合物能生成稳 定的硫酸化轭合产物。醇和羟胺化合物形成硫酸酯后,由于硫酸酯有 一个很好的离去基团,会使轭合物生成正电中心,因后者具有亲电能 力,而显著增加药物的毒性。 酚羟基在形成硫酸酯化轭合反应时,具有较高的亲和力,反应较为 迅速。如:支气管扩张药沙丁醇胺(Albuterol,3-98),结构中有三个羟 基,只有酚羟基形成硫酸酯化结合物,而脂肪醇羟基硫酸酯化轭合反 应较低,且形成的硫酸酯易水解成为起始物。
第三章常用药物结构与作用03
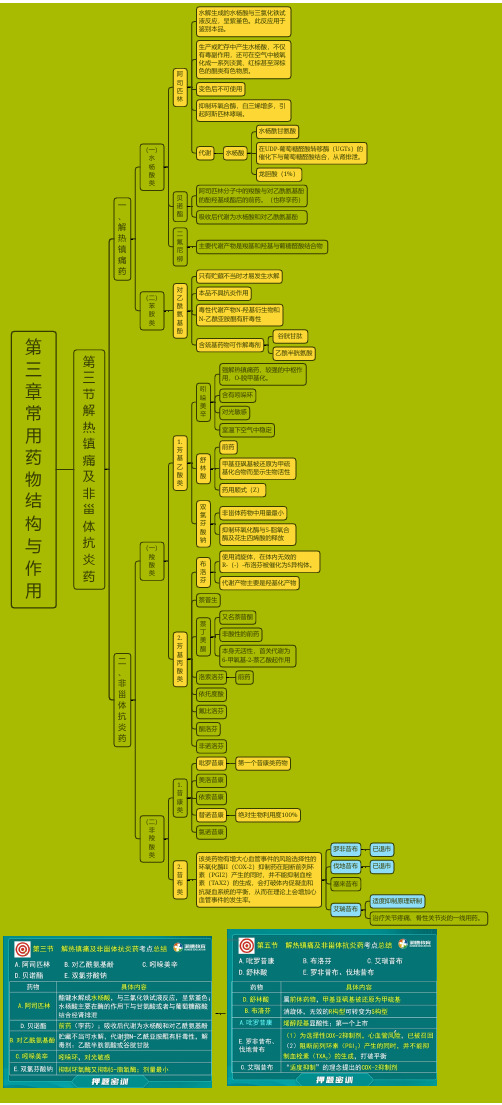
第三 章 常用 药 物 结 构与 作用 第三 节 解 热 镇 痛 及 非 甾 体 抗 炎药 一、 解 热 镇 痛药(一) 水 杨 酸类 阿司 匹林 水解生成的水杨酸与三氯化铁试液反应,呈紫堇色。
此反应用于鉴别本品。
生产或贮存中产生水杨酸,不仅有毒副作用,还可在空气中被氧化成一系列淡黄、红棕甚至深棕色的醌类有色物质。
变色后不可使用 抑制环氧合酶,白三烯增多,引起阿斯匹林哮喘。
代谢水杨酸水杨酰甘氨酸 在UDP-葡萄糖醛酸转移酶(UGTs )的催化下与葡萄糖醛酸结合,从肾排泄。
龙胆酸(1%) 贝诺 酯 阿司匹林分子中的羧酸与对乙酰氨基酚的酚羟基成酯后的前药。
(也称孪药)吸收后代谢为水杨酸和对乙酰氨基酚 二 氟 尼柳主要代谢产物是羧基和羟基与葡糖醛酸结合物(二) 苯 胺类 对 乙 酰 氨 基酚只有贮藏不当时才易发生水解本品不具抗炎作用 毒性代谢产物N-羟基衍生物和N -乙酰亚胺醌有肝毒性含巯基药物可作解毒剂谷胱甘肽乙酰半胱氨酸 二、 非 甾 体 抗 炎药(一) 羧 酸类 1. 芳 基 乙 酸类 吲哚 美辛 含有吲哚环对光敏感室温下空气中稳定 舒林酸前药 甲基亚砜基被还原为甲硫基化合物而显示生物活性药用顺式(Z ) 双氯 芬 酸钠非甾体药物中用量最小 抑制环氧化酶与5-脂氧合酶及花生四烯酸的释放2. 芳 基 丙 酸类 布洛 芬 使用消旋体,在体内无效的R -(-)-布洛芬被催化为S 异构体。
代谢产物主要是羟基化产物萘普生 萘丁 美酮又名萘普酮非酸性的前药 本身无活性,首关代谢为6-甲氧基-2-萘乙酸起作用 洛索洛芬前药 依托度酸 氟比洛芬 酮洛芬 非诺洛芬(二) 非 羧 酸类1. 昔 康类吡罗昔康第一个昔康类药物 美洛昔康 依索昔康 替诺昔康绝对生物利用度100%氯诺昔康2. 昔 布类 该类药物有增大心血管事件的风险选择性的环氧化酶II (COX-2)抑制药在阻断前列环素(PGI2)产生的同时,并不能抑制血栓素(TAX2)的生成,会打破体内促凝血和抗凝血系统的平衡,从而在理论上会增加心血管事件的发生率。
Y03药物化学第三章—药物代谢反应

20
长碳链的烷烃常在碳链末端甲基上氧化生成羟基, 羟基化合物可被脱氢酶进一步氧化生成羧基,称 为ω-氧化;氧化还会发生在碳链末端倒数第二位 碳原子上,称ω-1 氧化。
21
含有脂环和杂环的药物,容易在环上发生羟基化。 如口服降糖药醋磺已脲的主要代谢产物是反式4-羟 基醋磺环已脲。
O2 S O CH 3
16
2.含烯烃和炔烃药物的代谢
烯烃的氧化与芳环类似,也生成环氧化物中间体,但 该中间体的反应性较小,进一步代谢生成反式二醇化 合物,而不与生物大分子结合。
具有抗惊厥活性
卡马西平
17
黄曲霉素B1(aflatoxin B1)
环氧化合物
共价键化合物
黄曲霉素B1(aflatoxin B1)经代谢后生成环氧化合物,该 环氧化合物会进一步与DNA作用生成共价键化合物, 是该化合物致癌的分子机理。
美托洛尔(metoprolol)
1′R : R1=H, R2=OH; 1′S: R合物的氧化
含氮药物的氧化代谢主要发生在两个部位:一是在 和氮原子相连接的碳原子上,发生N-脱烷基化和 脱氨反应;另一是发生N-氧化反应。
26
1. N-脱烷基化和脱氨反应
N-脱烷基和氧化脱氨是胺类化合物氧化代谢过程 的两个不同方面,本质上都是碳-氮键的断裂,条 件是与氮原子相连的烷基碳原子上应有氢原子(即 -氢原子),该-氢原子被氧化成羟基,生成的羟基胺是不稳定的中间体,会发生自动裂解。其过 程中,在CYP-450酶的作用下,氮原子和-碳原子 上发生电子转移所致。
香豆素羟化酶 香豆素的 7- 羟基化,萘普生、 他克林、氯氮平、美西律等的 羟基化 环磷酰胺、异环磷酰胺、安非 他酮、尼古丁
CYP2C
药理学第三章药物代谢动力学

药物 + 蛋白质
复合物
无活性、贮存型、难进入组织
一、与血浆蛋白结合率
特点: ① 差异性。 ② 暂时失活和暂时贮存血液中 。 ③ 可逆性。 ④ 饱和性及竞争性。
由于血浆蛋白总量和结合能力有限,加上结合的非特异性,出现两个问题:①当药物结合达到饱和后,继续增加药量,游离型药物浓度增加,出现药物作用或不良反应增强;
二、细胞膜屏障
血脑屏障(BBB):血管壁与神经胶质细胞形成的血浆与脑细胞外液间的屏障和由脉络膜丛形成的血浆与脑脊液间的屏障。具有保护脑组织生理屏障作用。分子大、极性高的药物不能通过,流脑时SD易通过 。
01
胎盘屏障:胎盘绒毛与子宫血窦间的屏障。几乎所有药物都能穿过胎盘屏障进入胎儿,只是程度和快慢不同。 另外还有血-眼屏障、血-关节囊屏障
分为简单扩散和滤过扩散两种。
特点:(1)药物顺浓度差转运 不耗能 不需要载体 无饱和限速及竞争性抑制
被动转运(下山转运)
添加标题
添加标题
脂溶扩散(lipid diffusion) (简单扩散):大多数药物是通过该方式转运。
影响因素:①膜两侧浓度差:药物在脂质膜的一侧浓度越高,扩散速度越快,当膜两侧浓度相同时,扩散即停止。
代谢的结果:
大多数药物灭活成为无活性的代谢产物; (灭活:药物经转化后活性降低或消失的现象) 少数药物仍有药理活性; (活化:药物经转化后,由无活性转变为有活性的现象。 ) 药物经代谢后水溶性和极性增加。
二、药物转化的酶系统 1、专一性酶:专一性强,主要催化水溶性较大的药物。如AchE、MAO。
2、肝药酶(非专一性酶) 是混合功能氧化酶系统。主要存在于肝细胞内质网上,可促进多种脂溶性药物的转化,其中CYP450酶系统是促进药物转化的主要酶系统。
03章:药物代谢动力学

---是指体内药物或其代谢物排出体外 的过程,它与生物转化统称为药物消 除(elimination)。
排
(一)肾脏排泄 :
泄 途 径
1.排泄方式
(1)肾小球滤过。
(2)肾小管被动重吸收,在远曲小管
(3)肾小管主动分泌,近曲小管(同时主动重吸 收营养物质). 2.肾排泄药物的特点 (1)尿药浓度高,有利也有弊
无吸收 过程
肌内注射(intramuscular injection,im) 。 2. 从鼻黏膜、支气管或肺泡吸收
气体、挥发性液体药物(如吸入麻醉药)或分散在空 气中的固体药物(如气雾剂) 4.从直肠吸收
给药方式与血药浓度的关系
二 .分
布
• 分布(distribution)是指吸收入血的药 物随血流转运至组织器官的过程 • 药物的分布速率主要取决于药物的理化性 质、各器官组织的血流量与对药物的通透 性以及药物在组织与血浆的分配比。
药物在血液中的分布
1. 与血细胞结合 2. 与血浆蛋白结合 成为结合型药物
(bound drug),血浆白蛋白是最重要的
结合蛋白。药物与血浆蛋白结合是可逆的,
游离型药物与结合型药物经常处在平衡状
态之中 。
药物与血浆蛋白结合的特点
• 暂时失活性:结合后药理活性暂时消失,暂 时“储存”于血液中 • 可逆性
体内药量变化的时间过程
时量关系(time-concentration relationship)是指血浆药物浓度 (C)随时间(t)的改变而发生变化 的规律。
曲线下面积(AUC)
坐标轴与时量曲线围成的面积 反应进入体循环药物的相对量
生物利用度 (bioavailability,F)
第3章-药物代谢动力学

D:用药总量。
绝对生物利用度:同一制剂,不同给药途径的AUC
(五)体内屏障
1. 血-脑屏障
脑组织毛细血管内皮细胞间连接紧密,外 表面几乎全部为星形胶质细胞所包围。许多 分子量大、极性高的药物不能穿透,脂溶性 高或分子量小的药物可透过。
Blood-brain barrier limits drug access to brain
(五)体内屏障:
2. 胎盘屏障
2.易化扩散
顺差转运 不消耗能量
需要载体 具有饱和性 具有竞争性
第二节 药物的体内过程
吸收(Absorption) 分布(Distribution) 代谢(Metabolism) 排泄(Excretion)
LOCUS OF ACTION
“RECEPTORS”
Bound
Free
TISSUE RESERVOIRS
药物的影响而出现增强或减弱现象。
药酶诱导药:凡能够增强药酶活性的 药物(巴比妥类、苯妥英钠、利福平 等)。合用时,使其他药效力下降,并 可产生耐受性,应增加其他药的剂量。
药酶抑制药:凡能够减弱药酶活性的 药物(异烟肼、西咪替丁、保泰松等)。 合用时,使其他药效力增强,并可产生 中毒,应减少其他药的剂量。
简单扩散
顺差转运 不消耗能量
无需载体 无饱和性 无竞争性
简单扩散的条件:脂溶性、解离度、浓度差。
绝大多数药物为弱酸性或弱碱性,均有解离型
与非解离型,后者脂溶性高。
现以弱酸性药物为例说明(H-H方程)
HA
H+ + A-
Ka = [H+][A-]
[HA]
- lgKa= -lg [H+][A-] [HA]
药物化学第三章-药物的结构与生物活性

分 子 间 引 力
静 电 作 用
离子键
(ionic bond, ion-ion bond)
(electrostatic interaction)
指药物带正电荷的正离子与受体带负电的负离 子之间,因静电引力而产生的电性作用
偶极-偶极作用
(dipole-dipole interaction) (electrostatic interaction)
0.72nm H H O H Z-己烯雌酚 H E-己烯雌酚 O 1.45nm H O 1.45nm O H
O
O 雌二醇
(2)几何异构对药效的影响
产生:由双键或环等刚性或半刚性系统导致 分子内旋转受到限制 几何异构体的理化性质和生理活性都有较大 的差异
顺式异构体抗精神病作用比反式强5-10倍
解离度对药物活性的影响
5
三、药物和受体间的相互作用对药效的影响
受体学说
药物 + 受体 药物受体复合物
受体构象改变
药理效应
受体:位于细胞膜或细胞内能识别相应化学信使 并与之结合,产生某些生物学效应的一类物质。 影响药物与受体相互作用的因素有很多 药物受体的结合方式 药物结构中的各官能团 药物分子的电荷分布 药物分子的构型、构象等立体因素
结构非特异性药物:
活性取决于药物分子的各种理化性质 药物作用与化学结构关系不密切 药物结构有所改变,活性并无大的变化
结构特异性药物:
靶点是不同的受体(蛋白、酶),所以生物活性主要 与药物结构与受体间的相互作用有关 活性与化学结构的关系密切 药物化学结构稍加变化,药物分子与受体的相互作 用和相互匹配也发生变化,从而影响药效学性质。
F N O C N C2 H5 诺氟沙星 COOH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 CH3 O
CH3 CH3 O CH3
麻 药 硫 妥 Thiopental) 醉 物 喷 (
ቤተ መጻሕፍቲ ባይዱ
硫醚氧化反应
O R S R1 R S R1 R O S O 砜 R1
亚 : 物 活 组 砜 药 或 性 分
S O N SCH3 N S
CH3
N CH3 抗 神 常 物 硫 哒 , Thioridazine. 精 失 药 , 利 嗪
H3C N 美 哒 , 索 嗪 Mesoridazine. 活 提 一 性 高 倍
1.5 醇和醛氧化
脱氢酶催化。如甲醇毒性:
难 解 分 成 CH 3OH HCOOH CO 2 在 脏 聚 肝 内 集 酸 毒 损 视 经 中 、 害 神
至目前,几乎没有醛类药物,但是,伯醇和伯胺体 内代谢生成醛,一般有毒性,也不稳定,可进一步代谢 为酸 。甲灭酸:甾体抗炎药
COOH NH2 + H2N OH
N
3.其他反应
3.1脱卤反应
一部分卤代烃与谷胱甘肽和硫醚氨酸形成接合物代谢排
除体外,主要包括氧化脱卤、还原脱卤。
R
CHCl2
R COCl
蛋 质 白 P
R
H C Cl
COP
CF 3
H +e e- . Br CH CF 3 + C CF 3 - Br Cl Cl 氟 烷 Halothane P H P Cl CF 3
课本:美沙酮(P70,第二版P64)。
2.2硝基还原:亚硝基、羟氨等
R NO 2
+e -
R
. NO
2
+ 2H R NO - H2O 亚 基 合 硝 化 物
+ 2 e+
e H+
H R N
. O
+ e-
H+
H R N OH 羟 胺 ( 性 , 癌 毒 大 致 )
+ 2 e+ + 2H
R
NH2 + H2O
硫酸
氨基酸 谷胱甘肽
硫酸酯 肽(酰胺) …
结合反应(Conjugation)特点:
1、由多个被称为转移酶的酶家族催化; 2、酶具有的特性:药物和内源性小分子化合物在酶 的两个临近位点结合,进一步使药物与内源性小分 子形成结合物。 3、除了药物甲基化和乙酰化作用内源性小分子外, 内源性小分子极性都较高。
多环苯致癌机理:苯并芘
O
HO HO RNA HO NH
苯并芘药物 强致癌
RNA
细 癌 胞 变
HO HO
1.1.2烯烃双键氧化:
烃中双键活性比苯环大,易被氧化成反式二醇。
R1 R2
R3 R4
CYP 450
H3C H3C
O
CH3 CH3
R
环 化 氧 酶
H3C
HO CH
3
H3C OH
R H
CH3
R
重 排 R R HO H H O
第三章 化学结构和药物代谢 (Chemical Structure and Metabolism)
第一节 概述
课本编写较好,主要突出药物结构和代谢过程中反应。
药物代谢:在酶的作用下将药物转化成极性分子,再通
过人体的正常系统排出体外。
药物代谢:既是药物在人体内发生的化学变化,也是人
体对自身的一种保护机能。 无效或低效 药物 有效结构产物
CH3 R N CH3 H3C N O CH3 CH3
R
N
R
N
O
N氧 实 化 例 NH N NH2 O+ N NH NH2
NH
NH
抗 血 药 : 乙 高 压 物 胍 烷
②伯胺仲胺中无a-碳上无氢原子
R NH2
R NHOH
肟
R N O 亚 化 物 硝 合
R NO 2 硝 基
③芳香伯胺,无α-碳氢,生成N羟基胺
H2N
SO2 NH2 胺 砜抗 风 苯 麻 药
H2N
SO2 NHOH
④芳香伯胺致癌机理
芳 伯 致 机 香 胺 癌 理 NH R1 R N R Y H P R OH N R1 乙 酯 酸 硫 酯 酸 X
+
OX N R R1
P- Y生 大 子 物 分
R1 R
NH R1 Y P
芳 胺 化 有 似 结 香 酰 物 类 的 果
---F Cl CH CF 2
3.2 水解反应
各 酯 酰 水 成 和 种 、 胺 解 醇 酸 R OOCR 1 R O NO 2 R OH + HOOCR 1 R OH R OH
+ HNO 3 + H2SO4
R1COOH
R OSO3H RNHCOR 1
RNH 2 +
阿 匹 的 谢 司 林 代 COOH OOCCH 3 COOH OH + HOOCCH 3
NH2 活 底 : 性 物 提 活 硫 基 供 泼 酸 O 3‘-磷 腺 酸 苷 -5’-磷 硫 酰 酸 O N O OH H PO3H2O HO N O H H N
N
HO S O P O
PAPS
主要反应:
1)-OH,酯化。主要是与酚羟基轭合,脂肪-OH, 易成C正离子。 2)R-NH2 轭合成盐 与葡萄糖醛酸轭合反应竞争!
CH 2
• 长链烃:
• ω-氧化:末端C氧化成:-OH和-COOH • ω-1氧化: 末端倒数第二个碳氧化-OH • 抗癫痫药:丙戊酸钠(Sodium Valproate)
n n C3H7 COOH H3C ω- 1氧 化 H3C OH CH2 ω- 化 氧 C3H7 HO-CH2CH2CH2CHCOONa n C3H7 CH COONa
⑤ 酰胺氧化生成N羟基胺
酰胺也可被氧化成羟胺,而羟基酰胺具有很高反应 活性,通常是强致癌物质。如尿烷和N-乙酰芴。
1.3含氧药物氧化反应
主要氧化C-O键碳原子。 反应通式:
. R O CH 2R' OH R O CHR' ROH + R'CHO
R O CHR'
+
条件:α-碳原子上有氢 醚键只一个发生脱烷基化反应。
②和SP2杂化碳原子相邻碳原子的氧化(活化碳原子)
反应活性增强,容易生成羟基化合物。
+
OH OH
甲 磺 脲 降 糖 ( 苯 丁 : 血 药 Tolbutamide) CH3 CH 2OH COOH
SO2NHCONHC 4H9 SO2NHCONHC 4H9
SO2NHCONHC 4H9
生成的羟化合物通常具有立体选择性,特别是对 甾体化合物。
COOH CH3 CH3 NH
COOH NH
COOH CH3
一个药物中有多个氧化部位,具 体在何处进行,与药物立体构型、各 官能团电子效应、药物药理作用、所
处人体器官等各种因素有关。
2. 还原反应
在体内代谢,引入-OH、NH2-等极性 基团。 2.1羰基的还原 C=O CH-OH(主要是酮)
如水合氯酰: Cl3C-CH(OH)2 Cl3C-CH2OH
R CH3
R
CH2OH
R
CHO
R
R
S
COOH
O
R NH2
R
NH
O
R SH
O
1.1 C=C的氧化:
1.1.1 苯环双键氧化反应
R 重 排 R R
环 化 氧 酶
R H
R (主 ) 要 OH
HO R H
H H
O H
O H
OH OH GSH 谷 苷 S-转 酶 胱 肽 移 R 生 大 子 核 物 分 亲 基 M 团 M OH
1.2.1 N-脱烷基化反应
本质:C-N断裂
条件:胺的α-碳原子上应该有氢,C-C-OH, N-C断裂。
R1 伯 胺 R2 仲 , 胺 多 产 胺 叔 : 种 物 CH NH 2
H R1 R2 CH O + H N H H
+
一 产 种 物
R1 R1 CH NH CH 2 R3 R2 CH O R2 R1 R2 CHNH 2
反应过程
酶具有的特性:药物和内源性小分子化合物在酶
的两个临近位点结合,进一步使药物与内源性小分子
形成结合物。 HXR:药物Ⅰ项代谢产物
葡萄糖醛酸代谢结合基团:
HO-:醚
-COOH 酯
NH2- 胺 -SH 硫醚
产生范围广:
①葡萄糖醛酸来源广; ②药物代谢后生成-OH,-NH2,-COOH多。
2、硫酸酯轭合
与内源性物质结合生成水溶性物质排出体外,生成的
产物如葡萄糖酸,硫酸盐,氨基酸等。
催化剂: 各种酶,如细胞色素转化酶P-450酶系还原酶、 氧化酶、水解酶。
第二节 第Ⅰ相生物转化反应(官能团转化反应)
Functionalization Reaction
第Ⅰ相生物转化反应主要发生在药物官能团上或较活
泼部位、位阻较小部位,常见反应类型有氧化反应、还原反 应、水解反应等。 1、氧化反应:
SCH3 N N 抗 药 癌 N N N H 6-甲 嘌 硫 呤 N SCH2OH N N N
SH N N H
N H 6-Methymercaptopurine
氧化脱硫:主要是C=S和 P=S键
S R C R1 O HN S N H SO [ R C R ] 1 SO2 R C R1 O HN CH3 O N H O R C R1
脱烷基化次序:链越长,分支链多,脱烷基化速度慢。
OCH 3 OH CH3 NH2 OCH 3 血 维 药甲 明 压 持 氧 O O CH3 NH2
