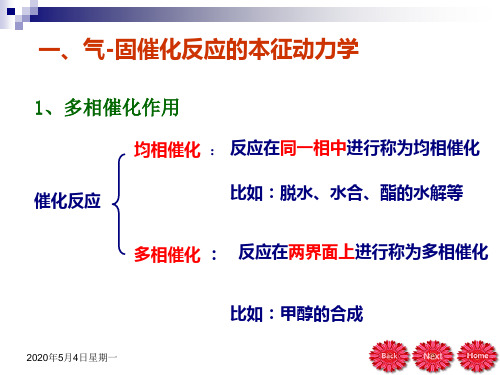
第五章 气-固界面
第5章 气固界面

第五章 气固界面
1
5.1 固体表面的特性
固体表面上的原子或分子与液体一样,受力也 是不均匀的。 固体与液体的一个重要不同点,是液体分子易 于移动,而固体分子几乎是不移动的。 液体表面——易于波动,有自动缩小的趋势,形成 光滑均匀的表面; 固体表面——很难变形,不易缩小,是不均匀的。 即使从宏观上看似乎很光滑,但从原子水平上看是 凹凸不平的。
弯曲液面上的蒸汽压 Kelvin公式
2 Vm RT ln p r
r *
p
凸液面,蒸汽压较平液面的高;凹液面,蒸汽压较平液面的低; 对于孔性固体构成,孔中液面与孔外液面的曲率不同。在 形成凹形液面的情况下,孔中液体的平衡蒸气压低于液体 的正常蒸气压。故在体系蒸气压低于正常饱和蒸气压时即 可在毛细管中发生凝结。此即所谓毛细凝结现象。
——Langmuir吸附等温式 式中a称为吸附系数,它的大小代表了固体 表面吸附气体能力的强弱程度。
32
ap q 1 ap
以q 对p 作图,得:
33
两种极限情况
1.当 p 很小或 吸附很弱时, ap <<1,q = ap, q 与 p 成线性关系。 2.当p很大或 吸附很强时, ap>>1,q =1, q 与 p无关, 吸附已铺满单分子层。
van der waals引力将气体分子吸附到表面上的。因为分子之 间也有van der waals力,故气相中的分子撞在被吸附的分子 上面时也有被吸附的可能。即吸附可以是多分子层的。这是 BET理论与Langmuir理论的主要不同点。 第一层吸附与第二层吸附,因为相互作用的对象不同, 故吸附热也不同,第二层及以后各层的吸附热接近于凝聚热。 41
化学反应工程-第五章 气固相催化反应宏观动力学

P催化剂颗粒孔隙率-
SV催化剂颗粒的比表面积cm2cm3
P催化剂颗粒密度g cm3
Sg单位催化剂的比表面积cm 2g 1
9
5.1.3 综合扩散
微孔孔径在一定范围之内,两种扩散同时
起作用。 当10-2< λ/do<10时
D
1/
Dk
1
1 ayA
/
DAB
a 1 NB NA
35.9
1.98 D2 6.70 NH3
14.9
5.48 He 2.88 H2O
12.7
5.69 N2 17.9 (CCl2F2) 114.8
19.5 O2 16.6 (Cl2)
37.7
17.0 空气 20.1 (SiF4) 69.7
16.1 CO 18.9 (Br2)
67.2
22.8 CO2 26.9 (SO2) 41.1
13
氢在苯中的分子扩散系数为:
DAB
273 200 1.5 1
0.436
78
1
1
0.5
2
1
2
78.15 cm2s1 p
p 7.073 90.683
当p=101.33 kPa时DAB=0.7712 cm2s-1 p=3039.3 kPa时DAB=0.02571 cm2s-1
D
1
0.01522cm2s1
1 1
0.0373 0.02571
有效扩散系数为:
De
D P
0.01522 0.43 4
0.001636cm2s1
16
5.2气固相催化反应等温宏观动力学
第五章_固体表面吸附(固-气界面吸附)

③化学吸附具有选择性
如:CO在金属表面上的吸附
O C MM
OO CC MM
NO + 1/2O2 CH2=CH2 + 1/2O2
NO2 O
NO只在Pt上吸附 只用Ag作催化剂。
无选择性;吸附热与气体凝聚热相近;吸附速度快;多层吸附。
(2)相互作用势能
设 f 代表作用力,r 为粒子间距离,U(r)为粒子间相互作用势能,有:
f U (r) r
或
r
U(r)
f dr
永久偶极矩相互作用势能为:
U (r)
2 3
12 22
3k Tr 6
诱导偶极矩相互作用势能为:
Ui(r)
( i 2 12
使体相中某些组分在表面区产生富集的现象。 其特点为组成随表面吸附质不同而变化。
如:Ag-Pd合金,吸附CO时,体相中的Pd可通过扩散到达 表面与CO形成羰基键,从而使表面富Pd。除去CO后,表面 组成由回到原来的状态。
第二节 物理吸附和化学吸附
1、物理吸附与Lennard-Jone势能曲线
(1)物理吸附特点
S
RT
则:
p
或: bp
b(1 )
1 bp
若有两种气体存于表面而发生竞争吸附时:
则:
A
பைடு நூலகம்
bA pA 1 bA pA bB
pB
B
bB pB 1 bA pA bB
pB
如果吸附解离成两个碎片,且各占据一个吸附位置,则:
f ( ) (1 )2 f '( ) 2
材料物理化学-第五章 表面与界面

湖南工学院
④n↑或↓ 三、吸附与表面改性 吸附:新鲜的固体表面能迅速地从空气中吸附气体或其它物质来降低其表面能。吸附是 一种物质的原子或分子附着在另一种物质表面现象。 表面改性:通过改变固体表面结构状态和官能团。 表面活性剂:降低体系的表面(或界面)张力的物质。
5.3 无机材料的晶界与相界
液体
开 the contact 两相的化学性能或
F 为润湿张力,θ为润湿角(接触角 angle),由于 所以,润湿先决条件是γSV>γS或γSL很小,当固液 化学结合方式很接近时,是可以满足这一要求。
材料物理化学
固
湖南工学院
改变γSV——减少氧化吸附膜; 改变γSL——两相组成相似; 改变γLV——液体中加入表面活性剂 ⑶浸渍润湿 浸渍润湿指固体浸入液体中的过程。
湖南工学院
第五章
表面与界面
表面的质点由于受力不均衡而处于较高的能阶。这就使物体表面呈现一系列特殊的性 质。高分散度物系比低分散度物系能量高得多,必然使物系由于分散度的变化而使两者在物 理性能(如熔点、沸点、蒸气压、溶解度、吸附、润湿和烧结等)和化学性质(化学活性、 催化、固相反应)方面有很大的差别。随着材料科学的发展,固体表面的结构和性能日益受 到科学界的重视。随着近年来表面微区分析、超高真空技术以及低能电子衍射等研究手段的 发展,使固体表面的组态、构型、能量和特性等方面的研究逐渐发展和深入,并逐渐形成一 门独立学科——表面化学和表面物理。 表面与界面的结构、性质,在无机非金属固体材料领域中,起着非常重要的作用。例如 固相反应、烧结、晶体生长、玻璃的强化、陶瓷的显微结构、复合材料都与它密切相关。 表面:—个相和它本身蒸汽(或真空)接触面称之。 界面:—个相与另一个相(结构不同)接触的分界面称之。 相界:指具有不同组成或结构的两固相间的分界面。 晶界:是指同材料相同结构的两个晶粒之间的边界。 习惯上把液-气界面、固-气界面称为液体表面和固体表面。表面可以由一系列的物理化 学数据来描述(表面积、表面组成、表面张力、表面自由能、熵、焓等),表面与界面的组 成和结构对其性能有着重要的影响。 表面与界面起突出作用的新型材料,如薄膜、多层膜、超晶格、超细微粒与纳米材料等 发展如日中天。
第五章 气-固相催化反应器

多段绝热式固定床
间接换热式 原料气冷激式 冷激式 惰性气体冷激式
(a)间接换热式;(b)原料气冷激式;(c)非原料气冷激式
连续换热式固定床
• 根据换热介质的不同可分为外热式和自热式。 • 外热式:用某种和反应无关的热载体加热或冷却反 应床层的反应器。它一般用于强放热或强吸热反应。 其型式多用列管式,通常将催化剂放在管内,管间 通过载热体,也有的与之相反。载热体可根据反应 过程所要求的温度,反应热效应,操作压力及过程 对温度的敏感度来选择。一般采用强制循环进行换 热。
固定床的空隙率是颗粒物料层中颗粒间自由体积与整个 床层体积之比。 V空 rb e= = 1V床层 rp
(2)空隙率的影响因素 形状、粒度(大小)、表面粗糙度、填充方式、颗粒与 容器直径之比。
(3)固定床的当量直径de
①床层的比表面积Se
忽略粒子间接触点的这一部分表面积,则单位床层中粒 子的外表面积(床层的比表面积)Se为:
2 150 r f u0 1 - e fM = + 1.75 D p = fM ( 3 )L Re M ds e d s r f u0 1 dG 1 Re M = = s m 1- e m 1- e
②当10<ReM<1000(过渡区),
2 r f u0 1 - e 150 Dp = ( + 1.75) ( 3 )L Re M ds e
A
c
B C D E F G
b a
图5-2间接换热式
Topt = Te RTe E 1+ ln 2 E2 - E1 E1 E2 - E1 k f ( y) R ln[ 20 2 ] k10 f1 ( y )
图5-3 单一可逆放热反应三段间接换热式操作状况 图中的平衡曲线为反应达到平衡时,过程的温度与反应 速率(转化率)的关系。此曲线系针对一定的原料气起 始组成由热力学计算得到。平衡曲线为操作的极限。如 果达到平衡转化率,则所需的催化剂量为无限多,所以 实际操作点应处于平衡曲线的下方。
第五章 气-固相催化反应动力学

5.2.2 吸附等温方程 思考1:吸附等温方程?
第五章 气-固相催化反应动力学 5.1 气-固相催化反应 5.2 气-固相催化反应本征动力学 5.3 气-固相催化反应宏观动力学
5.1 气-固相催化反应
5.1.1 气-固相催化反应概述 1、气-固相催化反应——非均相反应——发生在气-固界面。
2、气-固相催化反应的特征
(1)在操作条件下反应物和产物都为气体;
图例 外层气膜 内孔结构 向内传递 向外传递
气 流 主 体
反应物 生成物
气 膜 界 面
反应物 生成物
颗 粒 外 表 面
孔 反应物 道
内 生成物 表
面
气-固相催化反应过程基本概念
● 气流主体——对流过固体催化剂颗粒的气体物料的统称。 ● 气 膜——气流主体流过固体颗粒催化剂外表面所形成的
层流边界层。 ● 外扩散过程——反应组分在气膜中的扩散过程。
(2)反应主要在固体颗粒催化剂内表面上进行;
ri
1 S
dni dt
或ri
1 W
dni dt
(3)反应速率与固体颗粒催化剂内的扩散速率有关。
5.1.2 固体催化剂的表面积、外表面积和内表面积
S108型二氧化硫氧 A202型氨合成催 化制硫酸催化剂 化剂
C307型中低压合 成甲醇催化剂
T-504型常温COS 水解催化剂
① ②
Hale Waihona Puke B① ②③ M
① A A B B
② A B L M
A+B
L+M
气-固相催化反应本证动力学 过程示意图
③ L L M M
5.2.1 本证动力学过程速率方程
第5章-气固界面-2异相催化

8.10 Kinetics of adsorption
8.10 Kinetics of adsorption
Schematic Lennard-Jones type potential energy diagram for the adsorption of a gas on a solid. Ed is the possible bond dissociation energy from the physical adsorbed state; Ec and Ec* are, respectricesly, the energy and the activation energy for desorption from the chemisrobed state; and Et is the activation energy for the transition from the physically adsorbed state to the chemisorbed state. The potential energy of molecules in the gas phase is taken as zero.
H a d ln p 1 R d( ) T const
如果在不同温度下测定吸附等温线,则可以计算反应焓变。
8.9 The enthalpy of adsorption
The term isosteric (等比容的) means that the amount adsorbed, θ=nσ/nσm, is held constant. Thus, a value (θ<1) is selected, the corresponding values of p are found for each temperature and the slope of the plot of lnp against 1/T then yields ΔHa.
第五章气固相催化反应本征动力学

rd kd exp(h ) kd kd 0 f ( ) exp( Ed0 RT ) h RT
表观吸附速率为 r ra rd ka pA exp(g ) kd exp(h )
平衡时:ka kd
pA
exp[( g h) ]
令
K
A
ka kd
f hg
则
1 f
ln(K A pA )
焦姆金等温吸附方程
令
ka ka0 exp( Ea0 RT ) f ( )
活性 选择性 寿命
催化剂的性能
影响
物理性质: 比表面积; 孔容积; 孔容积分布。
1、比表面积:单位质量的催化剂具有的表面积Sg,m2/g; 影响催化剂的吸附量和活性。
!!!测定表面积的方法是:氮吸附法。
2、孔容积:每克催化剂内部微孔的容积Vg。cm3/g !!!测定孔容积较准确的方法是:氦-汞法。
非活化的,低活化能;活化的, 高活化能。>40kJ/mol
<8kJ/mol
>40kJ/mol
多分子层
单分子层
高度可逆
常不可逆
用于测定表面积、微孔尺寸
用于测定活化中心的面积及阐 明反应动力学规律
2、化学吸附速率的一般表达式
1)吸附方程:
A+σ→A σ
吸附率: A
被A组分覆盖的活性中心数 总的活性中心数
3)提高催化剂的机械强度。
4、催化剂活化:目的是除去吸附和沉积Байду номын сангаас外来杂质。
方法是:1)适度加热驱除易除去的外来杂质; 2)小心燃烧除去顽固杂质; 3)用氢气、硫化氢、一氧化碳或氯化烃作为活化剂
活化催化剂。
5、催化剂的开工和停工
化学反应工程-17-第五章-气固相催化反应宏观动力学

1
NA NB
NA、NB为A、B组分的扩散通量,mol•m-2•s-1。
上式简化: 比如对 A B 等类型反应, A、B在孔道中进行的是等分子逆向扩散过程。
N A N B 则 0
1 1 1 上式: D DAB DK
5.1.4 以颗粒为基准的有效扩散系数De
De为以颗粒外表面积计算基准的有效扩散系数。 问题是De如何求?
DAB 称为分子扩散系数,由下式计算:
1 1 T 1.5 M A MB 0.436 1 1 P V A / 3 VB / 3
2 0.5
D AB
式中 DAB 为A组分在B中的扩散系数,cm2•s-1;P为系统总压,kPa;T为 系统温度,K;MA、MB为A、B组分的相对分子量;VA、VB为A、B组分 的分子扩散体积(见表5-1)cm3•mol-1。表中未列气体,其扩散体积可按
yi 为I组分的mol分率;
Nj为j组分扩散通量。
工程计算时,常用Wilke简化模型,如下式:
D Am
1 yA yi D i Ai
5.1.2 努森扩散 记扩散系数为 D K,则:
DK 4850d 0
T M
式中:D K 为努森扩散系数,cm2•s-1;T为系统温度,K;M为 组分的相对分子量;d0为微孔直径,cm。
根据 S 的定义式: S
4 3 R V R 3 S 3 4R 2 SS
R 3
kV ' f C AS De
f C A f C AS C A C AS
4 3 Fr rA r dr r 3 3
单位时间球壳中A的累积量:
气固界面知识点

ቤተ መጻሕፍቲ ባይዱ (3) 外来粒子在固体表面上相互作用,并形成另一种新相 例如金属表面的氧化
化学吸附的特点:
(1) 吸附力是由吸附剂与吸附质分子之间产生的化 学键力,一般较强。
(2) 吸附热较高,接近于化学反应热,一般在 40kJ/mol 以上。
(3) 吸附有选择性,固体表面的活性位只吸附与之 可发生反应的气体分子,如酸位吸附碱性分子, 反之亦然。
四、吸附等温方程式
BET理论认为,固体对气体的物理吸附是Vander waals 引力造成的后果。因为分子之间也有Vander wanls力,所以 分子撞在已被吸附的分子上时也有被吸附的可能,也就是 说,吸附可以形成多分子层。
BET接受了Langmuir理论中关于固体表面是均匀的观 点,但他们认为吸附是多分子层的。当然第一层吸附与第二 层吸附不同,因为相互作用的对象不同,因而吸附热也不同, 第二层及以后各层的吸附热接近与凝聚热。
总之:物理吸附仅仅是一种物理作用,没有电 子转移,没有化学键的生成与破坏,也没有原子重 排等。
外来粒子与固体表面的相互作用主要有三种类型: (1) 形成离子键为主的离子吸附;
(2) 以共价键吸附外来粒子 此时,没有电子从固体能带中 转移出来,只是吸附粒子与固 体的一个或几个表面原子间的 化学结合。这种吸附可以发生 在有“悬空键”的表面上,如 图(b)中氧吸附在锗表面, 与表面原子形成定域双键。
(4) 吸附很稳定,一旦吸附,就不易解吸。 (5) 吸附是单分子层的。 (6) 吸附需要活化能,温度升高,吸附和解吸速 率加快。
总之:化学吸附相当与吸附剂表面分子与吸 附质分子发生了化学反应,在红外、紫外-可见 光谱中会出现新的特征吸收带。
物理-化学共存吸附情况?
第五章 气固相体系解读

吸收过程示意图
变温吸附:利用温度的变化完成循环操作。 变压吸附:利用压力的变化完成循环操作。 变浓度吸附:待分离溶质为热敏性物质时可利 用溶剂冲洗或萃取剂抽提来完成解吸再生。 色谱分离:
图5-2 气-固相反应体系的等粒径缩芯模型示意图
四川大学本科生课程化学工艺学
4/89
气固反应缩芯模型
气相非催化反应的过程: 1:气相主体扩散到固体表面 2:向内的固体膜扩散 3:表面反应 4:向外的固体膜扩散 5:固体表面到气流主体的气膜扩散。
稳态假定:
气-固相体系缩芯模型浓度分布
分为气膜扩散控制、固体层扩散控制、界面反应控制
n=1~2
最快
加压有利
最慢
n=0
在常压和高压下煤焦气化反应速率的比较
四川大学本科生课程化学工艺学
25/89
5.2.2 移动床煤气化
原料:块煤 加料方式:煤由气化炉顶加入,气化剂由炉底送入 气化反应:气化剂与煤逆流接触 产物气体:显热供给煤气化前的干燥和干馏,煤气出口温度低 产物灰渣:显热预热入炉气化剂
-57.80 -67.64
-10.1 -49.2
R10
CHXOY=(1-y)C+yCO+x/2H2
R11
CHXOY=(1-y-x/8)C+ x/4H2+x/8CH4+yCO
四川大学本科生课程化学工艺学
23/89
元素 S N
煤气化过程中硫和氮的基本化学反应
反应
S+O2=SO2 SO2+3H2=H2S+2H2O SO2+2CO=S+2CO2 2H2S +SO2= 3S+2H2O
第五章第一节 气-固催化反应的本征动力学
i V 1
i
V Ki Pi V 1 i
则未覆盖率为:V 1 (1 Ki Pi )
i
2020年5月4日星期一
i 1
1 Ki Pi
(无解离时)
i
当被吸附的分子发生解离现象时
ka
A2 2 2A kd
吸附速率和脱附速率分别为:
a ka pA (1 A )2
d kd A
吸附平衡时: a d
2020年5月4日星期一
4)BET模型 对于物理吸附的情况:
p
1 (c 1) p
V ( p0 p) Vmc Vmcp0
式中:c为常数, p0为在该温度下吸附组分的饱和蒸汽压,
应用此式来测定参数。
2020年5月4日星期一
3、气-固催化反应动力学方程
反应:
A B R S
A的吸附:
A A
B的吸附:
K kRd K AB k Ra
2020年5月4日星期一
rA
K APA
k
PA PB PS
PR
/
K
KB PB
K AB
PA PB PS
KS PS
1
反应速率
动力学项 推动力
吸附项n
2020年5月4日星期一
2)幂数型的反应速率式
N2 3H 2 2NH3
合成氨的机理为:
N2 2 2N 控制步骤 H2 2 2H N H NH NH H NH2 NH2 H NH3 NH3 NH3
① 催化剂表面各处的吸附能力是均一的,即均匀表面 ② 被吸附分子间的作用力可略去不计(无作用力) ③ 单分子吸附 ④ 吸附的机理均相同。
2020年5月4日星期一
ka
A A kd
气-固体表面相互作用

Rads Ae( Ea/ RT )C x
另外 ,气体吸附速度由以下两个参数所控制(由分子水平 来看): • 分子到达表面速率(与表面相碰撞)F • 与表面作用分子被 吸附住的机率S
Rads F • S
F P / 2 mkT
0 S 1
S f ( )e(Ea /RT )
Q1 =125 J mol-1K-1 Q2 = 54 J mol-1K-1
对bcc金属,如W, Mo, Fe等
0.75 < T/Tm < 1 Ds = 3.2×104 exp(-Q1Tm/RT)
T/Tm<0.75
Ds = 1.0 exp (-Q2Tm/RT)
Q1= 146 J/mo-1k-1 Q2 = 77J mol-1K-1
Fcc金属自扩散系数与温度的关系
bcc金属自扩散系数与温度的关系
(2) 自扩散活化能和机理
在logDS与1/T的关系中,不同温度范围存在不同的活化能, 这意味着 高温区和低温区扩散机理不同。
对于低温区,吸附原子的扩散及吸附原子同表面原子的交换可能是原 子传输的主要机理; 而高温区, 由于高温导致大量的空位的形成, 因而空位 的扩散可能是传输的主要机理. 后者的活化能较大.
f
z0
exp(
H m K BT
)
Δ Hm
1
2
Energy
平衡位置1
平衡位置2
1定域扩散 2非定域扩散
随机行走理论
假定原子运动是任意的,跳跃的距离是等长的,为d,并且为一
维扩散。则一个原子行走的净距离x应等于-nd到+nd之间各个跳
跃的代数和。因为正负两个方向跳跃的机率相等,该吸附原子行
第五章 气—固界面

(一) Langmuir理论模型 二、Langmuir 吸附等温式—单分子层吸附 1.对于化学吸附,吸附力近似化学键力,故为单 理论 分子层吸附;也包括单层的物理吸附; 2.吸附是局部的,即吸附质分子吸附在固面上的 活化中心上,这些地方具有很强的不饱和力场, 因此具有强烈的吸附气体分子以平和不饱和力场 的能力; 3.吸附热与表面覆盖率无关。按式5-11覆盖率可 S0 V 表示为:
vd k d S o
Ao p
1 2
ka =
Ao p (2πm kT)
1 2
解出覆盖率:
S0 k o (2πm kT) exp( q / kT ) θ= = Ao p S 1+ 1 k o (2πm kT) 2 exp( q / kT )
bp 或 θ= 1 + bp
bp θ= 1 + bp
V = Vm bp 1 + bp p p 1 V Vm b Vm
二、固体的表面结构
(一)固体表面的粗糙度ω 粗糙度ω定义为: ω=真实表面积/理想几何表面积 »1
表5—1 几种表面粗糙度ω 表面 ω 一次清洁玻璃球 二次清洁玻璃球 充分清洁玻璃球 银箔 腐蚀过的银箔 电抛光的钢材 1.6 2.2 5.4 5 15 1.13
(二)表面晶型的无定形化
Vm S
4.不考虑被吸附分子之间的作用力; 5. 吸附平衡是吸附与解吸间的平衡。
单位重量固体,其表面上有 S 个活性基点,其 (二)Langmuir吸附等温式 中有So个已被气体分子所占据,那么吸附速率 可表示为: va k a ( S S o ) 通过分子运动论可以给出: 解吸速率为:
一、固体表面与 第一节 液体表面比较
化学反应工程第五章气固催化反应本证动力学详解

Tayler,1928(看作固体中 的不饱和原子,固体表面 不均匀、断层、晶体边缘 及粒子间的裂缝)
活性位:催化剂表面可和被 吸附原子或分子形成强化 学键的中心
化学吸附的 微观形态
给定某一吸附剂,给定被吸附的物质(通常是气 体),给定吸附温度,当吸附压力变化时,吸附剂 的吸附能力如何变化? 吸附等温式给出了这一变化的规律
③ 吸附项的指数是控制步骤中吸附中心参与的个数,如果 n=3,说明三个吸附中心参与控制步骤;
④当出现解离吸附,在吸附项中出现开方( KA)p项A ;
小结
1、正确书写反应速率表达式,并能给出复杂化 学反应的速率式
2、理解活化能和反应级数的意义和概念
3、气固催化反应过程的7步骤,什么是物理吸附、 化学吸附和理想、非理想吸附模型,什么是速率 控制步骤,什么叫拟平衡态。并可进行本征动力 学推导。
Ed RT
)
吸附平衡时: rA rd
A
KA pA 1 KA pA
单组分A解离吸附:A2 +2 2A
ra k a pA (1A )2
rd
kd
2 A
ka
ka0exp(
Ea RT
)
kd
kd 0exp(
Ed RT
)
吸附平衡时: ra rd
A
1
KA pA KA pA
A
KA pA 1 KA pA
: 双组分A、B吸附
Ea
E
0 a
ln
Ed
E
0 d
ln
q
Ed -Ea
(
E
0 d
E
0 a
)
(
) ln
r ka pA exp( / RT ) ln kd exp( / RT ) ln
第五章固液界面

第五章固液界面要求:掌握Young 方程与接触角;了解粘附功与内聚能,YoungDupre 公式,接触角得测定方法,接触角得滞后现象,以及固体表面得润湿过程;理解固液界面得电性质,即扩散双电层理论,包括:GouyChapman 理论,DebyeHukel 对GouyChapman 公式得近似处理,Stern 对GouyChapman 与DebyeHukel 理论得发展;理解动电现象,平面双电层之间得相互作用,球状颗粒之间得相互作用;掌握新相形成,即成核理论,以及促进成核得方法。
§5、1 Young 方程与接触角1、固体表面得润湿固体被某种液体润湿或不能润湿,叫亲某种液体或疏(憎)某种液体,例如:亲水性(疏油性,疏气性);亲油性(亲气性,疏水性)。
根据水对固体表面得亲、疏性大小,水滴在固体表面,会出现如图51所示三种情况。
2、润湿性得度量——润湿接触角θ三相接触周边:液滴在固体表面,会存在固液气三相接触线,将液滴在固体表面铺展平衡时得固液气三相接触线叫三相平衡接触周边。
平衡接触角或接触角θ:三相平衡周边任意一点上得液气界面张力与液固界面张力之间得夹角,叫润湿接触角θ,如图52所示。
图52 润湿接触角示意图讨论:标出下列图中得润湿接触角。
亲水性固体表面中等亲水性固体表面疏水性固体表面图51 水在固体表面得润湿情况θ液气接触角θ可定量描述固体被液体润湿得大小,接触角越小,润湿性越好,接触角越大,润湿性越差。
一般分下面三种情况:(1)θ< 90o时:被润湿,润湿过程对外做功,有放热现象;(2)θ= 90o时:中等,无现象;(3)θ> 90o时: 不被润湿,外界对系统做功,有吸热现象。
3、Young方程如图52 所示,润湿周边任意一点上,当润湿达平衡时,其在水平方向上得受力合力应为零,则应有:(51)上述方程即为Young方程,它就是研究固液润湿作用得基础方程。
§5、2 粘附功与内聚能设有α,β两相,其相界面张力为,如图53所示,在外力作用下分离为ααββ图53 α,β两相得分离独立得α,β两相,表面张力分别为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.固体表面是均匀的,表面上各个晶格的吸附能力相同。
3.吸附热是常数,不随表面覆盖率变化而变化。 4.被吸附分子之间无相互影响,无相互作用力。 5.吸附平衡是吸附与解吸间的动态平衡。
2.2
Langmuir吸附等温式
• 2.2.1 吸附等温式的推导 • 单位质量固体,其表面上有S个活性基点,其中有So个已被气体分子占 据,那么吸附速率可以表示为: a ka (S S0 ) v 式中的吸附速率常数 ka 为单位时间内碰撞一个活性基点的次数, 通过分子运动理论可以给出: A0 p ka (2m kT)1/ 2 式中p为气体压力,m为分子的质量,A0为分子在表面所占面积。 • 解吸速率为:vd kd S0 式中 kd 为解吸速率常数。如果吸附热为q,那么只有在表面上的被 吸附分子能量大于q的分子才可能离开表面,仿佛为解吸活化能一样, 因此按阿累尼乌斯方程解吸速率为: q vd k0 exp( ) S 0 kT
设一系列c会得到如
图所示的一组经典曲线,曲线形状与5类典型曲线中的(b)(c)两
种很相似,这组曲线有以下特征: • (1)在x=p/p0 1时,吸附值迅速上升,
V/Vm
也就是说,理论上会无限层吸附下去,这
满足BET推导时的假设p p0时吸附层达∞。 • (2)曲线形状对c值很敏感,当c≤2 时, 曲线无拐点[适应于等温吸附线(c)]。 • (3)而当c>2时,拐点越来越敏感[适应典型 吸附等温曲线]。
1 斜率
吸附常数 b 斜率
p P 1 V Vm bVm
截距
• b值与吸附热有关,反映了吸附分子与固体表面作用的强弱, b值增加意味着吸附热增加,等温线的形状也相应变化,b值
越大等温线起始段斜率越大。
2.2.4 混合气体吸附的Langmuir等温式
• 在一定温度下,如果有两种或者两种以上的气体分子在固体 表面吸附时,利用纯气体在固面吸附的Langmuir公式推导可 以得到混合气体的Langmuir等温式。 • 设有A、B两种气体,吸附平衡时覆盖率为θA和θB,对应得
V=Vmbp
V=Vm
或
bp V Vm bp V V 1 1 bp bp
m
V=kp1/n或
V Vm bp 1 bp
2.2.3 求解饱和吸附量Vm和吸附常数b:
• 由式(5-3)作p/V-p图会得到一条直线,直线的截距为1/bVm,
斜率2 1
C=100 10 2 1 0.5
0.2
p/p0
0.4
0.6
0.8
1.0
1.2 对实验数据的适应能力
• 二常数BET公式
V cx Vm (1 x)[1 (c 1) x]
斜率 c 1 1 ;截距 c Vm c Vm
x=p/p0
p 1 c 1 p ( p0 p)V cVm cVm p0
V Vm
由图5.1所示,n值不同,只有在
n=∞ n=7 n=4
p/p0较大时对吸附量有影响,当p/p0
很低时,BET二常数公式和三常数公
式很接近,因此一般可以用简单的 二常数公式。当n=1时,三常数公式
图5.1 BET吸附等温线
p p0
即为Langmuir单分子层吸附公式。
V Vm bp 1 bp
• 在平衡时,a vd ,即 v
A0 p q ( S S0 ) k0 exp( ) S0 (2m kT)1/ 2 kT
•
A0 p S0 k0 (2m kT)1/ 2 exp(q / kT ) 解出覆盖率θ: S A0 p 1 k0 (2m kT)1/ 2 exp(q / kT )
2
89.47 20.62
125.22 156.61 179.30 187.46 23.74 26.09 27.77 28.30
17.09
已知此时丁烷饱和蒸汽压P0=774.4mmHg,每个丁烷分子的横截面积 Am=44.6Å ,求该吸附剂的表面积。 p 解:由已知的数据求出P/P0和 (图略) ( p0 p )V
式中pi第i种气体的平衡分压,bi是第i种气体的吸附常数。
2.2.4 Langmuir吸附等温式的缺点
• 假设吸附是单分子层的,分子之间无作用力的,且在单分
子层下达到吸附平衡,与事实不符;
• 假设表面是均匀的,而大部分真实表面是不均匀的; • 它适用于中等覆盖度,既可以是物理吸附,也可以是化学 吸附,但在覆盖率θ较大时,Langmuir吸附等温式不适用。
第五章 气—固界面
本节课内容提要:
第五节 吸附等温式
第六节 BET公式的验证与比表面积的测定
第七节 毛细凝结与吸附滞后现象
• 吸附等温线
B
第五节 吸附等温式
• Freundlich吸附经验式;
• Langmuir吸附等温式—单分子吸附理论; • BET公式—多分子层吸附理论
一、 Freundlich吸附经验式
截距
由以上二式可知:V m
1 p 1 c 1 p 截距 斜率 ( p0 p)V cVm cVm p0 Vm 是固体表面铺满单分子 层时吸附气体的体积。
(2)求比表面积S0
• 每克吸附剂的总表面积叫做比表面积,用S0表示。如
果已知每个吸附分子的横截面积Am,则可用下式求S0 。
p 0.3 p0 氮气在粒径为0.1μ m的α -Fe203上 吸附的实验曲线
0.05
而由固体密度和粒径所计算出的值为11.9m2/g,两者基本一致。
1.3 表现温度关系
• 在BET公式中,能体现温度关系的只有参数c(c exp( V )), kT 关于不同的c值(实际上是不同的T值)各种曲线前面已经 给出。 • 在c表达式中有两个影响T的因素: 一个是kT值; 另一个是 和V 值。在BET公式推导过程中,我们曾经假定 各个层的kai和kdi是恒定不变的,因为温度对各个层的kai和 kdi影响是次要的温度效应,所以这种假设是可行的。
lg k 1 lg p n
1 n
• 若以 lgV lg p 作图,就得一直线,截距为lg k ,斜率为 1 ,即 n
二、 Langmuir吸附等温式—单分子吸附理论
• 2.1 Langmuir单分子层吸附理论模型 1916年,Langmuir提出单分子层吸附理论,假设如下: 1.单分子层吸附(包括单分子层化学吸附和单分子层物理吸 附),固体每个吸附位只能吸附一个分子;
• Freundlich根据实验结果提出吸附气体体积V与压力p之间的
纯经验公式: k p V 式中k和n为吸附体系的有关经验常数,且n≥1。将此式两边
取对数得: lg V 可求得n和k。 • Freundlich吸附经验式的不足: 反映不出Langmuir型吸附等温线的水平部分,仅适用于该 等温线的中压区域。
2.比表面积的测定
• BET理论最重要的应用是测定固体的比表面积。比表面积是衡量固 体吸附剂性能的一项重要指标,现在最常用的测量方法就是BET法, 其步骤如下: V cx (1) 先求Vm
c 1 斜率 c Vm 1 c Vm
Vm
(1 x)[1 (c 1) x]
X=p/p0
• 显然,在混合气体的吸附条件下,一种气体压力的增加可 减少另一种气体的吸附。而且,如果两种气体的b值相差
很大,则b值大的气体的存在会导致b值小的气体的吸附量
大大下降。对i种气体混合吸附的Langmuir吸附等温式
Vmbi pi bi pi Vi 或i 1 bi pi 1 bi pi
• 令
b
A0 k0 (2m kT)1/ 2 exp(q / kT )
• 则
bp 1 bp
····· ·· ·· ·· ·· ·· ····· ··· · · ·· ·· ·· ·· ····· ·· · · · · · (5-1)
bp 1 bp p P 1 V Vm bVm
气体分压为pA和pB,吸附常数b分别为bA和Bb,则
bA p A A 1 bA p A bB pB
• 采用吸附量表示为: VA
VmA bA p A 1 bA p A bB pB
bB pB B 1 bA p A bB pB
VmB bB pB VB 1 bA p A bB pB
Vmcx 1 (n 1) x n nxn1 V [ ][ ] n 1 1 x 1 (c 1) x cx
三常数BET公式
n=1 c>>1 x<<1 n ∞ x<1
V cx Vm (1 x)[1 (c 1) x]
第六节 BET公式的验证与比表面积的测定
3.2 BET公式
• BET假设吸附层数不受限制,则有BET二常数公式:
V cx /(1 x) 2 cx Vm 1 cx /(1 x) (1 x)[1 (c 1) x]
式中 x p / p ;V为压力p下的吸附量;Vm为单分子层的饱和
0
吸附量;p0为吸附温度下的吸附质的饱和蒸气压;c为与吸附热
有关的常数,c=exp[(ε-εV)/kT]。
• 但是对于多孔性固体,吸附层数一定受孔大小的限制,就是在 无孔固体上也不可能形成无限多层吸附,所以考虑仅限于n层的 吸附,得到BET三常数公式:
Vmcx 1 (n 1) x n nxn1 V [ ][ ] n 1 1 x 1 (c 1) x cx
• 若以V/Vm代替θ,则有:
V Vm
············ ···········(5-2) ············ ···········(5-3)
式(5-1)(5-2)(5-3)均称为Langmuir吸附等温式。
