二烯烃和共轭体系
第四章 二烯烃与共轭体系

光照 顺旋
CH3 H CH3 H
(Z,Z,E)-2,4,6-辛三烯
对旋
光照 顺旋
H H CH3 CH3
顺-5,6-二甲基环己二烯
CH3 H H CH3
加热 对旋 (E,Z,E)-2,4,6-辛三烯
4.5.4 双烯合成:Diels-Alder 反应
•含环己烯环的化合物的制备方法
CH2
+
BrCH2CH
CHCH2Br
Br
(37%) (63%)
结论
1,4加成产物更稳定; 1,2加成产物和1,4加成产物是可逆的; 1,2加成产物的活化能低,反应速度快。
练习题: 由丁二烯合成重要的药物前体及 材料合成中间体3-羟甲基戊二酸
HO2C
OH CO2H
HO2C
OH CO2H
第四章 二烯烃与共轭体系
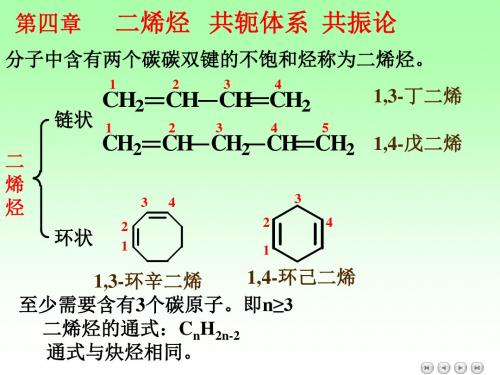
分子中含有两个碳–碳双键的不饱和烃称为二烯 烃, 包括链状二烯烃和环状二烯烃.
链状二烯烃
环状二烯烃
4.1 二烯烃的分类和命名
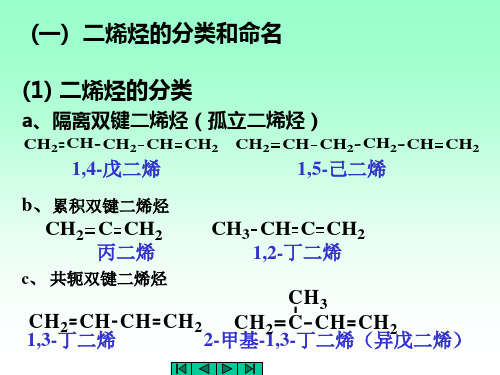
•隔离二烯烃 •共轭二烯烃
C
•累积二烯烃
4.2 二烯烃的结构
(1) 丙二烯的结构 (2) 1,3–丁二烯的结构
4.2 二烯烃的结构
4.2.1 丙二烯的结构
C +
+
+ C -
C + C +
p *3
C -
C
p2
成 键 轨 道
+ C + C -
+ C + C -
C + + C -
C + + C -
+ C + C C C C C
第4章 二烯烃和共轭体系

• 加热时:1, 4-加成为主要产物(达到平衡时比例高),说明较为稳
定。是由稳定性决定的产物(热力学控制)
• 低温产物比例加热后变化: 1, 4-加成产物较稳定,反应可逆。
P 134 习题4.8试判断下列反应的结果,并说明原因.
+
CH3CH=CHCH2CH2
思考题 思考题
上述三种情况,在加成反应的方向 与速率方面与乙烯有何不同?请给 予理论上的解释。
四、共振论
(1)共振论的基本概念
共振论:即离域体系可以用几个经典结构的叠加来描述。
CH2 CH CH CH2
+
CH2 CH CH2 CH2
-
-
CH2 CH CH2 CH2+
1,3-丁二烯的共振杂化体
共振论的基本思想
1,2-加成
ห้องสมุดไป่ตู้
CH2 CH CH CH2 + Br2
1,4-加成
CH2 CH CH CH2 Br Br
CH2 CH CH CH2 Br Br
影响1,2-加成和1,4-加成的的因素主要有反应
物的结构、试剂和溶剂的性质、产物的稳定性及温 度等。
极性溶剂有利于1,4-加成
正己烷 (62%) (38%)
CH2 CH CH CH2 + Br2
实验结果
HBr H2C CH CH CH2
(无过氧化物)
注意:双键位置有变化
H2C CH CH Br CH2 + H2C CH H H CH CH2 Br
1, 2-加成 -80oC 40oC 80% 20%
1, 4-加成 20% 80%
第四章二烯烃共轭体系共振论
sp2
C CH2
sp
0.131 nm
H
H C C CH2 H
H
H H
图4.1 丙二烯的结构示意图
两个π键相互垂直
CH2 = C = CH2 sp2 sp sp2
丙二烯结构示意图
注意:丙二烯分子中有四个平面相互垂直.
4.2.2 1,3-丁二烯的结构
特点:键长平均化~单键具有部分双键的性质
C=C C C
R CH CH CH3
(II)
R CH CH CH2 Br2
Br
R CH CH CH2 Br
R CH CH CH2 Br2 R CH CH CH2
Br
Br
反应中形成的是烯丙基型自由基,Br2进攻C3生成时 正常取代产物,进攻C1时生成重排产物。即:
R CH3 CH CH2 或 R CH CH CH2
E
E1'
E1
1, 2-加成
E2 1,4-加成 E2'
CH2 CH 1,2-加成产物 H
H
CH2
S-顺-1,3-丁二烯 S-(Z)-1,3 -丁二烯
s 指单键
(single bond)
S-反-1,3-丁二烯 S-(E)- 1,3-丁二烯
s-顺式
s-反式
这里的S—顺、S—反是指两个双键以单键为轴进行 旋转所形成的两种不同的构象。
4.2 二烯烃的结构
4.2.1 丙二烯的结构
118.4°
H C
贡献较小
(d)键长、键角变化大的极限结构对杂化体的贡献小。
贡献大
贡献较小,可忽略不计
4.4.2 书写极限结构式的基本原则: (a)极限结构式要符合价键理论和Lewis结构理论。
《有机化学》(第四版)第四章 二烯烃和共轭体系(习题答案)

第四章 二烯烃和共轭体系思考题习题4.1 下列化合物有无顺反异构体?若有,写出其构型式并命名。
(P119)(1) 1,3-戊二烯 CH 2=CH CH=CHCH 3解:有2个顺反异构体!C=CCH 3HCH 2=CHHC=CH CH 3CH 2=CHH(Z)- 1,3-戊二烯 (E)- 1,3-戊二烯(2) 2,4,6-辛三烯 CH 3CH=CH CH=CH CH=CHCH 3 解:有6个顺反异构体!C=C C=CHC=C HH CH 3H H CH 3HC=C C=CHC=C HCH 3HH H CH 3HC=CC=C H C=CHCH 3HCH 3H HH(Z,Z,Z)- 2,4,6-辛三烯 (Z,Z,E)- 2,4,6-辛三烯 (E,Z,E)- 2,4,6-辛三烯C=CC=C C=C HHHH CH 3CH 3H HC=CC=CC=C H HCH 3HHH HCH 3C=CC=C C=C HHCH 3H HCH 3H H(E,E,E)- 2,4,6-辛三烯 (E,E,Z)- 2,4,6-辛三烯 (Z,E,Z)- 2,4,6-辛三烯习题4.2 下列各组化合物或碳正离子或自由基哪个较稳定?为什么?(P126)(1) 3-甲基-2,5-庚二烯 和 5-甲基-2,4-庚二烯√CH 3CH=CCH 2CH=CHCH 3CH 3CH 3CH=CHCH=CCH 2CH 3CH 3π-π共轭无π-π共轭有(2)(CH 3)2C=CHCH 2CH 3CH=CHCH 2CH 2=CHCH 2、和(CH 3)2C=CHCH 2CH 3CH=CHCH 2CH 2=CHCH 26个超共轭σ-H 3个超共轭σ-H 0个超共轭σ-H 稳定性:>>(3)(CH 3)2CHCHCH=CH 2(CH 3)2CCH 2CH=CH 2(CH 3)2CCH 2CH 3、和 (CH 3)2CHCHCH=CH 2(CH 3)2CCH 2CH=CH 2(CH 3)2CCH 2CH 3稳定性:>>有p -π共轭p -π共轭无p -π共轭无给电子性:CH 3CH=CH 2>(4)、和CH 2CH=CHCH=CH 2CH 2CH=CHCH 2CH 3CH 3CHCH 2CH=CH 2稳定性:>>有π-π共轭CH 2CH=CHCH=CH 2CH 2CH=CHCH 2CH 3CH 3CHCH 2CH=CH 2p -π有共轭π-π无共轭π-π无共轭p -π有共轭p -π共轭无 (5)3 , (CH 3)22 , CH 32CH 3 和 (CH 3)3甲基自由基 一级自由基 二级自由基 三级自由基(6)(CH 2CH=CH)2, CH 22 和 CH 35个sp 2杂化碳共轭 3个sp 2杂化碳共轭 成单电子不在p 轨道上,不参与共轭共轭程度更大共轭程度相对较小习题4.3 解释下列事实:(P126)(1)CH 3CH 2CH=CHCH 3CH 3CH 2CH 2CHCH 3CH 3CH 2CHCH 2CH 3HCl+(主)(次)稳定性:>CH 3CH 2CHCH 2CH 3CH 3CH 2CH 2CHCH 3(2)CH 33CH 3CH 3CH 2CCH 3CH 3CH 3CHCHCH 3CH 3+HCl(主)(次)稳定性:>CH 3CH 2CCH 3CH 3CH 3CHCHCH 3CH 3(3)+HBr , 过氧化苯甲酰o(96%)(4%)CH 3CH=CH 2CH 3CH 2CH 2Br CH 3CHCH 3>稳定性:CH 32Br CH 3CHCH 2BrCH 3CH=CH 2CH 3CHCH 2Br CH 3CHCH 2BrPhCOOH + BrPhCOO+(过氧化苯甲酰)2PhCOOPhCO OCPh O O机理:... ...习题4.4 什么是极限结构?什么是共振杂化体?一个化合物可以写出的极限结构式增多标志着什么?(P130)解:极限结构——对真实结构有贡献,但不能完全代表真实结构的经典结构式;共振杂化体——由若干个极限结构式表示的该化合物的真实结构。
二烯烃,共轭体系

一二烯烃分子中含有不止一个双键的开链烃,按照双键数目的多少,分别叫做二烯烃,三烯烃.....至多烯烃等。
其中以二烯烃最为重要。
而根据二烯烃中双键位置的不同,又可以分为三类:a 累积二烯烃:两个双键连接在同一个碳原子上。
B 共轭二烯烃:两个双键之间,有一个单键相隔。
C 隔离二烯烃:两个双键之间,有两个或以上的单键相隔。
在这里主要介绍共轭二烯烃的性质。
1共轭二烯烃的结构以及共轭效应:1,3—丁二烯是最简单的共轭二烯烃,下面就以它为例来说明共轭二烯烃的结构。
在丁二烯分子中,四个碳原子和六个氢原子都处在同一个平面上。
其每一个碳原子都是sp2杂化,它们以sp2杂化轨道与相邻的碳原子相互交盖形成碳碳单键,与氢原子的1S轨道形成碳氢单键。
分子中一共形成了三个碳碳单键和六个碳氢单键,sp2杂化碳原子的三个σ键指向三角形的三个顶点,三个σ键相互之间的夹角都接近120°。
由于每一个碳原子的σ键都排列在一个平面上,所以就形成了分子中所有σ键都在一个平面的结构,此外,每一个碳原子都有一个未参与杂化的p轨道,它们都和丁二烯分子所在的平面垂直,因此这四个p轨道互相平行,在四个碳原子之间都有电子云交盖,从而电子也并不固定在两个原子之间,从而发生离域。
也就是说四个电子在四个原子轨道形成的共轭体系中流动,并不固定在某一位置。
2 共轭二烯烃的性质A 1,2—加成和1,4—加成共轭二烯烃和卤素,氢卤酸等都容易发生亲电加成,但可产生两种加成产物,如下所示:(1,2—加成产物和1,4—加成产物的键线式)1,2—加成产物是一分子试剂在同一个双键的两个碳原子上的加成,而1,4—加成产物则是一分子试剂加载共轭双键的两端碳原子上,同时原来的双键变为单键,而双键之间的单间变为双键。
1,3—丁二烯之所以有这两种加成方式,与其共轭结构有密切关系。
下面以溴化氢与丁二烯的加成来说明这一原理。
丁二烯与溴化氢的加成第一步也是H+的进攻,加成反应可能发生在C(1)或者C(2)上,然后生成相应的碳正离子(I)和(II)对于这两种碳正离子来说,双键上的碳原子,以及带有正电荷(在键线式中所表达出来的)的碳原子都是sp2杂化,而在(I)碳正离子中,三个碳原子剩余的p轨道均平行于三个碳原子锁组成的平面,因此它们之间存在共轭效应,从而正电荷并不只是单纯的聚集在同一个碳原子上,电荷因共轭效应而被分配到三个碳原子上,并且在C(2)和C(4)上的正电荷相对较多,从而分子比较稳定,生成(I)碳正离子所需要的活化能相对更低,而(II)碳正离子则没有共轭效应,因此反应总是向着(I)碳正离子的方向进行。
第4章--二烯烃 共轭体系
CH2Cl 高温高压
+
高温
CH2Cl HC Na
HgSO4/H2SO4
O
4.5.4 周环反应理论解释
福井谦一
伍德沃德
Robert Burns Woodward
霍夫曼 Roald Hoffmann
1981年诺贝尔化学奖
4.5.5 聚合反应
丁钠橡胶
Na n CH2 CH CH CH2 60 oC
*
CH2
4.5.2 1,4-加成的理论解释 第一步:亲电试剂H+的进攻
1
2
3
4
CH2 CH CH CH2 + H
空p轨道
H
CH3
CC
HC
H
H
CH2 CH CH CH3
稳定
CH2 CH CH2 CH2
4.5.2 1,4-加成的理论解释 第二步:溴离子( Br- )加成
共轭二烯烃的亲电加成产物1,2-加成和1,4-加成产物之比 与分子结构、所用试剂和反应条件(溶剂、温度、反应时 间)有关。
4.1.2 二烯烃的命名 主链必须包括两个双键在内,同时应标明两个双键的位置
顺反异构现象
H
H
H3C
CC
CC
CH3 S-反-(2Z, 4Z)-2,4-己二烯
H
H
s = single bond
4.2 二烯烃的结构
4.2.1 丙二烯的结构 sp sp2
H C C CH2
H 0.108nm 0.131nm
共振理论--是鲍林在20世纪30年代提出的。应用量子
力学的变分法近似地计算和处理象苯那样难于用价键 结构式代表结构的分子能量,从而认为:苯的真实结 构可以由多种假设的结构,共振(或叠加)而形成的共 振杂化体来代表。
09-二烯烃--共轭体系和共轭加成

第25页,共63页。
9.4.2 共振结构和共轭效应
+
H2C CH CH2
烯丙基正离子
H2C CH CH2
烯丙基自由基
H2C CH CH2
烯丙基负离子
电子离域结构式——烯丙基碳正离子中的正电荷、烯丙基自由基中 的单电子和烯丙基碳负离子中的负电荷都不是局限在一个p轨道中, 而是分散在了三个碳原子上。
烯丙基正离子
.
H2C CH-CH2
烯丙基自由基
.. H2C CH-CH2-
烯丙基负离子
π键
H H
π键
H H H
第20页,共63页。
CH2=CHCH2Cl 烯丙基氯
CH3CH2CH2Cl 1-氯丙烷 (CH3)2CHCl 2-氯丙烷
CH2=CHCH2+ + Cl- ΔHo= 716 kJ mol-1
S-trans-1,3-butadiene
无法改变的S-顺构象
二环[4.4.0]-1,9-癸二烯
无法改变的S-反构象
第17页,共63页。
H C
H C
C
C
H
H
HH
s-(顺)-1,3 -丁二烯
H C
H
H C
C H
H C
H
s-(反)- 1,3-丁二烯
Ho = -11.7 kJ mol-1
由s-顺式转变成s-反式所需的活化能约为26.8-29.3 kJ/ mol。在 室温下分子的热运动能提供这样多的能量,因此,它们迅速互变, 形成动态平衡。
共轭二烯中最重要的是1,3-丁二烯和2-甲基1,3-丁二烯(异戊
二烯)。
1,3-丁二烯的主要来源是石油裂解和丁烷的催化脱氢。
第四章 二烯烃和共轭体系

顺-
4
- 四氢化邻苯二甲酸酐
CHO 82%
丙炔醛
1,4 - 环己二烯甲醛
20
双烯合成一般规律:
1.双烯体连有供电基、亲双烯体连有吸电基时利于反应,反之。 供电基如:-CH3、-C2H5及其它烷基 吸电基如:-CHO、-COOH、-CN、-CH2Cl等 2.双烯体必须以s-顺式参加反应,否则不能反应。
5
(二) 电子离域与共轭效应
共轭效应 共轭体系产生电子离域,使体系能量降低的效应。
共轭效应类型 -共轭:如 CH2=CH-CH=CH2 p- 共轭:如 CH2=CHCH2
+
CH2=CH-CH=O
.
CH2=CHCH2
CH2=CHCl
-共轭:如 CH3-CH=CH2
-p共轭:如(CH3)3C+
一、完成反应式
1,2-加成
1. C 2 H5 2.
(1mol)
1,4-加成
3. CH3CH=CHOCH3 + HBr → ( 4.
)
29
二、写出
可能的极限式及共振杂化体。
三、结构推导
某化合物A(C5H6 )能使Br2/CCl4 溶液褪色,它与1molHCl加成 后的产物经臭氧化和还原水解得到2-氯戊二醛,试写出A可能的构造式 及各反应式。
8
2、p,π-共轭效应
双键与含有p轨道的原子相连时,由p 电子及π电子离域所体现的共轭效应。
烯丙型碳正离子(自由基): CH2=CHCH2+ 其它: CH2=CHCl
例如:
+ CH3 CH2 CH C H
( 1 +) 2 表示为
( 1 +) 2
正电荷、单电子或孤对电子被分散,体系更稳定。
二烯烃与共轭体系
O
O
100 oC
+
O 苯
O
95%
O
O
顺丁烯二酸酐 顺 - 4- 四氢化邻苯二甲酸酐
CHO 115 oC, 2~4 h
+
甲苯
丙炔醛
双烯体 亲双烯体
CHO 82%
1,4 - 环己二烯甲醛
双烯体含有供电基和亲双烯体具有吸电基时利于反应。
双烯体均以 s-顺式参加反应,如不能形成 s-顺式,
则反应不能进行。
(2)二烯烃的命名(标明每个双键位置和顺反关系)
CH3 CH CH CH2 CH CH2 1,4-己二烯
CH2 C CH CH2 CH3 1,2-戊二烯
CH3CH3 CH2 C C CH2
2,3-二甲基-1,3-丁二烯
H
CH3
C
CC
H
H
H
C CH3
顺,顺-2,4-己二烯 或(Z,Z)-2,4-己二烯
(20%)
(20%)
CH2 CH CH CH3 Br
(80%)
25 oC
(60%)
(40%)
CH2 CH CH CH2 + Cl2
200oC
(2) 电环化反应
CH2 CH CH CH2 + CH2 CH CH CH2
Cl Cl Cl
Cl
(30%)
(70%)
光(或热)
1,3-丁二烯
环状过渡态
环丁烯
(3)双烯合成, 亦称 Diels-Alder 反应
这个能量差值是共轭效应的具体表现,通称离域能 或共轭能。
由π电子离域所体现的共轭效应,称为π,π-共 轭效应。
共轭效应产生的条件: (1)构成共轭体系的原子必须在同一平面内。 (2)p轨道的对称轴垂直与该平面。
4、有机化学:二烯烃和共轭体系(4H).

前线轨道理论是由[日]福井谦一提出的。该理论将分 子轨道中最高占有分子轨道(简称HOMO)和最低空分子 轨道(简称LUMO)统称为称为前线分子轨道(FMO), 将分布在前线分子轨道中的电子称为前线电子。认为化学 键的形成主要是由FMO的相互作用所决定的。
键迁移反应等几种类型。
1、电环化反应
1.1 含“4n”个π电子共轭多烯烃体系
CH3
H
H
顺旋
CH3
(2E,4E)-2,4-己二烯
CH3 H
H CH3
反-3,4-二甲基环丁烯
CH3 H H
CH3
hv 对旋
CH3 H3C
H H
顺-3,4-二甲基环丁烯
1.2 含“4n+2”个π电子共轭多烯烃体系
CH3 H CH3 H
CO2CH3
2、
CCO2Et +
CCO2Et
CH3 CO2CH3
CH3
?
+
CO2CH3
(61%)
(39%)
CO2Et
?
CO2Et
3、 2
?
or
4、完成反应(表明产物的立体构型)
H H
4.1
CH3
CH3
CH3 H CH3
H
(苏大06年)
O
4.2
+
O
O
O O
O
(湘大06年)
3、周环反应的理论解释
1965年,[美]伍德沃德和霍夫曼提出了“分子轨道对 称守恒原理”,从而揭开了周环反应的奥秘。
1、顺丁橡胶
有机化学--第四章 二烯烃和共轭体系

具体到某一个反应,究竟是以1,2-加成为主,还是以1,4-加成为 主,则取决于很多因素,如反应物的结构、试剂和溶剂的性质、产 物的稳定性及反应温度等。例如,1,3-丁二烯与溴在-15℃进行反应, 1,4-加成产物的百分数随溶剂极性的增加而增多。
4.1 二烯烃的分类和命名
Байду номын сангаас4.1.1二烯烃的分类
根据二烯烃分子中两个双键相对位置的不同,可将二 烯烃分为三种类型。
1.隔离双键二烯烃
由于两个双键位次相距较远,相互影响较小,其性质 与单烯烃相似。
2.累积双键二烯烃
两个双键连接在同一个碳原子上的二烯烃,称为 累积双键二烯烃。例如:
由于累积双键很不稳定,累积双键二烯烃的存在和 应用均不甚普遍。
电环化反应的显著特点是具有高度的立体专一性, 即在一定的反应条件下(热或光),一定构型的反应物只 生成一种特定构型的产物*。例如:
加热顺旋被允许,光照对旋被允许。
4.2.3 双烯合成 (Diels-A1der反应 )
共轭二烯烃及其衍生物与含有碳碳双键、三键等的化合物进行 1,4-加成生成环状化合物的反应,称为双烯合成,亦称Diels-A1der反 应(周环反应的一种)。这是共轭二烯烃的另一特征反应。例如:
在共轭体系中,π电子的离域可用弯箭头表示,弯箭 头是从双键到与该双键直接相连的原子上和/或单键上, π电子离域的方向为箭头所示方向。例如:
在多原子分子中:
值得注意的是,共轭效应的发生是有先决条件的,即构成共轭
体系的原子必须在同一平面内,且其p轨道的对称轴垂直于该平面, 这样p轨道像才1能-氯彼丁此烷相这互样平,行由侧于面分交子盖内而成发键生原电子子的离电域负,性不否同则,电子 的离域而将引减起弱分或子不中能电发子生云。密另度外分,布共不轭平效均应,只且存这在种于影共响轭沿体分系中; 共轭效子应链在静共电轭诱链导上地产传生递电下荷去正,负这交种替分现子象内;原共子轭间效相应互的影传响递不因 共轭链的的电增子长效而应明,显称减为弱诱。导这效些应均(与ind诱uc导ti效ve 应eff不ec同t),。常用I表示
第四章 二烯烃和共轭体系

(2Z,4E)-2,4-庚二烯 (3E,5E)-1,3,5-庚三烯
顺,反-2,4-庚二烯
反,反-1,3,5-庚三烯
二烯烃的两种不同构象
CH2=CH—CH=CH2
H2C
CH2
C—C
H
H
1,3-丁二烯
s-顺-1,3-丁二烯 或s-(Z)-1,3-丁二烯
H
CH2
C—C
CH2
H
s-反-1,3-丁二烯 或s-(E)-1,3-丁二烯
反应称1,4-加成反应。
同样丁二烯与HBr的加成也有类似的现象。
1,2-加成 Br
HBr
3-溴-1-丁烯
1,4-加成
Br 1-溴-2-丁烯
在1,4-加成反应中,共轭双烯是作为一个整体参 加反应的,与单烯加成有明显不同,因此,
1,4-加成也称共轭加成,共轭加成是共轭双烯 的特征反应。
1,4-加成反应机理
H43H
CC 2 1 H
电子离域(P95)H C C
H
H
丁二烯分子中,1,2,3碳处于同一平面中,而2,3,4碳
也处于同一平面,所以整个分子在同一个平面中,4
个C原子以sp2方式杂化,C2-C3间以sp2-sp2重叠形成 键,C-H间以sp2–s成键。4个C原子均有一个未杂
化的p轨道垂直分子所在平面并互相平行,因此,不
的能量有所降低,使体系稳定。
由于电子离域,使得其中一个键受到其它分子的 影响而发生极化时,也必然影响到另一个键,并
使其发生同样的极化,从而产生了“交替极性”。
丁二烯由于存在“交替极性”,使其性质与单烯的
性质有着明显的不同。
共轭效应
在丁二烯中,单双键差别不如单烯明显,产生了共
第四章 二烯烃和共轭体系

有机化学
主讲教师:
佟拉嘎
北京石油化工学院
第四章 二烯烃和共轭体系 (4学时)
Ⅱ Ⅰ为仲碳正离子,Ⅱ为伯碳正离子。 Ⅰ中存在 如下p-π共轭效应, Ⅱ中不存在。故Ⅰ比Ⅱ稳 定。
1,2-加 成 + H 2C C H + C CH3 H Br1,4-加 成 H 2C C H Br H 2C C H
H C
CH3
Br C CH3 H
1,2-加成为动力学控制产物; 1,4-加成为热力学控制产物;
★p,π-共轭
• π轨道与相邻原子的 p轨道组成的共轭体系;
H2C C CH2 H
H2C
C H
CH2
存在p,π-共轭的分子举例:
H2C C CH2 H H2C C CH2+ H H2C C CH2H
H 2C
C Cl H
H 2C
C O R H
★超共轭
• 超共轭效应:涉及到C-Hσ键与相邻π键参 与的电子离域效应。也称σ,π-共轭效应。 存在这种效应的体系称为超共轭体系。 *超共轭效应比π,π-共轭效应和p,π-共轭效 应弱得多。
氯菌酸酐
+ COOCH3
H COOCH3
二环[2,2,1]-5-庚烯-2-羧酸甲酯
+
二环[2,2,1]-2,5-庚二烯
(2)加氢
+ H2
Pd-Ti 50 ℃
(3)α-氢原子反应
第三章-第四章(3) 二烯烃和共轭体系

(四) 电子离域与共轭体系
(1) π-π共轭
(2) p ,π - 共轭体系 (3) 超共轭
(五) 电子离域与共轭体系
共轭体系——三个或三个以上互相平行的p轨道形成的 大π键。
共轭体系的结构特征是:
1. 参与共轭体系的p轨道互相平行且垂直于相关原子 分子所处的平面; 2. 相邻的p轨道之间从侧面肩并肩重叠,发生键的离 域。 电子离域——共轭体系中,成键原子的电子云运动范 围扩大的现象。 电子离域亦称为键的离域。电子离域使共轭体系能 量降低。
CH3CH2C
CH
¼¼¼¼¼¼ á
Ag(NH3)2+
¼° × ° ×
CH2=CH-CH=CH2
电环化反应和环化加成反应都是经过环状过渡 态一步完成的协同反应,属于周环反应。
(三) 二烯烃的结构
(1) 丙二烯的结构
(2) 1,3-丁二烯的结构
(1) 丙二烯的结构
H
118.4
。 C
sp
sp
2
H C H
(二) 共轭二烯烃的化学性质
(1)1,4-加成反应
(2) 双烯合成
(二) 共轭二烯烃的化学性质
(1) 1,4-加成反应
Br2
Br Br Br Br CH2-CH=CH-CH2 + CH2=CH-CH-CH2
1,4-¼¼-2-¼¼ ¼¼ 3,4-¼¼-1-¼¼ ¼¼ ¼ ¼ ¼à ¨ ¼ ¼ ¼ ¨ 1,4-¼¼¼¼ ¼ ú 1,2-¼¼¼¼ ¼ ú
CH
d
-
CH
d
+
CH
d
-
2
(2) p ,π - 共轭体系
与双键碳原子直接相连的原子上有 p 轨道,这个p 轨道与组成π 键的 p 轨道平行,从侧面重叠构成 p ,π - 共轭体系。如:
第四章_二烯烃和共轭体系

在1,3-丁二烯分子中,两个双键还可以在碳碳(C2和 C3 之 间 ) 单 键 的 同 侧 和 异 侧 存 在 两 种 不 同 的 空 间 排 布 , 但 由 于 C2 和 C3 之 间 的 单 键 在 室 温 仍 可 以 自 由 旋 转 。 因此,这两种不同的空间排布,只是两种不同的构象,而
不 是 构 型 的 不 同 , 分 别 称 为 s- 顺 式 和 s- 反 式 [ s 指 单 键 (singlebond)],或以s-(Z)和s-(E)表示。
极性溶剂有利于1,4-加成
反应温度的影响也是明显的,一般低温有
利于1,2-加成,温度升高有利于1,4-加成。 例如:
4.4.2 共轭二烯烃1,4-加成的理论解释
共轭二烯烃能够进行1,4-加成可利用共轭效应进行 解释。例如,1,3-丁二烯与极性试剂溴化氢的亲电加成 反应,当溴化氢进攻1,3-丁二烯的一端时,1,3-丁二 烯不仅一个双键发生极化,而且整个共轭体系的电子云 发生变形,形成交替偶极。
第四章 二烯烃 共轭体系
主要内容
4.1 二烯烃的分类与命名 4.2 二烯烃的结构 4.3 电子离域与共轭体系 4.4 共轭二烯烃的化学性质
本章重点
共轭二烯烃 共轭体系与共轭效应
电子离域 1,4加成 电环化反应 周环反应 Diels-Alder反应 (双烯加成)
本章难点
1,3丁二烯分子轨道 共轭体系与共轭效应
H2C=CH CH=CH2
在共轭分子中,任何一个原子受到外界的影 响,由于π电子在整个体系中的离域,均会影响 到分子的其余部分,这种电子通过共轭体系传递 的现象,称为共轭效应。 由π电子离域所体现的共轭效应,称为π,π-共轭效应。
4个π电子扩展到四个碳原子之间:电子的离域
4二烯烃和共轭体系

2、加氯或加溴: 、加氯或加溴:
1,2
H2C
CH
CH
CH2
+
Cl2
常常
1,4
CH2Cl CH2Cl
CHCl CH (60%) CH HC (40%)
CH2 CH2Cl
H2C CH CH CH2 H2C C CH3
C(CH3)2 CH CH2
CH
CH2
3.隔离二烯烃:两个双键被多个单键隔开。 隔离二烯烃:两个双键被多个单键隔开。 隔离二烯烃
H2C CH CH2 CH CH2 H3C CH CH
第五章 二烯烃
二、命名 1. 选含两个双键的最长碳链为主链; 选含两个双键的最长碳链为主链; 2. 从靠近双键的一端开始编号,双键位置和最小; 从靠近双键的一端开始编号,双键位置和最小; 3. 写出名称,每个双键的位置都需要标明; 写出名称,每个双键的位置都需要标明; 4. 有顺反异构者,需标明。 有顺反异构者,需标明。
.. .
C H Cl
H H
.
C
电子数大于原子数,双键或三键碳原子上连接的原子带有孤对电子。 电子数大于原子数,双键或三键碳原子上连接的原子带有孤对电子。 轨道和π轨道参与的共轭 由p轨道和 轨道参与的共轭,叫p-π共轭 轨道和 轨道参与的共轭, 共轭
4.5.3.缺电子共轭 键(p-π共轭 : 缺电子共轭π键 共轭) 缺电子共轭 共轭 电子数小于原子数,双键或三键碳原子上连接的原子带有空的 轨 电子数小于原子数,双键或三键碳原子上连接的原子带有空的p轨 如烯丙基正离子。 轨道和π轨道参与共轭 共轭。 道,如烯丙基正离子。也由 轨道和 轨道参与共轭,叫p-π共轭。 如烯丙基正离子 也由p轨道和 轨道参与共轭, 共轭
二烯烃-共轭体系-共振论

•1, 2-加成产
物生成较快, 解离也较快。
•1, 4-加成产
物生成较慢, 解离也较慢。
35
➢ 其它例子
H2C CH CH CH2
HCl H2C
< 20 oC > 20oC
CH CH CH2 + H2C CH CH
Cl H
75~80% 25%
H
25~20% 75%
CH2 Cl
Cl2 H2C CH CH CH2
1
2
3
4
CH2 CH CH CH2
+
CH2
CH
CH
.._ CH2
.._ CH2
CH CH C+ H2
共价键多,贡献大 双键成分:C1C2,C3C4 >
电荷分离,贡献小 C2C3
27
② 对烯丙基自由基稳定性的解释
. CH2 CH CH2
. CH2 CH CH2
③ 对烯丙基自由基重排反应的解释
CH3(CH2)4CH2CH
Br 1,2-addition product
_ Br
HH H3C C C CH2
Br 1,4-addition product
=>
33
实验结果
注意:双键位置有变化
HBr
H2C CH CH CH2
H2C CH CH CH2 + H2C CH CH CH2
(无过氧化物)
Br H
H
Br
1, 2-加成
21
4.4.1 共振论的基本概念
(1) 当一个分子、离子或自由基不能用一个经典结构式
表示时,可用几个经典结构式的叠加(共振)来描述
极限结构
第4章 二烯烃和共轭体系

CH2
极性分子
以 1,3- 丁二烯与极性试剂溴化氢的亲电加成反应为例。
δ CH2
+
δ CH
δ CH
+
+ δ δ CH2 + H
δ Br
第一步:
CH2 CH CH CH2 H
+
CH2
CH2
CH
CH
CH
+
CH3
+
(Ⅰ)
(Ⅱ)
CH2 CH2
仲碳正离子(Ⅰ)比伯碳正离子 (Ⅱ)稳定, 因此 反应通常按生成碳正离子(Ⅰ)的途径进行。
当一个分子、离子或自由基的结构可用一个以上不同电子排
列的经典结构式(共振式)表达时,就存在着共振。这些共振式
均不是这一分子、离子或自由基的真实结构,其真实结构为所有 共振式的杂化体。
提示: 共振式之间只是电 子排列不同
共振杂化体不是共 振式混合物
共振杂化体也不是 互变平衡体系
关于共振论的几点说明:
如: 1,3-丁二烯,丙烯醛, 丙烯腈 超共轭( , π):甲基被视为部分失去一个质子, 可以和一个相邻的π键共轭 p, π 共轭: 一个π键和一个碳的P轨道紧邻, 中间无
饱和碳隔开.
, p共轭:CH3CH2+ , CH3CH2·
1
2
3 4
1. π, π 共轭;
2,3. p, π 共轭;
4. 超共轭
(20%)
(80%)
25 C CH2 CH CH CH2 + Cl2 200oC
o
(60%)
(40%)
CH2 CH CH CH2 + CH2 CH CH CH2 Cl Cl Cl Cl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1,3-丁二烯中的碳碳单键与一般乙烷中的碳碳单键并不相同,具有部分双键性质, 键长平均化。 乙烷 1,3-丁二烯 C—C C2—C3 0.154nm 0.148nm 乙烯 1,3-丁二烯 C=C C=C 0.133nm 0.134nm
8
按照分子轨道理论的概念,丁二烯的四个P轨道 可以组成四个π电子的分子轨道。
CH
CH2 Br
38% 63%
_
80℃
CH2 H
CH Br 80% CH Br 15%
CH
CH2
+
CH2 H
CH
CH
CH2 Br
CH2
CH
CH
CH2
+
HBr 40℃ CH2 H
20% CH CH2
+
CH2 H
CH
CH
CH2 Br
85%
19
思
考
为什么低温有利于1,2-加成,高温有利于1,4-加成?
1,2-加成所需的活化能较小,故反应速率较快,所以反应温度低时,以 1,2-加成产物为主。当反应温度较高时,碳正离子与溴负离子的加成是可 逆反应。由于反应温度升高后,反应物粒子的动能增大,活化能垒已不足 以阻碍反应的进程,此时决定最后产物的主要因素是化学平衡。对于两个 相互竞争的可逆反应,达到平衡时,每种产物的多少决定于该产物能量的 高低。由于1,4-加成产物的超共轭效应比1,2-加成产物的超共轭效应强, 能量较低而较稳定,故生成1,4-加成产物较多。总之,低温时是速率控制 或动力学控制的反应,活化能的高低起主要作用,对1,2-加成有利;温度 较高时,是化学平衡控制或热力学控制的反应,产物的稳定性高低起主要 作用,对1,4-加成有利。
-
CH CH 2Cl
CH3
CH3
22
2、电环化反应
电环化反应——在一定条件下,直链共轭多烯分子 可以发生分子内反应,π键断裂,同时双键两端的 碳原子以σ键相连,形成一个环状分子,这类反应 及其逆反应称为电环化反应。
光或热
[
]
环丁烯
23
s-顺 - 1 , 3 丁 二 烯
环状过渡态
电环化反应具有高度的立体专一性。
从共轭效应和诱导效应两方面解释,要 求能判断碳正离子稳定性、自由基稳定 性,解释实验事实。
15
练习一、排列稳定性顺序
CH3 (1) C H 3 CHCH CHCH2 (A) CH3 CH3 CCH CHCH3 (B) CH3 CH3 CHCHCH CH2 CH3 (C) (B) > (C) > (A) > (D) CH3 C C H 2C H C H 2 (D)
1、二烯烃的分类
根据双键的相对位置将二烯烃分为三类:
隔离双键二烯烃:两个双键被两个或两个以上单键隔开的
二烯烃,称为隔离(孤立)双键二烯烃。
累积双键二烯烃:两个双键连接在同一个碳原子上的二烯
烃,称为累积双键二烯烃。
共轭双键二烯烃:两个双键被一个单键隔开的二烯烃,称
为共轭双键二烯烃。
4
2、二烯烃的命名
11
共轭体系类型
π-π共轭、p-π共轭、σ-π超共轭、σ-p超共轭。
举例:
H π _ π 共轭 CH2 CH CH CH2 H H C C C H C H H
H p _ π 共轭 CH2 CH CH2
+
H H
C H
H CH2 CH CH2
H H H C C
C H
H
C
C
H CH2 CH Cl H H C C
Cl H H
σ
_
π 共轭
C CH3 CH CH2 C C
σ
_p 共轭
CH3
CH2
+
C
C
H H
12
2、共轭效应
从1,3-丁二烯的分子轨道的讨论指出,在其共轭体系中,四 个π电子是在四个碳原子的分子轨道中运动,这种离域的结果, 使其电子云密度的分布有所改变,从而使其内能更小,分子 更稳定,键长趋于平均化,这样由于共轭产生的效应叫做共 轭效应(Conjugative effect)。 共轭体系中存在的特殊的电子效应称为共轭效应。 共轭效应的表现 能量低,稳定。 键长平均化。电子向电子云密度低的部位转移。 交替极化。在共轭分子内存在供电子或吸电子基团,或在 外电场影响下共轭效应沿碳链传递不减弱,电荷正负极交替 分布。
H CH3 H C C
H C C H CH3 CH3 H
H C C
CH3 C C H H H CH3
H C C
CH3 C C H H
顺,顺-2,4-己二烯 或(2Z,4Z)-2,4-己二烯
顺,反-2,4-己二烯 或(2Z,4E)-2,4-己二烯
反,反-2,4-己二烯 或(2E,4E)-2,4-己二烯 6
H hν H CH 3 CH3 H H CH3 反 , 反 - 2, 4- 己 二 烯 H H hν CH3 顺 - 3, 4- 二 甲 基 环 丁 烯 CH3 CH3 顺 , 反 - 2, 4- 己 二 烯 H H CH3
CH3 反 - 3, 4- 二 甲 基 环 丁 烯
(B)>(C)>(A)>(D)
+ +
(2) (A) C H 2 C H
CHCH
CH2
(B) C H 2 C H
C H C H 2C H 3
(C) C H 3 C H C H 2 C H (A) > (B) > (C)
+
CH2
(A)>(B)>(C)
16Βιβλιοθήκη 练习二、完成反应H CH3 C H H CH3 C H CH CH CH3
ψ4
反键轨道
反键轨道
ψ
3
E
原子轨道
ψ
2
成键轨道
成键轨道
ψ1
丁 二 烯 π电 子 分 子 轨 道 的 能 级 图
丁二烯的分子轨道图形
9
说明: 从分子轨道图形可以看出,在ψ1轨道中π电子 云的分布不是局限在C1-C2, C3-C4之间,而是分布在碳 三、二烯烃的结构 原子的两个分子轨道中,这种分子轨道称为离域轨道, 这样形成的键称为离域键。从ψ2分子轨道中看出,C1C2,C3-C4之间的键加强了,但C2-C3之间的键减弱了, 结果,所有的键虽然都具有π键的性质,但C2-C3键的π 键的性质小些。所以,在丁二烯分子中,四个π电子是 分布在包含四个碳原子的分子轨道中,而不是分布在两 个定域的π轨道中。 原因:(1)1,3-丁二烯中碳原子sp2杂化,σC2-C3是Csp2 -Csp2形成的。碳sp2杂化比sp3杂化s轨道成分增加,电 负性增大,电子云更靠近原子核。对电子的吸引力增强, 键能增强,键长缩短。 (2)每个碳sp2杂化,p轨道侧面交盖,形成离域大π键, 10 电子云趋于平均化,所以键长平均化。
Br C2 δ+ CH2
4
δ CH
3
-
δ+ CH
2
δ CH2
1
-
C1
+
CH2 Br CH2
CH
CH
CH3 CH3
CH2 CH2
+
CH
CH
+
CH3 CH2
H
+
C4
CH
CH
18
C3
CH2
CH
例二
CH2
CH
CH
CH2
+
B r2
CH2 Br 正己烷 氯仿
CH Br 62% 37%
CH
CH2
+
CH2 Br
CH
H H 0.148nm C C 0.134nm C 122.4° H 119.8° C H H
0.108nm H
丁二烯分子中碳原子都以杂化轨道相互 重叠或与氢的轨道重叠,形成三个C-Cσ 键和6个C-Hσ键,所有的原子都在同一 平面上,键角都接近于120º 。此外,每 个碳原子上未参与杂化的轨道均垂直于 上述平面,四个轨道的对称轴互相平行 侧面重叠,形成了包含四个碳原子的四 电子共轭体系。
二烯烃的命名与单烯相似,选取含有二个双键的最 长碳链为主链,尽量使双键的位次最低。双键的位 置要标明。
CH 3CH
C H C H 2C H
CH2
CH2
C
C H CH 2CH 3
1,4-己二烯
1,2-戊二烯
C H 2C H 3 CH 3CH CHC CH2
5
H CH 2CH 3
烯
2-乙基-1,3-戊二烯
CH3
δδδ+ CH2
δδ+ CH2
δ+ CH2
δCl
由于分子内原子的电负性不同,而引起分子中电子云密度分布不平均, 且这种影响沿分子链静电诱导地传递下去,这种分子内原子间相互影响的 电子效应成为诱导效应(Iductive effect)。
14
4、解释一些具体问题
碳正离子稳定性 烯丙基碳正离子>3°R+ >2°R+ >1°R+ >CH3+ 自由基稳定性 烯丙基自由基>3°R· >2°R· >1°R· CH3 >·
四、共轭效应和诱导效应
1、共轭体系(共轭平均分担之意)
概念 在分子结构中,含有三个或三个以上相邻且共 平面的原子时,这些原子中相互平行的轨道之间 相互交盖连在一起,从而形成离域键(大键)体 系称为共轭体系。电子能够发生离域的体系称为 共轭体系。 形成条件 成键原子共平面性,共轭体系中各个σ键都在同 一平面内。 参加共轭的p轨道互相平行。
第四章 二烯烃和共轭体系
1
【教学要求】1、了解二烯烃的分类。2、掌握二 烯烃的命名法。3、理解丁二烯的分子结构及 分子轨道。4、掌握共轭效应和共轭体系的概 念。5、掌握共轭二烯烃的反应1,4-加成和1, 2-加成以及周环反应。
