芳香族卤代物
5芳香族化合物

2) 苯本身不能和酸性 KMnO4 溶液反应,不会与高锰酸钾反应褪色,与溴水混合只会发生萃取,而苯 及其衍生物中,只有在苯环侧链上的取代基中与苯环相连的碳原子与氢相连的情况下才可以使高锰酸
钾褪色(本质是氧化反应),这一条同样适用于芳香烃(取代基上如果有不饱和键则一定可以与高锰 酸钾反应使之褪色)。 注意:①是仅当取代基上与苯环相连的碳原子; ②这个碳原子要与氢原子相连 (成键) 。 至于溴水, 苯及苯的衍生物以及饱和芳香烃只能发生萃取 (条 件是取代基上没有不饱和键,不然依然会发生加成反应)。 1、能证明苯分子中不存在单双键交替的理由是 ( ) A 苯的邻位二元取代物只有一种 B 苯的间位二元取代物只有一种 C 苯的对位二元取代物只有一种 D 苯的邻位二元取代物有二种 ) 2、苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是( ①苯不能使溴水褪色 ②苯不能使酸性高锰酸钾溶液褪色 ③苯在一定条件下既能发生取代反应,又能发生加成反应 ④经测定,邻二甲苯只有一种结构 ⑤经测定,苯环上碳碳键的键长相等,都是1.40× 10-10m A.①②④⑤ B.①②③⑤ C.①②③ 3、下列物质中所有原子都有可能在同一平面上的是 ( )
8. 甲苯的化学性质:化学性质活泼,与苯相像。可进行氧化、磺化、硝化和歧化反应,以及侧链氯化 反应。甲苯能被氧化成苯甲酸。 (1) 硝化反应: CH3 CH3 +3HO-NO2 O2N-NO2+3H2O NO2 甲苯与浓硝酸在浓硫酸的催化( 100 摄氏度)下可发生反应,生成三硝基甲苯。又名 TNT ,是一种黄 色针状晶体。不溶于水。它是一种烈性炸药。用于国防、开矿、筑路等。 (2) 取代反应: (3) 加成反应: 课外小阅读(一) :苯的历程 苯最早是在 19 世纪初研究将煤气作为照明用气时合成出来的。 1803 年 -1819 年 G.T.Accum 采用同样方法制出了许多产品,其中一些样品用现代的分析方法检测 出有少量的苯。然而,一般认为苯是在 1825 年由麦可 · 法拉第发现的。他从鱼油等类似物质的热裂解 产品中分离出了较高纯度的苯,称之为 “ 氢的重碳化物 ” ( Bicarburetofhydrogen )。并且测定了苯的一 些物理性质和它的化学组成,阐述了苯分子的碳氢比。 1833 年, Milscherlich 确定了苯分子中 6 个碳和 6 个氢原子的经验式( C 6 H 6 )。弗里德里希 · 凯库 勒于 1865 年提出了苯环单、双键交替排列、无限共轭的结构,即现在所谓 “ 凯库勒式 ” 。 据称他是因为梦到一条蛇咬住了自己的尾巴才受到启发想出 “ 凯库勒式 ” 的。他又对这一结构作出 解释说环中双键位置不是固定的,可以迅速移动,所以造成 6 个碳等价。他通过对苯的一氯代物、二 氯代物种类的研究,发现苯是环形结构,每个碳连接一个氢。 1845 年德国化学家霍夫曼从煤焦油的轻馏分中发现了苯,他的学生 C.Mansfield 随后进行了加工 提纯。后来他又发明了结晶法精制苯。他还进行工业应用的研究,开创了苯的加工利用途径。 1861 年,化学家约翰·约瑟夫·洛斯密德( Johann Jasef Loschmidt )首次提出了苯的化学键,双 键交替结构,但他的成果未受到重视。 1865 年, 弗里德里希 · 凯库勒在论文 《关于芳香族化合物的研究》 中, 再次确认了四年前苯的结构, 为此,苯的这种结构被命名为 “ 凯库勒式 ” 。他对这一结构作出解释说环中双键位置不是固定的,可以 迅速移动,所以造成 6 个碳等价。他通过对苯的一氯代物、二氯代物种类的研究,发现苯是环形结构, 每个碳连接一个氢。 此外,詹姆斯 · 杜瓦发现了一种苯的类似物;命名为 “ 杜瓦苯 ” ,现已被证实,可由苯经光照得到。 大约从 1865 年起开始了苯的工业生产。最初是从煤焦油中回收。随着它的用途的扩大,产量不断 上升,到 1930 年已经成为世界十大吨位产品之一。 课外小阅读(二):苯的工业制备 苯可以由含碳量高的物质不完全燃烧获得。自然界中,火山爆发和森林火险都能生成苯。苯也存 在于香烟的烟中。煤干馏得到的煤焦油中,主要成分为苯。 直至二战, 苯还是一种钢铁工业焦化过程中的副产物。 这种方法只能从 1 吨煤中提取出 1 千克苯。 1950 年代后,随着工业上,尤其是日益发展的塑料工业对苯的需求增多,由石油生产苯的过程应运而生。 现在全球大部分的苯来源于石油化工。工业上生产苯最重要的三种过程是催化重整、甲苯加氢脱烷基 化和蒸汽裂化。 从煤焦油中提取:在煤炼焦过程中生成的轻焦油含有大量的苯。这是最初生产苯的方法。将生成 的煤焦油和煤气一起通过洗涤和吸收设备, 用高沸点的煤焦油作为洗涤和吸收剂回收煤气中的煤焦油, 蒸馏后得到粗苯和其他高沸点馏分。粗苯经过精制可得到工业级苯。这种方法得到的苯纯度比较低, 而且环境污染严重,工艺比较落后。 从石油中提取:在原油中含有少量的苯,从石油产品中提取苯是最广泛使用的制备方法。
第九章卤代烃化合物

氯丙稀 生物监测指标:烯丙基硫醇尿酸
氯丁二烯 生物监测指标:3-氯-2-羟基-3-丁烯硫醇尿酸 3,4-二羟丁基硫醇尿酸
第二节 饱和卤代烃
三氯甲烷(氯仿)
有机合成的重要原料,工业上常见的有机溶剂 可经消化道、呼吸道和皮肤进入人体 毒性: 抑制中枢神经系统,损害心肌、肝肾、胚胎, 致癌致畸
二氯乙烷
代谢过程与苯相似 生物监测指标:呼出气中氯苯 尿中4-氯邻苯二酚和4-氯酚 样本采集 呼出气:班后采样 尿样:聚乙烯塑料瓶收集班末尿
呼出气中氯苯的测定
(一)二硫化碳解吸-气相色谱法 原理 终末呼出气采集后,用活性炭富集,二硫化碳 解吸后进样,经FFAP色谱柱分离,火焰离子 化检测器检测。以保留时间定性,峰高或峰面 积定量。
常见芳香族卤代烃: 氯苯、二氯苯、氯甲苯、氯化联苯等 毒性:刺激皮肤黏膜 引起全身中毒,损失肝肾、神经系统
第一节 不饱和卤代烃
氯乙烯
主要通过呼吸道进入体内,液态可少量经皮肤 吸收 致癌物,可诱发多种肿瘤 生物监测指标:终末呼出气中氯乙烯含量 尿样中硫代二乙酸含量
氯乙烯样品采集
呼出气: 脱离工作现场,在空气清洁场所采集 平静呼吸5~6次后采集终末呼出气
(二)离子色谱法
原理: 血液样品经乙腈沉淀蛋白质、SPE-Ag柱和 SPE-H柱除氯后,再经过0.22µm滤膜过滤,经离 子色谱法柱分离,电导检测器检测,保留时间定 性,峰面积定量。
第三节 卤代芳烃类
氯苯
氯苯是人工合成化学物,主要应用于生产医药、 农药(如DDT)、色素等有机合成的吸附剂和 中间体。 可经呼吸道、消化道和皮肤等吸收。 体内主要分布于附睾和肾周的脂肪组织中。 对中枢系统具有抑制和麻醉作用。
卤代烃的制备

卤代烃的制备卤代烃是一类重要的有机合成中间体。
通过卤代烷的取代反应,能制备多种有用的化合物,如腈、胺、醚等。
在无水乙醚中,卤代烷和镁作用生成格氏试剂RMgX ,后者和羰基化合物如醛、酮及二氧化碳作用,可制得醇、酸。
制备卤代烃的原料,多为结构上对应的醇。
实验室中最常用的卤代烷是溴代烷。
其主要合成方法是由醇和HBr (47%)作用,使醇中的羟基被溴原子取代。
R-OH + HBr H 2SO 4R-Br + H 2O为了加速反应和提高产率,操作时常加入浓硫酸作催化剂,或采用浓硫酸和NaBr 、KBr 作溴代试剂。
NaBr + H 2S O 4NaHS O 4 + HBr 由于硫酸的存在可能会使醇脱水成烯和醚,所以制取叔溴代烷时主要产物为烯烃。
但叔醇与HBr 的反应较容易,只需47%HBr 即可,不必加硫酸催化。
为除去反应后多余的原料醇和副产物醚,可用硫酸洗涤。
氯代烃可用醇和SOCl 2或浓HCl 在ZnCl 2存在下制取。
碘代烷可通过醇和PI 3或P+I 2作用下而制得。
芳香族氯代和溴代物一般是用卤素(Cl 2或Br 2)在铁粉或三卤化铁催化下与芳香族化合物作用而制得。
芳香族氟代和碘代物则常通过重氮盐方法来制取。
正溴丁烷的制备实验目的:1、学习正溴丁烷的制备原理和方法2、练习回流、蒸馏、分液、液体干燥和气体吸收操作实验重点:卤代烃的制备方法实验难点:粗产物的提纯,即分步多次洗涤课时安排:6学时实验原理:正丁醇与溴化钠、浓硫酸共热即得。
NaBr + H 2S O 4NaHS O 4 + HBrn-C 4H 9OH + HBr 24n-C 4H 9Br + H 2O副反应:24n-C 4H 9OHCH 3CH 2CH=CH 2 + H 2O 242 n-C 4H 9OH (n-C 4H 9)2O + H 2O2 HBr + H 2SO 4 ==== Br 2 + SO 22O实验步骤:六步 1、加料 2、回流 3、蒸馏 4、洗涤 5、干燥 6、蒸馏100mL 圆底烧瓶 加10mLH O 1.加料14mL 浓硫酸分次,振摇9.2mL 正丁醇混匀,冷却 13g 溴化钠振摇,沸石2粒 2.回流 安装回流冷凝管5%氢氧化钠吸收尾气振摇下回流0.5hr 3.蒸馏冷却后,改成蒸馏, 补加沸石2粒 4.洗涤馏液10mL 水10mL 浓硫酸10mL 水10mL 饱和碳酸氢钠10mL 水5.干燥 无水氯化钙(1~2g )6.蒸馏 过滤后蒸馏(99~103℃),7~8g为了提高产率,所采取的措施有:1、 浓硫酸过量,其作用有:a 、 吸收反应中生成的水,使HBr 保持较高的浓度,加速反应的进行;b 、 使醇羟基质子化,容易离去;c 、 使反应中生成的水质子化,阻止卤代烷通过水的亲核取代变回原来的醇。
卤代芳香族化合物cas号

卤代芳香族化合物CAS号一、什么是卤代芳香族化合物?卤代芳香族化合物是指芳香环上的一个或多个氢原子被卤素(氟、氯、溴、碘)取代的有机化合物。
由于卤素的电负性较大,使得卤代芳香族化合物具有较高的极性和较强的惰性,具有广泛的应用领域。
二、常见的卤代芳香族化合物C A S号1.氯代苯(氯苯)-C AS号:108-90-7-分子式:C6H5C l-分子量:112.56氯代苯是最常见的卤代芳香族化合物之一,是苯环上的一个氢原子被氯原子取代而成。
氯代苯具有可燃性、刺激性气味,并且在工业上有广泛的应用,包括作为溶剂、药物合成中间体等。
2.溴代苯(溴苯)-C AS号:108-86-1-分子式:C6H5B r-分子量:157.01溴代苯是苯环上一个氢原子被溴原子取代的卤代芳香族化合物。
溴代苯具有类似氯代苯的特性,但比氯代苯的活泼性更高。
它在有机合成、医药和农药等领域得到广泛应用。
3.氟代苯(氟苯)-C AS号:372-45-4-分子式:C6H5F-分子量:96.1氟代苯是指苯环上一个氢原子被氟原子取代的卤代芳香族化合物。
与氯代苯和溴代苯相比,氟代苯在化学反应中具有更高的活性。
氟代苯在药物合成、有机光电材料等领域具有广泛的应用。
4.碘代苯(碘苯)-C AS号:591-50-4-分子式:C6H5I-分子量:204.01碘代苯是苯环上一个氢原子被碘原子取代的卤代芳香族化合物。
碘代苯具有类似的性质,但由于碘原子的较大体积和较低的极性,在反应性上与其他卤代苯有所不同。
碘代苯在有机合成、医药和染料工业等领域有广泛的应用。
三、总结卤代芳香族化合物是有机化学中常见的一类化合物,其特点是芳香环上的氢原子被卤素(氟、氯、溴、碘)取代。
常见的卤代芳香族化合物包括氯代苯、溴代苯、氟代苯和碘代苯等,它们在不同领域具有广泛的应用。
使用CA S号标识化合物可以确保对其唯一性的准确描述,便于在科学研究和工业生产中进行标识和鉴别。
对于需要研究、合成或应用卤代芳香族化合物的科学家和工程师们来说,了解这些常见的化合物的C AS号是非常重要的。
第九章 卤代烃

第九章卤代烃卤代烃可以看作是烃分子中一个或多个氢取代后所生成的化合物。
其中卤原子就是卤代烃的官能团。
R-X, X=Cl.、Br、I 、F卤代烃的性质比烃活泼得多,能发生多种化学反应,转化成各种其他类型的化合物。
所以,引入卤原子,往往是改造分子性能的第一步加工,在有机合成中起着桥梁的作用。
自然界极少含有卤素的化合物,绝大多数是人工合成的。
第一节卤代烃的分类、命名及同分异构现象一.分类卤代烃: 1. 脂肪族卤代烃(1)脂肪族卤饱和代烃(2)不饱和脂肪族卤代烃2.芳香族卤代烃根据和卤原子直接相连的碳原子类型的不同又可分为:R-CH2X ,一级卤代烃(伯卤代); R2CHX,二级卤代烃(仲卤代烃);R3C-X,三级卤代烃(叔卤代烃)二.命名1.结构简单的卤代烃可以按卤原子相连的烃基的名称来命名,称为卤代某烃或某基卤。
(CH3)2CHBr,溴代异丙烷(异丙基溴); C6H5CH2Cl,氯代苄(苄基氯)2.较复杂的卤代烃按系统命名法命名:①.卤代烷,以含有卤原子的最长碳链作为主链,将卤原子或其他支链作为取代基。
命名时,取代基按“顺序规则”较优基团在后列出。
[烷烃为母体]②.卤代烯烃命名,含双键的最长碳链为主链,以双键的位次最小为原则进行编号。
[烯烃为母体]③.卤代芳烃,[芳烃为母体]侧链氯代芳烃,常以烷烃为母体,卤原子和芳环作为取代基。
④.卤代环烷则一般以脂环烃为母体命名,卤原子及支链都看作是它的取代基。
[卤代环烷命名]较小的(原子序数小的)基团,编号最小三.同分异构现象卤代烷的同分异构体数目比相应的烷烃的异构体数多。
如一卤代烷除了具有碳干异构体外,卤原子在碳链上的位置不同,也会引起同分异构现象。
第二节卤代烷一.物理性质。
(自学)二.光谱性质。
1.IR:νC-F 1400~1000cm-1νC-F 800~600cm-1 νC-Br 600~500cm-1 νC-I 500cm-1碳卤键的吸收频率随着卤素原子量的增加而减少。
芳香族化合物的合成法

11
通过重氮盐可以合成多种化合物,如下所示:
CHO i. HNO3,H2SO4 ii. Fe/HCl iii. HNO2 KI CHO N2+ CuCN PhH HOS KSCOEt CHO Gomberg -Bachmann CHO I CHO
CHO i. NaBF4 ii. F Schiemann CHO
CH2CH2CH3 Cl2 Fe CH2CH2CH3 NBS Cl CHBrCH2CH3 CH=CHCH3 KOH EtOH Cl Cl
19
TM(15)
准则8 若涉及邻、对位取代时(如甲苯的溴 代),一个可采用的避免分离(分离增加了步 骤,是要损失产率的!)的策略就是占位:
CH3 H2SO4 CH3 Br2/Fe CH3 Br H2O(g) SO3H CH3 Br
R R'
14
NH2
再如由甲苯合成3,5-二硝基苯甲酰氯(12)(以 及3,5-二卤代苯甲酸、酯等羧酸衍生物)。
CH3 i. HNO3/H2SO4 ii. Fe/HCl iii. Ac2O CH3 HNO3(e) O2N CH3 NO2 NHAc
NHAc
i. HOii. HNO2 iii.HCHO
CH3 O2N NO2 i. KMnO4 ii. SOCl2 O2N
6
化合物(6)的合成涉及到甲基的氯代和环上 的氯代,这就有先后顺序和官能团转化的问题:
Cl Cl3C (6) H3C Cl H3C
文献报道的合成产率还很不错,但一般却不能 这样引入甲基邻、对位的氯或溴,因为二者的 沸点相近难以分离,需采用后面的重氮盐的应 用。
7
再如由苯合成间溴正丙基苯(7)。
注意两点:一是溴的引入方式;二是三个 碳以上直链的引入方法,即酰基化后经 Clemmensen还原。合成过程如下:
第二节芳香烃

苯与浓硝酸、浓硫酸的混合物在55 (2)苯与硝酸反应 基苯;
H + HO-NO2 浓H2SO4 55℃~60℃
~ 60℃时生成硝
注意硝基苯 的物理性质
-NO2+H2O
的反应叫做硝化反应
浓硫酸的作用:
硝基苯是一种带有苦杏仁味的、无色的油状液体, 硝基:-NO2(注意与NO2- 区别) 密度比水大。难溶于水,易溶于乙醇和乙醚。硝基 苯有毒(硝基苯与皮肤接触或它的蒸气被人体吸收, 烃分子中的氢原子被-NO2所取代 都能引起中毒),是制造染料的重要原料。
硝基苯
吸水剂和催化剂
苯 的 硝 化 反 应 实 验
苯的硝化实验中的问题:
①浓硫酸的作用:催化剂、吸水剂 ②配制混合酸时,要将浓硫酸慢慢倒入浓硝酸中, 并不断搅拌。以减少浓硝酸的挥发与分解。 ③浓硝酸和浓硫酸的混合酸要冷却到50~60℃以下, 再慢慢滴入苯,边加边振荡,必要时需冷却。因为 反应放热,温度过高时有副反应发生,且苯、硝酸 易挥发,硝酸也会分解。 ④本实验采用水浴加热,温度计的水银球必须插入 水浴中。“浴热”容易控制恒温,且易使被加热物 受热均匀。
• 怎样从混合物中分离出溴苯? • 得到的溴苯是一种什么颜色、状态的物质? • 如何除去无色溴苯中溶解的溴?
剧烈反应,有白雾生 成,三颈烧瓶底部有 褐色油状物出现,加 NaOH溶液后有红褐 色沉淀生成
导管为什么不伸入锥形瓶的液面以下? HBr易溶,防止倒吸 如何分离反应后的混合物中的各成分? 先倒入盛有冷水的烧杯中,再进一步处理。 溴苯具有怎样的物理性质? 如何除去溴苯中溶解的溴?
2、氧化反应
⑪可燃性 ⑫可使酸性高锰酸钾褪色
CH3
KMnO4溶液
COOH
H+
芳香烃__卤代烃

芳香烃、卤代烃【知识要点梳理】知识点一、苯的结构与化学性质:(苯是最简单、最基本的芳香烃)1、物理性质:苯是一种无色、有特殊气味的液体,密度比水小,不溶于水。
2、结构特点:现代科学对苯分子结构的研究:①苯分子为平面正六边形结构,分子中的6个碳原子构成正六边形,键角为120°,分子中的6个碳原子和6个氢原子都在同一平面内。
②苯分子中碳碳键键长为40×10-10m,介于单键和双键之间。
(独特的结构决定其具有独特的性质)③结构简式:或均可3、化学性质:(组成上高度不饱和,结构比较稳定)从苯的分子组成上看,具有很高的不饱和度,其性质应该同乙烯、乙炔相似,但实际上苯不能与溴的四氯化碳溶液、高锰酸钾酸性溶液反应,苯在化学性质上与烯烃和炔烃明显不同。
说明苯的结构比较稳定,这是苯的结构和化学性质的特殊之处──“组成上高度不饱和,结构比较稳定”。
①苯的稳定性(与烷烃相似):表现在不能与溴的四氯化碳溶液、酸性高锰酸钾溶液反应。
②苯在空气中燃烧:燃烧现象:在空气中燃烧,燃烧时产生明亮的带有浓烟的火焰,这是由于苯分子里含碳的质量分数很大的缘故。
方程式:③苯的取代反应(与烷烃相似)——卤代、硝化、磺化苯与液溴在铁粉催化下发生取代反应:条件:液溴、铁粉做催化剂苯与浓硝酸发生取代反应:(硝化反应)条件:50℃~60℃、水浴加热、浓硫酸做催化剂、吸水剂。
④苯的加成反应(与H2、Cl2) :苯在特殊条件下可与H2发生加成反应:条件:镍做催化剂、180℃~250℃的条件下小结:在通常情况下苯的性质比较稳定,在一定条件下能发生氧化、加成、取代等反应。
苯的化学性质——易取代、能氧化(燃烧)、难加成。
知识点二、苯的同系物:(由于苯基和烷基的相互影响,使其性质发生了一定的变化——更活泼)1、基本概念:①芳香族化合物:分子中含有苯环的有机化合物,如硝基苯、溴苯、苯乙烯等。
②芳香烃:含有苯环的烃类,如甲苯、苯乙烯等。
③苯的同系物:苯环上的H原子被烷基取代的产物,如甲苯、二甲苯等。
简单芳香环记忆
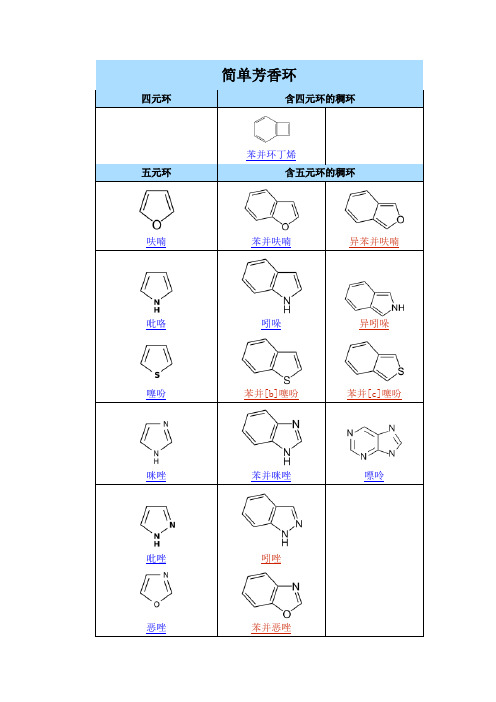
芳伯胺:ArCH2NH2伯胺:RNH2仲胺:R2NH叔胺:R3N是挺烦的。
因为它们也都属于非苯芳香系,结构与苯相似,存在间隔的双键,一般是五元、六元环,而且都是环上的C原子被O、S、N替换,并且单键C可以被O、S、NH替换,双键C只能被N 替换。
而且被O、S替换的物质很少,若有S,名字中就会出现噻。
所以其它的我自己是这样记的。
首先,有4个是必须记住的,就是呋喃、噻吩、吡咯、吡啶,这是最基本的结构。
1、五元环,单键C改成O、S、NH的分别叫呋喃、噻吩、吡咯。
若有C=N的叫唑,另外有O的叫恶唑,有S的叫噻唑,有NH的叫咪唑,一般间位,若相邻就叫“异”。
2、六元环,只会出现N。
1个N,叫吡啶。
2个N,或吡或啶,哒邻(darling),嘧间(蜜饯),嗪对位(请对位)。
3、稠环,有的六并五,有的六并六其中苯并呋喃、苯并噻吩好记。
最讨厌的还是含N的,但是若出现多个N原子,一般都是间位。
苯并吡咯叫吲哚苯并吡啶叫喹啉苯并喹啉叫吖啶嘧啶吡嗪成喋啶(6+6)嘧啶吡唑成嘌呤(6+5)-ch3是甲基.-CH2CH3是乙基系统命名口诀: 最长碳链作主链,主链须含杂环化合物把如何命名带官能团的有机物一、有机物:除水和一些无机盐外,生物体的组成成分几乎全是有机物,如淀粉、蔗糖、油脂、蛋白质、核酸以及各种色素。
过去误以为只有动植物(有机体)能产生有机物,故取名“有机”。
现在不仅许多天然产物可以用人工方法合成,而且可以从动植物、煤、石油、天然气等分离或改造加工制成多种工农业生产和人民生活的必需品,象塑料、合成纤维、农药、人造橡胶等。
与无机物相比,有机物的种类众多,一般挥发性较大、熔点和沸点较低,反应较慢(较复杂)。
溶于有机溶剂,且能燃烧。
碳原子可用共价键彼此连接生成多种结构,组成数量巨大的不同种类的有机分子骨架。
二、有机物命名法:IUPAC有机物命名法。
IUPAC有机物命名法是一种有系统命名有机化合物的方法。
该命名法是由国际纯粹与应用化学联合会(IUPAC)规定的,最近一次修订是在1993年。
有机化学学习笔记:第九章芳香烃

CH3 CH3
1,3-二甲苯 (m-二甲苯)
C2H5
CH 3 CHCH 3
C H
3
1,4-二甲苯 (p-二甲苯)
乙苯
异 丙 苯
B. 以苯作为取代基的命名
CHO
C H = C H 2
C H 3 C H C O O H 2 C H C = C H 3
苯 甲 醛
苯 乙 烯
苯 乙 酸
1 苯 基 2 甲 基 丙 烯
A l C l 3 C H C H C H C H 3 2 2 2
C H C H C H 2 3 C H C H C H C H 2 2 2 3 CH3 主产物 C H C H C H 2 3 C H 3
重 排
次 产 物
CH2CH2CH2CH3
A l C l 3 + F C H C H C H C l 222
各种取代基在苯环上时作为母体的优先顺序
O O O C O O HS O HC O R C N H C XC N 3 2 O O C H C R O HN H O RRXN O 2 2
O 作 为 母 体 时 称 为 “醛 ” 对 羟 基 苯 甲 醛 对 甲 酰 基 苯 甲 酸 C H 为 取 代 基 时 称 为 “甲 酰 基 ” C H O 作 C H O
O H C O O H
N O
2
对 硝 基 氯 苯
C l
O H
C H
3
C H
3
对 -氯 甲 苯
C l
N H
2
对 甲 基 苯 胺
N H
2
对 氨 基 苯 酚
C. 稠环芳烃的命名
8 7 6 5 4 1 2 3 7 6 5 1 0 4 8 9 1 2 3
卤代烷

LiAlH4 + 4H2O
LiOH + Al(OH)3 +4H2
12
CH3(CH2)6CH2X + LiAlH4
THF 250C
X T(反应时间)
Cl
24h
Br
1h
I
1h
CH3(CH2)6CH3 + AlH3 + LiX
产率 73% 99% 100%
CH3(CH2)6CH2X + NaBH4
X 反应温度
H
H
H
CH3
150
1
0.01
0.001 21
在SN2反应中,由于亲核试剂是从卤原子的背后进攻卤 代烷的-碳原子的,如果-碳的取代基增多, -碳原子周 围将变得拥挤,进攻试剂接近-碳原子的阻力增加,因此 活性也就降低。β-C上烷基数目的增加也使反应速率减慢.
不同结构的卤代烷发生SN2反应的活性顺序为:
CH3
CH3CHCH2CHCH3
CH3 BrCH2CHFCHCH2I
2-甲基-4-氯戊烷 2-甲基-3-氟-4-溴-1-碘丁烷
H CH3
H Cl
反-1-甲基-3-氯环己烷
3
CHCH2Cl CH3
2-苯基-1-氯丙烷
CH3
H
Br
Br
H
CH3
(2S,3S)-2,3-二溴丁烷
5.2 一卤代烷的结构和物理性质
(1)反应动力学:v=k[(CH3)3CBr] 一级反应 反应过程:反应分两步进行:
第一步:叔丁基溴在溶剂中首先离解成叔丁基碳正离子和溴 负离子,这是一步慢反应:
(CH3)3C-Br [(CH3)3C+ ···Br-] (CH3)3C+ + Br -
有机化学 第8章 卤代烃

CH3CH2CHCH2CH2CH3 CH2Br
2-乙基-1-溴戊烷
CH3CH2CHCH2CHCH2CH3
CH3 Cl 3-甲基-5-氯庚烷 (不叫5-甲基-3-氯庚烷)
CH3CHCH2CHCH2Cl CH3 Cl
4-甲基-1,2-二氯戊烷
CH3CH2CHCHCH2CH3 Br Cl
3-氯-4-溴己烷 (不叫3-溴-4-氯己烷)
O…C…Br三个原子在同一直线上,两者相互垂直。
❖ 过渡态后,反应继续进行,体系能量下降,最后形成一个稳 定的C—O共价键,C—Br键同时断裂,溴原子带者一对电 子离去,生成甲醇和Br-,反应完成。
❖ 3.说明 (1)中心C原子杂化态的变化:在形成过渡 态的过程中,中心C原子的杂化态就开始“改组”, 由sp3向着sp2和p轨道的方向“改组”,到过渡态 “改组”完成。反应完成后,碳原子的杂化态又恢 复到sp3杂化态。
CH3CH2CH2CH2Br + 2NH3 (大大过量)
CH3CH2CH2CH2NH2 + NH4Br 正丁胺(伯胺)
说明
❖ 1.叔卤代烷分别与上述试剂反应,发生的主 要反应则不是取代,而是消除——消除一分 子卤化氢生成烯烃。
CH3 H3C C Cl
CH3 叔丁基氯
NaOH或RONa 或NaCN或NH3
△
CH3CH2CH=CH2 + KBr + H2O(消除反应)
(浓乙醇溶液)
❖ (一)消除反应 由一个分子中脱去一些小分子,如
HX、H2O等,同时产生C=C的反应叫消除反应。
❖ (二)卤代烷分子中在β—碳原子上必须有氢原子时,
才有可能进行消除反应。
❖ (三)脱HX的能力 叔卤代烷>仲卤代烷>伯卤代 烷
有机合成中的卤代化合物

有机合成中的卤代化合物在有机合成领域中,卤代化合物是一类广泛应用的化合物。
卤代化合物是指含有卤素(氟、氯、溴、碘)原子的有机分子。
这些化合物在合成有机化合物、药物和材料等方面起着重要作用。
本文将从卤代化合物的合成方法、反应性质以及应用等方面进行探讨。
一、卤代化合物的合成方法1. 直接卤代反应直接卤代反应是最直接、简单的合成卤代化合物的方法。
它通常将有机物与卤素在适当条件下反应,生成相应的卤代产物。
例如,将溴与苯反应可以得到溴苯。
此类反应条件温和,操作简单。
2.间接卤代反应间接卤代反应是通过先将有机物转化为亲电或亲核试剂,然后再与卤素反应得到卤代产物。
这种方法在选择性、收率和操作性上有一定的优势。
例如,将醇与氯化亚砜反应可以得到氯代醚。
3. 卤化醇反应卤化醇反应指的是醇与卤素(溴、氯)反应生成卤代醇的过程。
这是一种常用的合成卤代化合物的方法,适用于不同类型的醇。
例如,将乙醇与氯气反应可以得到氯乙醇。
二、卤代化合物的反应性质1. 亲电取代反应卤代化合物具有亲电子性,容易进行亲电取代反应。
这类反应中,卤素被替换掉,取代它的官能团进入化合物中。
常见的亲电取代反应包括氢氧化、碱解、还原和取代等反应。
2. 亲核取代反应卤代化合物也可参与亲核取代反应。
在这类反应中,卤代化合物的卤素被亲核试剂所取代。
亲核试剂可以是普通的亲核离子、亲核试剂还可以是亲核试剂及普通亲核离子的中间体。
常见的亲核取代反应有芳香核取代反应、亲核加成反应等。
三、卤代化合物的应用1. 有机合成卤代化合物作为重要的中间体,在有机合成过程中发挥着至关重要的作用。
它们可以作为起始物质用于合成其他有机分子或者在反应中被进一步转化。
例如,乙烯基溴可以参与许多重要的碳碳键形成反应,用于构建分子骨架。
2. 药物研究卤代化合物在药物研究领域中具有广泛的应用。
它们可以用作药物的前体,通过后续的化学转化形成具有特定功能的药物分子。
卤代化合物的引入可以改变药物分子的生物活性、稳定性和吸收性等特性。
卤代烃定义

卤代烃定义1、定义:烃分子中的氢原子被卤素原子取代后的化合物称为卤代烃(Haloalkane),简称卤烃。
卤代烃的通式为:(Ar)R-X,X为卤素原子,可看作是卤代烃的官能团,包括氟、氯、溴、碘。
2、命名:根据取代卤素的不同,分别称为氟代烃、氯代烃、溴代烃和碘代烃;也可根据分子中卤素原子的多少分为一卤代烃、二卤代烃和多卤代烃;也可根据烃基的不同分为饱和卤代烃、不饱和卤代烃和芳香卤代烃等。
此外,还可根据与卤原子直接相连碳原子的不同,分为一级卤代烃RCH2X、二级卤代烃R2CHX和三级卤代烃R3CX。
3、物理性质:基本上与烃不相似,CH3F、CH3CH2F、CH3Cl、CH3Br在常温下是气体,余者低级为液体,高级的是固体。
它们的沸点随分子中碳原子和卤素原子数目的增加(氟代烃除外)和卤素原子序数的增大而升高。
密度随碳原子数增加而降低。
一氟代烃和一氯代烃的密度一般比水小,溴代烃、碘代烃及多卤代烃密度比水大。
绝大多数卤代烃不溶于水或在水中溶解度很小,但能溶于很多有机溶剂,有些可以直接作为溶剂使用。
卤代烃大都具有一种特殊气味,多卤代烃一般都难燃或不燃。
卤代烃的同分异构体的沸点随烃基中支链的增加而降低。
同一烃基的不同卤代烃的沸点随卤素原子的相对原子质量的增大而增大。
4、化学性质:卤代烃是一类重要的有机合成中间体,是许多有机合成的原料,它能发生许多化学反应,如取代反应、消去反应等。
卤代烷中的卤素容易被—OH、—OR、—CN、NH3或H2NR取代,生成相应的醇、醚、腈、胺等化合物。
一般反应式可写为:R─X+:Nu®-Nu+:X碘代烷最容易发生取代反应,溴代烷次之,氯代烷又次之,芳基和乙烯基卤代物由于碳-卤键连接较为牢固,很难发生类似反应。
卤代烃可以发生消去反应,在碱的作用下脱去卤化氢生成碳-碳双键或碳-碳三键,比如,溴乙烷与强碱氢氧化钾在乙醇共热的条件下,生成乙烯、溴化钾和水。
卤代烃发生消去反应时遵循查依采夫规则。
卤代芳香族化合物cas号

卤代芳香族化合物cas号卤代芳香族化合物(CAS号XXXXXX):理解其结构、特性和应用导言:卤代芳香族化合物是一类如溴代苯、氯代苯等化合物,其分子中含有芳香环并有卤素原子取代。
这些化合物在许多领域中起着重要的作用,如有机合成、医药、材料科学等。
本文将深入探讨卤代芳香族化合物的结构、特性、应用以及对环境的潜在影响。
一、卤代芳香族化合物的结构1.1 芳香环的特点芳香环是由连续的π键形成的稳定结构,具有独特的化学性质。
通过对芳香环上的氢原子进行卤素取代,可以改变化合物的性质和反应活性。
1.2 卤素原子的取代位置卤代芳香族化合物中,卤素原子可以取代芳香环上的不同位置,包括取代苯环上的不同碳原子以及取代芳香环上的多个位置。
这种取代位置的差异会影响化合物的稳定性和反应特性。
二、卤代芳香族化合物的特性2.1 物理性质卤代芳香族化合物常常呈现出较高的沸点和熔点,相对于未取代的芳香化合物,其极性也会增加。
卤素的电负性会影响化合物的极性和溶解性。
2.2 化学性质卤代芳香族化合物通常显示出较激烈的反应活性,例如发生亲电取代反应和亲核取代反应。
卤素原子的引入会导致化合物在环上发生取代反应或发生环开启反应。
三、卤代芳香族化合物的应用3.1 有机合成卤代芳香族化合物广泛用于有机合成领域。
通过卤素的引入,可以改变分子的性质和反应活性,从而实现特定官能团的引入、形成新的化学键和构建复杂的有机分子骨架。
3.2 医药应用卤代芳香族化合物在药物研发中有着重要的应用。
其特殊的化学性质赋予了这些化合物在药物分子的活性和选择性方面的独特性能。
3.3 材料科学卤代芳香族化合物可以用于合成具有特殊性能的材料,如聚合物、液晶材料等。
通过在芳香环上引入卤素原子,可以改变材料的性质和结构,从而实现对材料的优化设计。
四、对环境的潜在影响卤代芳香族化合物在某些情况下可能对环境产生负面影响。
部分卤代化合物具有持久性和生物蓄积性,可能对生态系统和人类健康造成潜在风险。
6-1苯

• 当p电子数 = 4n(n≥ 1)时,p电子除了填满成键轨道外,
还有两个在非成键轨道上,这时,环多烯烃的能量反而比 相应的直链多烯烃高。
芳香性和芳香族化合物的判据:
(1)化学性质: 难氧化、难加成、难还原、易亲电取代
(2)热力学稳定性——非常稳定,具有较高的共轭能
(3)结构上同时满足三点: a. 具有环闭的共轭体系 b.共轭体系中所有的原子共平面,平面的上下两侧有环状离 域的π电子云 C.组成π电子云的p电子数必须符合4n+2规则 结论: 当单环体系中π电子数目为4n+2时,环具有芳香性,热力学稳定性好; 当单环体系中π电子数目为4n时,环具有反芳香性,热力学稳定性差。
酮与AlCl3络合, 消耗1eqv. AlCl3
(3)烷基化反应不易停留在一元阶段,通常在反应中有多烷基苯生成。
(4)苯环上已有–NO2、-SO3H、-COOH、-COR等取代基时,烷基化反应不再 发生。
(5)烷基化试剂也可是烯烃或醇。
苯环烷基化其它方法
问题:正碳离子的产生途径还有那些?
•由烯烃
R C R C
R R H+ OH
H
+
R C R R OH2
磺化反应及苯磺酸衍生物的重要性
亲油端
NaOH C12H25 SO3H C12H25 SO3Na
• 合成苯磺酸衍生物
C12H25 H2SO4 (浓)
亲水端
合成洗涤剂
H3C H2SO4 (浓) H3C SO3H
(有机强酸,固体)
TsOH,对甲基苯磺酸
• 由磺酸转化为其它衍生物
Ar SO3H POCl3 Ar SO2Cl
与烯烃相比 较,苯环性
芳香族卤代物

sp2
+ E +
E +
sp3
H -H +
+E
sp2 E
亲电试剂
络合物
络合物
产物
卤素的邻、对位有吸电子基团时反应易进行
特别稳定
Z Cl
NO2 Z Cl
NO2
Z Cl
NO2 Z Cl
Z Cl NO2
对位吸电子
负电荷还可离域 在NO2氧原子上
Z Cl
间位吸电子
NO2
NO2
SN1和SN2取代反应中,卤代烷活性次序: R-I > R-Br > R-Cl > R-F
G为吸电子基,Nu亲核试剂进入的 位置
G为给电子基,Nu-亲核试剂进入的位置
苯炔的制备
采用邻氨基苯甲酸制备
COOH
H+
+ NH2 CH3(CH2)4O
CH2Cl2
NO
O -
CO
N
+
2
+ H2O + CH3(CH2)4OH
*对碰撞极敏感,也 极易爆炸,但在非质 子溶剂中较稳定,加 热也不发生事故。
+ CH3(CH2)4ONCO l
Cl
用邻二卤代苯与锂或镁反应制备
+ S+N1C和H3SCNH22取C代H2反CCH应2l中Li ,卤代烷活C 性l 次序:
CH CH CH CH + CH3(CH2)4ONO Cl
3222
乙醚,氮气保护 -25-35oC
Cl
L
Cl
Ci l
Cl
Li 卤代苯邻、对位连有吸电子基团时,卤原子可以在比较温和的条件下被取代
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G为给电子基,Nu-亲核试剂进入的位置
苯炔的制备
采用邻氨基苯甲酸制备
COOH
H+
+ NH2 CH3(CH2)4O
CH2Cl2
NO
O C O-
N+ 2
+ H2O + CH3(CH2)4OH
*对碰撞极敏感,也 极易爆炸,但在非质 子溶剂中较稳定,加 热也不发生事故。
+ CO2 + N2
P814
用邻二卤代苯与锂或镁反应制备
F M THF Br
F
消除
M
-MF
Cl
Cl
Cl
+
Cl
Cl
Cl
CH3CH2CH2CH2Li NhomakorabeaCl
-LiCl
Cl
25-50oC
Cl Cl
乙醚,氮气保护 -25-35oC
M=Li, Mg
Cl
Cl
L
Cl
Ci l
Cl
用苯酚的邻三甲基硅三氟甲磺酸酯与CsF反应制备
NO2 + OH-
aq. NaHCO3 35 oC
O2N
NO2
NO2
NO2
Cl + OH-
NO2
加成 slow
Cl OH NO2
消除 fast
OH + Cl-
NO2
邻、对位吸电子基团有利于负电荷离域,反应易进行, 吸电子取代基: -N(CH3)3+, -NO2, -CN, -SO3H, -COOH, -CHO, -COR, -X
(1)加成-消除机理
双分子置换反应,双分子芳香亲核取代反应SN2Ar
卤代苯邻、对位连有吸电子基团时,卤 原子可以在比较温和的条件下被取代
Cl
NO2 + OH-
aq. NaHCO3 130 oC
OH NO2
Cl
NO2 + OH-
aq. NaHCO3 100 oC
NO2
OH NO2
NO2
Cl
OH
O2N
断裂C-X键的容易程度取决于它 的强度,因此造成速率差别大
芳香族亲核取代反应中,各种卤代物间的活性差别小
(2)消除-加成机理(苯炔中间体机理) 采用强碱发生亲核取代反应
Mechanism
a. 苯炔的结构
H
H
H H
sp2轨道侧面交叠成键 位于电子云平面外
取代基对亲核取代的影响
受取代基诱导效应的影响
与芳环上的亲电取代反应相比较
sp2 + E+
sp3
sp2
H
E
E+
-H+
+
E
亲电试剂
络合物
络合物
产物
卤素的邻、对位有吸电子基团时反应易进行
特别稳定
Z Cl
NO2 Z Cl
NO2
Z Cl
NO2 Z Cl
对位吸电子
Z Cl
负电荷还可离域 在NO2氧原子上
NO2
Z Cl
间位吸电子
NO2
NO2
SN1和SN2取代反应中,卤代烷活性次序: R-I > R-Br > R-Cl > R-F
第18章 芳香族卤代物及芳香亲核取代反应
卤素直接连在芳环上的化合物
X
Y
(X = F, Cl, Br, I)
卤代芳烃与卤代烷在性质上差别很大
一、卤代芳烃的制备
1. 重氮盐法
如对溴甲苯合成:
CH3
HNO3 H2SO4
CH3 reduction
CH3 NO2 +
CH3
CH3
分馏分离
NO2
CH3
CH3
NO2
NH2
N2+X-
Br
2. 芳烃亲电取代
X + X2 Lewis acid
对于活性较大的环,只需卤素,不加催化剂
CH3
CH3
CH3 + Br2
CCl4 10 oC
Br
CH3
CH3
CH3
二、卤代芳烃的反应
1.亲电取代(邻、对位定位基)
2. 亲核取代反应 卤代苯不活泼,相对于极易发生亲核取代 反应的卤代烷,但某些情况下可以通过加 成-消除或消除-加成二种机理进行。
苯炔的反应
P815
苯炔在有机合成中的应用:see a review : H. Pellissier, M. Santelli, Tetrahedron, 2003,59,701
