蛋白质资料介绍
人教版高中化学选修五4.3 蛋白质 课件(共27张PPT)

资料
分子式:C3H6N6 含氮量:66.7%
各个品牌奶粉中蛋白质含量为15-20%, 蛋白质中含氮量平均为16%。以某合 格牛奶蛋白质含量为2.8%计算,含氮 量为0.44%,某合格奶粉蛋白质含量 为18%计算,含氮量为2.88%。而三 聚氰胺含氮量为66.7%,是牛奶的151 倍,是奶粉的23倍。每100g牛奶中添 加0.1克三聚氰胺,就能提高0.4%蛋 白质! 资料
医生在把管道插进病 人身体以便抽血液,同 时将甘油溶剂代替血液 注入到血管中去
体温被降到零下196摄氏度大约需要5天。这些冷 冻人体身上都包裹着一层锡箔,当去掉锡箔时,可 看到每具人体的体表都凝聚着一层液氮的寒霜
动物性蛋白质: 鸡、鸭、鱼、肉等 蛋白质来源
植物性蛋白质: 谷类、豆类、蔬菜、 水果、菌类等
而多数食品均为氨基酸构成不平衡,所以蛋白质 营养价值就受到影响。 如玉米中亮氨酸过高影响了异亮氨酸的利用; 小米中精氨酸过高,影响了赖氨酸的利用。 因此以植物性为主的膳食,应注意食物的合理搭 配,协调氨基酸构成比例的不平衡。 如将谷物类与豆类混食,制成黄豆玉米粉、黄豆 小米粉等,可提高蛋白质的利用率和营养价值。
资料:蛋白质的主要功能和作用
调节功能:胰岛素调节糖的代谢 催化功能:如淀粉酶、胃蛋白酶的催化作用 运输功能:如血红蛋白输送氧 传递功能:如叶绿体传递能量——光合作用 运动功能:如肌肉的运动 免疫功能:如免疫球蛋白 保护功能:如指甲、头发、蹄角等 致病功能:如病毒蛋白可致病 毒害功能:如毒蛋白
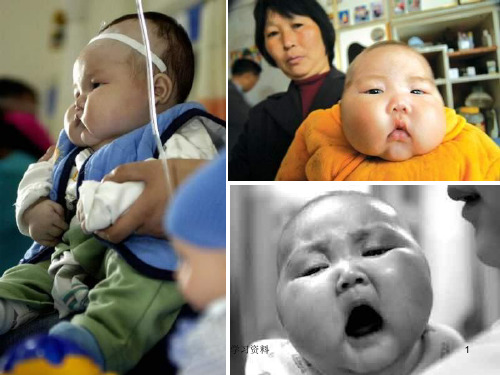
南方网讯 5月10日4个 月大的男婴刘金鹏进入 湖南儿童医院治疗,被确 诊为患有重度营养不良 症的“大头娃娃”,医 院曾一度向家属下达了 病危通知。
思考:2.氨基酸和蛋白质怎样转化? 氨基酸
蛋白质是构成一切细胞和组织结构必不可少的成分它是人资料

蛋白质蛋白质是构成一切细胞和组织结构必不可少的成分。
它是人类生命活动最重要的物质基础。
在人体细胞中,蛋白质约占1/3,成年人体内平均约含蛋白质16.3%,皮肤和骨骼肌中约占80%,胶原约占25%,血液中约占5%,其总量仅次于水分。
蛋白质由不同的氨基酸所组成,其中一部分可以由人体自己合成,称为非必需氨基酸;而另外约有八种氨基酸必需由食物供给,称为必需氨基酸。
食物中如含有齐全的必需氨基酸,而且数量又多,这种食物蛋白质营养价值就高。
如牛肉、鸡蛋、鱼、大豆等,其含完全蛋白质较丰富,所以营养价值就高。
而米面等食物所含的蛋白质为不完全蛋白质,所以营养价值就低些。
因此,饮食单调就会造成营养失调。
平时注意各种食品的搭配,就可以发挥蛋白质互补作用。
有实验表明,营养价值最高的食品是35%鸡蛋白和65%土豆蛋白的混制品。
蛋白质在人体内的主要功能是:(1) 构成酶、激素、抗体以及机体组织。
(2)促进人体生长发育。
(3)维持毛细血管渗透压。
(4)供给人体部分能量。
人体每天需要通过食物摄入一定量的蛋白质,用以常机体生长、更新、组织修补以及各种生理功能的需要。
也就是说,生命的产生、存在与消亡,无一不与蛋白质有关。
人体的神经、肌肉、血液、骨骼、甚至毛发没有一处不含蛋白质,一个几公斤重的婴儿长成为一个几十公斤重的大人,体内各种组织成分的自我更新都离不开蛋白质。
人体的新陈代谢是通过成千上万种化学反应来实现的,而这些反应都需要酶来催化,酶能在正常体温下,广泛参加人体各种各样的生命活动。
如肌肉收缩、血液循环、呼吸、消化、生长、发育和繁殖以及各种各样的思维活动。
如果没有酶的参加,生命活动就无法进行。
而这些具有各种各样特异作用的酶,和调节生理功能的一些激素一样,本身也是蛋白质。
由此可见,在生命活动中蛋白质是无处不存在的,而且具有多种多样的重要功能。
生物体一旦失去蛋白质,那么一切生命活动即将停止,生命终结。
所以说,蛋白质是生命物质。
一个人每天需要多少蛋白质,要根据年龄、性别、劳动条件和健康情况而定,并因食物来源而有所不同。
[精选]蛋白质预测--资料
![[精选]蛋白质预测--资料](https://img.taocdn.com/s3/m/9f0e75dcf90f76c660371a0f.png)
Primary structure = the linear amino acid sequence
2. 二级结构
Secondary structure = spatial arrangement of amino-acid residues that are adjacent in the primary structure
TEAVDAWTVEKAFKTFANDNGVDGAWTVEKAFKTFTVTEK
-helix
-strand
Source: Minor and Kim. 1996. Nature 380:730-734
3. 超二级结构
概念:两个或几个二级结构单元被连接多肽连接起 来,进一步组合成特殊的几何排列的局域空间结构。 (supersecondary structure,或简称motif)
三个比较特殊的氨基酸:
脯氨酸(P,Prห้องสมุดไป่ตู้):是环状的亚氨基酸,易形成顺式肽 链; 甘氨酸(G,Gly):α碳原子上有两个氢,没有侧链,不 和其它残基互作,没有位阻; 半胱氨酸(C,Cys):高度化学反应活性,易形成二硫 键。
维持和稳定蛋白质高级结构的因素:
1. 静电作用:严格服从库仑定律
2. 氢键:在二级结构形成中,十分重要 3. 范德华力:蛋白质分子巨大,此力不可忽视 4. 亲疏水性:三级结构中,至关重要 5. 配位键:例如金属蛋白 6. 二硫键:蛋白质的稳定十分有用 7. 其它因素:翻译后修饰
蛋白质预测
序列------结构------功能
Protein structure prediction: The holy grail of bioinformatics
一、蛋白质结构
蛋白质组学复习资料

蛋白质组学复习资料一、名词解释1、蛋白质组学:蛋白质组学是研究与基因对应的蛋白质组的学科,蛋白质组(proteome)一词,源于蛋白质(protein)与基因组(genome)两个词的杂合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。
2、二维(双向)电泳原理:根据蛋白质的等电点和相对分子质量的特异性将蛋白质混合物在第一个方向上按照等电点高低进行分离,在第二个方向上按照相对分子质量大小进行分离。
二维电泳分离后的蛋白质点经显色,通过图象扫描存档,最后是呈现出来的是二维方向排列的,呈漫天星状的小原点,每个点代表一个蛋白质。
3、三步纯化策略:第一步:粗提。
纯化粗样快速浓缩 (减少体积) 和稳定样品 (去除蛋白酶)最适用层析技术: 离子交换/疏水层析第二步:中度纯化。
去除大部分杂质最适用层析技术: 离子交换/疏水层析第三步:精细纯化。
达到最终纯度(去除聚合物,结构变异物)最适用层析技术:凝焦过滤/离子交换/疏水层析/反相层析4、高效纯化策略:在三步纯化蛋白质过程中,同时考虑到纯化的速度、载量、回收率及分辨率的纯化策略。
5、离子交换色谱:离子交换色谱中的固定相是一些带电荷的基团,这些带电基团通过静电相互作用与带相反电荷的离子结合。
如果流动相中存在其他带相反电荷的离子,按照质量作用定律,这些离子将与结合在固定相上的反离子进行交换。
固定相基团带正电荷的时候,其可交换离子为阴离子,这种离子交换剂为阴离子交换剂;固定相的带电基团带负电荷,可用来与流动相交换的离子就是阳离子,这种离子交换剂叫做阳离子交换剂。
阴离子交换柱的功能团主要是-NH2,及-NH3 :阳离子交换剂的功能团主要是-SO3H及-COOH。
其中-NH3 离子交换柱及-SO3H离子交换剂属于强离子交换剂,它们在很广泛的pH范围内都有离子交换能力;-NH2及-COOH 离子交换柱属于弱离子交换剂,只有在一定的pH值范围内,才能有离子交换能力。
高一生物蛋白质课件学习资料.ppt
学习资料
33
课堂小结
蛋白质
种类:约20种
基本单位:氨基酸
R
脱缩 水合
结构通式:NH2 C COOH H
多肽 蛋白质的 盘 折 分子结构 曲 叠
蛋白质的空间结构
蛋白质结 构多样性
学习资料
34
例题:
1.谷氨酸的R基团为-C3H5O2,在一个谷氨酸 分子中,碳原子和氧原子数分别是(B) A.4、4; B.5、4; C.4、5; D.5、5
6
1
5
5
6
2
4
4
n
m
n-m n-m
小结:在m条肽链中
脱去的水分子数 =肽键数=氨基酸总数- m
学习资料=氨基酸-肽链的条数 22
有关蛋白质计算
E、100个氨基酸形成的1条肽链,至少含有多少
个氨基,至少含有多少个羧基呢?
R1
R2
R3
H2N C CO HN C CO HN C COOH
H
Hale Waihona Puke HHF、100个氨基酸形成的2条肽链,至少含有多少 个氨基,至少含有多少个羧基呢?
3.一个由n个氨基酸形成的含有m条肽链的蛋白
质,氨基酸的平均分子质量为a,则蛋白质的相对
分子质量=
。
学习资料
24
有关蛋白质计算
G.蛋白质的相对分子质量=氨基酸数×氨基酸 的平均分子量-失去的水分子数×水的分子量
一个由n个氨基酸形成的含有m条肽链的蛋白质 ,氨基酸的平均分子质量为a,则蛋白质的相对 分子质量=a·n-18(n-m)。
脱水缩合
多肽
空间结构
一条多肽链盘曲折叠形 成蛋白质 (多条多肽链盘曲折叠形 成蛋白质)
2.蛋白质2

鹅膏蕈碱的化学结构
二、一级结构(Primary structure)
也称共价结构,基本结构,1°结构。
维系一级结构的主要化学键是肽键和二硫键
一级结构:多肽链的氨基酸序列(IUPAC规定) 组成蛋白质分子中的多肽链的数目,每条多肽链 的氨基酸的组成和排列顺序,以及多肽链内或链 间二硫键的数目和位置。
一、肽 、肽键和肽链
1. 肽是氨基酸的线性聚合物,因此也常称 作肽链(peptide chain)。 蛋白质是由一条或多条具有确定的氨 基酸序列的多肽链构成的大分子。 除蛋白质外,蛋白质的部分水解产物 和生物体内游离存在的一些激素和抗生素也 是多肽。 蛋白质与多肽并无严格的界线,通常 是将分子量在6000道尔顿以上的多肽称为 蛋白质。
② 还原法:
肽链C末端AA ↓硼氢化锂 α-氨基醇 ↓水解 氨基醇+aa ↓层析法 鉴别氨基醇种类
③ 羧肽酶法:
最有效,最常用的测C端残基方法
性质:羧肽酶是一种肽链外切酶,它能专一的从多肽 链的C-端逐个的水解,释放出游离AA。根据不同的反 应时间测出酶水解所释放出的氨基酸种类和数量,从 而知道蛋白质的C-末端残基顺序。
不是只能水解以Leu为N末端的肽键,只是水解以 Leu为N末端的肽键速度最大
N末端残基的氨基封闭情况:
N末端是焦谷AA残基
焦谷氨酸 不能用Edman降解法
(层析法鉴定)
测定顺序
(2)C末端测定法
① 肼解法 蛋白质or 多肽+无水肼 ↓△ 肼解 ↙ ↘ C末端aa以 其他aa转变为 游离形式存在 相应的aa酰肼化物 ↓ ↓+苯甲醛 存在于上清液中 二苯基衍生物(沉淀) ↓ DNFB、DNS、层析法。 缺点:谷氨酰胺、天冬酰胺、半胱aa破坏不易测出, C末端的Arg→鸟aa
蛋白质复习简要资料

简述凝胶层析、亲和层析、离子交换层析的原理离子交换层析原理:根据待分离物质带电性质不同的分离纯化方法。
凝胶层析原理:利用某些凝胶对于不同分子大小的组分阻滞作用的不同。
大分子物质不能进入凝胶孔内,在凝胶颗粒之间的空隙向下移动,并最先被洗脱出来;小分子物质可自由出入凝胶孔,流程长而后流出层析柱。
亲和层析原理:利用生物大分子间特异的亲和力来纯化生物大分子.体通过适当的化学反应共价的连接到载体上,待纯化的物质可被配体吸附,杂质则不被吸附,从层析柱流出,变换洗脱条件,即可将分离的物质洗脱下来,实现分离提纯简述凝胶电泳的分类及其原理?琼脂糖凝胶电泳:一般用于核酸的分离分析。
琼脂糖凝胶孔径度较大,对大部分蛋白质只有很小的分子筛效应。
聚丙烯酰胺凝胶电泳:可用于核酸和蛋白质的分离、纯化及检测。
分辨率较高。
酶合成调节的类型诱导: 组成酶:细胞固有的酶类。
诱导酶:是细胞为适应外来底物或其结构类似物而临时合成的一类酶。
阻遏:分解代谢物阻遏和反馈阻遏名词解释 1.标志酶:通常可以将只分布于细胞内某个特定组分的酶称为标志酶,可以将它作为细胞组分鉴别的依据,甚至可以判别组织或器官是否发生病变。
2.寡聚酶:由两个或两个以上的亚基组成的酶,分子量一般高于30kDa,具有四级结构。
构成寡聚酶的亚基可以相同,也可以不同,亚基之间一般以非共价键排列。
3.多酶复合体:多酶复合体由两个或两个以上的酶靠非共价键连接而成4.液体深层发酵:也称浸没式培养,它利用液体培养基,在发酵罐内进行的一种搅拌通气培养方式,发酵过程需要一定的设备和技术条件,动力消耗也较大,但是原料的利用率和酶的产量都较高,培养条件容易控制。
5.共价催化:又称亲核或亲电子催化,在催化时,亲核催化剂或亲电子催化剂分别放出电子或吸取电子并作用于底物的缺电子中心或负电子中心,迅速形成不稳定的共价配合物,降低反应的活化能,以达到加速反应的目的。
7.酶反应器:通常将用于酶进行催化反应的容器及其附属设备称为酶反应器。
有关蛋白质的文献资料

有关蛋白质的文献资料
蛋白质是一类极为复杂的含氮化合物,是构成生物体的主要成分,是构成细胞的基本物质材料,占生物体干物质重的50%。
以下是一些有关蛋白质的文献资料:
1. “The structure and function of proteins” (2016) by Robert A. Copeland. 这本书是蛋白质领域的经典著作,涵盖了蛋白质的结构、功能、折叠、反应机制等方面。
2. “Protein Structure, Function, and Bioinformatics” (2019) by Arthur M. Lesk. 这本书介绍了蛋白质的结构、功能和生物信息学,重点关注蛋白质结构预测和分子模拟。
3. “Protein Nanotechnology” (2018) by Wei Min. 这本书介绍了蛋白质纳米技术的最新进展,包括蛋白质纳米材料的制备、表征和应用。
4. “Proteins: Structure, Function, and Bioinformatics” (2016) by John E. Walker. 这本书是蛋
白质领域的入门读物,介绍了蛋白质的结构、功能、分类和生物信息学等方面。
5. “Protein Engineering” (2019) by David E.西山. 这本书介绍了蛋白质工程的基本原理和方法,包括蛋白质设计、定向进化和蛋白质改造等方面。
蛋白质的分离纯化和表征医学知识

•
蛋白质分子表面上的可解离基团,在适当的pH条下.都带有相同的
净电荷,与其周围的反离子构成稳定的双电层。
• 蛋白质溶液由于具有水化层—— 双电层两方面的稳定因素,所以作为 胶体系统是相当稳定的,如无外界因素的影响,就不致互相凝集而沉淀。
• 蛋白质溶液也和一般的胶体系统一样具有丁达尔效应、布朗运动以及 不能通过半透膜。
资料仅供参考,不当之处,请联系改正。
资料仅供参考,不当之处,请联系改正。
蛋白质有四级结构
肽链中各种氨基酸相互联接的顺序是蛋白质的初级结构, 也叫一级结构。
多肽链主链骨架中的若干肽段,通过氢键,形成有规则 的构象,这称为二级结构。
α-螺旋
β-折叠 无规线团
在二级结构的基础上,多肽链间通过氨基酸残基侧链的
资料仅供参考,不当之处,请联系改正。
一、蛋白质的酸碱性质
资料仅供参考,不当之处,请联系改正。
资料仅供参考,不当之处,请联系改正。
二、蛋白质分子的大小和空间结构
• 蛋白质分子量很大,相对分子量变化范围在6000-1000000或更大一些。 • 测定蛋白质分子量的方法: • 1.根据蛋白质化学组成测定最低相对分子量 • 2.渗透压法测定相对分子量 • 3.蛋白质的扩散和扩散系数 • 4.沉降分析法测定蛋白质相对分子量 • 5.凝胶过滤法测定相对分子量 • 6.SDS聚丙烯酰胺凝胶电泳法测定相对分子量
资料仅供参考,不当之处,请联系改正。
生物碱试剂和某些酸类沉淀法
• 生物碱试剂是指能引起生物碱沉淀的一类试剂,如骤酸 也称单宁酸苦味酸即2,4,6-三硝基酚,钨酸和碘化钾等。
• 某些酸类指的是三氯醋酸,磺基水杨酸和硝酸等。当溶 液pH小于等电点时,蛋白质颗粒带正电荷,容易与生物碱 试剂和酸类的酸根负离子发生反应生成不溶性盐而沉淀。 这类沉淀反应经常被临床检验部门用来除去体液中干扰测 定的蛋白质。
初中八年级生物复习资料之蛋白质种类

初中八年级生物复习资料之蛋白质种类初中八年级生物复习资料之蛋白质种类胶原是细胞外最重要的水不溶性纤维蛋白,是构成细胞外基质的骨架。
纤维蛋白(fibrous protein):一类主要的不溶于水的蛋白质,通常都含有呈现相同二级结构的多肽链许多纤维蛋白结合紧密,并为单个细胞或整个生物体提供机械强度,起着保护或结构上的作用。
球蛋白(globular protein):紧凑的,近似球形的,含有折叠紧密的多肽链的一类蛋白质,许多都溶于水。
典形的球蛋白含有能特异的识别其它化合物的凹陷或裂隙部位。
角蛋白(keratin):由处于α-螺旋或β-折叠构象的平行的多肽链组成不溶于水的起着保护或结构作用蛋白质。
胶原(蛋白)(collagen):是动物结缔组织最丰富的一种蛋白质,它是由原胶原蛋白分子组成。
原胶原蛋白是一种具有右手超螺旋结构的蛋白。
每个原胶原分子都是由3条特殊的左手螺旋(螺距0.95nm,每一圈含有3.3个残基)的`多肽链右手旋转形成的。
伴娘蛋白(chaperone):与一种新合成的多肽链形成复合物并协助它正确折叠成具有生物功能构向的蛋白质。
伴娘蛋白可以防止不正确折叠中间体的形成和没有组装的蛋白亚基的不正确聚集,协助多肽链跨膜转运以及大的多亚基蛋白质的组装和解体。
肌红蛋白(myoglobin):是由一条肽链和一个血红素辅基组成的结合蛋白,是肌肉内储存氧的蛋白质,它的氧饱和曲线为双曲线型。
血红蛋白(hemoglobin):是由含有血红素辅基的4个亚基组成的结合蛋白。
血红蛋白负责将氧由肺运输到外周组织,它的氧饱和曲线为S型。
蛋白质变性(denaturation):生物大分子的天然构象遭到破坏导致其生物活性丧失的现象。
蛋白质在受到光照,热,有机溶剂以及一些变性剂的作用时,次级键受到破坏,导致天然构象的破坏,使蛋白质的生物活性丧失。
复性(renaturation):在一定的条件下,变性的生物大分子恢复成具有生物活性的天然构象的现象。
蛋白质分子结构

蛋白质分子结构蛋白质结构是指蛋白质分子的空间结构。
蛋白质主要由碳、氢、氧、氮等化学元素组成,是一类重要的生物大分子,所有蛋白质都是由20种不同氨基酸连接形成的多聚体,在形成蛋白质后,这些氨基酸又被称为残基。
蛋白质和多肽之间的界限并不是很清晰,有人基于发挥功能性作用的结构域所需的残基数认为,若残基数少于40,就称之为多肽或肽。
要发挥生物学功能,蛋白质需要正确折叠为一个特定构型,主要是通过大量的非共价相互作用(如氢键,离子键,范德华力和疏水作用)来实现;此外,在一些蛋白质(特别是分泌性蛋白质)折叠中,二硫键也起到关键作用。
为了从分子水平上了解蛋白质的作用机制,常常需要测定蛋白质的三维结构。
由研究蛋白质结构而发展起来了结构生物学,采用了包括X射线晶体学、核磁共振等技术来解析蛋白质结构。
一定数量的残基对于发挥某一生物化学功能是必要的;40-50个残基通常是一个功能性结构域大小的下限。
蛋白质大小的范围可以从这样一个下限一直到数千个残基。
估计的蛋白质的平均长度在不同的物种中有所区别,一般约为200-380个残基,而真核生物的蛋白质平均长度比原核生物长约55%。
更大的蛋白质聚合体可以通过许多蛋白质亚基形成;如由数千个肌动蛋白分子聚合形成蛋白纤维。
蛋白质的分子结构可划分为四级,以描述其不同的方面:一级结构:组成蛋白质多肽链的线性氨基酸序列。
二级结构:依靠不同氨基酸之间的c=o和n-h基团间的氢键形成的稳定结构,主要为α螺旋和β折叠。
三级结构:通过多个二级结构元素在三维空间的排列所形成的一个蛋白质分子的三维结构。
四级结构:用于描述由不同多肽链(亚基)间相互作用形成具有功能的蛋白质复合物分子。
扩展资料:蛋白质的物理性质包括:1、水解性:蛋白质经水解后为氨基酸。
有的蛋白质能溶于水,如鸡蛋白,有的难溶于水,如丝、毛等。
2、盐析性:蛋白质的盐析性一般是可逆的,也就是说,蛋白质经过盐析并没有丧失生物活性。
在蛋白质溶液中加入(NH4)2SO4有沉淀生成,加入水后沉淀有消失,这就是一个盐析的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人体所需要六大营养成分是蛋白质、糖、脂肪、维生素、无机盐和水。
1、蛋白质:蛋白质是生命的基础,是人身体各个部分的主要成分。
蛋白
质是少年儿童生长发育必不可少的物质。
没有蛋白质就没有人体、就没有生命。
它的主要作用是提供肌体生长、组成和修补人体组织材料。
如果体内缺乏蛋白质,容易出现发育迟缓、智力低下、体瘦和贫血等症状。
瘦肉中蛋白质含量最多。
2、糖:是保护肝脏、维持体温恒定的必要物质。
糖类分为单糖、双糖和多糖,单糖可直接被吸收转化为热能。
如果摄入糖类过多,消耗的剩余部分就会转化为脂肪储存起来,易患肥胖、高血压、糖尿病等症。
糖类摄入过少,易患低血糖症,出现头晕、无力、出虚汗、心慌的现象。
3、脂肪:是人体内含热量最高的物质,是人体热能的主要来源,脂肪主要有四大功能:维持正常体重、保护内脏和关节、滋润皮肤和提供能量。
如果体内缺乏脂肪容易产生饥饿感,若体内脂肪过多,则会导致身体肥胖。
许多肥胖儿童多数是因为运动消耗太少,脂肪堆积过多造成的。
4、维生素:在孩子的生长发育和生理功能方面是必不可少的有机化合物质,它主要参与各种代谢过程,若体内缺乏维生素会导致代谢过程障碍、生理功能紊乱、抵抗力减弱,以及引发多种病症。
一般天然食物中就含有各种我们所需要的营养素,而且比例适宜,所以,少年儿童在合理膳食中就可以获得充足的维生素。
5、无机盐:也叫矿物质、微量元素,是组织、细胞的构成成分,也是人体代谢中的必要物质。
它能维持体内的酸碱平衡,调节和维持机体功能。
体内无机盐过多过少都会引起代谢絮乱,导致生理和功能性病变。
人在运动期间,由于大量排汗,导致盐分随汗液丢失,可以通过运动饮料补充无机盐,防肌肉痉挛,并帮助缓解身体的疲劳。
6、水:是“生命之源”。
水约占体重的70%左右,它是营养和代谢物的溶剂,如果体内水份损失20%,生命就难以维持。
参加运动的孩子要积极主动的补水。
比如,运动时最好补充运动饮料。
运动后,也要补水,但不宜集中“暴饮”,要少量多次地补。
参加运动的人,只有保持良好的水营养,才能有良好的体能和健康。
