第二节 阿片类镇痛药
阿片类性镇痛药及拮抗药

阿片类性镇痛药及拮抗药
28
3、吗啡的消除半衰期为2~3h,主要是在肝脏中分 解,60~70%与葡萄醛酸 结合,5~10%脱甲基后 形成去甲基吗啡,均由尿中排出,另有10~15% 以原形经肾脏排出,还有部分经胆道排出 (7~10%)。
阿片类性镇痛药及拮抗药
29
(三)临床应用
1、 吗啡主要用于急性疼痛患者,尤其是适用于严 重创伤、心肌梗塞、手 术疼痛成人常用剂量为 8~10mg,皮下或肌注。休克病人应采用静脉 注 射并适当减量。
是指药物的血浆浓度下降一半的时间,由于受分布容积 和清除率的 共同影响,并不能直接反映机体中药物的清 除速度。如异丙酚最初的分布半衰期为2~8分钟,消除半 衰期为1~3小时;分布半衰期和消除半衰期分别为30~70 分钟和2~24小时不等。
阿片类性镇痛药及拮抗药
43
时量相关半衰期(context sensitive Half time,T1/2CS),动态半衰期
阿片类性镇痛药及拮抗药
34
(一)fentanyl:
芬太尼是目前临床麻醉使用最普遍的阿片类药物,临床使用 的制剂是枸盐酸盐。
1、药理学特点:
镇痛作用强,芬太尼的镇痛效力是吗啡的100倍, 度冷丁的1000倍,三种药物的等效剂量为
0.1mg fentanyl =10mg morphine =100mg pethidine
独特的性能,被誉为21世纪的阿片类药物。 芬太尼是1959年合成 瑞芬太尼是1996 年合成,2001年国产化,
目前正在国内推广。 瑞芬太尼是纯μ受体激动剂,其主要特点是:
瑞芬太尼是作用效能比芬太尼强而作用时间比芬太尼短, 其作用强度是芬太尼的2~4倍,作用时间是芬太尼的1/4。
(阿片类)镇痛药

>神经性疼痛
椎管内给药产生节段性镇痛,无意识消失,对 视听觉无影响。
——与激动丘脑内侧、脑室、导水管周围灰质及脊髓胶质 区的阿片受体有关。
中枢神经系统
镇静、致欣快作用:消除紧张、焦虑和恐惧
等情绪反应 提高患者对疼痛的耐受力 安静环境下易诱导入睡,但易被唤醒 部分病人可出现欣快感(euphoria)
特点:
镇痛作用强大
反复应用易成瘾
呼吸抑制
需按《麻醉药物管理条例》严加管理
菲类:
吗啡、可待因→镇痛、镇咳
异喹啉类: 罂粟碱→ 松弛平滑肌 , 扩张血管 罂粟花与果实
吗 啡 morphine
梦神 (Morpheus )
HO
O HO
基本骨架:氢化菲核
N-CH3
体 内 过 程
口服吸收快,首关消除显著,生物利用度低,常注射 给药。 脂溶性低,少量通过血脑屏障,但足以发挥药理作用
血浆蛋白结合率低(约35%)
主要在肝脏代谢,大部分自肾排出T1/2=2.5~3.5h
代谢产物吗啡-6-葡糖醛酸具更强药理活性,t1/2更长
可通过胎盘,也可经乳汁分泌
药
理
作
用
中枢神经系统
平滑肌 心血管系统
免疫系统
中枢神经系统
镇痛:对各种躯体内脏疼痛均有效
对持续性钝痛的效果>间断性锐痛
受体:μ、δ、κ、σ
孤啡肽(FQ) —— 孤儿阿片受体
结构相似、但功能特性不同,与经典阿片受体结合力 很弱
阿 片 受 体 ( 、 、 、 …)
阿片受体的分布:
脊髓胶质区、丘脑内侧、脑室及导水管周围灰质
——与疼痛有关
阿片类镇痛药

(一)药理作用
曲马多
• 曲马多可与阿片受体结合,但其亲和力很
弱。
• 曲马多主要是克制神经元突触对去甲肾上
腺素旳再摄取,并增长神经元外5-羟色胺
浓度,从而影响痛觉传递而产生镇痛作用 。
(一)药理作用
曲马多
• 此药旳镇痛强度约为吗啡旳1/10。大剂量
可引起呼吸频率减慢,但程度较吗啡轻。
• 对心血管系统基本无影响。不引起缩瞳,也
• 目前临床上应用旳阿片受体拮抗药,主要
是纳洛酮,还有纳曲酮和纳美芬。
纳洛酮
• 该药拮抗麻醉性镇痛药旳强度大,拮抗谱广
静脉注射后 2~3min即产生最大效应,作用 连续时间约 45min;肌内注射10min产生最大 效应,作用连续时间约2.5~3h。
• 此药旳亲脂性很强,约为吗啡旳30倍,易于
透过血-脑脊液屏障,静脉注射后脑内药物 浓度可达血浆中浓度旳 4.6倍,而吗啡脑内 浓度仅为血浆中浓度旳 1/10。
吗啡因为对迷走神经旳兴奋作用和 对平滑肌旳直接作用,增长胃肠道平滑肌 和括约肌旳张力,减弱消化道旳推动性蠕 动,从而可引起便秘。吗啡可增长胆道平 滑肌张力,使奥狄括约肌收缩,造成胆道 内压力增长。
药理作用
吗啡
5.对泌尿系统作用
吗啡可增长输尿管平滑肌张力,并使膀胱 括约肌处于收缩状态从而引起尿储留。动 物试验中,吗啡可增长下丘脑一垂体系统 释放抗利尿激素(ADH),使尿量降低。
脉注射后5~10min呼吸频率减慢至最大程度,
连续约10min后逐渐恢复。剂量较大时潮气
量也降低,甚至呼吸停止.
药理作用
芬太尼
• 对心血管系统旳影响:不克制心肌收缩力,
一般不影响血压。芬太尼和舒芬太尼可引起 心动过缓。
第13章 镇痛药(药理学人民卫生出版社第8版)

第一节 阿片类镇痛药
一、阿片生物碱类镇痛药
阿片是罂粟科植物罂粟未成熟蒴果浆汁干燥物,含有20多种 生物碱。包括菲类的吗啡、可待因,异喹啉类的罂粟碱等。 • 菲类:吗啡和可待因,是主要镇痛成分。 • 异喹啉类:罂粟碱,无镇痛作用,有松弛平滑肌、 舒张血管
的作用。
123
• 阿片在16世纪已被广泛应用于镇痛、止泻、止咳、解除焦虑和 催眠。由于疗效显著,有“天赐良药”的美名。
3 耐受性和依赖性
机体对药物产生的适应性改变,一旦 停药产生难以忍受的不适感,如兴奋、
耐受性:长期用药(2-3周失腹)眠泻流后、泪甚,、至流虚C涕脱N、、S出意对汗识药、丧震失颤等、—呕—吐戒、
断症状(withdrawal syndrome)。
物敏感性降低,需要增加剂量达到原来的药效。
依赖性
身体依赖性(physical dependence)
吗啡类药物与阿片受体(μ) 结合,模拟内阿片肽样作用(1)
P PP
P
吗啡类药物与阿片受体(μ) 结合,模拟内阿片肽样作用(2)
P PP
P
EE E
阿片受体
阿片类药物作用的细胞和分子机制
内源性阿片肽 阿片类镇痛药
产生镇痛作用
激动阿片受体
Gi 抑制AC 促进K+外流 减少Ca2+内流
123
减弱或阻滞痛觉 信号传递
• 1803年首先从阿片中提取得到阿片生物碱吗啡纯品。
Papaver somniferum 罂粟
The word “morphine” came from Morpheus, the Greek god of dreams.
The beautiful, useful but “terrible” flower
第15章 阿片类镇痛药

吗啡药理作用—中枢作用
(5)催吐:
兴奋延脑催吐化学感受区(CTZ)引起恶 心和呕吐。
1.生理情况下对阿片受体不引起效应
2.能快速对抗阿片类药物过量中毒所致的呼 吸抑制和血压下降等 3.对各种应激状态下内源性阿片系统激活所 产生的休克、呼吸抑制、循环衰竭等系列症 状有明显对抗作用
作用于中枢神经系统,选择性抑制或消除痛 觉。减轻由疼痛引起的紧张、焦虑等情绪,不影 响意识。镇痛作用强大,反复用易成瘾。 2.解热镇痛抗炎药(非甾体抗炎药)
抑制体内PG的生物合成,镇痛作用较弱,同时 兼有解热、抗炎作用。用于各种钝痛,无成瘾性。
罂粟
鸦片
吗啡
可待因
海洛因
冰毒
摇头丸
大麻
镇痛药(analgesics)
4.支气管哮喘、肺心病、颅脑损伤者禁用
芬太尼
• 为强效镇痛药,镇痛效力是吗啡的80倍。
• 起效快,持续时间短。
• 镇痛剂量时对呼吸抑作用轻,成瘾性小。
• 与氟哌利多合用产生“神经阻滞镇痛”效果 ,适用于某些小手术或医疗检查。
• 可用于各种剧痛。
美沙酮
• • •
镇痛效价强度与吗啡相同,但耐受性 和成瘾性发生缓慢,停药后戒断症状轻。 广泛用于吗啡或海洛因成瘾者的脱毒 治疗。 适用于创伤、术后、晚期癌痛及多种 原因引起的剧烈疼痛。
第15章
阿片类镇痛药
概述
疼痛是一种复杂的主观感觉,是机体受到伤害
阿片类镇痛药

第二节阿片类镇痛药之阳早格格创做一、效率体造阿片类镇痛药又称麻醒性镇痛药( narcotic analgesics ),是一类能与消或者减少痛痛并改变对于痛痛情绪反应的药物.除少量效率强的药物以中,此类药物若使用不当多具备成瘾性,但是用于调理脚段本去不会戴去太大问题.钻研隐现缓性痛痛患者少暂采与阿片类药物治疗时,成瘾的爆收率极矮.表附录12 阿片受体激动后的效率阿片类药物的镇痛效率体造是多仄里的:中周神经有阿片受体;阿片药物可与位于脊髓背角胶状量(第二层)感觉神经元上的阿片受体分离,压造 P 物量的释搁,进而遏止痛痛传进脑内;阿片物量也可效率于大脑战脑搞的痛痛中枢,收挥下止痛痛压造效率.二、阿片类药物的分类阿片类药物有多种分类要领:1. 按化教结构:分为吗啡类战同喹啉类,前者即天然的阿片死物碱(如吗啡、可待果) , 后者主假如罂粟碱,有仄滑肌紧张效率.表附录13 强阿片类药物简表表附录14 强阿片类药物简表2. 按根源该类药物可分为天然阿片类、半合成衍死物 ( 如单氢可待果,二乙酰吗啡 ) 战合成的阿片类镇痛药.合成药物又分为四类:①苯丙吗啡烷类 (phenylpiperidinederivatives) ,如哌替啶、芬太僧等;②吗啡喃类(morphinenans) ,如左吗喃;③苯同吗啡烷类(bengmorphans) ,如喷他佐辛;④二苯甲烷类(diphenylmethanes) ,如好集酮.3. 按受体典型可分为μ、κ、δ受体,该三种受体的分子结构已被决定,并被乐成克隆.从功能上还大概存留ε战δ受体,并大概进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 战δ 1 、δ 2 等亚型.表 32 为受体激动后的药理效率.4. 按药理效率分,阿片类镇痛药又可分为激动药 ( 吗啡、芬太僧、哌替啶等 ) ,激动一拮抗药 ( 喷他佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)战拮抗药 (纳洛酮等) .激动—拮抗药又称部分激动药,主要激动κ受体,对于δ受体也有一定激动效率,而对于μ受体则有分歧程度的拮抗效率.由于对于受体效率分歧,那类药物通过κ受体爆收镇痛战呼吸压造效率,有“天花板”效力,很少爆收依好性;通过σ 受体爆收粗神效率战幻觉.根据激动—拮抗程度分歧,纳布啡战布托啡诺主要用做镇痛药,而另一些药如烯丙吗啡主要用做拮抗药.正在临床应用中,已应用杂激动药治疗的患者不克不迭换用混同激动一拮抗药或者部分激动药,可则大概引导戒断反应,而用混同激动—拮抗药或者部分激动药举止治疗的患者可较仄安天换用杂阿片激动药,不会爆收戒断反应.5. 根据阿片类药的镇痛强度,临床分为强阿片药(表附录13) 战强阿片药(表附录14) .强阿片药如可待果、单氢可待果,强阿片药包罗吗啡、芬太僧、哌替啶、舒芬太僧战雷米芬太僧.强阿片药主要用于沉至中度慢缓性痛痛战癌痛的治疗,强阿片类则用于齐身麻醒诱导战保护的辅帮用药以及术后镇痛战中至沉度癌痛、缓性痛的治疗.表附录15 时常使用阿片类药的效率强度战药代教参数表附录1-6 阿片类药物剂量换算表阿片类药的效率强度战药代教本量分歧 ( 表附录15) .表附录16 为临床时常使用的阿片类药物剂量换算表.三、阿片类药物的临床给药道路战要领阿片类药物是暂时已创造镇痛效率最强的药物,而且不“天花板”效力,镇痛效率随剂量的减少而巩固,果此本去不存留所谓最大或者最好剂量.对于个体患者而止,最好剂量由镇痛效率与可耐受不良反应之间的仄稳决断,若判决患者对于阿片类药物仅部分敏感 ( 如部分神经病理性痛痛 ) ,则不该再减少剂量.果此,正在赢得镇痛效率的共时处理阿片类相闭不良反应具备要害意思.( 一 ) 临床药理脂溶性、离子化程度战蛋黑分离率正在决断起效时间、峰时间战效率时间上起主要效率.脂溶性下、分子量小的药物有较下的死物膜渗透性.非离子化药物的脂溶性比离子化药物大 1000 ~ 10000 倍,故非离子化药物的比率愈下,可被弥集进中枢神经系统的药物愈多,起效愈快.蛋黑分离力效率药物的再分集是果为惟有已被分离的药物可弥集透过死物膜,蛋黑分离率下,可用做补偿血浓度落矮的储备量也较多.( 二 ) 终终半衰期直交随分集容积变更并与扫除率相闭.分集容积大,排除半衰期延少,扫除率减少,则排除半衰期支缩.故芬太僧虽扫除率下,但是分集容积大,半衰期仍少.除雷米芬太僧主要由黑细胞战骨骼肌中的非特同性酯酶代开中,其余阿片类药物的代开主要正在肝净中举止,与肝血流相闭.( 三 ) 给药道路无创给药 ( 心服、经皮等 ) 是治疗缓性痛痛、癌痛的尾选给药办法,对于无创要领给药无效以及脚术战脚术后镇痛的患者则采用持绝或者单次静脉给药、持绝或者单次硬膜中给药,也不妨用持绝皮下给药或者临时性肌注给药.为预防或者缩小中周阿片受体激动引导的不良反应,集结收挥中枢镇痛效率,新的给药道路正正在夸大应用.包罗经心腔粘膜、鼻腔粘膜、眼结膜给药等.1) 经心腔粘膜吸支芬太僧 (oral transmucosal fentanyl) 将枸橼酸芬太僧搞成糖块,患者含服时,芬太僧经心腔战食管粘膜吸支直交加进血液循环,仅小部分随唾液加进胃肠,使与胃肠讲阿片受体分离的药物明隐缩小,也落矮了恶心、呕吐战便秘的爆收率.此种给药办法已乐成用于癌痛的突收性痛痛治疗、小女术前用药战小女诊疗性支配.经鼻粘膜战经眼结膜给药共样有预防肝净尾过效力战缩小阿片受体与胃肠讲阿片受体分离的便宜,暂时主要用芬太僧 ( 滴鼻 ) 战舒芬太僧.2) 经皮给药芬太僧脂溶性下,分子量小,镇痛效率强,无局部刺激战皮肤代开,死物利用度下.芬太僧透皮揭剂( 多瑞凶 ) 揭于皮肤后 12 ~ 24h ,血药浓度渐降至稳态并保护 72h .便秘爆收率近矮于心服给药是其主要便宜.该药已广大用于癌痛 ( 提供前提镇痛 ) 战缓性痛痛治疗.3) 患者自控镇痛 (PCA) PCA 是患者感觉痛痛时按压 PCA 开用键,由镇痛泵背体内自动注射设定剂量药物的要领.其特性是医师树立背荷剂量 ( 尽量达到治疗窗浓度 ) 、持绝给药量 ( 保护前提镇痛 ) 、冲打量 ( 统造突收痛或者动做前提镇痛不脚的补充 ) 战锁定时间 ( 预防冲打量尚已收挥效率,患者反复按压开用键引导药物蓄积 ) ,患者按镇痛所需调控镇痛药的注射时机战剂量,是符合于分歧患者、分歧痛痛时间战强度的个体化给药要领,也是国际上通用的术后镇痛给药要领.PCA 分为静脉 PCA(PCIA) 、硬膜中 PCA(PCEA) 、皮下PCA(PCSA) 战中周神经阻滞 PCA(PCNA) .PCIA 采与的主要镇痛药为阿片类药 ( 吗啡、芬太僧、舒芬太僧、阿芬太僧、瑞芬太僧 ) 或者直马多,为预防阿片类药物的恶心、呕吐等不良反应,常加用胃复安、天塞米紧、 5 — H T 、受体拮抗药或者小剂量氟哌啶 (5mg / d 以下 ) ,也可复合非甾体抗炎药以缩小阿片类药物的用量.PCEA 则常采与矮浓度罗哌卡果、布比卡果或者利多卡果等局麻药复合芬太僧、舒芬太僧、吗啡等药物.可加用小剂量可乐定,与局麻药战阿片类药物均有协共效率.( 四 ) 副效率阿片类药的副效率本量是阿片的受体效力.可分为短时间耐受战万古间耐受二大类.镇定、意识朦胧 ( 包罗幻觉 ) 、嗜睡、恶心、呕吐、瘙痒及尿潴留皆是短促反应,数天或者 1 — 2 周后那些症状可消得.最顽固战少期的副效率是便秘,睹于所有强、强阿片类药.耐受性战躯体依好性也是少暂用药后的副效率.阿片耐受性爆收缓缓,各别病人大概果基果突变引导对于吗啡耐受.躯体依好表示为突然停药时出现戒断症状,可通过渐渐减量去预防那种局里.。
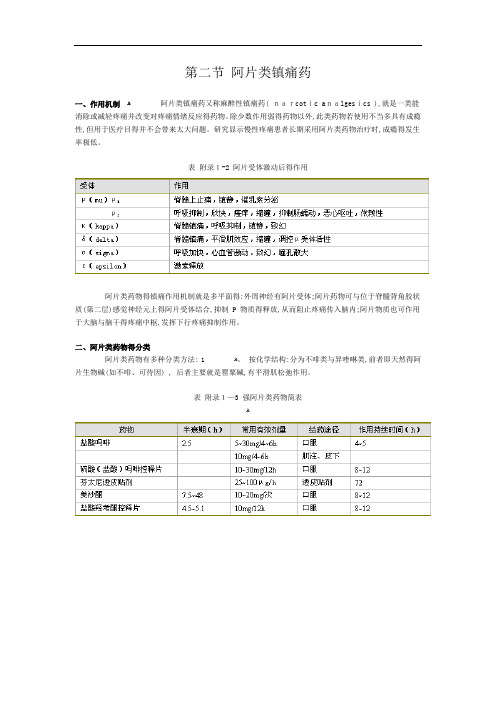
第二节 阿片类镇痛药

第二节阿片类镇痛药一、作用机制阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),就是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低。
表附录1-2 阿片受体激动后的作用阿片类药物的镇痛作用机制就是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制 P 物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑与脑干的疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物的分类阿片类药物有多种分类方法:1、按化学结构:分为不啡类与异喹啉类,前者即天然的阿片生物碱(如不啡、可待因) , 后者主要就是罂粟碱,有平滑肌松弛作用。
表附录1-3 强阿片类药物简表表附录1-4 弱阿片类药物简表2、按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰不啡 ) 与合成的阿片类镇痛药。
合成药物又分为四类:①苯丙不啡烷类 (phenylpiperidine derivatives) ,如哌替啶、芬太尼等;②不啡喃类 (morphinenans) ,如左不喃;③苯异不啡烷类 (bengmorphans) ,如喷她佐辛;④二苯甲烷类 (diphenylmethanes) ,如美散酮。
3、按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆。
从功能上还可能存在ε与δ受体,并可能进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 与δ 1 、δ 2 等亚型。
表 3-2 为受体激动后的药理作用。
4、按药理作用分,阿片类镇痛药又可分为激动药 ( 不啡、芬太尼、哌替啶等 ) ,激动一拮抗药( 喷她佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)与拮抗药 (纳洛酮等) 。
激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度的拮抗作用。
第二节 阿片类镇痛药
第二节阿片类镇痛药一、作用机制ﻫ阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),就是一类能消除或减轻疼痛并改变对疼痛情绪反应得药物。
除少数作用弱得药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目得并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾得发生率极低。
表附录1-2 阿片受体激动后得作用阿片类药物得镇痛作用机制就是多平面得:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上得阿片受体结合,抑制 P 物质得释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑与脑干得疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物得分类1。
按化学结构:分为不啡类与异喹啉类,前者即天然得阿阿片类药物有多种分类方法: ﻫ片生物碱(如不啡、可待因) , 后者主要就是罂粟碱,有平滑肌松弛作用。
表附录1—3 强阿片类药物简表ﻫ表附录1-4 弱阿片类药物简表ﻫ2。
按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰不啡) 与合成得阿片类镇痛药。
合成药物又分为四类:①苯丙不啡烷类 (phenylpiperidinederivatives) ,如哌替啶、芬太尼等;②不啡喃类 (morphinenans) ,如左不喃;③苯异不啡烷类 (bengmorphans) ,如3。
按受体类型可分为μ、κ、喷她佐辛;④二苯甲烷类(diphenylmethanes) ,如美散酮。
ﻫδ受体,该三种受体得分子结构已被确定,并被成功克隆、从功能上还可能存在ε与δ受体,并可能进一步分为μ 1、μ 2 、κ 1 、κ 2 、κ 3与δ 1 、δ 2等亚型。
表 3-2 为受体激动后得药理作用。
4. 按药理作用分,阿片类镇痛药又可分为激动药 ( 不啡、芬太尼、哌替啶等) ,激动一拮抗药( 喷她佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)与拮抗药 (纳洛酮等) 。
ﻫ激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度得拮抗作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节阿片类镇痛药
一、作用机制
阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低。
表附录1-2 阿片受体激动后的作用
阿片类药物的镇痛作用机制是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制 P 物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑和脑干的疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物的分类
阿片类药物有多种分类方法:
1. 按化学结构:分为吗啡类和异喹啉类,前者即天然的阿片生物碱(如吗啡、可待因) , 后者主要是罂粟碱,有平滑肌松弛作用。
表附录1-3 强阿片类药物简表
表附录1-4 弱阿片类药物简表
2. 按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰吗啡 ) 和合成的阿片类镇痛药。
合成药物又分为四类:①苯丙吗啡烷类 (phenylpiperidine derivatives) ,如哌替啶、芬太尼等;②吗啡喃类 (morphinenans) ,如左吗喃;③苯异吗啡烷类 (bengmorphans) ,如喷他佐辛;
④二苯甲烷类 (diphenylmethanes) ,如美散酮。
3. 按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆。
从功能上还可能存在ε和δ受体,并可能进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 和δ 1 、δ 2 等亚型。
表 3-2 为受体激动后的药理作用。
4. 按药理作用分,阿片类镇痛药又可分为激动药 ( 吗啡、芬太尼、哌替啶等 ) ,激动一拮抗药( 喷他佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)和拮抗药 (纳洛酮等) 。
激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度的拮抗作用。
由于对受体作用不同,这类药物通过κ受体产生镇痛和呼吸抑制作用,有“天花板”效应,很少产生依赖性;通过σ 受体产生精神作用和幻觉。
根据激动—拮抗程度不同,纳布啡和布托啡诺主要用作镇痛药,而另一些药如烯丙吗啡主要用作拮抗药。
在临床应用中,已应用纯激动药治疗的患者不能换用混合激动一拮抗药或部分激动药,否则可能导致戒断反应,而用混合激动—拮抗药或部分激动药进行治疗的患者可较安全地换用纯阿片激动药,不会产生戒断反应。
5. 根据阿片类药的镇痛强度,临床分为强阿片药(表附录1-3) 和弱阿片药(表附录1-4) 。
弱阿片药如可待因、双氢可待因,强阿片药包括吗啡、芬太尼、哌替啶、舒芬太尼和雷米芬太尼。
弱阿片药主要用于轻至中度急慢性疼痛和癌痛的治疗,强阿片类则用于全身麻醉诱导和维持的辅助用药以及术后镇痛和中至重度癌痛、慢性痛的治疗。
表附录1-5 常用阿片类药的作用强度和药代学参数
表附录1-6 阿片类药物剂量换算表
阿片类药的作用强度和药代学性质不同 ( 表附录1-5) 。
表附录1-6 为临床常用的阿片类药物剂量换算表。
三、阿片类药物的临床给药途径和方法
阿片类药物是目前已发现镇痛作用最强的药物,并且没有“天花板”效应,镇痛作用随剂量的增加而增强,因此并不存在所谓最大或最佳剂量。
对个体患者而言,最佳剂量由镇痛作用与可耐受不良反应之间的平衡决定,若判定患者对阿片类药物仅部分敏感 ( 如部分神经病理性疼痛 ) ,则不应再增加剂量。
因此,在获得镇痛作用的同时处理阿片类相关不良反应具有重要意义。
( 一 ) 临床药理
脂溶性、离子化程度和蛋白结合率在决定起效时间、峰时间和作用时间上起主要作用。
脂溶性高、分子量小的药物有较高的生物膜渗透性。
非离子化药物的脂溶性比离子化药物大 1000 ~ 10000 倍,故非离子化药物的比率愈高,可被弥散入中枢神经系统的药物愈多,起效愈快。
蛋白结合力影响药物的再分布是因为只有未被结合的药物可弥散透过生物膜,蛋白结合率高,可用作补偿血浓度降低的储备量也较多。
( 二 ) 终末半衰期
直接随分布容积变化并与清除率相关。
分布容积大,排除半衰期延长,清除率增加,则排除半衰期缩短。
故芬太尼虽清除率高,但分布容积大,半衰期仍长。
除雷米芬太尼主要由红细胞和骨骼肌中的非特异性酯酶代谢外,其余阿片类药物的代谢主要在肝脏中进行,与肝血流相关。
( 三 ) 给药途径
无创给药 ( 口服、经皮等 ) 是治疗慢性疼痛、癌痛的首选给药方式,对无创方法给药无效以及
手术和手术后镇痛的患者则选择持续或单次静脉给药、持续或单次硬膜外给药,也可以用持续皮下给药或临时性肌注给药。
为避免或减少外周阿片受体激动导致的不良反应,集中发挥中枢镇痛作用,新的给药途径正在扩大应用。
包括经口腔粘膜、鼻腔粘膜、眼结膜给药等。
1) 经口腔粘膜吸收芬太尼 (oral transmucosal fentanyl) 将枸橼酸芬太尼做成糖块,患者含服时,芬太尼经口腔和食管粘膜吸收直接进入血液循环,仅小部分随唾液进入胃肠,使与胃肠道阿片受体结合的药物明显减少,也降低了恶心、呕吐和便秘的发生率。
此种给药方式已成功用于癌痛的突发性疼痛治疗、小儿术前用药和小儿诊断性操作。
经鼻粘膜和经眼结膜给药同样有避免肝脏首过效应和减少阿片受体与胃肠道阿片受体结合的优点,目前主要用芬太尼 ( 滴鼻 ) 和舒芬太尼。
2) 经皮给药芬太尼脂溶性高,分子量小,镇痛作用强,无局部刺激和皮肤代谢,生物利用度高。
芬太尼透皮贴剂 ( 多瑞吉 ) 贴于皮肤后 12 ~ 24h ,血药浓度渐升至稳态并维持 72h 。
便秘发生率远低于口服给药是其主要优点。
该药已广泛用于癌痛 ( 提供基础镇痛 ) 和慢性疼痛治疗。
3) 患者自控镇痛 (PCA) PCA 是患者感觉疼痛时按压 PCA 启动键,由镇痛泵向体内自动注射设定剂量药物的方法。
其特点是医师设置负荷剂量 ( 尽快达到治疗窗浓度 ) 、持续给药量 ( 维持基础镇
痛 ) 、冲击量 ( 控制突发痛或作为基础镇痛不足的补充 ) 和锁定时间 ( 避免冲击量尚未发挥作用,患者反复按压启动键导致药物蓄积 ) ,患者按镇痛所需调控镇痛药的注射时机和剂量,是适合于不同患者、不同疼痛时间和强度的个体化给药方法,也是国际上通用的术后镇痛给药方法。
PCA 分为静脉 PCA(PCIA) 、硬膜外 PCA(PCEA) 、皮下 PCA(PCSA) 和外周神经阻滞 PCA(PCNA) 。
PCIA 采用的主要镇痛药为阿片类药 ( 吗啡、芬太尼、舒芬太尼、阿芬太尼、瑞芬太尼 ) 或曲马多,为防止阿片类药物的恶心、呕吐等不良反应,常加用胃复安、地塞米松、 5 — H T 、受体拮抗药或小剂量氟哌啶 (5mg / d 以下 ) ,也可复合非甾体抗炎药以减少阿片类药物的用量。
PCEA 则常采用低浓度罗哌卡因、布比卡因或利多卡因等局麻药复合芬太尼、舒芬太尼、吗啡等药物。
可加用小剂量可乐定,与局麻药和阿片类药物均有协同作用。
( 四 ) 副作用
阿片类药的副作用实际是阿片的受体效应。
可分为短时间耐受和长时间耐受两大类。
镇静、意识模糊 ( 包括幻觉 ) 、嗜睡、恶心、呕吐、瘙痒及尿潴留都是短暂反应,数天或 1 — 2 周后这些症状可消失。
最顽固和持久的副作用是便秘,见于所有强、弱阿片类药。
耐受性和躯体依赖性也是长期用药后的副作用。
阿片耐受性发生缓慢,个别病人可能因基因突变导致对吗啡耐受。
躯体依赖表现为突然停药时出现戒断症状,可通过逐渐减量来避免这种现象。
