抗菌药物敏感性试验的技术要求
抗菌药物敏感性试验

抗菌药物对倍稀释
1
移液素
抗 生
管
14
另设测试菌生长对照管一支不含药物。将已调节好的待测菌悬液 1mL加入各含药管内,使每mL含细菌约5×105CFU/mL。各试管置 35℃孵育16~24h后观察结果。质控菌对照按上述操作平行进行。
结果报告:MIC的测定(mg/L) ➢ MIC小于或等于敏感解释标准:敏感S ➢ MIC大于或等于敏感解释标准:耐药R ➢ MIC在敏感和耐药解释标准之间:中介I
3
一、实验目的:
1.掌握纸片扩散法药物敏感试验(K-B法)的原理、方法、结果判读。 2.了解K-B法的质量控制。 3.熟悉肉汤稀释法药物敏感性试验的原理、操作方法、结果判读和临
床意义。
4
二、试验器材:
1.菌种:大肠埃希菌18-24h培养物。 2.MH平板、 MH肉汤。 3.药敏纸片、环丙沙星、无菌生理盐水、无菌棉签、刻度尺、
0.5麦氏比浊管、镊子、天平、无菌试管、无菌吸头等。
5
(一)纸片琼脂扩散法(disk diffusion method)
将含有定量抗菌药物的纸片贴在已接种测试菌的琼脂平 板上,药敏纸片中的药物吸收琼脂中的水分溶解后不断向纸片 周围扩散形成递减的梯度浓度,药物形成类似于同心圆的等浓 度圈,当某一圈的药物浓度恰好刚刚能抑制细菌生长时,细菌 仅能在此圈外面生长而形成药敏纸片的抑菌圈。抑菌圈的大小 反应细菌对药物的敏感度,抑菌圈越大越敏感。
15
杆菌肽耐药
16
实验结果:
左起第四管为药物最低浓度而无细菌生长,即待检菌的MIC
17
临床微生物学及检验
医学检验学院 病原生物学教研室
9
4. 孵育:放于35℃孵箱中,通常于16-18h后,测量抑菌环直径。
抗菌药物敏感性试

• 在贴条过程中, 90mm 平皿只能贴 2 条,同时不同的试纸条高浓度 的一段应该向背;若贴 2 条含有酶抑制剂的试条应将含有酶抑制剂的 一端贴在同一侧。 • 贴条注意事项:试条事先恢复室温: 10 分钟左右。 • 试条的数量与角度: 4-6 条、 1-2 条。 • 贴条的时间:平皿多余水分已经消失。 • 试条的方向:高浓度端向外。 • 贴条的动作:平稳、流畅、不拖拉。 • 气泡的处理:尽量向一端赶。 • 3.孵育同 K-B 法 • 注意孵育时间、环境温度及酸碱度。 • 读数原则:杀菌剂读清晰的边缘见图 1 ,抑菌剂读大菌落与小菌落的 交界见图 2 。变形杆菌读最小的 MIC 值,后两张为含酶抑制剂抗生 素的测试结果。
抗菌药物敏感性试验规范化 卫生部北京医院 艾效曼
•
学习目标 1 、了解抗菌药物敏感性试验的意义、我国抗菌药物敏感性试验应遵循的规 则。 2 、掌握纸片扩散法和 E 试验原理,牢记试验的操作步骤及各步骤中的注意 事项,在日常工作中进行规范化的操作。
• • • • • •
抗菌药物敏感性试验的意义是什么?我国抗菌药物敏感性试验应遵循哪些规 则? 一、基本内容 药敏试验的意义: (一) 药敏试验的意义: 1.查出耐药,减少治疗错误,便于医生选择个体化疗方案、节省费用。 2. 进行 耐药监测 ,为医院感染控制部门提供防治依据,为经验用药提供可靠 依据。 3.利用耐药监测结果控制抗菌药物应用,减少耐药菌株的出现,延长新药使 用寿命。 4. 为新药的研究和评估提供有价值的信息。 )、药物敏感试验规则 (二)、药物敏感试验规则
• • • •
• • • •
目前世界上通用的规则是德国和欧洲标准,而我国主要以临床试验室标准化 委员会( CLSI ),即美国国家实验室标准委员会 (NCCLS) 的规则为标准, 这个标准主要包括 CLSI 纸片扩散法( M2 )和需氧菌稀释法( M7 )。 )、抗菌药物敏感性试验结果参照标准 (三)、抗菌药物敏感性试验结果参照标准 1.标准的正确使用 M100 – 即新表 M100-S17 ,每年更新 1 次;包括 M2 和 M7 文件, M2 – 即 纸片扩散法 (DD) 文件 M2-A9 , M7 – 即 MIC 文件 M7-A7 。 M2 、 M7 文 件每 3 年更新一次 ;使用文件时应注意文件是否已更新,避免使用旧文件造 成判断结果失误。 2.获得文件的方法 如果购买厂家的纸片可向厂家索取标准,每年国际化会议也会颁发此文件的 中心内容。 表内容: (四)、 CLSIM-100 表内容: CLSIM-100 表主要包括版本中的更新要点、各版本抗菌药物分组、 M2 纸片 扩散法用的表、 M7 MIC 用的表、 M7 MIC 用的表及词汇表等内容。
药物敏感试验

药物敏感试验96孔板法1.适用范围本实验通过检测细菌对抗菌药物的敏感性,筛选最有疗效的药物。
2.仪器设备50ml容量瓶、10ml移液管、橡胶吸头、细菌瓶、96孔板、广口瓶、高速蜗旋仪、高速离心机、分析天枰、恒温振荡器(室温至60℃,30-50转/分钟)、恒温培养箱(室温到70℃)、培养皿、微量移液器(1000μl、100μl、10μl)、八排微量移液器(100μl)、及其配套枪头、OD值测量仪、微型振荡器。
3.试剂液体培养基(MH肉汤、LB培养基)、磷酸缓冲液、灭菌蒸馏水、灭菌去离子水、0.1mol/L HCL。
4.实验材料15%金霉素、10%抗敌素、相关各地区致病菌液。
5.试剂的配置(1)MH肉汤MH肉汤21.0g蒸馏水1000ml(2)LB培养基蛋白胨10g酵母浸粉5g氯化钠5g蒸馏水1000ml(3)磷酸缓冲液Nacl 80gKcl 2gNa2H PO4`12 29gK2HPO4 2g去离子水1000ml用磷酸缓冲液(磷酸缓冲液:水=9:1)调节PH至7.0。
(4)15%金霉素药样制备15%金霉素0.0512g0.1mol/L HCL 3000-5000μl加去离子水定容至50ml10%抗敌素药样制备10%抗敌素0.0512g加去离子水溶解,定容50ml离心,1000转5分钟,取上清液放至4℃冰箱保存。
6.实验操作步骤(1)菌种复苏各地相关菌种用平板划线(37℃恒温培养12~16小时)使其在平板培养基上生长。
(2)菌的扩增从平板上获取菌加入液体培养基,用恒温振荡器培养(37℃)12小时,备用。
(3)用八排微量移液器向96孔板中依次加入100μlMH肉汤。
(4)用100μl微量移液器向96孔板第一纵排分别加入药样上清液(每种药样加2孔)。
(5)倍比稀释用八排微量移液器从第一纵排吸取100μl混合液体,反复吸取8~10次,使吸入的混合液体液面相平后加入第二纵排反复吸取10次,依次法进行加至第十纵排。
4.抗菌药物的敏感性试验

肠球菌属:青霉素 、万古霉素 、甲氧苄啶/磺胺异
噁唑 、庆大霉素、环丙沙星、红霉素、氨苄西林
不动杆菌属:头孢他啶 、亚胺培南、阿米卡星、哌拉 西林/他唑巴坦、头孢吡肟 、头孢曲松 、环丙沙 星、米诺环素; 洋葱伯克霍德菌:头孢他啶 、米诺环素、甲氧苄啶/磺 胺异噁唑 、美罗培南 ;
嗜麦芽窄食单胞菌:甲氧苄啶/磺胺异噁唑、左氧氟沙 星、米诺环素 ;
嗜血杆菌属:氨苄西林、甲氧苄啶/磺胺异噁唑、头孢
他啶、美罗培南、阿奇霉素、环丙沙星、头孢克洛;
淋病奈瑟菌:头孢曲松、环丙沙星、青霉素、大观霉素、
四环素 ;
肺炎链球菌:红霉素 、苯唑西林 、甲氧苄啶/磺胺异噁唑、 克林霉素、左氧氟沙星、四环素、万古霉素 ; 除肺炎链球菌外的其他链球菌:红霉素、青霉素、克 林霉素、万古霉素、头孢曲松、左氧氟沙星。
5.盖上平板的盖子,放置培养箱内孵育,放置3~10分钟 后贴上标准抗生素纸片。
6.根据选择的菌株挑选相应的抗菌纸片。
肠杆菌科:氨苄西林、阿米卡星、哌拉西林/ 他唑巴坦、头孢噻肟、环丙沙星、亚胺培 南、氨曲南、庆大霉素; 铜绿假单胞菌:头孢他啶、庆大霉素、哌拉西林、 阿米卡星、环丙沙星、头孢吡肟、亚胺培南; 葡萄球菌属:头孢西丁、青霉素、红霉素、万古霉 素、环丙沙星、庆大霉素、利福平 ;
操作方法:1.抗菌药物的稀释和融解
2.抗菌药物母液的稀释
3.在微量聚乙烯微板孔中加入各种不同浓度的抗生素
100μ l,从低浓度往高浓度加样,不需要更换吸管。
4.挑选18~24小时的菌落置M-H肉汤增菌4~6小时。
5.制备0.5麦氏比浊管,然后1:200稀释,使之最终 浓度105 CFU/ml。
6.孵育后形成一椭圆形抑菌圈,抑菌圈和试条的相交
四抗菌药物敏感性试验

四、抗菌药物敏感性试验(一)药敏试验的目的测定病原微生物对化学治疗药物敏感性的试验称为化疗药物敏感性试验(Drug sensitivity test),简称药敏试验。
药敏试验的主要目的是:①用于测定新的抗菌药物或制剂的抗菌谱;②对病灶分离菌进行流行病学调查,主要应用于测定细菌经过多年后敏感性的变化情况和地区特异性;③在临床治疗感染性疾病时,针对病原菌选择合适的首选药物品种。
(二)药敏试验的原理及种类药敏试验是通过培养基培养的细菌确定细菌对药物的敏感性方法。
将被检菌接种在适当的培养基上,然后加上不同种类或不同浓度的抗菌药物(或制剂),观察细菌生长发育的速度和程度。
用药后,细菌在培养基上停止生长并且死亡,抑菌圈清晰,说明细菌对药物敏感,药物表现有较强的杀菌作用;用药后,细菌停止生长,但液体培养基经过一定时间后还可能出现浑浊或固体培养基上的抑菌圈不清晰,说明细菌对药物比较敏感,预示药物对被检细菌只是起抑菌作用。
通常判定一种药物对细菌的杀菌或抑菌作用的强度指标是固体培养基中抑菌圈的大小,但这也不是绝对的,因为抑菌圈的大小与药物对培养基的渗透性是密切相关的。
药敏试验方法较多,但在原理上不外乎是稀释法和扩散法两大类。
而扩散法(包括纸片法、管碟法)通常适用于临床治疗选择药物。
(三)常用培养基制作法1.普通肉汤培养基牛肉浸膏 3.0克蛋白胨 10.0克氯化钠 5.0克蒸馏水 1000毫升放在三角烧瓶中,微温溶解后,调节pH值至7.4~7.6,煮沸10分钟,冷却后的pH值为7.2±0.2。
15磅压力下灭菌15分钟(115℃灭菌30分钟)即得。
本培养基可用作为固体、鉴别、选择等培养基制造的基础原料,大部分细菌都能在其中生长。
1.普通肉汤琼脂培养基照上述普通肉汤培养基的配方及制法,加入15~20克琼脂,加热溶解后,调节pH值使灭菌后为7.2±0.2,分装,115℃灭菌30分钟,即得。
3.0.5%葡萄糖肉汤培养基蛋白胨 10克氯化钠 5克葡萄糖 5克牛肉浸膏 3克蒸馏水 1000毫升微温溶解后,调节pH值至弱碱性,煮沸后,加葡萄糖溶解,摇匀,滤清,调节pH值使灭菌后为7.2±0.2,分装,115℃灭菌30分钟,即得。
第4章抗菌药物敏感试验

第4章抗菌药物敏感试验一、需氧菌和兼性厌氧菌的体外抗菌药物敏感试验1.扩散法(K-B法)(1)原理将含有定量抗菌药物的纸片贴在接种有待检菌的琼脂平板上,该点称为抗菌药源。
药物向周围扩散,形成了随着药源距离增加,琼脂中药物浓度递减的浓度梯度。
在药源周围可抑菌浓度范围内待检菌的生长被抑制,形成无菌生长的透明圈即抑菌圈,其大小可以反映待检菌对测定药物的敏感性,并与该药对待检菌的最低抑菌浓度(MIC)呈负相关,即抑菌圈愈大,MIC愈小。
(2)实验材料①培养基:采用水解酪蛋白(M-H)琼脂,pH为7.2,琼脂厚度4mm。
对生长条件要求高的细菌,如链球菌属细菌需加入5%脱纤维羊血,嗜血杆菌属细菌需加入1%血红蛋白(含Ⅴ因子)和1%Ⅹ因子复合物。
②抗菌药物纸片:选用直径为6.35mm,吸水量20μl的专用药敏纸片。
制备时取灭菌药敏纸片,经加样或浸泡药物溶液后冷冻干燥,置4℃保存备用,在有效期内使用。
③接种菌液挑取平板上形态相同的菌落4~5个,接种于3~5ml M-H肉汤中,于35℃中培养2~8h。
嗜血杆菌属和链球菌属细菌需用加血肉汤培养过夜。
用生理盐水或肉汤校正菌液至0.5麦氏比浊标准(相当于1.5×109/ml的含菌量)后在15min内接种。
(3)试验方法以无菌棉拭蘸取已制备好的菌液(其浊度为0.5麦氏比浊标准),在M-H琼脂表面均匀涂布接种3次,每次平板旋转60°,最后沿平板内缘涂抹1周。
平板置室温干燥3~5min,后用无菌镊子或专用纸片分配器将含药纸片贴于琼脂表面。
纸片应贴得均匀,各纸片中心相距>24mm,纸片距平板内缘>15mm。
直径为90mm的平板可贴6张纸片。
纸片贴牢后应避免再移动。
平板室温放置15min后倒置于35℃培养箱中培养16~18h后读取结果。
(4)结果解释平板置黑色背景上,从背面量取包括纸片直径在内的抑菌圈直径,单位为mm。
培养基中如果加有血液须打开皿盖从正面测量抑圈菌。
医院抗菌药物敏感性试验的技术要求(2019年版)

医院抗菌药物敏感性试验的技术要求(2019年版)目录1 范围 (2)2 术语和定义 (2)3 常规药敏试验的药物选择和报告 (4)4 药敏试验方法 (7)5 各种属细菌药敏试验 (12)6 质量控制(Quality control, QC) (17)7 商品化药敏试验检测系统的性能验证 (19)附录 A (资料性附录)临床各种属细菌的药敏试验方法和试验条件 (23)附录 B (资料性附录)不常见苛养菌和非苛养菌药敏试验折点 (27)1 范围本标准规定了临床抗菌药物敏感性试验的技术要求,包括常规药敏试验的药物选择和报告、药敏试验方法、各种属细菌药敏试验、常见菌特殊耐药表型检测、药敏试验的质量控制、商品化药敏试验检测系统的性能验证。
本标准适用于开展临床微生物学检验的各级临床实验室。
2 术语和定义下列术语和定义适用于本文件。
2.1抗微生物药物敏感性试验Antimicrobial susceptibility testing指检测微生物(本行业标准特指细菌)对抗微生物药物(本行业标准特指抗菌药物)的体外敏感性,以指导临床合理选用药物的微生物学试验,简称药敏试验。
2.2最低抑菌浓度Minimal inhibitory concentration;MIC指在琼脂或肉汤稀释法药物敏感性检测试验中能抑制肉眼可见的微生物生长的最低抗菌药物浓度。
2.3折点Breakpoint能预测临床治疗效果,用以判断敏感、中介、剂量依赖型敏感、耐药、非敏感的最低抑菌浓度(MIC)或者抑菌圈直径(mm)的数值。
2.3.1敏感Susceptible;S当抗菌药物对分离株的MIC值或抑菌圈直径处于敏感范围时,使用推荐剂量进行治疗,该药在感染部位通常达到的浓度可抑制被测菌的生长,临床治疗可能有效。
2.3.2中介Intermediate;I当菌株的MIC值或抑菌圈直径处于中介时,该数值接近药物在血液和组织中达到的浓度,从而治疗反应率低于敏感菌群。
抗菌药物敏感性试验执行标准

抗菌药物敏感性试验执行标准抗菌药物敏感性试验是临床微生物学中非常重要的一项实验,它可以帮助医生选择最有效的抗菌药物来治疗感染性疾病。
执行标准的严格性和准确性对于试验结果的可靠性至关重要。
下面将介绍抗菌药物敏感性试验执行标准的相关内容。
首先,进行抗菌药物敏感性试验前,需要准备好所需的培养基、试验材料和各种试剂。
同时,要做好实验室的消毒和无菌操作,以确保试验的准确性和可靠性。
在进行试验时,需要按照严格的操作规程进行。
首先,要准备好待测菌株的悬浮液,然后按照一定比例将其接种到含有不同浓度抗菌药物的琼脂平板上。
接种后,要在恒温培养箱中进行培养,培养时间一般为16-18小时。
培养结束后,需要观察菌落的生长情况,并进行相关的数据记录和分析。
根据菌落的生长情况和抗菌药物的浓度,可以判断出菌株对抗菌药物的敏感性。
在记录和分析数据时,要注意细致入微,确保数据的准确性和可靠性。
在执行标准中,对试验结果的解释和判定也非常重要。
根据试验结果,可以判断出菌株对抗菌药物的敏感性、耐药性或者中间敏感性。
这些判定对于临床治疗具有指导意义,可以帮助医生选择最合适的抗菌药物来治疗感染性疾病。
此外,在执行标准中,还需要对试验过程中可能出现的干扰因素进行控制和排除。
比如,培养条件、试剂质量、操作技术等都可能对试验结果产生影响,需要在试验过程中进行严格的控制和调节。
总的来说,抗菌药物敏感性试验执行标准的严格性和准确性对于试验结果的可靠性至关重要。
在实验过程中,需要严格按照操作规程进行,确保试验过程的准确性和可靠性。
同时,对试验结果的解释和判定也非常重要,可以帮助医生选择最合适的抗菌药物来治疗感染性疾病。
在执行标准中,还需要对试验过程中可能出现的干扰因素进行控制和排除,以确保试验结果的准确性和可靠性。
抗菌药物敏感试验实验

无菌试管、刻稀释法
K-B法操作方法
操作注意事项:
菌液应在15分钟内接种完毕 接种后,平板放置时间不要超过5min 注意纸片距离
肉汤稀释法操作方法
1
2
3
4
5
6
7
8
9
10
M-H肉汤(ml)
2
2
2
2
2
2
2
2
2
2
抗生素(ml) 菌液(ml)
2
2
2
2
2
2
2
2
2弃 -
去
0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1 0.1
35℃孵育16~18h,观察结果
实验内容
第二次 1.观察K-B法的结果 2.观察肉汤稀释法的结果
K-B法结果解释
测量抑菌圈直径,参照CLSI的标准解释结果。
20mm
金黄色葡萄球菌抗菌药物敏感性试验结果判断
大肠埃希菌抗菌药物敏感性试验结果判断
实验目的 1.掌握纸片扩散法(K-B法)和肉汤稀释法
的原理、操作方法、结果的判读及其临床 意义。 2.掌握纸片扩散法和肉汤稀释法的质量控制。
实验内容 纸片琼脂扩散法(K-B法) 肉汤稀释法
实验器材
1. 菌种: 金黄色葡萄球菌、大肠埃希菌 2. 培养基:水解酪蛋白琼脂(MH琼脂)、MH肉汤 3. 抗菌纸片:青霉素(PEN)、庆大霉素(GEN)、
抗菌药物敏感性试验与细菌耐药性检测

2.试验方法及结果判读
三、实验内容
1、实验材料
(1)药敏纸片: ① 用于G+c:红霉素、克林霉素、万古霉素、替考
拉宁、复方新诺明、新生霉素、头孢 西丁 ② 用于G-b:环丙沙星、亚胺培南、头孢曲松、 头孢噻肟、头孢他啶、氨曲南、 阿莫西林/棒酸
(2)菌株: 金黄色葡萄球菌、大肠埃希菌标准菌株;
3、掌握葡萄球菌克林霉素诱导耐药(D试验) 的检测方法及结果判读。
二、实验原理
(一)抗菌药物敏感性试验检测
(二)细菌耐药表型检测
(一)抗菌药物敏感性试验
四种方法
1、纸片琼脂扩散法(K-B法) 2、稀释法 (1)肉汤稀释法 (2)琼脂稀释法 3、E-test法 4、联合药敏试验
纸片琼脂扩散法
1.基本原理
2、试验方法
MRS菌株的表型检测方法主要有头孢西丁 纸片扩散法、苯唑西林稀释法和苯唑西林盐 平板筛选试验,以头孢西丁纸片扩散法最常 用。
头孢西丁纸片扩散法解释标准
葡萄球菌克林霉素诱导耐药的检测 (D-test)
1.基本原理:
对大环内酯类耐药的葡萄球菌可能有天 然或诱导性对克林霉素的耐药,或只对大环 内酯类耐药。本试验可以测定诱导性的克林 霉素耐药。
2、什么叫D-test?该项检测有何意义?
2.试验方法
7
3.结果判读
用游标卡尺量取抑菌环直径,根据CLSI标准, 报告细菌对该抗菌药物是敏感(S)、中介 (I)还是耐药(R)。
4.注意事项
(1)菌液浊度应配制成0.5麦氏单位; (2)菌液调配好后应在15min内接种完; (3)菌液涂布药敏琼脂后应放置3-5min再贴
药敏纸片; (4)贴完纸片后不能再移动纸片;
金黄色葡萄球菌抗菌药物敏感性试验
《抗菌药物敏感试验折点研究技术指导原则》

《抗菌药物敏感试验折点研究技术指导原则》(网上征求意见稿)一、概述(一)目的本指导原则为药品注册申请人和临床试验研究者在规划、设计、实施和监督抗菌药物敏感试验折点(以下简称:抗菌药物折点)研究和敏感标准制定提供必要的技术指导,使安全有效的抗菌药物得以更好更早地用于临床治疗。
本指导原则主要适用于全身用药的创新性抗菌药物的临床试验。
(二)意义抗菌药物折点(breakpoint)用来判断病原菌对药物敏感、中介或耐药,其结果是临床医生选择抗菌药物治疗病原菌感染的重要依据。
我国目前还没有折点制定原则,抗菌药物临床应用时所采用的折点多是国际已有的标准,但对于自主研发的I类新抗菌药物等,无国际折点参考。
必须进行相关研究以制定药敏折点,保障临床医生能根据正确的药敏结果,合理应用抗菌药物。
(三)基本研究过程及与抗菌药物研发的整体关系抗菌药物折点的确立涉及临床前体内外抗菌作用研究、药物代谢动力学研究、临床各期研究等多个药物研发环节,是新药研究中的一项重要内容。
折点研究贯穿新药研究全过程,其研究原理可以概括为:在了解药物自身的抗菌特点、对各种致病菌作用强弱后,通过体外和动物试验,或直接通过动物试验,建立PK/PD指数及反映疗效的靶值。
并利用此指数、靶值与人体结果有较好一致性的特点,进而建立抗菌药物体外抑菌浓度与预期临床疗效间的关系,最终确定对感染部位使用推荐药物剂量时,该致病菌株能被通常可达到的抗菌药物所抑制的浓度。
折点制定过程中,有些数据可能来源于其他研究项目。
如:菌株的MIC值、药物杀菌曲线、抗生素后效应值、药物血浆蛋白结合率、药物人体药代参数等。
当使用外来数据时,首先要求数据可溯源。
其次,测定、分析方法符合折点制定的要求。
如:MIC测定所用方法相同、测定范围需涵盖整个MIC分布;杀菌曲线图能反映出完整的药物浓度对杀菌速率的影响等。
(四)应用范围本指导原则主要用于指导新抗菌药物折点研究,目前仅限定为抗细菌药物,创新抗真菌药物也可参照。
clsi药敏试验标准2023

CLSI药敏试验标准2023一、药敏试验定义药敏试验(Antimicrobial Susceptibility Testing,AST)是一种实验室方法,用于测定细菌对各种抗菌药物的敏感性或耐药性。
药敏试验可以帮助医生选择最合适的抗菌药物来治疗感染,提高治疗效果并减少耐药性的传播。
二、试验规则1.试验方法:CLSI推荐使用微量稀释法(microdilution method)进行药敏试验。
该方法通过在试管或微孔板中加入细菌悬液和不同浓度的抗菌药物,测定细菌生长情况,从而判断细菌对药物的敏感性。
2.试验菌种:CLSI推荐使用临床分离的细菌菌种进行药敏试验,包括革兰阳性菌、革兰阴性菌、非发酵菌等。
3.药物浓度:药敏试验中使用的抗菌药物浓度应符合CLSI标准,以保证试验结果的准确性。
4.孵育时间:孵育时间应根据菌种和药物特性确定,一般为16-20小时。
5.结果判定:根据细菌生长情况,药敏试验结果可分为敏感(S)、中介(I)和耐药(R)三种类型。
三、质量控制1.室内质控:每次试验应包括阴性对照(无菌生长)和阳性对照(细菌生长),以验证试验的准确性。
2.室间质控:参加CLSI组织的室间质控计划,以确保不同实验室之间的结果具有可比性。
四、抗生素敏感性试验1.常规抗生素:包括β-内酰胺类(如青霉素类、头孢菌素类等)、氨基糖苷类(如链霉素、庆大霉素等)、氟喹诺酮类(如环丙沙星、左氧氟沙星等)等多种抗生素。
2.特殊抗生素:针对某些特定感染,如结核病、真菌感染等,需使用特殊的抗结核药物或抗真菌药物进行药敏试验。
五、抗菌药物分组CLSI将抗菌药物分为五个组别,分别为:β-内酰胺类、氨基糖苷类、氟喹诺酮类、抗真菌药和其他抗菌药物。
药敏试验时应根据抗菌药物的分组选择相应的药敏试验方法。
六、选药流程1.根据感染部位和临床诊断,选择可能有效的抗菌药物。
2.根据细菌培养和药敏试验结果,调整抗菌药物的选择。
3.根据患者个体差异(如年龄、肾功能等)和药物相互作用,选择最合适的抗菌药物。
药敏试验

≤13 14~22 ≥23
≥8
≤0.5
GEN 庆大霉素 10IU
≤12 13~14 ≥15
≥8
≤4
(五)药物敏感试验结果解释
“敏感”(susceptible,S):表示测试菌可被测 定药物常规剂量给药后在体内达到的血药浓度 所抑制;
“耐药”(resistant,R):表示测试菌不能被在 体内感染部位可能达到的抗菌药物浓度所抑制, 临床治疗无效。
二、稀释法:琼脂稀释法
将药物混匀于琼脂培养基中,配制含不同 浓度药物平板,使用多头接种器接种细 菌,经孵育后观察细菌生长情况,以抑 制细菌生长的琼脂平板所含药物浓度测 得MIC。
MIC:稀释法所测得的某抗菌药物能抑制 被检菌肉眼可见生长的最低浓度
琼脂稀释法具体实验步骤:
1. 抗菌药物储备液的配制:将各种抗菌药物制备 成琼脂稀释法试验需要的药物浓度。
标卡尺量取抑菌圈直径。 根据NCCLS标准,作出 “敏感”、“耐药”和 “中介”的判断。
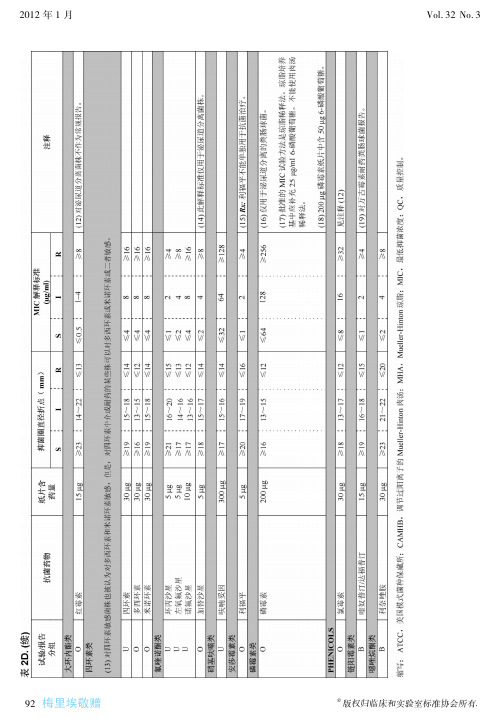
几种抗生素抑菌环解释标准及相应的最低抑菌浓度
代号 抗生素
纸片 含药量
抑菌环直径(mm)
耐药
中介
敏感
相应的MIC(μg/ml)
耐药
敏感
P-G 青霉素G 10IU
≤20 2素
15IU
一、纸片扩散法
(一)试验原理 将含有定量抗菌药物的纸片贴在已接种 测试菌的琼脂平板上,纸片中所含的药 物吸收琼脂中水分,溶解后不断向纸片周 围扩散形成递减的梯度浓度。在纸片周围 抑菌浓度范围内测试菌的生长被抑制, 从而形成无菌生长的透明圈即为抑菌圈。 抑菌圈的大小反映测试菌对测定药物的 敏感程度,并与该药对测试菌的MIC呈负 相关关系,即抑菌圈愈大,MIC值愈小。
抗菌药物敏感性试验执行标准2
!"#! 年 # 月
$ % & ' (! ) % ' (
#4+ 梅里埃敬赠
版权归临床和实验室标准协会所有'
用于 , "-. / 0 , 1 2试验
, #"". 3!!
此页空白
版权归临床和实验室标准协会所有'
梅里埃敬赠 #44
!"#! 年 # 月
$ % & ' (! ) % ' (
#45 梅里埃敬赠
用于 , "!. ## 和 , "/. +
, #""0!!
此页空白
版权归临床和实验室标准协会所有'
梅里埃敬赠 #"(
!"#! 年 # 月
$ % & ' (! ) % ' (
#"1 梅里埃敬赠
版权归临床和实验室标准协会所有'
用于 , "!. ## 和 , "/. +
, #""0!!
版权归临床和实验室标准协会所有'
版权归临床和实验室标准协会所有'
用于 , "!. ## 和 , "/. +
, #""0!!
版权归临床和实验室标准协会所有'
梅里埃敬赠 #"+
!"#! 年 # 月
$ % & ' (! ) % ' (
##" 梅里埃敬赠
版权归临床和实验室标准协会所有'
2023年《抗菌药物敏感性试验的技术要求》试题及答案

2023年《抗菌药物敏感性试验的技术要求》
试题及答案
1、β酰胺酶阳性说明对(E)耐药
A、青霉素
B、氨基青霉素
C、羧基青霉素
D、脲基青霉素
E、以上都是
2、检测金黄色葡萄球菌β内酰胺酶产生的方法,不正确的是(D)
A、检测方法为青霉素纸片扩散法
B、培养基为MHA
C、药物浓度为青霉素纸片(10单位)
D、孵育条件为室温环境
E、孵育时间16-18h
3、β内酰胺酶检测的质控菌株为(B)
A、流感嗜血杆菌
B、金黄色葡萄球菌
C、粪肠球菌
D、淋病奈瑟菌
E、卡他莫拉菌
4、药敏试验结果解释SDD指的是(B)
A、敏感
B、剂量依赖型敏感
C、中介
D、耐药
E、非敏感
5、药敏试验测试药物的分组U组为(D)
A、常规测试并报告
B、常规测试选择性报告
C、补充测试选择性报告
D、泌尿道感染
E、脑脊液感染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗菌药物敏感性试验的技术要求1 范围本标准规定了临床抗菌药物敏感性试验的技术要求,包括常规药敏试验的药物选择和报告、药敏试验方法、各种属细菌药敏试验、常见菌特殊耐药表型检测、药敏试验的质量控制、商品化药敏试验检测系统的性能验证。
本标准适用于开展临床微生物学检验的各级临床实验室。
2 术语和定义下列术语和定义适用于本文件。
2.1抗微生物药物敏感性试验Antimicrobial susceptibility testing检测微生物(本文件特指细菌)对抗微生物药物(本文件特指抗菌药物)的体外敏感性,以指导临床合理选用药物的微生物学试验,简称药敏试验。
2.2最低抑菌浓度Minimal inhibitory concentration;MIC在琼脂或肉汤稀释法药物敏感性检测试验中能抑制肉眼可见的微生物生长的最低抗菌药物浓度。
2.3折点Breakpoint能预测临床治疗效果,用以判断敏感、中介、剂量依赖型敏感、耐药、非敏感的最低抑菌浓度(MIC)或者抑菌圈直径(mm)的数值。
2.3.1敏感Susceptible;S当抗菌药物对分离株的MIC值或抑菌圈直径处于敏感范围时,使用推荐剂量进行治疗,该药在感染部位通常达到的浓度可抑制被测菌的生长,临床治疗可能有效。
2.3.2中介Intermediate;I当菌株的MIC值或抑菌圈直径处于中介时,该数值接近药物在血液和组织中达到的浓度,从而治疗反应率低于敏感菌群。
该分类意味着采用高于常规剂量治疗时或在药物生理浓集的部位,临床治疗可能有效。
该分类同样可作为“缓冲域”,以防止由微小、不可控的技术因素导致的重大偏差,尤其是毒性范围较窄的药物。
2.3.3剂量依赖型敏感Susceptible-dose dependent;SDD细菌菌株对抗菌药物的敏感性依赖于抗菌药物的剂量。
当某种药物对菌株的MIC或抑菌圈直径在SDD 范围时,临床可通过提高剂量和(或)增加给药频率等修正给药方案以达到临床疗效。
2.3.4耐药Resistant;R当抗菌药物对分离株的MIC值或抑菌圈直径处于该分类范围时,使用常规治疗方案,该药在感染部位所达到的药物浓度不能抑制细菌的生长,和(或)被测菌株获得特殊耐药机制,且治疗性研究显示该药临床疗效不确切。
2.3.5非敏感Nonsusceptible;NS对于那些因未现或罕现耐药,而仅具有敏感折点的抗菌药物,当该药对某分离株的MIC值高于或抑菌圈直径低于敏感折点时,此分类为非敏感。
2.4流行病学界值Epidemiological cutoff value;ECV将微生物群体区分为有或无获得性耐药的MIC值或抑菌圈直径,是群体敏感性的上限。
根据ECV,可将菌株分为野生型和非野生型。
2.4.1野生型 Wild-type;WT根据ECV值,将抗菌药物(包括抗真菌药物)评估中未获得耐药机制或无敏感性下降的菌株定义为野生型。
2.4.2非野生型Non-wild-type;NWT根据ECV值,将抗菌药物(包括抗真菌药物)评估中获得了耐药机制或存在敏感性下降的菌株,定义为非野生型。
2.5效价Potency抗菌药物中具有抗菌活性的成分,通过同类标准物质测定得出。
单位mg/g、IU/g或用百分比表示。
2.6基本一致性Essential agreement;EA待测MIC系统与参考方法MIC值相差不超过1个稀释倍数。
当待评估方法为纸片扩散法时,不计算EA。
2.7分类一致性Categorical agreement;CA被评估药敏方法与参考方法判断试验结果为敏感、中介、耐药的一致性。
2.8极重大误差Very major error;VME将耐药误判为敏感,即假敏感。
2.9重大误差Major error,ME将敏感误判为耐药,即假耐药。
2.10小误差Minor error将中介判为敏感或耐药、或者将耐药或敏感判为中介。
2.11常规药敏试验Routine test用于临床常规检测的纸片扩散法、肉汤或琼脂稀释法。
2.12补充(非常规)药敏试验Supplemental (not routing) test通过常规纸片扩散法、肉汤或琼脂稀释法以外的方法检测某种或某类药物的敏感性或耐药性,且该方法无需额外试验确证药物的敏感性或耐药性。
2.13筛选试验Screening test提供假定结果的试验。
当筛查结果阳性时,需进行附加试验进行确认。
2.14替代药物试验Surrogate agent test当目标抗菌药物的药敏无法检测或替代药物的药敏检测性能优于目标药物时,该药物可替代目标药物进行药敏试验。
2.15等效药物试验Equivalent agent test某药可预测与其密切相关的同类药物的药敏结果,测定该药的药敏试验可减少其他相关药物的检测数量以提高检测效率。
3 常规药敏试验的药物选择和报告3.1 药敏试验测试药物的分组A组:对特定的菌种,常规测试并报告的基本抗菌药物。
B组:常规测试,但只选择性报告的基本抗菌药物,例如当对A组同类药物耐药时。
选择性报告指征还包括:特定部位分离菌(如三代头孢菌素对脑脊液中肠杆菌科菌)、混合感染、多部位感染、患者对A组药物过敏/不耐受/无反应、出于感染控制目的。
C组:包括替代性或补充性的抗菌药物。
在某些医疗机构,地方或流行菌株对A组/B组多个药物耐药时,需测试该组药物;当对基本测试药物过敏、或测试少见细菌时、或流行病学和感染控制需要时,需测试的补充药物。
U组:包括那些仅仅或主要用于治疗泌尿道感染的抗菌药物。
各级实验室结合当地病原谱特征、药物代表性、临床需求和本实验室条件等,确定本室不同菌种/药物测试和报告组合。
综合上述原则选择自动化药敏板,当药敏板无法满足需求时,予以补充。
3.2 结果解释分类实验室测试和报告抗菌药物的MIC值或抑菌圈直径(mm)的结果,按折点分为:敏感(S)、剂量依赖型敏感(SDD)、中介(I)、耐药(R)或非敏感(NS);按ECV分为野生型(WT)或非野生型(NWT)。
3.3 报告原则3.3.1 基本原则只有当分离株可能有临床意义而非定植或污染时,才可报告药敏试验。
药敏试验检测获得性耐药而非天然耐药,实验室应明确各类菌属的天然耐药谱,避免将天然耐药误报为敏感。
个别菌属对某些药非常敏感,或该菌引起的感染不需使用抗菌药物时(如大肠埃希菌O157引起的腹泻),常规不需药敏试验。
实验室根据药物分组、标本类型等,选择性报告药敏结果。
3.3.2 药敏方法和折点的选择针对不同药物/菌种组合,实验室应选择适当的药敏方法,并制定相应药敏试验的操作程序(包括质控标准、结果解释等)。
实验室宜采用国内、外权威机构近两年发布的折点,并每年评审本室药敏检测系统的折点范围;因药敏板条浓度范围受限,无法采用新折点时,需补充相应的耐药表型检测试验,且告知临床。
判定折点的适用性与菌种、药敏方法、检测条件、纸片含量、感染部位、药物(种类、剂量、频次、途径)有关。
当上述条件符合相应要求时,折点方适用。
对于国际药敏委员会未给出折点的药物,建议采用国内、外专家共识和权威文献等进行操作和判断,并告知临床。
3.3.3 药敏报告特殊注意事项a)肠道分离的沙门菌属和志贺菌属仅需报告氨苄西林、一种氟喹诺酮类药物和甲氧苄啶/磺胺甲噁唑。
肠道外分离的沙门菌属,需增加测试并报告一种三代头孢菌素,必要时测试并报告氯霉素。
伤寒样沙门菌(伤寒沙门菌和甲、乙、丙型副伤寒沙门菌)应进行药敏试验,肠道分离的非伤寒样沙门菌一般不进行药敏试验。
沙门菌属和志贺菌属对第一代、第二代头孢菌素、头霉素和氨基糖苷类体外可能敏感,但临床治疗无效,所以不测试和报告这些药物。
b)苯唑西林耐药葡萄球菌对目前可用的β-内酰胺类(除头孢洛林等外)均耐药。
测试青霉素和苯唑西林或头孢西丁可以推测其它β-内酰胺类的敏感性。
c)肠球菌属对氨基糖苷类(除外高浓度的氨基糖苷类)、头孢菌素类、克林霉素和甲氧苄啶/磺胺甲噁唑体外可能出现敏感,但临床治疗无效,不应报告为敏感。
d)脑脊液分离菌株,不宜常规测试和报告下列药物:仅有口服剂型的药物、第一代和第二代头孢菌素(除外头孢呋辛注射剂)和头霉菌素类、克林霉素、大环内酯类、四环素类和氟喹诺酮类。
e)呼吸道分离株不应测试和报告达托霉素,尿液分离株不报告氯霉素、克林霉素和红霉素,非尿液分离株不测试和报告呋喃妥因。
f)罕见耐药表型、广泛耐药或全耐药菌应复核后方可发出药敏报告。
一旦确认应报告医院感染控制办公室。
实验室保留这些菌株,以备流行病学调查或临床追加额外的药敏试验之需。
3.3.4 报告单内容和形式3.3.4.1 一般信息报告单包括:患者信息(姓名、年龄、性别、病历号等)、临床信息(如科室、临床诊断、抗菌药物使用、标本类型等)、实验室信息(包括标本采集时间、送检时间、接收时间和审核报告时间、操作人和审核人双签名)等。
3.3.4.2 药敏试验3.3.4.2.1 细菌和药物名称细菌名称应规范化,参见细菌命名标准。
宜标注拉丁文名称。
药物名称应使用规范的化学通用名称,不使用商品名。
宜同时显示药物的中英文名称,且同一类药物不同品种集中排列。
3.3.4.2.2 结果呈现a)报告单应明确列出各类药物对该菌种的折点、本实验室所用标准的版本号或出版时间。
b)若没有折点而借用其他菌种折点或采用权威文献折点,需备注说明。
c)MIC法报告MIC值(单位为mg/L或μg/mL)和结果解释;纸片扩散法报告抑菌圈直径值(应为整数,单位为mm)。
结果解释根据折点或ECV判断为S、I、R、SDD、NS、WT、NWT等类型。
d)不报告替代药物的药敏结果。
如用于判断金黄色葡萄球菌对苯唑西林耐药性的头孢西丁不应报告。
3.3.4.2.3 特殊耐药表型宜在报告中明确标注特殊耐药表型,同时对特殊耐药表型进行专业解释,包括含义、机制、用药限制和建议等。
对于罕见耐药现象,进行复核,并标示结果状态,如复核中、已复核等。
少见和矛盾耐药表型进行确认。
3.3.4.3 报告单备注或注释a)形式性注释:用于符号、缩写等的详细解释。
b)专业性注释:包括概念解释(如特殊菌天然耐药)、临床意义和治疗建议等,专业性注释宜有科学依据。
c)重要性提示:如“高致病性/高传播性”。
d)时效性提示:如“若有疑义,请于48 h内与实验室联系”。
e)管理性提示:如“需要上报传染病卡”。
f)免责提示:如“该结果仅对该标本负责”,“该结果解释宜结合患者临床表现与治疗反应,仅供参考”等。
g)医院地址和实验室联系方法等。
3.3.5 报告发放药敏报告应尽快发放。
紧急情况应将部分结果先行发出,如血培养和脑脊液等其他无菌体液培养的初步药敏试验结果。
无论提前还是延时,报告上应显示时间,并注明报告级别(初步报告或最终报告)。
保存抗菌药物敏感性试验资料,至少每年向临床报告流行病学分析结果。
