2021版:中国胸腺上皮肿瘤临床诊疗指南(全文)
中国胸腺上皮肿瘤临床诊疗指南

中国胸腺上皮肿瘤临床诊疗指南中国胸腺上皮肿瘤是一种相对罕见的恶性肿瘤,诊断和治疗上存在一定的困难。
临床诊疗指南的制定对于提高胸腺上皮肿瘤的诊疗水平,规范化临床操作具有重要的指导意义。
本文旨在综述中国胸腺上皮肿瘤临床诊疗指南的制定过程和内容。
胸腺上皮肿瘤是一种起源于胸腺上皮细胞的恶性肿瘤,包括胸腺癌和胸腺类癌。
由于病因不明、症状多样、易被误诊和难以手术切除等特点,临床诊疗领域对该疾病的认知和治疗方案存在较大的差异。
为了规范胸腺上皮肿瘤的诊断和治疗,中国胸外科学会胸腺疾病学组于2024年制定了《中国胸腺上皮肿瘤临床诊疗指南》。
指南的制定过程基于循证医学的原则,结合国内外相关研究的最新进展。
制定组由来自全国各地的经验丰富的胸外科专家和肿瘤学专家组成。
制定组首先进行了系统性的文献检索和筛选,收集了大量的胸腺上皮肿瘤相关的研究文章和临床试验资料。
然后,在组内进行了多次专家会议,根据收集到的证据和专家经验,共同讨论和制定了诊疗指南的内容。
指南主要包括胸腺上皮肿瘤的分类、诊断、分期、治疗和随访等方面的内容。
在分类上,根据肿瘤的组织学类型和分化程度,将胸腺上皮肿瘤分为良性、低度恶性和高度恶性三种类型。
在诊断上,指南提出了详细的诊断流程和标准。
针对不同类型的胸腺上皮肿瘤,指南给出了相应的治疗策略和原则。
对于手术可切除的胸腺上皮肿瘤,手术切除是首选的治疗方法,术前和术后的辅助治疗也应根据具体情况进行。
对于无法手术切除的患者,放疗、化疗和靶向治疗等也可以用于控制肿瘤的生长和复发。
指南还对术后随访和复发的管理提出了指导性建议。
总之,中国胸腺上皮肿瘤临床诊疗指南的制定是一项系统性、科学性的工作,旨在改善胸腺上皮肿瘤的诊断和治疗水平,提高患者的生存质量和预后。
该指南的出台对于规范临床操作、减少误诊和漏诊,提高胸腺上皮肿瘤的治疗效果具有重要的意义。
指南的实施需要医生的积极参与和遵循,同时也需要结合具体情况和专业经验进行个体化治疗。
《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》要点

《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》要点原发性支气管肺癌简称肺癌,是我国及世界范围内发病率和死亡率较高的恶性肿瘤之一。
近年来肺癌的发病率和死亡率呈明显上升趋势,据我国国家癌症中心统计,2015年我国肺癌发病率和死亡率均居恶性肿瘤首位,其中新发病例约78.7万,死亡病例约63.1万;男性高于女性,城市高于农村;发病率和死亡率存在区域差异,东北部最高,其次为中部、南部、北部、东部,西北部最低。
早期肺癌多无明显症状,临床上多数患者出现症状就诊时已属晚期,晚期肺癌患者整体5年生存率不高肺癌的筛查一、筛查人群的选择(一)年龄段(2A类推荐证据)本指南推荐在45~75岁人群中开展肺癌筛查。
2015年全国肿瘤统计数据显示,肺癌的年龄别发病率及死亡率在45岁之后显著增加,因此,推荐肺癌筛查的起始年龄为45岁。
75岁之后,肺癌的年龄别发病率及死亡率有所下降,考虑到75岁以上人群的预期寿命、合并症、手术耐受性及筛查成本等因素,对于>75岁人群的肺癌筛查获益可能较小,因此,推荐肺癌筛查的终止年龄为75岁。
对于无法耐受可能的肺癌切除手术或罹患严重疾病预期寿命较短的个体不建议进行肺癌筛查。
(二)肺癌的危险因素(2A类推荐证据)肺癌筛查的获益随着肺癌发病风险的增加而增加,对高危人群进行筛查是目前国内外筛查指南的共识。
本指南对于高危人群的选择充分考虑了除年龄外的肺癌危险因素,结合中国肺癌的发病特点,推荐在符合年龄段的基础上,含有下列危险因素之一的人群进行肺癌筛查。
1. 吸烟:吸烟可显著增加肺癌的发病风险。
2. 二手烟或环境油烟吸入史:亚洲人群中非吸烟女性的肺癌发生率显著高于欧美人群,推测可能与二手烟暴露和厨房等场所的环境油烟暴露有关。
3. 职业致癌物质暴露史:长期接触氡、砷、铍、铬、镉及其化合物等高致癌物质者更易罹患肺癌。
石棉暴露可显著增加肺癌的发病风险。
另外,二氧化硅和煤烟也是明确的肺癌致癌物。
4. 个人肿瘤史:既往罹患其他恶性肿瘤者可能携带异常基因突变,基因突变可增加肺癌的发病风险。
胸腺瘤诊疗指南或共识

胸腺瘤诊疗指南或共识流行病学1.胸腺上皮肿瘤起源于胸腺,包括胸腺瘤和胸腺癌,胸腺瘤的发病率约0.13/1 0万-0.15/10,是前纵隔常见的原发肿瘤。
男女发病率相似,40-70岁是好发年龄,儿童和青少年很少发生胸腺瘤。
酒精、烟草、电离辐射都不是胸腺瘤发病的高危因素。
2.前纵膈肿块包括肿瘤病变:胸腺瘤、淋巴瘤、胸腺癌、胸腺类癌、胸腺脂肪瘤、生殖细胞肿瘤、肺转移瘤等(只有胸腺瘤、胸腺癌和胸腺脂肪瘤来源于真正的胸腺成分)。
3.胸腺瘤是前纵隔最常见的原发肿瘤,约占50%,病程常呈缓慢发展(除外淋巴瘤和生殖细胞肿瘤)。
诊断1.CT扫描是诊断胸腺瘤的首选影像学检查,其表现为:位于前纵隔的圆形、卵圆形或分叶状肿块,不伴有淋巴结的肿大。
常邻近大血管、心脏,在左侧无名静脉下方,邻近胸骨;若病灶较大可包绕纵膈大血管,CT表现:中等软组织密度,少部分患者可表现囊性化和钙化。
2.MRI主要用于制定手术计划时确定切缘边界,尤其对于在术前考虑有大血管、心脏侵犯的病人更有价值;不能耐受碘造影进行增强CT扫描的患者,可进行胸部MR I。
3.低剂量CT不能用于胸腺瘤或胸腺癌筛查,因为没有数据证实胸腺瘤或胸腺癌的筛查可以提高生存期。
4.PET-CT能更好的提示解剖结构的情况,能更好的提示解剖结构的情况;有研究显示胸腺癌的最大SUV值明显高于胸腺瘤,与胸腺瘤相比,胸腺癌呈均匀性摄取。
(PET-CT对于胸腺瘤的诊断价值有待进一步明确)5.纵膈肿瘤需要查AFP和β-HCG检测以便于排除生殖细胞肿瘤;查T3、T4、TSH 排除纵膈甲状腺肿。
6.胸腺上皮样肿瘤:①胸腺床部位界限清晰的纵膈包块并不与甲状腺连续;②肿瘤标记物AFP或β-HCG阴性;③无淋巴结肿大表现。
7.FNA可以引起针道肿瘤细胞的种植,因此在考虑胸腺瘤时谨慎使用FNA。
8.若临床和影像学特征都强烈提示胸腺瘤为可切除病灶(例如重症肌无力和影像学典型的占位病灶),没有必要进行手术活检,避免经胸膜的方法进行活检,以防止肿瘤的种植转移。
中国胸腺上皮肿瘤临床诊疗指南(2021版)

• 根据现有文献报道,很多既往为良性的早期胸腺肿瘤,术后亦有复发转移可能, 因此,恶性或良性胸腺瘤的相关术语已不再适宜,目前所有胸腺肿瘤均已被视 作恶性肿瘤。
• 胸腺肿瘤属于惰性肿瘤,即使疾病进展后,部分胸腺瘤患者的生存时间仍较长。
结束,谢谢聆听
治疗
• (三)内科治疗 • 1.化疗 • 单纯化疗应仅为不可手术切除和不可放疗的转移性(ⅣB期)胸腺瘤的推荐治疗;对
于局部晚期(Ⅲ~ⅣA期)胸腺瘤(癌),应在活检明确病理后,先进行诱导化疗, 继而根据病灶转归情况决定后续手术或放疗;对于晚期或转移性(ⅣB期)胸腺瘤 (癌),应行以铂类为基础的联合化疗。 • 2.靶向治疗 • 胸腺瘤(癌)缺乏有效的靶向治疗药物,循证医学证据有限,其疗效预测标志 物及预后尚不明确。舒尼替尼、依维莫司、组蛋白去乙酰化酶抑制剂对胸腺肿 瘤尤其是胸腺瘤具有一定治疗作用。
量,可考虑术后辅助化疗。对于初始评估无法切除患者,应先行新辅助化疗 (优选蒽环为基础的方案)、新辅助放疗(40~50Gy)或新辅助放化疗。
治疗
• 4.Masaoka-KogaⅣB期 • 标准化疗。若化疗后有局部残留病灶,或者局部症状较重,可给予引起症状区
域病灶的姑息放疗。
治疗
• 二、胸腺上皮肿瘤的治疗 • (一)外科治疗 • 若临床提示为可手术切除的胸腺瘤,为减少胸腺瘤包膜破坏时导致肿瘤播散种
植,应避免行术前组织病理穿刺活检术。对于不可手术切除的局部晚期胸腺瘤 (癌),可通过穿刺活检或开放式活检明确病理类型。 • (二)放射治疗 • 明确的放疗指征包括无法手术切除的胸腺瘤(癌)(包括术前新辅助治疗后疾 病进展)和不完全手术切除后的胸腺瘤(癌),应行根治性放疗;局部晚期胸 腺瘤(癌)术后应行辅助治疗;晚期胸腺瘤(癌)化疗后可行姑息手术治疗。
2021 NCCN与CSCO乳腺癌指南更新(全文)

2021 NCCN与csco乳腺癌指南重新(全文)2021年上半茸NCCN乳腺癌指南己更新5版,我们将就该指南2021上半年较2020年指南更新内容要点进行汇总。
新辅助/辅助治疗要点1HER2阴性乳腺癌新辅助/辅助治疗茵选方案新增奥拉帕利(若gBRCA1/2突变伴高风险),井新增脚洼,对于gBRCA1/2突变伴高凤险患者1)TNBC E注pT2或注pN1( 1类);或2)HR+/HER2-注4枚阳性淋巴结患者考虑辅助化疗后增加奥拉帕利辅助治疗1年;对于BRCA1/2突变且HR+HER2号L腺癌术前化疗者,如果残存病灶且CPS+EG评分泣,也应考虑、接受奥拉帕利辅助治疗1年。
*真奥拉帕利治疗gBRCA突变HER2阴性乳腺癌在中国尚未获批,本资料内容不作为治疗或使用建议,目前中国获批的适应证为用于携带胚系或体细胞BRCA突变的(gBRCAm或sBRCAm)晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌初治成人患者在一线含幸自化疗达到完全缓解或部分缓解后的维持治疗;铀敏感的复发性上皮性卵巢癌、输卵筐癌或原发性腹膜癌成人患者在含铀化疗达到完全缓解或部分缓解后的维持治疗;携带胚系或体细胞BRCA突变(gBRCAm或sBRCAm)且既往治疗(包括一种新型内分泌‘药物)失败的转移性去势抵抗性前列腺癌成人患者。
要点2绝经前pT1-3和pNOHR+/HER2-患者治疗选择调整,不适合接受化疗的患者接受辅助内分泌治疗+卵巢师制,可化疗患者根据墓因检测预后评估接受辅助化疗序贯内分泌治疗或内分泌治疗+卵巢抑制;绝经后pT1-3和pNO或pN+HR+/HER2-患者辅助治疗分层修改为21墓因RS注26与RS<26;RS<26患者推荐接受辅助内分泌治疗,厄运26患者推荐辅助化疗序贯内分泌治疗。
要点3对于接受芳香化酶抑制剂治疗5年+卵巢抑制/卵巢切除的绝经前患者,应考虑进行延长芳香化酶抑制剂治疗3-5年;对于接受芳香酶抑制剂辅助治疗的绝经后(自然或诱发)患者,考虑接受双麟酸盐或地舒单抗辅助治疗。
2021年CSCO《乳腺癌诊疗指南》更新要点解读

文章编号:1674-4136(2021)03-0209-07
Update and interpretation of the 2021 Guidelines for the Diagnosis and Treatment of Breast Cancer by
关注 T⁃DM1 与 HP 双靶这两个更强方案之间的对
双靶在新辅助治疗后辅助治疗阶段的临床研究,两
者间的疗效差异无从得知。 鉴于 T⁃DM1 在中国尚
未进入医保,患者用药的经济负担仍较重,2021 版
指南对于新辅助抗 HER⁃2 治疗使用 HP 双靶后未
达 pCR 的患者,将 HP 双靶由 2020 版的Ⅱ级推荐调
靶新辅助治疗后未达 pCR 的患者,T⁃DM1 均为术后
辅助治疗Ⅰ级推荐的首选策略。
2019 年圣安东尼奥乳腺癌研讨大会( SABCS)
1 1 新增 HER⁃2 低表达定义:IHC 2 + 且 ISH 阴性
或 IHC 1 +
上 APHINITY 研究 6 年随访结果公布,HP 双靶辅助
drug conjugate,ADC) DS⁃8201a 对于 HER⁃2 低表达
策略。 但与此同时,新型药物的出现对于传统的分
子分型也提出了挑战,已不能简单地将 HER⁃2 表达
状态分为阴性、阳性。
存期(invasive disease⁃free survival, iDFS)绝对差异高
达 11 3%,T⁃DM1 组疾病复发 / 死亡风险较曲妥珠单
抗组降低 50% [6] 。 因此,对于曲妥珠单抗以及 HP 双
第一作者: 黄香,女,博士,副教授,研究方向:肿瘤免疫治疗,Email:lorelai@ njmu.edu.cn
2021版肺癌指南

2021版肺癌指南摘要:一、肺癌的发病率和死亡率二、2021 版肺癌指南的制定背景和目的三、2021 版肺癌指南的主要内容1.病理分型和分期2.基因检测和免疫分子标志物检测3.肺癌的治疗手段4.肺癌的防治措施四、2021 版肺癌指南的意义和影响正文:肺癌是一种常见的恶性肿瘤,其发病率和死亡率均位于恶性肿瘤中的第1 位。
为了进一步提高我国肺癌的诊疗水平,规范防治措施,改善患者的预后,中华医学会组织呼吸内科、肿瘤内科、胸外科、放疗科、影像科和病理科专家,结合国际指南推荐意见和中国临床实践现状,制定了2021 版肺癌指南。
一、肺癌的发病率和死亡率肺癌的发病率和死亡率在我国一直居高不下,给患者和家庭带来了沉重的负担,同时也对医疗资源造成了巨大的压力。
据统计数据显示,我国肺癌的发病率和死亡率均呈上升趋势。
二、2021 版肺癌指南的制定背景和目的为了更好地应对肺癌的挑战,中华医学会组织相关领域的专家,制定了2021 版肺癌指南。
本指南旨在为各级临床医务人员提供专业的循证医学意见,规范肺癌的诊疗过程,提高治愈率,改善患者的生活质量。
三、2021 版肺癌指南的主要内容1.病理分型和分期肺癌的病理分型包括鳞状细胞癌、腺癌、小细胞肺癌等,不同类型的肺癌在发病机制、临床表现和治疗手段上存在差异。
肺癌的分期包括I、II、III、IV 期,分期越早,治愈率越高。
2.基因检测和免疫分子标志物检测基因检测和免疫分子标志物检测是肺癌诊断和治疗的重要手段。
通过检测患者的基因突变和免疫分子标志物,可以为肺癌的个体化治疗提供依据。
3.肺癌的治疗手段肺癌的治疗手段包括手术、放疗、化疗、靶向治疗、免疫治疗等。
根据患者的具体情况,选择合适的治疗方案,以达到最佳的治疗效果。
4.肺癌的防治措施肺癌的防治措施包括早期筛查、戒烟、避免二手烟、控制空气污染等。
通过这些措施,降低肺癌的发病率和死亡率。
四、2021 版肺癌指南的意义和影响2021 版肺癌指南的发布,为我国肺癌的防治工作提供了科学依据和指导方针,有助于提高肺癌的诊疗水平,改善患者的预后。
胸腺瘤诊断治疗指南

胸腺瘤诊断治疗指南【概述】大约95%的胸腺瘤发生在前纵隔,少数发生在纵隔以外的部位如颈部、肺门和肺实质内。
在纵隔内,胸腺瘤还可发生在前纵隔的心膈角处,甚至有报道如息肉一样的气管内胸腺瘤。
所有胸腺瘤均起源于胸腺上皮细胞,但仅有4%的胸腺瘤是由单一的胸腺上皮细胞组成,绝大多数胸腺瘤是胸腺上皮细胞和淋巴细胞混合组成的。
胸腺82临床诊疗指南胸外科分册瘤分以下四种类型:①淋巴细胞型:胸腺瘤组织中,淋巴细胞成分超过66%;②上皮细胞型:胸腺瘤组织中,上皮细胞成分超过66%;③淋巴、上皮细胞混合型:胸腺瘤组织中,淋巴细胞和上皮细胞所占的比例相同;④梭形细胞型:为上皮细胞型的一个亚型。
胸腺瘤的各种组织类型中,淋巴细胞型约占22%,上皮细胞型约占27%。
淋巴、上皮细胞混合型约占50%,梭形细胞型所占比例最少。
1985年,Marino等根据显微镜下肿瘤胸腺上皮细胞的形态,将胸腺瘤分为三种组织学类型:①皮质型:由中等到较大的上皮细胞组成,核呈圆形或卵圆形,染色质细而分散,核仁位于中央。
胞浆不清楚。
肿瘤内有许多不成熟的淋巴细胞。
②髓质型:由小到中等的上皮细胞组成,核的形状不规则,多呈梭形,没有核仁。
肿瘤内淋巴细胞数量较少,且都是成熟的T 细胞。
③混合型:由皮质型和髓质型两种成分组成。
该分类方法公布后,越来越受到重视,逐渐为临床所接受。
肉眼看,胸腺瘤呈圆形或椭圆形,体积大小不一。
肿瘤质地软,颜色为深褐色或灰红色。
肿瘤可有分叶,其间有明显的灰白色纤维组织间隔。
除了整个胸腺组织已被胸腺瘤组织所取代外,绝大多数胸腺瘤与正常胸腺组织相接壤。
胸腺瘤中,可经常见到各种退行性变,如出血、钙化和囊性变等。
胸腺瘤的大体形态特征中,最重要的是肿瘤的包膜是否完整以及肿瘤是否侵及邻近的正常器官。
所有胸腺瘤中,良性胸腺瘤即包膜完整的非浸润型胸腺瘤所占的比例大约是40%~70%。
偶尔,这些包膜完整的非浸润型胸腺瘤,显微镜下却发现肿瘤细胞已经浸润到包膜或包膜外,这类胸腺瘤应归为恶性浸润型胸腺瘤。
2021年CSCO BC诊疗指南更新:三阴性乳腺癌术前新辅助治疗更新要点(全文)

2021年CSCO BC诊疗指南更新:三阴性乳腺癌术前新辅助治疗更新要点(全文)2021全国乳腺癌大会暨中国临床肿瘤学会乳腺癌(CSCO BC)年会以“线上+线下”形式,于4月9日在北京顺利开幕。
CSCO BC年会是国内乳腺癌领域最具影响力的学术盛会之一。
术前新辅助治疗适应证满足以下条件之一者可选择术前新辅助药物治疗:肿块较大(>5cm)、腋窝淋巴结转移、HER2阳性乳腺癌、三阴性乳腺癌、有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者。
注释:1.若乳腺原发肿物大小2.0~5.0cm之间,应综合其他生物学指标选择是否先行药物治疗;2.专家组成员认同,仅以HER2阳性或三阴性乳腺癌,作为乳腺癌术前新辅助药物治疗选择的标准时,肿瘤应大于2cm;或可以加入严格设计的临床研究。
新辅助治疗的适应证不再仅仅依据临床分期,而应结合肿瘤分子分型、临床分期及患者意愿个体化确定。
三阴性乳腺癌新辅助治疗策略更新要点:I级推荐中新增TP方案;II级推荐中,新增参加严格设计的临床研究。
I级推荐:1.蒽环联合紫杉方案:TAC方案(1A);AT方案(2A)2.TP方案(2A)II级推荐:1. AC-T方案(1B)2. 参加严格设计的临床研究,如含白蛋白紫杉醇联合PD-1/PD-L1抑制剂。
TNBC新辅助治疗铂类应用的价值既往多项研究探索了紫杉类序贯蒽环类标准新辅助治疗±铂类是否能提升完全病理缓解(pCR)率。
结果显示,紫杉序贯蒽环+铂类仍能提高pCR率,pCR率约能提高到50%以上。
GALGB 40603和GeparSixto两项研究探索了新辅助治疗加入铂类后的长期生存获益。
结果相反,前者不能带来生存获益,后者可带来长期生存获益。
因此,长期生存获益的不一致性导致了铂类是否可用于新辅助治疗一直备受争议。
少数研究探索了紫杉+铂类用于新辅助治疗的疗效。
WSG-ADAPT TN 研究旨在评估白蛋白紫杉醇+卡铂对比白蛋白紫杉醇+吉西他滨用于早期三阴性乳腺癌的疗效。
【指引V来】江泽飞教授:2021CSCO乳腺癌诊疗指南更新解读!

【指引V来】江泽飞教授:2021CSCO乳腺癌诊疗指南更新解读!编者按:基于MONARCH plus研究在中国人群中的优异结果,阿贝西利两项适应症在我国获批。
与此同时,CSCO BC大会上发布的《CSCO乳腺癌诊疗指南2021》中,对于HR阳性绝经后晚期TAM、NSAI和SAI治疗失败的患者,阿贝西利氟维司群均为Ⅰ级推荐。
《肿瘤瞭望》特邀解放军总医院第五医学中心江泽飞教授对该指南推荐进行了解读,以帮助临床医生更好学习、理解指南。
更多内容,请戳视频☟《肿瘤瞭望》:2021年中国临床肿瘤学会(Chinese Society of Clinical Oncology, 简称CSCO) 乳腺癌诊疗指南发布。
请问此次《CSCO乳腺癌诊疗指南2021》更新的指导方针和理念是什么?江泽飞教授:《CSCO乳腺癌诊疗指南2021》一如既往地遵循证据,兼顾可及性。
过去的2020年是不平凡的一年,受新冠疫情影响,大家工作重点都在围绕疫情开展,因此许多工作都暂时被搁置。
但指南编写委员会及各指南小组的工作却丝毫没有被耽误,专家和同道们在防疫抗疫的工作之余,积极投入到指南讨论、撰写、执笔、校对的工作中,才使得我们各领域新版指南能准时出版发布。
与此同时,自指南发布后,我们快速印刷了一批指南并及时发送到医生手中,使他们能第一时间学习指南,并应用指南指导临床实践。
《肿瘤瞭望》:激素受体阳性晚期乳腺癌患者约占整体晚期患者的60%,请问针对这部分患者诊疗,2021版指南有哪些更新?这些更新基于什么背景与考量?江泽飞教授:激素受体阳性乳腺癌患者生存期较长,疾病进展较为缓慢。
随着CDK4/6抑制剂、HDAC抑制剂等靶点药物的出现及在国外上市,我国乳腺癌患者的治疗也逐渐受到影响。
继第一个CDK4/6抑制剂上市后,第二个CDK4/6抑制剂阿贝西利也在我国获批适应症。
此外,在HDAC这一通路上,许多研究也在进行中,相信未来更多产品也会面世。
基于当前产品的多元化及各项研究所得到的结果和结论,《CSCO 乳腺癌诊疗指南2021》激素受体阳性部分药物进行了细化,并对不同药物等级进行了相应推荐,明确提出了哪种情况下需要进行联合治疗。
中国抗癌协会乳腺癌诊治指南与规范(2021年版)

中国抗癌协会乳腺癌诊治指南与规范(2021年版)近年来,乳腺癌在全球范围内发病率逐年上升,成为女性最常见的恶性肿瘤之一,对女性健康带来巨大恐吓。
为了推行乳腺癌的早期诊断与规范化治疗,保障患者的生命安全和生活质量,中国抗癌协会制定并发布了乳腺癌诊治指南与规范,不息完善诊断、治疗和护理等方面的指导,以期提高乳腺癌患者的生存率和生活质量。
一、预防与筛查乳腺癌是一种可以通过早期筛查和发现的癌症,在指南中,中国抗癌协会鼓舞女性自我检查乳房,了解乳腺癌早期症状,并定期进行临床乳房检查。
尤其对于高风险人群,如有家族性乳腺癌史、BRCA1和BRCA2基因突变等,应定期进行乳腺核磁共振检查,以便尽早发现病变。
此外,乳腺癌筛查中的其他影像学方法如乳腺钼靶、超声检查和乳腺造影等,也都在指南中进行了详尽阐述,以便医生和患者参考。
二、诊断与分期指南强调早期诊断的重要性,建议医生应运用现代化的乳腺影像学技术进行细致的乳腺癌筛查和综合评估,为患者进行早期致病最少侵略性的手术切除。
在乳腺癌诊断方面,不仅依靠细针穿刺活检、乳房穿刺骨针活检、深部组织影像引导穿刺活检等方式明确诊断,还结合病理学分型和分子生物学标志物等进行个体化诊治方案的制定。
乳腺癌分期是治疗和预后评估的重要依据。
指南对乳腺癌分期进行了详尽诠释,并提供了最新的TNM分期系统。
通过明确分期,有助于选择合适的手术方式、帮助治疗和转移病灶的评估,为乳腺癌患者提供更精准、个体化的治疗方案。
三、手术治疗与综合治疗乳腺癌的手术治疗是早期乳腺癌患者的主要治疗方式之一。
依据患者的病情和身体状况,指南中给出了针对性的手术方案,包括乳腺保留术、乳腺切除术和乳房重建等手术技术。
对于有淋巴结转移的患者,还明确了腋窝淋巴结消除的条件与适应症。
综合治疗是依据患者不同的分子表型、肿瘤特征和分期状况,结合化学、内分泌和靶向治疗等手段,从全身治疗的角度出发,提供更有效的治疗方案。
指南中详尽介绍了各种治疗方法的适应症、禁忌症、毒副作用与风险管理等,援助医生和患者做出更明智的治疗决策。
中国临床肿瘤学会更新多部肿瘤诊疗指南

中国当代医药2021年6月第28卷第17期-封面报道-帼临床肿瘤学会更新多部肿瘤诊疗指南文图/《中国当代医药》主笔潘锋“中国临床肿瘤学会(CSCO)指南大会”4月23日〜24日在北京举行,今年CSCO更新了鼻咽癌、分化型甲状腺癌、非小细胞肺癌、卵巢癌等23部指南,同时发布了神经内分泌肿瘤、中枢神经系统转移肿瘤等10部指南遥CSCO副理事长兼秘书长、解放军总医院肿瘤医学部江泽飞教授说:“今年是CSCO发布与更新指南数量最多的一年,随着指南制定经验的积累,CSCO各项肿瘤诊疗指南充分结合了国内外研究最新进展与我国医疗国情,已经成为具有中国特色的普适性指南和临床医生日常工作的重要参考书。
”CSCO副理事长、东部战区总医院秦叔逵教授介绍说,医学的发展经历从经验医学、实验医学到循证医学以及向精准医学发展的阶段,循证医学有三大核心,第一要积极寻求和应用最新最好的研究证据,第二要结合临床专家、医务人员的个人经验和专业知识,第三要以人为本,充分尊重患者甚至患者家属的意愿。
其中大规模随机对照的高级别临床研究及其系统评价是形成专家共识和指南并用于指导临床应用的重要组成,CSCO 指南反映了国内外最新的研究进展,同时也能更好地规范肿瘤诊疗行为。
加强ICIs毒性管理免疫检查点抑制剂渊ICIs)近年来在多个肿瘤治疗领域得到应用,但其毒性问题也备受临床关注。
山东第一医科大学第一附属医院王俊教授分别从目录、特殊人群筛查与基线检查、毒性管理和毒性监测以及附录4个部分,对2021版《CSCO免疫检查点抑制剂相关的毒性管理指南》的更新内容进行了解读。
王俊教授介绍说,新版指南对目录进行了调整,新增胰腺毒性管理章节,常见与少见的毒性管理由原来的13节增加至14节,分为常见毒性和少见毒性两大类,常见9种毒性分别是内分泌毒性、反应性皮肤毛细血管增生症(RCCEP)、肺毒性、肝脏毒性、胃肠毒性、胰腺毒性、输注反应、骨关节与肌毒性、皮肤毒性;5种少见毒性分别是眼毒性、神经毒性、心脏毒性、血液毒性、肾脏毒性,同时在附录中增加常用免疫抑制剂的用法、用量和适应证。
《中国恶性胸膜间皮瘤临床诊疗指南(2021版)》主要内容

《中国恶性胸膜间皮瘤临床诊疗指南(2021版)》主要内容间皮瘤是一种来源于胸膜或其他部位间皮细胞的罕见肿瘤,其中来源于胸膜的约占81%,其他部位包括腹膜、心包和睾丸鞘膜等。
恶性胸膜间皮瘤(MPM)初诊时多为晚期,治疗困难,疗效欠佳,患者中位总生存时间约为1年,5年生存率约为10%,治愈病例罕见。
MPM的主要发病人群为暴露于石棉的老年男性(确诊中位年龄为72岁),暴露人群常于暴露于石棉的20~40年后发病。
一、发病率和病因(一)发病率2020年全球恶性间皮瘤新发病例数为30870例,占全球新发恶性肿瘤的0.2%,死亡病例数为26278例,占全球恶性肿瘤死亡病例数的0.3%。
(二)发病诱因1. 石棉:非职业性石棉暴露也是MPM发病的危险因素。
2. 电离辐射:3. 毛沸石:4. 基因突变:二、诊断(一)诊断的基本原则1. 临床特征:MPM常见症状包括气短、胸痛、咳嗽、失眠、乏力、食欲不振、体重减轻等。
MPM的临床症状常较其他肿瘤更为严重,MPM 病灶局限时患者即出现较明显的气短、胸痛。
2. 检查:筛查发现胸膜增厚者,推荐胸部增强CT检查以及病理或细胞学检查以明确诊断,也可监测可溶性间皮素相关肽水平,可溶性间皮素相关肽水平可能与MPM有关。
3. 鉴别诊断:MPM主要需要与良性胸膜病变和其他恶性肿瘤胸膜转移(如肺癌、肉瘤和其他实体肿瘤等)进行鉴别。
(二)病理诊断(三)影像诊断不常规推荐采用低剂量螺旋CT筛查MPM。
MPM的正确分期需要影像学检查和有创操作性探查相结合,分为无创性(非侵入性)检查和有创性(侵入性)检查,无创性检查包括CT、磁共振成像(MRI)、超声、正电子发射计算机断层扫描(PET-CT)或PET-MRI 等;有创性检查包括气管镜、胸腔镜、纵隔镜和腹腔镜等。
推荐首先采用胸腹部增强CT进行临床分期,胸部MRI 对于评估胸壁、脊柱、膈肌或血管病变有更高的灵敏度,尤其对于有碘造影剂禁忌证的患者可选择胸部MRI。
最新2021版NCCN乳腺癌指南更新要点(全文)
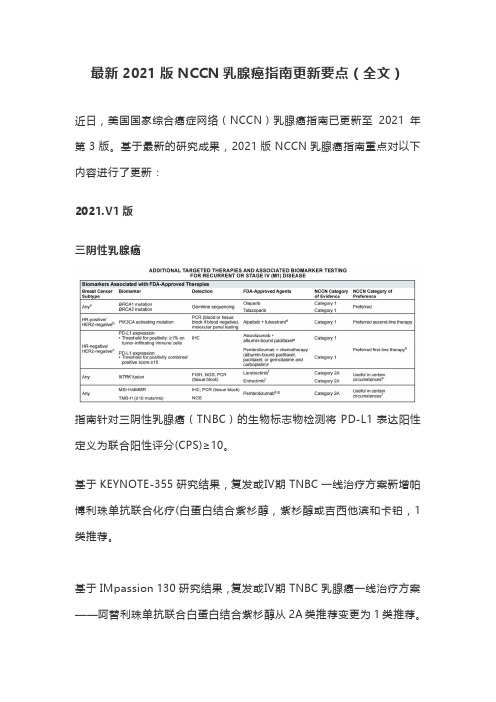
最新2021版NCCN乳腺癌指南更新要点(全文)近日,美国国家综合癌症网络(NCCN)乳腺癌指南已更新至2021年第3版。
基于最新的研究成果,2021版NCCN乳腺癌指南重点对以下内容进行了更新:2021.V1版三阴性乳腺癌指南针对三阴性乳腺癌(TNBC)的生物标志物检测将PD-L1表达阳性定义为联合阳性评分(CPS)≥10。
基于KEYNOTE-355研究结果,复发或Ⅳ期TNBC一线治疗方案新增帕博利珠单抗联合化疗(白蛋白结合紫杉醇,紫杉醇或吉西他滨和卡铂,1类推荐。
基于IMpassion 130研究结果,复发或Ⅳ期TNBC乳腺癌一线治疗方案——阿替利珠单抗联合白蛋白结合紫杉醇从2A类推荐变更为1类推荐。
指南指出,虽然一线治疗已有数据,但是如果之前没有使用过PD-L1抑制剂治疗,那么这些方案可用于二线及其后续治疗。
如果使用PD-L1抑制剂治疗时疾病进展,那么没有数据支持使用其他PD-L1抑制剂进行下一线的治疗。
HR阳性乳腺癌对于芳香酶抑制剂5年+卵巢抑制或切除的绝经前激素受体(HR)阳性的乳腺癌患者,指南新增考虑再用芳香酶抑制剂3~5年。
对于接受芳香酶抑制剂辅助治疗的绝经后(自然或诱发)HR阳性患者,考虑双膦酸盐或地舒单抗辅助治疗。
HER2阳性乳腺癌以下从“首选方案”移至“某些情况下有用”:AC→TH(多柔比星+环磷酰胺→紫杉醇+曲妥珠单抗,各种疗程);AC→THP(多柔比星+环磷酰胺→紫杉醇+曲妥珠单抗+帕妥珠单抗,各种疗程)删除脚注:回顾研究证据表明,对于HER2阳性肿瘤患者,蒽环类化疗方案可能优于非蒽环类方案。
修改脚注e:由于医学原因(例如过敏反应),对于某些患者,紫杉类(例如多西他赛、紫杉醇、白蛋白结合紫杉醇)可以互相替代。
如果替代每周紫杉醇或多西他赛,那么紫杉醇每周剂量不应超过125mg/m²。
(删除白蛋白结合紫杉醇)。
对于复发或IV期的HER2阳性乳腺癌的全身治疗,在其他推荐方案中,恩美曲妥珠单抗(T-DM1)改为1类推荐意见。
2021版CSCO乳腺癌指南:HER2+早期乳腺癌新辅助治疗更新要点解读(全文)

2021版CSCO乳腺癌指南:HER2 +早期乳腺癌新辅助治疗更新要点解读(全文)2021版CSCO乳腺癌指南关于HER2 +早期乳腺癌术前新辅助治疗的更新聚焦于三方面:新辅助治疗适应证、新辅助治疗I级推荐、新辅助治疗后辅助治疗选择。
新辅助治疗适应证:将临床分期与分子分型相结合作为依据2021版CSCO指南仍然强调,术前新辅助治疗的适应证应结合肿瘤分子分型、临床分期及患者意愿个体化确定。
这一理念也是CSCO于2018年率先在国内提出的,即对于HER2 +乳腺癌的患者,若肿瘤二2cm(T>2)或有淋巴结转移(N>1 ),推荐给予新辅助治疗。
满足以下条件之一者可选择术前新辅助药物治疗:1. 肿块较大(> 5cm )2. 胶窝淋巴细够3. HER-2阳性4. 三阴性新辅助治疗的适应证不再仅仅依据临床分期,而应结合肿瘤分子分型、临床分期及患者意愿个体化确定5.有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者注O:1. 若孚扇原发月黝大小2.0~5.0cm之间,应综合其他生物学指标选择是否先行药物治疗.2. 专家组成员认同,仅以HER-2阳性或三阴性,作为乳腺癌术前新辅助药物治疗选择的标准时,肿瘤应大于2cm ;或可以加入严格设计的临床硏究.图1 2021版CSCO指南关于术前新辅助治疗的适应证对于美国国家综合癌症网络(NCCN)指南,2018版仍然仅依据临床分期确定新辅助治疗适应证;2020版和2021版则指出,对于HER2 +、三阴性乳腺癌,若"2或N",推荐给予新辅助治疗。
可见,CSCO指南提出的分子分型与临床分期相结合的理念比NCCN 指南早了 2 年。
NCCN 指南(2018版)NCCN Guidelines Version 3.2018 Invasive Breast CancerPREOPERATIVE 8Y8TEMIC THERAPY FOR OPERABLE DISEASE WORKUP CLINICALSTAGE图2 2018版和2020版NCCN 指南推荐然而,2021版美国临床肿瘤学会(ASCO )指南指出,对于T1a 和T1b 的患者,不应常规给予新辅助治疗。
中国胸腺上皮肿瘤临床诊疗指南护理课件

放疗
放疗适应症
放疗主要用于手术切除不彻底或 无法手术的患者,以及术后辅助
治疗。
放疗方式
放疗包括常规放疗、立体定向放疗 和调强放疗等,根据病情选择合适 的方式。
放疗副作用
放疗可能导致疲劳、恶心、呕吐、 骨髓抑制等副作用,需密切监测并 及时处理。
化疗
化疗适应症
化疗主要用于晚期或转移性胸腺 上皮肿瘤的治疗,以及术后辅助
营养支持
合并症管理
评估患者的营养状况,对营养不良的患者 进行适当的营养补充,以提高手术耐受性 。
对患者的合并症(如高血压、糖尿病等) 进行评估和控制,确保手术安全。
术中护理
监测生命体征
在手术过程中,密切监 测患者的生命体征,确
保手术顺利进行。
体位管理
根据手术需要,协助医 生调整患者的体位,并 注意保护患者的皮肤和
治疗。
常用药物
常用的化疗药物包括顺铂、异环 磷酰胺、阿霉素等,根据病情选
择合适的药物和剂量。
化疗副作用
化疗可能导致恶心、呕吐、骨髓 抑制、肝肾损伤等副作用,需密
切监测并及时处理。
其他治疗
免疫治疗
免疫治疗如PD-1抑制剂等在胸腺上皮肿瘤中取得了一定的疗效, 可用于辅助治疗或复发后的治疗。
靶向治疗
针对特定基因突变或受体阳性的胸腺上皮肿瘤,可采用靶向治疗, 如曲妥珠单抗等。
分类
根据组织学特点,胸腺上皮肿瘤 可分为良性、交界性和恶性三类 。
流行病学特点
发病率
胸腺上皮肿瘤在人群中的发病率较低,但随着诊 断技术的提高,近年来发病率有所上升。
发病年龄
胸腺上皮肿瘤可发生于任何年龄段,但以中老年 人群较为多见。
性别差异
胸腺上皮肿瘤

大体和镜下均无包膜受累。 大体见肿瘤累及周围脂肪或纵隔胸 膜,镜下累及包膜。 大体见累及邻近器官。
累及胸膜和心包。 远处淋巴或血行转移。
第7页/共24页
不同期别胸腺瘤生存情况
期别 I II III IV
5年生存率 96%-100% 86%–95% 56%–69% 11%–50%
Shamji et al,J Thorac Cardiovasc Surg 1984;87:43–47
第18页/共24页
侵袭性胸腺瘤发生肺内转移
并非手术禁忌 在切除原发瘤的同时切除肺内转移瘤 术式:肺楔形切除、肺段切除、肺叶切除 年青患者在根治性的前提下可以考虑行全肺切除术
第19页/共24页
侵袭性胸腺瘤伴有上腔静脉综合征: 一般不宜手术治疗,应进行放疗或化疗
肿瘤种植引起胸腔积液或心包积液: • 不考虑外科手术 • 有报道行胸膜肺切除术及胸腺切除术
第8页/共24页
WHO胸腺肿瘤国际肿瘤学分类(1999)
胸腺上皮肿瘤 A型 AB型 B1型
B2型 B3型 C型
梭形细胞,髓质型 混合性 富于淋巴细胞;淋巴细胞性; 皮质优势性 皮质型 上皮性;鳞样;高分化胸腺癌
胸腺癌Βιβλιοθήκη 第9页/共24页影像学表现
• 前上纵隔,升主动脉、右室流出道和肺动脉上方血管前间隙 • 一侧性生长(胸腺增生鉴别) • 半数有囊变,少数有钙化(蛋壳样)、出血、坏死 • 分叶状形态、纵膈脂肪及大血管受侵高度提示侵袭性胸腺瘤。
第20页/共24页
影响手术疗效的因素
• 上腔静脉综合征是预后不良的标志 • 肿瘤的组织学类型 • 合并MG的病人手术疗效和预后较好 • 根治性手术优于姑息性手术或活检手术
术后是否放化疗亦是影响生存率的因素
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021版:中国胸腺上皮肿瘤临床诊疗指南(全文)中国胸腺肿瘤是一种罕见的胸部肿瘤类型,世界卫生组织将其划分为胸腺上皮肿瘤,包括胸腺瘤和胸腺癌。
中国胸腺肿瘤的发病率略高于欧美国家,约为4.09/100万。
对于可手术切除的胸腺上皮肿瘤,优先推荐手术完全切除,术后或辅助以放化疗。
而晚期不可切除的胸腺上皮肿瘤,治疗方式以放化疗为主,但缺乏标准的一、二线治疗方案。
近年来,靶向治疗药物和免疫检查点抑制剂在胸腺上皮肿瘤中展现出了一定的治疗前景。
目前,XXX肿瘤的诊疗尚无指南发布。
因此,XXX肿瘤多学科诊疗专业委员会对国内外胸腺上皮肿瘤的研究进展进行了认真分析和讨论,并对胸腺上皮肿瘤的诊断、治疗和预后等方面进行总结,制定了中国胸腺上皮肿瘤临床诊疗指南(2021版),以供临床医师参考。
胸腺肿瘤是一种罕见的肿瘤,通常位于前纵隔。
根据世界卫生组织的病理学分类,它被划分为胸腺上皮肿瘤,其发病率为1.3~3.2/100万。
在2019年中国肿瘤登记年报中,上报2016年肿瘤数据登记处为682个,质量控制后共纳入487个肿瘤登记处,覆盖人口3.8亿。
筛选胸腺恶性肿瘤(国际疾病分类ICD10编码为C37)的新发病例为1562例,发病率约为4.09/100万,标化发病率(Segi′s世界标准人口)为2.73/100万,高于欧美国家。
根据美国监测、流行病学和最终结果数据库,北美的胸腺肿瘤发病率为2.14/100万,胸腺肿瘤在亚裔人中的发病率(3.74/100万)高于高加索族裔(1.89/100万)。
2016年中国胸腺上皮肿瘤死亡710例,死亡率1.86/100万,标化发病率(Segi′s世界标准人口)为1.20/100万,2000年始至今发病率呈波动性增高趋势。
胸腺肿瘤的诊断基于临床表现和医学检查。
胸腺肿瘤的起病隐匿,当肿瘤体积较小时,患者常无体感症状;随着肿瘤增大,患者首发表现为纵隔局部压迫症状,如胸闷、气短、头面部肿胀感等。
约1/3的胸腺瘤患者伴有自身免疫性疾病,其中最常见的伴发疾病为重症肌无力。
重症肌无力在AB型、B1型和B2型胸腺瘤中最为常见,多与抗乙酰胆碱受体抗体有关。
其他常见伴发疾病包括纯红再生障碍性贫血(5%)和低γ球蛋白血症(5%)。
二、治疗一)手术治疗手术切除是胸腺肿瘤的主要治疗方法。
对于早期胸腺瘤,手术切除是治疗的首选。
对于大多数胸腺癌,手术切除是唯一的治疗方法。
对于手术不可行的患者,放疗和化疗是可选的治疗方法。
手术切除的方式包括胸骨前开胸和腔镜手术。
胸骨前开胸手术是最常见的手术方式,但腔镜手术在近年来也得到了广泛应用。
手术切除后,需要对患者进行随访以监测复发和转移。
三、预后胸腺肿瘤属于惰性肿瘤,即使疾病进展后,部分胸腺瘤患者的生存时间仍较长,5年生存率接近90%。
因此,建议针对胸腺肿瘤开展较长时间的随访(如10年),以便更好地了解患者总生存时间(overall survival。
OS)和复发状况。
但是,胸腺癌常伴有远处转移,患者5年生存率约为55%。
因此,早期诊断和治疗非常重要。
在初步诊断胸腺瘤的过程中,需要对患者的自身免疫性疾病进行评估。
临床诊断需要综合分析完整的病史、体格检查、神经系统检查以及实验室和影像学检查结果。
如果患者出现了自身免疫性疾病并伴有前纵隔肿块,需要考虑胸腺瘤的可能性。
胸腺癌患者常常会出现非特异性的局部刺激或压迫症状,如肿瘤侵及肺和支气管时,患者可能会出现剧烈咳嗽、呼吸困难等症状;肿瘤压迫交感神经时,可能会引起Horner综合征;肿瘤压迫喉返神经时,可能会导致声音嘶哑;当上腔静脉受压时,可能会引起上腔静脉阻塞综合征。
胸腺肿瘤的诊断需要与前纵隔其他类型肿瘤和非恶性胸腺病变相鉴别。
胸腺上皮肿瘤是前纵隔肿物的最常见原因,约占前纵隔肿物的35%;其次为淋巴瘤(结节硬化型霍奇金淋巴瘤或弥漫大B细胞型非霍奇金淋巴瘤),约占25%;生殖细胞肿瘤(畸胎瘤或精原细胞瘤或非精原细胞瘤)约占20%。
淋巴瘤患者常表现为无痛性淋巴结肿大,伴或不伴乳酸脱氢酶升高;畸胎瘤影像学上表现为密度不均匀的肿块,呈脂肪和囊性改变。
精原细胞瘤和非精原细胞瘤瘤体较大,精原细胞瘤常伴有血清β-人绒毛膜促性腺激素升高,非精原细胞瘤则常伴有甲胎蛋白升高。
转移癌最常见的为肺癌转移。
区分胸腺恶性肿瘤与生理性胸腺增生存在一定难度。
应激、损伤、化疗、放疗、抗激素治疗或皮质激素治疗后可能导致胸腺反应性增生。
胸腺淋巴增生最常见于重症肌无力患者,但也可见于甲状腺功能亢进、结缔组织病或血管疾病等患者。
在病理上,胸腺肿瘤被归类为上皮肿瘤,以上皮细胞和淋巴细胞的结合为特征。
胸腺癌具有恶性细胞特征,而胸腺瘤在细胞学角度一般被认为是偏良性病变。
胸腺癌是一种少见的上皮来源恶性肿瘤,较胸腺瘤更具侵袭性。
胸腺癌占胸腺肿瘤发病率的15%左右,胸腺癌患者的发病率和生存时间均明显低于胸腺瘤患者。
胸腺癌最常见的细胞组织类型为鳞状细胞癌、淋巴上皮癌和未分化癌。
2015年,XXX将胸腺上皮肿瘤分为6个亚型,分别为A 型、AB型、B1型、B2型、B3型和C型。
这些亚型的分型反映了肿瘤的生物学行为和预后。
根据肿瘤组织不同亚型的生物学行为差异,将组织学分型简化为低危组、高危组和胸腺癌组三个亚型。
不同分组之间的治疗和预后存在一定差异。
组织病理分型和手术根治性切除是关系到患者预后的独立危险因素。
胸腺肿瘤的影像学评估标准检查是对胸部纵隔和胸膜进行从肺尖到肋膈隐窝的增强CT扫描。
CT在前纵隔肿物诊断方面与MRI相当或更优,但囊性病变除外。
胸腺瘤表现为前上纵隔边界清楚、有包膜、密度均匀的肿物。
然而,如果肿物出现出血、坏死或囊肿形成,则胸腺瘤在影像上的表现可以是多样的。
胸腺癌常会出现局部浸润,也可出现区域淋巴结转移和远处转移。
胸腺癌影像学上表现为大块边界不清、易引起渗出的前纵隔肿物,常伴有胸腔积液和心包积液。
胸腺瘤的影像学特征包括低衰减、对称和脂肪模式,保持胸腺的双锥体形状。
然而,很难通过CT评估胸腺肿物是否存在侵袭性。
但是,侵袭性肿物的影像学特征表现为血管损伤和周围肺组织分界不清。
如果CT诊断不明确,可以采用MRI 评估肿瘤对周围脂肪的浸润情况。
正电子发射计算机断层扫描(PET-CT)不常规推荐用于胸腺肿瘤的评估。
尽管B3型胸腺瘤和胸腺癌的摄取值可能偏高,但胸腺增生也可表现为高代谢活性。
对于进展期、晚期肿瘤可以选择PET-CT扫描用于评估远处转移情况。
胸腺上皮肿瘤的分期和治疗方案是非常重要的。
Masaoka-Koga分期系统是目前常用的分期系统,而TNM分期系统也被建议用于胸腺肿瘤的分期。
胸腺肿瘤的预后与手术切除的完整性密切相关,因此Masaoka-Koga分期仍然是制定治疗策略的主要依据之一。
胸腺上皮肿瘤的不同亚型和分期详见表1和表2.胸腺上皮肿瘤的治疗主要基于手术可切除性和完整性。
在XXX分期治疗方案尚未完善的情况下,Masaoka-Koga分期通常被用于指导临床治疗。
XXX分期和Masaoka-Koga分期存在一定的对应关系,可以结合二者综合考虑制定治疗策略。
胸腺瘤的TNM分期应该采用AJCC第八版,详见表3.病理分期需要经过镜下确认。
对于Masaoka-KogaⅠ期的胸腺瘤,手术治疗是首选。
对于完全切除的Ⅰ期胸腺瘤,不建议进行术后辅助治疗。
对于未完全切除的病灶,推荐进行术后放疗(50~54 Gy)。
如果术后病灶仍然明显残留,放疗剂量应该参照根治性放疗。
2.对于Masaoka-KogaⅡA期的胸腺瘤,手术治疗是首选。
对于R0切除的患者,国际指南推荐术后辅助放疗,但是这个建议仍然存在争议。
在与患者充分沟通后,通常认为A型和B1型胸腺瘤的术后辅助放疗指征较弱,而B2型和B3型的指征较强。
建议术后辅助放疗剂量为45~50 Gy。
对于R1切除的患者,推荐进行术后放疗,剂量建议为54~60 Gy。
3.对于Masaoka-KogaⅡB期的胸腺瘤,手术治疗也是首选。
对于R0切除的患者,国际指南推荐术后辅助放疗,但是这个建议仍然存在争议。
在与患者充分沟通后,通常认为A型和B1型胸腺瘤的术后复发风险较低,而B2型和B3型的风险较高。
建议术后辅助放疗剂量为45~50 Gy。
对于R1切除的患者,推荐进行术后放疗,剂量建议为54~60 Gy。
4.对于Masaoka-KogaⅢ~ⅣA期的胸腺瘤,对于可切除的患者,推荐直接手术治疗。
尽管缺乏高级别证据,大部分资料支持术后辅助放疗(45~50Gy)。
对于初始评估无法切除的患者,应先行新辅助化疗(优选蒽环为基础的方案)、新辅助放疗(40~50Gy)或新辅助放化疗,如果经新辅助治疗后肿瘤转化为可切除病灶,可选择手术治疗。
如果术前未行新辅助放疗,则建议术后进行辅助放疗(45~50 Gy)。
如果病灶为不完全(R1~R2)切除,则应进行局部残留区域加量放疗。
如果经诱导治疗后仍不可切除或R2切除,则建议进行根治性放疗(60 Gy)或选择同步放化疗。
对于病灶不可切除者,也可初始选择同步放化疗(铂类和依托泊苷,60 Gy)。
5.对于Masaoka-KogaⅣB期的胸腺瘤,化疗为主要的综合治疗方法。
如果经过化疗后,病灶转化为可切除病灶,可以考虑手术或放疗。
如果原发灶和转移灶均可接受根治性放疗,建议进行同步放化疗。
如果化疗后有局部残留病灶或者局部症状较重,可以进行姑息放疗以缓解症状。
综合治疗原则:1.对于Masaoka-KogaⅠ期的胸腺瘤,手术治疗是首选。
对于R0切除的患者,可以考虑术后辅助放疗(45~50 Gy);对于R1切除的患者,推荐进行术后放疗(50~54 Gy)。
2.对于Masaoka-KogaⅡ期的胸腺瘤,手术治疗是首选。
对于R0切除的患者,可以考虑术后辅助放疗(45~50 Gy);对于R1切除的患者,推荐进行术后放疗(50~54 Gy),并可以考虑术后辅助化疗。
3.对于Masaoka-KogaⅢ~ⅣA期胸腺瘤(癌)患者,如果病灶可切除,建议进行手术治疗,并术后进行辅助放疗(45~50Gy)和局部区域加量,可以考虑术后辅助化疗。
如果初始评估无法切除病灶,应先进行新辅助化疗(优选蒽环为基础的方案)、新辅助放疗(40~50Gy)或新辅助放化疗。
如果经过治疗后肿瘤转化为可切除病灶,可以选择手术治疗。
如果术前未进行新辅助放疗,术后应进行辅助放疗(45~50Gy)。
对于R1~R2切除者,可以考虑给予局部残留区域加量放疗,并且可以考虑术后辅助化疗(R0或R1切除)。
如果病灶经过诱导治疗后仍然不可切除或为R2切除者,可以给予根治性放疗(60 Gy)或选择同步放化疗。
对于病灶不可切除的患者,也可以初始选择同步放化疗(铂类和依托泊苷,60 Gy)。
4.对于Masaoka-KogaⅣB期胸腺瘤(癌)患者,标准化疗是首选治疗。
如果化疗后仍有局部残留病灶,或者局部症状较重,可以考虑进行姑息放疗来缓解症状。
