1蛋白质分离纯化
4.1.1蛋白质地分离与纯化方法
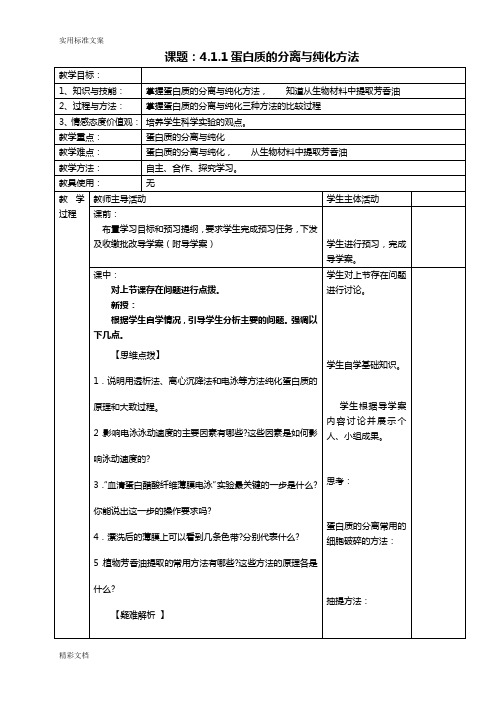
课题:4.1.1蛋白质的分离与纯化方法生物成分的分离与测定技术导学案一、学习目标:二、知道蛋白质的分离常用的细胞破碎的方法,蛋白质抽提方法,掌握蛋白质的分离与纯化方法。
二、知识构成:1.蛋白质的分离常用的细胞破碎的方法有:根据蛋白质的不同特性,分别可选择哪些抽提方法?、、蛋白质的纯化主要是根据之间以及之间在、、、等方面存在的差异进行的。
常用的方法包括、、等。
2.用电泳分离纯化蛋白质时,泳动速度主要取决于,即。
此外,、等因素对泳动速度也有影响。
3.血清蛋白醋酸纤维薄膜电泳的实验的基本步骤包括:、、、、、、、、、。
4.浸泡醋酸纤维薄膜前,用笔做记号是在(填“光泽面”或“非光泽面”);点样是在(填“光泽面”或“非光泽面”);平悬薄膜时,(填“光泽面”或“非光泽面”)朝上。
5.经电泳后,可以在薄膜上看到条色带,它们分别是、、、、。
'6.植物芳香油的提取方法有和等。
三、学法和自检:本节内容主要通过看书、分析蛋白质的提取、分离、纯化的不同方法。
动手试一试:[1]盐析法分离蛋白质的原理是( )A.破坏蛋白质的一级结构B.破坏蛋白质的二级结构C.破坏蛋白质水化膜而改变溶解度D.使蛋白质发生变性沉淀[2]利用透析法将蛋白质和其他小分子物质分离的原理是( )A. 利用蛋白质分子不能透过半透膜的特性B.利用蛋白质分子的水溶性C.利用蛋白质分子的胶体性D.利用蛋白质分子所带电荷[3].下列关于血清蛋白醋酸纤维薄膜电泳实验的说法不正确的是( )A.实验所用的巴比妥缓冲液的pH为8.6 B.点样是在薄膜的光泽面上进行的C.实验后可以得到五条色带D.整个实验最关键的步骤是点样[4].有一混合蛋白质溶液,各种蛋白质的pH分别为4.5、5.2、6.6、7.2,电泳时欲使其中三种泳向正极,则缓冲液的pH应该是( ) A.2.0 B.5.0 C.6.0 D.7.0四、、学习小结和课外作业:1、学习小结:2、上本作业:列举蛋白质粗提取时次报的破碎、蛋白质的抽提、纯化方法。
蛋白质的分离纯化(1)

白质的净电荷为零时的pH称等电点(pI)。
蛋白质等离子点: 没有其他盐类干扰时, 蛋白质质子供体基团解离出来
的质子数与质子受体基团结合的质子数相等时的pH称为等 离子点。
二、蛋白质的紫外吸收性质
蛋白质溶液能吸收一定波长的紫外光,主要是由带 芳香环的氨基酸决定的。其在280nm处对紫外吸收能力 的强弱顺序为:
电
电
泳
泳
方
方
向
向
等电聚焦电泳
SDS-PAGE
双向电泳后的凝胶经染色蛋白呈现二维分布图,水平方向反映 出蛋白在pI上的差异,而垂直方向反映出它们在分子量上的差别。
所以双向电泳可以将分子量相同而等电点不同的蛋白质以及等 电点相同而分子量不同的蛋白质分开。
5.层析聚焦(P310)
是根据蛋白质的等电点差异分离蛋白质混合物的柱层析方法。
(polyacrylaminde gel electrophoresis) 电泳
PAGE
样品浓缩成很薄的起始区带(0.1mm)
它以聚丙烯酰胺 凝胶为支持物,一般 制成凝胶柱或凝胶板 (不连续体系)。
浓缩胶 分离胶
凝胶的浓度(孔径大小)、 缓冲液组分和离子强度、 pH以及电场强度都是不同的
分离成单区带
依次洗脱收集后, 通过紫外吸收法测定吸 收峰。
这样大小不同的蛋白 质就被分离开来了。
(二)根据蛋白质溶解度不同的纯化方法
(蛋白质的胶体和沉淀性质)
主要方法: 1:等电点沉淀和PH值控制 2:蛋白质的盐溶和盐析 3:有机溶剂分级分离法 4:改变温度
1.等电点沉淀和PH值控制
即在不改变其它条件的情况下,PH处于等电点时的蛋白质 溶解度达到最低点。而位于等电点两侧的PH条件下蛋白质的溶
2009-1蛋白质的分离纯化)

目前经常使用的凝胶有
线形的 -1,6葡聚糖 交联葡聚糖 Sephadex 聚丙烯酰胺凝胶 (Bio-gel P) 1-氯-2,3-环氧丙烷
交联度大,网孔小,分级 分子量的范围偏窄,凝胶 颗粒吸水值也小,机械性 能好
商品名后的数字103为 该凝胶的排阻极限
丙烯酰胺(单体)
甲叉双丙烯酰胺(交联剂)
1、前处理:
动物材料:应先剔除结缔组织和脂肪组织
种子材料:应先去壳甚至去种皮以免受单宁等物质的污染, 油料种子:最好先用低沸点的有机溶剂如乙醚等脱脂。
组织和细胞的破碎
动物组织和细胞:
电动捣碎机(Waring blender) 匀浆器破碎 超声波处理(u1trasonication) 研磨的方法破碎 纤维素酶处理 超声波震荡 与砂研磨 高压挤压 溶菌酶处理(以分解肽聚糖)等
盐析沉淀的蛋白质保持着它的天然构象,能再溶解。
3、有机溶剂分级分离法
与水互溶的有机溶剂(如甲醇、乙醇和丙酮等)能使蛋白质 在水中的溶解度显著降低。 原因 改变了介质的介电常数
与蛋白质直接争夺水化水,致使蛋白质聚集而沉淀。
在室温下,这些有机溶剂不仅能引起蛋白质沉淀,而且伴 随着变性。
如果预先将有机溶剂冷却到−40℃至−60℃,然后在不
植物组织和细胞:
细菌细胞的破碎:
提取蛋白液
水溶性蛋白用中性缓冲溶液抽提, 酸性蛋白用稀碱性溶液抽提,
脂溶性蛋白用表面活性剂抽提等。
2、粗分级分离
盐析 方法 等电点沉淀 有机溶剂分级分离 蛋白质提取液体积较大,则可采用 超过滤 凝胶过滤 冷冻真空干燥 或其他方法(如聚乙二醇浓缩法) 特点 简便 处理量大 既能除去大量杂质(包 括脱盐),又能浓缩蛋 白质溶液
质存在于原液中,两次沉淀即可得到最大量的酶,而且由于在第
蛋白质的分离与纯化

(1)凝胶的选择:
。
(2)方法: 配置凝胶悬浮液:计算并称取一定量的凝胶浸泡于 中充分溶胀
后,配成
。
(3)凝胶色谱柱的装填方法
① 固定:将色谱柱处置固定在支架上
② 装填:将
一次性的缓慢倒入 内,装填时轻轻敲动色谱柱,
使凝胶填装均匀。
③ 洗涤平衡: 装填完毕后,立即用缓冲液洗脱瓶,在 高的操作压下,用
3、具体过程:
相对分子质量 较小的蛋白质
(1)
(2) (3) (4)
(5)
相对分子质量 较大的蛋白质
A B
A
的蛋白质由于
作用进入凝胶颗粒内部而被滞
留;
的蛋白质被排阻在凝胶颗粒外面,在了里之间
迅速通过。
B(1)
混合物上柱;
(2)洗脱开始,
的蛋白质扩散进入凝胶颗粒内;
的蛋白质被排阻于凝胶颗粒之外;
(3)
子
以及分子本身 、
的不同使带电分子产
生不同的
,从而实现样品中各种分子的分离。
3、分类: 琼脂糖凝胶电泳 聚丙稀酰胺凝胶电泳。
测定( 蛋白质相对分子质量 )通常用十二烷基硫酸钠(SDS)—聚丙稀酰胺凝胶
电泳。蛋白质在聚丙烯酰胺凝胶中的迁移率取决于它所带静电荷的多少以及分子的
大小等因素。为了消除静电荷对迁移率的影响可以在凝胶中加入
(4) 透析
2. 凝胶色谱制作
1)凝胶色谱柱的制作
① 取长40厘米,内径1.6厘米的玻璃管,两端需用砂纸磨平。
② 底塞的制作:打孔 挖出凹穴
安装移液管头部 覆
盖尼龙网,再用100目尼龙纱包好。
a、选择合适的的橡皮塞,中间打孔;
b、在橡皮塞顶部切出锅底状的 ,在0.5ml的 头部切
对蛋白质分离纯化的方法

对蛋白质分离纯化的方法
蛋白质分离纯化的方法有很多种,常用的方法如下:
1. 溶液的分离:利用差速离心、过滤或超滤等方法,将悬浮液或溶液中的蛋白质与其他组分分离开。
2. 色谱层析:将蛋白质溶液经过色谱柱,利用分子大小、电荷、亲疏水性等物理性质作用于柱内填充物,实现蛋白质的分离纯化。
3. 电泳:利用蛋白质在电场中的电荷性质以及大小和形状的差异,在凝胶电泳或毛细管电泳中进行分离纯化。
4. 凝胶过滤:利用凝胶的孔隙结构,根据蛋白质的分子大小将蛋白质分离开。
5. 亲和层析:利用蛋白质与亲和配体之间的特异性相互作用实现分离纯化。
6. 离子交换层析:利用蛋白质与离子交换树脂之间的电荷相互作用实现分离纯化。
7. 逆流电泳:利用蛋白质在电场中的电荷性质和溶液中的流动,通过逆流电泳系统实现蛋白质的分离纯化。
8. 蛋白质沉淀:利用加入盐、酸、有机溶剂等物质改变蛋白质的溶解度,使其沉淀下来。
以上是常用的蛋白质分离纯化方法,不同方法适用于不同的蛋白质特性和实验目的。
需要根据具体情况选择合适的方法进行操作。
蛋白质分离纯化的一般程序

蛋白质分离纯化的一般程序可分为以下几个步骤:(一)材料的预处理及细胞破碎分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。
所以要采用适当的方法将组织和细胞破碎。
常用的破碎组织细胞的方法有: 1. 机械破碎法这种方法是利用机械力的剪切作用,使细胞破碎。
常用设备有,高速组织捣碎机、匀浆器、研钵等。
2. 渗透破碎法这种方法是在低渗条件使细胞溶胀而破碎。
3. 反复冻融法生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。
这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。
4. 超声波法使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。
5. 酶法如用溶菌酶破坏微生物细胞等。
(二) 蛋白质的抽提通常选择适当的缓冲液溶剂把蛋白质提取出来。
抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。
如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100等),使膜结构破坏,利于蛋白质与膜分离。
在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。
(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。
比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。
常用的有下列几种方法:1. 等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。
2. 盐析法不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。
被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。
3. 有机溶剂沉淀法中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。
能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。
此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。
由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。
蛋白质分离纯化设计

蛋白质分离纯化设计1. 简介蛋白质分离纯化是一项重要的实验技术,在生物医药、食品科学、农业等领域有着广泛的应用。
通过对蛋白质进行分离纯化,可以获得单一纯度的蛋白质用于后续研究及应用。
本文将详细介绍蛋白质分离纯化的设计方法和常用技术,包括样品准备、分离方法选择、纯化步骤设计等。
同时,我们还将讨论常见的挑战和解决方案,以及如何评估分离纯化效果。
2. 样品准备在进行蛋白质分离纯化前,首先需要准备好样品。
样品的选择和准备对于后续分离纯化过程非常重要。
2.1 选择合适的样品样品可以来自细胞、组织、体液、培养基等。
在选择样品时,需要考虑到蛋白质的种类、表达水平、目标纯化程度以及后续实验需要。
2.2 样品预处理样品在分离纯化前需要进行预处理,以去除可能干扰纯化过程的杂质。
常用的预处理方法包括细胞破碎、离心、除去非蛋白质成分等。
预处理方法的选择应根据样品类型和后续纯化方法进行优化。
3. 分离方法选择根据蛋白质分离的原理和样品特性,我们可以选择合适的分离方法。
常见的分离方法包括离子交换层析、凝胶过滤、透析、亲和层析等。
3.1 离子交换层析离子交换层析是一种基于蛋白质带电性质的分离方法。
可以根据蛋白质的以阴离子或阳离子带电来选择合适的离子交换树脂,实现不同蛋白质的分离纯化。
3.2 凝胶过滤凝胶过滤是一种基于蛋白质大小的分离方法。
通过选择适当的孔径大小的凝胶,可以分离不同分子大小的蛋白质。
3.3 透析透析是一种基于蛋白质分子量和溶液成分的分离方法。
通过选择适当的膜材料和透析缓冲溶液,可以实现蛋白质与小分子化合物的分离。
3.4 亲和层析亲和层析是一种基于蛋白质与配体之间的特异性结合来分离纯化的方法。
选择合适的亲和配体,可以选择性地结合目标蛋白质,从而实现其分离纯化。
4. 纯化步骤设计在选择合适的分离方法后,需要设计纯化步骤来实现目标蛋白质的分离和纯化。
纯化步骤的设计应根据分离方法的特点和目标蛋白质的性质进行优化。
4.1 样品加载将预处理的样品通过适当的装载方式加载到分离纯化柱中,如使用注射器将样品缓慢注入。
蛋白质分离纯化的技术

蛋白质分离纯化的技术前言蛋白质是生物体内非常重要的大分子有机物质,具有各种生物学功能,如结构支持、催化反应、传递信息、运输物质及免疫防御。
而蛋白质的研究和应用,早已成为生命科学的热门领域。
然而,大多数生物体中的蛋白质都混杂着众多的其他大分子物质,为了研究或应用某种特定蛋白质,就需要将它从其它物质中分离纯化出来。
今天我们就要来讲一讲蛋白质分离纯化的技术。
一、蛋白质分离的基本原理蛋白质分离的基本原理是利用不同的性质来分离具有不同特性的蛋白质。
蛋白质的各种性质包括分子大小、分子形状、电荷、亲疏水性、氨基酸序列等。
根据这些不同的性质,分别选择不同的分离纯化方法,可以实现不同程度的分离纯化效果。
二、蛋白质分离纯化技术的分类根据分离方式的不同,蛋白质分离纯化技术可以分为以下几类:1. 分子筛层析:分子筛层析是根据蛋白质的分子大小、形状来进行分离,其原理是在一定的缓冲液中,将特定孔径大小的陶瓷或聚合物微球填充进层析柱,根据蛋白质的分子大小,从层析柱中流出不同的蛋白质。
这种方法可以使蛋白质得到较好的分离纯化,但需要考虑蛋白质的保护。
2. 表面等电聚焦(IEF):表面等电聚焦是根据蛋白质的等电点来进行分离,其原理是在聚丙烯酰胺凝胶电泳板上加上一组垂直于电泳方向的电场,在酸性一端放置一种酸性缓冲液,碱性一端放置一种碱性缓冲液,中间分别加入样品,蛋白质会在等电点处停留,使得不同等电点的蛋白质得到了分离和收获。
这种方法可以进行多品种、高分辨率的蛋白质分离。
3. 亲和层析:亲和层析是根据蛋白质与其他化合物的特异性相互作用进行分离,其原理是特定的化合物置于层析柱中,当特定的蛋白质与化合物结合时,蛋白质就可以纯化出来。
如在层析柱中放入钙离子,就可以纯化出骨钙蛋白,并且可以通过控制钙离子浓度来实现蛋白质的分离。
4. 透析:透析是将样品分子分离于透析膜之内或之外的方法。
通常将混合物放置于透析袋内,在培养基、缓冲液等适当环境中,透析袋内的小分子会从透析膜渗透出去,而较大的蛋白质则被留在透析袋内。
蛋白质的分离纯化

蛋白质的分离纯化一,蛋白质(包括酶)的提取大部份蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质那么溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采纳不同溶剂提取分离和纯化蛋白质及酶。
(一)水溶液提取法稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。
提取的温度要视有效成份性质而定。
一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。
但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。
为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。
下面着重讨论提取液的pH值和盐浓度的选择。
1、pH值蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH 范围内。
用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。
2、盐浓度稀浓度可促进蛋白质的溶,称为盐溶作用。
同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等中性盐,一般以摩尔。
升浓度为宜。
缓冲液常采用磷酸盐和碳酸盐等渗盐溶液。
(二)有机溶剂提取法一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的必然的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。
但必需在低温下操作。
丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶专门优越,一是因为丁醇亲脂性强,专门是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为%)可不能引发酶的变性失活。
另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。
蛋白质的分离、纯化

胰岛素的分离纯化
胰岛素是一种由胰腺分泌的激素, 具有降低血糖的作用。胰岛素的 分离纯化通常采用离子交换色谱
和结晶法。
胰岛素的分离纯化对于治疗糖尿 病具有重要意义。纯化的胰岛素 可以用于注射,帮助糖尿病患者
控制血糖水平。
在胰岛素的分离纯化过程中,需 要特别注意避免蛋白质的聚集和 变性,以确保产品的安全性和有
利用半透膜,根据不同物质之间的分 子大小和形状差异进行分离。
色谱分离
利用不同物质在固定相和流动相之间 的吸附、分配等作用力差异进行分离。
蛋白质的纯度鉴定
化学分析
电泳分析
利用蛋白质中的特定化学基团进行定量分 析,如测定氨基酸组成和序列、测定肽键 等。
利用不同蛋白质在电场中的迁移率差异进 行分离,再通过染色或放射自显影等技术 进行检测。
有机溶剂沉淀法
利用有机溶剂降低水的介电常数,使 蛋白质发生沉淀。常用的有机溶剂有 乙醇、丙酮等。
离心法
高速离心法
利用高速旋转产生的离心力使溶液中 的悬浮颗粒沉降,从而实现蛋白质的 分离。
超速离心法
在高速离心的基础上,利用密度梯度 离心技术,将不同密度的蛋白质进行 分离。
膜分离法
微滤
利用微孔滤膜,将溶液中的悬浮颗粒和微生物截留,从而实现蛋白质的分离。
蛋白质在水中的溶解度 受pH、离子强度、温度 等因素影响。不同蛋白 质具有不同的溶解度。
蛋白质的分离纯化方法
沉淀法
利用蛋白质的溶解度差异,通过改变 某些条件(如pH、离子强度、温度 等)使蛋白质沉淀析出。
离心分离
利用离心机的高速旋转产生的离心力, 根据不同物质之间的密度和沉降系数 差异进行分离。
膜分离
血红蛋白的分离纯化通常采用色谱技术,如凝胶过滤色谱和离子交换色谱。这些技术可以根据蛋白质 的大小、电荷和疏水性等性质进行分离。
蛋白质分离纯化的一般原则

蛋白质分离纯化的一般原则蛋白质是生物体内重要的功能分子,它们在细胞的结构和功能中扮演着重要角色。
蛋白质的纯化和分离是研究蛋白质结构和功能的基础。
本文将介绍蛋白质分离纯化的一般原则和方法。
蛋白质分离纯化的一般原则是根据蛋白质的物理化学性质进行选择性分离。
蛋白质具有不同的分子量、电荷、溶解性、亲疏水性等特性,可以通过这些特性来实现蛋白质的分离纯化。
蛋白质分离纯化的第一步是提取蛋白质。
提取蛋白质的方法有多种,常见的包括机械破碎、超声波破碎、溶剂提取等。
提取蛋白质的目的是将其从细胞或组织中释放出来,为后续的分离纯化步骤做准备。
蛋白质的分离纯化可以通过多种方法来实现。
其中最常用的方法是色谱技术。
色谱技术基于蛋白质的物理化学性质,将混合溶液中的蛋白质分离开来。
常见的色谱技术包括凝胶过滤色谱、离子交换色谱、亲和色谱、逆相色谱等。
凝胶过滤色谱是一种基于蛋白质分子量的分离方法。
其原理是通过孔径大小选择性地分离不同分子量的蛋白质。
凝胶过滤色谱常用于蛋白质的初步分离和浓缩。
离子交换色谱是一种基于蛋白质电荷的分离方法。
其原理是通过蛋白质与离子交换基质之间的相互作用来实现分离。
离子交换色谱可以根据蛋白质的电荷性质选择性地分离不同电荷的蛋白质。
亲和色谱是一种基于蛋白质与亲和基质之间的特异性相互作用来实现分离的方法。
亲和色谱可以利用蛋白质与亲和基质之间的特异性结合,选择性地分离目标蛋白质。
逆相色谱是一种基于蛋白质亲疏水性的分离方法。
其原理是利用蛋白质与逆相基质之间的亲疏水作用来实现分离。
逆相色谱可以根据蛋白质的亲疏水性选择性地分离不同性质的蛋白质。
还有一些其他的蛋白质分离纯化方法,如电泳、超高速离心、超滤等。
这些方法在特定的实验条件下可以实现蛋白质的分离纯化。
蛋白质分离纯化的一般原则是根据蛋白质的物理化学性质进行选择性分离。
通过选择合适的分离纯化方法,可以有效地分离出目标蛋白质,并去除其他杂质。
蛋白质的纯化程度越高,其质量和活性也就越好,对于后续的研究和应用具有重要意义。
蛋白质的分离纯化

度最大,向上逐渐减小
常用的密度梯度有 蔗糖梯度(图) 聚蔗糖梯度 其他合成材料的密度梯度 蔗糖便宜,纯度高,浓溶液(60%,w/w)密度可达1.28g/cm3。 聚蔗糖的商品名是Ficoll,它是由蔗糖和1- 氯-2,3-环氧丙烷合成的 高聚物,Mr 约400000。
需要高密度和低渗透压的梯度时,可用Ficoll代替蔗糖。
脂溶性蛋白用表面活性剂抽提等。
2、粗分级分离
盐析 方法 等电点沉淀 有机溶剂分级分离 蛋白质提取液体积较大,则可采用 超过滤 凝胶过滤 冷冻真空干燥 或其他方法(如聚乙二醇浓缩法) 特点 简便 处理量大 既能除去大量杂质(包 括脱盐),又能浓缩蛋 白质溶液
3、细分级分离
凝胶过滤 一般使用层析法 包括
第三节 蛋白质的分离纯化
一、蛋白质分离纯化的一般原则:
蛋白质纯化的总目标 增加制品的纯度或比活 (1)前处理:把蛋白质从原来的组织或细胞中以溶解的状态
蛋 释放出来,并保持原来的天然状态,不丢失生 白 质 物活性。 的 分 (2)粗分级分离:将所要的蛋白质与其他杂蛋白分离开来。 离 纯 (3)细分级分离:样品的进一步纯化。 化 步 (4)结晶:是蛋白质分离纯化的最后步骤。 骤
盐析法的一般操作是:
选择一定浓度范围的盐溶液(如0-25%饱和度硫酸铵),使部
分杂质呈“盐析”(沉淀)状态,有效成分呈“盐溶”(溶解
)状态。经离心分离后得到上清液,再选择一定浓度范围的盐 溶液(如25%-60%饱和度的盐溶液),使有效成分等物质呈盐 析状态,而另一部分杂质呈盐溶状态,用离心法收集的沉淀物 即为初步纯化的有效成分物质。
过硫酸铵
丙烯酰胺、Bis和TEMED的水溶液
激活 TEMED 通过Bis交联 ②光聚合: 活化 聚合
蛋白质分离纯化的基本步骤

分离纯化:根据目标蛋白质的特性和分离技术的选择,进行分离和纯化。例如,利用分子大小、电荷、亲和性等特性进行分离,重复操作以提高纯度。
蛋白质的分离纯化是在混合蛋白质溶液中将目标蛋白质从其他杂质中分离出来,并获得高纯度的目标蛋白质样品的过程。以下是蛋白质分离纯化的基本步骤:
细胞破碎:从生物样品(例如细胞或组织)中提取蛋白质。可以使用细胞破碎方法,如超声波破碎、高压破碎等,破坏细胞膜和细胞结构,释放蛋白质。质等固体颗粒和大分子物质,获得相对清晰的蛋白质上清液。
纯化监测:对分离得到的蛋白质样品进行检测和监测,常用方法包括紫外吸收光谱、荧光染色、Western blot等,以确定纯度和目标蛋白质的存在。
储存和保存:将纯化的蛋白质样品适当储存,使用低温、避光和减少冻融循环等方式,保持其稳定性和活性。
需要根据实际情况和目标蛋白质的特性选择适当的方法和步骤进行蛋白质的分离纯化。此外,为了确保实验的成功和结果的准确性,应遵循相关的实验室操作规程和安全措施。
蛋白质分离纯化主要方法

蛋白质分离纯化主要方法
一、抽提
1、抽提冷冻干燥法
抽提冷冻干燥法是抽提当中常用的一种方法,能将活性蛋白以及未发生水解的蛋白从膜结构层中抽提出来,这种方法是一种简单、快捷、方便的抽提方法,可以较为有效的分离纯化未发生水解的蛋白,其原理是,将膜结构或者蛋白质复合物冷冻干燥,冷冻干燥后的蛋白质复合物会在温度迅速升高的情况下发生水解,蛋白质以抽提的形式分离出来,进而得到纯的蛋白质。
2、抽提凝胶凝集法
抽提凝胶凝集法是将蛋白质和抗体通过凝胶结合产生凝集反应,分离纯化蛋白质的一种方法。
这种方法可以将蛋白质从活性溶液和抗性溶液中分离出来,凝胶凝集反应主要是利用结合反应,将蛋白质物质结合到凝胶表面上,然后用浓盐溶液洗去不结合的物质。
蛋白质的分离纯化讲解

①从生物材料中分离制备蛋白质,研究其结构与 功能,对于了解生命活动的规律,阐明生命现 象的本质有重大意义。
②工业生产的需要:食品、发酵、纺织、制革等 工业,需要大量的高活性的酶制剂。如用淀粉 酶制造葡萄糖、麦芽糖、糊精以及糖浆等。
③医疗的需要:如用猪胰岛素治疗糖尿病。 ④基因工程的需要
特点
在 pH<8.6 应用
阴离子 DEAE—
常用的离子交换纤维素
的生物亲和力
1、粗分级分离
▪ 主要是利用盐析法、等电点沉淀、有机溶 剂沉淀等方法,使目的蛋白与其它较大量 的杂蛋白分开,这些方法的特点是简便、 处理量大、既能除去大量杂质,又能浓缩 蛋白质,但分辨率低。
(1)盐析
向蛋白质溶液中加入大量的中性盐[(NH4)2SO4, Na2SO4],使蛋白质脱去水化层而聚集沉淀,这种现象称 为盐析。
(NH4)2SO4
血清
50%饱和度
球蛋白
析出
清蛋白
100%饱和 析出
(2)等电点沉淀
蛋白质是两性电解质,其溶解度与其净电荷数 量有关,随溶液pH变化而变化。在溶液pH值 等于蛋白质等电点时,蛋白质的溶解度最小。
不同的蛋白质有不同的等电点,因此通过调节 溶液pH到目的蛋白的等电点,可使之沉淀而 与其它蛋白质分开,从而除去大量杂蛋白。
第四节 蛋白质的层析分离
应用广泛。特征:有一个固定相和一个流动相。 由于待分离的各种物质在这两个相分配系数不 同,当两个相作相对运动时,这些物质在两相 间反复多次分配,结果使其相互分开。
根据两相的状态,层析法可分为:气相层析和 液相层析;按层析原理可分为:吸附层析、分 配层析、离子交换层析、凝胶过滤层析和亲和 层析等。按操作形式分为:柱层析、薄层层析、 纸层析等。
igg分离纯化和鉴定

igg分离纯化和鉴定分离纯化和鉴定是在生物技术领域中常用的实验技术,用于提取目标物质并确定其纯度和特性。
下面以IGG为例,介绍分离纯化和鉴定的步骤和方法。
分离纯化IGG的第一步是蛋白质提取。
可以选择适当的提取缓冲液,将IGG所在的样品(如血浆或细胞培养液)与提取缓冲液进行适当的混合,使细胞或组织中的蛋白质释放出来。
提取后,可以使用离心等方法去除杂质。
将混合物进行离心,使得IGG和其他蛋白质分离。
离心后,可以将上清液取出,其中含有较高纯度的IGG。
为了进一步提高IGG的纯度,可以使用亲和层析等技术。
亲和层析是利用IGG与特定配体之间的亲和力进行分离的方法。
可以将配体固定在柱子上,然后将提取的上清液通过柱子,IGG会与配体结合,其他蛋白质则流过。
最后,通过改变柱子的条件,如改变pH值或添加特定溶剂,可以使IGG与配体解离,从而获得纯净的IGG。
获得纯净的IGG后,需要对其进行鉴定。
常用的鉴定方法包括SDS-PAGE和Western blotting。
SDS-PAGE可以将蛋白质按照分子量分离出来,可以通过与已知分子量的标准蛋白进行比较,确定IGG的分子量。
Western blotting则可以通过与特异性抗体的结合来确认IGG的存在。
除了分子量和存在性,还可以使用其他方法对IGG进行鉴定,如免疫荧光和ELISA等。
免疫荧光可以通过特异性抗体与IGG结合后的荧光信号来检测IGG的存在。
ELISA可以通过与特异性抗体的结合来定量IGG的含量。
总的来说,分离纯化和鉴定IGG是一个复杂的过程,需要使用多种技术和方法。
通过合理的实验设计和操作,可以获得高纯度的IGG,并对其进行准确的鉴定。
这些技术的应用不仅可以用于IGG的分离纯化和鉴定,还可以应用于其他蛋白质的研究和应用中。
简述蛋白质分离纯化的方法

简述蛋白质分离纯化的方法
蛋白质可是生命活动中超级重要的物质呀!那要怎么把它分离纯化出来呢?这可有不少方法呢!
首先说说盐析法吧。
就是向蛋白质溶液中加入中性盐,随着盐浓度的增加,蛋白质的溶解度会降低而沉淀出来。
操作起来也不难,先把蛋白质溶液准备好,然后慢慢加入盐,边加边搅拌,注意盐的浓度可不能一下子加太高哦,不然蛋白质可能会变性。
还要注意搅拌要均匀,这样才能保证效果好。
接下来谈谈层析法。
这就像是给蛋白质们设置了一场赛跑,根据它们的不同特性在层析柱中跑不同的速度,从而实现分离。
过程中要注意选择合适的层析柱和洗脱液,这可直接关系到分离的效果呢。
而且操作要精细,不能马虎。
在这个过程中,安全性可是很重要的呀,要避免使用有毒有害的试剂,保证实验人员的安全。
同时,稳定性也得保证,柱子不能漏呀,洗脱液的流速要稳定呀,不然怎么能得到好结果呢。
那这些方法有啥用呢?哎呀,用处可大啦!在生物制药领域,能分离纯化出高纯度的蛋白质药物,这可是能救命的呀!在科研中,能帮助我们更好地研究蛋白质的结构和功能。
优势也很明显呀,比如盐析法简单易行,层析法分离效果好。
就说在新冠疫苗的研发中吧,不就用到了蛋白质分离纯化的技术嘛。
通过这些方法,把新冠病毒的相关蛋白质分离出来,然后进行深入研究和开发疫苗,这多厉害呀!这可实实在在地看到了这些方法的效果呀!
所以呀,蛋白质分离纯化的方法真的超级重要,是我们探索生命奥秘和推动医学发展的有力工具呀!它们就像是一把把钥匙,能打开蛋白质世界的大门,让我们更好地了解和利用蛋白质的神奇力量!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质分离纯化How to detect, analyze and prepare?Different purposes, different protocols Detective/analytical level: nanogram(ng) or picogram(pg)Preparative level: milligram (mg)Protein detection/analysis:1, Hybridization: Western blot2, Immunological Techniques: Elisa & Co-IP3, electrophoresisSDS PAGE, 2-D gel, CE, IEF4, chromatography: HPLC, FPLC,5, Spectrometry: DLS, NMR, Mass-Spect, LC-MS 6, X-ray crystallography…Western blot: Protein-proteinThis method is dependent on the use of a high-quality antibody directed against a desired protein.Southern blot: DNA-DNA (Edward Southern. Detection of specific sequences among DNA fragments separated by gel electrophoresis.J Mol Biol. 1975 Nov 5;98(3):503-17)Northern blot: DNA-RNASDS-PAGE (sodium dodecyl(lauryl) sulfate-polyacrylamide gel electrophoresis)has a number of uses, which include:•Establishing protein size•Protein identification•Determining sample purity•Identifying disulfide bonds•Quantifying proteins•Blotting applicationsN-terminal protein sequencing by Edman chemistry 1.Samples can be supplied in solution or as membrane blots with more than 90% purities(μg level)2.If the sample is not pure enough, it might be separated with SDS-PAGE or 2-D gel electrophoresis and then electrotransfered to ProBlottTM PVDF membrane3.The length limit of the sequence obtained depends on the sample amount, the protein properties etc, ranging from 30 to 70 residues.pI: IEF (Isoelectric focusing)Focusing separation of species in an inhomogeneous medium (pH-gradient) according to their isoelectric points (pI).Molecular weight:SDS PAGE (polyacrylamide gel electrophoresis) HPLC (high pressure liquid chromatography)MS (Mass spectrometry)Protein concentration detection:BSA methodCo-efficientYeast ORF Ygr271c-apMDANTLNVSFEEILKGKKLDEDSIGLTLSP DKDHEDGSQVSPTQDRKELDQVVGEDEK DDFFENo W or Y, extinction coefficient is 0Absorption spectra of the aromatic amino acids in the near-ultraviolet regionFrom D. Wetlaufer, Adv. Protein Chem. (1962) 17:303-390.©1962 Academic PressUV detectionWhat is chromatography (色谱)?it is a broad range of physical methods used to separate and/or to analyze complex mixtures. The components to be separated are distributed between two phases: a stationary phase (固定相) bed and a mobile phase (流动相)which percolates (filters) through the stationary bed.How Does It Work?A mixture of various components enters a chromatography process, and the different components are flushed through the system at different rates.These differential rates of migration as the mixture moves over adsorptive materials provide separation. Repeated sorption/desorption acts that take place during the movement of the sample over the stationary bed determine the rates. The smaller the affinity a molecule has for the stationary phase, the shorter the time spent in a column.Liquid Chromatography1.reverse phase,2.high performance and3.size exclusionProtein surface propertiesReverse phase chromatography (RPC)Based on the hydrophobic interactions between solute (溶质) molecules and immobilized, matrix-bound ligands.RPC has found favour in a wide variety of preparative applications including micropurification of protein fragments for sequencing and process-scale purification of recombinant protein products.RPC also offers the benefit of exceptional flexibility in separation conditions so that either molecules of interest can be bound while contaminants pass through, or contaminants can be bound while the molecule of interest passes through.Reversed phase chromatography (RPC)Binding of the protein in a polar mobile phaseElution by changing the composition of the mobile phase to becomemore non-polarHydrophobic interaction chromatography (HIC)is a technique for the purification and separation of biomolecules based on differences in their surface hydrophobicity.Many biomolecules, generally considered to be hydrophilic, also have sufficient numbers of hydrophobic groups allowing interaction with hydrophobic ligands coupled to the chromatographic matrix.HIC vs RPC–Less substituted matrix –Less hydrophobic ligands–Weaker binding–Elution with water/dilute buffers–Native protein–Adsorption chromatography–Low pressure chromatography –More substituted matrix –More hydrophobic ligands–Stronger binding–Elution with non-polar solvents–Denatured protein–Partition chromatography–High performance liquid chromatography (HPLC)HIC RPCHigh performance liquid chromatography (HPLC)the process is conducted at a high velocity and pressure drop. The column is shorter and has a small diameter, but it is equivalent to possessing a large number of equilibrium stages.Size exclusion chromatography, also known as gel permeation or filtration chromatography (分子筛)does not involve any adsorption and is extremely fast (FPLC).The packing is a porous gel, and is capable of separating large molecules from smaller ones.The larger molecules elute first since they cannot penetrate the pores. This method is common in protein separation and purification.Ion Exchange Chromatography(离子交换层析)Ion exchange chromatography is commonly used in the purification of biological materials.There are two types of exchange:cation exchange (S)in which the stationary phase carries a negative charge, and anion exchange (Q)in which the stationary phase carries a positive charge.An increase in ionic strength is typically used to elute proteins from IEX media. However, it is possible to use a change in pH to displace bound material.Affinity Chromatography(亲和层析)involves the use of packing which has been chemically modified by attaching a compound with a specific affinity for the desired molecules, primarily biological compounds.The packing material used, called the affinity matrix, must be inert and easily modified. Agarose is the most common substance used, in spite of its cost. The ligands, or "affinity tails/tag", that are inserted into the matrix can be genetically engineered to possess a specific affinity.GKPIPNPLLGLDST V5MASMTGGQQMG T7EQKLISEEDL MycProtien Maltose Binding Protein (MBP)HHHHHH Poly-HisYPYDVPDYA HAProtein GSTEYMPME GLU-GLUProteinGFP (Green Fluorescent Protein)KRRWKKNFIAVSAANRFKKISSSGAL Calmodulin Binding ProteinEpitope TagSequenceThe two strategies:1, fish out the target protein from the mix 2, remove the contaminants from the target proteinPurification by removing the target molecule from the contaminants.Affinity chromatography techniques are very specific for the target molecule or for a group of molecules with closely related biological properties. This makes them capable of "fishing out" the target molecule (or the group), leaving all contaminants behind.When applicable these techniques are to be preferred, since they drastically simplify the purification protocol.Purification by removing the contaminants from the target molecule.When a suitable affinity chromatography technique is not at hand, one has to rely on a sequence of general chromatography techniques to remove the contaminants.A typical purification protocol when nothing is known about the target protein employs the IEX-HIC-GF sequence of purification steps.蛋白质的理化性质及其分离策略的选择:1.分子大小2.形状3.溶解度4.电荷5.疏水性6.密度7.亲和能力8.可逆性缔合9.稳定性10.表面活性1.分子大小1.1 透析和超滤1.2 离心、密度梯度离心1.3 凝胶过滤2. 形状球状蛋白具有较小的有效半径(斯托克半径)膜过滤凝胶过滤3. 溶解度等电点沉淀盐溶(NaCl)和盐析(NH4)2 SO4有机溶剂(PEG, Ethanol)分级4. 电荷电泳(pI: 0.02 pH unit)离子交换5. 疏水性蛋白质表面的疏水氨基酸残基的数目和分布6. 密度一般1.3-1.4 g/ml含大量磷酸盐或脂质的蛋白质不同7. 亲和能力重组融合蛋白(GST-, His-tag et al.)配基(底物、抑制剂、辅因子、抗体)8. 可逆性缔合在不同条件下,蛋白质的聚合状态可能不同9. 稳定性热稳定性酶解稳定性10. 表面活性泡沫分离反胶团相转移聚合物-盐-水液-固萃取体系。
