4卤代烷5
有机化学第三版-夏百根-黄乾明-主编-课后答案(四川农业大学)

(1) (2) (3) (4) (5)
(6)
3、
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
4、
(1)1,4-丁二醇〉 正辛醇>3-己醇〉2-甲基-2-戊醇>正己烷
(2)
1碳酸〉邻甲苯酚〉水〉苯甲醇〉苯甲醚
22,4—二硝基苯酚>邻硝基苯酚>苯酚>邻甲苯酚
(3)④>②〉③>①
5、
(3)具有多电子得p—共轭体系;(1)、(4)具有—共轭体系;
10、
11、
12、
13、
14、
15、
第四章芳香烃作业参考答案
1、
(1)邻硝基甲苯(2)3-羟基苯磺酸(3)3-甲基-4—氯苯甲酸(4)1,4-二甲基萘
(5)4—甲基-3-苯基-1—戊烯(6)6-氯—2—萘酚
2、
(1)(2)(3)(4)(5)
(5)Z(顺)—3-甲基—2—氯—2-戊烯(乙烯型)(6)3—甲基-4-溴-1-丁烯(隔离型卤代烃)
(7)对-氯甲苯(乙烯型) (8)1-苯基-1-溴丙烷(烯丙基型)
2、(1)(2)(3)(4)
(5)(6)(7)(8)
3、(1)
(2)
(3)
4、
(1)
(2)
(3)
(4)
5、
(1)
(2)
(3)
(4)
(5)
(3)3-噻吩磺酸(4)3-吡啶甲酰胺
第十三章碳水化合物习题参考答案
第十四章氨基酸、蛋白质习题参考答案
(6)
3、(1)
(2)
(3)
(4)
(5)
(6)
(7)
卤代烃的分类、命名及同分异构;卤代烷烃的化学性质;卤代烯烃和

cis-1-bromo-2-methylcyclopropane trans-1-bromo-2-methylcyclopropane
H H Br CH3
顺-1-甲基-2-溴环己烷 (1R,2S)-1-甲基-2-溴环己烷
(1S,2R)-1-bromo-2-methylcyclohexane
7
卤代烯烃:
KOH C2H5OH
CH3 CH3CH C(CH3)2 + CH3CH2C
29%
28
CH2
71%
消除反应常和亲核取代反应的互相竞争: 体积大的碱,有利于消除反应。
CH3CHCH3+ C2H5ONa Br
C2H5OH 55 ℃
(CH3)2CHOC2H5+ CH3CH CH2
21% 79%
溶剂:水有利于取代反应,醇有利于消除反应。
30
溶剂乙醚的作用:和生成的有机镁化合物络合,成为稳
定的溶剂化物。
C2H5 O· · C2H5
R Mg X
· ·O
C2H5 C2H5
苯、四氢呋喃、其他醚类也可以也可以作为溶剂。
一卤代烷生成格氏试剂的活性顺序是: RI > RBr > RCl > RF
通常用一溴代烷制备格氏试剂。
31
Grignard试剂的性质:
CH2
CHCHCH2Cl CH3
3-甲基-4-氯-1-丁烯 4-chloro-3-methylbut-1-ene
卤代芳烃:
Cl CH3
邻氯甲苯
2-chlorotoluene 1-chloro-2-methylbenzene
CH CH3
CH2Cl
2-苯基-1-氯丙烷
《有机化学》第四章 卤代烃

9 第一节 卤代烃的分类和命名
第四章
二、 卤代烃的命名
‖
—
(一)习惯命名法
对于不饱和卤代烃,其命名方法是:选择含有卤素原子和不饱和键的最长碳链作为主链,
主链编号时使不饱和键的位次最小。顺反异构体用Z/E或顺/反标明其构型。例如:
— —
CH3—
CH2CH3
CC
Cl —
CH3
反-3-甲基-2-氯-2-戊烯
例如:
CH3CH2CHCH2Cl
—
2-苯基-1-氯丁烷
11
过 渡 页
1 卤代烃的分类和命名
2 卤代烃的性质
3 重要的卤代烃
12 第二节 卤代烃的性质
一、 卤代烃的物理性质
第四章
接下页
室温时,氯甲烷、氯乙烷、氯乙烯和溴甲烷为气体,其余卤代烃为液体 或固体。卤代烃难溶于水,而易溶于有机溶剂。一些卤代烃,如CH2Cl2、 CHCl3等本身就是有机溶剂。除一氯代烃的相对密度小于1外,溴代烷、碘 代烷以及多氯代烷的相对密度均大于1。
构造式
熔点(℃)
沸点(℃)
CH3Cl CH3Br CH3I
CH2Cl2
-97 -93 -66
-96
-24 4 42
40
三氯甲烷
CHCl3
-64
62
四氯化碳
CCl4
-23
77
氯乙烷
C2H5Cl
-139
12
溴乙烷
C2H5Br
-119
38
磺乙烷
C2H5I
-111
72
1-氯丙烷
CH3CH2CH2Cl
-123
卤代烃可分为饱和卤代烃(又称卤代烷)、不饱和卤代烃和芳香族卤代烃。例如:
第四章卤代烃

R X + N H 3
(3)被氨基取代
ROH
醚
R N H + H X 2
胺 R O H RX + N a C N RC N + N a X Δ
由于产物具有亲核性,除非使用大过量的氨 (胺),否则反应很难停留在一取代阶段。如果 卤代烷过量,产物是各种取代的胺以及季铵盐
季铵
12
** (4)被氰基取代——增长碳链的方法之一
过渡态1
H H O H
碳正离子
H
+
H H
C B r H O C H H
B r H O C
r +B H H
过渡态2
14
SN1历程反应的活性次序
R3C-X > R2CH-X > RCH2-X > CH3-X
2、双分子亲核取代历程—SN2
一步完成,没有活性中间体碳正离子生成 C H OH 2 5 O + R CH CH CH CH 2 2 + KOH R 2 + KX Δ
31
2.烯丙基型和苄基型卤代烃
C
C
+
C
σ-π超共轭效应,有利于亲核进攻
a . (CH )2CHI (CH . (CH )2CHI (CH )3CClb )2CHCl 3 3 3 3 c. CH Cl 2
>
>
> >
CH CHCH Br . CH CHCH CH Br CH Cl d 3 2 2 3 2 2 CH 3 CH 3
30
因此卤原子的活性比相应的卤代烷弱,在 通常情况下不与 NaOH 、 C2H5ONa 、 NaCN 等亲核 试剂发生取代反应,甚至 与硝酸银的醇溶液共 热也不生成卤化银沉淀。
卤代烃

第五章卤代烃一、学习要求1、理解卤代烃的概念、分类,掌握卤代烃的命名。
2、掌握卤代烃的结构和化学性质。
3、了解卤代烃亲核取代反应、消除反应的机制和两种反应的关系。
4、了解有机氟化物的基本特点和一些氟代烷在医药及其它方面的应用。
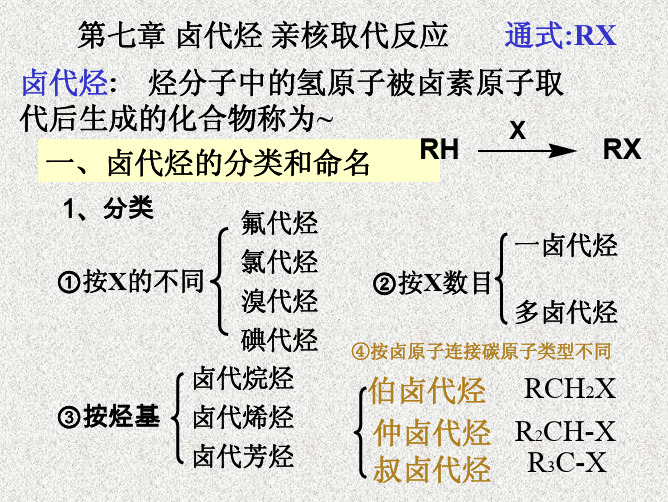
二、本章要点(一)卤代烃的定义、分类卤代烃(halohydrocarbon)是烃分子中一个或多个氢原子被卤原子取代所生成的化合物,用通式RX(X=F、Cl、Br、I)表示。
(二)卤代烃的命名卤代烃常用系统命名法命名,即以X作取代基,相应的烃作母体,书写形式与烃相同。
简单卤代烃也可采取普通命名法,即卤素名+ 烃的名称或烃基名+ 卤素名。
(三)卤代烃的结构卤代烃的结构特点是碳卤键具有极性Cδ+-Xδ-,α-C带部分正电荷。
(四)卤代烃的化学性质1、卤代烷的化学性质带部分正电荷的α-C易受亲核试剂的进攻而发生亲核取代反应;X的-I效应使β-H酸性增强,可与强碱发生消除反应。
(1)亲核取代反应:α-C受亲核试剂的进攻,X带着一对电子离去,亲核试剂取代X的位置,生成各种取代物。
常见的亲核试剂有-OH、-OR、-CN、NH3、-ONO2等。
亲核取代反应的机制有S N1、S N2两种,反应按何种机制进行,影响因素有烷基的结构、试剂的亲核性、溶剂的极性、离去基团的离去能力等。
(2)消除反应:卤代烷的β-H与碱作用,最终X和β-H从分子中脱去,发生消除反应。
当仲卤代烷或叔卤代烷有不同类型的β-H时,产物取向遵循Saytzeff(查依切夫)规则,即消除反应的主产物是双键碳原子上连烃基最多的烯烃或对称性最好的烯烃。
消除反应也有两种机制,即E 1、E 2。
反应机制同样受反应条件的影响。
(3)亲核取代反应和消除反应的关系:亲核取代反应和消除反应往往同时发生,相互竞争。
发生S N 1的条件也有利于E 1发生;发生S N 2的条件也有利于E 2发生。
同一卤代烷按不同机制进行反应生成产物的比例由烷基的结构、溶剂的极性、试剂的亲核性和碱性、反应的温度所决定。
卤代烃亲核取代反应
硝酸银醇溶液 室温 卤化银沉淀 +
加热 +
加热 -
练习:将下列卤代烃按与硝酸银醇溶液的反应活 性排列成序: ①1-溴丙烯;②1-苯基-2-溴丁烷; ③3-溴-1-庚烯
(2) 亲核试剂的影响 对SN1反应速率影响不大。 对SN2反应,亲核性越强,反应速度越快。 亲核性:试剂对Cδ+的结合能力(给电子能力) 碱 性:指其对质子的结合能力。
H
CC
H CH3 Cl C2H5
CH3CHCH=CCH2CH3 Br CH3
4-甲基-2-溴-3-己烯
(2E,4R)-4-甲基-4-氯-2-己烯
二、结构和化学性质
• 卤素是卤代烃分子中的官能团。
• 卤代烃的化学性质是由于卤原子的存在所
引起的。
亲核试剂
δ++ δ+
• 亲核取代反应 R βCH αCH2
卤代烃:
饱和卤代烃 不饱和卤代烃 芳香卤代烃
RCH2X
RCH CHX
2、命名
普通命名法:
卤(代)某烃
Br
X
烃基 + 卤素
某 基 卤 CH2 CH CH2Br
俗名
CHCl3
比较复杂的卤代烃一般用系统命名法
CH3I
甲基碘
CH2 CH Br
乙烯基溴
Cl 烯丙基氯
Br
丙烯基溴
Cl
2-甲基-4-氯-1-丁烯
SN1: R X
δ+ δ -
RX
R+ + X-
反应物
过渡态
极性
溶剂的极性越大,对过渡态溶剂化作用越强,
办公楼、写字楼消防安全须知

疏散楼梯
疏散通道
2、利用疏散指示标示进行逃生
在大中型建筑物内的公共区域,都会设有安全疏散指 示标示和应急照明设施,这些设施是在发生灾害时供人员 逃生时使用。
疏散指示标示
应急照明设施
2、结绳自救 在准备逃离房间前,应用手摸摸房门或 开一道小缝观察,如果房门发烫或有浓烟扑入,说明火已 离你不远,门外己十分危险,此时要另寻生路。可将窗帘、 被罩撕成粗条,结成长绳,一端紧固在暖气管道或其它足 以载负体重的物体上,另一端沿窗口下垂直至地面或较低 楼层的窗口、阳台处,顺绳下滑逃生。注意应将绳索结扎 牢固,以防负重后松脱或断裂。
5、办公室内的纸张要整齐码放பைடு நூலகம்码放时尽量离电源远一些。 6、为了您的安全和健康尽可能创建“无烟型”办公室,如不能及时创 建,去单位指定的位置吸烟,如果没有指定的吸烟区域,在吸烟之 前先将烟灰缸内倒入少量的水,这样吸完的烟头就可以完全熄灭 了,吸烟时严禁在自己办公桌下的垃圾桶内弹烟灰,或将吸完的烟 头直接丢进垃圾桶内。 7、下班后及时将办公室内的烟灰缸、垃圾桶清理干净最后将总电源关 闭。 8、加强消防宣传教育,定期组织开展消防演练。
(三)、 ABC干粉灭火器的 组成 灭火器主要有压把、压 力表、橡胶软管、灭火剂 喷头、储剂罐组成。保险 销。 (四)、灭火器的操作 首先,拿起灭火器检查 压力表压力是否正常,再 检查喷管是否老化,打开 保险销,右手握住压把,左 手握住喷管头部对准火焰 根部,距火点约2米——3 米,右手将压把压下,使 干粉灭火剂喷出将火灾扑 灭。
做好自我防护避免烟雾毒气
现代建筑虽然比较坚固,但几乎所有的装潢材料,诸如塑料 壁纸、化纤地板、聚苯乙烯泡沫板、人造宝丽板等,均为易燃物 品。这些化学装饰材料燃烧时散发的有毒气体,随着浓烟以快于 人奔跑速度的四至八倍迅速蔓延,人们即使不烧死,也会因烟雾 窒息死亡。所以当烟雾太浓时,可用湿毛巾捂住口鼻,屏住呼吸 ,防止烟雾毒气呛入体内,同时宜俯卧爬行,因烟气及毒气比空 气轻,贴近地面的空气,一般比较清洁少烟,且含氧较多,可避 免被毒烟熏倒而窒息。 火场实践证明,一条温毛巾,折叠3层, 烟雾消除率可达60%,折叠16层可达90%以上。因此,捂住口鼻 ,就是一个简易的防毒面具,此时,在充满强烈刺激性烟雾的15 米走廊慢慢行走,无明显不适感。但毛巾过湿会使呼吸困难,故 使用湿毛巾时,一般应将毛巾的含水量控制在毛巾自重的3倍以下 。
4卤代烷 亲核取代反应

-
V=[(CH3)3CBr] 特点: 特点:①单分子反应 ②反应是分步进行的 ③有活性中间体正碳离子生成。 有活性中间体正碳离子生成。
第一步: 第一步:
CH3 CH3 C Br CH3 CH3
[ CH3
Cδ
+
δ Br
]
CH3 CH3 C
+
+ Br
-
CH3
CH3
第二步: 第二步:
CH3 CH3 C
+
共轭效应本质上是电子离域效应, 电子离域效应 共轭效应本质上是电子离域效应,电子密度 从高往低跑. 从高往低跑.
(2)共轭体系的分类 ) 共轭: ①π-π共轭: 共轭 CH2=CH-CH=CH2 1,3-丁二烯 , 丁二烯
π
π
共轭: ②p -π共轭:
..
=CHCH2=CH-Cl
氯乙烯
=CHCH2=CH-CH2·
一、亲核取代反应
Br
CH3O
-
O
和卤代烷起作用的是OH OH¯ CN¯ 1. 和卤代烷起作用的是OH 、CN 、和 :NH3 等负离子或带有未共用电子对的分子,它们具 负离子或带有未共用电子对的分子, 有亲核性质。 有亲核性质。 2. 含这些负离子的试剂或含未共用电子对 分子的物质叫亲核试剂。 分子的物质叫亲核试剂。 亲核试剂 3. 由亲核试剂的进攻而引起的取代反应叫 亲核取代反应,简写作S 亲核取代反应,简写作SN。
H C CH2 C H CH2
结构式: 结构式: H2C=CH-CH=CH2
1,3-丁二烯分子中的大 键 , 丁二烯分子中的大 丁二烯分子中的大π键
2. 共轭二烯烃的特点 (1)键长平均化 共轭体系能量降低,分子稳定。 (2)共轭体系能量降低,分子稳定。 3. 共轭效应 (1)概念 在共轭体系中,各原子之间相互影响, 在共轭体系中,各原子之间相互影响,使得体 电子云密度和键长趋向平均化 键长趋向平均化、 系电子云密度和键长趋向平均化、体系趋于稳 的电子效应称为共轭效应 共轭效应。 定的电子效应称为共轭效应。
高中化学有机物的性质及鉴别总结完整版
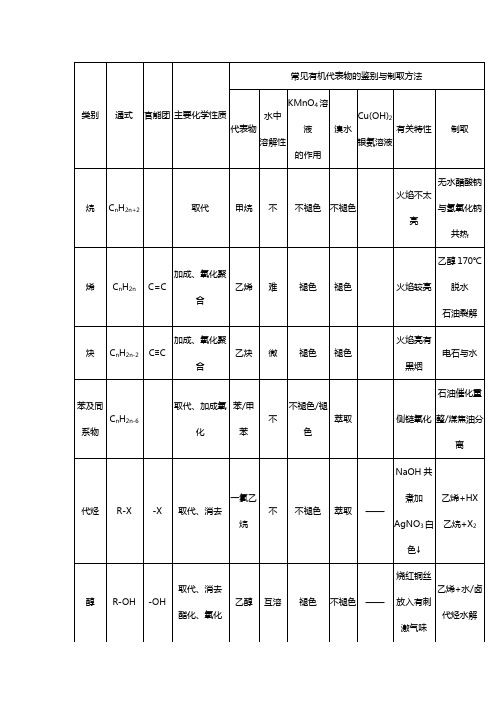
高中化学有机物知识点总结一、重要的物理性质 1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑤ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH 3)4]亦为气态② 衍生物类:一氯甲烷(.....CH ..3.Cl ..,沸点为....-.24.2....℃)..甲醛(...HCHO ....,沸点为....-.21..℃)..(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH甲酸HCOOH 乙醛CH3CHO★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
第4章:卤代烃

§4-1卤代烃的分类和命名§4-2卤代烃的性质§4-3重要的卤代烃§4-4卤代烃的制法本章节内容第四章卤代烃第一节卤代烃的分类和命名一、卤代烃的分类二、卤代烃的命名第二节卤代烃的性质一、物理性质二、化学性质第三节重要的卤代烃一、溴甲烷二、三氯甲烷和四氯化碳三、聚四氟乙烯四、氟氯代烃第四节卤代烃的制法§4-1卤代烃的分类和命名卤代烃是烃分子中一个或多个氢原子被子卤素(F、Cl、Br、I)取代的衍生物,它在自然界中存在极少,绝大多数是人工合成的。
比比皆是的聚氯乙烯制品,千家万户使用的冰箱中的致冷剂、防火必备的四氯化碳灭火剂等到,都是卤代烃。
卤代烃也是实验室中最常用的有机化合物,它经常起着从一种化合物变成另一种化合物的桥梁作用,是有机合成中经常用到的化合物。
人们在使用卤代烃的同时,也带来了严重的污染问题,六六六被禁用,DDT被取缔。
近年来,科学家证明臭氧层空洞的形成与使用氟氯烃有关。
可见,只有掌握卤代烃的性质及其反应规律,才能驾驭其上,造福于人类。
§4-1卤代烃的分类和命名(一)分类分类一卤代烃多卤代烃卤代烷卤代烯卤代芳香烃伯卤代烷:RCH2-X仲卤代烷:R2CH-X叔卤代烷:R3C-X如:R-XCH =CH XR-如:x如:如: CHCl3(二)命名1. 饱和卤代烃以烃为母体命名,按照烃的命名法编号123452-乙基-1-溴戊烷2-甲基-4-氯戊烷1234564-甲基-2-氯己烷6543212-甲基-3, 3, 5-三氯己烷12345CH 3CH 2CHCH 2CH 2CH 3CH 2Br CH 3CHCH 2CHCH 3CH 3Cl CH 3CHCH 2CHCH 2CH 3CH 3Cl CH 3CH-C-CH 2CHCH 3H 3C Cl Cl Cl §4-1卤代烃的分类和命名2. 不饱和卤代烃通常以含有不饱和键的最长碳链为主链,编号时要使不饱和键的位置最小4-溴-2-戊烯12342-丙基-4-氯丁烯124534-甲基-5-溴-2-戊炔12345CH 3CHCH=CHCH 3Br CH 2=C-CH 2CH 2-ClCH 2CH 2CH 3CH 3CH 3-C≡C -CHCH 2-Br3. 卤代脂环烃和卤代芳香烃分别以脂环烃和芳香烃作母体,把卤原子作取代基命名1-异丁基-1, 4-二氯环己烷顺-1-甲基-2-氯环己烷1, 3-二溴苯Cl Cl CH 2CH(CH 3)2CH 3H H ClH Br CH 3CH 2CH 3Br Br(R)-2-溴丁烷苯氯甲烷(或氯化苄、苄基氯)1-苯基-2-氯乙烷β-溴萘CH2ClCH2CH2ClBr(三)同分异构现象卤代烷的同分异构体数目比相应的烷烃的同分异构体多丁烷1-氯丁烷卤代烯烃的同分异体比相应的烯烃的同分异构体更多CH 3CH 2CH 2CH 3CH 3-CH-CH 3CH 3CH 3CH 2CH 2CH 2-Cl CH 3CH 2CH-CH 3Cl CH 3-CH-CH 2-Cl CH 3ClCH 3-C-CH 3CH 3§4-2 卤代烃的性质一、一卤代烷通式:CH2n+1X常用R—X表示n物理性质在室温下,氯甲烷、氯乙烷、溴甲烷、氟甲烷、氟乙烷、氟丙烷为气体,其他15个碳原子以下的一卤代烷为液体,15个碳原子以上的是固体。
第七章 卤代烷1-每页4片

不饱和卤代烃 Cl CH2=CHBr 溴乙烯 Cl 3-氯环己烯
一元卤代烃
CH2=C-CH=CH2 2-氯1,3-丁二烯
F2C=CF2 四氟乙烯
多元卤代烃
伯
1
卤代烯烃 R-CH=CH-X R-CH=CH-CH2-X 乙烯型 烯丙型
CH2=CHCl
CH2=CHCH2Cl 3- 氯丙烯
二. 卤代烃的命名
91%
CH2CH3
卤原子连在芳烃侧链上的,常以脂肪烃(烷烃、烯 烃)为母体,卤原子和芳环作为取代基
α
Br, 光 100%
CHCH3 Br
CH=CHBr
β
β -溴代苯乙烯
烯烃α-H的高温卤代
2. 不饱和烃的加成
3. 氯甲基化反应、芳烃的亲电取代
CH2Cl + 70% CH2Cl CH2Cl + H2O
R-X + Nu亲核试剂
δ
R-Nu + X离去基团
反应物 底物
① 分子中C—X 键为极性共价键,碳带部分正电荷,易受 带正电荷或孤电子对的试剂的进攻。 ②分子中C—X 键的键能(C—F除外)都比C—H键小。 键 C—H C—Cl C—Br C—I 键能KJ/mol 414 339 285 218 C—X 键比C—H键容易断裂。
第七章
卤代烃(1)
一. 卤代烃类型
卤代烃通式: 主要内容
n n n
R
X ( X = F, Cl, Br, I)
卤代烷的类型和命名 卤代烷的亲核取代,取代产物的类型 亲核取代反应的两种机理——SN1和SN2机理, 两种机理在反应动力学和立体化学上的不同之处 碳正离子,碳正离子的稳定性,碳正离子的重排
R Cl , R Br , R I 性质接近 通常总称卤代烷 通常总称卤代烷
卤代烷烃——精选推荐

第九章 卤代烃1、卤代烷烃(1)代烷烃的分类和命名 (2)卤代烷烃的制法(3)卤代烷烃的物理性质(4)卤代烷烃的化学性质:取代反应(-X 分别被-OH 、-OR 、-NH2和-CN 等取代);亲核取代反应机理(SN1、SN2反应)、立体化学及其影响因素;消除反应的机理(E1、E2反应)、立体化学及其影响因素; Zaitesev 规则;Grignard 试剂的制备及其应用;Wurtz 反应。
2、卤代烯烃卤代烯烃的分类和命名;双键位置对卤原子活性的影响3、卤代芳烃 芳卤和苄卤;卤代芳烃的亲核取代(加成-消除)反应机理、卤苯中邻对位取代基对卤原子活性的影响,苯炔中间体的活性。
4、多卤代烃简介基本要求:1.掌握卤代烃的分类、命名和制备方法。
2.熟练掌握卤烃的化学性质。
3.深刻理解SNi 、SN2的反应机理、立体化学及其影响的因素,掌握各种类型卤代烃反应活性的规律。
4.深刻理解E1、E2的反应机理、立体化学及其影响的因素,熟练掌握和应用Zaitesev规律。
5.掌握卤代烯烃中双键位置对卤原子活泼性的影响及烯丙位重排的规律。
6.深刻理解卤代芳烃的亲核取代(加成-消除)反应机理、中间体苯炔的活性,掌握卤苯中邻对位取代基对卤原子活性的影响规律。
烃分子中的氢原子被卤原子取代后所生成的化合物称为卤代烃,一般用R-X 表示(分子中存在C-X 键, X 为F 、Cl 、Br 或I )。
9.1卤代烃的分类、命名9.1.1分类1. 按分子中所含卤原子的数目,分为一卤代烃和多卤代烃。
2. 按分子中卤原子所连烃基类型,分为:卤代烷烃 R-CH 2-X卤代烯烃 R-CH=CH-X 乙烯式R-CH=CH-CH 2-X 烯丙式R-CH=CH (CH 2)n-X ≥2 孤立式卤代芳烃 乙烯式 乙烯式3. 按卤素所连的碳原子的类型,分为:X CH 2X R-CH 2-X R 2CH-X R 3C-X仲卤代烃叔卤代烃一级卤代烃二级卤代烃三级卤代烃( )°23°°( )( )伯卤代烃19.1.2命名简单的卤代烃用普通命名或俗名,(称为卤代某烃或某基卤)复杂的卤代烃用系统命名法(把卤素作为取代基)编号一般从离取代基近的一端开始,取代基的列出按“顺序规则”小的基团先列出。
卤代烷

LiAlH4 + 4H2O
LiOH + Al(OH)3 +4H2
12
CH3(CH2)6CH2X + LiAlH4
THF 250C
X T(反应时间)
Cl
24h
Br
1h
I
1h
CH3(CH2)6CH3 + AlH3 + LiX
产率 73% 99% 100%
CH3(CH2)6CH2X + NaBH4
X 反应温度
H
H
H
CH3
150
1
0.01
0.001 21
在SN2反应中,由于亲核试剂是从卤原子的背后进攻卤 代烷的-碳原子的,如果-碳的取代基增多, -碳原子周 围将变得拥挤,进攻试剂接近-碳原子的阻力增加,因此 活性也就降低。β-C上烷基数目的增加也使反应速率减慢.
不同结构的卤代烷发生SN2反应的活性顺序为:
CH3
CH3CHCH2CHCH3
CH3 BrCH2CHFCHCH2I
2-甲基-4-氯戊烷 2-甲基-3-氟-4-溴-1-碘丁烷
H CH3
H Cl
反-1-甲基-3-氯环己烷
3
CHCH2Cl CH3
2-苯基-1-氯丙烷
CH3
H
Br
Br
H
CH3
(2S,3S)-2,3-二溴丁烷
5.2 一卤代烷的结构和物理性质
(1)反应动力学:v=k[(CH3)3CBr] 一级反应 反应过程:反应分两步进行:
第一步:叔丁基溴在溶剂中首先离解成叔丁基碳正离子和溴 负离子,这是一步慢反应:
(CH3)3C-Br [(CH3)3C+ ···Br-] (CH3)3C+ + Br -
本科有机化学 第四章 卤代烷

34
• 溶剂的影响(溶剂化作用) (a)质子溶剂(protic solvent):具有酸性质子的溶剂,常含 O—H、N—H键,可与带负电荷的亲核试剂形成氢键; (b)非质子溶剂(aprotic solvent):不含O—H、N—H极性键; (c)极性非质子溶剂(polar aprotic solvent):不含能形成氢键 的O—H、N—H基团,但具有强烈的偶极。 • 对亲核试剂的影响:强烈溶剂化小体 积负离子,使亲核性降低; • 优点:价格便宜,溶解能力较强。 原子半径小,电荷集中,则在质 子溶剂(protic solvent)中溶剂 化程度高(通过氢键),亲核性 弱(如:F-弱于I-, RO-弱于RS-)
思考:(1) 判断下列基团的离去能力? F- , OH- , NH2- , CH3(2) 下面反应能否发生?
30
I-是良好的 离去基团
其它良好的离去基团(离去能力 > I-):
比碘负离子 更容易离去
31
•亲核试剂(nucleophile)的影响 对SN1反应:影响不大 对SN2反应:提高亲核试剂浓度及亲核性则有利于反应
乙醇/水
CH3Br + NaOH
sp2
-
CH3OH + NaBr
sp3
sp3
-
亲核试剂从离去基团背面进攻 Back-side attack
构型反转!
Inversion of configuration
协同反应(concerted reaction):新键的生成与旧键的断裂 同时发生,一步反应,无中间体生成. 13
21
从反应机理入手分析:
推动力:叔碳正离子比仲碳正离子稳定
22
迁移基团:可以是H、甲基或更大体积的烷基 推动力:生成更稳定的中间体或热力学稳定的产物
卤代烷

五、 常见亲核取代反应 1. 水解反应 (Hydrolysis):卤代烷在强碱水溶液中共热制备醇
OH + CH3CH2 Br H2O CH3CH2 OH + NaBr 水解反应的相对活性: RI>RBr>RCl>RF (烷基相同)
2. 与 NaCN反应制备腈(Nitrile):
BrCH2(CH2)5Br
CH3
叔丁基溴
CHCl3 三氯甲烷 氯仿, chloroform
CHCl3 氯仿(三氯甲烷) CHI3 碘仿(三碘甲烷)
CF2Cl2 氟里昂(二氟二氯甲烷) C6H6Cl6 六六六(1,2,3,4,5,6-六氯环已烷)
z IUPAC命名法
选取连有卤原子的碳原子在内的最长碳链为主链,根据主链的碳原 子数称为某烷。卤原子作为取代基,主链编号规则与烷烃相同。取 代基的列出次序按基团的优先顺序规则(较优基团后列出)
因为生成的伯胺仍是一个亲核试剂,它可以继续与卤代烷作用, 生成仲胺或叔胺的混合物,故反应要在过量氨(胺)的存在下进行
5. 与AgNO3 的醇溶液反应,生成 AgX沉淀
EtOH RX + AgNO3
RONO2 + AgX
反应活性: RI > RBr > RCl SN1 : 3° > 2° > 1°
伯卤代烷需加热
对比
的原子排列,寿命= 0,无法测得。
中间体:反应中生成的寿命较短的分子、离子或自由基,中间体
一般很活泼,但可通过实验方法观察到。
二、 亲核取代反应
1. SN2亲核取代反应
H3C Br + OC2H5
1). SN2亲核取代反应机理:
δ+
慢步骤
RX
《有机化学(第二版)》第5章:卤代烃

19:46
四、卤代烃的化学性质
卤代烃的化学反应主要发生在官能团卤 原子以及受卤原子影响而比较活泼的β 原子以及受卤原子影响而比较活泼的β-氢原 子上:
R
CH H
δ+ CH 2 δX
取代反应 消去反应
19:46
(一)亲核取代反应(nucleophilic substitution)
Nu+ C
底物
X
19:46
2、系统命名法 、
• ⑴.选择含有卤原子的最长碳链为主链,把支链和卤素 选择含有卤原子的最长碳链为主链, 看作取代基, 按照主链中所含碳原子数目称作“ 看作取代基 , 按照主链中所含碳原子数目称作 “ 某 烷”。 • ⑵.主链上碳原子的编号从靠近支链一端开始,使卤素 主链上碳原子的编号从靠近支链一端开始, 及其它取代基具有最低位次, 及其它取代基具有最低位次,位号之和最小 ; • ⑶.当卤素与烷基具有相同编号时,优先考虑官能团 当卤素与烷基具有相同编号时, (卤素原子),使卤素原子位号最小;然后按次序规则, 卤素原子) 使卤素原子位号最小;然后按次序规则, 小基团优先列出,写出取代基名称、个数、位次。 小基团优先列出,写出取代基名称、个数、位次。
19:46
一、卤代烃的分类 卤代烃的分类
• 分类依据: 分类依据: 1、按烃基的结构分类 、 2、按卤素连接的碳原子分类 、 3、按卤素数目分类 、 4、按卤素原子的种类 、
19:46
按烃基的结构分类
•
• 脂肪卤代烃 • • 卤代烃 • 芳香卤代烃
饱和卤代烃 CH3CH2Cl 不饱和卤代烃 CH2=CHCl
卤代烃 二卤代烃 CH2I2
多卤代烃 CHI3
19:46
二、卤代烃的命名
消防基础知识培训课件

详细说明火场的基本情况,如什么时间发生火灾、什么物质燃烧,火势大小,消防车从哪个地方驶入比较方便。
02
耐心回答“119”接警人员的提问;报警后电话机旁应留人,或者随身携带手机,注意来电,以便随时和消防部门联系;有新的情况要及时告知“119”火警台。
03
报警后不要只是在起火地点等待,应立即派人到主要路口引导消防车进入火灾现场。
冲出着火带。当着火地带火势不猛时,我们再急也不能在毫无保护准备的情况下乱冲,否则与自跳火坑没有区别。我们可以把身体浇湿,用湿床单等物披在身上,屏住呼吸,鼓足勇气冲出着火带。
逃向天台也是路。如果下去的楼梯已经烧塌,可以上行至天台、楼顶,等待救生时机。
千万不要盲目开窗、开门,不要盲目乱跑、跳楼。要采取积极措施求救,等待救援。(可利用自制救生绳索自救逃生,但三楼以上的人慎用此方法)
氧化剂(助燃剂)。凡能帮助或支持燃烧的物质(如空气、高锰酸钾等)
02
03
04
5防火的基本措施:
控制可燃物。如用难燃的材料替换易燃的材料,加强通风等
隔绝助燃物。干粉、干沙、泡沫灭火就是隔绝可燃物和空气
消除着火源。禁止将任何火源带进仓库
阻止火势蔓延。设置防火通道、防火区间、防火门
灭火剂与灭火器
1最常用的灭火剂——水
克服盲目追随的方法是:平时要多了解与掌握一定的消防自救与逃生知识,避免事到临头没有主见。
01
02
03
错误四:从高往低处逃生 特别是高层建筑一旦失火,人们总是习惯性地认为:尽快逃到一楼,跑到室外,才有生之希望。殊不知,盲目朝楼下逃生,可能自投火海。因此,在发生火灾时,有条件时可登上房顶或在房间内采取有效之防烟、防火措施后等待救援。
消防安全四个能力建设
初起火灾扑救及建筑灭火设施

(Байду номын сангаас)灭火的局限性
1、不宜扑救自已能生氧的化学药品的火灾。 2、不宜扑救活泼金属及其氢化物火灾。 3、不宜扑救能自然分解的化学物品的火灾。 4、不宜扑救内部阴燃的纤维物的火灾 。
第三
灭火器
一、灭火器的组成: 灭火器是由筒体、器头、喷嘴等部件组成。 二、灭火器类型: (一)按操作使用方法分类 1、 手提式灭火器 2、 推车式灭火器 3、 背负式灭火器 4、 手抛式灭火器 5、 悬挂式灭火器
(7) 水压试验压力 (8) 毒性及防触电警告 (9) 生产许可证 (10) 出厂日期 (11) 制造厂名称或代号
四、灭火器的操作使用及维护管理
(一)、灭火器的操作使用 1、要对有关人员进行适当的培训,确保火 灾时在场人员能够正确使用所配臵的灭火器。 2、使用手提式灭火器时,可手提灭火器的 提把,迅速奔到距燃烧处约5米左右,放下灭火 器,拔出保险销,一手握住灭火器的可启压把, 另一只手握住喷射软管前端的喷嘴外或灭火器 底圈,对准火焰根,用力压下开启压把并紧压 不松开,由近而远左右扫射,直至将火焰全部 扑灭。
建筑灭火设施
第一、 灭火设施的类型 一、初起火灾的灭火设施 灭火器、消防水喉、轻便消防水龙 二、初、中期火灾灭火的设施 火灾自动报警,灭火系统目前常用的有以下几种: (1)自动喷水灭火系统 (2) 气体灭火系统。 (3)泡沫灭火系统。 (4) 干粉灭火系统。 (5) 蒸气灭火系统
三、较大火灾灭火设施 消防栓给水系统
二、泡沫灭火剂 (一)类型 泡沫灭火剂有两类: 一类是空气泡沫灭火剂; 另一类是化学泡沫灭火剂 (二)、灭火作用 1、 冷却作用。 2、 窒息作用。 3、 遮断作用。 4、淹没作用
(三)常用的泡沫灭火剂的种类 及适用范围(A、B类火灾)
mfzabc4灭火器啥意思

mfzabc4灭火器啥意思
MFZ/ABC4灭火器是指4kg手提式干粉灭火器。
可用于扑灭:A类火(普通的固体材料火),B类火(可燃液体火),C类火(气体和蒸气火)。
灭火器的类别
一、灭火器按充装的灭火剂可分为五类:
1、干粉类的灭火器。
充装的灭火剂主要有两种,即碳酸氢钠和磷酸铵盐灭火剂。
2、二氧化碳灭火器。
3、泡沫型灭火器。
4、水型灭火器。
5、卤代烷型灭火器(俗称“1211”灭火器和“1301”灭火器)
二、灭火器按驱动灭火器的压力型式可分为三类:
1、贮气式灭火器。
灭火剂由灭火器上的贮气瓶释放的压缩气体的或液化气体的压力驱动的灭火器.
2、贮气式灭火器.灭火剂由灭火器同一容器内的压缩气体或灭火蒸气的压力驱动的灭火器.
3、化学反应式灭火器.灭火剂由灭火器内化学反应产生的气体压力驱动的灭火器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R X
[R
δ +
δ -
X]
R + X-
+
电荷增加
SN2反应,在多数情况下,过渡状态的电荷 分散,因此非极性溶剂对SN2反应有利。
Nu + R
-
δ -
δ -Leabharlann X[ NuR
X]
Nu
R + X-
电荷分散
41
三. 消除反应的机理
卤代烃脱卤化氢的反应,是消除反应。
β-碳上的氢和离去基团L同时离去的反应,
称为β-消除反应 α-碳上的氢和离去基团L同时离去的反应, 称为α-消除反应。
81% 主产物 19%
CH3
KOH C2H5OH
CH3CH
C(CH3)2 + CH3CH2C
29%
CH2
三. 还原反应
卤代烷可以用氢化铝锂还原为烷烃。这是制备
纯烷烃的一种重要方法。
CH3(CH2)6CH2X
反应活性:
LiAlH4 THF
CH3(CH2)6CH3 + AlH3 + LiX
烷基相同时, 活性为RI>RBr>RCl, 氟代烷不反应。 烷基不同时,伯卤代烷>仲卤代烷>叔卤代烷。
无水乙醚
R
X + Mg
R
MgX
有机镁试剂称为Grignard试剂。 Grignard 试 剂 的 组 成 : 很 复 杂 , 为 RMgX 、 R2Mg、MgX2 、(RMgX)n 等的混合体系,但常用 R—MgX表示。
20
Grignard试剂的性质: ①和含活泼氢的化合物反应,迅速分解生成烷烃。
Nu + R1
-
+
R2
R1 C
Nu R2 + R1
C
C R3
R3 R2 Nu
{
外消旋体
34
R3
二. 影响亲核取代反应活性的因素
1. 反应物烃基的结构
RX 3°
RX 2°
RX 1°
CH3X
SN2的活性增强 SN1的活性增强
SN2反应中空间效应起主导作用:空阻越大,SN2 反应速率越小; SN1反应中电子效应起主导作用,碳正离子越稳定, 反应越容易进行 。
38
试剂亲核性的规律:
①亲核原子相同时,亲核性和碱性的强弱一致。
RO- > OH- > ArO- > RCOO- > ROH > H2O
②带负电荷的试剂亲核性比它的共轭酸强。
OH- > H2O RO- > ROH
③亲核原子为同周期元素,亲核性与碱性强弱 一致。
H2N- > OH- > FR3C- > R2N- > RO- > F39
18
氢化铝锂遇水会分解,反应要在无水条件下进 行。
LiAlH4 + 4H2O
代烷。
LiOH + Al(OH)3 + 4H2
硼氢化钠可以在水溶液中使用,也可用于还原卤
NaBH4
R
X
R
H
氢碘酸作还原剂也可将卤代烷还原为烷烃。
R X
HI
R H
19
四. 和金属反应
(1) 和镁反应 有机镁化合物中的C—Mg键是强极性共价键。
4
叔卤代烃 3º 卤代烃
2 卤代烃的命名
(1) 系统命名法
看作烃的卤代衍生物,把卤素原子作为取代 基。 卤代烷烃:
CH3CHCHCH3 Br CH3
2-甲基-3-溴丁烷
5
卤代环烷烃:
H H Br CH3
(1R,2S)-1-甲基-2-溴环己烷
同一化合物中含有两种卤素:
CH3CHCH2CHCH3 Br Cl
11
和NaOH或KOH的水溶液共热,生成相应的醇。
H2O
RX + OH
-
ROH + X -
和醇钠反应生成醚,Williamson合成法。
R
X + R'ONa
R
O
R' + NaX
与过量的氨反应可得胺。
R X + NH3 R NH3X
+
-
NH3
R
NH2 + NH4X
12
和氰化钠在乙醇溶液中反应生成腈。
CH3CH CH2 Cl Cl
CH3CCH3 Br
偕二卤代烷
连二卤代烷
三卤代烃
CHF3
氟仿
CHCl3
氯仿
CHBr3
溴仿
CHI3
碘仿
3
按与卤素原子直接相连的碳原子的类型:
CH3CHCH2CH 2 CH3 Cl
伯卤代烃 1º 卤代烃
CH3CHCH2CH3 Br
仲卤代烃 2º 卤代烃
CH3 CH3CCH3 Br
CH3COCH3
R I + NaCl
R Br + NaI
CH3COCH3
R I + NaBr
原因:NaI溶于丙酮,NaCl和NaBr不溶于丙酮。 亲核取代反应的活性:RI > RBr > RCl >RF。
15
二. 消除反应
卤代烷与NaOH或KOH的乙醇溶液共热,失去 卤化氢生成烯烃。
RCH CH 2+ NaOH H X
CH3CH2CHCH3 Cl
Cl
CH3CHCH3 CH3
CH3CHCH2Cl CH3
CH3CHCH 3 CH3
8
第二节 结构和物理性质(自学)
物态:1C~3C的氟代烷、1C~2C的氯代烷和溴甲烷为气
体, 其他一卤代烷为液体, 15C以上为固体。
沸点: 随碳原子数增加而升高,比相应的烷烃高。 相对密度:一氟代烷和一氯代烷的相对密度小于1,一溴
23
(2) 和锂反应
在氮气或氩气的保护作用下,生成有机锂化 合物。C—Li键也是强极性共价键。
C4H9Cl + 2Li
石油醚
C4H9Li + LiCl
有机锂试剂的反应与格氏试剂相似,但比格 氏试剂更为活泼。
OCH3 + C4H9Li H OCH3 + C4H10 Li
24
烷基锂与碘化亚铜作用,生成二烷基铜锂,
OH
29
反应的活性中间体为碳正离子。
sp2杂化
CH3 C CH3
+
CH 3
2p空轨道
正电荷分散程度越大,碳正离子越稳定。 (稳定性顺序同烷基自由基)
30
碳正离子易发生重排,有重排产物生成。
CH3 CH3-C-CH-CH3 H3C Br
H2O -H
+
CH3
H2O
SN1 OH CH3- C- CH- CH3 H3C CH3
α
C C L H
β
α
C H L
β-消除(1,2-消除)
α-消除(1,1-消除)
42
1 E2历程 是通过一个过渡状态,一步完成的。
第四章 卤代烷 亲核取代反应
鸟嘌呤
溴甲烷 昆虫熏蒸剂
1
第一节 分类和命名
1 卤代烃的分类
按分子中所含的卤素:
氟代烃、氯代烃、溴代烃、碘代烃。 按烃基的结构:
CH3CH2X
饱和卤代烃
CH2 CHCH2X
不饱和卤代烃
X
卤代芳烃
CH2X
2
按分子中卤素原子数: 一卤代烃
CH3CH2Br
Br
二卤代烃
④亲核原子为同族元素时,亲核性与碱性强弱顺
序相反。
RS- > RORSH > ROH
I- > Br- > Cl- > F⑤体积较大的试剂不易接近碳原子,亲核性较 小。 CH3O- >CH3CH2O- >(CH2)2CHO- >(CH3)3CO40
4. 溶剂的极性 SN1反应,溶剂的极性增强,使反应速度加快。
酸的根是很好的离去基团。
卤素的离去倾向顺序为:I- > Br- > Cl- > F-。
37
3. 亲核试剂 亲核试剂的强弱,对SN1反应没有影响;但亲核 性强的试剂,有利于SN2历程。 亲核性和碱性: ①碱性是平衡问题,亲核能力是有关速度的问题。 较强的碱在平衡时能抓住大部分的酸,而较强的 亲核试剂进攻碳比较快。 ②碱性是指与质子的相互作用,亲核能力和离去 能力则是指与碳的相互作用。
R
X + AgNO 3
C 2H5OH
R
ONO2 + AgX
用途: ①根据生成沉淀的快慢,可确定卤代烃的活性次 序; ②用于各类卤代烃的鉴别:3º 卤代烃在室温下能
迅速反应,生成卤化银沉淀,2º 卤代烃反应较慢,
1º 卤代烃要加热才能反应。
14
氯代烷和溴代烷可以和碘化钠的丙酮溶液反应。
R Cl + NaI
-
HO H
Br H
28
(2) 单分子历程SN1
(CH3)3C Br + OH-
(CH3)3C OH + Br-
反应是分两步进行的:
(CH3)3C Br
慢
δ + δ -
[ (CH3)3C
δ +
Br ]
δ -
(CH3)3C + Br
+
-
(CH3)3C ++ OH
-
[ (CH3)3C
OH ]
(CH3)3C
中心碳原子 离去基团
RCH2
反应物
L + Nu· ·
