《气体的等温变化》PPT课件
合集下载
气体的等温变化课件

在化学反应动力学研究中,气体的等温变化原理被用于研 究化学反应速率与温度的关系,为化学反应机理和动力学 模型的研究提供重要依原理是研究热力学性质 和状态方程的重要基础,如范德华方程、维里方程等。
在日常生活中的应用
压力锅
温度调节
压力锅是利用气体的等温变化原理来 提高烹饪效率的厨房用具。通过加压 烹饪,可以缩短烹饪时间并保持食物 的营养和口感。
验结果的影响。
数据记录
准确记录实验数据,避 免遗漏或误差。
实验后处理
实验结束后,应关闭气 瓶阀门,清理实验装置
,确保实验室整洁。
04
等温变化的实验结果分析
实验数据记录与整理
数据记录
在实验过程中,需要详细记录气体的 温度、压力和体积等数据,确保数据 的准确性和完整性。
数据整理
将实验数据整理成表格或图表形式, 便于分析和比较不同条件下的实验结 果。
在日常生活中,温度调节设备如空调 、暖气等都利用了气体的等温变化原 理。通过调节温度和压力,实现室内 温度的调节和控制。
气球和飞艇
气球和飞艇利用气体的等温变化原理 来调节浮力和姿态。通过充气和放气 ,气球和飞艇可以实现升空、悬浮和 下降等动作。
感谢您的观看
THANKS
如化工、制药、食品加工 等领域,利用等温变化原 理进行气体分离、液化、 压缩等操作。
科学实验研究
在实验室中模拟等温变化 过程,研究气体性质和反 应机理。
02
理想气体定律
理想气体定律的表述
理想气体定律的表述
在等温、等压条件下,气体的体积与气体的物质的量成正比。
公式表示
V1/n1=V2/n2 或 p1V1=p2V2
理想气体定律的适用范围
适用范围
在日常生活中的应用
压力锅
温度调节
压力锅是利用气体的等温变化原理来 提高烹饪效率的厨房用具。通过加压 烹饪,可以缩短烹饪时间并保持食物 的营养和口感。
验结果的影响。
数据记录
准确记录实验数据,避 免遗漏或误差。
实验后处理
实验结束后,应关闭气 瓶阀门,清理实验装置
,确保实验室整洁。
04
等温变化的实验结果分析
实验数据记录与整理
数据记录
在实验过程中,需要详细记录气体的 温度、压力和体积等数据,确保数据 的准确性和完整性。
数据整理
将实验数据整理成表格或图表形式, 便于分析和比较不同条件下的实验结 果。
在日常生活中,温度调节设备如空调 、暖气等都利用了气体的等温变化原 理。通过调节温度和压力,实现室内 温度的调节和控制。
气球和飞艇
气球和飞艇利用气体的等温变化原理 来调节浮力和姿态。通过充气和放气 ,气球和飞艇可以实现升空、悬浮和 下降等动作。
感谢您的观看
THANKS
如化工、制药、食品加工 等领域,利用等温变化原 理进行气体分离、液化、 压缩等操作。
科学实验研究
在实验室中模拟等温变化 过程,研究气体性质和反 应机理。
02
理想气体定律
理想气体定律的表述
理想气体定律的表述
在等温、等压条件下,气体的体积与气体的物质的量成正比。
公式表示
V1/n1=V2/n2 或 p1V1=p2V2
理想气体定律的适用范围
适用范围
《1 气体的等温变化》PPT课件(部级优课)
温变化过程中压强与体积的定量关系
1、实验中的研究对象是什么? 一定质量的气体
2、如何控制气体的质量m、温度T保持不变?
封闭、缓慢移动活塞、不触碰容器壁
3、如何改变压强P、体积V? 4、如何测量压强P、体积V?
求压强
Ps
m M
P0s (M+m)g
横截面积S Ps =P0s +(M+m)g
P=P0 +(M+m)g/S-F/S
(三)玻意耳定律
1、内容:
一定质量的气体,在温度不变的情况下,它的压强跟体 积成反比
2、表达式: PV C P1V1 P2V2
3、图像:
P
P
V
4、适用范围:温度不太低,压强不太大 1/V
5.等温变化图象
①等温线是双曲线的一支。 ②温度越高,其等温线离原点越远.
同一气体,不同温度下等温线是不同的
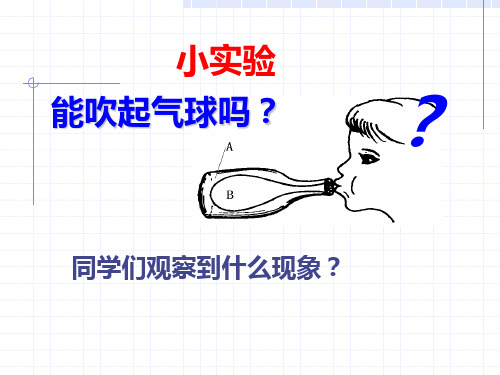
小实验
能吹起气球吗?
?
同学们观察到什么现象?
热学性质 T
复习: 气体状态的描述 (气体的三个状态参量)
几何性质
V
力学性质 P
(一) 气体的等温变化
m不变 T不变
(二)实验探究
猜想: P、V的关系
水中的气泡在上升的过程中,气泡 不断变大,说明压强减小,体积增大。
定量研究: 设计一个实验研究一定质量的气体在等
求压强刻度值是体积吗? 怎么算体积? 一定需要测截面积吗?
实 验次
实验数据的处理
数1 2 3 4 5
压强(×105Pa)
体积(L)
p/105 Pa
3
2
1
0
0.2
0.4
0.6
0.8
1/V
1、实验中的研究对象是什么? 一定质量的气体
2、如何控制气体的质量m、温度T保持不变?
封闭、缓慢移动活塞、不触碰容器壁
3、如何改变压强P、体积V? 4、如何测量压强P、体积V?
求压强
Ps
m M
P0s (M+m)g
横截面积S Ps =P0s +(M+m)g
P=P0 +(M+m)g/S-F/S
(三)玻意耳定律
1、内容:
一定质量的气体,在温度不变的情况下,它的压强跟体 积成反比
2、表达式: PV C P1V1 P2V2
3、图像:
P
P
V
4、适用范围:温度不太低,压强不太大 1/V
5.等温变化图象
①等温线是双曲线的一支。 ②温度越高,其等温线离原点越远.
同一气体,不同温度下等温线是不同的
小实验
能吹起气球吗?
?
同学们观察到什么现象?
热学性质 T
复习: 气体状态的描述 (气体的三个状态参量)
几何性质
V
力学性质 P
(一) 气体的等温变化
m不变 T不变
(二)实验探究
猜想: P、V的关系
水中的气泡在上升的过程中,气泡 不断变大,说明压强减小,体积增大。
定量研究: 设计一个实验研究一定质量的气体在等
求压强刻度值是体积吗? 怎么算体积? 一定需要测截面积吗?
实 验次
实验数据的处理
数1 2 3 4 5
压强(×105Pa)
体积(L)
p/105 Pa
3
2
1
0
0.2
0.4
0.6
0.8
1/V
《气体的等温变化》课件

《气体的等温变化》ppt课件
目录
• 气体的等温变化概述 • 理想气体模型 • 波义耳定律 • 等温变化的实验验证 • 等温变化的工程应用
01
气体的等温变化概述
等温变化的概念
等温变化
在等温过程中,气体的温度保持 不变,即气体与外界没有热量交
换。
等温变化的过程
气体在等温条件下经历的状态变化 。
等温变化的条件
理想气体模型的应用
在科学研究、工业生产和日常生活中,理想气体模型被广泛用于描述气体的性质和 行为。
在化学反应、燃烧过程、热力学等领域,理想气体模型为理论分析和实验研究提供 了基础。
通过理想气体模型,我们可以推导出许多重要的热力学公式和定律,如波义耳定律 、查理定律等。
03
波义耳定律
波义耳定律的表述
02
理想气体模型
理想气体模型的定义
01
理想气体模型是一种理论模型, 用于描述气体在一定条件下(如 温度和压力)的行为。
02
它忽略了气体分子间的相互作用 和分子自身的体积,只考虑气体 分子的平均动能。
可以忽略不计。
气体的温度保持恒定 ,即等温变化。
气体分子本身的体积 相比于容器容积可以 忽略不计。
在管道输送过程中,等温过程 可以减少气体温度的变化,保 证输送效率。
在气瓶压力控制过程中,等温 过程可以保证气瓶压力的稳定 性,提高气瓶的使用安全性。
THANKS
感谢观看
波义耳定律的应用实例
总结词
波义耳定律的应用实例
详细描述
波义耳定律在日常生活和工业生产中有着广泛的应用。例如,在气瓶压力不足时,可以通过减小体积来增大压力 ;在气瓶压力过高时,可以通过增大体积来减小压力。此外,波义耳定律还应用于气体压缩、气体输送、气体分 离等领域。
目录
• 气体的等温变化概述 • 理想气体模型 • 波义耳定律 • 等温变化的实验验证 • 等温变化的工程应用
01
气体的等温变化概述
等温变化的概念
等温变化
在等温过程中,气体的温度保持 不变,即气体与外界没有热量交
换。
等温变化的过程
气体在等温条件下经历的状态变化 。
等温变化的条件
理想气体模型的应用
在科学研究、工业生产和日常生活中,理想气体模型被广泛用于描述气体的性质和 行为。
在化学反应、燃烧过程、热力学等领域,理想气体模型为理论分析和实验研究提供 了基础。
通过理想气体模型,我们可以推导出许多重要的热力学公式和定律,如波义耳定律 、查理定律等。
03
波义耳定律
波义耳定律的表述
02
理想气体模型
理想气体模型的定义
01
理想气体模型是一种理论模型, 用于描述气体在一定条件下(如 温度和压力)的行为。
02
它忽略了气体分子间的相互作用 和分子自身的体积,只考虑气体 分子的平均动能。
可以忽略不计。
气体的温度保持恒定 ,即等温变化。
气体分子本身的体积 相比于容器容积可以 忽略不计。
在管道输送过程中,等温过程 可以减少气体温度的变化,保 证输送效率。
在气瓶压力控制过程中,等温 过程可以保证气瓶压力的稳定 性,提高气瓶的使用安全性。
THANKS
感谢观看
波义耳定律的应用实例
总结词
波义耳定律的应用实例
详细描述
波义耳定律在日常生活和工业生产中有着广泛的应用。例如,在气瓶压力不足时,可以通过减小体积来增大压力 ;在气瓶压力过高时,可以通过增大体积来减小压力。此外,波义耳定律还应用于气体压缩、气体输送、气体分 离等领域。
《气体的等温变化》课件

《气体的等温变化》PPT课件
本PPT课件是关于气体的等温变化的介绍。通过本课件,您将了解气体等温 变化的定义、特点、图形表示、实际应用、意义和影响等内容。让我们一起 探索气体的神奇世界吧!
气体的等温变化:定义
气体的等温变化是指在恒定温度下,气体的体积和压力之间的关系变化。
等温过程的特点
1
定义
等温过程是指温度保持不变的情况下,气体发生的体积和压力变化。
2
原理
等温过程遵循理想气体状态方程 PV = nRT,其中 P 为压力,V 为体积,n 为物 质的物质量,R 为气体常数,T 为温度。
3
物理公式
Boyle's Law: PV = k (k为常数)
Charle's Law: V/T = k(k为常数)
气体等温变化的图形表示
等温图
等温图是表示气体等温变化的 图形,横轴为体积,纵轴为压 力,曲线为等温线。
等温线
等温线是等温变化曲线上的每 个点,表示相同温度下对应的 压力和体积。
示意图
示意图通过简化的图形展示了 气体等变化的基本特点。气体等温变化的实际应用
工业过程
气体等温变化广泛应用于工业过程中的气体压缩、液化和输送。
自然现象
气体等温变化在自然界中的应用包括大气压力变化、温度变化和气候现象。
实验示例
通过气体等温变化的实验,可以观察气体在相同温度下体积和压力的关系。
气体等温变化的意义和影响
• 运算过程中的注意事项 • 熵变与气体等温变化之间的关系 • 对系统能量的转化和传递的影响
总结与展望
通过本PPT课件的学习,您已经了解了气体的等温变化的定义、特点、图形 表示、实际应用、意义和影响。希望您对气体的等温变化有了更深入的理解。 继续探索气体世界的奥秘吧!
本PPT课件是关于气体的等温变化的介绍。通过本课件,您将了解气体等温 变化的定义、特点、图形表示、实际应用、意义和影响等内容。让我们一起 探索气体的神奇世界吧!
气体的等温变化:定义
气体的等温变化是指在恒定温度下,气体的体积和压力之间的关系变化。
等温过程的特点
1
定义
等温过程是指温度保持不变的情况下,气体发生的体积和压力变化。
2
原理
等温过程遵循理想气体状态方程 PV = nRT,其中 P 为压力,V 为体积,n 为物 质的物质量,R 为气体常数,T 为温度。
3
物理公式
Boyle's Law: PV = k (k为常数)
Charle's Law: V/T = k(k为常数)
气体等温变化的图形表示
等温图
等温图是表示气体等温变化的 图形,横轴为体积,纵轴为压 力,曲线为等温线。
等温线
等温线是等温变化曲线上的每 个点,表示相同温度下对应的 压力和体积。
示意图
示意图通过简化的图形展示了 气体等变化的基本特点。气体等温变化的实际应用
工业过程
气体等温变化广泛应用于工业过程中的气体压缩、液化和输送。
自然现象
气体等温变化在自然界中的应用包括大气压力变化、温度变化和气候现象。
实验示例
通过气体等温变化的实验,可以观察气体在相同温度下体积和压力的关系。
气体等温变化的意义和影响
• 运算过程中的注意事项 • 熵变与气体等温变化之间的关系 • 对系统能量的转化和传递的影响
总结与展望
通过本PPT课件的学习,您已经了解了气体的等温变化的定义、特点、图形 表示、实际应用、意义和影响。希望您对气体的等温变化有了更深入的理解。 继续探索气体世界的奥秘吧!
气体的等温变化PPT教学课件

四.平衡状态
平衡态: 在不受外界影响(即系统与外界没有物质和能
量的交换)的条件下,无论初始状态如何,系统的 宏观性质在经充分长时间后不再发生变化的状态。 准静态过程:如果状态变化过程进行得非常缓慢,以 至过程中的每一个中间状态都近似于平衡态,这样的 过程称为“准静态过程 ”,又称“平衡过程 ”。
§3 理想气体物态方程
例:若汽缸内气体为系统,其它为外界
二.系统状态的描述 微观量:分子的质量、速度、动量、能量等。
在宏观上不能直接进行测量和观察。 宏观量: 温度、压强、体积等。
在宏观上能够直接进行测量和观察。 宏观量与微观量的关系: 宏观量与微观量的内在联系表现在大量分子杂乱无章 的热运动遵从一定的统计规律性上。在实验中,所测 量到的宏观量只是大量分子热运动的统计平均值。
3.1 气体的实验规律 一.气体定律
P1V1 P2V2 恒量 (质量不变) T1 T2
二.阿伏伽德罗定律 在相同的温度和压强下,1摩尔的任何气体所占据的体积 都相同.在标准状态下,即压强P0=1atm、温度T0=273.15K 时, 1摩尔的任何气体的体积均为 v0=22.41L/mol
N A 6.022 1023 mol 1
D
p=p0-h
探究方法: 控制变量法
控制变量法:在实验中研究三个物理量的关 系时,先保持一个量不变,研究另外两个 量的关系;然后再保持另一个量不变,研 究剩余两个量的关系,最后把研究结果结 合起来,这种方法叫做控制变量法
基础知识:
等温变化: 气体在温度不变的状态下,
发生的变化叫做等温变化。
猜想
讨论回答:
气体等温变化的p-v图像
p
t2 t1
0
V
例题:
气体的等温变化(第一课时)课件(共44张PPT)高二下学期物理人教版(2019)选择性必修第三册

专题 1 : 封闭气体压强的计算
一、压力与压强
F
1、压强的计算: p
P =ρgh h:为竖直方向的高度
S
2、压强的单位:
(1)国际单位:帕斯卡(Pa) 1pa=1N/m2
(2)常用单位:标准大气压(atm)
厘米汞柱(cmHg)、毫米汞柱(mmHg)
5
1atm 1.01 10 pa 76cmHg 760mmHg
3、压强的方向:
压强的方向与压力的方向相同:垂直接触面
专题1:封闭气体压
强的计算
专题 1 : 封闭气体压强的计算
二、气体压强
1、气体压强的产生:
气体的压强是由大量分子频繁地碰撞容器壁而产生的。
2、气体压强的特点:
由于气体的自重忽略不计,故密闭气体内部各部分压强
处处相等。但大气压强是由重力产生的,大气压随高度的
(2)p - 1 图像:一定质量的气体的p - 1 图像为过原点的_________,如图乙
V
所示。
V
探究与思考
1
p- 图像是一条过原点的直线,更能直观描述压强与体积的关系,
V
为什么直线在原点附近要画成虚线?
1
提示:在等温变化过程中,体积不可能无限大,故 和 p不可能为零,所以图线在
V
原点附近要画成虚线,表示过原点,但此处实际不存在。
状态参量
状态的这几个物理量叫作气体的_________。
2.等温变化:
一定质量的气体
温度不变
我们首先研究一种特殊的情况:_______________,在_________的条件下,其压
强与体积变化时的关系,我们把这种变化叫作气体的等温变化。
玻意耳定律
气体的等温变化精品PPT课件

h
h
h
②
③
一 气体的压强
h
h
h
④
⑤
⑥
一 气体的压强
⑦ m
S
⑧
m S
一 气体的压强
⑨
M
Sm
⑩ Sm
M
二 气体等温变化
实验探究 等温变化过程中压强与体积的关系 m S
结论:V减小,P增大
猜想: P、V 反比?
二 气体等温变化
二 气体等温变化
玻意耳定律
1、内容: 一定质量的气体,在温度不变的情况下,它的压强跟
例2. 某个容器的容积是10L,所装气体的压强是20×105Pa。 如果温度保持不变,把容器的开关打开以后,容器里剩下的气 体是原来的百分之几?设大气压是1.0×105Pa。
结束语
当你尽了自己的最大努力时,失败也是伟大的, 所以不要放弃,坚持就是正确的。
When You Do Your Best, Failure Is Great, So Don'T Give Up, Stick To The End
体积成反比
2、表达式: PV C P1V1 P2V2
二 气体等温变化
二.等温变化图象 等温线是双曲线的一支。
p
23
1
0
V
t3>t2>t1
二 气体等温变化
例1 一定质量气体的体积是20L时,压强为1×105Pa。当气体的 体积减小到16L时,压强为多大?设气体的温度保持不变。
二 气体等温变化
感谢聆听
不足之处请大家批评指导
Please Criticize And Guide The Shortcomings
演讲人:XXXXXX 时 间:XX年XX月XX日
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精选ppt
3
隔离活塞:活塞受力情况为: PS+F-mg-P0S=0
计算的方法是: 对固体(活塞或汽缸)进行受力分析,列出平 衡方程,进而求解出封闭气体的压强.
精选ppt
4
2.如图所示,气缸由两个横截面不同的圆筒连接而成.活 塞A、B被轻质刚性细杆连接在一起,可无摩擦移动.A、 B的质量分别为mA,mB,横截面积分别为SA,SB.一定质 量的理想气体被封闭在两活塞之间,活塞外侧大气压强 p0。气缸水平放置达到平衡状态如图(a)所示, 将气缸 竖直放置达到平衡后如图(b)所示. 求两种情况下封闭 气体的压强.
的,B端开口向上。两管中水银面的高度差h=20cm。
外界大气压强为76cmHg。求A管中封闭气体的压强。
A
B
(提示:76cmHg=760mmHg=1.01×105Pa h 液体压强公式:P= ρgh)
计算的方法步骤是:
图8-2
①选取一个假想的液体薄片(其自重不计)为研究对
象(选最低液面);
②分析液片两侧受力情况,建立力的平衡方程,消去
第八章 气体
1、气体的等温变化
精选ppt
1
气体的状态参量
1、温度
热力学温度T ,单位:开 尔文 T = t + 273 K
宏观上表示物体的冷热程度,微观上表示物
体内部分子无规则运动的剧烈程度。
复 习 2、体积
体积 V 单位:有L、mL等
气体的体积是指气体分子所能达到的空间,等
于容器的容积。
3、压强
2、表达式: PVC P1V1P2V2
3、图像: P
P
精选ppt
V
1/1V5
三、玻意耳定律
点拨:(1)玻意耳定律是实验定律,由英国科学家 玻意耳和法国科学家马略特各自通过实验独立发现的。
(2)成立条件:质量一定,温度不变, 适用范围:压强不太大,温度不太低。
(3)pV=C。其中常量C 与气体的质量、种类、 温度有关。
小结:一定质量的某种气体,温度不变,当体积缩小 时,压强增大,气体体积增大时压强减小 猜想:可能压强和体积成反比
精选ppt
13
p/105 Pa
3
实 验2 数 据 处 理
1
0
0.2
0.精4选ppt 0.6
0.8
14
1/V
三、玻意耳定律
1、内容:
P 1 PC
V
V
一定质量的气体,在温度不变的情况下,它的压 强跟体积成反比
精选ppt
16
四、等温线
1、图象平面上的一
个点代表什么?曲线
1.一定质量的某种气体在等温 AB代表什么? 变化过程中压强p跟体积V的反 2、pV=恒量一式中 比关系,在p-V 直角坐标系中 的恒量是普适恒量吗?
表示出来的图线叫等温线。
2.一定质量的气体等温线的p-
V图是双曲线的一支。
3.等温线的物理意义:
①.注射器内一定质量的气体. ②.压强、体积(体积的变化与空气柱的长度有关)
③.变化过程十分缓慢、容器透热、环境恒温;手 不要握住注射器的外管。
④.柱塞上涂上凡士林密封
精选ppt
12
我们可用注射器来定性研究
研究题目:一定质量的某种气体,温度不变,当体 积缩小时,压强有什么变化?你怎么体会到的?当 体积增大时,压强有什么变化?你怎么体会到的? 强调:实验过程中,手不要握住注射器的外管
水平时:对活塞AB和细 杆进行受力分析有: P0SA-P1SA-P0SB+P1SB=0
竖直时,同理可得:
P0SA+mAg-P2SA+
P2SB+mBg-P0SB=0
精选ppt
5
3.容器加速运动时求封闭气体的压强
例3:如图所示,一个壁厚可以不计、质量为M的汽 缸放在光滑水平地面上,活塞的质量为m,面积为S, 内部封有一定质量的气体.活塞不漏气,摩擦不计,外 界大气压强为P0,若在活塞上加一水平向左的恒力F (不考虑气体温度的变化),求汽缸和活塞以共同加
速度运动时,缸内气体的压强多大?
F
计算的方法步骤是:
①当容器加速运动时,通常选择与气体相关联的液体
柱,固体等作为研究对象,进行受力分析,画出分析 图示;
②根据牛顿第二定律列出方程;
③解方程,求出封闭气体压精选强ppt
6
2.用液体封闭的气体压强的计算(平衡态)
例2:如图8-2所示,粗细均匀的U形管的A端是封闭
横截面积,得到液片两侧的压强平衡方程;
③解方程,求得气体压强精选ppt
7
3.压强的计算练习
1、如图1所示,试求甲、乙、丙中各封闭气 体的压强P1、P2、P3、P4 。(已知大气压为 P0,液体的密度为ρ,其他已知条件标于图上, 且均处于静止状态)
图1 精选ppt
8
气体的等温变化
精选ppt
9
诱思导学:
图线上的一点表示气体的一个
确定的状态。同一条等温线上
各状态的温度相同,p与V的乘
积相同。不同温度下的等温线,
离原点越远,温度越高。
精选ppt
17
五、典型例题
例1、粗细均匀的玻璃管,一端封闭,长为12cm, 一个人手持玻璃管开口向下潜入水中,当潜到水下 某深度时看到水进入玻璃管口2cm,求人潜入水中 的深度。(取水面大气压强为P0 =1.0 ×105Pa, g暴晒常常会 爆胎,为什么? 一只凹进的乒乓球,怎样能使它恢复原状?
其实,生活中许多现象都表明,气体的压强,体积, 温度三个状态量之间一定存在某种关系,那么是什 么关系呢?我们怎么来研究?
研究的方法-----控制变量法
本节课我们就来研究控制一定质量的某种气体,
温度不变的情况下,压强与体积的变化关系。
我们称之为等温变化。精选ppt
10
实验探究:
提出问题:一定质量的 气体在温度不变的情况 下,压强与体积之间有 什么关系呢?
二、探究气体等温 变化的规律
1.实验装置(课本实验)
精选ppt
11
①.我们的研究对象是什么? ②.实验需要测量的物理量? ③.怎样保证实验过程温度不变? ④.怎样保证气体质量不变? ⑤.要使密封气体的压强,体积变化,应如何操作? 压强如何表达?
压强 p 单位:Pa(帕斯卡)
气体作用在器壁单位面积上的压力叫做气体压
强。
精选ppt
2
一、压强的计算
气体压强是大量气体分子对容器壁碰撞而产生的。容 器壁上单位面积所受气体的压力即压强。可见,求气 体压强的问题其实是一个力学问题。
1.用固体封闭的气体压强的 计算(平衡态)
例1.封闭气体的汽缸挂在弹簧秤 下,弹簧秤的读数为F,已知缸体的 质量为M,活塞的质量为m,截面 积为S,活塞与汽缸间的摩擦不计, 外界大气压强为P0,则汽缸内气体 压强p为多少?
