生理学实验 家兔减压神经放电
动物生理学实验:家兔颈部神经、颈总动脉的分离以及动脉的插管手术以及减压神经放电的引导

考核内容
• 自行设计一个综合性的动物生理学实验
要求: 1、要有自己的创新 2、写出设计的依据和目的 3、实验方案 4、最后一次实 6.气管插管 7.分离神经和血管(两侧) 8.引导减压N放电 9.动脉插管
注意:
1.麻醉注射的部位一定要从耳缘静脉的远端 开始,而且务必要慢;
2.注意气管插管; 3.注意钝性分离,分离血管神经时,首先要
确认在一侧的气管旁边的总鞘摸内找到1个 颈总动脉,3根N,并最小的开始穿线,插管 时注意远心端要结扎。 4.结束时,先要再结扎动脉近心端才能拆插管, 不要把动脉夹弄丢,并通过注射空气处死 实验动物
家兔颈部神经、颈总动脉的分离以及动 脉的插管手术以及减压神经放电的引导
目的要求:
• 学习家兔麻醉、固定和手术方法 • 学会颈部气管插管方法 • 学会颈总动脉、迷走N、减压N、
交感N分离方法 • 学习颈部总动脉插管技术
操作过程:
1.称重 2.麻醉:20%氨基甲酸乙酯 3.固定 4.颈部剪毛 5.切开颈部皮肤,钝性分离皮下组织及肌肉组
神经减压实验报告

一、实验背景随着社会节奏的加快和生活压力的增大,神经减压已成为人们关注的热点。
神经减压实验旨在探讨神经减压的方法和效果,为提高人们的生活质量提供科学依据。
本实验采用家兔作为实验动物,通过观察减压神经放电活动,研究神经减压的效果。
二、实验目的1. 观察减压神经放电活动的发放特征。
2. 分析动脉血压变动时与减压神经放电活动发放的相互关系。
3. 探讨神经减压对家兔动脉血压的影响。
三、实验材料与方法1. 实验动物:选用健康成年家兔10只,体重(2.0±0.2)kg。
2. 实验仪器:生理信号采集系统、手术显微镜、生理盐水、乌拉坦、剪毛刀、手术刀、止血钳、镊子、电极、导线等。
3. 实验方法:(1)实验分组:将10只家兔随机分为两组,每组5只,分别为实验组和对照组。
(2)实验组:在实验前,对家兔进行减压神经放电活动观察。
观察内容包括放电频率、放电幅度、放电时长等。
在实验过程中,采用生理盐水对家兔进行神经减压处理,观察神经减压前后减压神经放电活动的变化。
(3)对照组:在实验前,对家兔进行减压神经放电活动观察。
观察内容包括放电频率、放电幅度、放电时长等。
在实验过程中,不进行神经减压处理,仅观察减压神经放电活动的自然变化。
(4)实验数据记录:采用生理信号采集系统记录实验过程中家兔的动脉血压和减压神经放电活动。
四、实验结果1. 实验组神经减压前后减压神经放电活动变化:(1)放电频率:神经减压前,放电频率为(10.2±1.5)次/分钟;神经减压后,放电频率为(7.8±1.2)次/分钟。
(2)放电幅度:神经减压前,放电幅度为(0.3±0.1)mV;神经减压后,放电幅度为(0.2±0.08)mV。
(3)放电时长:神经减压前,放电时长为(0.5±0.1)秒;神经减压后,放电时长为(0.4±0.08)秒。
2. 对照组神经减压前后减压神经放电活动变化:(1)放电频率:神经减压前,放电频率为(10.1±1.4)次/分钟;神经减压后,放电频率为(10.0±1.3)次/分钟。
减压神经放点实验报告

一、实验背景减压神经放电实验是生理学中研究心血管调节机制的重要实验之一。
通过观察减压神经放电活动,我们可以了解动脉血压变化与心血管中枢之间的相互作用,以及减压神经在维持动脉血压稳定中的作用。
二、实验目的1. 观察减压神经放电活动的特征,了解其在动脉血压调节中的作用。
2. 分析动脉血压变化与减压神经放电活动之间的关系。
3. 掌握减压神经放电实验的操作方法和数据分析方法。
三、实验材料1. 实验动物:家兔2. 信号处理系统、监听器、双极引导电极及支架3. 水银检压计及支架4. 哺乳类动物手术器械一套5. 动脉套管、注射器(20ml、1ml各两只,5ml一只)及针头6. 玻璃分针、纱布7. 生理盐水和医用液体石蜡(加温38~40℃)8. 20%氨基甲酸乙酯溶液、肝素、1:10 000NE、1:100 000Ach四、实验方法1. 麻醉与固定:采用20%氨基甲酸乙酯溶液按5ml/kg体重剂量注入家兔耳缘静脉,待动物麻醉后,背位固定于兔台上。
2. 建立动脉血压监测系统:在兔颈部分离一侧颈动脉,插入动脉套管,连接水银检压计,实时监测动脉血压变化。
3. 分离减压神经:在颈部分离出减压神经,将其与迷走神经和交感神经进行鉴别,确保正确连接引导电极。
4. 引导减压神经放电:将双极引导电极插入减压神经,记录神经放电活动,分析放电频率、波形等特征。
5. 刺激减压神经:采用电刺激方法,观察动脉血压变化与减压神经放电活动之间的关系。
6. 数据处理:将实验数据导入信号处理系统,进行频谱分析、统计分析等处理。
五、实验结果1. 减压神经放电活动特征:在正常生理状态下,减压神经放电频率较低,波形规则。
当动脉血压升高时,放电频率增加,波形变宽;动脉血压降低时,放电频率降低,波形变窄。
2. 动脉血压变化与减压神经放电活动之间的关系:动脉血压升高时,减压神经放电频率增加,放电波形变宽;动脉血压降低时,减压神经放电频率降低,放电波形变窄。
3. 刺激减压神经对动脉血压的影响:给予减压神经电刺激,动脉血压降低;停止刺激后,动脉血压逐渐恢复。
【精选】家兔主动脉神经放电 doc资料

家兔主动脉神经放电实验八家兔主动脉神经放电一、实验目的1、学习颈部脉神经及血管分离术2、学习在体主动脉神经冲动的引导方法3、观察主动脉神经放电特点及药物对神经冲动发放的影响二、实验原理1、主动脉神经(又称减压神经)是主动脉弓压力感受器的传入神经。
神经传入冲动的频率,在一定范围内随主动脉血压的升高或降低而相应增加或减少,从而使压力感受性反射增强或减弱,以维持动脉血压的相对稳定,即减压反射。
2、心电图导联心脏除极,复极过程中产生的心电向量,通过容积导电传至身体各部,并产生电位差,将两电极置于人体的任何两点与心电图机连接,就可描记出心电图,这种放置电极并与心电图机连接的线路,称为心电图导联(lead)。
常用的导联如下:(一)标准导联亦称双极肢体导联,反映两个肢体之间的电位差。
⏹Ⅰ导联将左上肢电极与心电图机的正极端相连,右上肢电极与负极端相连,反映左上肢(L)与右上肢(r )的电位差。
当l 的电位高于r 时,便描记出一个向上的波形;当r 的电位高于l 时,则描记出一个向下的波形。
⏹Ⅱ导联将左下肢电极与心电图机的正极端相连,右上肢电极与负极端相连,反映左下肢(F)与右上肢(r )的电位差。
当f 的电位高于r 时,描记出一个向上波;反之,为一个向下波。
Ⅲ导联:将左下肢与心电图机的正极端相连,左上肢电极与负极端相联,反映左下肢(F)与左上肢(l )的电位差,当f 的电位高于l 时,描记出一个向上波;反之,为一个向下波。
3、心电图①、P波:心房除极化②、QRS:心室去极化③、T波:心室复极化T > 1/10R④、P-R间期:< 0.20s (60-90次/分)兴奋通过房室交界和房室束传导所需的时间⑤、S-T段:< 0.05 ~ 0.1 mV 心室肌细胞均处于复极化缓慢进行阶段,各部分之间没有电位差。
⑥、u波:T后0.02 ~ 0.04s,与T波方向一致,蒲肯野细胞复极化。
三、材料与方法(一)动物与器材⏹家兔⏹兔体手术台、RM6240计算机采集系统、音箱、常用手术器械、引导电极、止血钳、注射器、20%氨基甲酸乙酯、生理盐水、肾上腺素(1∶5000)、乙酰胆碱(1∶10000)、石蜡油、棉花。
血压动物生理学实验

家兔动脉血压系列实验家兔动脉血压系列实验I. 家兔动脉血压测定及神经、体液调节。
II. 家兔减压神经放电。
1.掌握学习动脉插管直接测量和记录动脉血压的实验方法;2.了解减压神经放电的引导记录方法;3.观察某些神经和体液因素对动脉血压的调节;4.观察减压神经传入冲动的发放特征,进一步认识动脉血;5.压变动与减压神经传入冲动发放的相互关系。
动脉血压的动态平衡和相对稳定性是通过神经和体液因素的调节而实现的;参与支配心脏活动的神经主要有心交感神经和心迷走神经,支配血管的神经有缩血管神经和舒血管神经。
在神经调节中以颈动脉窦-主动脉弓的减压反射尤为重要。
支配血管的交感缩血管神经兴奋时,使血管收缩、外周阻力增加,动脉血压升高。
体液因素主要为肾上腺素和去甲肾上腺素。
它们的作用主要是调节心脏的心输出量、外周阻力等。
心脏的神经支配--心交感神经其节前神经纤维发自脊髓的第1~5胸段的中间外侧柱,节后神经元位于星状神经节或颈交感神经节内。
节后神经元的轴突形成心脏神经丛,分布在心脏的窦房结、房室交界、房室束、心房肌和心室肌等处。
心交感节后神经元末梢释放的去甲肾上腺素与心肌细胞膜上的β-肾上腺素受体结合,通过增加自律细胞和心室肌细胞钙内流,导致心率加快,房室交界的传导加快,心房肌和心室肌的收缩能力加强(正性变时、变力、变传导作用)。
心脏的神经支配--心迷走神经节前神经元的胞体位于延髓的迷走神经背核和疑核,在胸腔内与心交感神经一起组成心脏神经丛,相伴行进入心脏,与心内神经节细胞发生突触联系;节后神经纤维支配心脏的窦房结、房室交界、心房肌、房室束及其分支;心迷走神经节后纤维末梢释放神经递质乙酰胆碱,作用于心肌细胞膜的M型胆碱受体,通过抑制钙内流和自律细胞的内向电流,导致心率减慢,心房肌不应期缩短,房室传导速度减慢,心房肌收缩能力减弱(负性变时、变力、变传导作用);血管的神经支配与生理作用交感缩血管神经交感舒血管神经副交感舒血管神经中枢延髓的缩血管中枢(T1-L2-3侧角) 皮质运动区脑干副交感核S2-3外侧核链递质去甲肾上腺素乙酰胆碱乙酰胆碱分布绝大多数血管多为单一支配)骨骼肌血管软脑膜、消化腺、外生殖器血管作用α受体→血管缩β受体→血管舒血管舒张血管舒张特点①调节血压作用大②持续发放紧张性冲动紧张性↑→血管缩紧张性↓→血管舒①不参与血压调②平时无作用③与情绪、运动有关①不参与血压调节②参与调节局部血流效应器(心、血管)心血管中枢(延髓)感受器(颈动脉窦和主动脉弓)交感缩血管神经心交感神经心迷走神经迷走神经窦神经心血管活动的神经调节血压升高时,可引起压力感受性反射,其反射效应是使心率减慢,外周血管阻力降低,血压回降,这一反射也称为减压反射;减压反射是一种负反馈调节机制。
家兔减压神经、膈神经放电

探讨其他动物模型中类似神经放电现象的共 性和差异,以更全面地理解神经放电的规律。
结合新技术和方法,如基因编辑、 光学成像等,进一步揭示神经放电 的奥秘,为医学和生物学领域的发 展做出更大的贡献。
THANKS FOR WATCHING
感谢您的观看
实验设备与仪器
1 2
减压神经和膈神经放电记录仪
用于记录家兔减压神经和膈神经的放电活动。
手术显微镜
用于手术过程中观察和操温度变化对实验结果 的影响。
实验试剂与药品
01
02
03
生理盐水
用于手术过程中的冲洗和 维持家兔的生命体征。
肝素
用于抗凝,防止血液凝固 堵塞电极。
放电频率
减压神经的放电频率通常 高于膈神经,且在吸气和 呼气相中均保持较高的频 率。
幅度与波形
减压神经的放电幅度较大, 波形较为单一;而膈神经 的放电幅度较小,波形较 为复杂。
与呼吸同步性
减压神经放电与呼吸同步 性较强,而膈神经放电与 呼吸同步性较弱。
04
讨论
减压神经放电的可能机制
减压神经放电与心血管调节
01
减压神经放电可能是家兔体内心血管调节的一部分,通过放电
活动对血压和心率进行调节。
机械感受器作用
02
减压神经可能包含机械感受器,能够感知血管壁的张力变化,
从而调节神经放电活动。
化学感受器作用
03
减压神经可能受到血液中化学成分的刺激,如氧、二氧化碳等,
这些刺激可能影响神经放电。
膈神经放电的可能机制
家兔减压神经、膈神 经放电
目录
• 实验动物与设备 • 实验方法 • 实验结果 • 讨论 • 结论
01
【机能实验】家兔减压神经、膈神经放电

膈神经膈神经放电膈神经群来自放电呈梭形与吸气同步,
可听到“拉锯样”声音
呼吸运动
CO2
对膈神经放电的影响
注意事项
1. 接地线夹在动物颈部切口皮下。 2. 不可用力牵拉神经。 3. 信号不清时,减压神经可向外周端移动, 膈神经可向中枢端移动。 4. 不能用局麻药,否则记不出放电。 5. 电极只能接触神经,不要接触其它组织。
3、手术:
(1)颈正中切口: 5-7㎝左右,钝性分离皮下组织暴露气管。 (2)气管插管: 型切口
4. 分离减压神经
呈三角形,幅度先大后小
群集放电节律与心率同步 电位幅度为100~200微伏 听到类似火车开动样的声音
给药NE0.05ml/kg(从耳缘静脉)
家 5.分离膈神经 兔 膈 神 经 的 解 剖 定 位
(+)
血管
外周 阻力 心率 心输 出量 BP
心脏
膈神经
传出神经
线上方钩住神经 (中枢端)
1、麻醉:乌拉坦 5ml/kg
指标: (1)角膜反射 (2)四肢松弛 (3)呼吸平而深
*(4)对疼痛刺激反应。
近心端 耳
耳廓
慢!
背 面
廓
耳缘静脉
进针位置
远心端
2、固定:
四肢伸展,前肢交叉固定(尽量使颈部 拉长),绳子穿过门牙固定。
C4脊神经 C5脊神经 C6脊神经 C7脊神经 C8脊神经 T1脊神经 膈神经
膈神经主要是由C4,C5,C6脊神经的腹支的分支构成。 贴着颈部的脊柱肌肉的两侧下行入胸腔,比减压神经部位深。 C4脊神经与甲状腺稍下水平相齐。
膈神经
在颈外静脉与胸锁乳突肌之间用止血钳
作钝性分离,可见较粗的臂丛,在其内 侧有一条较细的膈神经,从斜方肌的腹 缘进入胸腔。分离1-2cm。
家兔减压神经_实验报告

一、实验目的1. 掌握减压神经的解剖结构和生理功能;2. 观察减压神经在调节血压中的作用;3. 研究减压神经在维持血压稳定中的重要性。
二、实验原理减压神经(depressor nerve)是家兔心脏调节系统中的一种重要神经,主要负责调节血压。
当血压升高时,减压神经传入冲动增多,使心迷走神经紧张增强,交感性紧张减弱,从而使血压下降;反之,当血压降低时,减压神经传入冲动减少,使心迷走神经紧张减弱,交感性紧张增强,从而使血压升高。
减压神经是一种负反馈调节机制,在维持血压稳定中发挥着重要作用。
三、实验材料1. 家兔一只(体重2-3kg);2. 生物信号采集与处理系统;3. 血压换能器;4. 麻醉剂(戊巴比妥钠);5. 手术器械;6. 注射器;7. 药物(酚妥拉明、去甲肾上腺素、异丙肾上腺素等)。
四、实验方法1. 家兔麻醉:以戊巴比妥钠进行耳缘静脉注射,剂量为5mg/kg体重,使家兔麻醉。
2. 固定家兔:将家兔仰卧固定于手术台上,颈部暴露。
3. 分离减压神经:沿颈正中切开皮肤,钝性分离颈部肌肉,暴露颈总动脉和减压神经。
4. 连接血压换能器:将血压换能器连接到颈总动脉,实时监测血压变化。
5. 观察减压神经放电:通过生物信号采集与处理系统观察减压神经放电情况。
6. 实验分组:(1)对照组:观察正常血压下减压神经放电情况;(2)减压神经阻断组:切断减压神经,观察血压变化和减压神经放电情况;(3)药物干预组:给予酚妥拉明(阻断α受体)、去甲肾上腺素(兴奋α受体)、异丙肾上腺素(兴奋β受体)等药物,观察血压变化和减压神经放电情况。
五、实验结果1. 对照组:减压神经放电频率在正常血压下保持相对稳定,血压波动范围较小。
2. 减压神经阻断组:切断减压神经后,血压明显升高,减压神经放电频率显著降低。
3. 药物干预组:(1)酚妥拉明组:血压无明显变化,减压神经放电频率无明显变化;(2)去甲肾上腺素组:血压明显升高,减压神经放电频率降低;(3)异丙肾上腺素组:血压明显降低,减压神经放电频率升高。
家兔颈部动脉和神经的分离及减压神经放电的引导实验报告

.中央民族大学生命与环境科学学院生理学实验报告2011年10月28日家兔颈部动脉和神经的分离及减压神经放电的引导和家兔动脉血压的神经与体液调节【目的与要求】1.学习家兔颈部手术与分离主动脉神经的方法。
2.学习在体神经冲动引导与记录的方法,理解主动脉神经的生理功能。
3.掌握记录和测量家兔动脉血压的直接测量方法。
4.观察神经和体液因素改变对家兔动脉血压调节的影响,并分析该些因素的作用机制。
【实验原理】主动脉神经是主动脉弓压力感受器的传入神经,又称减压神经。
神经传入冲动的频率,在一定范围内随主动脉血压的升高或降低而相应增加或减少,从而使压力感受性反射增强或减弱,以维持动脉血压的相对稳定。
由于家兔主动脉神经独成一束,易于分离,故常用家兔为实验动物,进行主动脉神经冲动的引导与血压实验。
在正常的生理情况下,人和高等动物的动脉血压是相对稳定的。
这种相对稳定性是通过神经和体液因素的调节而实现的,其中以颈动脉窦-主动脉弓压力感受器反射尤为重要。
此反射即可使升高的血压下降,又可使降低的血压升高,故有血压缓冲反射之称谓。
家兔的主动脉神经在解剖上独成一支,易于分离与观察其作用。
【实验动物及器材】家兔、兔手术台,常用手术器械,止血钳、眼科剪、支架、气管插管、Pc-Lab生物信号采集系统、保护电极、纱布、棉球、丝线、 20ml注射器、20%-25%氨基甲酸乙酯,肝素,去甲肾上腺素,生理盐水;RM6240生物信号采集系统,手术剪1把,眼科剪1把,止血钳,镊子,电刺激连线,兔手术台,注射器及针头,血管插管,动脉夹,血压换能器,铁架台,婴儿秤,输液装置,照明灯,有色丝线;【实验步骤】1、实验动物准备1)麻醉:取家兔一只称重,按4-5ml/Kg(1g/Kg)耳缘静脉注射20%-25%氨基甲酸乙酯进行麻醉。
2)固定剪毛:背位固定在兔手术台上,剪去颈部手术视野中的被毛。
3)手术分离血管与神经A、颈部皮肤切口5-7cm,分离皮下组织B、分离肌肉层:钝性分离C、行气管插管:倒“T”切口,插管固定D、分离血管与神经:一侧:迷走神经(1)、主动脉神经(2)、颈动脉(1)另一侧:迷走神经(1)、颈动脉(3)(插管用)2、连接仪器引导减压神经放电活动打开Pc-Lab生物信号采集系统,连接引导电极在第一通道中,设置通道功能为神经放电,输入实验相关信息,采样观察减压神经放电活动。
家兔颈部动脉和神经的分离及减压神经放电的引导实验报告

中央民族大学生命与环境科学学院生理学实验报告家兔颈部动脉和神经的分离及减压神经放电的引导和家兔动脉血压的神经与体液调节2011年10月28日【目的与要求】1.学习家兔颈部手术与分离主动脉神经的方法。
2.学习在体神经冲动引导与记录的方法,理解主动脉神经的生理功能。
3.掌握记录和测量家兔动脉血压的直接测量方法。
4.观察神经和体液因素改变对家兔动脉血压调节的影响,并分析该些因素的作用机制。
【实验原理】主动脉神经是主动脉弓压力感受器的传入神经,又称减压神经。
神经传入冲动的频率,在一定范围内随主动脉血压的升高或降低而相应增加或减少,从而使压力感受性反射增强或减弱,以维持动脉血压的相对稳定。
由于家兔主动脉神经独成一束,易于分离,故常用家兔为实验动物,进行主动脉神经冲动的引导与血压实验。
在正常的生理情况下,人和高等动物的动脉血压是相对稳定的。
这种相对稳定性是通过神经和体液因素的调节而实现的,其中以颈动脉窦-主动脉弓压力感受器反射尤为重要。
此反射即可使升高的血压下降,又可使降低的血压升高,故有血压缓冲反射之称谓。
家兔的主动脉神经在解剖上独成一支,易于分离与观察其作用。
【实验动物及器材】家兔、兔手术台,常用手术器械,止血钳、眼科剪、支架、气管插管、Pc-Lab生物信号采集系统、保护电极、纱布、棉球、丝线、20ml注射器、20%-25%氨基甲酸乙酯,肝素,去甲肾上腺素,生理盐水;RM6240生物信号采集系统,手术剪1把,眼科剪1把,止血钳,镊子,电刺激连线,兔手术台,注射器及针头,血管插管,动脉夹,血压换能器,铁架台,婴儿秤,输液装置,照明灯,有色丝线;【实验步骤】1、实验动物准备1)麻醉:取家兔一只称重,按4-5ml/Kg(1g/Kg)耳缘静脉注射20%-25%氨基甲酸乙酯进行麻醉。
2)固定剪毛:背位固定在兔手术台上,剪去颈部手术视野中的被毛。
3)手术分离血管与神经A、颈部皮肤切口5-7cm,分离皮下组织B、分离肌肉层:钝性分离C、行气管插管:倒“T”切口,插管固定D、分离血管与神经:一侧:迷走神经(1)、主动脉神经(2)、颈动脉(1)另一侧:迷走神经(1)、颈动脉(3)(插管用)2、连接仪器引导减压神经放电活动打开Pc-Lab生物信号采集系统,连接引导电极在第一通道中,设置通道功能为神经放电,输入实验相关信息,采样观察减压神经放电活动。
实验七家兔减压神经放电

实验目的
学习和掌握哺乳类的麻醉和解剖方法。 学习观察测定神经放电的方法。 观察药物对减压神经放电的影响。
实验步骤
1.麻醉和固定 (1)麻醉:20%氨基甲酸乙酯 5 ml/kg体重,实验用家兔<2 kg,注射 约10 ml即可; 注射部位:耳缘静脉 注意:①速度----缓慢!!! ②观察:肌张力;呼吸频率;瞳孔的变化;角 膜反射
六、结果分析:
1.减压神经呈簇状放电,神经放电幅度与心动周期中动脉血压的变化呈正相关。 2.去甲肾上腺素结合血管平滑肌α受体,使血管收缩,血压升高。 3.乙酰胆碱与心肌M受体结合,心率减慢,心输出量降低,血压降低;同时ACh 激动内皮细胞M受体,血管舒张,降低外周阻力,使血压下降。
七、实验结论:
1.压力感受性反射参与动脉血压的即时调节 2.心血管活动受植物神经调控 3.减压神经是传入神经,其群集放电的幅度与血压呈正相关
心 血 管 活 动 的 神 经 调 节
心血管中枢 (延髓)
迷 走 神 经
窦ห้องสมุดไป่ตู้神 经
心 迷 走 神 经
心 交 感 神 经
交 感 缩 血 管 神 经
感受器 (颈动脉窦、 主动脉弓) BP搏动性变化
效应器 (心、血管)
生理意义:
减压反射是一种负反馈调节机制。它在 平时经常起作用,使动脉血压维持在比较恒 定的水平。
实验七
家兔的减压神经放电
实验原理
兔的主动脉弓压力感受器的传入神经纤维自成一 束,在颈部与迷走神经、交感神经并行,称为减压神 经(depressor nerve)。 减压神经在动脉血压的调控中发挥重要作用,当 动脉血压升高时,主动脉弓压力感受器的传入冲动增 多,经减压神经传入中枢,使心迷走紧张增强,交感 性紧张减弱,从而使血压下降;反之,当动脉血压降 低时,主动脉弓压力感受器发放冲动减少,经减压神 经传入中枢,使心迷走紧张减弱,交感性紧张增强, 从而使血压升高。
减压神经放电

膈神经放电
分离膈神经及迷走神经 观察与纪录 正常的膈神经放电 吸入气中CO2浓度增加 剪断双侧迷走神经 吸气末注气 呼气末抽气注意Fra bibliotek
1. 分离神经要干净,且不能过度牵拉神经, 既要防止神经干燥,也要避免神经及引导 电极上水分过多引起短路。 2. 记录减压神经时电极首先放在近外周端, 如果描记不出神经放电,再把引导电极往 中枢端移动,记录膈神经放电时相反。 电极不可触及周围组织,并注意动物接地 (用接于引导电极外壳的导线夹夹在动物 颈部切口处皮肤,使动物接地。
减压神经放电 膈神经放电
【实验原理与目的】 【实验对象】 家兔 【实验器材和药品】 【实验步骤和观察指标】
减压神经放电 (1)动物常规麻醉与固定后,气管插管。 (2)分离家兔一侧颈部减压神经。)。 (1)记录正常的减压神经放电 (2)静脉注射乙酰胆碱 (3)静脉注射去甲肾上腺素
实验六 家兔减压神经放电与动脉血压的关系

11
四、思考题
1. 为什么神经表面干燥会影响记录效果? 2. 为什么一侧颈总动脉被阻断后,动物的生理
功能并不发生大的变化?
12
7
三、实验步骤和操作注意事项
1 准备实验器材 2 家兔的麻醉和固定
20%氨基甲酸乙酯,5ml/kg 3 颈部手术
分离气管插气管套管 分离左侧颈总动脉,穿两条线备用 分离右侧的减压神经和迷走神经,穿线备用。
8
9
10
4 颈总动脉插管 5 安放电极 注意防止神经干燥,可用液体石蜡 6 记录动脉血压和神经放电 7 刺激神经或注射药物改变血压,观察并记录神
实验九 家兔减压神经放电与动脉血压的关系
1
一、实验原理
1. 减压神经的 位置和功能
减压神经也称作 主动脉神经,是 主动及弓压力感 受器的传入神经
2
3
4
2. 神经放电的细胞外记录
5
6
二、实验仪器和材料
• 家兔 • BL-420生物机能实验系统 • 气管套管 • 动脉套管 • 压力传感器 • 神经放电记录电极
减压神经放电实验报告

一、实验目的1. 了解减压神经放电的基本原理和实验方法。
2. 观察减压神经放电与动脉血压之间的关系。
3. 分析减压神经放电在动脉血压调节中的作用。
二、实验原理减压神经放电是机体在血压调节过程中,通过压力感受性反射维持动脉血压相对稳定的重要机制。
当动脉血压发生变化时,颈动脉窦和主动脉弓的压力感受器会感受到刺激,通过传入神经将冲动传入中枢,使心血管中枢的活动发生变化,进而调节动脉血压。
三、实验方法1. 实验动物:家兔(体重约2-3kg)。
2. 实验仪器:生理信号采集系统、刺激器、动脉血压计、手术器械等。
3. 实验步骤:(1)家兔麻醉:采用耳缘静脉注射25%乌拉坦溶液(1g/kg体重)进行麻醉。
(2)手术操作:切开颈部皮肤,暴露颈动脉窦和主动脉弓,分离减压神经。
(3)连接仪器:将减压神经与生理信号采集系统连接,通过刺激器进行电刺激,观察减压神经放电情况。
(4)记录动脉血压:采用动脉血压计连续监测动脉血压变化。
(5)实验分组:将实验分为对照组和实验组,对照组不进行电刺激,实验组进行电刺激。
(6)数据分析:对比对照组和实验组的减压神经放电频率、动脉血压变化,分析减压神经放电在动脉血压调节中的作用。
四、实验结果1. 对照组:减压神经放电频率随动脉血压变化而变化,动脉血压升高时放电频率增加,动脉血压降低时放电频率减少。
2. 实验组:在电刺激下,减压神经放电频率明显增加,动脉血压下降;停止电刺激后,减压神经放电频率恢复正常,动脉血压回升。
五、实验结论1. 减压神经放电与动脉血压密切相关,动脉血压升高时减压神经放电频率增加,动脉血压降低时放电频率减少。
2. 减压神经放电在动脉血压调节中发挥重要作用,通过调节心血管中枢的活动,使动脉血压维持相对稳定。
六、实验讨论1. 减压神经放电是一种负反馈调节机制,有助于维持动脉血压的相对稳定。
2. 电刺激减压神经可以引起动脉血压下降,说明减压神经放电在动脉血压调节中具有重要作用。
14减压神经放电

【方法与步骤】
1.麻醉和固定: 耳缘静脉注射20%氨基甲酸乙酯(5ml/ kg),仰卧固定。 2. 手术:剪毛,切开,分离,暴露气管,气管插管。 3.分离神经:分离血管神经束,分离减压神经。 4.实验仪器的连接 (1)调试仪器:前置放大器高频滤波使用1 0kHz,时间常数为 0.0ls.放大倍数×1000,整机灵敏度为l00一200μv/cm, 扫描速度为50一100ms/cm。 (2)安放引导电极:颈部接地,小心地将减压神经搭在引导电 极上 5.观察正常时减压神经放电情况,观察减压神经放电频率 和幅度,监听器可听到放电的声音。减压神经是类似火车 开动的声音。
【思考题】 1.正常时减压神经放电有何特点?
Hunan Normal University
2. 人体心电图的描记
【目的】
初步学习人体心电图的描记方法,学习心电波形的测 量和分析方法。辨认正常心电图波形并了解其生理意 义。
【原理】 每一心动周期中,心脏各部分兴奋过程中的电变化及 其时间顺序、方向和途径等,都有—定规律。这些电 变化通过心脏周围的导电组织和体液传导到全身,在 一定体表部位出现有规律的电变化。将测量电极放置 在人体表面的一定部位记录到的心脏电变化曲线,就 是临床上常规记录的心电图。
【方法与步骤】 1. 耳部手术:健康的幼年豚鼠,用20%氨基甲酸乙酯按 5ml/kg腹腔注射麻醉。剪毛,沿耳廓跟部切口,分离 皮下组织,暴露骨乳突,乳突钻孔。 2. 放置电极:将银球电极从骨孔插向深部,胶泥固定,参 考电极置于手术伤口肌肉,接地电极动物前肢。 3. 仪器连接及参数设置:BL—410生物机能实验系统电极 连线接到1通道接口,刺激输出端与耳塞机相连,刺激 参数:连续、串间隔1s,强度5v,波宽0.05ms,串长 1。“显示方式”选“触发叠加”,将1通道选择叠加, 叠加放大倍数选1。监听。 4.直接对豚鼠外耳道说话或唱歌,采用连续采样方式采 样,在屏幕上可见到与所给声音的频率和振幅相应的 电位变化。监听电变化规律 5.观察短声刺激引起的耳蜗电位:将耳塞机对准动物外 耳道,给予适当的短声刺激,观察微音器电位和听神 经动作电位。反转刺激器输出极性,观察微音器电位 和听神经动作电位的变化。 Hunan Normal University
生理学实验家兔减压神经放电

生理学实验家兔减压神经放电实验二十一家兔减压神经放电Rabbit depressor neural discharges【实验目的】学习引导减压神经放电的电生理学实验方法;观察动脉血压变化与减压神经放电的关系。
【实验原理】当动脉血压升高或降低时,压力感受器的传入冲动也随之增加或减少,通过中枢机制引起心率、心肌收缩力、心输出量、血管阻力等发生相应变化,使动脉血压降低或回升,从而调节血压相对稳定,这一反射称为减压反射。
家兔降压反射的主动脉弓压力感受器的传入神经在颈部单独成一束,称为主动脉神经或减压神经。
它是减压反射的传入神经,可将感受器感受血压变化的传入冲动传送到中枢。
用电生理学实验方法可引导、显示、记录减压神经放电,并用监听器监听减压神经放电的声音。
【实验对象】家兔。
【实验材料】哺乳类动物手术器械,兔手术台,BL-410 生物信号采集处理系统,压力换能器、引导电极,电极架,注射器,玻璃分针,烧杯,棉球及丝线,纱布,滴管,液体石蜡,生理盐水, 1.5%戊巴比妥钠,1:10000 肾上腺素溶液,1:10000 乙酰胆碱溶液。
【实验步骤】1.手术(1)麻醉和固定用 1.5%戊巴比妥钠,按 2ml/kg的剂量从兔耳缘静脉缓慢注入,待动物麻醉后,取仰卧位固定于兔手术台上。
(2)分离减压神经颈部剪毛,在颈部正中切开皮肤(约6~8cm),钝性分离皮下组织及肌肉,暴露气管。
沿气管两侧小心分离减压神经(如头发粗细)和颈总动脉,穿线备用。
减压神经分布(图 21-1、-2、-3)(3)颈总动脉插管。
(4)安置电极向内滴入温热的液体石蜡,浸没神经和电极,以防神经干燥,并起绝缘、保温作用。
将引导电极固定在电极架上,用备用线提起减压神经并搭到引导电极的神经钩上,注意神经不可牵拉过紧。
引导电极应悬空并固定于支架上,不能触及周围组织,将接地线就近夹在皮肤切口组织上。
神经放电引导电极参见图 21-4。
2.连接实验仪器装置(1)神经放电引导电极接到生物信号采集处理系统第1 通道上,记录减压神经放电。
兔子减压神经实验报告

一、实验背景减压神经(depressor nerve)是哺乳动物心血管调节系统的重要组成部分,主要参与血压的调节。
减压神经的放电活动与动脉血压的变化密切相关,本研究旨在通过实验观察兔子减压神经放电活动,分析其与动脉血压的关系,为深入理解减压神经在血压调节中的作用提供实验依据。
二、实验目的1. 观察兔子减压神经放电活动的特征。
2. 分析减压神经放电活动与动脉血压之间的关系。
3. 探讨减压神经在血压调节中的作用机制。
三、实验材料与方法1. 实验动物:成年家兔3只,体重约2.5kg。
2. 实验仪器:生理信号采集系统、生物信号处理软件、血压计、手术显微镜、手术器械等。
3. 实验方法:(1)麻醉与固定:采用20%氨基甲酸乙酯溶液按5ml/kg体重剂量进行耳缘静脉注射,待动物麻醉后,背位固定于兔台上。
(2)减压神经分离:在颈部剪毛,颈正中切口约5~7cm,用止血钳纵向钝性分离颈部肌肉,分离一侧减压神经血管神经鞘(颈总动脉、迷走、交感和减压神经)。
分离出一段减压神经,清除附着的脂肪或结缔组织;加温石蜡油以防止干燥。
(3)减压神经放电活动记录:将双极引导电极插入减压神经,连接生理信号采集系统,记录减压神经放电活动。
(4)动脉血压测量:采用血压计测量动物动脉血压,并记录动脉血压变化。
(5)数据分析:采用生物信号处理软件对减压神经放电活动进行统计分析,分析放电频率与动脉血压之间的关系。
四、实验结果1. 减压神经放电活动特征:在实验过程中,减压神经放电活动呈现周期性变化,放电频率在0.5~10Hz之间,放电幅度在1~5mV之间。
2. 减压神经放电活动与动脉血压的关系:分析结果显示,减压神经放电频率与动脉血压呈负相关。
当动脉血压升高时,减压神经放电频率降低;当动脉血压降低时,减压神经放电频率升高。
3. 减压神经在血压调节中的作用:减压神经放电活动通过调节心迷走神经和交感神经的活性,实现对动脉血压的调节。
当动脉血压升高时,减压神经放电活动增强,使心迷走神经活性增强,交感神经活性减弱,从而使动脉血压降低;反之,当动脉血压降低时,减压神经放电活动减弱,使心迷走神经活性减弱,交感神经活性增强,从而使动脉血压升高。
兔减压神经放电及药物对放电的影响

兔减压神经放电及药物对放电的影响【目的和原理】本实验的目的是熟悉外周神经复合电位引导方法,通过同步记录减压神经放电及颈总动脉血压变化,观察二者之间的关系,从而了解压力感受器的工作特性,加深对减压反射的理解。
压力感受性反射是保持动脉血压稳定的重要调节机制。
减压神经为主动脉弓血管壁上压力感受器的传入纤维。
多数哺乳动物的减压神经在颈部混入迷走神经,其传入中枢的冲动引起降压反射。
家兔的减压神经自成一束,在颈部与交感神经、迷走神经和颈总动脉一起走行于颈动脉鞘内,主要反映主动脉弓压力感受器感受压力刺激的情况。
减压神经是传入神经,当主动脉弓处血压升高时,主动脉管壁被动扩张,减压神经传入冲动频率增多,反之,传入减少。
在压力感受性调节中,心迷走神经的节前和节后纤维均为胆碱能纤维,其节后纤维通过释放Ach作用于心肌M受体而抑制心肌的活动使得血压降低;心交感神经和交感缩血管神经的节前和节后纤维分别为胆碱能纤维和肾上腺素能纤维,节前纤维释放Ach作用于节后神经元的N受体而兴奋节后神经,后者再释放去甲肾上腺素兴奋心肌,收缩血管,使得血压升高。
不同药物作用于迷走神经及交感神经改变动脉血压,使得减压神经放电出现差异。
【实验对象】家兔【实验器械和药品】台秤、兔手术台、注射器(1ml、20ml各一个)、哺乳类动物手术器械一套、BL-420生物信号记录分析系统、监听器、引导电极、血压换能器、三通阀、铁支架2个、动脉夹2个、动脉插管、玻璃分针、棉线、25%氨基甲酸乙酯(乌拉坦)、0.5%肝素盐水、1:100000乙酰胆碱、1:10000去甲肾上腺素、生理盐水、酚妥拉明。
【实验方法和步骤】1:动物手术(1)家兔捉拿、称重。
静脉注射25%乌拉坦(4ml/kg)将动物麻醉,仰卧固定于兔手术台;(2)减压神经和颈总动脉的分离:剪去颈部手术野的毛,于喉下正中部位切开皮肤6~9cm,止血钳行钝性分离,暴露气管及两侧颈总动脉。
先不破坏颈动脉鞘,仔细观察迷走神经与交感神经之间一条最细的神经即为减压神经。
实验家兔主动脉神经放电.
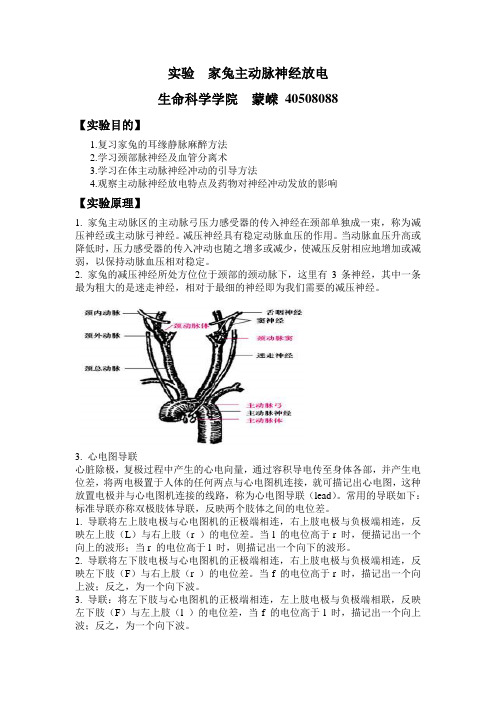
实验家兔主动脉神经放电生命科学学院蒙嵘40508088【实验目的】1.复习家兔的耳缘静脉麻醉方法2.学习颈部脉神经及血管分离术3.学习在体主动脉神经冲动的引导方法4.观察主动脉神经放电特点及药物对神经冲动发放的影响【实验原理】1. 家兔主动脉区的主动脉弓压力感受器的传入神经在颈部单独成一束,称为减压神经或主动脉弓神经。
减压神经具有稳定动脉血压的作用。
当动脉血压升高或降低时,压力感受器的传入冲动也随之增多或减少,使减压反射相应地增加或减弱,以保持动脉血压相对稳定。
2. 家兔的减压神经所处方位位于颈部的颈动脉下,这里有3条神经,其中一条最为粗大的是迷走神经,相对于最细的神经即为我们需要的减压神经。
3.心电图导联心脏除极,复极过程中产生的心电向量,通过容积导电传至身体各部,并产生电位差,将两电极置于人体的任何两点与心电图机连接,就可描记出心电图,这种放置电极并与心电图机连接的线路,称为心电图导联(lead)。
常用的导联如下:标准导联亦称双极肢体导联,反映两个肢体之间的电位差。
1. 导联将左上肢电极与心电图机的正极端相连,右上肢电极与负极端相连,反映左上肢(L)与右上肢(r )的电位差。
当l 的电位高于r 时,便描记出一个向上的波形;当r 的电位高于l 时,则描记出一个向下的波形。
2. 导联将左下肢电极与心电图机的正极端相连,右上肢电极与负极端相连,反映左下肢(F)与右上肢(r )的电位差。
当f 的电位高于r 时,描记出一个向上波;反之,为一个向下波。
3. 导联:将左下肢与心电图机的正极端相连,左上肢电极与负极端相联,反映左下肢(F)与左上肢(l )的电位差,当f 的电位高于l 时,描记出一个向上波;反之,为一个向下波。
4.心电图P波:心房除极化QRS:心室去极化T波:心室复极化T > 1/10RP-R间期:< 0.20s (60-90次/分)兴奋通过房室交界和房室束传导所需的时间S-T段:< 0.05 ~ 0.1 mV 心室肌细胞均处于复极化缓慢进行阶段,各部分之间没有电位差。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二十一 家兔减压神经放电
Rabbit depressor neural discharges
【实验目的】
学习引导减压神经放电的电生理学实验方法;观察动脉血压变化与减压神经放电的关 系。
【实验原理】
当动脉血压升高或降低时, 压力感受器的传入冲动也随之增加或减少, 通过中枢机制引 起心率、心肌收缩力、心输出量、血管阻力等发生相应变化,使动脉血压降低或回升,从而 调节血压相对稳定,这一反射称为减压反射。
家兔降压反射的主动脉弓压力感受器的传入神 经在颈部单独成一束,称为主动脉神经或减压神经。
它是减压反射的传入神经,可将感受器 感受血压变化的传入冲动传送到中枢。
用电生理学实验方法可引导、显示、记录减压神经放 电,并用监听器监听减压神经放电的声音。
【实验对象】
家兔。
【实验材料】
哺乳类动物手术器械,兔手术台,BL410 生物信号采集处理系统,压力换能器、引导 电极,电极架,注射器,玻璃分针,烧杯,棉球及丝线,纱布,滴管,液体石蜡,生理盐水, 1.5%戊巴比妥钠,1:10000 肾上腺素溶液,1:10000 乙酰胆碱溶液。
【实验步骤】
1.手术
(1)麻醉和固定 用 1.5%戊巴比妥钠,按 2ml/kg的剂量从兔耳缘静脉缓慢注入,待动 物麻醉后,取仰卧位固定于兔手术台上。
(2)分离减压神经 颈部剪毛,在颈部正中切开皮肤(约 6~8cm),钝性分离皮下组织及 肌肉,暴露气管。
沿气管两侧小心分离减压神经(如头发粗细)和颈总动脉,穿线备用。
减压 神经分布(图 21-1、-2、-3)
(3)颈总动脉插管。
(4)安置电极 向内滴入温热的液体石蜡,浸没神经和电极,以防神经干燥,并起绝缘、 保温作用。
将引导电极固定在电极架上, 用备用线提起减压神经并搭到引导电极的神经钩上, 注意神经不可牵拉过紧。
引导电极应悬空并固定于支架上,不能触及周围组织,将接地线就 近夹在皮肤切口组织上。
神经放电引导电极参见图 21-4。
2.连接实验仪器装置
(1)神经放电引导电极接到生物信号采集处理系统第 1 通道上,记录减压神经放电。
(2)颈总动脉插管通过压力换能器输入到生物信号采集处理系统第 2 通道上,记录动脉 血压曲线变化。
(3) 打开计算机启动生物信号采集处理系统,点击菜单“输入信号/1 通道/神经放
(图21-5)
,按开始按钮记录实验数据。
、 “输入信号/2通道/压力”
电”
【参数设定】
实验参数详见下表(可据实际情况调整各参数)
通道 换能器类型 增益选项 时间常数 滤波调节 扫描速度 50Hz滤波
采样参数
1 银丝电极 5000 0.01 10k 80ms/div 开
2 压力换能器 50 DC 10k 80ms/div 开
【观察项目】
1. 正常减压神经放电 减压神经伴随血压波动而呈现群集性放电, 电压约 100~200uV; 从监听器中可听到如火车开动样的“轰轰”声(图 1324)。
2.夹闭颈动脉 观察减压神经群集性放电和动脉血压曲线的变化。
3.注射肾上腺素 从耳缘静脉注射 1:10000肾上腺素 0.3ml,观察减压神经群集性放电 和动脉血压曲线的变化。
4.注射乙酰胆碱 从耳缘静脉注射 1:10000 乙酰胆碱 0.3m1,观察减压神经群集性放 电和动脉血压曲线的变化。
【注意事项】
1.麻醉不宜过浅,以免动物躁动,产生肌电干扰。
2.仪器和动物均要接地,并注意适当屏蔽。
3.分离神经时动作要轻柔,不要牵拉;分离后及时滴旭温热液体石蜡,以防止神经干 燥,并可保温。
4.保持神经与引导电极接触良好;引导电极不可触及周围组织,以免带来干扰。
【思考题】
1.正常减压神经放电的基本波形有何特征?
2. 静脉注射肾上腺素、乙酰胆碱后,减压神经放电频率、幅度有何变化?与血压的关 系如何?
3.肾上腺素、乙酰胆碱是如何影响动脉血压的?。
