Q_HTM YQ014-2019肉类中组胺仪器检测试剂盒
预购2019年度动物疫病监测诊断试剂清单

预购2019年度动物疫病监测诊断试剂清单1. 微孔板样品预稀释:1:40 倍195μL 样品稀释液 14 加入每孔。
5μL 用于检测样品加入对照不需要稀释加样:100μL 阴性对照(不需稀释)加入孔 A1 和 B1。
100μL 阳性对照(不需稀释)加入孔 C1 和 D1。
100μL 预稀释样品加入剩下孔内提示:加样后板震荡混匀(2min,200rpm)效果更佳且不会影响结果。
2. 21℃(±5℃)下孵育 30min±3min。
3. 用 300μL 左右的洗涤液洗涤每个板孔 5 次。
在洗涤和加入下一个试剂前,避免孔变干。
4. 用样品稀释液 3 按照 1:10 的比例的稀释浓缩酶标结合物(10X)制备酶标结合物(1X)(1 份浓缩洗涤液加 9 份样品稀释液 3)。
5. 吸取 100μL 的酶标记结合物(1X)加入到每孔中。
6. 21℃(±5℃)下孵育 30min±3min。
7. 重复步骤 3。
8. 吸取 100μL 的底物溶液加入到每孔中。
9. 21℃(±5℃)下暗室内孵育 15min±2min。
10. 在每孔中加入 100μL 的终止液终止显色反应。
11. 在酶标仪的 450nm 波长读结果。
实验有效性:在下列情形下实验有效:阴性对照的平均 OD 小于等于 0.150. OD NC ≤≤ 0.150阳性对照与阴性对照平均 OD 值差值大于等于 0.150 OD PC - OD NC ≥ 0.150结果判定:对于每个样品,计算其 S/P 比值:每个样品得出一个(S/P):S/P≤0.4,阴性;SN值>04,阳性试剂盒内容:包被的微量滴定板、酶结合物浓缩液(10X)、阳性对照、阴性对照、稀释缓冲液 8、稀释缓冲液 12、浓缩洗涤液(20X)、底物溶液、终止液1. 酶结合物、阴阳性对照以及底物溶液必须在 5℃(±3℃)下贮存。
2. 其它试剂可放置+2℃~+26℃保存。
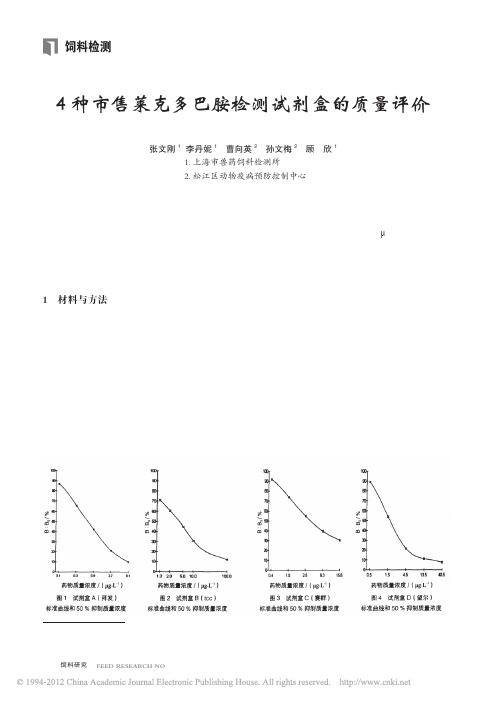
4种市售莱克多巴胺检测试剂盒的质量评价
通信地址 :上海市虹井路 855 弄 30 号上海市 兽药饲料检测所 201103
饲料研究 FEED RESEARCH NO.4,2010 37
阴性尿样添加不同量的莱克多巴胺配制而成,质 量浓度分别为 1、2、5、10 和 20 μg/L。 1.4 分析指标和方法
各试验均按照试剂盒的操作步骤严格进行操 作,用酶标仪测定吸光度值。 1.4.1 标准曲线和 50 % 抑制质量浓度
根据各试剂盒的标准质量浓度组成,重复测 定 6 次, 绘 制 各 自 的 标 准 曲 线, 计 算 出 B/B0 为 50 % 时所对应药物质量浓度的平均值。 1.4.2 板内变异系数
种试剂盒的孔间差异数值均较大,说明试剂盒的 精密度较差。 3.3 在回收率试验中,4 种试剂盒样品添加试验 所用的样品均为相同批次,但测定结果却相差较 大,其中试剂盒 A 的回收率最高,平均回收率达 到 80.5 % ;而试剂盒 B 的回收率最低,实际检测 中也发现,添加质量浓度为 1 和 2 μg/L 时,该试 剂盒的检测结果均为未检出。另外 2 种试剂盒的 回收率则位居二者之间。
/(μg·L-1) 回收率 / % 回收率 / % 回收率 / % 回收率 / %
1
85.1
未检出
56.9
49.9
2
80.7
未检出
63.2
57.8
5
81.0
30.2
59.3
60.0
Hale Waihona Puke 1089.942.4
65.5
49.8
20
肉类中氟苯尼考和氟苯尼考胺的残留量检测

氟苯尼考作为氯霉素的隔代产品,在禽类及畜类动物感染疾病控制中应用广泛,具有良好的抗菌能力,安全性较高。
随着研究的不断深入发现,氟苯尼考会导致胚胎毒性反应,动物在使用后易发生厌食及腹泻等反应。
不正当的使用氟苯尼考也会导致禽类、畜类、水产品等动物体内残留药物,对食用者的健康造成不利影响。
氟苯尼考代谢物是以氟苯尼考胺的形态存在,国家规定其最大残留量为100μg/ kg,可利用氟苯尼考代谢物等对氟苯尼考胺进行检测。
在检测过程中构建高灵敏度的检测流程,从而满足检测需求。
在本次研究过程中,对动物体中的氟苯尼考胺残留量进行检测,并形成以下报告。
1 资料与方法1.1 一般资料选择Dr.Ehrenstorfer公司的甲醇、氨水、乙酸乙酯、正己烷和一级水等配置储备液,并在4 ℃的环境中保存,选择标准规格的氟苯尼考、氟苯尼考胺、D5-氯霉素。
选择Agilent企业所生产的1200超高液相色谱仪-6410串联四级质谱,其中配置喷雾型离子源及U;tra-Turrax T25均质器,选择应用能效良好的20PR-520离心机。
1.2 方法在50 mL的具塞容量管中加入2 g 氟苯尼考、正己烷等,加入一定量的D5-氯霉素或者污无水硫酸钠,在管中继续加入15 mL乙酸乙酯及小剂量氨水。
拿出规格等同的另一个具塞容量管,其中氨水及乙酸乙酯的剂量不发生变化,加入一定量的洗涤液进行混合,经过1 min的离心处理后,观察上清液的变化,并将氨水及乙酸乙酯上清液倒入锥形容量瓶,加入5 mL的正己烷涡旋30 s,在处理后将上层部分过滤,向其中添加正己烷溶液,从而继续离心处理,等待的进一步检测。
对色谱条件进行优化,色谱柱规格为2.1 mm×50 mm,1.8 μm,流动相中甲醇与水的比例为70∶30.色谱柱温度控制在40 ℃,样本进入量为10 μL,流动速度控制在0.2 mL/min。
对质谱条件进行优化,干燥气的质量控制在9 μL /min,干燥温度控制在350 ℃,喷雾气体的压力控制在35 psi,MRM的相关参数见表1。
鱼肉制品中组胺检测方法的研究

Study on detection m ethod of histam ine in fish m eat products
CH EN Yan
Abstract Fish meat products were taken as raw materials,and ethanol solution was used as ex- tract,and the content of histamine was determ ined.The experiment was optimized by o ̄hogonal m ethod, the results showed that the effect was the best when it was extracted with 45% ethanol solution at 40。C for 60 r ain.and then use aaNAT to avoid the inf luence of other non—volatile histamine.The method had good stability,and it was simple and convenient,and recovery rate was high.
用 提 取 剂将 水 产 品 中 的组 胺 提 取 出 来 ,再 与 偶 时间 下对 样 品进行 处 理 .过滤 。
氮试 剂 反 应 生 成 红 色 化 合 物 ,加 人 aaNAT避 免 其 他 1.3.2 标 准曲 线及样 品 测定
生物 胺 的影 响 ,其 吸光 度 与 样 品 中 的组 胺 含 量 成 正
1.2 主 要试 剂和 仪器 正戊 醇 、三 氯 乙酸 、碳 酸 钠 、氢 氧 化 钠 、盐 酸 、组
兽药残留检测项目

兽药残留检测项目本项目全面考察学生对高效液相色谱法检测禽畜肉中抗生素残留项目的实施过程中所涉及的样品预处理、样品检测(送至第三方检测机构进行,不作为考核点,但选手制备样品的回收率和RSD值将根据检测机构检测数据计分)、数据处理(提供统一打印图谱,考核选手根据图谱计算检测结果的能力)和离线色谱工作站操作4个环节的基本操作与过程的整体把握和运用能力以及在整个实验过程中的操作文明和操作安全意识。
本项目预处理现场操作要求每个参赛队员在2.5个小时内完成。
色谱工作站操作和数据处理分别要求在45分钟和60分钟内完成。
赛项为个人赛,包括农药残留检测、兽药残留检测、重金属污染检测共3个分项,每名选手分别选择其中一个项目进行比赛。
每位参赛选手可以有一名指导教师,参赛选手须为2016年新疆在籍同校高职学生。
以学校为单位组成参赛队,安排领队1名。
农残、兽残检测竞赛项目的试样前处理过程将由参赛人员现场操作完成(过程评分)。
试液的上机测定由赛项专家组安排第三方检测机构专家按规定统一进行(仪器操作不作为选手考核点)。
选手制备样品的回收率和RSD值将直接根据检测机构检测数据计分(结果评分)。
为了考核参赛选手图谱解读及数据处理能力,将提供统一的打印图谱,考核选手根据图谱计算回收率和RSD值等数据处理及正确填写检测记录单的能力(结果评分)。
此外,开展离线色谱工作站软件使用操作考核(色谱工作站软件由赛项专家组指定)(结果评分)。
重金属检测竞赛项目考察选手试样预处理(样品消解液由组委会提前准备好,样品消解不作为考核点)(过程评分)、上机测量(过程评分)、数据处理(结果评分)等全部过程。
竞赛流程(一)竞赛日程(二)竞赛各场次流程七、竞赛试题本赛项为公开试题项目。
八、竞赛规则1.限于竞赛场地设备等条件的制约,3个现场操作项目的竞赛需要分批进行,选手参加考试的批次和竞赛工位将通过抽签决定。
2.参赛选手必须带身份证和学生证,并佩带参赛证件,提前30分钟到候考室检录,在引导员带领下至相应赛场,按签号指定的位置就位,完成相应竞赛任务。
超高效液相色谱-串联质谱方法同时测定猪肉中7种β-受体激动剂残留量

1 .. . 31 3
液 相色 谱 条 件
色谱 柱 :Z ra B s .mm × l O ob x S CI21 ( O mm,18 .“m) :
柱 温 :3 0℃ ;进 样 量 : 1 L; 流 动 相 :A 相 为 0. % 0 1
甲酸 水 溶 液 :B相 为 乙腈 ; 二元 梯 度 洗 脱 :0 n,A、 mi
r sd e iue
中 图分 类 号:06 76 5 .3
文 献 标 识码 :A
文 章编 号:10 —132 1 )50 2 —5 0 18 2 (0 20 0 50
p 受体 激 动 剂(p a o it) 一 —g nss , 主 要 包 含 克伦 特 罗 、 沙 丁 胺 醇 、 莱 克 多
西 马特 罗 、氯 丙 那 林 7种 较 为 常 见 的 B 受 体激 动 剂 残
件下 用氮 气吹至 05 . mL,加 甲醇 一.% 甲酸( 积 比 19溶 01 体 :) 液2 mL,涡 旋 混匀 ,过 0. m 滤 膜 后 进样 检 测 。 2b t
1- .3 3 UP C— / L MSMS条件
肉类研究
中国 肉类 亩品综 合 研究 中心
CHI NA M E AT R EARCH CENTE ES R
乙醇 胺 A 属 于 瘦 肉精 新 品种 , 在 动 物 源 食 品 中报 道 很
少 。孙 文 等 研 究 了猪肌 肉组 织 中 苯 乙醇 胺 A残 留液 相 色 谱 一串联 质 谱 检 测 方 法 , 其 中前 处 理 用 的 酶 解 方 法 , 过 程 繁 琐 。 而 目前 关 于 猪 肉 中 苯 乙醇 胺 A 、 克伦 特 罗 等 B一受 体 激 动 剂 同 时快 速 检 测 的 方 法 还 末 见 报 道 。 因此 ,本 研 究 旨 建 立 猪 肌 肉组 织 中苯 乙醇 胺 A、 盐 酸 克 伦 特 罗 、沙 丁 胺 醇 、 莱 克 多 巴 胺 、特 布 他 林 、
食品中组胺的测定

组胺的检测组胺是自体活性物质之一,在体内由组氨酸脱羧基而成,组织中的组胺是以无活性的结合型存在于肥大细胞和嗜碱性粒细胞的颗粒中,以皮肤、支气管粘膜、肠粘膜和神经系统中含量较多。
当机体受到理化刺激或发生过敏反应时,可引起这些细胞脱颗粒,导致组胺释放,与组胺受体结合而产生生物效应。
抗组胺是拮抗组胺对人体的生物效应,即应用抗组胺药物。
抗组胺受体就是拮抗组胺的H1和H2受体。
由于此两种受体在人体内分布不同而产生不同的效应,它是抗组胺药应用治疗疾病的生理药理基础。
毒理药物中毒组胺主要用于胃分泌功能检查,作最大酸分泌(MAO)测定。
但目前已被五肽胃泌素取代。
组胺通过激活体内组胺H1受体和H2受体,收缩多种平滑肌如气管、支气管和胃肠道平滑肌;但同时松弛小血管平滑肌,增加毛细血管通透性;还能强烈刺激胃酸分泌,减慢房室传导,增加心肌收缩力等。
误用大剂量或静脉给药可引起中毒。
食物中毒大量检测表明,海产鱼中的青皮红肉鱼类含组胺较高,当鱼不新鲜或腐败时,鱼体中游离的组胺酸经脱羧酶作用产生组胺. 组胺中毒潜伏期一般为0.5~1小时,最短可为5min,最长达4h.检测方法1.分光光度法1 主要仪器和试剂721型分光光度计组胺标准溶液:取经95℃干燥2.5小时的磷酸组织胺分析纯试剂配制成含20ug·ml 的组胺标准溶液。
0.2 对氨基苯磺酸溶液(简称甲液)1oNNaNO 溶液(简祢乙液),现配现用。
所用水均为二次蒸馏水。
2 组胺测定方法及条件试验2.1 测定方法:在25ml容量瓶中,移入一定量的组胺标准溶液,依次加入0-2 甲液、0.4%HCI、10%乙液和2.0%NaCO 溶液,用水稀释至刻度,摇匀。
于25℃室温下放置20分钟,用试剂空白为参比,测其吸光度值。
2.2 吸收光谱:取2.0ml组胺标准溶液,按上述方法显色,以水为参比,分别测定显色化合物和试剂空白的吸收光谱。
图1表明显色化合物在506nm 处有一最大吸收,本实验取506nm 作为吸收波长。
鸡肉中多种磺胺兽药残留量测定的高效液相色谱-电化学检测法

第21卷第4期分析测试学报V ol.21N o.42002年7月FENXI CESHI XUE BAO(Journal of Instrum ental Anal y sis)Jul.2002鸡肉中多种磺胺兽药残留量测定的高效液相色谱-电化学检测法王建华,林黎明,陈长法(青岛出入境检验检疫局食品实验室,山东青岛266002)摘要:采用液相色谱电化学法测定了鸡肉中磺胺类药物残留量;磺胺用氯仿提取后,取部分提取液用氮气吹干,残渣溶于K H2PO4中,用正己烷脱脂,水相进样,液相色谱分析用C18柱,流动相为甲醇-0.01m ol/L KH2PO4(p H6,体积比25∶75),检测电位1.0V;与紫外检测器相比,电化学检测器(ECD )有更高的灵敏度和选择性,ECD的检出限为磺胺嘧啶0.02n g,磺胺甲氧哒嗪0.06n g,磺胺甲基异 唑0.07n g。
关键词:高效液相色谱;安培电化学检测;磺胺类药物;残留物;鸡肉中图分类号:T S251.55文献标识码:A文章编号:1004-4957(2002)04-0079-03磺胺类药物(SAs)广泛用于预防和治疗食源性动物的疾病,然而过量使用这些抗生素会导致在食用动物产品中残留。
这些残留物对人体有不良影响。
因此,欧盟将磺胺类药物列为必须严格监控的药物,并制定了动物源食品中磺胺的最大残留限量为100μg/k g[1]。
G C和G C-MS对肉、奶中磺胺类药物残留的测定灵敏度高而且专属性强,但需要繁冗的净化和衍生步骤[2],不适合大量样品的分析。
液相色谱紫外检测法也有许多应用[3],但灵敏度低。
有些分析方法基体干扰严重。
美国农业部食品安全检查局(FSIS)采用荧光胺衍生的薄层色谱(T LC)筛选方法[4]。
这种方法灵敏度、选择性较好,但重复性不够好。
近年来,用荧光胺柱前衍生或柱后衍生,进行磺胺测定的液相色谱荧光检测法已成为测定动物组织多种磺胺快速分析方法[5],这种方法灵敏度、选择性都较好。
组胺检查法

试验动物豚鼠1只(250~350g),雌雄不限。
MP100型十六道生理仪、恒温水浴槽、注射器(1ml)、移液管(1ml和5ml)、电子天平、剪刀、镊子等。
试剂蒸馏水、氯化钠注射、氯化钾、氯化钙、氯化镁、磷酸二氢钠等。
药品硫酸阿托品、磷酸组胺对照品、供试品试验方法实验准备将离体器官浴筒洗净并干燥,备用。
将恒温水浴槽接通电源,加热使其温度保持为34~36℃,备用。
对照品溶液:取磷酸组胺对照品1支,加水配制成每1ml含1.0mg组胺的对照品溶液,用氯化钠注射液继续稀释。
A溶液:称取氯化钠160g、氯化钾4g、氯化钙2g、氯化镁1g、磷酸二氢钠0.1g,加水溶解并稀释至1000ml。
B溶液:取A溶液50ml,称取硫酸阿托品0.5mg、碳酸氢钠1g、葡萄糖0.5g,加水溶解并稀释至1000ml(24h内使用)。
离体肠段的固定:取禁食24h的豚鼠,处死。
剖取远端小肠(距离盲肠2cm)一段约2cm长的肠段,用注射器抽取溶液B,小心冲洗除去肠段的内容物。
两端用细线结扎,在肠段中部作一横的小切口,将其放入体积20ml的离体器官浴筒中,该浴筒含有溶液B,维持恒温(34~36℃),并通入95%O2和5%CO2的混合气体。
肠段一端用细线结扎固定在靠近浴筒底部,另一端细线附着在十六道生理仪拉力转换器上。
根据其灵敏度加以调节使对肠段的拉力约为1g,记录该肠段的收缩。
用溶液B冲洗器官浴筒,让浴液保留10min。
再用溶液B冲洗2-3次。
实验方法用磷酸组织胺溶液0.2~0.5ml加入浴液中,刺激其一系列的收缩,找出可重复的低于最大收缩反应的组胺浓度,即为高剂量(SH)。
每次加入组胺前,用溶液B冲洗浴筒3次,使肠段能完全松弛。
加入等体积的组胺溶液,引起收缩反应约为高剂量的一半,而且可以重复出现,此剂量为低剂量(SL)。
等体积的供试品原液(T1、T2、T3……)。
按顺序将SH、SL、T1、T2、T3……依次加入溶液B中,记录反应值。
组胺的检测实验报告

一、实验目的1. 了解组胺的化学性质及其在生物体内的作用。
2. 掌握组胺的检测方法,包括原理、步骤和注意事项。
3. 通过实验,提高学生对生物化学实验操作技能的掌握。
二、实验原理组胺(Histamine)是一种生物胺,广泛存在于人体组织中,具有调节免疫、过敏反应等生理功能。
组胺的检测方法主要有比色法、荧光法、电化学法等。
本实验采用比色法检测组胺,其原理是基于组胺与特定试剂发生反应,生成具有特定颜色的化合物,通过测定其吸光度来定量分析组胺含量。
三、实验材料1. 样品:含有组胺的样品,如血清、尿液等。
2. 试剂:组胺标准品、显色剂、缓冲液、蒸馏水等。
3. 仪器:紫外可见分光光度计、移液器、容量瓶、试管等。
四、实验步骤1. 标准曲线绘制(1)准确称取一定量的组胺标准品,用缓冲液配制成不同浓度的标准溶液。
(2)取试管若干,分别加入不同浓度的组胺标准溶液,加入显色剂,混匀。
(3)室温下放置10分钟,用紫外可见分光光度计在特定波长下测定吸光度。
(4)以组胺浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定(1)取试管若干,分别加入待测样品和空白对照。
(2)按照标准曲线绘制步骤,加入显色剂,混匀。
(3)室温下放置10分钟,用紫外可见分光光度计在特定波长下测定吸光度。
(4)根据标准曲线,计算样品中组胺的含量。
五、实验结果与分析1. 标准曲线绘制以组胺浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到线性回归方程:y = 0.0476x - 0.0052,相关系数R² = 0.9975。
2. 样品测定(1)空白对照组吸光度:0.015(2)样品组吸光度:0.120(3)样品中组胺含量:0.120 - 0.015 = 0.105根据标准曲线,样品中组胺含量为:0.105 × 1000 / 0.0476 = 2215.5 ng/mL六、实验讨论1. 实验过程中,样品处理、试剂配制、操作步骤等环节需严格按照实验要求进行,以确保实验结果的准确性。
试剂1技术参数

试剂(1)技术参数产品名称:吸入性食物性过敏原特异性抗体IgE检测试剂盒(免疫印迹法)规格:20人份/盒产品用途:该产品用于定性检测人血清中过敏原特异性IgE水平,检测项目:共21位点,30项目:、屋尘螨/户尘螨、屋尘、蟑螂、狗毛皮屑、猫毛皮屑、矮豚草、艾蒿、葎草、霉菌组合(点青霉/交链孢霉/烟曲霉/分枝孢霉)、树花粉组合(栎树/榆树/梧桐/柳树/杨树)、鸡蛋白、牛奶、牛肉、羊肉、蟹、虾、鳕鱼、鲑鱼、龙虾/扇贝、花生、黄豆主要技术参数和要求:1.检测方法:免疫印迹法,血清检测。
2.检测位点:21个位点。
3.检测区间:≥0.35IU/ml4.适用仪器:手工或全自动免疫印迹仪5.主要性能指标:最低检出量:用最低检出量质控品进行检测,不高于0.35IU/ml。
阴性质控品符合率:阴性质控品结果判读为阴性结果,阴性质控品符合率为100%。
阳性质控品符合率:阳性质控品结果判读符合阳性质控品性质,阳性质控品符合率为100%。
精密度:以某一浓度的人IgE校准品重复测定(n=10),反应结果一致,显色度均一。
交叉反应:与5.0IU/ml人IgA、IgG、IgM无交叉反应;由于两种或两种以上过敏原蛋白在结构上的相似,使它们竞争IgE抗体的结合表位,引起交叉反应。
临床灵敏度:>95.0%临床特异性:>98.0%6.资质:国家食品药品监督管理局批准的三类体外诊断试剂证书。
试剂(2)技术参数产品名称:总IgE检测试剂盒(胶体金法)规格:规格:20人份/盒产品用途:该产品用于定性检测人血清中总IgE抗体含量。
主要技术参数和要求:1.检测方法:胶体金法,血清检测。
2.检测位点:总IgE3.检测区间:≥87IU/ml5.适用仪器:无需仪器6.主要性能指标:最低检出量:用最低检出量质控品进行检测,不高于87IU/ml。
阴性质控品符合率:阴性质控品结果判读为阴性结果,阴性质控品符合率为100%。
阳性质控品符合率:阳性质控品结果判读符合阳性质控品性质,阳性质控品符合率为100%。
快速检测试纸检测肉类食品安全

科技资讯2015 NO.33SCIENCE & TECHNOLOGY INFORMATION学 术 论 坛肉类是人们重要的食物来源,肉类食品安全是食品安全中的重点之一。
目前,有些商贩在高价肉类中掺入低价肉类,以降低成本,这样很容易引发食品安全问题,甚至可能引发宗教问题与民族矛盾。
另一方面,肉类中残留的β-兴奋剂类药物(包括克伦特罗,莱克多巴胺、沙丁胺醇等)则会危害人类健康。
因此,建立一种快速准确的检测肉类食品安全的检测方法,用于检测肉类掺假,以及肉类中残留的β-兴奋剂类药物,具有重要意义。
检测肉类掺假的方法,有色谱法[1]、电泳法[2]、聚合酶链式扩增法(PCR)[3]、酶联免疫分析法(ELISA)[4]等。
检测β-兴奋剂类药物的方法有高效液相色谱法[5,6]、酶联免疫分析法(ELISA)[7,8]、胶体金免疫层析法[9]等。
其中,色谱法与电泳法的操作较繁琐,对操作人员的要求较高,PCR与ELISA的方法反应时间较长。
该研究使①基金项目:空间多指标生物分析仪器开发及应用(项目编号:2012YQ040140)。
作者简介:王琳(1980—),男,辽宁省海城市人,硕士,工程师,研究方向:快速诊断检测技术的研究开发和应用等。
DOI:10.16661/ki.1672-3791.2015.33.209快速检测试纸检测肉类食品安全①王琳 王雪 宋云飞(北京普析通用仪器有限责任公司 北京 101200)摘 要:目的 建立检测肉类食品安全的快速检测方法。
方法 使用快速检测试纸检测肉类掺假,以及肉类中残留的盐酸克伦特罗、莱克多巴胺与沙丁胺醇。
结果 使用猪肉检测快速检测试纸,检测羊肉中掺加的猪肉,掺加猪肉的比例为0.75%~25%,可以检出。
使用胶体金检测仪结合快速检测试纸,检测肉类中添加的盐酸克伦特罗、莱克多巴胺与沙丁胺醇,盐酸克伦特罗的平均添加回收率在110%左右,莱克多巴胺的平均添加回收率为90%~120%,沙丁胺醇的平均添加回收率在110%左右。
DB13_T5145-2019鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留检测方法酶联免疫吸附法

ICS65.020.30B 43 DB13 河北省地方标准DB 13/T 5145—2019鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留检测方法酶联免疫吸附法2019-12-27发布2020-01-28实施前言本标准按照GB/T 1.1-2009给出的规则起草。
本标准由河北省农业农村厅提出。
本标准起草单位:河北省兽药监察所、河北英茂生物科技有限公司、北京维德维康生物技术有限公司、秦皇岛市农产品质量安全监督检验中心、承德市畜禽水产品质量检验监测中心、石家庄市畜产品质量监测中心、唐山市食品药品综合检验检测中心、邢台市动物卫生监督所、邢台市农业农村局、邢台市畜牧站。
本标准主要起草人:王萍、刘怡菲、翟明成、李研东、闫超、李海龙、马立才、张嘉楠、刘力、李云、崔沙沙、赵芳、武侠均、钱春彩、左佳、孟令庄、李文香、李肖莉、陈宝明。
鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留检测方法酶联免疫吸附法1 范围本标准规定了鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留量酶联免疫吸附(ELISA)法的制样和检测方法。
本标准适用于鸡肉、鸭肉中金刚烷胺、金刚乙胺、索金刚胺残留量的快速筛选测定。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的文件,仅注日期的版本适用于本文件。
凡是不注的日期的引用文件,其最新版本(包括所有修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法3 制样3.1 样品的制备取新鲜或冷冻的空白或供试组织,去除脂肪和筋膜,绞碎均质。
3.2 样品的保存-20℃以下贮存,保存期6个月。
4 测定方法4.1 原理本方法的测定原理是竞争性酶联免疫反应。
酶标板微孔上预包被有偶联抗原,加标准品或待测样品后,再加抗金刚烷胺抗体,包被抗原与加入的标准品或待测样品竞争抗体,通过洗涤除去游离的抗原、抗体及抗原抗体结合物。
再加入酶标记物,酶标记物与抗体结合。
加入底物液后,结合到板上的酶标记物使底物显色。
HPLC-MS联用法测定猪肉组织中5种磺胺类药物的残留

HPLC-MS联用法测定猪肉组织中5种磺胺类药物的残留范莹莹;其鲁;杨树民【期刊名称】《现代仪器与医疗》【年(卷),期】2008(014)001【摘要】建立一种用高效液相色谱与质谱联用法测定猪肉组织中磺胺类药物残留的方法,该方法检测猪肉中的磺胺类药物快速、准确.样品经2%的醋酸水溶液提取后通过固相萃取柱净化,用甲醇洗脱,吹干,然后用流动相A溶解,用DAD及MS检测器检测.采用Agilent HC-C18(4.6×250mm,5μm)色谱柱,以0.3%甲酸和5%甲醇的水溶液-0.3%甲酸的甲醇溶液为流动相进行梯度洗脱.在添加水平为0.1mg/kg,0.2mg/kg,0.5mg/kg时,对于不同的药物,回收率范围为55.3%~102.8%,相对标准偏差在0.79%~10.4%之间,方法的最低检出限为0.1~0.5ppb.通过大量的实验结果表明,该方法适用于猪肉组织中磺胺类药物的残留测定.【总页数】4页(P27-30)【作者】范莹莹;其鲁;杨树民【作者单位】中信国安盟固利电源技术有限公司,北京,102200;北京大学,北京,100871;国家体委兴奋剂检测中心,北京,100029【正文语种】中文【中图分类】S8【相关文献】1.气相色谱-质谱联用法测定猪肉组织中氟苯尼考残留 [J], 贺利民;曾振灵;黄显会;刘文字;刘戎2.液相色谱-质谱联用法测定猪肉中16种磺胺类药物的残留 [J], 蒋丽娜;柏旭3.浅谈高效液相色谱法测定猪肉中磺胺类药物残留的注意事项 [J], 魏春梅; 熊杰; 李春晓4.液相色谱—质谱/质谱法测定猪肉中4种磺胺类药物残留量的不确定度评定 [J], 闫顺华;王亚丽;夏依拉·艾尼5.超高相液相色谱-串联质谱法测定鲜猪肉中8种磺胺类药物残留 [J], 王玲;林柯璐因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Q/HTM 杭州天迈生物科技有限公司企业标准
Q/HTM YQ014-2019
代替Q/HTM YQ014-2017肉类中组胺仪器检测试剂盒
2019-11-14发布2019-11-14实施
Q/HTM YQ014-2019
前 言
本标准根据GB/T1.1-2009进行编写。
请注意本文件的某些内容可能涉及专利。
本文件的发布机构不承担识别这些专利的责任。
本标准由杭州天迈生物科技有限公司提出。
本标准起草单位:杭州天迈生物科技有限公司。
本标准主要起草人:张诗曼。
本标准由杭州天迈生物科技有限公司归口。
本标准发布后代替Q/HTM YQ014-2017。
肉类中组胺仪器检测试剂盒
1范围
本标准规定了肉类中组胺仪器检测试剂盒的原理、要求、试验方法、检验规则、标签、包装、运输、贮存。
本标准适用于本公司生产和销售的以三氯乙酸、氢氧化钠、正戊醇、盐酸、碳酸钠、对硝基苯胺、亚硝酸钠等配制而成的,用于仪器检测的肉类中组胺仪器检测试剂盒(以下简称试剂)。
本标准适用于定量检测鲜、冻动物性水产品中组胺的含量的检测试剂。
2规范性引用文件
下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191包装储运图示标志
GB/T603化学试剂试验方法中所用制剂及制品的制备
GB-2733-2015食品安全国家标准鲜、冻动物性水产品
3原理
样品中的组胺经提取后,与检测试剂发生化学反应,生成黄褐色产物,颜色深浅与组胺含量呈正比,通过仪器内置标准曲线可得样品中组胺的含量。
4技术要求
4.1原料要求
三氯乙酸(分析纯)
氢氧化钠(分析纯)
正戊醇(分析纯)
盐酸(分析纯)
无水碳酸钠(分析纯)
对硝基苯胺(分析纯)
亚硝酸钠(分析纯)
4.2感官指标
a)试剂盒外观应干净整洁无破损。
b)试剂应密封、无污损、无泄漏。
c)试剂盒标签、批号和生产日期准确无误,内容物应和标签所示数量一致。
4.3检出限
12.0mg/100g(以样品稀释倍数20计)。
4.4准确性
7次重复测试,测试结果相对误差不大于10%。
5试验方法
5.1感官
目视检查。
5.2检出限
配制检测范围内浓度的磷酸组胺标准溶液(如0.5mg/100g),进行7次平行检测,记录检测结果并计算标准偏差,以标准偏差3倍数值作为最低检出吸光度,根据标准曲线,计算此吸光度对应的浓度,记为检出限。
5.3准确性
分别配制浓度为0.5mg/100g和 4.0mg/100g的磷酸组胺标准溶液,按照试剂使用说明书分别进行7次平行检测,记录检测结果,计算检测结果的相对误差。
6检验规则
试剂盒经检验部门检验合格后方能出厂,并附有产品合格证书。
6.1检验分类
产品的检验分为:
a)出厂检验;
b)型式检验。
6.2组批
使用同批次原料一次性生产的同规格的产品为同一组批。
6.3抽样方法
从每一批次中按下表所示随机抽样,作为检验。
表1抽样方法
检验批量N盒≤10≤100≤500≤2000>2000
抽取样本量n盒11020502%
6.4出厂检验
产品应逐批经公司质检部门检验合格后,并附合格证或合格签章方能出厂。
检验项目为技术要求涵盖的各条款,所检项目均应合格。
6.5型式检验
6.5.1试剂在下列情况之一时,应进行型式检验。
a)新产品试制和定型鉴定时;
b)正常生产情况下每半年进行一次;
c)如工艺、原材料有较大改变可能影响产品质量时;
d)产品停产半年后,重新恢复生产时;
e)国家质量监督部门抽查时。
6.5.2型式检验项目为本标准的全部项目。
6.6判定规则
抽检产品检验结果如有任何一项不符合本标准要求时,允许加倍抽样进行复验,复验仍不合格时,该批产品即判为不合格产品。
7标志、包装、运输、贮存
7.1标志
产品包装上应有以下标志:产品名称、规格、包装数量、产品标准号、产品批号、生产日期、保质期、贮存方法、公司名称、公司地址、联系方法。
7.2包装
包装材料符合国家相关要求,包装储运标志应符合GB/T191标准要求。
包装盒内附使用说明书。
7.3运输
在运输过程中应防止日晒、雨淋、抛压。
7.4贮存
产品在4℃冷藏保存。
有效期为12个月。
