高中化学电子式书写注意点
高考化学中常见的电子式大全
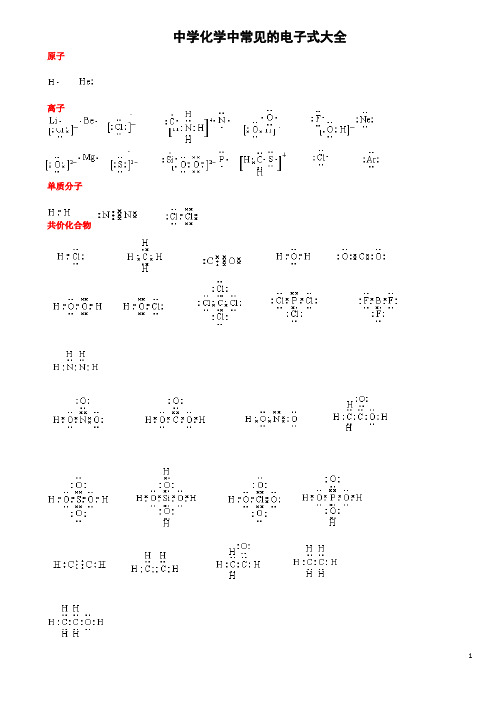
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
电子式的书写

电子式是高中化学必修二的一个重要高中化学只是带你,考查形式通常为电子式的书写和判断正误,也是高考化学试题中常涉及到的一个知识点。
首先我们来看看什么是电子式?电子式就是在元素符号周围用小黑点“·”或小叉“×”来表示元素原子的最外层电子的式子。
其次,中学化学网现将不同粒子的电子式的书写方法总结如下:1.原子的电子式①书写方法:首先写出其元素符号,再在元素符号周围用“·”或“×”标出它的最外层电子。
依据元素的原子最外层电子个数的多少,先用小黑点“•”(或“×”)等符号在元素符号上、下、左、右各表示出1个电子,多余的电子配对。
②例子:元素周期表中前18号元素原子电子式如下图:2.离子的电子式(1)简单阳离子的电子式①书写方法:用该阳离子的离子符号表示。
具体原因是:简单阳离子由于在形成过程中已失去最外层电子,所以其电子式就是其离子符号本身。
②例子:钠离子Na+;镁离子Mg2+;钡离子Ba2+(3)复杂的阳离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:铵根离子电子式如下图(铵根离子电子式)(3)简单阴离子的电子式①书写方法:不但要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷。
②例子:氯离子和氧离子的电子式如下图:(4)复杂的阴离子的电子式①书写方法:不仅要标出最外层电子数,而且要用“[ ]”括起来,并在右上角标明离子所带的电荷②例子:过氧根离子和氢氧根离子的电子式分别如下图(过氧根离子电子式)(氢氧根离子电子式)3.单质分子的电子式①书写方法:对于以共价键作用结合成的非金属单质分子,他们的电子式由对应原子的电子式组合而成,但同时要表示出共用电子对数;而对其他(金属单质、稀有气体单质等)则一律用原子的电子式表示②例子:(氧气分子电子式)(氯气分子电子式)③技巧:可以根据非金属单质中各原子最外层都要达到8电子稳定结构(He除外),来确定非金属单质中的共用电子对数4.化合物的电子式(1)离子化合物的电子式①书写方法:离子化合物的电子式由阴、阳离子的电子式组合而成,但相同的离子不能合并②例子:(氯化钠电子式)(硫化钾电子式)(氯化铵电子式)(2)共价化合物的电子式①书写方法:共价化合物的电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况②例子:(氯化氢电子式)(二氧化碳电子式)③技巧:一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数5.用电子式表示物质的形成过程如:H2的形成过程K2S的形成过程注意:①用“→”表示形成过程,不用“=”;②“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,“→”右边是该物质的电子式;③用电子式表示离子化合物的形成过程时,可以在原子之间用箭头表示电子得失的关系,也可以不表示。
高中化学考试注意事项及电子式书写技巧

高中化学考试注意事项及电子式书写技巧1 、排列顺序时,分清是“由大到小”还是“由小到大”,类似的:“由强到弱”、“由高到低”等等。
2 、书写化学方程式时,分清是“=”还是“⇌”,如一种盐水解方程式一定用“⇌”不能用“=”,其产物也不能标“↓”或“↑”,弱酸、弱碱的电离一定要用“⇌”不能用“=”。
多元弱酸电离、多元弱酸根离子水解:不能一步写成和或漏写可逆符号;3 、别忽视题干中“混合物”、“化合物”、“单质”等限制条件。
4 、有单位的要写单位,没有单位的就不要写了。
如“溶解度”单位是“ g ”,却不写出,“相对分子质量”、“相对原子质量”无单位,却加上“g ”或“g ·mol -1”。
摩尔质量有单位(g ·mol -1) 却不写单位,阿伏加德罗常数单位是“ mol -1”而未写,失分。
5 、要求写“名称”却写分子式或其他化学式,要求写分子式或结构式却写名称。
电子式、原子或离子结构示意图、结构简式、结构式不看清,张冠李戴。
要求写离子方程式而错写成化学方程式。
书写电子式时,共价化合物忘了未成对电子,离子化合物中的阴离子与原子团离子忘了加中括号;元素符号和元素名称、结构简式和分子式、化学方程式和结构简式不要混淆。
6 、所有的稀有气体都是单原子分子而误认为双原子分子。
7 、273 ℃与273K 不注意区分,是“标况”还是“非标况”,是“气态”还是“液态”“固态”不分清楚。
22.4L.mol-1的适用条件。
注意三氧化硫、乙烷、己烷、水等物质的状态。
区分液态氯化氢和盐酸,液氨和氨水,液氯和氯水。
8 、计算题中往往出现“将样品分为两等份” ( 或“从 1000mL 溶液中取出50mL ”) ,最后求的是“原样品中的有关的量”,你却只求了每份中的有关量。
9 、请注意选择题“正确的是”,“错误的是”两种不同要求。
请注意,做的正确,填卡时却完全填反了,要十分警惕这种情况发生。
10 、求“物质的质量”与“物质的物质的量”、求气体的“体积分数”与“质量分数”不看清楚,失分。
中学高中高考化学中常见的电子式大全
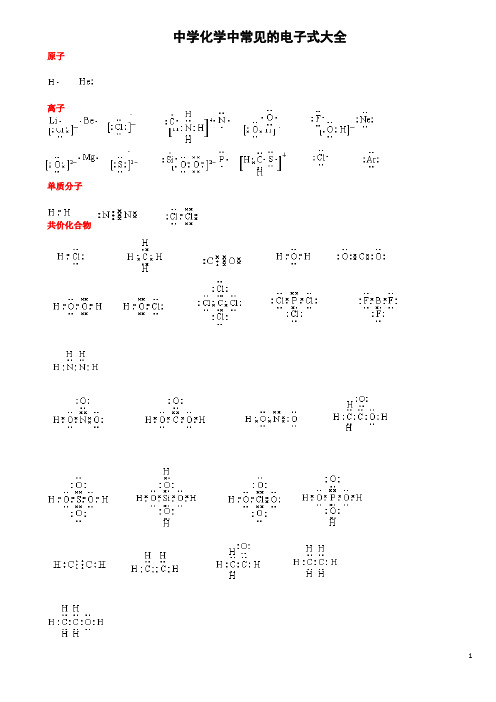
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高中有机化学知识点汇总(一)

高考有机化学专题一:有机物的结构和同分异构体:(一)有机物分子式、电子式、结构式、结构简式的正确书写:1、分子式的写法:碳-氢-氧-氮(其它元素符号)顺序。
2、电子式的写法:掌握7种常见有机物和4种基团:7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。
4种常见基团:-CH3、-OH、-CHO、-COOH。
3、结构式的写法:掌握8种常见有机物的结构式:甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。
(注意键的连接要准确,不要错位。
)4、结构简式的写法:结构简式是结构式的简写,书写时要特别注意官能团的简写,烃基的合并。
要通过练习要能识别结构简式中各原子的连接顺序、方式、基团和官能团。
掌握8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。
(二)同分异构体:要与同位素、同素异形体、同系物等概念区别,注意这四个“同”字概念的内涵和外延。
并能熟练地作出判断。
1、同分异构体的分类:碳链异构、位置异构、官能团异构。
2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。
3、烃卤代物的同分异构体的判断:找对称轴算氢原子种类,注意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。
专题二:官能团的种类及其特征性质:(一)、烷烃:(1)通式:C n H2n+2,代表物CH4。
(2)主要性质:①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。
③、隔绝空气时高温分解。
(二)、烯烃:(1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。
③、加聚反应。
(三)、炔烃:(1)通式:C n H2n-2(n≥2),代表物CH≡CH,官能团-C≡C-(2)主要化学性质:①、跟卤素、氢气、卤化氢、水发生加成反应。
【高中化学】2021年高考化学第一轮复习:电子式的书写

【高中化学】2021年高考化学第一轮复习:电子式的书写
本文主要为考生提供“2021年高考化学第一轮复习专题小结”,希望对考生朋友有所帮助!
电子写作
电子式,原子结构示意图,分子式,结构式,结构简式的表示方法是
高考
重中之重,是表示物质的化学用语,我们在化学试卷上依靠它们来表达,所以我们必须规范书写,每年的高考由于书写不规范造成失分的大有人在.
常用的电子式有:离子晶体na2o2naohna2onh4cl、分子晶体nh3n2ccl4co2h2o,以及一些需要记住的特殊电子式,如hclo-ohoh-ch3h3o+。
高中时,我们研究的电子式符合2或8电子稳定结构。
对于分子,最外层有几个小于8的电子,形成几个共价键(n2n)≡ 不CO)由离子晶体组成的粒子是阴离子和阴离子。
阴离子的电子标有[]和它们携带的电荷,而阳离子只表示电荷的数量。
容易出错的是ccl4n2-ch3,
电子式的书写注意美观,大众化,最好都用·或都用×,写错了必须重写,千万不要在错误的上改,那样卷面会让阅卷老师看不清,减分也是必然的了。
高考化学中常见的电子式大全
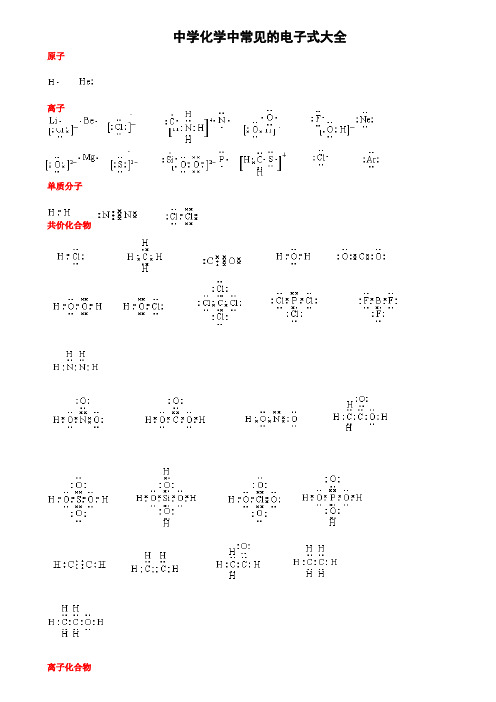
6.“基”中至少有一个原子是不符合8电子稳定结构,“基”是不显电性的,例如:-CH3、-OH。
三、注意微粒间的排列方式。
7.离子化合物多离子微粒阴阳离子交替排列。
8.共价化合物(有机物除外)多原子微粒正负价原子交替排列。
(4) 盐:氯化钠、氯化钙、硫化钠、氯化铵、硫化铵、甲酸钠、乙酸钠、次氯酸钠、次氯酸钙。
Na+[]-[]-Ca2+[]-Na+[]2-Na+
H H H
[]+[]-[]+[]2-[]+
H H H
H
[]-Na+[]-Na+
H
Na+[]-[]-Ca2+[]-
(5)类盐:电石、二氮化三镁。
Ca2+[]2-Mg2+[]3-Mg2+[]3-Mg2+
7.用电子式表示物质的形成过程
①离子化合物的形成过程
形成用“→”表示,形成之前为原子的电子式并用弯箭头表示电子得失,形成之后为离子化合物的电子式。例如,NaCl的形成过程为:
N2()CO()、
NO+()、
CN-()、
C22-()
CO2(电子式见前)NO2+、N3-、CNS-
SO
PO43-
掌握了微粒电子式的写法,就可以快速书写该微粒的结构式,也可以用电子式来表示微粒的形成过程。对于简单短周期元素的原子形成的微粒还可以依据其电子式推导其空间结构,
如BF3()中B原子上无孤对电子,此分子应为平
一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。例如, 、 、 。
高中化学电子式书写规则

高中化学【1】电子式书写规则在元素符号周围用“·”和“×”来表示原子的最外层电子(价电子),这种式子叫做电子式。
1. 原子的电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子。
例如,⋅H、⋅⋅N....、⋅⋅O....、⋅⋅F....。
2. 金属阳离子的电子式金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出。
所以金属阳离子的电子式即为离子符号。
如钠离子的电子式为Na+;镁离子的电子式为Mg2+,氢离子也与它们类似,表示为H+。
3. 非金属阴离子的电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
例如,[:]H-、[:..:]..F-、[:..:]..S2-。
4. 共价化合物的电子式共价化合物是原子间通过共用电子对结合而成的。
书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子。
例如,H Cl:..:..、: ..: ..:....Cl Cl。
5. 根离子的电子式根离子中,若不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用“[]”括起来,右上角标出电荷数。
例如,铵根阳离子:[:..:]..H NHHH+;氢氧根离子:[:..:]..O H-。
6. 离子化合物的电子式先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并。
例如,NaCl 、MgCl 2、Na 2O 的电子式分别为Na Cl +-[:..:]..、[:..:][:..:]....Cl Mg Cl -+-2、Na O Na +-+[:..:]..2。
高考化学中常见的电子式大全
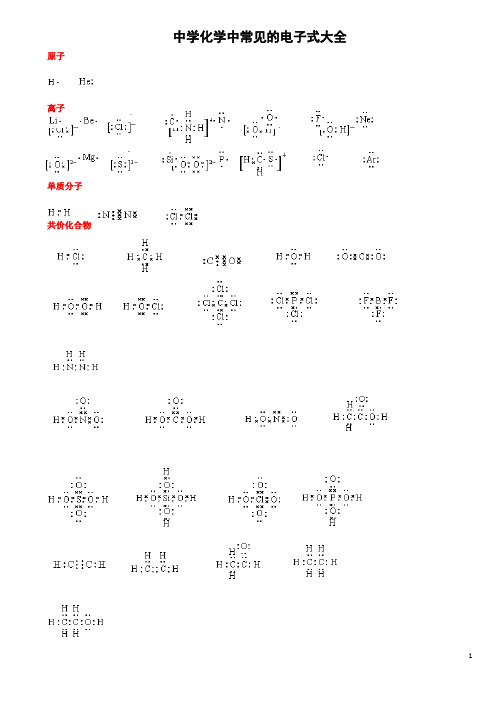
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O带部分负电荷,因此的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 价,的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔O O H Cl O Mg 2+Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
(完整版)高考化学中常见的电子式大全

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高考化学中常见的电子式大全
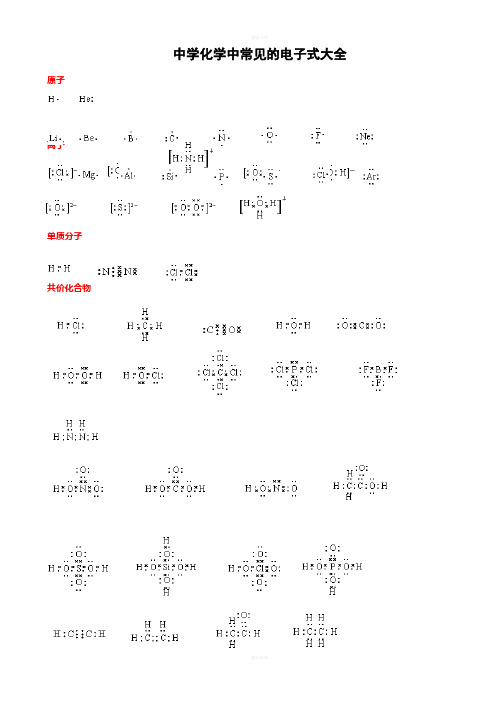
中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高,OO H Cl OMg 2+ Cl 2如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
化学电子式 元素周期表 离子式

高中化学电子式书写规则在元素符号周围用“·”与“×”来表示原子得最外层电子(价电子),这种式子叫做电子式。
1、原子得电子式由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子得最外层电子全部排列在元素符号周围。
排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子。
例如,、、、。
2、金属阳离子得电子式金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子得电子式时,就不再画出原最外层电子,但离子所带得电荷数应在元素符号右上角标出。
所以金属阳离子得电子式即为离子符号。
如钠离子得电子式为;镁离子得电子式为,氢离子也与它们类似,表示为。
3、非金属阴离子得电子式一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带得电荷数,电荷得表示方法同于离子符号。
例如,、、。
4、共价化合物得电子式共价化合物就是原子间通过共用电子对结合而成得。
书写时将共用电子对画在两原子之间,每个原子得未成对电子与孤对电子也应画出。
因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强得原子,而偏离吸引电子能力弱得原子。
例如,、。
5、根离子得电子式根离子中,若不同原子间以共价键结合,画法同共价化合物,因根离子带有电荷,所以应把符号用“[]”括起来,右上角标出电荷数。
例如,铵根阳离子:;氢氧根离子:。
6、离子化合物得电子式先根据离子电子式得书写方法,分别画出阴、阳离子得电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并。
例如,NaCl、MgCl2、Na2O得电子式分别为、、。
7、用电子式表示物质得形成过程①离子化合物得形成过程形成用“→”表示,形成之前为原子得电子式并用弯箭头表示电子得失,形成之后为离子化合物得电子式。
例如,NaCl得形成过程为:MgCl2得形成过程为:②共价化合物或非金属单质得形成过程表示方法基本同离子化合物相同,不同得就是因没有电子得失,所以不要再画弯箭头,并且“→”之后为共价化合物或非金属单质得电子式。
高考化学中常见的电子式大全(可编辑修改word版)

中学化学中常见的电子式大全原子离子单质分子共价化合物子的 Cl离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质; 对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查 热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电 排布,而只能靠O记忆、知识积累来处理这一类问题,错 误率较高,Mg 2+ 如将氧原子的电子式写成(正确应为 )。
典型错误归纳有以下两类: 一、无法正确排列微粒中原子或离子的顺序。
例如 HClO 的电子式写成:; MgCl 2 的电子式写成:。
二、不能正确表达共价键的数目。
例如混淆O2和H 2O2中氧原子间的共用电子对数目。
针对以上问题,笔差很小的非 或 性 氧 , 出式中 Mg 为+2 价,N 为-3 价,根 化 者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原) 子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为 HClO ,但 根据 H 、Cl 、O 个三原子的 ( 电负性)差异可知该分子中 H 、Cl 带部分正电荷,O 带部分负电荷,因此 HClO 的电子式应为:。
对于离子化合物Mg 3N 2,先可判断 Mg 2+Mg 2+Mg 2+据“异性相吸、电荷交叉”的规律其电子式为。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如 MgCl 2 由 Mg 2+和 Cl -以 1:2 的比例构成,Na 2O 2 由 Na +和 O 22-以 2:1 的比例构成。
而对于共价微粒、只有少数氧化性(电 负性)相 H C N 金属原子形成的共价体有例外,例如 HCN (其中 C 为+4 价、N为-3 价,电子式为 )。
高考化学中常见的电子式大全
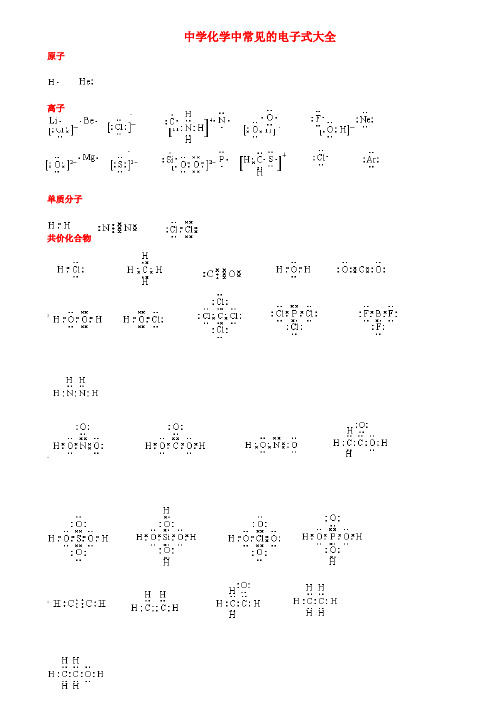
中学化学中常见的电子式大全原子离子(单质分子共价化合物》";离子化合物 $?\形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高,》如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共O OH O Cl H Cl O Mg 2+ Cl 2 Mg 2+NMg 2+NMg 2+3–3–价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中化学高考知识点---化学用语及离子反应易错点详细清单

高中化学高考知识点---化学用语及离子反应易错点详细清单一、有关化学用语的易错点1.电子式:离子带电荷,原子团不显电性。
如OH-为,-OH为。
2.书写化合物的电子式时要切实注意:①明确是离子化合物还是共价化合物;②切勿漏掉未成键电子对;③理清原子的排列顺序,如。
④书写电子式不要漏写非成键电子对,如NH3的电子式是,而不是。
3.结构简式需保留官能团,如CH2=CH2,不能写成CH2CH2。
4.各“式”切勿张冠李戴:是名称还是化学式,是分子式还是实验式(最简式),是结构式还是结构简式,是原子结构示意图还是离子结构示意图,是化学方程式还是离子方程式等。
5.化学方程式或离子方程式要遵循质量守恒、电荷守恒,如果是氧化还原反应的还要遵循电子得失守恒,化学计量数要最简,注明反应条件并注意↑↓? === →等符号的使用。
6.因混淆电离方程式和水解方程式而导致错误。
如HS-+H2O ? H3O++S2-是HS-的电离方程式,HS-+H2O ? H2S+OH-是HS-的水解方程式。
7.注意球棍模型、比例模型原子大小的比较,如甲烷和四氯化碳的球棍模型分别为,而不能记反了,碳原子、氢原子、氯原子的大小顺序为氢原子<碳原子<氯原子。
8.球棍模型要表示出构型,结构式不用。
二、有关离子反应的易错点1.写离子方程式关键是“拆”,要“拆”得合理。
①熟记可“拆”的强酸、强碱和易溶盐。
下面的有关盐的溶解性口诀可帮助你记忆:钾钠铵盐都可溶,硝酸盐遇水无踪影,硫酸盐不溶硫酸钡,氯化物不溶氯化银。
②不能拆成离子的物质:难溶的物质,弱酸、弱碱和水(难电离的)、气体、单质、氧化物、多元弱酸的酸式酸根(HSO除外)。
③对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则不能拆写成离子,应保留化学式Ca(OH)2。
2.判断离子方程式正误要抓住两易、两等、两查。
①两易:易溶、易电离的物质以实际参加反应的离子的符号表示,非电解质、弱电解质、难溶物、气体等物质用化学式表示。
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律O O H O ClH Cl O Mg 2+Cl 2Mg 2+ N Mg 2+ N Mg 2+其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
OO H Cl O Mg 2+Cl 2“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
高考化学中常见的电子式大全

中学化学中常见的电子式大全原子 离子 单质分子 共价化合物 离子化合物 形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成:; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电O O H O ClH Cl OCl 2荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学电子式书写注意点
电子式是重要的化学用语,能清楚地表示出原子、离子、离子化合物和共价化合物的结构和形成,要能正确地掌握和应用,书写时必须注意以下问题。
1. 用电子式表示离子化合物的形成的注意点
(1)左边写出形成离子化合物中各原子的电子式,右边写出生成的离子化合物的电子式,中间用“→”连接,而不是“=”。
(2)用电子式表示离子化合物的结构时,对于阳离子来说,一般用阳离子符号表示,如等;而阴离子则不同,应在元素符号的周围用小黑点(·)或小叉(×)表示最外层电子数,外面加上中括号([ ]),并在中括号的右上角标上离子所带的负电荷数,如。
(3)构成离子化合物的每一个离子都要单独书写,不可合并,书写原子的电子式时,若有几个相同的原子,可合并书写。
如:
2. 用电子式表示共价化合物的形成的注意点
(1)左边书写出形成共价化合物的原子的电子式,相同可以合并,右边写出生成的共价化合物的电子式,相同原子不可合并,中间用“”连接。
(2)不同元素的原子形成分子时,共用电子对的数目不同,原子最外层电子数目离稳定结构差几个电子,一般要共用几对电子。
(3)共价化合物的电子式中,要注意使每个原子周围的电子数均达到稳定结构。
(4)由于共价化合物中没有阴、阳离子,所以用电子式表示共价化合物的结构时,不使用中括号,也不标电荷数。
如:
3. 电子式书写中的常见错误
(1)漏写未参加成键的电子对。
如:
(2)离子错误合并。
如:
(3)错写分子中原子间的结合方式。
如:
中是O与H和Cl成键,应写为。
(4)离子化合物、共价化合物不分,乱用或丢掉中括号。
如:
(5)不遵循成键规律,胡乱添加电子。
如:
4. 例题解析
例1. 下列化合物的电子式书写正确的是()
A. 氨气:
B. 四氯化碳:
C. 甲烷:
D. 二氧化碳:
解析:A项中N的最外层电子没有全部标出;B项中Cl的最外层电子也没有全部标出;D项中C、O共用电子对数目标错。
故选C项。
点评:书写共价化合物的电子式时应注意:①各原子最外层的电子即使未参与成键也必须全数标出;②要正确标出共用电子对的数目;③较复杂的分子要标出原子间的连接方式,原子间的连接方式不一定是分子式书写的顺序。
例2. 化合物A是一种不稳定的物质,它的分子组成可用
表示,10mLA气体能分解成和(均在同温同压下测定)。
请据此填空:
(1)A的化学式是,推断的依据是。
(2)已知分子中x个氧原子呈…O—O—O…链状排列,则A 分子的电子式是。
解析:(1)由阿伏加德罗定律可知,相同条件下,气体的体积之比等于其物质的量之比,得,再根据质量守恒定律得x=3、y=2,则为。
(2)由题给信息以及成键规律可得,的电子式为。
