可见异物检查SOP
可见异物检查操作规程

可见异物检查操作规程
一、目的:制定可见异物检查操作规程
二、依据:客户要求
三、适用范围:本公司轻碱,小苏打成品出厂检验。
四、检查过程:准确称取成品500g,用已洁净的80目筛子过筛后,用药勺在筛上物中检查,均匀反复检查,目测出黑星,金属屑,块状异物等个数及其大小,一般要求最大粒径不超过2mm;称量80目筛上物多少克,要求产品粒度80目小于4%
五、按客户要求20吨产品异物不超过10g,即500g样品中所有异物总克数不超过万分之一克,且异物指的是粒径不超过2mm的;
六、若有最大粒径超过2mm的,需及时上报各级领导并在报告中特别注明。
七、本规程即日起执行。
桐柏海晶碱业有限责任公司
质控中心
2016年3月30日。
003可见异物检查标准操作规程(药品)

003可见异物检查标准操作规程(药品)公司标准操作规程编号:STD-SOP-QM-003-00题目可见异物检查标准操作规程颁发部门分析测试中心制定日期审核日期批准日期分发分析测试中心研发部药品研发中心目的:规范可见异物检查操作法范围:半成品、成品职责:分析测试中心对本规程的实施负责正文:1.准备工作1.1检查装置的准备1.1.1光源:采用带遮光板的日光灯。
无色注射液或滴眼液检查时的光照度为1000~1500Lx的位置,透明塑料容器或有色注射液或滴眼液检查时的光照度为2000~3000Lx的位置,混悬型注射液或滴眼液应为光照度为4000Lx条件下检查色块、纤毛等外来污染物。
1.1.2式样:采用伞棚式装置,两面或单面用。
1.1.3背景:为不反光黑色。
侧面和底部为不反光白色背景(供检查有色异物)。
1.1.4距离:供试品至人眼距离通常为25cm 。
1.1.5检查:应在避光室内或在暗处进行。
1.2 检查人员的准备1.2.1视力:远距离和近距离视力测验,均为4.9或4.9以上(矫正后视力后应为5.0或5.0以上)。
1.2.2色盲测验:应无色盲。
1.2.3可见异物检查操作人员经统一判断标准的实习,能正确辨别各种异物后,方可作为正式检查人员。
2.操作步骤或程序2.1检查方法除另有规定外,置供试品于遮光板边缘处,在黑色背景下,用目检视,再在白色背景下检视一次。
2.2水(醇)溶剂型注射液除另有规定外,将供试品20支(瓶),除去标签,擦净容器外壁。
手持取支(瓶或袋)数连续操作,于伞棚边缘处,手持容器颈部(或两手分别持软袋的口管和吊环处)使药液轻轻翻转和翻转容器,使药液中的可见异物悬浮(注意不使药液产生泡),用目检视,按2.1检查方法检查。
50ml或50ml以上的注射液按直、横、倒三步法旋转检视。
2.3油溶剂型注射液油溶剂型注射液按水(醇)溶剂型注射液的检查方法检查。
如有结晶析出,可在80 o C以下水浴中加热30分钟,振摇,放冷至20~30 o C检查,若结晶不溶者判为不合格。
可见异物检查法操作规程.doc

题目可见异物检查法标准操文件编号SOP/ZZ15-614-00 作规程制定人审核人批准人审核日期制定日期审核人批准日期审核日期颁发部门质管部生效日期分发部门质管部、质控部可见异物检查法标准操作规程1、目的:建立一个可见异物检查法标准标准操作规程,确保检验结果的正确性2、适用范围:可见异物检查法3、职责:3.1.检验操作人员负责按可见异物检查法标准标准操作规程进行操作。
3.2.质保部负责可见异物检查法操作规程的文件审核及监督实施。
4、内容4.1 检验依据:《中国药典》2010 年版二部附录ⅨΗ。
4.2 简述可见异物系指存在于注射剂、眼用液体制剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm,可见异物检查法包括灯检法和光散射法,本药厂注射剂可见异物检查方法现执行灯检法,灯检法应在暗室中进行。
本药厂有静脉用小容量注射剂、非静脉用小容量注射剂4.3 操作方法4.3.1 检查装置a.光源无色注射剂或滴眼剂的检查,光照度应为1000~ 1500L X;透明塑料容器或有色溶液注射剂于光照度为2000~ 3000L X的位置,混悬型注射剂和混悬型滴眼剂,光照度为4000Lx,仅检查色块、纤毛等可见异物。
b.式样采用伞棚式装置,两面或单面用,见中华人民共和国药典附录ⅨΗ。
c.背景为不反光黑色,在背部右侧和底部为不反光白色(供检查有色异物)。
d.距离供试品至人眼距离通常为25cm。
e.检查应在避光室内或暗处进行。
4.3.2 检查规则4.3.2.1 检查人员条件a.视力远距离近距离视力测验,均为 4.9 或 4.9 以上(矫正后视力为 5.0 或 5.0 以上)。
色盲测验应无色盲。
b.可见异物检查操作人员应经有关可见异物检查法的全面培训,能正确掌握判断标准,熟练掌握操作方法,方可上岗操作。
4.3.2.2 检查方法除另有规定外,取供试品 20 支,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的专用玻璃容器内,置供试品于遮光板边缘处,在明视距离分别在黑色和白色背景下,手持供试品颈部使药液轻轻翻转,轻轻旋转和翻转容器使药液中可能存在的可见异物悬浮(注意不使药液产生气泡),轻轻翻转后即用目检视,重复 3 次,总时限为 20 秒。
可见异物检查法标准操作规程

可见异物检查法标准操作规程1、目的:建立一个可见异物检查法标准标准操作规程,确保检验结果的正确性2、适用范围:可见异物检查法3、职责:3.1.检验操作人员负责按可见异物检查法标准标准操作规程进行操作。
3.2.质保部负责可见异物检查法操作规程的文件审核与监督实施。
4、内容4.1检验依据:《中国药典》20XX版二部附录ⅨΗ。
4.2简述可见异物系指存在于注射剂、眼用液体制剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm,可见异物检查法包括灯检法和光散射法,本药厂注射剂可见异物检查方法现执行灯检法,灯检法应在暗室中进行。
本药厂有静脉用小容量注射剂、非静脉用小容量注射剂4.3操作方法检查装置a.光源无色注射剂或滴眼剂的检查,光照度应为1000~1500L;透明塑料X的位置,混悬型注射剂和混悬型容器或有色溶液注射剂于光照度为2000~3000LX滴眼剂,光照度为4000Lx,仅检查色块、纤毛等可见异物。
b.式样采用伞棚式装置,两面或单面用,见中华人民共和国药典附录ⅨΗ。
c.背景为不反光黑色,在背部右侧和底部为不反光白色(供检查有色异物)。
d.距离供试品至人眼距离通常为25cm。
e.检查应在避光室内或暗处进行。
检查规则.1检查人员条件a.视力远距离近距离视力测验,均为4.9或4.9以上(矫正后视力为5.0或5.0以上)。
色盲测验应无色盲。
b.可见异物检查操作人员应经有关可见异物检查法的全面培训,能正确掌握判断标准,熟练掌握操作方法,方可上岗操作。
.2检查方法除另有规定外,取供试品20支,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的专用玻璃容器内,置供试品于遮光板边缘处,在明视距离分别在黑色和白色背景下,手持供试品颈部使药液轻轻翻转,轻轻旋转和翻转容器使药液中可能存在的可见异物悬浮(注意不使药液产生气泡),轻轻翻转后即用目检视,重复3次,总时限为20秒。
必要时将药液转移至洁净透明的专用玻璃容器内;用目检视。
0904可见异物检查法

注射用无菌制剂及无菌原料药溶解所用的适当方法应与其制剂使用说明书中注明的临 床使用前处理的方式相同。除振摇外,如需其他辅助条件,则应在各品种正文中明确规 定。
眼用液体制剂 除另有规定外,取供试品 20 支(瓶),按上述方法检查。临用前配制 的滴眼剂所带的专用溶剂,应先检查合格后,再用其溶解滴眼用制剂。
产生气泡),使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检查,重 复观察,总检查时限为 20 秒。供试品装量每支(瓶)在 10ml 及 10ml 以下的,每次检查可 手持 2 支(瓶)。50ml 或 50ml 以上大容量注射液按直、横、倒三步法旋转检视。供试品 溶液中有大量气泡产生影响观察时,需静置足够时间至气泡消失后检查。
结果判定 同灯检法。
检查法
溶液型供试品 除另有规定外,取供试品 20 支(瓶),除去不透明标签,擦净容器外 壁,置仪器检测装置上,从仪器提供的菜单中选择与供试品规格相应的测定参数,并根据
供试品瓶体大小对参数进行适当调整后,启动仪器,将供试品检测 3 次并记录检测结果。 凡仪器判定有 1 次不合格者,可用灯检法确认。用深色透明容器包装或液体色泽较深等灯 检法检查困难的品种不用灯检法确认。
可见异物检查法

可见异物检查法
可见异物系指存在于注射剂和滴眼剂中,在规定条件下目视可以观测到的任何不溶性物质。
实验室检测时应避免引入可见异物。
检查人员条件远距离和近距离视力测验,均为4.9或4.9以上(矫正后视力应为5.0或5.0以上);应无色盲。
检查法
取供试品20瓶,除去容器标签,擦净外壁污痕,放室温静置过夜,在避光室内或暗处,手持供试品容器瓶颈部于遮光板边缘处,轻轻旋转和翻转容器,使药液中可能存在的可见异物悬浮(注意不使药液产生气泡),在明视距离(指供试品至人眼的清晰观察距离,通常为25cm),分别在黑色和白色背景下,用目检视,检查时限为20秒。
每次检查拿取2瓶,被观察供试品放置处的光照度应为1000~1500lx。
结果判定
检察的20瓶供试品中,均不得检出玻璃屑、金属屑、纤维、色点、色块等明显可见异物,检出不符合下表规定的细微可见异物不得超过1瓶。
如检出2瓶,应另取20瓶同法复试。
初、复试检出不符合下表规定的细微可见异物的供试品不得超过2瓶。
关于细微可见异物的说明:
(1)白点系指不能辨清平面或棱角的白色物体。
(2)细小蛋白质絮状物或蛋白质颗粒系指半透明的小于约1mm的絮状沉淀或蛋白质颗粒。
(3)少量絮状物或蛋白质颗粒系指在规定检查时间内,较难计数的蛋白质絮状物或蛋白质颗粒。
(4)微量沉积物系指静置后供试品中的微小沉积物,轻轻转动后有烟雾状沉淀浮起,轻摇即散失者。
(5)摇不散的沉淀系指久置后蛋白质溶液出现的少量沉积物,轻轻摇动后不能分散消失者。
[附注]
检查时发现瓶盖松动或有微量沉积物的供试品需做无菌检查。
322JZ-SOP-yq-322可见异物检测仪验证方法

可见异物检测仪验证方法1 说明1.1 本方法适用于可见异物检测仪的验证。
1.2 本方法参照《中国药典》2005年版二部(附录IX H)及相关资料制订。
2 验证项目和技术要求照度的准确度:误差≤±5%3 验证条件3.1 环境条件:在暗室内进行3.2 照度计3.3 设定照度值:1000Lx 2000Lx 3000Lx4参考标准照度计5 验证方法5.1 将电源插头插入插座,打开电源开关。
5.2 调节照度5.2.1 将照度传感器放在灯箱伞棚边缘,显示光的照度,调节仪器上部右侧的照度调节旋钮,使光的照度至1000Lx。
5.2.2 按下启动键,五声蜂鸣短响后,再按一下启动键,调试结束。
5.3 用照度计进行校准5.3.1 将探头与主机连接。
5.3.2 按ON∕OFF键,将电源打开。
5.3.3 将探头对准测量目标,显示屏显示测得的数值。
起草人:刘静批准人:毕秀玲5.3.4 按HOLD键使显示的值停止,显示屏上显示“HOLD”和终止的数值,记录显示的数值,再按HOLD键,重复测定两次。
5.4 按4.2操作,调节旋钮使光的照度至2000Lx,再按4.3重复操作。
5.5 按4.2操作,调节旋钮使光的照度至3000Lx,再按4.3重复操作。
5.6 关闭检测仪、照度计及电源。
5.7 计算出三个照度的三次测定结果的均值和设定值的误差。
6 验证结果处理及周期6.1 验证结果全部项目均符合要求者,判为合格,方可使用。
若个别指标达不到要求,应进行维修,经验证,合格后方可以使用。
6.2 仪器如经搬迁、故障维修或出现数据异常时应重新进行验证。
6.3 验证周期一般为一年。
7 量值溯源图起草人:刘静批准人:毕秀玲起草人:刘静批准人:毕秀玲。
可见异物检查法-

可见异物检查法-以下是为大家整理的可见异物检查法-的相关范文,本文关键词为可见,异物,检查,,您可以从右上方搜索框检索更多相关文章,如果您觉得有用,请继续关注我们并推荐给您的好友,您可以在教育文库中查看更多范文。
中国药品检验标准操作规范可见异物检查法可见异物是指存在于注射剂、滴眼剂中,在规定条件下目视可以观测到的任何不溶性物质,其粒径或长度通常大于50um。
中国药典20XX年版二部附录Ixh中采用了灯检法和光散射法两种检查方法。
第一法灯检法1、简述本法为注射剂和滴眼剂可见异物检查的常用方法。
本法还用于光散射法检出可见异物的供试品的复核确认。
2、环境、装置与人员2.1环境实验室检测时应避免引入可见异物,供试品溶液的容器(如不透明、不规则形状容器等)不适于检测,需转移至专用玻璃容器中时,均应在100级的洁净环境(如层流净化台)中操作。
灯检法应在避光室内或在暗处进行。
2.2检查装置2.2.1光源采用带遮光板的日光灯,光照度在1000~4000lx范围内可以调节。
无色注射液或滴眼液检查时的光照度应为1000~1500lx;透明塑料容器或有色溶液注射液或滴眼液检查时的光照度应为2000~3000lx,混悬型注射液和滴眼液在光照度为4000lx条件下检查色块、纤毛等外来污染物。
2.2.2背景正面不反光的黑色面作为检查无色或白色异物的背景;侧面和底面的白色面作为检查有色异物的背景。
2.3检查人员条件远距离和近距离视力测验,均应为4.9或4.9以上(矫正后视力应为5.0或5.0以上);应无色盲。
3、距离检查人员调节位置,使供试品位于眼部的明视距离处(指供试品至人眼的距离,通常为25cm)。
4、操作方法4.1检查方法除另有规定外,置供试品于遮光板边缘处,在黑色背景下,用目检视,再在白色背景下检视一次。
4.2注射液的检查方法4.2.1水(醇)溶剂型注射液除另有规定外,取供试品20支(瓶),除去容器标签,擦净容器外壁。
药典可见异物检查标准

药典可见异物检查标准
药典对于药物的质量要求非常严格,包括对于药物中是否存在异物的检查标准也有明确的规定。
以下是根据药典所列出的药物异物检查标准的一般要求:
1.无可见异物:药物应当在肉眼可见的范围内没有任何异物存在。
2.异物含量限制:如果药物中确实存在一定量的异物,药典一
般会对异物的种类、含量和大小等进行明确规定,以确保药物的安全和质量。
常见的异物包括铁屑、颗粒、棉絮等。
3.颜色要求:药物的颜色应当符合药室所规定的颜色标准,以
确保药物的外观质量。
除了上述的一般要求外,具体药物的异物检查标准还可以根据药物的特性和用途进行进一步的规定。
需要注意的是,药物质量和安全性的评价不仅仅依赖于药典的检查标准,还受到其他因素的影响,如药物的生产工艺、包装和贮存等。
因此,对于药物的质量和安全性,仍然需要全面的评估和监管。
如果你对特定药物的异物检查标准有具体的疑问,建议咨询专业人士或相关药物监管部门。
生产操作可见异物检查法标准操作规程

生产操作可见异物检查法标准操作规程目的:建立生产操作可见异物检查法标准操作规程,规范生产操作中可见异物检查的操作。
范围:适用于生产操作中可见异物的检查工作。
责任:QA检查员、岗位操作者对本规程的实施负责。
内容:1. 过滤后纯化水、注射用水可见异物检查方法:1.1 将纯化水或注射用水管路阀门打开排放10~20秒,用可见异物检查合格的具塞三角瓶取水样约瓶容积的一半,盖上瓶塞,置澄明度测试仪遮光板边缘处,在明视距离(指瓶至人眼的清晰观测距离,通常为25cm),分别在黑色和白色背景下,手持瓶颈部轻轻旋转和翻转容器使水中可能存在的可见异物悬浮(但避免产生气泡),轻轻翻转后即用目检视。
1.2 合格标准:应无可见异物。
2. 直接接触药液(药粉)及出胶塞的器具、部件的最后冲洗水,粉针剂用胶塞最后精洗水、大容量注射剂用胶塞最后清洗水,可见异物检查方法:2.1 用可见异物检查合格的具塞三角瓶,取最后冲洗水约瓶容积的一半,盖上瓶塞,置澄明度测试仪遮光板边缘处,在明视距离(指瓶至人眼的清晰观测距离,通常为25cm),分别在黑色和白色背景下,手持瓶颈部轻轻旋转和翻转容器使水中可能存在的可见异物悬浮(但避免产生气泡),轻轻翻转后即用目检视。
2.2 合格标准:应无可见异物。
3. 精洗后的输液瓶可见异物检查方法:3.1 抽取精洗后输液瓶,迅速盖上经过可见异物检查合格的胶塞,每瓶加入可见异物检查合格的注射用水约瓶容积的一半,置澄明度测试仪遮光板边缘处,在明视距离(指瓶至人眼的清晰观测距离,通常为25cm),分别在黑色和白色背景下,手持瓶颈部轻轻旋转和翻转容器使水中可能存在的可见异物悬浮(但避免产生气泡),轻轻翻转后即用目检视。
3.2 合格标准:应无可见异物。
4. 粉针剂用管制瓶精洗后、灭菌后可见异物检查方法:4.1 抽取精洗后管制瓶,迅速盖上经过可见异物检查合格的胶塞,用注射器抽取适量的纯化水或注射用水,经0.22µm的滤器过滤注入瓶中,每瓶加水至瓶容积3/5左右,置澄明度测试仪遮光板边缘处,在明视距离(指瓶至人眼的清晰观测距离,通常为25cm),分别在黑色和白色背景下,手持瓶颈部轻轻旋转和翻转容器使水中可能存在的可见异物悬浮(但避免产生气泡),轻轻翻转后即用目检视。
可见异物检查标准操作规程

1、目的:制定可见异物检查操作规程。
2、依据文件:《中华人民共和国药典》(三部)3、适用范围:质保部、制造部4、检查装置:4.1光源:采用日光灯。
检查无色供试品溶液时的光照度应为1000-1500lx,检查塑料容器或有色供试品溶液时光照度应为2000-3000lx4.2式样:采用伞棚式装置,单面用。
4.3背景:为不反光黑色,在背部右侧和底部为不反光白色(供检查有色异物用)。
4.4距离:供试品离人眼距离为20-25厘米。
4.5检查:应在避光室内或在暗处进行。
5、检查人员要求:5.1视力:远距离和近距离视力测验,均为0.9或以上(不包括矫正后视力)。
5.2色盲测验:应无色盲。
6、操作:6.1取供试品20支(瓶),除去标签并擦净瓶外壁污痕(或保持外壁清洁),温室静置一定时间;6.2手持供试品颈部于伞棚边缘处,轻轻旋转和翻转容器,使药液中可能存在的可见异物悬浮(注意不使药液产生气泡),在明视距离,分别在黑色和白色背景下,用目检视,检查时限为20秒。
6.3供试品装量在10ml及10ml以下的每次检查拿取2支(瓶),10ml以上的每次检查拿取1支(瓶)。
50ml或50ml以上的按直、横、倒三步法放置检视。
7、结果判定:除另有规定外,检查的20支(瓶)供试品中,均不得检出玻璃屑、纤维、色点、色块等外来异物,检出不符合下表规定的其他可见异物不得超过1支(瓶)。
如果检出2支(瓶),应另取20支(瓶)同法复试。
初、复试检出不符合下表规定的其他可见异物的供试品不得超过3支(瓶)。
8、关于异物的说明:8.1白点系指不能辨清平面或棱角的白色物体按白点计。
8.2细小蛋白絮状物或蛋白颗粒系指半透明的小于约1mm的絮状沉淀或蛋白颗粒。
8.3少量絮状物或蛋白颗粒系指在规定检查时间内,较难计数的蛋白絮状物或蛋白颗粒。
8.4微量沉积物系指静置后供试品中的微小沉积物,轻轻转动后有烟雾状沉淀浮起,轻摇即散失者。
8.5摇不散的沉淀系指久置后蛋白溶液出现的少量沉积物,轻轻摇动后不能分散消失者。
可见异物检查法标准操作规程 Word 文档

可见异物检查法标准操作规程可见异物系指存在于注射剂、眼用液体制剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。
《中国药典》2010年版二部附录IX H中采用了灯检法和光散射法两种检查方法。
第一法灯检法1 简述本法为注射剂和眼用液体制剂中可见异物检查的常用方法。
本法还用于光散射法检出可见异物的供试品的复核确认。
本实验所用供试品必须按规定随机抽样。
灯检法应在暗室中进行。
2 环境、装置与人员2.1 环境实验室检测时应避免引入可见异物。
当制备注射用无菌粉末和无菌原料药供试品溶液时,或供试品溶液的容器不适于检测(如不透明、不规则形状容器等),需转移至适宜容器中,均应在100级的解决环境(如层流净化台)中进行。
灯检操作应在暗室中进行。
2.2检查装置光源采用带遮光板的日光灯,光照度在1000~4000lx 范围内可以调节。
用五色透明容器包装的无色供试品溶液,观察所在处的光照度应为1000~1500lx ;用透明塑料容器包装或用棕色透明容器包装的供试品溶液或有色供试品溶液,观察所在处的光照度应为2000~3000lx;乳状液或混悬液观察所在处的光照度应约为4000lx。
2.2.2 背景不反光的黑色面作为检查无色或白色异物的背景;不反光的白色面作为检查有色异物的背景。
2.3 检查人员条件远距离和近距离视力测验,均应为4.9或4.9以上(矫正后视力应为5.0或5.0以上);应无色盲。
3 检视距离检查人员调节位置,使供试品位于眼部的明视距离处(指供试品至人眼的清晰观测距离,通常为25cm)。
4 操作方法4.1 液体供试品的检查方法除另有规定外,除去容器标签,擦净容器外壁。
手持容器颈部(装量在10ml或10ml以下的供试品每次可手持2支)轻轻旋转和翻转容器,使药液中存在的可见异物悬浮(注意不使药液产生气泡),并分别在黑色和白色背景下,目视检查,重复3次,总时限为20s。
液体制剂中如有结晶析出,可参照药品使用说明书中溶解结晶方式先进行处理,再进行可见异物检查。
2020版《中国药典》可见异物检验操作规程
一、目的:可见异物检验操作规程编写/修订人/日期年月日部门/姓名审核人/日期年月日部门/姓名批准人/日期年月日部门/姓名执行日期2020年11月01日颁发部门品质部分发部门品质部二、范围:本标准适用于样品可见异物的测定。
三、职责:1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录;2、化验室负责人:监督检查检验员执行本操作规程。
四、内容:1、概述:1.1可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。
1.2注射剂、眼用液体制剂应在符合药品生产质量管理规范(GMP)的条件下生产,产品在出厂前应采用适宜的方法逐一检査并同时剔除不合格产品。
临用前,需在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。
1.3可见异物检査法有灯检法和光散射法。
一般常用灯检法,也可采用光散射法。
灯检法不适用的品种,如用深色透明容器包装或液体色泽较深(一般深于各标准比色液7号)的品种可选用光散射法;混悬型、乳状液型注射液和滴眼液不能使用光散射法。
1.4实验室检测时应避免引入可见异物。
当制备注射用无菌粉末和无菌原料药供试品溶液时,或供试品的容器不适于检査(如透明度不够、不规则形状容器等),需转移至适宜容器中时,均应在B 级的洁净环境(如层流净化台)中进行。
1.5用于本试验的供试品,必须按规定随机抽样。
2、第一法(灯检法)2.1灯检法应在暗室中进行。
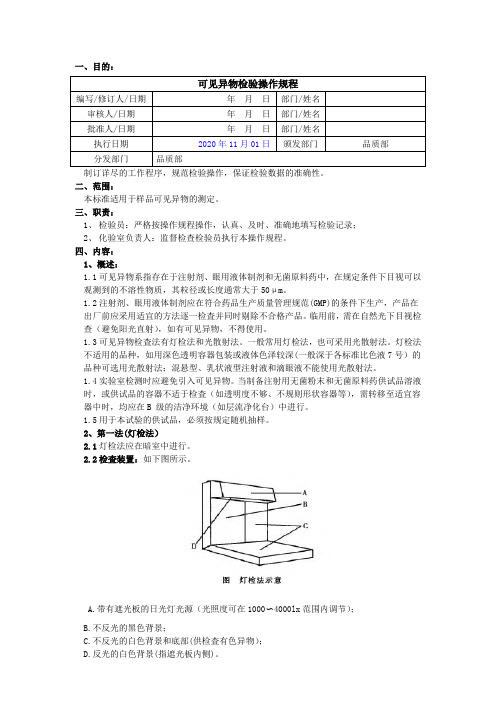
2.2检査装置:如下图所示。
A.带有遮光板的日光灯光源(光照度可在1000〜4000lx范围内调节);B.不反光的黑色背景;C.不反光的白色背景和底部(供检査有色异物);D.反光的白色背景(指遮光板内侧)。
2.3检查人员条件:远距离和近距离视力测验,均应为4. 9及以上(矫正后视力应为5 .0及以上);应无色盲。
2.4检査法:2.4.1按以下各类供试品的要求,取规定量供试品,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的适宜容器内,将供试品置遮光板边缘处,在明视距离(指供试品至人眼的清晰观测距离,通常为25cm),手持容器颈部,轻轻旋转和翻转容器(但应避免产生气泡),使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检査,重复观察,总检査时限为20秒。
可见异物检查法标准操作规程

品种
规格
批号
生产单位
检验日期
报告日期
检验依据
《中国药典》2010年版
【检查】:
取供试品20支,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的专用玻璃容器内。每次夹取2支供试品,置供试品于遮光板边缘处,在明视距离(指供试品至人眼的距离,通常为25cm),于1000-1500lx的光照度下,分别在黑色和白色背景下,手持供试品颈部轻轻旋转和翻转容器使药液中存在的可见异物悬浮(注意不使药液产生气泡),用目检视,重复3次,总时限为20秒。剩余瓶数按上述方法连续操作检视完毕。透明塑料容器或有色供试品溶液,检查光照度为2000-3000lx。
【结果】:
名称
数量(支)
执行标准
结果计算
法定标准
内控标准
点状物
5%
5%
×100%
= ×100%
=
块(<2mm)
短纤毛(<2mm)
金属屑
0
玻璃屑
纤毛(≥2mm)
块状物(≥2m:符合规定
检验人:复核人:
3.1.检验操作人员负责按可见异物检查法标准标准操作规程进行操作。
3.2.质保部负责可见异物检查法操作规程的文件审核及监督实施。
4、内容
4.1检验依据:《中国药典》2010年版二部附录ⅨΗ。
4.2简述
可见异物系指存在于注射剂、眼用液体制剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm,可见异物检查法包括灯检法和光散射法,本药厂注射剂可见异物检查方法现执行灯检法,灯检法应在暗室中进行。
4.4结果判断
4.4.1小容量静脉注射剂可见异物结果判定:
509可见异物检查SOP BCAA

可见异物检查标准操作规程编 号 JSB ZL509 (A) 生效日期编 制 人日 期 审 核 人 批 准 人日 期日 期 分发部门 质量部、工程研发中心复审日期1/21 目的建立固体粉末产品中可见异物检查标准操作规程。
2 范围油脂微囊粉、SDG 粉末等固体产品 3 职责QC 检验员、中控主任、QC 经理。
4 方法提要在规定条件下用肉眼观察到的样品杂色斑点数量。
以样品每平方厘米的斑点数量表示。
5 检验依据《中国药典》2010年版 6 仪器透明板:刻有10个(1㎝×1㎝)的无色透明板。
平板:能均匀分布待测样品。
7 检测 7.1 测定方法7.1.1 称取混合均匀的样品10克,均匀分布在平板上。
7.1.2 将透明板盖在已均匀分布的待测样品上,并轻轻压平。
在较好的光线下,眼与透明板的距离保持30㎝,用肉眼观察样品的斑点,并进行计数。
计数10个空格内的斑点总数。
7.1.3 对同一样品进行两次测定。
(分析人员视力应在1.0以上) 7.2 结果观察10个空格内样品的斑点总数。
7.3 允许差分析人员连续两次测定,其结果之差的绝对值应不超过1.0。
可见异物检查标准操作规程编 号 JSB ZL509 (A)生效日期分发部门 质量部、工程研发中心2/28附 件编 号01《可见异物检查记录》JL- JSB ZL509-01(A )9 文件修订履历 No. 修订日期 修订原因主要修订内容附件01编 制 人 审核人 批 准 人日 期日 期日 期可见异物检查记录JL-JSB ZL509-01(A )产品名称 速溶支链氨基酸微囊粉2∶1∶1产品批号编 码F60102检验日期年 月 日检验依据 JSB ZL509 检验方法:平板计数法:取样品10g ,均匀分布在平板上,将透明板盖在样品上,观察10个空格内的斑点总数。
透明板为刻有10个(1cm ×1cm )的无色透明板仪器设备名称编号 精度 有效期 天平 417319 0.1mg 2012年1月4日————————检验原始数据样品号12透明板内样品斑点总数C,个平均值,个指标值: ≦10个结论:检验人/日期 年 月 日 复核人/日期 年 月 日。
可见异物的检查操作规程
制药GMP管理文件
一、引用标准:中华人民共和国药典(2005年版)一部。
二、目的:本标准规定了可见异物检查法标准操作规程。
三、适用范围:适用于可见异物的检查。
四、责任者:质检人员。
五、正文:
检查装置澄明度检查仪
检查人员条件远距离和近距离视力测验,均应为4.9或4.9以上;应无色盲。
检查法除另有规定外,取供试品20支,除去容器标签,擦净容器外壁,轻轻旋转和翻转容器使药液中存在的可见异物悬浮,必要时将药液转移至洁净透明的专用玻璃容器内,置供试品于遮光板边缘处,在明视距离,分别在黑色和白色背景下,手持供试品颈部使药液轻轻翻转,用目检视。
无色注射液或滴眼液的检查,光照度应为1000~1500lx,透明塑料容器或有色溶液注射液或滴眼剂的检查,光照度应为2000~3000lx,混悬型注射液和混悬型滴眼液,光照度为4000lx,
仅检查色块、纤毛等可见异物。
结果判定溶液型静脉用注射液、注射用浓溶液和滴眼剂 20支供试品中,均不得检出可见异物。
如检出可见异物的供试品不超过1支,应令取20支同法检查,均不得检出。
混悬型注射液和混悬型滴眼剂 20支供试品中,均不得检出色块、纤毛等可见异物。
溶液型非静脉用注射液、注射用无菌粉末和供注射用无菌原料药按国务院药品监督管理部门的有关规定执行。
监控检查细则(sop)

质量监控标准细则一、可见异物检查法操作方法:除另有规定外,除去容器标签,擦净容器外壁。
手持容器颈部(装量在10ml或10ml以下的供试品每次可手持2支)轻轻旋转和翻转容器,使药液中存在的可见异物悬浮(注意不使药液产生气泡),并分别在黑色和白色背景下,目视检查,重复3次,总时限为20s。
判断标准:1.溶液型静脉用注射液:盐酸左氧氟沙星注射液照度:2000-3000Lx、二乙酰氨乙酸乙二胺注射液1000-1500Lx,逐盘抽检轻轻旋转时,不得检出烟雾状微粒柱且不得有玻璃屑、金属屑、长度或最大粒径超过2mm的纤维和块状物等明显外来的可见异物,如检出微细可见异物(如点状物、2mm以下的短纤维和块状物等)≤1%。
2.溶液型非静脉用注射液:人胎盘组织液照度:2000-3000Lx逐盘抽检,不得有玻璃屑、金属屑、纤维、色点、色块等明显外来的可见异物,如检出细微可见异物(如白点、细小蛋白质絮状物或蛋白质颗粒;少量絮状物或蛋白质颗粒、微量沉积物、摇不散的沉淀)≤2.5%。
3.溶液型滴眼液:照度:2000-3000Lx逐盘抽检轻轻旋转时,不得检出烟雾状微粒柱且不得有玻璃屑、金属屑、长度或最大粒径超过2mm的纤维和块状物等明显外来的可见异物,如检出微细可见异物(如点状物、2mm以下的短纤维和块状物等)≤3.0%。
二、装量检查装量:按照各品种灌封标准操作规程中要求的装量,进行随机抽样检查,每批抽检两次,滴眼剂和口服溶液剂按照最低装量检查法标准操作规程检查。
小容量注射剂灌装开始半小时左右、全批灌装一半左右时取样检查。
(详见中间产品质量监控标准操作规程KY-ZL-SOP-ZK-01400)滴眼剂:取供试品5支,开启时注意避免损失,将内容物转移至预经标化的干燥量入式量筒中(量具的大小应使待测体积至少占其额定体积的40%)将容器倒置尽量倾净读出每个容器内容物的装量。
注射剂:取供试品20支,开启时注意避免损失,将内容物用预经标化的干燥量入式注射器抽尽。
中国药典2015版4部 可见异物检查法

0904 可见异物检查法可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。
注射剂、眼用液体制剂应在符合药品生产质量管理规范(GMP)的条件下生产,产品在出厂前应采用适宜的方法逐一检查并同时剔除不合格产品。
临用前,需在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。
可见异物检查法有灯检法和光散射法。
一般常用灯检法,也可采用光散射法。
灯检法不适用的品种,如用深色透明容器包装或液体色泽较深(一般深于各标准比色液7号)的品种可选用光散射法;混悬型、乳状液型注射液和滴眼液不能使用光散射法。
实验室检测时应避免引人可见异物。
当制备注射用无菌粉末和无菌原料药供试品溶液时,或供试品的容器不适于检查(如透明度不够、不规则形状容器等),需转移至适宜容器中时,均应在B级的洁净环境(如层流净化台)中进行。
用于本试验的供试品,必须按规定随机抽样.第一法(灯检法)灯检法应在暗室中进行。
检查装置如下图所示。
ABCD图灯检法示意A。
带有遮光板的日光灯光源(光照度可在1000~4000lx范围内调节);B.不反光的黑色背景;C。
不反光的白色背景和底部(供检査有色异物);D.反光的白色背景(指遮光板内侧).检查人员条件远距离和近距离视力测验,均应为4.9及以上(矫正后视力应为5。
0 及以上);应无色盲.检査法按以下各类供试品的要求,取规定量供试品,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的适宜容器内,将供试品置遮光板边缘处,在明视距离(指供试品至人眼的清晰观测距离,通常为25cm),手持容器颈部,轻轻旋转和翻转容器(但应避免产生气泡),使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检查,重复观察,总检查时限为20秒。
供试品装量每支(瓶)在10ml及10ml以下的,每次检查可手持2支(瓶)。
50ml或50ml以上大容量注射液按直、横、倒三步法旋转检视。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可见异物检查SOP
分发单位
质量部[] 生产技术部[] 物料部[] 工程部[ ] 人力资源部[] 财务部[] 销售部[] 总经办[] 市场部[ ] 原料药车间[] QC 室[] QA 室[] 提取车间[] 固体制剂车间[ ] 注射剂车间[] 1 主题内容
本标准规定了注射剂、滴眼剂的可见异物检查的基本要求
2适用范围
适用于注射剂、滴眼剂的可见异物检查。
3责任人
QC检验员:负责按此规程对注射剂、滴眼剂的可见异物检查。
QC室主管:监督此文件的执行。
4制定依据
《中国药典》2005年版二部附录区H
5内容
5.1可见异物是指存在于注射剂滴眼剂中,在规定条件下目视可以观测到的不溶性物质,其粒径或
长度通常大于50um。
5.2注射剂、滴眼剂应在符合药品生产质量管理规范(GMP)的条件下生产,产品在出厂前应采用适
宜的方法逐一检查并同时剔除不合格产品。
5.3可见异物检查法有灯检法和光散射法。
一般常用灯检法,也可采用光散射法。
灯检法不适用的
品种(如用有色透明容器包装或液体色泽较深的品种)应选用光散射法。
5.4实验室检测时应避免引入可见异物。
当供试品溶液的容器(如不透明、不规则形状容器
等)不适于检测,需转移至专用玻璃容器中时,均应在100级的洁净环境(如层流净化
台)中进行。
5.5检查方法
5.5.1灯检法灯检法应在暗室中进行。
5.5.1.1检查装置采用伞棚式装置、两面或单面
5.5.1.2检查人员条件
远距离和近距离视力测验,均应为4.9或4.9以上(矫正后视力应为5.0或5.0以上);应无色盲。
5.5.1.3检查法
――除另有规定外,取供试品20支(瓶),除支容器标签,擦净容器外壁,轻轻旋转和翻转容器使药液中存在的可见异物悬浮(注意不使药液产生气泡),必要时将药液转移洁净透明的专用玻璃容器内;置供试品于遮光板边缘处,在明视距离(批供试品至人眼的距离,通常为25cm),分别在黑色和白色背景下,手持供试品颈部使药液轻轻翻转,用
目检视。
――无色注射液或滴眼剂的检查,光照度应为1000-1500IX;透明塑料容器或有色溶液注射液或滴
眼剂的检查,光照度应为2000-3000IX;混悬型注射液和混悬型滴眼剂,光照度为4000IX,仅检查色块、纤毛等可见异物。
5.5.1.4结果判定
――溶液型静脉用注射液、注射用浓溶液、混悬型注射液、溶液型滴眼剂、混悬型滴眼剂均不得检出金属屑、玻璃屑、长度或最大粒径超过2mm的纤毛和块状物等明显外来的可见
异物,并在旋转时不得检出烟雾状微粒柱。
混悬型注射液和混悬型滴眼液亦不得检出色块等可见异物。
其他可见异物(如2mm以下的短纤毛和块等)如有检出,除另有规定外, 应分别符合下列规定:
——溶液型静脉注射液、注射用浓溶液20支(瓶)供试品中,均不得检出可见异物。
如检出可见异物的供试品不超过1支(瓶),应另取20支(瓶)同法检查,均不得检出。
――溶液型滴眼剂20支(瓶)供试品中,均不得检出可见异物。
如检出其他可见异物,应另取20支(瓶)同法复试,初、复试的供试品中,检出其他可见异物的供试品不得超过3支(瓶)。
5.5.2光散射法
5.5.2.1当一束单色光激光照射溶液时,溶液中存在的不溶物质使入射光发生散射,散射的能量与
不溶物质的大小有关。
本方法通过对溶液中不溶性物质引起的光散射能量的测量,并与规定的阈值比较,以检查可见异物。
5.522不溶性物质的光散射能量可通过被采集的图像进行分析。
设不溶性物质的光散射能量为E,通
过光电信号转换,即可用摄像机采集到一个锥体高度为H、直径为D的相应立
体图像。
散射能量E为D和H的一个单调函数,即E=?(D,H )。
同时,假设不溶性物质的光散射强度为q,摄像曝光时间为t,则又有E=g(q,T)。
由此可以得出图像中的D与q、T之间的关系为D=w(q,T),也为一个单调函数关系。
在测定图像中的D 值后,即可根据函数曲线计算出不溶性物质的光散射能量。
5.5.2.3仪器装置和检测原理
――仪器由旋瓶装置、激光光源、图像采集器、数据处理系统和终端显示系统组成,并配有自动上瓶和下瓶装置。
――供试品通过上瓶装置被送至旋瓶装置,旋瓶装置应能使供试品沿垂直中轴线高速旋转一定时间后迅速停止,同时激光光源发出的均匀激光束照射在供试品上;池药液涡流基本
消失,瓶内贡液因惯性继续旋转,图像采集器在特定角度对旋转药液中悬浮的不溶性物质引起的散射光能量进行连续摄像,采集图像不少于75幅;数据处理系统对采集的序列
图像进行处理,然后根据预先设定的阈值自动判定超过一定大小的不溶性物质的有无,或在终端显示器上显示图像供人工判定,同时记录检测结果,指令一瓶装置自动分检合格与不合格供试品。
5.524仪器校准
――仪器应具备自动校准功能,在检测供试品前可采用标准粒子进行校准。
――除另有规定外,分别用粒径为40um和60um的标准粒子对仪器进行标定。
根据标定结果得到曲线方程并计算出与粒径50um相对应的检测像素。
当把检测像素参数设定为与粒径50um相对应的数值时,对60um的标准粒子溶液测定3次,应均能检出。
5.5.2.5检查法
――除另有规定外,从仪器提供的菜单中选择与供试品规格相应的测定参数,瓶根据供试品瓶体大小对参数进行适当调整后,将供试品检测3次。
凡仪器判定有1次不合格者,用灯检法确认。
用有色透明容器包装或液体色泽较深等灯检法检查困难的品种不用灯检法确认。
――一般情况下,取样视窗的左右边线和底线应与瓶体重合,上边线与液面的弯月面成切线;旋转时间的设置应能使液面漩涡到底,以能带动固体物质悬浮并消除气泡;静置时间的设置应尽可能短,但不能短于液面漩涡平复的时间,以避免气泡干扰,同时也保证摄像启动时固体物质仍在转动;嵌瓶松紧度参数与瓶底直径(mm)基本相同,可根据安瓿质量调整,如瓶体不平正,转动时瓶体摇动幅度较大,气泡易产生,则应将嵌瓶松紧度调大以减小摇动,但同时应延长旋转时间,使用漩涡仍能到底。
――注射液除另有规定外,取供试品20支(瓶),除支不透明标签,擦净污渍,置仪器上瓶装置上,启动仪器并记录检测结果,应不得检出可见异物。
如经确认检出可见异物的不超过1支(瓶),加取20支(瓶)同法复试,均不得检出。
――滴眼剂除另有规定外,取供试品20支(瓶),将药液转移至洁净透明的专用玻璃容器内,置仪器的上瓶装置上,启动仪器瓶记录检测结果,应不得检出可见异物。
如经确认检出可见异物的不超过1支(瓶),另取20支(瓶)同法复试,均不得检出。
