酸碱中和滴定曲线之对数曲线专练
溶液的酸碱滴定练习题滴定曲线滴定终点与酸碱反应

溶液的酸碱滴定练习题滴定曲线滴定终点与酸碱反应溶液的酸碱滴定是一种常见的实验方法,用于确定溶液中酸碱物质的浓度。
在滴定过程中,通过向待测溶液中滴加已知浓度的酸碱溶液,观察化学指标的变化,从而确定待测溶液的浓度。
本文将通过几个酸碱滴定练习题,讨论滴定曲线、滴定终点以及酸碱反应等相关主题。
1. 题目一:强酸与强碱的滴定首先,我们考虑一种常见的酸碱滴定情景:强酸与强碱的滴定。
假设我们需要测定一溶液中NaOH的浓度,我们可以使用HCl作为滴定液。
在滴定过程中,逐渐向待测溶液中滴加HCl,观察滴定过程中pH值的变化。
首先,待测溶液中的pH值会随着HCl滴加量的增加逐渐下降。
当HCl滴加量较小的时候,待测溶液中的OH-离子会被中和,但pH值仍然较高。
当HCl和NaOH的物质摩尔比接近1:1时,待测溶液中的pH值会急剧下降,这个时候称为滴定终点。
滴定终点的出现是由于酸碱中和反应达到了摩尔比接近1:1的情况,滴定溶液的酸碱指示剂的颜色也会发生明显变化,用来指示滴定终点的指示剂可以是酚酞。
2. 题目二:弱酸与强碱的滴定接下来,让我们考虑不同酸碱性质的滴定情况。
例如,我们需要测定一溶液中乙酸(CH3COOH)的浓度,我们可以选择NaOH作为滴定液。
这里的滴定过程与题目一有所不同。
由于乙酸是一个弱酸,所以在滴定过程中pH值的变化就显得非常重要。
当NaOH滴加量较小的时候,乙酸在水溶液中仅部分中和产生CH3COO-离子,pH值会上升但仍然较低。
当NaOH滴加量逐渐增加时,CH3COOH的中和反应逐渐水解产生H2O和CH3COO-,pH值也会逐渐上升。
在滴定终点,CH3COOH的中和反应完全进行,pH值急剧上升,这个时候也是指示剂变色的点。
用于指示滴定终点的指示剂可以是溴酚蓝。
3. 题目三:多个酸碱滴定曲线的比较最后,让我们比较不同酸碱滴定曲线的特点。
我们以弱酸与强碱滴定曲线和弱碱与强酸滴定曲线为例。
在弱酸与强碱滴定曲线中,pH值的变化相对平缓,滴定终点的pH值较大,这是因为弱酸在水溶液中的电离程度较低,所以需要较大的NaOH滴加量才能使其完全中和。
专题02 酸碱中和滴定曲线类型对点练习-2018高考化学解题方法技巧 含解析 精品

酸碱中和滴定曲线练习1.(2018届河北省邢台市高三上学期期末考试)化学上常用AG 表示溶液中的酸碱度,AG=lg()()c Hc OH+-。
25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1HNO2溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是()A. D点溶液中的pH=11.25B. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)C. C点时,加入NaOH溶液的体积为20.00 mLD. 25℃时,HNO2的电离平衡常数K a=1.0×10-5.5【答案】A【解析】A、D点溶液中的AG= -8.5,即()()c Hc OH+-=10-8.5,又K w= c(H+)×c(OH-)=10-14,求得c(H+)=10-11.25碱性,所以C点时加入NaOH溶液的体积为略小于20.00 mL,则C错误;D、由图象可知0.100mol·L-1HNO2溶液的AG=8.5,即()()c Hc OH+-=108.5,又K w= c(H+)×c(OH-)=10-14,c(H+)=10-2.75mol·L-1,所以K a=()()()22c Hc HNOc NO+-⨯=()2c(H)0.100mol/L c H++-≈1.0×10-4.5,故D错误。
本题正确答案为A。
2.(2018届江苏省泰州市高三第一次调研)常温下,向20mL 浓度均为0.1mol/L (NH4)2SO4、NH4HSO4混和溶液中滴加0.1mol/L的Ba(OH)2溶液。
充分反应后静置,溶液的pH 与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是A. a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/LB. b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-)C. c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-)D. d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)【答案】Bc(NH3·H2O)> c(OH-),选项B正确;C、c点溶液中pH=7,c(H+)= c(OH-),根据电荷守恒有2c(Ba2+)+ c(NH4+)+ c(H+)= c(OH-)+2c(SO42-),则: 2c(Ba2+)+ c(NH4+)= 2c(SO42-),选项C错误;D、根据所加溶液体积可知,若不考虑生成的氨水的电离和铵根离子的水解,得到的溶液中生成的一水合氨和铵根离子1:1,但溶液呈碱性,故电离大于水解,故c(NH4+)> c(NH3·H2O),选项D错误。
《分析化学》 酸碱滴定曲线练习题

酸碱滴定曲线练习题一、填空1.在酸碱滴定中,指示剂的选择是以为依据的。
2.强碱滴定弱酸,滴定曲线的突跃范围在碱性范围内,因此甲基橙、甲基红等都作为滴定的指示剂。
3.滴定范围的大小与滴定剂和被滴定物的浓度有关,浓度越,突跃范围越长,可供选择的指示剂越。
4.在酸碱滴定分析过程中,为了直观形象地描述滴定溶液中H+浓度的变化规律,通常以为纵坐标,以加入滴定剂的为横坐标,绘成曲线。
此曲线称为。
5.酸碱滴定曲线是以变化为特征的。
滴定时酸碱的浓度越大,滴定的突跃范围。
6.酸碱滴定法是用去滴定各种具有酸碱性的物质,当达到化学计量点时,通过滴定剂的体积和,按反应的关系,计算出被测物的含量。
7.在酸碱滴定中,选择指示剂是根据和来确定的。
8.二元弱酸被准确滴定的判断依据是,能够分步滴定的判据是。
二、判断题(正确的请在括号内打√,错误的打×)1.能用HCl标准溶液准确滴定0.1 mol·L-1NaCN。
已知HCN的K=4.9×10-10。
()2.强酸滴定强碱的滴定曲线,其突跃范围大小只与浓度有关。
()3.酸碱滴定中,化学计量点时溶液的pH值与指示剂的理论变色点的pH值相等。
()4.酸式滴定管一般用于盛放酸性溶液和氧化性溶液,但不能盛放碱性溶液。
()5.酸碱指示剂的选择原则是变色敏锐、用量少。
()6.各种类型的酸碱滴定,其化学计量点的位置均在突跃范围的中点。
()三、选择题(下列各题只有一个正确答案,请将正确答案填在括号内 )1.由于弱酸弱碱的相互滴定不会出现突跃,也就不能用指示剂确定终点,因此在酸碱滴定法中,配制标准溶液必须用()。
A.强碱或强酸B.弱碱或弱酸C.强碱弱酸盐D.强酸弱碱盐2.用NaOH测定食醋的总酸量,最合适的指示剂是()。
A.中性红B.甲基红C.酚酞D.甲基橙3.在酸碱滴定中,一般把滴定至等量点()的溶液pH值变化范围称为滴定突跃范围。
A. 前后±0.1%相对误差B. 前后±0.2%相对误差C. 0.0%D. 前后±1%相对误差4.用强碱滴定一元弱酸时,应符合cK a≥10-8的条件,这是因为()。
(人教版)2020年高考化学一轮复习 酸碱中和滴定曲线大全 专题01 强碱滴定二元弱酸曲线练习

专题01 强碱滴定二元弱酸曲线1.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。
有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。
根据图示判断,下列说法正确的是( )A. H 2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H +)>c(OH-)【答案】C2.已知:pK a= -lgK a,25℃时,H2SO3的pK a1=1.85,pK a2=7.19。
常温下,用0.1mol/LNaOH 溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。
下列说法不正确的是A. A点所得溶液中:V o等于lOmLB. B点所得溶液中:C. C点所得溶液中:D. D点所得溶液中水解平衡常数【答案】A【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;C.根据亚硫酸的电离平衡常数结合电荷守恒分析;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为K a1=c(H+)c(HSO3−)/c(H2SO3)=10-1.85mol/L,所以c(H+)=K a1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),B正确;C.H2SO3的二级电离平衡常数为K a2=c(H+)c(SO32-)/c(HSO3−)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=K a2,表明溶液中c(SO32-)=c(HSO3−),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3−)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3−),C正确;D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则K h1=K w/K a2=10−14/10−7.19=10-6.81,D正确。
酸碱中和反应计算酸碱浓度与中和曲线练习题

酸碱中和反应计算酸碱浓度与中和曲线练习题酸碱中和反应是化学中常见的反应类型,涉及到酸和碱的相互中和过程。
在这篇文章中,我们将通过一系列的练习题来帮助你巩固酸碱中和反应的计算以及酸碱浓度与中和曲线的相关知识。
1. 假设你有100 mL的1 mol/L HCl 溶液,你需要知道它的酸度(pH)是多少?解答:由于HCl 是强酸,它完全电离为H+和Cl-离子。
所以,1mol/L 的 HCl 溶液中,H+ 的浓度就是1 mol/L。
根据pH 的定义,pH = -log[H+], 所以,pH = -log(1) = 0。
2. 对于上题中的溶液,它的酸性是否强于pH为2的溶液?为什么?解答:是的,上题中的溶液的酸性更强。
因为pH 值越低,溶液的酸性越强。
pH = 0 的溶液比 pH = 2 的溶液酸性更强。
3. 如果将上题中的1 mol/L HCl 溶液和1 mol/L NaOH 溶液按化学计量比例混合,会发生什么?解答:HCl 和 NaOH 都是强酸和强碱,它们的中和反应是非常剧烈和快速的。
它们按化学计量比例混合会完全中和,生成盐和水:HCl + NaOH → NaCl + H2O。
4. 你有200 mL 的0.2 mol/L H2SO4 溶液,你需要知道它的酸度(pH)是多少?解答:H2SO4 是二元强酸,它完全电离为两个H+和一个SO4-2离子。
所以,0.2 mol/L 的 H2SO4 溶液中,H+ 的浓度是0.4 mol/L。
根据pH 的定义,pH = -log[H+], 所以,pH = -log(0.4) ≈ 0.4。
5. 你有200 mL 的0.1 mol/L NaOH 溶液,你需要计算它的碱度是多少?解答:NaOH 是一元强碱,它完全电离为Na+和OH-离子。
所以,0.1 mol/L 的 NaOH 溶液中,OH- 的浓度是0.1 mol/L。
碱度可以通过pOH 来表示:pOH = -log[OH-], 所以,pOH = -log(0.1) = 1。
高考化学总复习《酸碱中和滴定及曲线》专项复习
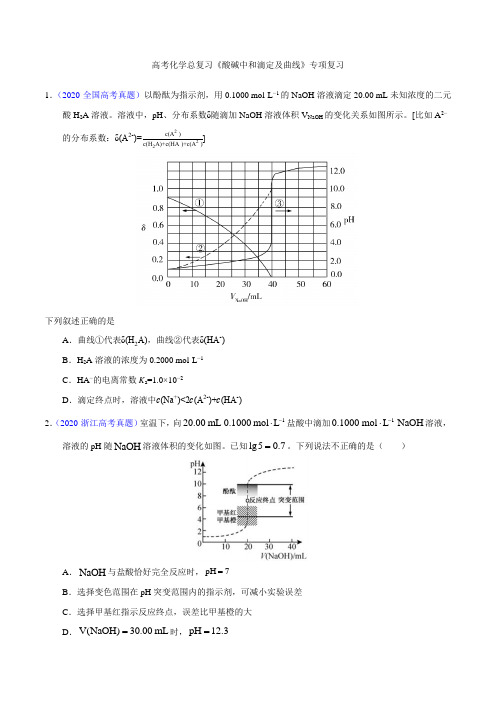
高考化学总复习《酸碱中和滴定及曲线》专项复习1.(2020·全国高考真题)以酚酞为指示剂,用0.1000 mol·L −1的NaOH 溶液滴定20.00 mL 未知浓度的二元酸H 2A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积V NaOH 的变化关系如图所示。
[比如A 2−的分布系数:δ(A 2-)=c(A 2-)c(H 2A)+c(HA -)+c(A 2-)]下列叙述正确的是A .曲线①代表δ(H 2A),曲线②代表δ(HA -)B .H 2A 溶液的浓度为0.2000 mol·L −1C .HA −的电离常数K a =1.0×10−2D .滴定终点时,溶液中c (Na +)<2c (A 2-)+c (HA -)2.(2020·浙江高考真题)室温下,向120.00mL 0.1000mol L -⋅盐酸中滴加10.1000mol L NaOH -⋅溶液,溶液的pH 随NaOH 溶液体积的变化如图。
已知lg50.7=。
下列说法不正确的是( )A .NaOH 与盐酸恰好完全反应时,pH 7=B .选择变色范围在pH 突变范围内的指示剂,可减小实验误差C .选择甲基红指示反应终点,误差比甲基橙的大D .V(NaOH)30.00mL =时,pH 12.3=3.(2020·山东高考真题)25℃时,某混合溶液中()()133CH COOH CH COO 0.1mol L c c --+=⋅,1gc( CH 3COOH)、1gc(CH 3COO -)、lgc(H +)和1gc(OH -)随pH 变化的关系如下图所示。
K a 为CH 3COOH 的电离常数,下列说法正确的是A .O 点时,()()33CH COOH CH COO c c -= B .N 点时,a pH=-lgKC .该体系中,()()()+-13+a 0.1c H c CH COOH =mol L K +c H ⋅ D .pH 由7到14的变化过程中, CH 3COO -的水解程度始终增大4.(2019·全国高考真题)NaOH 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H 2A 的K a1=1.1×10−3 ,K a2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b 点为反应终点。
酸碱滴定曲线分析练习题分析酸碱滴定曲线并确定等价点

酸碱滴定曲线分析练习题分析酸碱滴定曲线并确定等价点酸碱滴定曲线是化学实验中常用的一种实验方法,用于确定溶液中酸碱物质的浓度以及确定等价点。
本文将通过解答酸碱滴定曲线分析练习题的方式,来分析酸碱滴定曲线并确定等价点。
一、题目1已知0.1mol/L的硫酸溶液(酸性)滴入0.05mol/L的氢氧化钠溶液(碱性),请绘制滴定曲线,并确定等价点。
解析:1. 首先,我们需要根据已知的浓度和体积计算出反应物的物质量以及摩尔数。
假设我们滴定的硫酸溶液体积为V1,氢氧化钠溶液体积为V2。
硫酸的摩尔数(n1)= 浓度(C1)×体积(V1)= 0.1 × V1 (mol)氢氧化钠的摩尔数(n2) = 浓度(C2) ×体积(V2)= 0.05 × V2 (mol)2. 在滴定过程中,硫酸与氢氧化钠发生酸碱中和反应,反应方程如下:H2SO4 + 2NaOH → Na2SO4 + 2H2O根据反应方程,可以得知反应物的摩尔比为1:2。
因此,在反应结束后,硫酸与氢氧化钠的摩尔数满足以下关系:n1 = 2n23. 根据滴定过程和酸碱滴定曲线的特点,可以得出下面的结论:a. 当硫酸与氢氧化钠刚开始混合时,酸性溶液中的H+离子和碱性溶液中的OH-离子迅速中和,pH值逐渐升高。
b. 随着反应的进行,等价点附近,酸性溶液中的H+离子与碱性溶液中的OH-离子的摩尔比接近1:1,pH值逐渐增加到最大值。
c. 在等价点附近,溶液的酸性碱性程度相对较弱,pH值维持在较高的水平。
d. 等价点之后,碱性溶液中的OH-离子多于酸性溶液中的H+离子,pH值逐渐下降。
4. 根据以上分析和知识,我们可以得出酸碱滴定曲线的大致形状。
根据题目中的浓度和体积数据,可以绘制出对应的酸碱滴定曲线,并找到等价点。
5. 等价点的确定方法:a. 通过绘制的酸碱滴定曲线,我们可以根据pH值的变化情况找到变化最为剧烈的点,即为等价点。
酸碱中和滴定曲线分析与应用 练习 2021届高三化学一轮复习重点专题

2021届高三化学一轮复习——酸碱中和滴定曲线分析与应用素养说明:酸碱中和滴定曲线是近几年热点题型,通过分析建模,让考生形成解题程序,也体现大纲对考生对图形的识别与分析的能力要求。
知识梳理1.图示强酸与强碱滴定过程中pH曲线(以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例)2.强酸(碱)滴定弱碱(酸)pH曲线比较氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)特别提醒恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
强化训练1、(2020年北京3月份试测题)用一定浓度NaOH溶液滴定某醋酸溶液。
滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。
下列说法不正确...的是A.a点对应的溶液中:c(CH3COO-) = c(Na+)B.a→b过程中,n(CH3COO-)不断增大C.c→d溶液导电性增强的主要原因是c(OH-)和c(Na+)增大D.根据溶液pH和导电能力的变化可判断:V2<V3答案 C2.常温下,用0.100 mol·L-1的NaOH溶液分别滴定同浓度、体积均为20.00 mL的盐酸和醋酸溶液(用HA 表示酸),得到2条滴定曲线,如图所示。
下列说法正确的是()A.滴定醋酸的曲线是图1B.由图分析可得b>a=20C.D点对应的溶液中:c(Na+)=c(A-)D.根据E点可计算得K(HA)=[0.050+(10-6-10-8)]×10-810-6-10-8答案 C解析根据图知,图1中A点未加氢氧化钠溶液时溶液的pH=1,由于酸的浓度是0.100 mol·L-1,所以图1中为强酸,即滴定盐酸的曲线是图1,选项A错误;由选项A分析可知图1滴定盐酸且滴定终点溶液呈中性,图2滴定醋酸且滴定终点溶液呈碱性,故b=a=20,选项B错误;根据图示可知,D点显示中性;c(H+)=c(OH-),结合电荷守恒可知:c(Na+)=c(A-),选项C正确;E点pH=8,则c(H+)=10-8mol·L-1,c(OH -)=10-6mol·L-1,c(Na+)=0.050 mol·L-1,结合电荷守恒可知;c(A-)=c(Na+)+c(H+)-c(OH-)=0.050 mol·L-1+10-8 mol·L-1-10-6mol·L-1,c(HA)=0.050 mol·L-1-(0.050+10-8-10-6) mol·L-1=(10-6-10-8)mol·L-1,K(HA)=c(H+)·c(A-)c(HA)=10-8×(0.050+10-8-10-6)10-6-10-8,选项D错误。
高二化学关于酸碱中和滴定曲线的计算练习题

高二化学关于酸碱中和滴定曲线的计算练
习题
1. 某实验中,我们需要测定一种强酸的浓度,使用了一种已知
浓度的强碱进行滴定。
已知强酸溶液的摩尔浓度为0.05 mol/L,滴
定时,滴加了15 mL的强碱溶液后,指示剂的颜色发生了变化。
已
知强酸和强碱的质量反应比为1:1。
请计算该酸溶液的摩尔浓度。
2. 在另一次实验中,我们需要测定一种弱酸的浓度,同样使用
了一种已知浓度的强碱进行滴定。
已知弱酸溶液的摩尔浓度为0.1 mol/L,滴定时,滴加了30 mL的强碱溶液后,指示剂的颜色发生
了变化。
已知弱酸和强碱的质量反应比为1:2。
请计算该酸溶液的
摩尔浓度。
3. 又一次实验中,我们需要测定某个酸的浓度,使用了一种已
知浓度的强碱进行滴定。
已知该酸溶液的摩尔浓度为0.05 mol/L,
滴定时,滴加了20 mL的强碱溶液后,指示剂的颜色发生了变化。
已知该酸和强碱的质量反应比为2:1。
请计算该酸溶液的摩尔浓度。
4. 在最后一个实验中,我们需要测定一种弱酸的浓度,同样使用了一种已知浓度的强碱进行滴定。
已知弱酸溶液的摩尔浓度为0.2 mol/L,滴定时,滴加了40 mL的强碱溶液后,指示剂的颜色发生了变化。
已知弱酸和强碱的质量反应比为1:1。
请计算该酸溶液的摩尔浓度。
---
1. 强酸溶液的摩尔浓度为0.05 mol/L。
2. 弱酸溶液的摩尔浓度为0.05 mol/L。
3. 酸溶液的摩尔浓度为0.025 mol/L。
4. 酸溶液的摩尔浓度为0.1 mol/L。
《分析化学》酸碱滴定曲线及指示剂的选择练习题

《分析化学》酸碱滴定曲线及指示剂的选择练习题《分析化学》酸碱滴定曲线及指示剂的选择练习题一、填空1、滴定曲线2、滴定突跃3、指示剂的选择原则是_________________________________________________________________________________________________________________ __4、滴定范围的大小与滴定剂和被滴定物的浓度有关,浓度越,突跃范围越长,可供选择的指示剂越。
5、直接滴定弱酸的依据6、弱酸的浓度和Ka越大,突跃范围7.某溶液中加入酚酞和甲基橙各一滴,显黄色,说明此溶液的pH 值范围是。
8.硼酸是___元弱酸;因其酸性太弱,在定量分析中将其与____反应,可使硼酸的酸性大为增强,此时溶液可用强酸以酚酞为指示剂进行滴定。
9.多元酸能被准确滴定的条件是,分步滴定的条件是。
10.最理想的指示剂应是恰好在时变色的指示剂。
11.用强碱滴定一元弱酸时,使弱酸能被准确滴定的条件是。
12.在酸碱滴定中,指示剂的选择是以为依据的。
13.酸碱指示剂(HIn)的理论变色范围是pH= ,选择酸碱指示剂的原则是。
14.[OH—]= 0.10 mol/L的溶液中,pH= 。
15.六亚甲基四胺的pKb=8.85,用它配制缓冲溶液时的pH范围是。
16.酸碱指示剂的变色范围为,选择指示剂的原则为,指示剂的变色范围应落在滴定的之内。
二、选择1. 酸碱滴定突跃范围为7.0~9.0,最适宜的指示剂为()A.甲基红(4.4~6.4)B.酚酞(8.0~10.0)C.中性红(6.8~8.0)D.甲酚红(7.2~8.8)2.pH变色范围为8.0~9.8的指示剂是()A.甲基橙B.甲基红C.石蕊D.酚酞3.某酸碱指示剂的pK Hln=5,其理论变色范围是()pHA.2~8B.3~7C.4~6D.5~74.浓度为0.1 mol/L HAc(Ka=1.8×10-5)溶液的pH是()A、4.87B、3.87C、2.87D、1.875.pH =1.00的HCl溶液和pH =13.00的NaOH溶液等体积混合后pH是()A、14B、12C、7D、66.各类型的酸碱滴定,其化学计量点的位置均在()A.pH=7B.pH>7C.pH<7D.突越范围中点7.酸碱滴定中选择指示剂的原则是()A、指示剂变色范围与化学计量点完全符合B、指示剂应在pH 7.00时变色C、指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D、指示剂变色范围应全部落在滴定pH突跃范围之内8.浓度为0.10 mol/L NH4Cl (Kb=1.8×10-5)溶液的pH是()A、5.13B、4.13C、3.13D、2.139、将甲基橙指示剂加到一无色水溶液中,溶液呈黄色,该溶液的酸碱性为()A、中性B、碱性C、酸性D、不能确定其酸碱性10、当弱酸满足()时,方可准确滴定。
酸碱中和滴定训练题

酸碱中和滴定训练题一1.指示剂的选择应根据酸碱反应时终点附近的pH变化来定,如某学生用0.1 mol·L-1H2SO4溶液滴定0.1 mol·L-1NaOH溶液,中和后加水至100 mL。
若滴定终点的判定有误差:①少滴了一滴H2SO4溶液;②多滴了一滴H2SO4溶液(1滴为0.05 mL),则①和②两种情况下所得溶液的pH之差是;而这种在终点附近可以在酸碱反应的曲线图上清晰的反映出来,右图是该学生通过pH计测定硫酸与氢氧化钠反应后绘制的滴Array定曲线a和b,试认真分析后填空:(1) 曲线a是用溶液滴定溶液;曲线b是用溶液滴定溶液;(2) P点的坐标为( );2.某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 B.用标准溶液润洗滴定管2~3次 C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm E.调节液面至“0”或“0”以下某一刻度,记下读数 F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.就此实验完成填空:(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是____________________________________________。
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是_________________________________________________________。
(4)判断到达滴定终点的实验现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是________原因是____________________________________。
酸碱中和滴定曲线图像习题
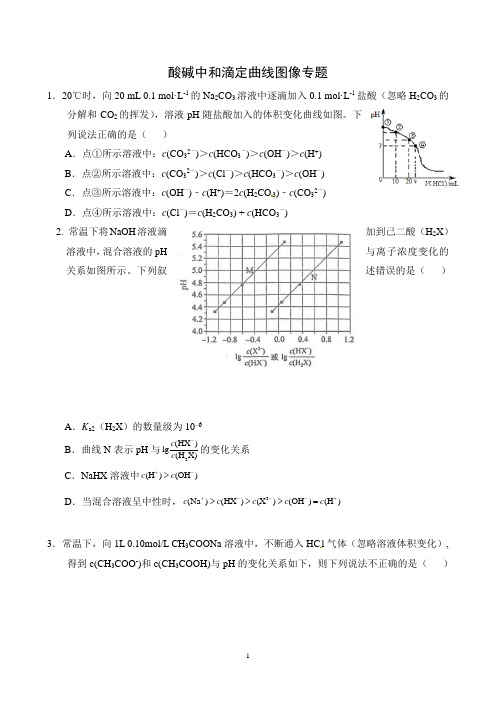
酸碱中和滴定曲线图像专题1.20℃时,向20 mL 0.1 mol·L -1的Na 2CO 3溶液中逐滴加入0.1 mol·L -1盐酸(忽略H 2CO 3的分解和CO 2的挥发),溶液pH 随盐酸加入的体积变化曲线如图。
下列说法正确的是( )A .点①所示溶液中:c (CO 32-)>c (HCO 3-)>c (OH -)>c (H +)B .点②所示溶液中:c (CO 32-)>c (Cl -)>c (HCO 3-)>c (OH -)C .点③所示溶液中:c (OH -)﹣c (H +)=2c (H 2CO 3)﹣c (CO 32-)D .点④所示溶液中:c (Cl -)=c (H 2CO 3) + c (HCO 3-) 2. 常温下将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A .K a2(H 2X )的数量级为10–6B .曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系C .NaHX 溶液中(H )(OH )c c +->D .当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=3.常温下,向1L 0.10mol/L CH 3COONa 溶液中,不断通入HC l 气体(忽略溶液体积变化),得到c(CH 3COO -)和c(CH 3COOH)与pH 的变化关系如下,则下列说法不正确的是( )A.溶液的pH比较:x>y>zB.在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)C.在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点D.该温度下,CH3COONa的K a=10-4.754.已知H2A为二元弱酸,25 ℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随n(HA-)n(A2-)变化的关系如图所示,以下说法不正确的是( )A.NaHA溶液中:c(H+)>c(OH-)B.Na2A溶液中:c(A2-)>c(HA-)C.H2A的第一步电离常数为10-7.2D.当吸收液呈中性时:c(Na+)=c(HA-)+2c(A2-)5.某温度下,向20.00 mL 0.1 mol·L-1 NaOH溶液中滴加0.1 mol·L-1苯甲酸(C6H5 COOH,弱酸)溶液,溶液的pH和pOH[pOH=-lg c(OH-)]关系如图所示。
微题型74 酸碱中和滴定与曲线分析(原卷版)
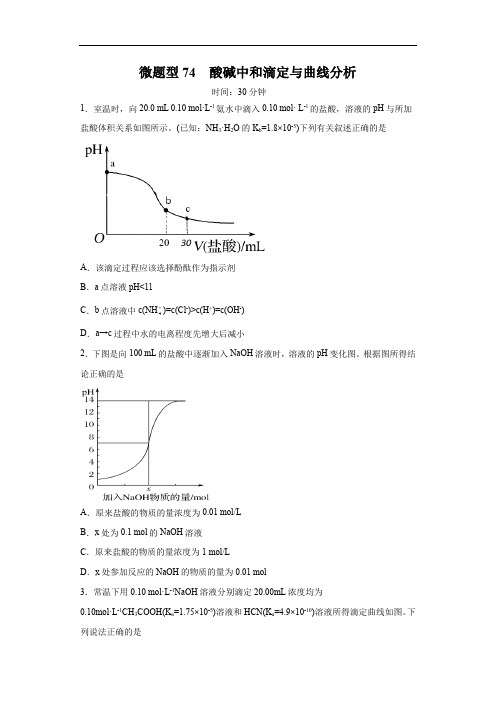
微题型74 酸碱中和滴定与曲线分析时间:30分钟1.室温时,向20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol· L-1的盐酸,溶液的pH与所加盐酸体积关系如图所示。
(已知:NH3·H2O的K b=1.8×10-5)下列有关叙述正确的是A.该滴定过程应该选择酚酞作为指示剂B.a点溶液pH<11)=c(Cl-)>c(H+)=c(OH-)C.b点溶液中c(NH4D.a→c过程中水的电离程度先增大后减小2.下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。
根据图所得结论正确的是A.原来盐酸的物质的量浓度为0.01 mol/LB.x处为0.1 mol的NaOH溶液C.原来盐酸的物质的量浓度为1 mol/LD.x处参加反应的NaOH的物质的量为0.01 mol3.常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH(K a=1.75×10-5)溶液和HCN(K a=4.9×10-10)溶液所得滴定曲线如图。
下列说法正确的是A .曲线I 和曲线II 分别代表的是CH 3COOH 和HCNB .点③和点④所示溶液中由水电离出的c(H +): ③>④C .点①和点②所示溶液中:--33c(CH COO )-c(CN )=c(HCN)-c(CH COOH)D .在点②和③之间(不包括端点)存在关系:+-+-c(Na )>c(A )>c(H )>c(OH ) (A -代表溶液中的酸根离子)4.室温下,用10.01 mol L -⋅的NaOH 溶液滴定110.00 mL 0.01 mol L -⋅的3CH COOH 溶液,水电离出的-c(OH )随NaOH 溶液体积的变化曲线如图所示。
下列说法正确的是A .P 、M 、N 三点,M 点pH 最大B .M 点溶液显中性,1V =10.00 mLC .该滴定过程选择甲基橙作为指示剂D .N 点溶液中++--3c(Na +c(H =c CH COO +c()()OH ))5.常温下,用0.1000mol /LNaOH 溶液滴定20.00mL 同浓度的甲酸溶液,过程中溶液pH 与NaOH 溶液体积的关系如图所示(已知:HCOOH 溶液的Ka=1.0×10-4,下列有关叙述正确的是提示:几种常见的酸碱指示剂变色范围如下:指示剂变色范围(pH)颜色酸色碱色甲基橙 3.1~4.4红黄酚酞8.2~10.0无红A.当加入10.00mLNaOH溶液时,溶液中:c(HCOO-)>c(Na+)>c(HCOOH)B.该滴定过程中选择甲基橙试液作为指示剂C.当加入20.00mLNaOH溶液时,溶液pH=7.0D.加入5.00mLNaOH溶液和加入25.00mLNaOH溶液时,水的电离程度相同6.常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。
2021年高考化学考点65酸碱中和对数曲线必刷题

考点六十五酸碱中和对数曲线1.常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[常温下K b(NH3•H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。
以下表达正确的选项是( )A.0.1 mol·L-1HR溶液的pH约为3B. HR为弱酸,常温时Ka (HR)=1×l0-73时,c(R -)>c(NH4+)D.当c(HR) =c(R-)时,溶液必为中性【答案】A2.常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如下图,pK a=-lgK a,以下有关表达错误的选项是A.常温下,Ka(CH3COOH)=10-5B. a点时,c(F-)=c(HF)>c(Na+)>c(H+) >c(OH-) 3COONa溶液的pHD.向CH3COOH 溶液中参加NaOH溶液后所得的混合溶液中,()()() 3310a pK pH c CH COOc CH COOH--=【答案】D3.常温下将NaOH溶液添加到己二酸()2H X溶液中,混合溶液的pH与离子浓度变化的关系如下图.以下表达错误的选项是A . ()a22K H X 的数量级为610-B . 曲线N 表示pH 与()()2c HX lgc H X -的变化关系C . NaHX 溶液中()()c H H c O +->D . 当混合溶液呈中性时, ()()()()()2c Na X XH c H c H c c O +---+>>>= 【答案】D4.25℃时,用NaOH 溶液滴定H 2C 2O 4 溶液,溶液中()()224lg c H c H C O +-和-lgc(HC 2O 4-)或()()24lgc H c HC O +--和-lgc(C 2O 42-)关系如下图,以下说法正确的选项是A.曲线L1表示()()224lgc Hc H C O+-和-lgc(HC2O4-)的关系B. Ka2(H2C2O4)的数量级为10-2C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)2C2O4溶液中参加少量水() ()-24224c HC Oc H C O减小【答案】A()()-24224c HC O c H C O =()1a K c H+ol /LH 2C 2O 4溶液中参加少量水,K a1不变,c(H +)减小,那么()()-24224c HC O c H C O =()1a K c H+增大,故D 错误;答案选A 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱中和滴定曲线之对数曲线专练1.若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pC(H2A)、pC(HAˉ)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是A. pH=4时,c(HAˉ)<c(A2-)B. c(H2A)+c(HAˉ)+c(A2-)是定值C. 该酸的电离常数K a1=10-1.3D. 常温下,NaHA的水溶液呈碱性【答案】C2.已知:pOH=-lgc(OH-)。
常温下,某弱酸的钠盐(Na2XO3)溶液中微粒浓度的变化关系如下图所示。
下列说法正确的是A. 溶液加水稀释,先增大后不变B. 在NaHXO3溶液中:>1C. 向Na2XO3溶液中滴加稀盐酸至溶液显中性时:c(Na+)+2c(H+)=c(HXO3-)+2c(XO32-)+2c(OH-)D. 实线M表示pOH与的变化关系【答案】B【解析】分析:A. 溶液加水稀释,c(H+)×c(XO32-)/c(HXO3-)的值不变;B. 在NaHXO3溶液中,= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=K h/K a1,结合pOH=2计算;C.根据溶液中电荷守恒及中性溶液中c(H+)=c(OH-)进行分析;D.已知pOH=-lgc(OH-),则pOH越大,c(OH-)越小,当pOH较大时,溶液中的氢离子较多,则c(H2XO3)较大,所以实线M表示pOH与的变化关系;根据以上分析解答。
详解:Na2XO3溶液加水稀释,水解程度增大,但是溶液中c(HXO3-)、c(OH-)均减小,温度不变,Kw不变,因此c(H+)增大,Na2XO3溶液加水稀释,一直增大,A错误;= [c(OH-)×c(HXO3-)×c(H2XO3)]÷[c(H+)×c(XO32-)×c(HXO3-)]=K h/K a1,根据图像当=0时,溶液的pOH=4,水解大于电离,溶液显碱性,所以K h/K a1>1,即在NaHXO3溶液中:>1,B正确;向Na2XO3溶液中滴加稀盐酸至溶液显中性时:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HXO3-)+2c(XO32-)+c(OH-),C错误;Na2XO3为强碱弱酸盐,水解显碱性,分两步水解:XO32-+H2O= HXO3-+ OH-, HXO3-+ H2O= H2XO3+ OH-;水解的第一步程度较大,因此c(HXO3-)/c(XO32-)比值较大,当c(HXO3-)/c(XO32-)=10-4时,溶液的碱性最强,pOH=0;第二步水解受到第一步抑制,水解程度较小,c(H2XO3)/c(HXO3-)比值较小,当c(HXO3-)/c(XO32-)=10-9时,溶液的碱性最强,pOH=0;所以实线M表示pOH 与的变化关系,D错误;正确选项B。
3.常温下,二元弱酸H2Y 溶液中滴加KOH 溶液,所得混合溶液的pH 与离子浓度变化的关系如下图所示,下列有关说法错误..的是A. 曲线M 表示pH与lg的变化关系B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)C. H2Y 的第二级电离常数K a2(H2Y)=10-4.3D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)【答案】D【解析】详解:A.随着pH的增大,H2Y 的电离程度逐渐增大,溶液中逐渐增大,逐渐减小,lg逐渐增大,lg逐渐减小,因此曲线M表示pH 与的关系,故A正确;B. a点溶液中存在电荷守恒:c(H+) +c(K+)=2c(Y2-)+c(HY-)+c(OH-),因此c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+),故B正确;C.pH=3时,lg=1.3,则K a2(H2Y)===10-4.3,故C正确;D. 交点b的溶液中存在:lg = lg>1.3,因此>101.3,即c(Y2-)<c(HY-),故D错误;综合以上分析,本题选D。
4.25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中()()OHlgHcc-+的关系如图所示。
下列说法正确的是A. H2A的电离方程式为H2A H++HA -B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/LC. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)D. 25℃时,该氨水的电离平衡常数为7 b101 Kb-=-【答案】B5.常温下,将0.1mol/LNaOH溶液分别滴加到0.1mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH 的变化关系如图所示,下列说法不正确的是A. K a(HB)<K a(HA)B. a点时,c(A-)=c(HA)>c(Na+)>c(H+)>c(OH-)C. 常温下,0.1mol/LNaA溶液的pH大于0.1mol/LNaB溶液的pHD. 向HB溶液中加入NaOH溶液,混合溶液中c(B-)/c(HB)=10[pH-pKa(HB)](已知:pKa=-lgKa)【答案】C6.向XmL0.01mol/L的氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的POH=—lgc(OH-)、温度随加入的硫酸溶液体积的变化如图所示。
下列说法正确的是A. X=20B. b点时溶液的POH=PHC. a,b,d三点NH3·H2O的电离常数: K(b)>K(d)>K(a)D. c点对应的溶液中:C(SO42-)>C(NH4+)>C(H+)>C(OH-)【答案】C【解析】b点时溶液温度最高,表明此时酸碱恰好反应完全,因1molH2SO4可与2 mol NH3·H2O反应,故X=40,A错误;恰好反应时生成(NH4)2SO4,溶液显酸性,POH≠PH,B错误;a、b、d三点的温度高低顺序为b>d>a,温度越高,NH3·H2O的电离常数越大,C正确;c点时溶液中的溶质为等物质的量的(NH4)2SO4与H2SO4,由于NH4+能水解,c(H+)> C(SO42-)>C(NH4+)>c(OH-),D错误;正确选项C。
7.常温下,用0.1 mol/L的氨水滴定10.00 mL 0.1 mol/L的酸HA,所加氨水的体积(V)与溶液中lg的关系如图所示。
下列说法错误的是A. X点:c(A-)>c(H+)>c(NH4+)>c(OH-)B. Y点:V(NH3·H2O) <10.00 mLC. Z点:2c(A-)= c(NH4+)+c(NH3·H2O)D. HA的电离方程式为HA=H++A-【答案】B【解析】由图可知,0.1 mol/L的酸HA的lg=12,则=1012,=1012,c2(H+)=1012K W=101210-14=10-2,c(H+)=0.1mol/L,说明HA完全电离,为强酸。
A. X点:加入5mL0.1 mol/L的氨水得到等浓度的NH4A和HA混合溶液,c(A-)>c(H+)>c(NH4+)>c(OH-),A正确;B. Y点:lg=0,即=1,c(H+)=c(OH-),溶液呈中性,若加入氨水V(NH3·H2O) =10.00 mL,恰好得到NH4A溶液,此时溶液由于NH4+水解而显酸性,故加入的氨水应比10.00 mL大,故B错误;C. Z点为等浓度的NH4A和NH3·H2O的混合溶液,根据物料守恒,2c(A-)= c(NH4+)+c(NH3·H2O),C正确;D. HA为强酸,电离方程式为HA=H++A-,D正确;本题正确答案应选B。
8.常温,某二元弱酸H2A溶液中离子浓度与pH的关系如图所示(y为lg [c(HA−)/c(H2A)]或lg[c(A2−)/c(H2A)]):下列说法不正确...的是A. 曲线b为lg[c(HA−)/c(H2A)] 与pH的变化关系B. 该温度下,H2A的K a2约为10−4.1C. 若在上图中作lg[c(HA−) /c(A2−)] ~ pH关系图,得到的曲线会与曲线b平行D. 若升高温度,则图中曲线a、b上移【答案】C9.设pC为溶液中粒子物质的量浓度的负对数,即: pC=-lgC。
25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。
下列说法正确的是A. 曲线I表明,c(R2-)随着pH增大而逐渐增大B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/LC. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000D. NaHR水溶液中: c(Na+)>c(HR-)>c(OH-)>c(H+)【答案】C【解析】分析:H2R H++HR-, HR-H++R2-,随pH增大电离平衡正向移动,c(H2R),开始较大,后逐渐减小,c(HR-)先增大后减小,c(R2-)开始较小,后逐渐增大,pC为溶液中粒子物质的量浓度的负对数,C越大pC越小,由图像可知:曲线I是pC(HR-)随溶液pH的变化曲线,曲线II是pC(H2R)随溶液pH的变化曲线,曲线III是pC(R2-)随溶液pH的变化曲线;详解:A. 从以上分析可知,曲线III表明,c(R2-)随着pH增大而逐渐增大,故A错误;B. pH=1.3时,c(HR-)= c(H2R),根据电荷守恒c(HR-)+2c(R2-)+c(OH-)=c(H+)=10-1.3mol/L由于c(HR-)> c(R2-),所以3c(R2-)+c(OH-)<10-1.3mol/L,故B错误;C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=====1000,故C正确;D. pH=1.3时,c(HR-)= c(H2R),Ka1==c(H+)=10-1.3,pH=4.3时,c(HR-)= c(R2-),Ka2==c(H+)=10-4.3,NaHR的水解常数Kh===10-12.7,因此,NaHR水解小于电离,溶液显酸性,c(OH-)<c(H+),故D错误;因此,本题正确答案为C。
10.类比pH的定义,对于稀溶液可以定义pC=-1gc。
