第九章醛酮x
有机化学 第9章 醛、酮、醌

O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
有机物醛、酮、醌

OH R-C-OR' H
OR' R-C-OR' H
¥¥¥¥ ° ¨¥¥¥ ¨¥
¥¥¥ ¨¥¥ ¨¥
缩醛具有双醚结构,对碱和氧化剂稳定,但遇酸迅速水解 为原来的醛和醇 O OR' + H O/H R-C-H + 2R'OH R-CH-OR' 2
¥¥ ¥¥¥¥¥¥¥¥ ¨
所以,制备缩醛时必须用干燥的HCl气体,体系中不能含水。
O O CH3C-CH2-CCH3 2,4- 戊二酮 戊二酮
三、 醛和酮的物理性质
物态:CH2O为气体;C2-C12醛、酮为液体;C13以上醛、 酮为固体。
沸点:与分子量相近的醇、醚、烃相比, 醇>醛、酮>醚>烃。 原因:a. 醇分子间可形成氢键,而其它不能形成氢键; b. 醛、酮的偶极矩大于醚、烃的偶极矩:
一些醛和酮的物理常数
四、 醛和酮的化学性质 (1) 羰基的亲核加成
(甲) 加氢氰酸 (乙) 加格氏试剂 (丙) 加亚硫酸氢钠 (丁) 加醇 (戊)加氨的衍生物
(2) α-氢原子的反应
(甲) 卤化反应 (乙) 缩合反应
(3) 氧化反应 (4) 还原反应 (5) Cannizzaro反应(岐 化反应)
H2/Ni
NaBH4
RCH=CHCHO
-CH=CHCHO
¥¥¥
RCH2CH2CH2OH
-CH=CHCH2OH
¥¥¥
(B)
C=O
[H]
CH 2 (Clemmensen还原法,酸性介质)
[H]: Zn-Hg/HCl
5、 岐化反应
没有-活泼氢的醛在强碱作用下,发生分子间的氧化还原而 生成相应醇和相应酸的反应。
+
有机化学第09章醛酮
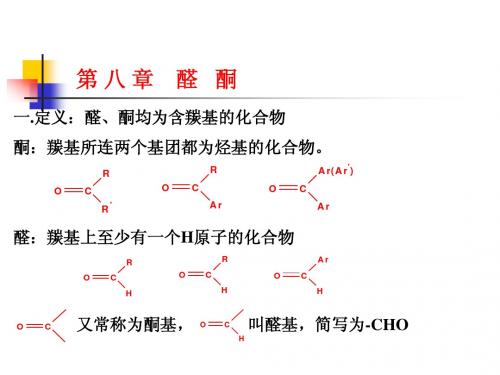
羰基比醛羰基的活性小。当分子中有吸电子基时,羰基电子密度减小,反应加快。
羰基的活性顺序
H O C H
H
H
CH3
>
O
C R
>
O
C Ar
>
O
C CH3
O
O
O C CH3
O C
>
R
C
CH3
>
>
按与HCN反应活性的大小排列
(1) CH3CHO (2) ClCH2CHO (3) Cl3CCHO (4) CH3CH2COCH3
2 反应机理
R R
' -
C=O
CN
R R
'
C
C N H 2O O
-
R R
'
CN C OH
3 反应条件 反应必须在弱碱性条件下进行。 4 烃基结构 a.空间结构 :R,R’ 越大,空间阻碍不利于亲核试剂进攻。反应时,羰基C由 sp2→sp3 杂化,键角由120°→109.5° b.电子效应 :羰基上连烷基越多,电子密度越高,越不利于亲核加成,所以酮
+ C =O H
+ ] C- O H
Nu
-
Nu C OH
(2)醛、酮的反应活性
R H
C =O
>
R R'
Ar
C =O
>
C =O
R'
(1)与HCN的加成
醛,酮与HCN作用,得到α-羟基腈
OH R CH O
+
H ----C N
+
R C H OH CN
R
C R'
最新第9章醛和酮亲核加成反应PPT课件

H
H
H
H
H
C3H C = O>
C3H
= O> C3H C = O> RC = O> Ph C = O> Ph C = O
R
R
C3H
Ph
上页
下页
返回
对于芳香族醛、酮,主要考虑环上取代基的电子效应。
O 2 N CH > O CH > C O 3HCHO
(3) 、反应范围 醛、脂肪族甲基酮 、八个碳以下的环酮(八个碳以下的
C l C l CC H O+H 2O C l
C l
O H
C l CC H
C l
O H
水合氯醛(具有安眠作用)
O O +H2O
O
OH O
O OH
水合茚三酮
5. 与ROH加成
R H CO+
( R' )
无 水 HCR l OH
R''OH
C
H OR''
( R' )
R''OH R C OR''+H2O 干HCH l OR''
2. 沸点
由于羰基为一极性基团,故醛、酮的b.p比相对分子质量 相近的烃和醚高,又比相同碳原子数的醇要低。
3.溶解度 醛、酮的羰基能与水中的氢原子形成氢键,故低级醛、酮
可溶于水;但芳香族醛、酮则微溶或不溶于水。
上页
下页
返回
Boiling Points of Ketones and Aldehydes
返回
(C )转化成α-羟基腈
α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
有机化学课件第五版汪小兰第9章醛、酮、醌

醛、酮、醌
• 醛、酮、醌的结构、分类和命名
• 醛、酮、醌的物理性质
• 醛、酮、醌的化学性质
9-1 醛和酮的结构、分类及命名
一、结构 • 醛、酮:分子中含有羰基,故称为羰基化合物。
• 官能团: 羰基
C O
O R C H 醛
O C H 醛基
O R C R1
O C 酮基
酮
• C、O:sp2 杂化;
3-戊酮
O CH3CH2C CH CH3
5 4 3 2 1
CH2=CHCHO 丙烯醛
CH3
2-甲基-3-戊酮
O CH3C CH CH CH3
1 2 3 4 5
5 4 3 2 1 CH3CH CHCHCH3
OH
3-戊烯-2-醇
3-戊烯-2-酮
CHO
苯甲醛 苯乙醛
CH2CHO
COCH 3
苯乙酮
O CH2C CH3
CH
CH
CH R
CH3
4 CH
3 CH
H 2 C 1 O
H
+ RMgX 1,4-加
H CH C OH
成 CH 3
CH R
CH
C
OMgX
H+, H2O
CH3
CH R
CH3CHCH2CHO R
CH3CH=CH-CHO
1,2加成
+
CH3CH2MgX
CH3CH=CH-C
OH
CH2CH3
1,4加成
CH3CH
• 酮较难与一元醇反应,与1 ,2-或1,3-二员醇比较容易 进行,产物为环状缩酮。
O
O
O
+ HOCH2CH2OH
有机化学(主编邓苏鲁-化工第四版)课件:第9章+醛和酮-下
结束
1
甲醛易溶液于水,一般以水溶液的方式保存和出售,含37%~40%甲 醛、8%甲醇水溶液叫“福尔马林”,常用作杀菌剂和生物标本的防腐剂。 也可作农药用于防止稻瘟病。甲醛有毒,对眼黏膜、皮肤都有刺激作用,
过量吸入其蒸气会引起中毒。现代室内装饰材料用的木工板和家具等都
会不同程度的释放出有毒的甲醛,严重污染室内空气,刚使用时应注意 通风,以防中毒。 甲醛性质活泼,极易聚合。其水溶液久置或蒸发浓缩可生成直链的聚 合体——多聚甲醛— CH2O— ( ) n 。多聚甲醛为白色固体、加热至180~200 ℃时,可
应生成无色结晶,也能与碘的NaOH溶液反应。B不能与斐林试剂反应,A与浓硫酸脱 水后生成烯烃C(C3H6)。试推测A,B的构造式。
⒑ 化合物A、B、C,分子式均为C4H8O ;A、B可以和苯肼反应生成沉淀,而C不
能;B可以与斐林试剂反应,而A、C不能;A、C能发生碘仿反应,而B不能;试推 测A、B、C的构造式。
α-羟基磺酸钠
O R—C—H(R„ )
2R“OH ,干HCl
OR“ R—C—H(R„ ) OR”
NO2 NO2
2,4—二硝基苯腙 缩醛
NO2
H2N—NH— NO2
R—C—H(R„ )
12
结束
O CH3—C—H(R) )
O
3NaOI CI —C—H(R (I2—NaOH) 3
O
(R)H—C—ONa + CHI3↓
习
CH3 CHO ︱ ︱ ⑴ CH3—CH—CH2—CH—CH3 CH2—CH3 ︱ CH3—CH—CH2—CHO O ︱ ︱ ⑸ ⑻
C—CH3
题
CH3 O Cl ︱ ︱ ︱ ︱ CH3—CH—C—CH—CH3 CH3 ︱ ⑷
第九章 醛和酮

2 卤化-水解 4 加特曼-科赫反应
烯烃
炔烃
芳烃
醇
1 氧化 2 频哪醇重排
醛 酮
氧化
羧酸
取代
羧酸衍生物
还原
乙醛和丙酮的工业制备
一、羰基的亲核加成反应
1. 与氢氰酸加成(碱催化下)
R C (CH3)H O + H CN
OH-
R C (CH3)H
OH
H+
R C
OH COOH
CN
(CH3)H
α-羟基腈(氰醇)
RCH2OH
甲醛 伯醇
R
CH OH R1
R1
醛 仲醇
R1 RMgX +
H2O H
+
R
C OH 酮
叔醇
R2
该反应在有机合成中是增长碳链的方法。
5.与氨的衍生物加成—缩合反应
上式也可直接写成:
C O + H2 N Y C N Y + H2O
反应一般控制在弱酸性溶液(醋酸)中进行
Y: OH NH2 NH NH NO2 NO2
1、还原成醇
O H __ __ R C H( R ) OH R CH H( R )
__ __
(1)用金属氢化物还原 金属氢化物(NaBH4、 LiAlH4等)还原剂,具有选 择性,只还原羰基,不还原 C=C双键
CH3CH CHCHO
NaBH4
CH3CH CHCH2OH
(2)催化加氢 常用的催化剂是镍、钯、铂 产率高,选择性不强,不饱和基团同时被还原, 此法常用来制备饱和醇。
O O __ __ H R C__ H Ar C__ H
单酮 酮 混酮
酮分子中的羰基称为酮基。醛分子中的 称为醛基,醛基可以简写为—CHO。
第九章 醛和酮

4.加醇
醇是含氧的亲核试剂,在干燥的氯化氢的催化下, 一分子醛与一分子醇发生加成,生成半缩醛。
O R C H R' OH
干燥HCl
OH R C H OR'
半缩 醛羟 基
半缩醛分子中的羟基称为半缩醛羟基。半缩醛不 稳定,再与另一分子醇反应,脱水生成稳定的缩醛。
OH R C H R' OH OR' OR'
第九章
教学目标:
醛和酮
1、了解醛和酮的分类,物理性质 2、熟悉醛和酮的命名,制备方法 3、掌握醛和酮的结构特点,化学性质
碳原子以双键和氧原子相连的官能团称羰基
O C
羰基
O R C H
醛基
O R C R'
酮基
通 式:
O (Ar)R C H
O (Ar)R C R'(Ar)
一、结构和命名
(一)结构
δ+ δ-
除了具有活泼甲基的醛、酮可以发生碘仿反应 外,具有
CH3 CH R(H) 结构的醇也能发生碘仿反应, OH
这是因为具有这种结构的醇能被次碘酸钠氧化为 相应的具有活泼甲基的羰基化合物。
碘仿是黄色结晶,不溶于水,具有特殊气味,易识 别。所以可用于以上各类化合物的鉴别。
2.羟醛缩合 在稀酸或稀碱的催化下(最常用的是稀碱),一分
2.加NaHSO3
亚硫酸氢钠饱和水溶液能与醛、脂肪甲基酮和八个碳以下 的低级环酮生成结晶性物质而析出。
O R C H ( CH3) SO3H Na
+
SO3H R C ONa H ( CH3)
SO3Na R C OH H ( CH3)
1.由于加成物能溶于水而难溶于亚硫酸氢钠饱和水溶
有机化学第九章醛和酮
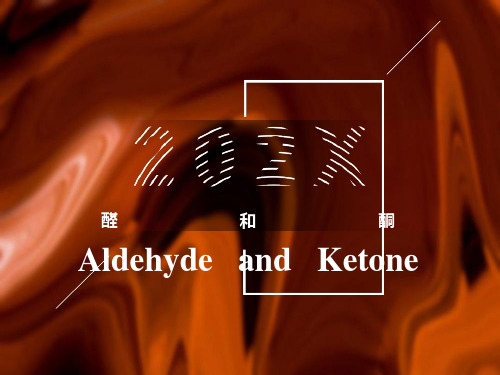
2-甲基丁醛
05
含羰基的最长碳链
06
使羰基的位次最小
07
复杂的醛酮用系统命名法
08
a
09
甲基丁醛
10
(2)脂肪酮按分子中碳原子数称某酮
1
2
3
4
5
4-甲基-2-戊酮
(3)不饱和醛酮要标出不饱和键位置
1
2
3
4
2-丁烯醛
1
3
4
3-戊烯-2-酮
2
5
2
1
苯乙醛
3-甲基环己酮
苯乙酮
环酮根据碳原子总数及所含羰基数 称为环某几酮
d+
d-
第三节 醛酮的化学性质
结构特点及反应类型
(一)亲核加成反应
-
+
亲核试剂Nu-
亲核加成反应
亲核试剂:
带负电荷或孤对电子
如:HCN,ROH 及氨的衍生物等
一些常见的亲核试剂
(一) 亲核加成反应
历程:
+
-
Nu-
慢
A+
快
动画模拟:亲核加成反应的机制
影响亲核加成反应的因素
(1)电子效应
▽酮羰基碳所带的正电性程度低 ▽连有两个烃基,空间位阻较大
烃基的斥电子效应和空间位阻增大
>
>
>
>
>
>
2
提高溶液的pH值
3
CNˉ浓度决定反应速度
1
如何提高此反应速度
4
羟基丙腈
1、加氢氰酸
加氢氰酸反应的用途
H2O H2O 增长碳链(多一个C)
醛、脂肪族甲基酮和8个碳以下的环酮
思考:芳香酮为什么不能反应?
最新9第九章醛酮

CO < CO < CO
H
C H 3
C H 3
甲基的超共轭作用使羰基碳上的正电荷分散
醛酮水合物的稳定性
H C O H > C H 3C O H > C H 3C O H
HO H HO H C H 3 O H
水合物 醛酮越稳定,水合物越难形成; 烷基的位阻
广东药学院
主讲人: 申东升
C l HC
H C
加碱可大大促进本反应。
广东药学院
主讲人: 申东升
O
OH
C H 3C H 2 CC H 3H C NCH3CH2 C CN
CH3
氰醇可用来合成羟基酸:
OH CH3CH2 C CN
OH
HCl
H 2 O CH3CH2 C COOH CH3
CH3
浓 H 2 S O 4 CH3CH C COOH CH3
广东药学院
由于“吊白块”的强还原性能将食品中的有色物质漂 白,具有保鲜作用,但吊白块”不能作为食用添加剂使用 ,摄入10g即可致人死亡。
不法分子不惜损害广大消费者的身心健康利益,对《中 华人民共和国食品卫生法》熟视无睹。
广东药学院
主讲人: 申东升
3. 与金属有机试剂的加成
(1) 与格氏试剂生成醇
H 2 C O +
9第九章醛酮
9.1 一元醛酮的结构和命名
O
羰基:
C
醛:
O
醛基
RC H
酮:
酮基
O
R C R'
广东药学院
主讲人: 申东升
1. 与HCN的加成
CO
R C O+HCN
H (CH3)
醛或酮
第九章 醛和酮

C
CH3 C O
CH3 + Br2
H+
CH3 C O
CH2Br + HBr C
α -溴丙酮
将次卤酸钠的碱性溶液与醛或酮作用生成卤仿的反 应称为卤仿反应。其通式表示如下:
C R C O CH3 + 3NaOX (X2 + NaOH)
NaOI NaOI
CH3 C O
ONa + CHX3 + 2H2O C
O C CH2CH3
Zn Hg , HCl
CH2CH2CH3 C
由于反应是在酸性介质中进行的,因此,羰基化合 物中含有对酸敏感的基团(如醇羟基、碳碳双键等)时, 不能用此法还原。
(4)沃尔夫—凯惜纳—黄鸣龙还原
先让醛或酮与氢氧化钠、肼(H2N―NH2)的水 溶液和高沸点的醇(例如二甘醇)一起加热,醛 和酮首先生成腙,再蒸出水和过量的腙,继续 升温回流,使腙分解放出氮气,此时羰基转变 成了亚甲基。例如:
H2 Pt
CH3CH2CH2OH CH3 CH OH CH3 C
H2 Pt
选择性不强
C CH3CH CHCHO
H2 Ni
CH3CH2CH2CH2OH
C
(2)金属氢化物还原
金属氢化物如氢化铝锂(LiAlH4)、硼氢化 钠(NaBH4)是还原羰基常用的试剂。
CH3CH CHCHO
NaBH4
异丙醇铝
CH3CH CHCH2OH
2 HCHO
浓NaOH
HCOONa + CH3OH
第九章 醛和酮
第一节 醛和酮的结构、分类及 命名
第二节 醛和酮的物理性质 第三节 醛和酮的化学性质 第四节 重要的醛和酮
第九章醛和酮亲核加成反应

第九章 醛和酮 亲核加成反应第一节 结构、命名和物理性质一、醛和酮的定义醛和酮都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛(甲醛与两个氢相连),与两个烃基相连的称为酮。
CO R'CR O HCR(H)O羰基 醛 酮二、醛和酮结构羰基是醛、酮的特征官能团。
羰基碳原子是sp 2杂化的,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道侧面重叠形成一个π键。
由于氧原子的电负性比碳原子大,故碳氧双键电子云偏向于氧原子,使氧原子带负电荷(δ-),而碳原子带正电荷(δ+),易被亲核试剂进攻发生亲核加成反应;由于羰基的吸电子作用,羰基的α-H 活性增强,表现出α-H 的酸性,进而发生羟醛缩合,卤代等反应。
此外,醛、酮还可以发生氧化、还原反应及其它一些反应。
醛、酮的结构与化学性质关系如下:CH R'H (H)R羰基的还原反应羰基的亲核加成反应醛的氧化反应H 的反应三、醛和酮的分类和命名(一)分类醛和酮根据烃基结构类型,可分为脂肪和芳香醛、酮;根据烃基的饱和程度,又分为饱和与不饱和醛、酮;根据羰基的数目,还分为一元、二元和多元醛、酮。
(二)命名 1.普通命名法结构简单的醛、酮,可采用普通命名法命名。
醛按分子中含有的碳原子数称为“某醛”,芳基作为取代基;酮则根据羰基所连的两个烃基来命名,简单的烃基放前,复杂的烃基在后,最后加“酮”字来命名。
2.系统命名法结构复杂的醛、酮主要采用系统命名法。
即选择含有羰基的最长碳链为主链,从距羰基最近的一端编号,由于醛基总是位于碳链的一端,不用标明醛基的位次,但酮的羰基位于碳链中间,位次必须标明。
将取代基的位次和名称放在母体名称前。
芳香烃基总是作为取代基。
多元醛、酮命名时,应选取含羰基尽可能多的碳链为主链,注明羰基的位置和数目。
不饱和醛、酮,应选择连有羰基和不饱和键在内的最长碳链做主链,并使羰基编号最小。
有机化学-第九章醛酮醌

3、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。
4、低级醛酮易溶于水,醛酮都能溶于水。丙酮能 溶解很多有机化合物,是很好的有机溶剂。
二、 醛酮的化学性质
1、 加成反应
• 烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
(1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)。
反应机理
O
H+ +OH
R-C-R'
R-C-R'
OH
R-C-R'
+
-H+ O R"COO-H
OH R-C-R'
O-OCR" O
R
O
R' C
O O
H
O
C R"
R’重排 O-O键断裂 -R”COO- , -H+
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物; 如:NH2-CH2-CH2-CO-CH3,就不能用此方法,
含有-NO2也被同时还原。 • 武尔夫-克日聂尔-黄鸣龙反应——适用对碱不敏感的
化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
• 由于醛基直接连在芳环上的芳醛都没有氢原子, 所以可以用坎尼扎罗反应来制备芳香族醇:
二、烃基的反应
1、α-氢原子的卤代反应
有机化学 第9章 醛和酮

R CH2OH
R' R CHOH R' R COH R"
伯醇 仲醇 叔醇
(5)与氨衍生物的加成缩合
氨及其衍生物是含氮的亲核试剂,可与羰基加成, 氨及其衍生物是含氮的亲核试剂,可与羰基加成, 再分子内失去一分子水形成碳氮双键 再分子内失去一分子水形成碳氮双键
+ δ
C
.. O + HN Y 2
δ
_
C NH2 Y _ O
CH3CH2CHCHO CH3
2-甲基丁醛
CH3CH CHCHO
2-丁烯醛(巴豆醛) 丁烯醛(巴豆醛)
CH2CH2CHO
3-苯基丙醛
注意醛基的写法: 注意醛基的写法:
右端:CHO 右端 左端: 左端:OHC
O 7 6 5 4 3 2 1 CH3CH2CHCH2C CH2CH3 CH3
O3 4 5 CH3 CCH2CH CH2
课堂练习: 课堂练习 1. 比较下列化合物和 比较下列化合物和HCN加成反应的速度 加成反应的速度
CH3CHO CH3CH2CHO CH3COCH3 CH3CH2COCH2CH3
2. 以丁酮为原料,合成 甲基 羟基丁酸 以丁酮为原料,合成2-甲基 甲基-2-羟基丁酸
O CH2CH2CCH3 HCN CH2CH2CCH3 CN OH H3O+ OH CH2CH2CCH3 COOH
α-羟基磺酸钠
适应于: 适应于: 脂肪族甲基酮和八个碳以下的环酮。 醛、脂肪族甲基酮和八个碳以下的环酮。
CH3CHO 89% CH3COCH3 56% CH3COCH2CH3 36% 35% O
CH3COCH(CH3)2 CH3COC(CH3)3 H5C2COC2H5 CH3COPh 12% 6% 2% 1%
第九章 醛酮

H3C C O H
第31页,共64页。
第32页,共64页。
第33页,共64页。
氧化还原反应
⑴ 氧化反应 醛/酮的最主要区别是对氧化剂的敏感性,因为醛中
羰基碳上的氢很容易被氧化为羧酸,甚至可被空气氧化 ;酮则要难得多,往往需要更强的氧化剂。醛常用的氧
化性试剂有:托伦(Tollens)试剂和费林(Fehling)试剂
OO
CH3CCH CHCH3
CH3CCH2CCH3
第5页,共64页。
命名
1. 系统命名法
• 以醛、酮为母体,选择含羰基的最长的碳链为主链。 • 编号时使羰基位次最小。标出羰基的位置(醛基不标).
CH3CHO
乙醛
CH3 CH3CHCHO
2-甲基丙醛
CH3COCH3 丙酮
第6页,共64页。
CH3COCH2CH3
此类反应,多出现在推 结构等题中出现
第24页,共64页。
与醇加成
•在无水醇中通入HCl气体或其他无水强酸,则在酸的催化下, 醛能与一分子醇加成,生成半缩醛。半缩醛不稳定,可以和另 一分子醇进一步缩合,生成缩醛:
第25页,共64页。
半缩醛反应历程:
质子化
• 半缩醛在酸催化下,可以失去一分子水,形成一个碳正 离子,然后再与另一个醇作用,最后生成稳定的缩醛:
第26页,共64页。
第27页,共64页。
• 缩醛对碱和氧化剂都相当稳定。由于在酸催化下生成缩醛的反应是
可逆反应,故缩醛可以水解成原来的醛和醇:
• 在有机合成中常利用缩醛的生成和水解来保护醛基。
• 醛与二元醇反应生成环状缩醛:
第28页,共64页。
• 酮也能与醇生成半缩酮或缩酮,但反应较为困难。而酮和 1,2-或1,3-二元醇比较容易生成环状缩酮:
有机第九章醛和酮

R(H) ( )
α—H的反应 的反应
一、亲核加成(nucleophilic addtion)反应 亲核加成( ) 反应机制: 反应机制: δ+ δR-C=O R`
Nu- 慢
OR-C-Nu R` 负氧离子中间体
A+,快
OA R-C-Nu R` 加成产物
亲核加成反应有以下几种类型: 亲核加成反应有以下几种类型:
—CH3-C-CH3 O 芳香醛酮: 芳香醛酮: —CHO —C-CH3 O
二、醛、酮的英文命名: 酮的英文命名: 改作“ , 醛:将烃名词尾“e”改作“al”,例 将烃名词尾“ 改作 如: CH3CHO Ethanal CH2=CHCHO CH3CHCH3CHO CH3 Propenal 3-methylbutanal
第三节 醛酮化学性质
酮分子中含有活泼的羰基, 醛、酮分子中含有活泼的羰基,可以发生多 种化学反应。 种化学反应。
氧化反应 还原反应
亲核加成
OδC C +
δ
R (H)
H
α-C及α-H的反应
醛、酮的反应一般可归纳如下: 酮的反应一般可归纳如下:
δ+
—C H
δC=O
亲 亲核试剂带负电荷部分 核 先进攻缺电子的碳原子 加 成 亲核试剂带正电荷部分 反 后进攻富电子的氧原 应 子 醛的特征反应
1,3-diphenyl-1, , , 3-propanedione 茴香醛 (anisaldehyde) )
CH3-O-
-CHO
—CH=CHCHO 肉桂醛 (cinnamaldehyde) )
请同学们用系统命名法命名下列化合物: 请同学们用系统命名法命名下列化合物: 5-甲基 乙 甲基-3-乙 甲基 O CH2CH3 基-4-庚烯 庚烯 CH3-C-CH-CH=C-CH3 -2-酮 3酮 ethyl-5CH2CH3 methyl-4CH2=CH OH hepten-2-one CH3CH2CH2-CH-CH2CHCHO 4-正丙基 羟基 己烯醛 正丙基-2-羟基 正丙基 羟基-5-己烯醛 2-hydroxy-4-n-proryl-5-hexenal
第九章 醛和酮 亲和加成反应

14
第三节 化学性质
15
亲核加成
O C H
活泼H的反应 α-活泼 的反应 活泼 (1)烯醇化 ) (2)羟醛缩合反应 ) 卤代( (3)α-卤代(卤仿反应) ) 卤代 卤仿反应)
16
C
H(R)
氧化还原
一 、亲核加成反应
(1)反应机理
(2)醛、酮的反应活性 )
H H C=O
>
R H
C=O
>
R R'
有机化学
第九章 醛和酮 亲核 加成反应
1
基本要求
掌握羰基化合物的结构及命名; 掌握羰基化合物的结构及命名; 掌握醛、酮主要化学性质:亲核加成、 掌握醛、酮主要化学性质:亲核加成、羟醛缩 卤代、卤仿反应,氧化还原反应,Michael 合、卤代、卤仿反应,氧化还原反应 加成 掌握醛、酮的鉴别; 掌握醛、酮的鉴别; 熟悉保护羰基的方法; 熟悉保护羰基的方法;
HO O HO CH3 5) 分子内含有羟基的醛 O +
H OH
CH3
H+
CH3 O CH3 O
H+
OH OH
28
(四)羰基与含氮亲核试剂的加成
OH C O + HNHR C NHR
西佛碱
HO CHO + H2N H
-HO 2 C NR
CH-N
CH=N
+ H2 O
29
羰基试剂
30
特点: 特点:
C=O
>
Ar R'
C=O
17
电子效应和空间位阻的影响 1) 酮羰基上连有烷基时,由于烷基是给电子基 酮羰基上连有烷基时, 降低了羰基碳的正电性;同时也增大 了羰基碳的正电性 增大了 团,降低了羰基碳的正电性;同时也增大了 空间位阻,不利于亲核加成; 空间位阻,不利于亲核加成; 位阻 2) 对于芳香类羰基化合物,羰基和苯环共轭时 对于芳香类羰基化合物, 电子向羰基离域, 了羰基碳的正电性 ,π电子向羰基离域,降低了羰基碳的正电性 电子向羰基离域 降低了羰基碳的 不利于亲核加成; ,不利于亲核加成; 正电性增强, 3) 烃基上有吸电子基时,羰基碳正电性增强, 烃基上有吸电子基时 羰基碳正电性增强 吸电子基 有利于亲核加成;反之相反; 有利于亲核加成;反之相反;
有机化学-醛酮

醛酮鉴别、提纯的一种方法
R(H) C O R C O + Na
-
R
SO3 Na HO C
-
+
+
-SO H 3
Na
+
R(H)
慢 HO S 3
快
R R(H) a-羟基磺酸钠
14
与氨衍生物加成 * 醛、酮 * 醛酮与其他化合物鉴别的一种方法
G
.. R(H)
NH2
R C O
R(H) C NH G
O 2N
+O
17
由Gridnard试剂制备醇
制伯醇
R1 MgX
+O
C
H ROR H
R1 CH2 OMgX
H2O H
+
R1 CH2OH
制仲醇
R1 MgX
+O
C
C
H ROR R
R1 CH OMgX R
H2O H
+
R1 CH OH R
制叔醇
R1 MgX
R R ROR R H2O R1 C R OMgX H
6
物理性质
羰基的强极性
沸点—— 比分子量相近的卤代烃、烷烃、醚高得多,但 比醇类低 水溶性—— 分子中碳原子数增加,溶解度降低 低分子量的易溶,高级醛酮溶于有机溶剂
羰基中氧可与水分子形成氢键
7
9.3 化学性质
1. 亲核加成(nucleophilic addition) 2. a-氢反应 3. 醛的氧化 4. 还原反应
R(Ar)
CH3
4
命名
普通命名 酮(RCOR):两个烃基R、R命名后加酮, 即某基某基酮,较优基团后列出。 系统命名 主链:含醛基、酮基最长的 编号:醛基在1位,酮基最小 芳环作取代基
2023届高三化学高考备考一轮复习 第九章 有机化学基础(06)醛 酮 课件
C—H3—C→HO NaOH/H2O
B C9H9O3Na
1KM—2n—HO→+4/OH-
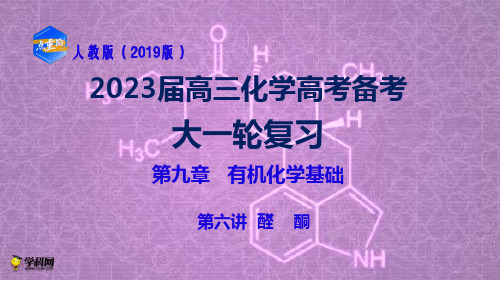
5.(2018·课标全国Ⅲ,36节选)近来有报道,碘代化合物E与化合物H在CrNi催化 下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知:RCHO+CH3CHONa―O△ ―H/→H2OR—CH===CH—CHO+H2O 回答下列问题: (1)A 的化学名称是________。 (2)B 为单氯代烃,由 B 生成 C 的化学方程式为_______________________。 (3)由 A 生成 B、G 生成 H 的反应类型分别是________、________。 (4)D 的结构简式为___________________________________。 (5)E 与 F 在 Cr-Ni 催 化 下 也 可 以 发 生 偶 联 反 应 , 产 物 的 结 构 简 式 为 ___________________________________________________________。
特殊气味 与水以任意比互溶
任务一:醛 酮
3.醛、酮的化学性质
(1)醛类的氧化反应(以乙醛为例)
△ ①银镜反应:CH3CHO+2[Ag(NH3)2]OH――→
CH3COONH4+2Ag↓+3NH3+H2O 。
△ ②与新制的Cu(OH)2反应:CH3CHO+2Cu(OH)2+NaOH――→
_C_H__3_C_O__O_N__a_+__C_u_2_O_↓__
生成CO2为13.44L(标准状况),则该D醛是 (
)
A.丙醛
B.丁醛
C.3—甲基丁醛
D.己醛
6.下列有关银镜反应实验的说法正确的是( A )
