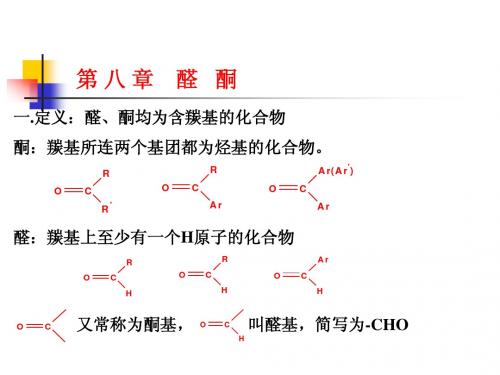
最新9第九章醛酮
合集下载
有机化学第09章醛酮
羰基比醛羰基的活性小。当分子中有吸电子基时,羰基电子密度减小,反应加快。
羰基的活性顺序
H O C H
H
H
CH3
>
O
C R
>
O
C Ar
>
O
C CH3
O
O
O C CH3
O C
>
R
C
CH3
>
>
按与HCN反应活性的大小排列
(1) CH3CHO (2) ClCH2CHO (3) Cl3CCHO (4) CH3CH2COCH3
2 反应机理
R R
' -
C=O
CN
R R
'
C
C N H 2O O
-
R R
'
CN C OH
3 反应条件 反应必须在弱碱性条件下进行。 4 烃基结构 a.空间结构 :R,R’ 越大,空间阻碍不利于亲核试剂进攻。反应时,羰基C由 sp2→sp3 杂化,键角由120°→109.5° b.电子效应 :羰基上连烷基越多,电子密度越高,越不利于亲核加成,所以酮
+ C =O H
+ ] C- O H
Nu
-
Nu C OH
(2)醛、酮的反应活性
R H
C =O
>
R R'
Ar
C =O
>
C =O
R'
(1)与HCN的加成
醛,酮与HCN作用,得到α-羟基腈
OH R CH O
+
H ----C N
+
R C H OH CN
R
C R'
7.第九章-醛、酮PPT课件

δO-
CC
δ+
H
1. 羰基上的加成反应
可被氧化也可 被还原
H
带部分正电, 被亲核试剂进 攻,加成
羰基中的碳氧双键由于电负性O > C,因此π电子云 不是对称地分布在碳和氧之间,而是靠近氧的一端,由于 碳正电中心的反应性能大于氧负电中心,因此易于与亲核 试剂发生加成反应。
R/
δ-
C=O
+
Nu-A+
R/ C-OA
H3C
OH
O
100%
O
H3C -H2O
O
-
39
(3)卤化反应和卤仿反应
例1 例2
一卤代醛、酮往往可以继续卤化成二卤代、三卤代产物
-
40
• 三卤代物在碱存在下,会进一步发生三卤甲基和羰基 碳之间的裂解,得到三卤甲烷和羧酸盐:
-
• 三卤甲烷俗称卤仿(氯仿、溴仿和碘仿(亮黄色))。该 反应叫卤仿反应,通式:
-
18
• 羟基腈是一类很有用的有机合成中间体。氰基-CN能 水解成羧基,能还原成氨基。 例如:有机玻璃 —聚-甲基丙烯酸甲酯的单体的合成:
丙酮氰醇 (78%)
-甲基丙烯酸甲酯(90%)
• 第二步包含:水解-、酯化和脱水等反应。 19
与格利雅试剂的加成——醇
•醛酮与格利雅试剂加成,后水解成醇:
强亲核试剂
空间位阻 ,反应
> > 如:H C=O H
R C=O
H
R δ+ δ C=O
R
> R C O H
CO H
亲核试剂
+-
A Nu H CN Na HSO3 H NH-Y H OR XMg R
有机化学 第9章 醛和酮(2)

2020/8/3
11
2. 炔烃和胞二卤代物的水解
3. 烯烃的臭氧化
2020/8/3
12
4.烯烃的羰基化法 烯烃的羰基化法是制备醛的重要方法。反应一般需要高压和过渡金属催化,最常用的 催化剂为羰基钴
5. 傅-克酰基化
2020/8/3
13
6. 瑞默-梯曼(Reimer-Tiemann)反应
2020/8/3
2.酮也能与醇生成半缩酮或缩酮,反应相对困难;常用原甲酸酯在酸催化下与酮反 应来制备缩酮,例如:
2020/8/3
20
3. 环状缩醛或酮——有机合成中的保护基团
缩醛或酮结构特征,醚,对碱性条件、亲核 试剂稳定;将醛/酮羰基转换为缩醛或酮, 对碱性条件、亲核试剂稳定
2020/8/3
21
4. 亲核试剂的亲核能力,例如:氢氧根代替水做亲核试剂
第9章 醛和酮
2020/8/3
1
2020/8/3
2
1. 醛和酮的结构及命名 2. 羰基的结构、亲核加成反应概述,底物对亲核加成反应的影响 3. 羰基与含碳亲核试剂的加成,包括:与氢氰酸、格式试剂、炔负离子的反应
4. 羰基与含氧亲核试剂的加成,包括半缩醛(酮)、缩醛(酮),有机合成中的 保护和去保护
最常用的氧化剂: (1) 高锰酸钾 (2) 铬氧化剂
铬酸(适合于将仲醇氧化为酮 ) Collins试剂 [C5H5N] 2CrO3 in CH2Cl2 氯铬酸吡啶盐(PCC) 重铬酸吡啶盐(PDC) [C5H5NH] 2[Cr2O7]
2020/8/3
10
Swern氧化 Swern氧化的反应活性高,特别适合于有立体位阻的醇的氧化,但通常都需要在低 温下进行。 二甲基亚砜-二环己基碳二亚胺(DMSO-DCC);二甲基亚砜-乙酸酐 (DMSO-Ac2O); 二甲基亚砜-三氟乙酸酐[DMSO-(CF3CO)2O]; 二甲基亚砜-草酰氯
第九章 醛和酮

2 卤化-水解 4 加特曼-科赫反应
烯烃
炔烃
芳烃
醇
1 氧化 2 频哪醇重排
醛 酮
氧化
羧酸
取代
羧酸衍生物
还原
乙醛和丙酮的工业制备
一、羰基的亲核加成反应
1. 与氢氰酸加成(碱催化下)
R C (CH3)H O + H CN
OH-
R C (CH3)H
OH
H+
R C
OH COOH
CN
(CH3)H
α-羟基腈(氰醇)
RCH2OH
甲醛 伯醇
R
CH OH R1
R1
醛 仲醇
R1 RMgX +
H2O H
+
R
C OH 酮
叔醇
R2
该反应在有机合成中是增长碳链的方法。
5.与氨的衍生物加成—缩合反应
上式也可直接写成:
C O + H2 N Y C N Y + H2O
反应一般控制在弱酸性溶液(醋酸)中进行
Y: OH NH2 NH NH NO2 NO2
1、还原成醇
O H __ __ R C H( R ) OH R CH H( R )
__ __
(1)用金属氢化物还原 金属氢化物(NaBH4、 LiAlH4等)还原剂,具有选 择性,只还原羰基,不还原 C=C双键
CH3CH CHCHO
NaBH4
CH3CH CHCH2OH
(2)催化加氢 常用的催化剂是镍、钯、铂 产率高,选择性不强,不饱和基团同时被还原, 此法常用来制备饱和醇。
O O __ __ H R C__ H Ar C__ H
单酮 酮 混酮
酮分子中的羰基称为酮基。醛分子中的 称为醛基,醛基可以简写为—CHO。
有机化学第九章醛和酮
04
2-甲基丁醛
05
含羰基的最长碳链
06
使羰基的位次最小
07
复杂的醛酮用系统命名法
08
a
09
甲基丁醛
10
(2)脂肪酮按分子中碳原子数称某酮
1
2
3
4
5
4-甲基-2-戊酮
(3)不饱和醛酮要标出不饱和键位置
1
2
3
4
2-丁烯醛
1
3
4
3-戊烯-2-酮
2
5
2
1
苯乙醛
3-甲基环己酮
苯乙酮
环酮根据碳原子总数及所含羰基数 称为环某几酮
d+
d-
第三节 醛酮的化学性质
结构特点及反应类型
(一)亲核加成反应
-
+
亲核试剂Nu-
亲核加成反应
亲核试剂:
带负电荷或孤对电子
如:HCN,ROH 及氨的衍生物等
一些常见的亲核试剂
(一) 亲核加成反应
历程:
+
-
Nu-
慢
A+
快
动画模拟:亲核加成反应的机制
影响亲核加成反应的因素
(1)电子效应
▽酮羰基碳所带的正电性程度低 ▽连有两个烃基,空间位阻较大
烃基的斥电子效应和空间位阻增大
>
>
>
>
>
>
2
提高溶液的pH值
3
CNˉ浓度决定反应速度
1
如何提高此反应速度
4
羟基丙腈
1、加氢氰酸
加氢氰酸反应的用途
H2O H2O 增长碳链(多一个C)
醛、脂肪族甲基酮和8个碳以下的环酮
思考:芳香酮为什么不能反应?
2-甲基丁醛
05
含羰基的最长碳链
06
使羰基的位次最小
07
复杂的醛酮用系统命名法
08
a
09
甲基丁醛
10
(2)脂肪酮按分子中碳原子数称某酮
1
2
3
4
5
4-甲基-2-戊酮
(3)不饱和醛酮要标出不饱和键位置
1
2
3
4
2-丁烯醛
1
3
4
3-戊烯-2-酮
2
5
2
1
苯乙醛
3-甲基环己酮
苯乙酮
环酮根据碳原子总数及所含羰基数 称为环某几酮
d+
d-
第三节 醛酮的化学性质
结构特点及反应类型
(一)亲核加成反应
-
+
亲核试剂Nu-
亲核加成反应
亲核试剂:
带负电荷或孤对电子
如:HCN,ROH 及氨的衍生物等
一些常见的亲核试剂
(一) 亲核加成反应
历程:
+
-
Nu-
慢
A+
快
动画模拟:亲核加成反应的机制
影响亲核加成反应的因素
(1)电子效应
▽酮羰基碳所带的正电性程度低 ▽连有两个烃基,空间位阻较大
烃基的斥电子效应和空间位阻增大
>
>
>
>
>
>
2
提高溶液的pH值
3
CNˉ浓度决定反应速度
1
如何提高此反应速度
4
羟基丙腈
1、加氢氰酸
加氢氰酸反应的用途
H2O H2O 增长碳链(多一个C)
醛、脂肪族甲基酮和8个碳以下的环酮
思考:芳香酮为什么不能反应?
高考一轮复习第九章有机化学第5讲醛酮课件

④加热沸腾不能太久,否则会有黑
⑤乙醛用量不宜太多,一般加3滴;
⑥银镜可用稀HNO3浸泡洗涤除去
色沉淀,这是Cu(OH)2受热分解生 成CuO所致
(2)含有碳碳双键和醛基的有机物中官能团检验的顺序
①只要有机物的分子中含有—CHO,就能产生银镜反应,也能被新制 Cu(OH)2悬浊液氧化。
②银氨溶液或新制Cu(OH)2悬浊液为弱氧化剂,不能氧化碳碳双键, 但 溴 水 或 酸 性 KMnO4 溶 液 为 强 氧 化 剂 , 可 氧 化 —CHO , 故 应 先 检 验 — CHO,再检验碳碳双键。
解析:(1)因为柠檬醛中含碳碳双键和醛基,醛基具有还原性,也能被酸性 高锰酸钾溶液氧化,所以检验碳碳双键前先除去醛基,则选择银氨溶液, 将醛基氧化后,再选择酸性高锰酸钾溶液,若高锰酸钾溶液褪色,证明含 有碳碳双键,所以选择试剂的顺序是C、B。
(2)柠檬醛中含有 1 个醛基,与新制氢氧化铜反应生成砖红色沉淀,化学方程
1.香茅醛(
)可作为合成青蒿素的中间体,下列关于香茅醛的
叙述正确的是
()
A.分子式为 C10H20O
B.不能发生银镜反应
C.可使酸性 KMnO4 溶液、溴水褪色
D.与 H2 发生氧化反应
解析:由结构简式可知,香茅醛的分子式为C10H18O,A错;含有醛基, 可产生银镜反应,B错;与H2产生加成反应,属于还原反应,D错;含 有醛基和碳碳双键,可使酸性KMnO4溶液和溴水褪色,C正确。 答案:C
[注意] ①—CHO具有明显的还原性,能被酸性高锰酸钾溶液等强氧化剂氧 化为—COOH,故能使酸性高锰酸钾溶液褪色。②醛产生银镜反应或与新 制 的 Cu(OH)2 反 应 时 碱 必 须 过 量 , 酸 可 以 破 坏 两 种 试 剂 , 且 与 新 制 的 Cu(OH)2反应时应加热煮沸。
9第九章醛酮

OH CH3CH2 C CN CH3
HCl H2 O
CH3CH2
OH C COOH CH3
浓H2SO4 CH3CH C COOH
CH3
广东药学院
主讲人: 主讲人 申东升
有机玻璃制备: 有机玻璃制备:
OH O HCN CH3 C CH3 CH3 C CN CH3 71-78%
CH3OH
浓H2SO4
COOCH3
广东药学院
主讲人: 主讲人 申东升
9.1.1 醛和酮的结构
H
C
H C O
O
H
116.5o C H
121.7oBiblioteka OC HO
H
σ键
C=O 120pm C-H 110pm
π键
<HCO 121度 度 <HCH 111度 度
甲醛的分子结构
广东药学院 主讲人: 主讲人 申东升
9.1.2 醛和酮的命名
1、普通命名法 、
R C H(R') OR" OR" H+ H2O
R C H(R') O + 2 R"OH
广东药学院
主讲人: 主讲人 申东升
羰基化合物与醇反应的机理
R C H(R') O H+
R C H(R') OH
R
R"OH
OH C OR" H
亲核加成
R H2O H(R')
H(R')
R C H(R')
R C H (R')
甲基乙烯基(甲 酮 甲基乙烯基 甲)酮 (丁烯酮 丁烯酮) 丁烯酮
二苯甲酮
广东药学院
9第九章醛酮

甲基丙烯酸甲酯
CH2 C CH3
n
90%
过氧化苯甲酰
聚甲基丙烯酸甲酯
广东药学院
主讲人: 申东升
反应机理:Hຫໍສະໝຸດ NR C R'R C R' CN
OHH+
O +
H+ + CN
CN
-
slow
R C R'
OH
OCN
HCN fast
+ CN
只有醛、脂肪族甲基酮、8个碳以下的环酮 才可与氢氰酸反应。
广东药学院 主讲人: 申东升
广东药学院
缩醛缩酮对碱稳定,酸性中水解而不稳定
R C H(R') OR" OR" H+ H2O
R C H(R') O + 2 R"OH
广东药学院
主讲人: 申东升
羰基化合物与醇反应的机理
R C H(R') O H+
R C H(R') OH
R
R"OH
OH C OR" H
亲核加成
R H2O H(R')
(CH3)2C CHCH2CH2CHCH2CH(OC2H5)2 CH3
HOOCCH2CH2CHCH2CH(OC2H5)2 CH3 H2O HCl
KMnO4
HOOCCH2CH2CHCH2CHO CH3
广东药学院 主讲人: 申东升
高分子材料改性
CH2 CH2 CH OH CH n OH H2CO H
+
+
-
117
主讲人: 申东升
(b) 羰基的特性
(c)
CH2 C CH3
n
90%
过氧化苯甲酰
聚甲基丙烯酸甲酯
广东药学院
主讲人: 申东升
反应机理:Hຫໍສະໝຸດ NR C R'R C R' CN
OHH+
O +
H+ + CN
CN
-
slow
R C R'
OH
OCN
HCN fast
+ CN
只有醛、脂肪族甲基酮、8个碳以下的环酮 才可与氢氰酸反应。
广东药学院 主讲人: 申东升
广东药学院
缩醛缩酮对碱稳定,酸性中水解而不稳定
R C H(R') OR" OR" H+ H2O
R C H(R') O + 2 R"OH
广东药学院
主讲人: 申东升
羰基化合物与醇反应的机理
R C H(R') O H+
R C H(R') OH
R
R"OH
OH C OR" H
亲核加成
R H2O H(R')
(CH3)2C CHCH2CH2CHCH2CH(OC2H5)2 CH3
HOOCCH2CH2CHCH2CH(OC2H5)2 CH3 H2O HCl
KMnO4
HOOCCH2CH2CHCH2CHO CH3
广东药学院 主讲人: 申东升
高分子材料改性
CH2 CH2 CH OH CH n OH H2CO H
+
+
-
117
主讲人: 申东升
(b) 羰基的特性
(c)
医学生物化学第九章 醛(aldehyde)和酮(ketone)

第九章
醛(aldehyde)和酮(ketone)
醛(aldehyde)和酮(ketone)是分子中含有羰基 (carbonyl group)官能团的有机物。羰基至少和一个 氢原子结合的为醛(-CHO又叫醛基), 羰基和两个烃 基结合的为酮。 羰 基
O O H C H R C H
O - C- Carbonyl group
快 (R')H
反应活性取决于:
亲核试剂性质;羰基碳正电性大小;空间位阻大小。 亲核反应活性:(p.154问题9-2) HCHO> CH3CHO> C6H5CHO> CH3COC6H5> C6H5COC6H5
9
1. 加HCN ( 醛、脂肪族甲基酮、八碳以内的环酮 )
O R C H + HCN
+
OH R C H CN
1-苯基-2-丁酮
1-phenylbutanone
2-甲基-1,3-环戊二酮
3-丁烯酮
2-methyl –1,3 –cyclopentanedione 3–butenone
3. 俗名
第二节
一、结构
醛、酮的结构及其物理性质
O
121.7o
C
121pm
H
116.6o
H
平面分子
羰基碳为sp2杂化,碳原子的3个sp2杂化轨道分别与氧及其 它2个原子形成 3个σ 键,这 3个σ 键处于一个平面,羰基碳余 下的1个未杂化的 p 轨道与氧的 2p 轨道彼此平行重叠,形成π 键。
O CH3CH2CH2CH2CH
稀酸
Ni CH3(CH2)3CH(OCH3)2
13
(2)水与醛、酮的羰基加成:
偕二醇,不稳定。
醛(aldehyde)和酮(ketone)
醛(aldehyde)和酮(ketone)是分子中含有羰基 (carbonyl group)官能团的有机物。羰基至少和一个 氢原子结合的为醛(-CHO又叫醛基), 羰基和两个烃 基结合的为酮。 羰 基
O O H C H R C H
O - C- Carbonyl group
快 (R')H
反应活性取决于:
亲核试剂性质;羰基碳正电性大小;空间位阻大小。 亲核反应活性:(p.154问题9-2) HCHO> CH3CHO> C6H5CHO> CH3COC6H5> C6H5COC6H5
9
1. 加HCN ( 醛、脂肪族甲基酮、八碳以内的环酮 )
O R C H + HCN
+
OH R C H CN
1-苯基-2-丁酮
1-phenylbutanone
2-甲基-1,3-环戊二酮
3-丁烯酮
2-methyl –1,3 –cyclopentanedione 3–butenone
3. 俗名
第二节
一、结构
醛、酮的结构及其物理性质
O
121.7o
C
121pm
H
116.6o
H
平面分子
羰基碳为sp2杂化,碳原子的3个sp2杂化轨道分别与氧及其 它2个原子形成 3个σ 键,这 3个σ 键处于一个平面,羰基碳余 下的1个未杂化的 p 轨道与氧的 2p 轨道彼此平行重叠,形成π 键。
O CH3CH2CH2CH2CH
稀酸
Ni CH3(CH2)3CH(OCH3)2
13
(2)水与醛、酮的羰基加成:
偕二醇,不稳定。
第九章 醛酮

第六页,编辑于星期一:一点 四十四分。
2、系统命名法
选择含羰基的、支链最多的最长碳链为主链,位 码最小的给羰基碳。
C H 3C H 2C H 2C H C H 2C H C H 2C H O
C H 3 C 2H 5 5-甲基-3-乙基辛醛
C H 3C HC H C H O
2-丁烯醛(巴豆醛)
CH3CHCH2CCH3 CH3 O
C H 3 C O P h + P h C H 2 M g C l无 水 乙 醚 PhCH2
CH3 C OMgCl
Ph
H2O
CH3 PhCH2 COH
NH4Cl
Ph 92%
第二十八页,编辑于星期一:一点 四十四分。
(2) 与炔钠
制炔醇
O+H CC -N a+液 N H 3 H + 33o CH 2O
分类
▪ 按分子中的烃基及羰基数目来分类: ▪ 1. 按分子中烃基种类
第四页,编辑于星期一:一点 四十四分。
▪ 2. 按分子中羰基数目
▪ ① 一元醛酮 只含一个羰基
▪
如:丙醛、丙酮
▪ ② 二元醛酮 含两个羰基
▪
如:丁二醛、戊二酮
▪ ③ 多元醛酮 含三个以上羰基
第五页,编辑于星期一:一点 四十四分。
OH OR" H
R C
H(R')
OH2 OR"
R H2O C OR"R"OH
H(R')
亲核取代
R C H OR"
H+
R
OR" C
OR" H(R')
OR" H (R')
2、系统命名法
选择含羰基的、支链最多的最长碳链为主链,位 码最小的给羰基碳。
C H 3C H 2C H 2C H C H 2C H C H 2C H O
C H 3 C 2H 5 5-甲基-3-乙基辛醛
C H 3C HC H C H O
2-丁烯醛(巴豆醛)
CH3CHCH2CCH3 CH3 O
C H 3 C O P h + P h C H 2 M g C l无 水 乙 醚 PhCH2
CH3 C OMgCl
Ph
H2O
CH3 PhCH2 COH
NH4Cl
Ph 92%
第二十八页,编辑于星期一:一点 四十四分。
(2) 与炔钠
制炔醇
O+H CC -N a+液 N H 3 H + 33o CH 2O
分类
▪ 按分子中的烃基及羰基数目来分类: ▪ 1. 按分子中烃基种类
第四页,编辑于星期一:一点 四十四分。
▪ 2. 按分子中羰基数目
▪ ① 一元醛酮 只含一个羰基
▪
如:丙醛、丙酮
▪ ② 二元醛酮 含两个羰基
▪
如:丁二醛、戊二酮
▪ ③ 多元醛酮 含三个以上羰基
第五页,编辑于星期一:一点 四十四分。
OH OR" H
R C
H(R')
OH2 OR"
R H2O C OR"R"OH
H(R')
亲核取代
R C H OR"
H+
R
OR" C
OR" H(R')
OR" H (R')
有机化学-第九章醛酮醌

2、低级醛有刺鼻的气味,中级醛(C8~C13)则有 果香。
3、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。
4、低级醛酮易溶于水,醛酮都能溶于水。丙酮能 溶解很多有机化合物,是很好的有机溶剂。
二、 醛酮的化学性质
1、 加成反应
• 烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
(1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)。
反应机理
O
H+ +OH
R-C-R'
R-C-R'
OH
R-C-R'
+
-H+ O R"COO-H
OH R-C-R'
O-OCR" O
R
O
R' C
O O
H
O
C R"
R’重排 O-O键断裂 -R”COO- , -H+
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物; 如:NH2-CH2-CH2-CO-CH3,就不能用此方法,
含有-NO2也被同时还原。 • 武尔夫-克日聂尔-黄鸣龙反应——适用对碱不敏感的
化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
• 由于醛基直接连在芳环上的芳醛都没有氢原子, 所以可以用坎尼扎罗反应来制备芳香族醇:
二、烃基的反应
1、α-氢原子的卤代反应
3、低级醛酮的沸点比相对分子量相近的醇低。 (分子间无氢键)。
4、低级醛酮易溶于水,醛酮都能溶于水。丙酮能 溶解很多有机化合物,是很好的有机溶剂。
二、 醛酮的化学性质
1、 加成反应
• 烯烃的加成一般为亲电加成; • 醛酮的加成为亲核加成,易于HCN、NaHSO3、ROH、 RMgX等发生亲核加成反应。
(1)一般过酸 + 无机强酸(H2SO4) (2)强酸的过酸 :CF3COOOH (3)一般酸 + 一定浓度的过氧化氢(产生的过酸立即反应)。
反应机理
O
H+ +OH
R-C-R'
R-C-R'
OH
R-C-R'
+
-H+ O R"COO-H
OH R-C-R'
O-OCR" O
R
O
R' C
O O
H
O
C R"
R’重排 O-O键断裂 -R”COO- , -H+
(1)碳碳双键加成
2,3,5,6-四溴环己二酮
注意:两种方法的适用范围
• 克莱门森还原——适用对酸不敏感的化合物; 如:NH2-CH2-CH2-CO-CH3,就不能用此方法,
含有-NO2也被同时还原。 • 武尔夫-克日聂尔-黄鸣龙反应——适用对碱不敏感的
化合物; 如:含有羧基等就不行。
补充:
-CO,-NO2均 还原!
用HCl,可使 之变为酚!
• 由于醛基直接连在芳环上的芳醛都没有氢原子, 所以可以用坎尼扎罗反应来制备芳香族醇:
二、烃基的反应
1、α-氢原子的卤代反应
有机化学 第9章 醛和酮

R CH2OH
R' R CHOH R' R COH R"
伯醇 仲醇 叔醇
(5)与氨衍生物的加成缩合
氨及其衍生物是含氮的亲核试剂,可与羰基加成, 氨及其衍生物是含氮的亲核试剂,可与羰基加成, 再分子内失去一分子水形成碳氮双键 再分子内失去一分子水形成碳氮双键
+ δ
C
.. O + HN Y 2
δ
_
C NH2 Y _ O
CH3CH2CHCHO CH3
2-甲基丁醛
CH3CH CHCHO
2-丁烯醛(巴豆醛) 丁烯醛(巴豆醛)
CH2CH2CHO
3-苯基丙醛
注意醛基的写法: 注意醛基的写法:
右端:CHO 右端 左端: 左端:OHC
O 7 6 5 4 3 2 1 CH3CH2CHCH2C CH2CH3 CH3
O3 4 5 CH3 CCH2CH CH2
课堂练习: 课堂练习 1. 比较下列化合物和 比较下列化合物和HCN加成反应的速度 加成反应的速度
CH3CHO CH3CH2CHO CH3COCH3 CH3CH2COCH2CH3
2. 以丁酮为原料,合成 甲基 羟基丁酸 以丁酮为原料,合成2-甲基 甲基-2-羟基丁酸
O CH2CH2CCH3 HCN CH2CH2CCH3 CN OH H3O+ OH CH2CH2CCH3 COOH
α-羟基磺酸钠
适应于: 适应于: 脂肪族甲基酮和八个碳以下的环酮。 醛、脂肪族甲基酮和八个碳以下的环酮。
CH3CHO 89% CH3COCH3 56% CH3COCH2CH3 36% 35% O
CH3COCH(CH3)2 CH3COC(CH3)3 H5C2COC2H5 CH3COPh 12% 6% 2% 1%
第九章 醛酮

H3C C O H
第31页,共64页。
第32页,共64页。
第33页,共64页。
氧化还原反应
⑴ 氧化反应 醛/酮的最主要区别是对氧化剂的敏感性,因为醛中
羰基碳上的氢很容易被氧化为羧酸,甚至可被空气氧化 ;酮则要难得多,往往需要更强的氧化剂。醛常用的氧
化性试剂有:托伦(Tollens)试剂和费林(Fehling)试剂
OO
CH3CCH CHCH3
CH3CCH2CCH3
第5页,共64页。
命名
1. 系统命名法
• 以醛、酮为母体,选择含羰基的最长的碳链为主链。 • 编号时使羰基位次最小。标出羰基的位置(醛基不标).
CH3CHO
乙醛
CH3 CH3CHCHO
2-甲基丙醛
CH3COCH3 丙酮
第6页,共64页。
CH3COCH2CH3
此类反应,多出现在推 结构等题中出现
第24页,共64页。
与醇加成
•在无水醇中通入HCl气体或其他无水强酸,则在酸的催化下, 醛能与一分子醇加成,生成半缩醛。半缩醛不稳定,可以和另 一分子醇进一步缩合,生成缩醛:
第25页,共64页。
半缩醛反应历程:
质子化
• 半缩醛在酸催化下,可以失去一分子水,形成一个碳正 离子,然后再与另一个醇作用,最后生成稳定的缩醛:
第26页,共64页。
第27页,共64页。
• 缩醛对碱和氧化剂都相当稳定。由于在酸催化下生成缩醛的反应是
可逆反应,故缩醛可以水解成原来的醛和醇:
• 在有机合成中常利用缩醛的生成和水解来保护醛基。
• 醛与二元醇反应生成环状缩醛:
第28页,共64页。
• 酮也能与醇生成半缩酮或缩酮,但反应较为困难。而酮和 1,2-或1,3-二元醇比较容易生成环状缩酮:
第九章 醛酮-05.26

H C H
H
O
H C O
碳氧σ 碳氧σ键
π键 键
2. 极性
氧原子的电负性(3.5)比碳原子(2.5)大 氧原子的电负性(3.5)比碳原子(2.5)大,且 比碳原子(2.5) 电子云易流动,氧原子一边的电子云密度大, π电子云易流动,氧原子一边的电子云密度大, 故碳氧双键是极性不饱和键. 故碳氧双键是极性不饱和键.
>
C =O >
C =O
>
C =O >
C =O
对于芳香族醛、酮而言: 对于芳香族醛、酮而言:
O2N CHO > CHO > CH3 CHO
范围: 范围:醛、位阻较小的甲基酮、或低级环酮(C8以下) 位阻较小的甲基酮、或低级环酮( 以下)
1.与 1.与HCN的加成 的加成 反应机理: 反应机理: HCN
应用-保护羰基 应用 保护羰基
例:由原料 CH2=CHCHO 合成
CH2CHCHO OH OH
2C
CH2=CHCHO
OC2H OC2H55 [ O ] H5OH 2 CH22=CH CH =CHCH 无水HCl OC H OC2H5 2 5
CH2 OH
CHCH OH
OC2H5 OC2H5
H ,H2O CH2 OH
半缩醛( 不稳定) 半缩醛(酮)(不稳定)
OR'' R C
无水HCl 无水+ HCl
OH + H OR"
H
OR'' OR'' + H2O
R C
H (R')
H (R') 缩醛 酮) 缩醛(酮
(对碱、氧化剂、还原剂稳定) 对碱、氧化剂、还原剂稳定)
H
O
H C O
碳氧σ 碳氧σ键
π键 键
2. 极性
氧原子的电负性(3.5)比碳原子(2.5)大 氧原子的电负性(3.5)比碳原子(2.5)大,且 比碳原子(2.5) 电子云易流动,氧原子一边的电子云密度大, π电子云易流动,氧原子一边的电子云密度大, 故碳氧双键是极性不饱和键. 故碳氧双键是极性不饱和键.
>
C =O >
C =O
>
C =O >
C =O
对于芳香族醛、酮而言: 对于芳香族醛、酮而言:
O2N CHO > CHO > CH3 CHO
范围: 范围:醛、位阻较小的甲基酮、或低级环酮(C8以下) 位阻较小的甲基酮、或低级环酮( 以下)
1.与 1.与HCN的加成 的加成 反应机理: 反应机理: HCN
应用-保护羰基 应用 保护羰基
例:由原料 CH2=CHCHO 合成
CH2CHCHO OH OH
2C
CH2=CHCHO
OC2H OC2H55 [ O ] H5OH 2 CH22=CH CH =CHCH 无水HCl OC H OC2H5 2 5
CH2 OH
CHCH OH
OC2H5 OC2H5
H ,H2O CH2 OH
半缩醛( 不稳定) 半缩醛(酮)(不稳定)
OR'' R C
无水HCl 无水+ HCl
OH + H OR"
H
OR'' OR'' + H2O
R C
H (R')
H (R') 缩醛 酮) 缩醛(酮
(对碱、氧化剂、还原剂稳定) 对碱、氧化剂、还原剂稳定)
有机化学-第九章 醛 酮 醌

A CH3CH2CHO + CH3MgBr
B CH3CHO + CH3CH2MgBr
分别由苯及甲苯合成2-苯基乙醇
CH
3
Cl 2 光照 Br Br
2
CH 2 Cl
Mg Et 2 O
CH 2 MgCl
1 ) HCHO 2) H +
CH 2 CH 2 OH
MgBr O Mg Et 2 O H
+
Fe
H 2O
N u· ·
-
δ+
δ-
加成
+
C
O
Nu
C
O
-
进一步反应
产物
氧亲核试剂——RO-,OH硫亲核试剂——SO3H-,RS氮亲核试剂——RNH2,HONH2,RNHNH2
碳亲核试剂——CN-,RMgX
(1) 加氢氰酸: 醛、脂肪族甲基酮、8个碳以下的环酮可以和HCN加成, 生成α-羟基腈。 α-羟基腈水解得α-羟基酸。
羟胺
OH
- H 2O R
[R
C R
NH
OH] R
C
N
OH
肟
R C R O + NH2 NH2
R C R N NH2
肼
腙
R C R O + NH2 N H C 6H 5
R C R N N H C 6H 5
苯肼
R C R O + NH2 NHCONH 2 R R
苯腙
C
N
NHCONH2
氨基脲
缩氨脲
这类反应一般在pH = 5的条件下进行。
醛酮互为同分异构体
(碳数相同的一元饱和醛酮有相同的通式CnH2nO) 醛有碳链异构、酮有碳链异构和官能团位置异构。
B CH3CHO + CH3CH2MgBr
分别由苯及甲苯合成2-苯基乙醇
CH
3
Cl 2 光照 Br Br
2
CH 2 Cl
Mg Et 2 O
CH 2 MgCl
1 ) HCHO 2) H +
CH 2 CH 2 OH
MgBr O Mg Et 2 O H
+
Fe
H 2O
N u· ·
-
δ+
δ-
加成
+
C
O
Nu
C
O
-
进一步反应
产物
氧亲核试剂——RO-,OH硫亲核试剂——SO3H-,RS氮亲核试剂——RNH2,HONH2,RNHNH2
碳亲核试剂——CN-,RMgX
(1) 加氢氰酸: 醛、脂肪族甲基酮、8个碳以下的环酮可以和HCN加成, 生成α-羟基腈。 α-羟基腈水解得α-羟基酸。
羟胺
OH
- H 2O R
[R
C R
NH
OH] R
C
N
OH
肟
R C R O + NH2 NH2
R C R N NH2
肼
腙
R C R O + NH2 N H C 6H 5
R C R N N H C 6H 5
苯肼
R C R O + NH2 NHCONH 2 R R
苯腙
C
N
NHCONH2
氨基脲
缩氨脲
这类反应一般在pH = 5的条件下进行。
醛酮互为同分异构体
(碳数相同的一元饱和醛酮有相同的通式CnH2nO) 醛有碳链异构、酮有碳链异构和官能团位置异构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO < CO < CO
H
C H 3
C H 3
甲基的超共轭作用使羰基碳上的正电荷分散
醛酮水合物的稳定性
H C O H > C H 3C O H > C H 3C O H
HO H HO H C H 3 O H
水合物 醛酮越稳定,水合物越难形成; 烷基的位阻
广东药学院
主讲人: 申东升
C l HC
H C
加碱可大大促进本反应。
广东药学院
主讲人: 申东升
O
OH
C H 3C H 2 CC H 3H C NCH3CH2 C CN
CH3
氰醇可用来合成羟基酸:
OH CH3CH2 C CN
OH
HCl
H 2 O CH3CH2 C COOH CH3
CH3
浓 H 2 S O 4 CH3CH C COOH CH3
广东药学院
由于“吊白块”的强还原性能将食品中的有色物质漂 白,具有保鲜作用,但吊白块”不能作为食用添加剂使用 ,摄入10g即可致人死亡。
不法分子不惜损害广大消费者的身心健康利益,对《中 华人民共和国食品卫生法》熟视无睹。
广东药学院
主讲人: 申东升
3. 与金属有机试剂的加成
(1) 与格氏试剂生成醇
H 2 C O +
9第九章醛酮
9.1 一元醛酮的结构和命名
O
羰基:
C
醛:
O
醛基
RC H
酮:
酮基
O
R C R'
广东药学院
主讲人: 申东升
1. 与HCN的加成
CO
R C O+HCN
H (CH3)
醛或酮
氢氰酸
反应的第1步是带负 电荷的粒子加到带正电 荷的碳原子上。
因此叫亲核加成。
R
OH
C
H
CN
(CH3)
羟基腈(氰醇)
O 亚硫酸氢钠
R
O-Na+
C OH
S
H (CH3)
O
O
R
OH
C O-Na+
H (CH3)
S OO
R C
H (CH3)
OH SO3-Na+
亚硫酸氢钠加合物(白色固体)
广东药学院
主讲人: 申东升
醛酮结构对亚硫酸加合物形成的影响
羰基旁的位阻对反应影响特别大。
C H 3 C H OC H 3 C O C H 3 C H 3 C O C H 2 C H 3
M g C l无 水 乙 醚
H2O
CH2OM gCl H2SO4
CH2OH 64-96%
C H 3 C O P h + P h C H 2 M g C l无 水 乙 醚 PhCH2
CH3 C OMgCl
H2O NH4Cl
PhCH2
CH3 C OH Ph 92%
Ph
Grignard: 1912 Nobel Prize
H 2O
HO
C l
H
HC CH
H O H
氯的吸电子作用,使羰基物不稳定,形成水合物后稳定
O
H 2 O
H O O H
环丙酮不稳定,形成水合物后,张力降低而稳定(SP2—SP3)
广东药学院
主讲人: 申东升
O C
CO C O
茚三酮
OH CO
C CO OH
茚三酮水合物
3个带正荷的羰基碳挤在一起不稳 定,形成水合物后电荷间的拆力减小
广东药学院
主讲人: 申东升
(2) 与炔钠
制炔醇
O+H CC -N a+液 N H 3 H + 33o CH 2O
C CH OH 65-75%
炔醇水解制甲基酮
CC H H gSO 4 / H 2SO 4
O H H 2O
O
CC H 3
O H
广东药学院
主讲人: 申东升
4. 加水
醛酮的稳定性
H
H
C H 3
O
8 9 % 5 6 % 3 6 %
3 5 %
C H 3 C O C H ( C H 3 ) 2 C H 3 C O C ( C H 3 ) 3H 5 C 2 C O C 2 H 5C H 3 C O P h
1 2 % 6 %
2 % 1 %
只有醛、脂肪族甲基酮、8个碳以下的环酮 才可与亚硫酸氢钠反应。
广东药学院
主讲人: 申东升
酸或碱可使亚硫酸加合物分解
OH
R C SO3Na H(CH3)
晶体
O
RC
+NaHSO3
H
N a2SO 3+N aH C O 3N a 2 C O 3 SO2 +H2O+NaCl H C l
本反应可用于鉴别、纯化和分离醛和酮。
广东药学院
主讲人: 申东升
经亚硫酸氢钠加合物可与氰化钠的 反应生成羟基酸(间接法)。
CHONaHSO3
OH NaCN CH
SO3Na
OH
CH
H2O
CN HCl
避免使用剧毒HCN
OH CH
COOH 67%
广东药学院
主讲人: 申东升
“吊白块”的化学名称是甲醛亚硫酸氢钠(甲醛与亚硫
酸氢钠的加合物),分子式NaHSO2·CH2O·2H2O,是一种半 透明白斜方晶系结晶或小块。易溶于水,微溶于醇,具有 极强的还原性,能使所染之色消失,因此常用于印染工业 作为漂白剂。无水吊白块很稳定,但是在高温、高湿、酸 性环境下即可分解,分解产生甲醛、二氧化硫等有毒气体, 而且甲醛是细胞原浆毒,能使蛋白质凝固。
广东药学院
主讲人: 申东升
5. 与醇的加成
R
H + R
O H
C O+H O R "
C
H (R ')
H (R ') O R "
醛酮
醇
半缩醛(酮)
只有少数半缩醛和环状半缩醛才是比较稳定的。
H+
CHO
OH
O OH
R H (R ')CO O H R " +H O R "H +R H (R ')CO O R R " "+H 2 O
半缩醛(酮)
缩醛(酮)
广东药学院
主讲人: 申东升
CHO
H2SO4 CH(OCH3)2
+ 2CH3OH
NO2
NO2
C H 3 C O C H 3 + H C ( O C 2 H 5 ) 3 H + H 3 C C O C 2 H 5+ H C O O C 2 H 5 H 3 CO C 2 H 5
O+H O C H 2 TsO H H O C H 2
O
O 80-85%
+H2O
广东药学院
主讲人: 申东升
缩醛缩酮对碱稳定,酸性中水解而不稳定
H+
R
slow R
C O + CN-
R'
R'
O- HCN C CN fastN-
R'
CN
只有醛、脂肪族甲基酮、8个碳以下的环酮 才可与氢氰酸反应。
广东药学院
主讲人: 申东升
2. 与NaHSO3的加成
醛酮与40%饱和亚硫酸氢钠作用得其固体加合物。
R
HO O-Na
CO+ S
H (CH3)
主讲人: 申东升
有机玻璃制备:
O
OH
CH3
C CH3HCN
CH3
C CN CH3
CH3OH 浓H2SO4
71-78%
CH2 C COOCH3 (PhCOO)2 CH3
90%
甲基丙烯酸甲酯
过氧化苯甲酰
COOCH3
CH2 C
n
CH3
聚甲基丙烯酸甲酯
广东药学院
主讲人: 申东升
反应机理:
OHHCN
H+
+CN-
