DNS氨基酸的双向讲义聚酰胺薄膜层析
聚酰胺薄膜层析法分离氨基酸——DNS-Cl法 实验报告

生物化学实验报告
题目:聚酰胺薄膜层析法分离氨基酸——DNS-Cl法
姓名:余振洋学号:200900140156系年级:09级生科3班
查阅资料得到以下几条结论:
1. DNS-丙氨酸的相对分子质量体积最小,非极性最强,形成氢键最弱,展层速度最快,因而在最上方;而Lys由于与聚酰胺表面形成2个氢键,极性强,所以展层速度慢;Phe的极性处于两者之间,因而展层速度也在两者之间。所以本实验的结果主要与氨基酸的极性和所形成的氢键有关。
2.聚酰胺薄膜层析是一类特殊的分配层析。混合物随展层液通过聚酰胺薄膜时,由于被分离氨基酸与薄膜形成氢键,而各氨基酸形成氢键的能力不同,决定吸附力的差异,吸附力强,展层速度慢,吸附力弱,展层速度快。导致所展示的层析结果。
2. 展层速度要快,单析( 7×7cm )一般只需 15 -20min。
3. 不会将氨基酸或者聚酰胺薄膜破坏,影响其实验结果。
4.被分离物质在溶剂与聚酰胺薄膜表面之间的分配系数有差异。
5.展层剂的组成应该是固定的,因此配制时各组分比例要正确。
6.展层剂的纯度要注意,一般溶剂采用分析纯试剂即可,必要时可精制后使用。
同组者:张刚刚时间:2011/4/16
一.【实验目的】
1.了解并掌握DNS-氨基酸制备和鉴定的原理及方法。
2.掌握聚酰胺薄膜层析法分离氨基酸的操作和方法。
二.【实验原理】
荧光试剂5-二甲氨基-1-萘磺酰氯(5-dimethylamino-1-naphthylene sulfonyl chloride,Dansyl ch1oride,简称DNS-Cl)在弱碱性(pH9.0 左右)条件下可与氨基酸的α-氨基反应,生成带黄色荧光的 DNS- 氨基酸。
生化实验三 Dansyl—氨基酸的聚酰胺薄膜层析法

实验四Dansyl—氨基酸的聚酰胺薄膜层析法实验目的1.学习聚酰胺薄膜层析法的原理。
2.学习利用Dansyl—氨基酸分析蛋白质N末端氨基酸及蛋白质组成的原理。
3.掌握制备Dansyl氨基酸和聚酰胺薄膜层析法的操作和方法。
实验原理聚酰胺是一类化学纤维原料,又称锦纶或尼龙。
它对许多极性化合物有吸附作用,具有特异的分辨性能,可用于柱层析、薄层层析及薄膜层析。
聚酰胺薄膜是将锦纶涂布于涤纶片上,形成质地均匀的紧密的多孔薄膜,层析性能十分优良。
聚酰胺的化学结构如右。
由于聚酰胺的—C=O基及—NH基可与被分离物质形成氢键,因此可以吸附酸类、酚类、醌类、硝基及胺基化合物等。
由于各种物质与聚酰胺形成氢键的能力不同,即聚酰胺对各种物质的吸附能力不同。
而在层析过程中,展层溶剂与被分离物质在聚酰胺表面竞相形成氢键。
因此,选择适当的层层溶剂,可使各种待分离物质在聚酰胺表面与溶剂之间有不同的分配系数,经过吸附与解吸附的展层过程,各自按一定次序分离开来。
与纸层析及纸电泳等方法相比,聚酰胺薄膜层析在分析氨基酸衍生物时具有灵敏度高、分辨力强、速度快、操作方便等优点。
除用于氨基酸衍生物的分析外,还可用于碱基、核苷酸、核苷、酚类、酚类糖苷、硝基化合物、杂环化合物、环酮、抗菌素、磺胺、合成染料等十几类化合物。
荧光试剂Dansyl—C1(二甲基氨基萘磺酰氯)可与氨基酸结合成带有荧光的Dansyl —氨基酸。
Dansyl—氨基酸在酸性条件下可被乙酸乙酯萃取出来,经聚酰胺薄膜层析后斑点集中,仅10—9至10—10克分子即可被检识,所以灵敏度很高。
用作蛋白质末端基分析,比DNP氨基酸纸层析法灵敏度高100倍;用于氨基酸组成的微量分析,比茚三酮显色法灵敏度高10多倍。
聚酰胺薄膜层析的展层速度也比纸层析快得多,单向层层7厘米只需15—20分钟。
但用于定量,需要特殊仪器,目前多用于定性鉴定。
Dansyl—C1能与所有的氨基酸作用生成具荧光的衍生物。
生物化学实验一 氨基酸聚酰胺薄膜层析DNS-Cl法

实验一氨基酸聚酰胺薄膜层析DNS-Cl法13生物基地 201300140059 刘洋 2015-03-24同组者:张奕一、实验目的1.了解并掌握DNS-氨基酸的制备和鉴定。
2.掌握制备Dansyl氨基酸和聚酰胺薄膜层析法的操作和方法。
二、实验原理荧光试剂5-二甲氨基-1-萘磺酰氯(dansyl-Cl,简称DNS-Cl)在弱碱性条件(pH9.0左右下与氨基酸(肽或蛋白质)的α-氨基结合成带有黄绿色荧光的DNS-氨基酸:其中赖氨酸、组氨酸、酪氨酸、天冬酰胺等氨基酸可生成双DNS-氨基酸衍生物。
这些衍生物相当稳定,可用于蛋白质的氨基酸组成的微量分析,灵敏度可达10-10~10-9mol,比茚三酮法高10倍以上,比过去常用的FDNB法高100倍。
将Edman法和DNS法结合起来(称为Edman-DNS法)应用于蛋白质结构的序列分析上作,可以提高Edman法的灵敏度及其分析速度。
DNS-Cl在pH过高时,水解产生副产物DNS-OH:在DNS-Cl过量时,会产生DNS-NH2:DNS-氨基酸在紫外光照射下呈现黄绿色荧光,而DNS-OH和DNS-NH2产生蓝色荧光,可彼此区分开。
DNS-氨基酸可用聚酰胺薄膜层析法进行分离和鉴定,在薄膜上检测灵敏度为0.01ug。
由于它具有灵敏度高,分辨力强,快速,操作方便等优点,已被广泛应用于各种化合物的分析工作中。
层析法是利用混合物中各组分物理化学性质的差异(如吸附力、分子形状及大小、分子亲和力、分配系数等),使各组分在两相(一相为固定的,称为固定相;另一相流过固定相,称为流动相)中的分布程度不同,即各组分所受的固定相的阻力和流动相的推力影响不同,从而使各组分以不同的速,从度移动而达到分离的目的。
聚酰胺是—类化学纤维原料,由己二酸与己二胺聚合而成,又称锦纶66 。
因这类物质的分子中都含有大量酰胺基团,故统称聚酰胺。
它对很多极性物质有吸附作用,这是由于聚酰胺的—C=O及>NH基能与被分离物质之间形成氢键。
氨基酸分离双向层析法

2. 依据“相似相溶”的原理,极性大(和带电荷) 水相中溶解度较大,而非极性大的AA在 的AA在水相 水相 有机相中溶解度较大。 有机相 由于滤纸纤维吸收了大量水份,可被视为“水 水 相”,而“第一相”(和“第二相”)则为 “有机相 有机相”。 有机相 这样,“极性大”的AA(如1.His组 2.Asp天冬 组 天冬 3.Ser丝)因在水相中溶解度较大,则易被水相 丝 (即滤纸)“拖住”,走不远。而“非极性大” 的AA(如7. Phe苯丙 8. Leu亮)因在有机相 苯丙 亮 中溶解度较大,则易被有机相“拖住”往上方 行走,走得远。
3. 整个操作过程要戴手套进行。 4. 点样斑点不可过大。 5. 滤纸卷成筒状,用铬丝相连,不可重叠相碰。
思考题 1.为什么展层时要用两种溶剂系统?
比移值Rf
原点至纸层析斑点中心 点的距离 原点至溶剂前沿的距离
Rf =
本实验采用八种混合氨基酸为样品, 本实验采用八种混合氨基酸为样品,用酸 性和碱性两种溶剂进行双向层析, 性和碱性两种溶剂进行双向层析,以茚三酮为 显色剂,可获得分离清晰的层析图谱。 显色剂,可获得分离清晰的层析图谱。
注意要点 1. 原文只用一张滤纸,在原点处点样(混合氨 原文只用一张滤纸,在原点处点样( 溶剂先沿Y 记酸 ) 后 , 溶剂先沿 轴方向自下而上展开 走第一相” 此后,滤纸旋转90度 (“走第一相”);此后,滤纸旋转 度,再 沿 X轴方向自下而上展开以使混合氨基酸被完 轴方向自下而上展开以使混合氨基酸被完 全拉开而分离( 走第二相” 全拉开而分离 ( “ 走第二相 ” ) 。 我们增加两 张滤纸(B只“走第一相”和C只“走第二相”) 张滤纸( 只 走第一相” 只 走第二相” 分别作为A走第一相和走第二相的对照 走第一相和走第二相的对照。 分别作为 走第一相和走第二相的对照。在B和 和 C的X轴和 轴上依此点上 轴和Y轴上依此点上 号单个氨记酸。 的 轴和 轴上依此点上1~8号单个氨记酸。 号单个氨记酸 1. His 2.Asp 3.Ser 4. Ala 5. Pro 6. Val 7. Phe 8. Leu
DNS-氨基酸的制备和鉴定

DNS-氨基酸可用聚酰胺薄膜层析法分离,所得层析图与 DNS-标准氨基酸层析图 谱相对比,可借此鉴定样品中氨基酸的种类,用此法鉴定蛋白质 N-端氨基酸比 FDNB 法灵敏 100 倍,仅10−10 ~10−9 mol 样品即可检出,产物也比 DNP-氨基酸稳 定,且操作简便、快速。 DNS-Cl 在 pH 过高时,水解产生副产物 DNS-OH,反应式如下:
DNS-氨基酸的制备和鉴定
刘翌 151140039
一、实验原理
1、聚酰胺是一类化学原料,又称锦纶(或尼龙) 。本实验所用的聚酰胺材料是已 二酸和乙二胺聚合成的锦纶 66,这类高分子物质中含有大量酰胺基团,故称为 聚酰胺。 聚酰胺薄膜是在涤纶片基上涂上一层锦纶薄膜制成。毛面是锦纶,作为点样 面;光面是涤纶。 聚酰胺对很多极性物质具有吸附作用, 这是由于聚酰胺的-C=O 及-NH 能与被 分离物质的一定基团之间形成氢键,如酚类(包括黄酮类、鞣质等)和酸类(如 核苷酸、氨基酸等)是羟基与酰胺键的羰基形成氢键;硝基化合物和醌类等物质 与酰胺键的氨基形成氢键。 被分离物质形成氢键能力的强弱,决定吸附能力的差 异。 2、荧光试剂 5-二甲氨基-1-萘磺酰氯(DNS-Cl)在弱碱性(pH9.0 左右)条件下 可与氨基酸的 α -氨基反应,生成带黄绿色荧光的 DNS-氨基酸。
五、实验结果
前沿
DNS-Phe
DNS-Gly
DNS-His( α )
DNS-His( ε )
DNS-OH
(bis)DNS -His
颜色
第一向(cm)
—— 5.20 —— 5.40 ——
黄绿色 黄绿色 3.20 0.615 1.00 0.185 1.65 0.317 2.40 0.444
绿色 0.55 0.106 4.95 0.917
实验2氨基酸分离——双向层析法

实验2 氨基酸分离——双向层析法目的要求(1) 学习双向纸层析的原理;(2) 掌握纸层析法分离混合氨基酸的操作方法。
实验原理纸层析是以滤纸作支持物,用一定的溶剂系统展开,使混合样品达到分离分析的层析方法。
其一般操作是将样品溶解在适当溶剂中,点样在滤纸的一端;再选用适当的溶剂系统,从点样的一端通过毛细现象向另一端展开,展开完毕,取出滤纸晾干或烘干,再以适当的显色剂或紫外灯、荧光灯下观察其图谱。
样品经展开后某一物质在纸层析谱上的位置常用比移值R f 来表示。
R f = 原点至溶剂前沿的距离点的距离原点至纸层析斑点中心 纸层析可看作是溶质(样品)在固定相与流动相之间的连续抽提,由于溶质在两相之间的分配系数不同而达到分离。
一定的物质在两相间有固定的分配系数,因而在恒定条件(液剂、PH 、温度)下,各物质有固定的R f 值,据此可达到分析鉴定的目的。
由于滤纸纤维可吸收20~25%的水分;且其中6~7%以氢键形式与纤维素上羟基结合,一般条件下难脱去;所以纸层析实际上是以水相作固定相,展开的溶剂作流动相。
纸层析操作按溶剂展开方向可分为上行、下行和径向三种。
氨基酸分离一般用上行法。
上行法又分单向(成分较为简单的样品)和双向(单向时斑点重叠分离不开,于是在其垂直方向用另一种溶剂系统展层)。
双相层析谱可分辨十几种以上的样品。
层析溶剂要求:(1)被分离物质在该溶剂系统中R f 在0.05~0.8之间,各组分之R f 值相差最好能大于0.05,以免斑点重叠。
(2)溶剂系统中任一组分与被分离物之间不能起化学反应。
(3)被分离物质在溶剂系统中的分配较恒定,不随温度而变化,且易迅速达到平衡,这样所得斑点较圆整。
本实验采用八种混合氨基酸为样品,用酸性和碱性两种溶剂进行双向层析,以茚三酮为显色剂,可获得分离清晰的层析图谱,如图1所示。
图1八种混合氨基酸双向层析图谱试剂和器材一、试剂0.1%(W/V)茚三酮丙酮溶液。
溶剂系统:第一相:正丁醇∶88%甲酸∶水=15∶3∶2(V/V);第二相:正丁醇∶吡啶∶95%乙醇∶水=5∶1∶1∶1(V/V)。
DNS-氨基酸的制备和鉴定-
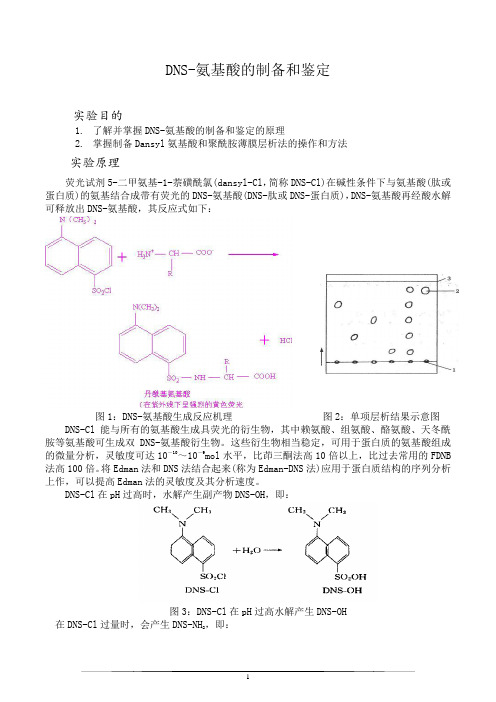
DNS-氨基酸的制备和鉴定实验目的1.了解并掌握DNS-氨基酸的制备和鉴定的原理2.掌握制备Dansyl氨基酸和聚酰胺薄膜层析法的操作和方法实验原理荧光试剂5-二甲氨基-1-萘磺酰氯(dansyl-Cl,简称DNS-Cl)在碱性条件下与氨基酸(肽或蛋白质)的氨基结合成带有荧光的DNS-氨基酸(DNS-肽或DNS-蛋白质),DNS-氨基酸再经酸水解可释放出DNS-氨基酸,其反应式如下:图1:DNS-氨基酸生成反应机理图2:单项层析结果示意图DNS-Cl能与所有的氨基酸生成具荧光的衍生物,其中赖氨酸、组氨酸、酪氨酸、天冬酰胺等氨基酸可生成双DNS-氨基酸衍生物。
这些衍生物相当稳定,可用于蛋白质的氨基酸组成的微量分析,灵敏度可达10-10~10-9mol水平,比茚三酮法高10倍以上,比过去常用的FDNB 法高100倍。
将Edman法和DNS法结合起来(称为Edman-DNS法)应用于蛋白质结构的序列分析上作,可以提高Edman法的灵敏度及其分析速度。
DNS-Cl在pH过高时,水解产生副产物DNS-OH,即:图3:DNS-Cl在pH过高水解产生DNS-OH在DNS-Cl过量时,会产生DNS-NH2,即:图4:DNS-Cl过量产生DNS-NH2DNS-氨基酸在紫外光照射下呈现黄绿色荧光,而DNS-OH和DNS-NH2产生蓝色荧光,可彼此区分开。
DNS-氨基酸可用聚酰胺薄膜层析法进行分离和鉴定,在薄膜上检测灵敏度为0.01ug(相当于10—10mol)。
由于它具有灵敏度高,分辨力强,快速,操作方便等优点,已被广泛应用于各种化合物的分析。
层析法是利用混合物中各组分物理化学性质的差异(如吸附力、分子形状及大小、分子亲和力、分配系数等),使各组分在两相(一相为固定的,称为固定相;另一相流过固定相,称为流动相)中的分布程度不同,即各组分所受的固定相的阻力和流动相的推力影响不同,从而使各组分以不同的速度移动而达到分离的目的。
实验三 Dansyl—氨基酸的聚酰胺薄膜层析法

实验四 Dansyl —氨基酸的聚酰胺薄膜层析法实验目的1.学习聚酰胺薄膜层析法的原理。
2.学习利用Dansyl —氨基酸分析蛋白质N 末端氨基酸及蛋白质组成的原理。
3.掌握制备Dansyl 氨基酸和聚酰胺薄膜层析法的操作和方法。
实验原理聚酰胺是一类化学纤维原料,又称锦纶或尼龙。
它对许多极性化合物有吸附作用,具有特异的分辨性能,可用于柱层析、薄层层析及薄膜层析。
与纸层析及纸电泳等方法相比,聚酰胺薄膜层析在分析氨基酸衍生物时具有灵敏度高、分辨力强、速度快、操作方便等优点。
除用于氨基酸衍生物的分析外,还可用于碱基、核苷酸、核苷、酚类、酚类糖苷、硝基化合物、杂环化合物、环酮、抗菌素、磺胺、合成染料等十几类化合物。
荧光试剂Dansyl —C1(二甲基氨基萘磺酰氯)可与氨基酸结合成带有荧光的Dansyl —氨基酸。
Dansyl —氨基酸在酸性条件下可被乙酸乙酯萃取出来,经聚酰胺薄膜层析后斑点集中,仅10—9至10—10克分子即可被检识,所以灵敏度很高。
用作蛋白质末端基分析,比DNP 氨基酸纸层析法灵敏度高100倍;用于氨基酸组成的微量分析,比茚三酮显色法灵敏度高10多倍。
聚酰胺薄膜层析的展层速度也比纸层析快得多,单向层层7厘米只需15—20分钟。
但用于定量,需要特殊仪器,目前多用于定性鉴定。
Dansyl —C1能与所有的氨基酸作用生成具荧光的衍生物。
这些衍生物都相当稳定,在5.7N 盐酸溶液中经105℃加热22小时,除Dansyl —色氨酸全部被破坏以及Dansyl聚酰胺薄膜是将锦纶涂布于涤纶片上,形成质地均匀的紧密的多孔薄膜,层析性能十分优良。
聚酰胺的化学结构如右。
由于聚酰胺的—C=O 基及—NH 基可与被分离物质形成氢键,因此可以吸附酸类、酚类、醌类、硝基及胺基化合物等。
由于各种物质与聚酰胺形成氢键的能力不同,即聚酰胺对各种物质的吸附能力不同。
而在层析过程中,展层溶剂与被分离物质在聚酰胺表面竞相形成氢键。
氨基酸的薄层层析

氨基酸的薄层层析【试验原理】聚酰胺薄膜层析是60年月以后进展起来的一种新的层析方法,特殊适用于氨基酸及其衍生物的分析。
具有灵敏度高、辨别率强、操作便利快捷等特点。
聚酰胺是一类化学纤维素原料,即锦纶(尼龙)。
由乙二酸和乙二胺聚合而成的,称锦纶66。
由于分子中含有大量的酰胺基团,故称聚酰胺。
聚酰胺薄膜是在涤纶片基上涂上一层锦纶制成的。
聚酰胺对很多极性物质有吸附作用,这是由于聚酰胺的-C=O和-NH- 能与被分别物质的肯定基团形成H键。
如酚类(黄酮类、鞣质)和酸类(氨基酸、核苷酸)能以其羟基与酰胺键的羰基形成H键。
在层析过程中,当样品随流淌相通过聚酰胺薄膜时,由于聚酰胺与各极性分子产生H键吸附力量的强弱不同,从而可将样品中各成分分别。
物质分别后,层析点在图谱上的位置,即在滤纸上的移动速率,用Rf来表示。
在肯定条件下,每个物质都有特定的Rf值,因此,用Rf可鉴定不同的物质。
无色物质的层析图谱可用光谱法(紫外照耀)或显色法鉴定。
氨基酸层析图谱常用茚三酮作显色剂。
本试验利用单向上行层析法鉴定氨基酸。
【试验试剂和器材】(一) 试剂1. 氨基酸标准液(10mg/ml):三种氨基酸是赖氨酸、脯氨酸、缬氨酸,分别配成上述浓度的溶液。
2. 氨基酸混合液(每种氨基酸5mg/ml)3. 展层剂:正丁醇:12%氨水:95%乙醇=13: 3: 3(V/ V)4. 0.1%茚三酮-正丁醇液。
(二) 器材聚酰胺薄膜,毛细管,层析装置,电吹风机,喷雾器,塑料手套等。
【试验方法】(一) 薄膜的剪裁取薄膜(7cm10cm)一张,在纸的一端距边缘2cm处用铅笔轻轻划始终线,在此直线上每隔1厘米作一记号为点样处(外侧两点距边缘2cm)。
(二) 点样氨基酸的点样量以5ul为宜。
点样时,用毛细管吸取氨基酸样品,与薄膜垂直方向轻轻碰点样处,每点在纸上集中的直径最大不超过2mm。
点样过程中,必需在第一点样品干后再点其次滴。
为加快样品干燥,可用吹风机吹干,留意温度不宜过高,以免损坏氨基酸。
氨基酸聚酰胺薄膜层析

氨基酸聚酰胺薄膜层析——DNS-Cl法一、实验目的:1.掌握聚酰胺薄膜层析技术的基本方法和应用。
2.熟悉蛋白质及肽的N末端氨基酸DNS分析法。
二、实验原理:.1.层析技术①概念:是利用化合物中各组分的物理性质的差别(如溶解度、吸附能力、分子形状和大小、分子极性等)使各组分在两相中的分布不同,从而使各组分以不同速度随流动相向前移动而达到分离的目的。
②特点:分离效率高,能分离各种性质相类似的物质。
不仅可用于少量物质的分离纯分,也可用于大量物质的分离纯化和制备。
③层析法的分类气相层析(以气体为流动相的层析法)液相层析(以液体为流动相的层析法,此为生物化学领域里常用的方法)I.吸附层析:薄层吸附层析、吸附柱层析II.分配层析:纸层析、柱层析、薄层层析III.离子交换层析IV.凝胶层析:柱层析、薄膜层析V.亲和层析④纸层析法(paper chromatography)是生物化学上分离、鉴定氨基酸混合物的常用技术,可用于蛋白质的氨基酸成分的定性鉴定和定量测定。
纸层析法是用滤纸为支持物进行层析的方法,所用展层溶剂大多由水和有机溶剂组成,滤纸纤维与水的亲和力强,与有机溶剂的亲和力弱,因此在展层时,水是固定相,有机溶剂是流动相。
溶剂由下向上移动的,称上行法;由上向下移动的,称下行法。
将样品点在滤纸上(此点称为原点),进行展层,样品中的各种氨基酸在两相溶剂中不断进行分配。
由于它们的分配系数不同,不同氨基酸随流动相移动的速率就不同,于是就将这些氨基酸分离开来,形成距原点距离不等的层析点。
溶质在滤纸上的移动速率用Rf值表示:Rf=原点到层析斑点的距离/原点到溶剂前沿的距离在一定条件下某种物质的Rf值是常数。
Rf值的大小与物质的结构、性质、溶剂系统、温度、湿度、层析滤纸的型号和质量等因素有关。
只要条件(如温度、展层溶剂的组成)不变,Rf 值是常数,故可根据Rf值作定性判断。
样品中如有多种氨基酸,其中某些氨基酸的Rf值相同或相近,此时如只用一种溶剂展层,就不能将它们分开。
DNS-氨基酸的双向聚酰胺薄膜层析凝胶层析分离血红蛋白与鱼精蛋白

葡聚糖凝胶网孔大小可通过调节交联剂和葡聚糖的配比及反应条件来控制。交联度越 大,网孔越小,吸水膨胀就越小。交联度越小,网孔越大,吸水膨胀就越大。
G类葡聚糖凝胶常用G-X代表,X数字既代表交联度,也代表特水量。X数字越小,交
联度越大,网孔越小,适用于分离低分子质量生化产品。X数字越大,交联度越小,网
颜色不同可直接观察到血红蛋白洗脱较快,鱼精蛋白洗脱较慢。
G类葡聚糖凝胶(Sephadex-G)的最基本骨架是葡聚糖,它是一种以右旋葡萄 糖为残基的多糖,分子间主要是α-1,6-糖苷键(约占95%),分枝为l,3-糖苷键 (约占5%),以1-氯-2,3-环氧丙烷为交联剂将链状结构连接为三维空间的网状 结构的高分子化合物。
叶绿素通过碳酸钙管柱所形成的色谱图
层析的两种相
固定相:固定相是层析的一个基质。它可以是固体物质(如吸附剂,凝胶,离子交换 剂等),也可以是液体物质(如固定在硅胶或纤维素上的溶液),这些基质能与待分 离的化合物进行可逆的吸附,溶解,交换等作用。 流动相:在层析过程中,推动固定相上待分离的物质朝着一个方向移动的液体、气体
外水体积为Vo,内水体积为Vi,基质体积为Vg,则有:
Vt=Vo+Vi+Vg 由于Vg相对很小,可以忽略不计,则有:
Vt=Vo+Vi
外水体积(V0)
内水体积(Vi)
基质体积(Vg)
柱床体积(Vt)
凝胶层析柱各种体积示意图(阴影部分)
样 品 的 量
洗脱体积
当分子的Kd=0时,Ve=Vo即该分子被完全排阻于凝胶颗粒之外,全部分布于流动 相里,固定相里分布为零(A); 当分子的Kd=1时,Ve=Vo+Vi即该分子完全不被排阻,均匀的分布在流动相和固 定相里,两相比值为1(C);
DNS法分析蛋白质

DNS法分析蛋白质N-末端氨基酸
DNS:丹磺酰氯(二甲氨基萘磺酰氯)
强荧光剂
灵敏度高
反应原理
聚酰胺薄膜层析法
•原理:各种DNS—氨基酸与聚酰胺薄膜形成氢键的能力不同,即在溶剂与聚酰胺薄膜之间的分配系数不一样,故可用聚酰胺薄膜层析分离各种DNS—氨基酸。
•优点:灵敏度高,分辨力强,快速,操作方便等
点样层析
PH9.9 的标准赖氨酸、丙氨酸、苯丙氨基酸,混合氨基酸
实验原理
•荧光试剂DNS—Cl能与所有氨基酸的氨基结合,生成荧光物质DNS—氨基酸。
DNS—Cl 也能与蛋白质或多肽的游离氨基结合,生成DNS—蛋白质或DNS—肽,经酸水解后释放出DNS—氨基酸。
•各种DNS—氨基酸与聚酰胺薄膜形成氢键的能力个同,即在溶剂与聚酰胺薄膜之间的分配系数不一样,故可用聚酰胺薄膜层析分离各种DNS—氨基酸。
DNS—氨基酸在360nm 或280nm 波长的紫外光照射下,发出黄绿色荧光,很方便进行检测。
•蛋白质和多肽经酸水解后,肽键断裂,生成游离氨基酸,所有氨基酸都能与DNS—Cl 反应。
所以DNS—Cl 法可用于蛋白质或多肽氨基酸组成的微量分析。
•在pH 值过高的情况下,DNS—Cl 会发生水解生成副产物DNS—NH2,DNS—OH 和DNS—Cl在紫外灯下产生蓝色荧光,可以与DNS—Cl 的黄绿色荧光区分开来。
氨基酸双向纸层析实验报告

氨基酸双向纸层析实验报告一、实验目的本实验旨在通过氨基酸双向纸层析技术,对不同氨基酸进行分离与鉴定,探究其在生物体内的作用及应用。
二、实验原理氨基酸是构成蛋白质的基本单位,其分子结构中含有羧基和氨基。
通过在纸层析板上涂覆两种不同极性的溶剂系统,可以使得不同极性的氨基酸在两个溶剂系统中具有不同的迁移速率,从而实现氨基酸的分离。
在显色试剂的作用下,各种氨基酸会呈现出不同颜色,进一步帮助进行鉴别与定量。
三、实验步骤1.制备双向纸层析板:将滤纸剪成大小合适的矩形,在其中心画一条粗线,将滤纸沿着该线对折,并将两侧各自涂覆一种溶剂系统(如丙酮-水和正丁醇-冰乙酸),待干燥后即可使用。
2.样品制备:取少量已知浓度的氨基酸标准品,加入显色试剂(如二硫化钠-醋酸溶液),振荡混合均匀。
3.纸层析操作:将样品滴于纸层析板中心线上,待样品渗透进滤纸后,放置于含有适量显色试剂的容器中,等待显色反应完成。
4.结果分析:根据不同氨基酸的迁移距离和颜色特征,进行鉴别与定量分析。
四、实验注意事项1.制备双向纸层析板时要注意两侧溶剂系统的涂覆均匀性和干燥程度。
2.样品制备时需注意浓度的准确性和显色试剂的添加量及混合均匀性。
3.纸层析操作时要注意样品滴加量、滤纸渗透程度、显色试剂的选择和添加量等因素对结果产生的影响。
4.实验过程中应注意安全,避免溶剂挥发、化学品接触皮肤等情况发生。
五、实验结果本次实验使用丙酮-水和正丁醇-冰乙酸作为两侧溶剂系统,在已知浓度为0.01mol/L的氨基酸标准品中,通过纸层析技术成功分离出甲、丙、谷、天冬氨酸等氨基酸,并通过显色试剂呈现出不同的颜色特征,进一步进行鉴别和定量。
六、实验总结本次实验通过氨基酸双向纸层析技术,成功地对不同氨基酸进行了分离和定量分析。
该技术在生物化学研究中具有广泛应用价值,可用于分离和纯化蛋白质、检测生物体内代谢产物等方面。
同时,在实验过程中也需要注意安全操作和结果准确性,以保证实验的顺利进行。
dnscl法

dnscl法
DNS-Cl法又叫蛋白质DNS分析法,也叫DNS-Cl(膜层析技术),能与所有氨基酸的氨基结合,生成荧光物质DNS-氨基酸。
DNS-Cl也能与蛋白质或多肽的游离氨基结合,生成DNS-蛋白质或DNS-肽,经酸水解后释放出DNS-氨基酸。
各种DNS-氨基酸与聚酰胺薄膜形成氢键的能力个同,即在溶剂与聚酰胺薄膜之间的分配系数不一样,故可用聚酰胺薄膜层析分离各种DNS-氨基酸。
DNS-氨基酸在360nm或280nm波长的紫外光照射下,发出黄色荧光,很方便进行检测。
DNS-Cl法可用于蛋白质或多肽氨基酸组成的微量分析。
在pH值过高的情况下,DNS-Cl会发生水解生成副产物DNS-NH2,DNS-OH 和DNS-Cl在紫外灯下产生蓝色荧光,可以与DNS-Cl的黄色荧光区分开来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应的副产物:DNS-NH2黄色荧光和DNS-OH蓝色荧光
DNS-氨基酸的双向层析图谱
Ⅱ 丝
甘 天
谷
丙
苯
亮Leabharlann 脯 颉赖 Ⅰ操作以及注意事项
1、DNS-氨基酸的制备 2、混合DNS-氨基酸的双向层析 (1)点样。距右下角距两边各0.5cm,直径控制在2- 3mm之间,点在无光泽面,可重复几次点样。 (2)苯-冰醋酸层析:展层剂前缘距薄膜顶端3mm处 即可停止,冷风吹干,紫外观察。 (3)甲酸-水层析:调转90度与第一相垂直,热风吹 干,紫外灯下观察,用铅笔轻轻标记。
Pour solvent into the beaker to a depth of just less than 0.5 cm.
临床生化上的应用
1.氨基酸的分离 2.核苷、核苷酸和核酸的分析
DNS-氨基酸的双向聚酰胺薄膜层析
二甲氨基萘磺酰氯 (1-Dimethylaminonaphtalene-5-sulfonyl chloride, DNS-Cl)可与氨基酸的游离氨基结合成DNS-氨 基酸。 形成的DNS-氨基酸在紫外线(260nm或365nm) 照射下发出强烈的黄色荧光,因此可用荧光检 测DNS-氨基酸的存在。
2.平衡 3.展开
方法:
上行层析法 下行层析法 双向展开法
显色
1)有色物质(如黄体酮)展开后即可显 出斑点
2)紫外灯下显出荧光斑点,如核苷酸和 某些生物碱
3)显色剂显色
荧光试剂 ——DNS-Cl二甲氨基萘磺酰氯
蛋白质、多肽、氨基酸可与其游离氨基 结合
DNS-aa发出黄绿色荧光
DNS-Cl在pH过高时,水解产生副产物 DNS-OH,即:
在DNS-Cl过量时,会 产生DNS-NH2,即:
DNS-氨基酸在紫外光照射下呈现黄色荧光 DNS-OH和DNS-NH2产生蓝色荧光
→可彼此区分。
三、薄层层析的应用
(一)定性分析:将已知化合物作为标准品与 样品一起进行层析后对照,可初步确定未知 化合物的组成。
(二)定量分析:可直接在薄板上测定,无须 破坏薄层; 用工具将斑点从薄层上取下,用溶剂洗脱, 再用其他方法测定。
吸附剂的吸附能力
常称为活度,用罗马字母Ⅰ、Ⅱ、Ⅲ、Ⅳ、 Ⅴ表示。
活度 强
弱
含水量 多
少
常用吸附剂
极性:
硅胶:
为首选吸附剂。本身具微酸性,适用于分离酸 性及中性物质。
氧化铝:
氧化铝具有分离能力强、活性可以控制等优点 碱性/中性/酸性氧化铝
……
非极性:
纤维素 聚酰胺:
→合成:己二酸、己二胺 →特点:氢键吸附剂
吸附剂
主要是利用吸附剂对不同物质吸附力 的不同而达到分离的目的。
➢薄层层析中吸附剂选择是关键。
吸附剂的选择
(1)应不溶于所使用的溶剂;与所使用的溶 剂和样品中各组分不起化学反应;
(2)应具有较大的吸附表面(吸附容量) 和一定的吸附力;对被分离个组分有不同 的吸附力,有足够的分辨力;
(3)吸附剂颗粒大小要均匀,保持良好的 重复性。
---一种物质被聚集在另一种物质表面的 现象。
➢ 吸附剂: ---凡是能够将其他物质聚集到本身分子表 面的物质称为吸附剂,如氧化铝、硅胶等。
➢ 被吸附物 ---聚集在吸附剂表面的分子就称为被吸附 物。
吸附层析(Absorption Chromatography)
各组分与流动相分子争夺吸附剂表面 活性中心,利用吸附剂对不同组分的吸 附能力差异而实现分离.
✓被分离物质形成氢键能力的强弱,确定吸附能力的差异。 ✓在层析过程中,展层溶剂与被分离物质在聚酰胺表面竞相 形成氢键。因此选择适当的展层溶剂,使被分离物质在溶 剂与聚酰胺表面之间的分配系数能有较大差异,经过吸附 与解吸的展层过程,可以一一分离.
溶剂
不同溶剂具有不同的结构性质,依极性大 小各种溶剂的洗脱能力各不相同。 ➢一般所选溶剂要求:
pH9.8 40℃,30min
本实验中,聚酰胺上胺基与氨基酸 的羰基形成氢键,酰胺基团上羰基 与AA中羟基或酚基形成氢键。由于 有些AA结构相似,如只采用一种溶 剂系统进行单向层析,难达到完全 分离的目的。因此可选择另一溶剂 系统进行第二向层析。
第一向——苯-冰醋酸
第二向——甲酸-水
显色
二甲氨基萘磺酰氯(DNS-Cl)可与氨基酸的游 离氨基结合成DNS-氨基酸。形成的DNS-氨基 酸在紫外光下呈黄绿色荧光。
注意
(1)严格控制点样位置以及点样直径。 (2)展层时勿将点样浸入溶剂系统。 (3)展层后必须经电吹风将膜吹干。 (4)使用紫外照射时要注意使用时间短.
Procedure for TLC
1. Prepare the developing container. The developing container for TLC can be a specially designed chamber, a jar with a lid, or a beaker with a watch glass on the top:
a.纯度合格 b.黏度要小→易与样品中各组分相分离 c.与所欲分离样品和吸附剂不起化学反应
溶剂选择考虑因素
1、溶剂与吸附剂之间的相互作用力 2、溶剂与样品之间的作用因素
➢ 溶剂的选择可通过实验来确定。
薄层层析的操作
1、点样
➢样品最好溶解在挥发性的溶剂中,如氯仿、 丙酮等,避免用水每次点少量样品,可在溶 剂挥发后反复进行至点完为止。 ➢样品原点直径<3mm
此处加标题
DNS氨基酸的双向聚 酰胺薄膜层析
眼镜小生制作
薄层层析(Thin-layer chromatography,TLC)
薄层层析 ---是吸附剂在平滑的玻璃板或聚脂薄膜 上铺成薄层作为固定相,以溶剂作为流 动相,将样品中各组分分离的方法。
➢ 分离原理:
——吸附层析
吸附层析的概念及原理
吸附
……
聚酰胺
是—类化学纤维原料,即锦纶(又称尼龙)。 由己二酸与己二胺聚合而成。
➢因为在这类物质分子中都含有大量酰胺基团, 故统称聚酰胺。
聚酰胺对极性物质的吸附作用
——是由于聚酰胺的-C=O(羰基)及>NH(氨基)能与被分离物
质之间形成氢键。 ➢如酚类(包括黄酮类、鞣质等)和酸类(如核苷酸、氨 基酸等)是以其羟基与酰胺键的羰基形成氢键 ➢如硝基化合物和醌类等物质与酰胺键的氨基形成氢键
