类胡萝卜素的检验方法(中国螺旋藻联盟)
鉴定胡萝卜素的方法

鉴定胡萝卜素的方法
首先,最常见的鉴定胡萝卜素的方法之一就是紫外-可见分光光度法。
这种方
法是利用不同波长下胡萝卜素的吸收特性来进行鉴定。
通过测定样品在特定波长下的吸光度,可以得到胡萝卜素的含量。
这种方法简单、快速,且准确度较高,因此被广泛应用于食品加工和质量监控领域。
其次,色谱法也是一种常用的鉴定胡萝卜素的方法。
色谱法是利用样品在色谱
柱中的分离和吸附特性来进行鉴定。
通过比较待测样品与标准物质在色谱图谱上的保留时间和峰面积,可以准确地确定胡萝卜素的含量和种类。
这种方法需要专业的设备和操作技能,但其分析结果准确可靠,因此在科研领域得到了广泛应用。
另外,光谱法也是一种常见的鉴定胡萝卜素的方法。
光谱法是利用样品在特定
波长下的吸收、发射或散射特性来进行鉴定。
通过测定样品在紫外、可见、红外等光谱范围内的吸收特性,可以得到胡萝卜素的含量和结构信息。
这种方法操作简单,且对样品的要求较低,因此在食品行业得到了广泛应用。
最后,生化分析法也是一种重要的鉴定胡萝卜素的方法。
生化分析法是利用生
物学试剂和生化技术来进行鉴定。
通过测定样品在特定生化反应条件下的变化,可以准确地确定胡萝卜素的含量和种类。
这种方法需要专业的实验室设备和操作技能,但其分析结果准确可靠,因此在科研领域得到了广泛应用。
综上所述,鉴定胡萝卜素的方法有很多种,每种方法都有其特点和适用范围。
在实际应用中,可以根据具体的需求和条件选择合适的方法进行鉴定。
希望本文介绍的内容能够对相关领域的科研工作者和食品从业人员有所帮助。
类胡萝卜素的分析测定

『 肠
/ Q /
!l .. , p ( , .
L +pn y, e e () b
产
构有关, 是其分子结构特征。 同时各吸收峰的相对 峰高比率也能反映类胡萝 卜 累的结构和纯度。因 此. 紫外一 可见光吸收图谱也是鉴定类胡萝 卜 素种
1 类胡萝 卜 素的光化学特点
11类胡萝卜 . 素的基本结构
类胡萝 卜 素是由 8 个异戊二烯基本单位( 图
类胡萝 卜 素的光吸收主要取决于分子内的吸 光色素基团, 结构上的其它差异对光吸收的影响 相对较小。类胡萝 卜 素分子中的主要吸光色素基
2) a组合成的多烯链, 通过共I双键构成的一类化 f E 合物或其氧化衍生物[。 [ 可以认为, I ] 所有的类胡萝 卜 素是由 番茄红素(a ,见图2 ) Co s H, ()通过系列 b 酶促反应过程形成的, 主要的生物化学反应包括 加氢反应、 去氢反应、 环化反应、 加氧反应、 双键漂 移、 基位移、 甲 链延长或链缩短等U ]
构的类胡萝 卜 素有 6。 0 种之多, 如常常提到的虾 青素、 角黄素.一 n胡萝 卜 R胡萝 卜 叶黄素、 素、一 素、 多甲藻素、 八氢番茄红素、 王米黄质等都是类胡萝 卜 a 1如果包括异构体在内, 素fa -。 类胡萝 卜 素的家 族数量则更加庞大, R胡萝 卜 单就 一 素而言, 分子 式为Ca , 在结构上含 9 , e H , 个共扼双键组成的大二 键, 理论上有 23 7 种异构体, 由于甲基的存在和阻
Sp 20 e . 1 0
类 胡 萝 卜素 的 分 析 测 定
黄 健, ,刘建国“
(. 1 青岛教育学院生化系。山东 青而 267: 601
2 中国科学院海洋研究所生物技术研究发展中心,山东 青岛 267) 601
植物叶绿素类胡萝卜素测定方法

叶绿素、类胡萝卜素含量的测定一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。
根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数.各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。
在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
二、材料、仪器设备及试剂(一)材料:新鲜(或烘干)的植物叶片。
(二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸;8)擦境纸;9)滴管.(三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉.暗中2h,0.5g,25ml三、实验步骤1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀.2)将取好的样品放入25ml容量瓶中,加混合浸提液(无水乙醇:丙酮=5:5)20ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用。
3)把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度。
选择波长663 646 和470nm.四、实验结果计算叶绿素a的浓度 = 12.21 ⨯ OD633 – 2。
81 ⨯ OD646叶绿素b的浓度 = 20.13 ⨯ OD646– 5。
植物类胡萝卜素含量检测试剂盒说明书 可见分光光度法

植物类胡萝卜素含量检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4330规格:50T/48S产品简介:类胡萝卜素(carotenoid)是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类的黄色、橙红色或红色的色素之中。
类胡萝卜素是体内维生素A的前体,同时还具有抗氧化、免疫调节、抗癌、减轻心血管疾病及着色剂等作用。
植物的类胡萝卜素存在于各种黄色质体或有色质体内;如黄叶,黄色花卉,黄色和红色的果实和黄色块根等组织,样本通过溶剂萃取,分离提取类胡萝卜素,在440±10nm处有特殊吸收峰。
大部分高等植物和藻类微生物的叶绿体内也含有类胡萝卜素,类胡萝卜素主要吸收蓝紫光,而叶绿素a 和叶绿素b既吸收红光又可吸收蓝紫光。
所以针对含叶绿体的组织,为排除叶绿素a和叶绿素b对类胡萝卜素的干扰,根据经验公式先计算出叶绿素a和叶绿素b的含量,再进一步得出类胡萝卜素的含量;针对不含叶绿素的组织可以直接根据类胡萝卜素的经验消光系数进行计算试验中所需的仪器和试剂:可见分光光度计、台式离心机、1mL玻璃比色皿、天平、可调式移液枪、研钵/匀浆器、10mL离心管/试管、蒸馏水和丙酮。
产品内容:提取液:自备,80%丙酮,即将丙酮:蒸馏水(V:V)=4:1混合待用。
试剂一:粉剂×1瓶,4℃保存。
操作步骤:一、样本制备:1、新鲜植物叶片(去掉中脉)或其他组织用蒸馏水洗干净,然后吸干表面水分,称取约0.1g,剪碎放入研钵或匀浆器中。
2、加入1mL蒸馏水,少量试剂一(约10mg),在黑暗或弱光条件下充分研磨,转入10mL离心管或试管中。
3、用提取液冲洗研钵或匀浆器,将所有冲洗液转入10mL 离心管或试管中,用提取液定容至10mL,置于黑暗条件或者包上锡箔纸浸提3h (期间可以颠倒混合2次),观察底部组织残渣接近于白色则提取完全,若组织残渣未完全变白,继续浸提至组织残渣颜色接近于白色。
类胡萝卜素的测定方法

类胡萝卜素的测定方法(高效液相色谱法)本方法适用于各类食品中以羟基类胡萝卜素为主的多种类胡萝卜素的测定。
本方法最低检出量为:α-胡萝卜素为5ng/mL,β-胡萝卜素为 4.3ng/mL,γ-胡萝卜素为3.5ng/mL,番茄红素为2.7ng/mL,斑蝥黄素为1.0ng/mL。
1. 方法提要样品以丙酮-石油醚(1+1体积比)混合溶剂反复萃取使类胡萝卜素与其他成分分离,在450nm 波长条件下进行HPLC分析检测,通过外标法计算各种类胡萝卜素的含量。
2. 仪器(1)高效液相色谱仪。
(2)冷凝回流皂化装置。
(3)旋转蒸发仪。
(4)离心机(5000r/min)。
3. 试剂本方法所使用试剂除特殊注明外,均为分析纯;所用水为重蒸馏水。
(1)丙酮-石油醚(1+1体积比)混合溶剂:取相同体积的丙酮、石油醚混匀。
(2)50% KOH甲醇-水溶液:称取250g氢氧化钾,用50mL适量水溶解后,用甲醇定容至500mL容量瓶,备用。
(3)无水硫酸钠(Na-2SO4)。
(4)二丁基羟基甲苯(BHT)。
(5)无水乙醇(C2H5OH)。
(6)流动相使用液:按乙腈+二氯甲烷+甲醇(85+10+5)比例准确量取各溶剂,并充分混匀,经.45μm微孔膜过滤后使用。
(7)类胡萝卜素标样:α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素、番茄红素、斑蝥黄素。
(8)标准溶液:准确称取α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素、番茄红素、斑蝥黄素一定量,先分别用少量的乙酸乙酯溶解,再用甲醇配制成60~80ng/L的标准储备液(于-30℃冻箱保存),使用时再配成3.5~16.5mg/L的标准使用液。
4. 测定步骤(1)样品处理:a. 皂化提取法(如牛奶等脂肪含量较高的样品):取250L鲜牛奶于2℃、5000r/min冷冻离心30min,取上层油脂于250mL皂化瓶中,加入50mL乙醇、40mL 50% KOH甲醇溶液、0.1g BHT,65~75℃回流皂化30min,用石油醚反复提取皂化液,多次水洗至中性后用无水硫酸钠脱水,定容至25mL容量瓶中,备用。
类胡萝卜素的检验方法(中国螺旋藻联盟)

类胡萝卜素的检验方法(中国螺旋藻联盟)类胡萝卜素(以β-胡萝卜素计)的测定A.1.1 原理根据在碱性条件下,样品中其它色素及酯类可被皂化,可用水除去。
不被皂化的总类胡萝卜素,可溶于乙醚中,通过测定其特征吸光度计算含量。
A.1.2 试剂所用试剂均为分析纯试剂。
a)混合溶剂:正己烷、丙酮、乙醇、甲苯体积比为10:7:6:7。
b)乙醚c) 40%KOH甲醇溶液:20克KOH溶于少量水中,用甲醇定容于50ml。
d)无水硫酸钠A.1.3 仪器分光光度计、恒温水浴锅。
A.1.4 操作方法A.1.4.1 样品处理称取0.03g至0.05g(精确至0.0001g)样品于50ml的比色管中,加35ml混合溶剂(a)和1ml40%KOH溶液(c),35℃恒温水浴并避光超声2小时,将浸泡提取液倒入250ml的分液漏斗中;在浸泡过的样品中加入25ml蒸馏水,轻轻摇荡、静置,合并以上提取液,加入乙醚(b)50ml萃取,并于萃取液中加入100ml蒸馏水,轻轻摇荡、静置,弃去下层溶液,重复洗涤至少两次,萃取液经过10g的无水硫酸钠(d),收集于100ml容量瓶中,用乙醚(b)定容至刻度线。
A.1.4.2 测定以乙醚(b)作空白,用带塞的1cm玻璃比色皿在453.0nm处测定吸光度。
A.1.5 计算类胡萝卜素含量(g/kg)=A453.0×V×10G×E式中:A:波长为453.0nm处的吸光度;V:定容萃取溶液的体积,ml;G:样品重量(g);E:总类胡萝卜素的吸光系数(2500)。
A.1.6 检验结果报告保留两位有效数字。
本方法来源于《中国螺旋藻战略联盟食用螺旋藻行业标准》。
胡萝卜素检验标准
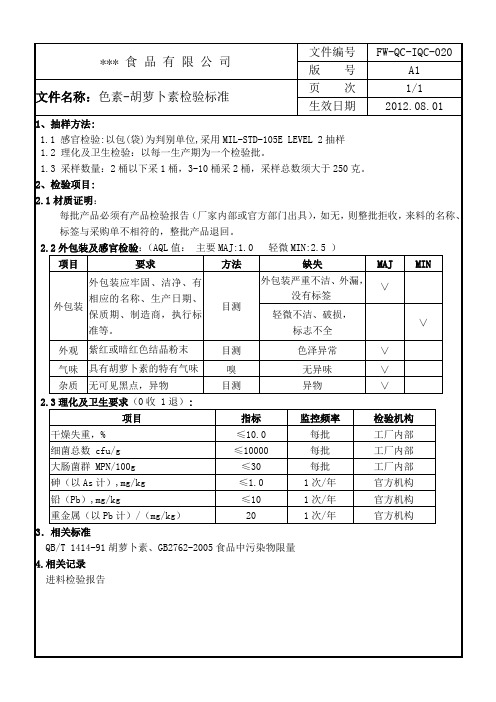
外包装严重不洁、外漏,没有标签
∨
轻微不洁、破损,
标志不全
∨
外观
紫红或暗红色结晶粉末
目测
色泽异常
∨
气味
具有胡萝卜素的特有气味
嗅
无异味
∨
杂质
无可见黑点,异物
目测
异物
∨
2.3理化及卫生要求(0收1退):
项目
指标
监控频率
检验机构
干燥失重,%
≤10.0
每批
工厂内部
细菌总数cfu/g
≤10000
每批
工厂内部
***食品有限公司
文件编号
FW-QC-IQC-020
版号
A1
文件名称:色素-胡萝卜素检验标准
页次
ห้องสมุดไป่ตู้1/1
生效日期
2012.08.01
1、抽样方法:
1.1感官检验:以包(袋)为判别单位,采用MIL-STD-105E LEVEL 2抽样
1.2理化及卫生检验:以每一生产期为一个检验批。
1.3采样数量:2桶以下采1桶,3-10桶采2桶,采样总数须大于250克。
2、检验项目:
2.1材质证明:
每批产品必须有产品检验报告(厂家内部或官方部门出具),如无,则整批拒收,来料的名称、标签与采购单不相符的,整批产品退回。
2.2外包装及感官检验:(AQL值:主要MAJ:1.0轻微MIN:2.5)
项目
要求
方法
缺失
MAJ
MIN
外包装
外包装应牢固、洁净、有相应的名称、生产日期、保质期、制造商,执行标准等。
大肠菌群MPN/100g
≤30
每批
工厂内部
砷(以As计),mg/kg
螺旋藻粉胡萝卜素含量测定方法的优化

文章编号:1673—2103(201205— 0030— 05螺旋藻粉B-胡萝卜素含量测定方法的优化*赵楠1,李勇勇1,邵明飞2,郁章玉1,3,秦松4(1 •曲阜师范大学化学与化工学院,山东曲阜273165;2 •南京农业大学资源与环境科学学院江苏省海洋生物学重点实验室,江苏南京210095;3 •菏泽学院化学与化工系,山东菏泽274015;4•中国科学院烟台海岸带研究所生物资源实验室,山东烟台264003摘要:采用可见分光光度法测定螺旋藻藻粉中B-胡萝卜素含量,并对测定过程中有关B—胡萝卜素的提取工艺进行了优化,确定了最佳工艺参数为:提取剂为v (正庚烷?V(丙酮?(无水乙醇?V (甲苯=10?7?6?7,提取剂体积为30mL ,浸提时间为12h,浸提温度为35?.在该工艺下测得螺旋藻藻粉的B—胡萝卜素含量为134. 15mg /100g.关键词:螺旋藻粉;阡胡萝卜素;含量;测定中图分类号:Q562文献标识码:A螺旋藻是丝状的多细胞蓝藻,具有很高的药用及营养价值,被联合国粮油组织推荐为“21 世纪最优秀的食品”.螺旋藻中B—胡萝卜素的含量非常丰富,所含的B—胡萝卜素达1700mg /kg (干重[1]•B-胡萝卜素是维生素A的前体物质,大量研究证实B-胡萝卜素是有效的抗氧化剂,能消除人体中的活性氧,消除自由基,在防癌[2]抗癌[3]、预防心血管疾病,增强免疫功能[4]等方面有明显作用[5]•螺旋藻粉中的B—胡萝卜素含量为所有食物之冠,比胡萝卜中的B—胡萝卜素含量还要高出10倍⑹•B—胡萝卜素作为螺旋藻综合开发利用的一种功能因子,有很大的商业化前景•因此,有关螺旋藻中B—胡萝卜素成分的研究和测定方法倍受重视•目前常用的测定p-胡萝卜素含量的方法有纸层析法、分光光度法和高效液相色谱法[7,8]•由于高效液相色谱法样品的前处理较为麻烦且所需仪器昂贵,所以还未能广泛普及•而纸层析法步骤比较繁琐,故本文采用分光光度法进行螺旋藻粉B-胡萝卜素含量的测定,并对该方法操作条件进行优化•1材料与方法材料螺旋藻粉,2011年12月份购于广西,置于阴凉抽屉中避光保存.1. 2试剂与仪器仪器:恒温水浴锅,上海福玛试验设备有限公司产品;电子分析天平,上海舜宇恒平科学仪器有限公司产品;TU - 1901紫外可见分光光度计,北京普析通用有限责任公司产品;50mL具塞比色管,分液漏斗等.试剂:标准B—胡萝卜素(Sigma公司产品,质量分数〉97%,无水硫酸钠、正庚烷、丙酮、无水乙醇、甲苯、乙酸乙酯、氯仿、甲醇、石油醚均为国产分析纯.1. 3B-胡萝卜素最大吸收波长的测定及标准曲线的绘制[5]取一定量的胡萝卜素标准品,溶解在石油醚中,在波长300 600nm范围内,用紫外可见分光3第34卷第5期Vol . 34No. 5菏泽学院学报Journal of Heze University 2012年10 月Oct. 2012*收稿日期:2012- 10- 09基金项目:国家海洋公益性行业科研专项经费项目(201205027国家海洋公益性行业科研专项经费项目(200905021—3;山东省自然科学基金资助项目(JQ200914山东省自然科学基金资助项目(ZR2012DQ015作者简介:赵楠(1987—,女,山东临沂人,在读硕士研究生,研究方向:分析化学.有障玉(I960—,男,山东临沂人教授,博士生导师,研究方向:生命电分析化学•秦松(1968—,男,山东莱州人,研究员,博士生导师,研究方向:海岸带生物技术.光度计进行波谱扫描,得到B-胡萝卜素的特征吸收峰,作为B-胡萝卜素的测定波长.准确称取2. 50mg3—胡萝卜素标准品,溶于石油醚,并定容于100mL棕色容量瓶中,配制成25ug/mL的B—胡萝卜素标准溶液,分别吸取0. 2,0. 4,0. 6,0. 8,1. 0mL于5个10mL棕色容量瓶中,用石油醚定容,以石油醚为参比溶液,在450nm处测定各样品的吸光度,并绘制标准曲线.1. 4样品的测定准确称取0. 2g左右的螺旋藻藻粉于50mL的比色管中加入30mL提取剂和1mL 质量浓度为400g/L的KOH溶液,混合均匀;比色管放于35?恒温水浴中浸泡12h后,将浸泡液过滤,滤液倒入内盛50mL的20g/L硫酸钠溶液的250mL分液漏斗中,用10mL提取剂冲洗滤渣,重复两次,将洗液、过滤液收集到分液漏斗中.向分液漏斗中加入30mL乙醚及100mL蒸馏水,振摇后静置分层,弃去下层溶液,上层溶液再重复萃取两次.萃取所得上层溶液通过一装有10g无水硫酸钠的小漏斗滤入100mL棕色容量瓶中,用少量石油醚洗涤分液漏斗,并洗去无水硫酸钠表面的色素,定容至刻度线,摇匀,用分光光度计测定其在450nm处的吸光度.1. 5提取剂在50mL具塞比色管中加入0. 2g螺旋藻粉后再分别加入30mL下列溶液:V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10?7?6?7;V (石油醚?V(丙酮=1?1;V(甲醇?V(石油醚=2?1;乙酸乙酯;V(石油醚?V(丙酮=4?1;V (丙酮?V(氯仿=1?2;V(丙酮?V(甲醇=7?2;石油醚.其余步骤按1. 4所述步骤进行操作.1. 6浸提温度在50mL具塞比色管中加入0. 2g螺旋藻粉、30mL最佳提取剂后,分别于25,35,45,55,65, 75?恒温水浴中浸泡12h,其余步骤按1. 4所述步骤进行操作.1. 7提取剂体积在50mL具塞比色管中加入0. 2g螺旋藻粉后,再分别加入15,20,25,30,35,40mL 最佳提取剂,于最佳浸提温度恒温水浴中浸泡12h其余步骤按1. 4所述步骤进行操作.1. 8浸提时间在50mL具塞比色管中加入0. 2g螺旋藻粉、最佳提取剂体积的提取剂后,于最佳温度恒温水浴中,分别密封避光浸泡2,4,6,8,10,12h其余步骤按1. 4所述步骤进行操作.1. 9正交试验设计采用L9(33正交试验表,以V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10?7?6?7为提取剂,选取浸提温度、提取剂体积、浸提时间3个因素,每个因素取3个水平,其因素水平见表1.表1L9(33正交试验的因素水平水平A浸提温度/?B提取剂体积/mL C浸提时间/h 125258235301034540122结果与分析2. 1 p-胡萝卜素的吸收光谱及标准曲线图B—胡萝卜素的吸收光谱,如图1所示•从图1可见,—胡萝卜素在波长300 600nm范围内有两处较大的吸收峰,其中在450nm处吸收峰值最大,是B—胡萝卜素的特征吸收峰,本试验选择450nm作为阡胡萝卜素的测定波长Alflgbhblip-.1 'Hww ■didLLiMlMtdf 耳Imui E图1 B—胡萝卜素光谱扫描曲线B—胡萝卜素的质量浓度(p在0 2. 5ug/mL范围内与吸光度值(A呈现很好的线性关系,如图2所示.其标准曲线公式为:A=0 . 3089p—0. 0088, r2=0. 999ChhnAllMhiriwt I low.■.J FWW jeribLnil1*4-101 Tl lMWtniN' Iwni* fJiKWnwfl:-Hr(4*n-■fl.t5.图2 B—胡萝卜素的标准曲线132012年赵楠,等:螺旋藻粉B-胡萝卜素含量测定方法的优化第5期2. 2提取剂对B-胡萝卜素含量测定的影响各提取剂对胡萝卜素含量测定的影响见表2.由表2知,V(正庚烷?V(丙酮?V (无水乙醇?V(甲苯=10?7?6?7为最佳提取剂,其提取到的胡萝卜素含量测定最高,以下实验中均以此为提取剂.表2提取剂对B-胡萝卜素含量测定的影响提取剂B—胡萝卜素测定含量/(mg/100g标准偏差V(正庚烷?V(丙酮?V(无水乙V(甲苯=10?7?6?7134. 51?). 869 V(石油醚?V(丙酮=1?198. 75?). 800 V(甲醇?V(石油醚=2?178. 97?1. 640乙酸乙酯119. 7?1. 253 V(石油醚?V(丙酮=4?185. 85?1. 523 V(丙酮?V(氯仿=1?294. 42?1. 406 V(丙酮?V(甲醇=7?291. 69?2. 193 石油醚125. 83?3. 1872. 3浸提温度对胡萝卜素含量测定的影响随着浸提温度的升高,,胡萝卜素的测定含量呈先增大后减小的趋势,见表3.当恒温水浴温度为35?时,卜胡萝卜素测定的含量最大,为134. 15mg/100g.此后随着恒温水浴温度的升高,,胡萝卜素的测定含量开始平缓地减小.这表明适当地提高浸提温度可提高胡萝卜素的测定含量,过高的温度可能会影响B-胡萝卜素的稳定性,可能会使阡胡萝卜素发生降解而被破坏,使得阡胡萝卜素的测定含量较低.表3浸提温度对B-胡萝卜素含量测定的影响浸提温度/?旷胡萝卜素测定含量/(mg/100g标准偏差25125. 79?3. 463 35134. 15?0. 869 45127. 59?0. 723 55118. 36?1. 562 65121. 56?2. 785 75109. 89?1. 2602. 4提取剂体积对B—胡萝卜素含量测定的影响当提取剂体积为30mL时提取效果较好,此时提取物中的f—胡萝卜素的测定含量达到最高值,见表4.试验表明,提取剂的体积过大或过小,都不利于f—胡萝卜素的提取,因此30mL为最佳提取剂体积.表4提取剂体积对f—胡萝卜素含量测定的影响提取剂体积/mL f-胡萝卜素测定含量/(mg/100g标准偏差15113. 88辺.10920118. 34?3. 06925118. 78?5. 21230134. 5170. 86935116.517. 65440121. 8772. 698232012年菏泽学院学报第5期2. 5浸提时间对胡萝卜素含量测定的影响当浸提时间为12h时,浸提效果最好,此时提取物中的3-胡萝卜素测定含量达到最高值为134. 15mg/100g见表5.浸提时间过短,不利于3-胡萝卜素的充分溶出.随着浸提时间的延长,-胡萝卜素测定含量逐渐增大.表5浸提时间对3—胡萝卜素含量测定的影响浸提时间/h —胡萝卜素测定含量/(mg/100g标准偏差2109. 17?2. 3274111. 85辺.613 6115. 11?2. 023 8117. 04?2. 544 10126. 4271. 732 12134. 5170. 8692. 6正交设计优化提取工艺3—胡萝卜素含量测定的正交试验结果见表6.由表6可知,影响3—胡萝卜素含量测定的因素依次为:浸提温度〉提取剂体积〉浸提时间,最佳提取工艺为A2B2C3,即以V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10777677为提取剂,提取剂体积为30mL,浸提时间为12h,浸提温度为357.表6L(33正交试验结果与分析试验号A浸提温度/?B提取剂体积/mL C浸提时间/h阡胡萝卜素含量/(mg/100g 111199. 20212297.773133103.284212105.675223126.42623112187.731397.458321108.03933295.82K1100. 08100. 77109. 70K2117. 99110. 7499. 75K100. 43106. 99109. 05R17. 919. 979. 95优水平A2B2C3主次因素A > B >C3讨论与结论1 3-胡萝卜素易被氧化,见光易分解,故本试验须在遮光条件下进行.样品在提取过程中,遮光条件下浸泡12h,在一定程度上减少了3-胡萝卜素的损失,从而提高了3—胡萝卜素的测定含量.2通过正交试验得出,提取3-胡萝卜素的最佳工艺条件为:V(正庚烷?V(丙酮?V(无水乙332012年赵楠,等:螺旋藻粉3-胡萝卜素含量测定方法的优化第5期醇?V(甲苯=10?7?6?7为提取剂,提取剂体积为30mL,35?下浸提12h;在最佳工艺条件下3—胡萝卜素的测定含量为134. 5mg/100g.3本试验方法简单,实验所需仪器均较为普通,便于企业生产过程对3-胡萝卜素进行快速检测及监控.参考文献:[1] 王文博.螺旋藻的生物活性成分分析及其免疫特性研究[D].呼和浩特:内蒙古农业大学,2009.[2] 赵文恩,韩雅珊,苏震,等.类胡萝卜素对H202—NaCIO体系生成的102的淬灭作用[J].生物物理学报,1997,13(1:137—142.[3] Gregory G K,Chen T S,Philip T. Quantitative analysis of lutein esters in marigold flowers(Tagetes erectaby high performanee liquid chromatography[J]. Food Sci,1986,51(4:1093—1095.[4] 房明.螺旋藻p-胡萝卜素的提取及生物活性研究进展[J].现代农村科技,2012,(1:70- 71.⑸李新,安鑫南,刘震.胡萝卜素原料筛选及其超临界二氧化碳萃取[J].南京林业大学学报,1999,23(3: 37—40.[6] 郑静.螺旋藻化学成分及其生物活性研究[J].科技信息,2009,(7:25—27.[7] 赵厚民,徐慧,周小平.螺旋藻中B—胡萝卜素高效液相色谱测定方法的研究[J].中国野生植物资源,2005,24(3:43 —45.[8] 卢红梅,梁逸曾.高效液相色谱法测定食物中的类胡萝卜素[J].色谱,2005,23(1:57—62.The Optimizati on of Method for Determ in ati onof 3- carotene from Spirulina PowderZHAO Nan 1丄I Yong —yong1,SHAO Ming —fei2,YU Zhang —yu1,3,QIN Song4(1. College of Chemistry and Chemical Engineering,Qufu Normal University,Qufu Sha ndo ng273165,Chi na;2. Key Laboratory of Marine Biology in Jiangsu,College of Resources andEn vir onmen tal Scie nces,Nanjing Agricultural University,Nanjing Jangsu210095,China;3. Department of Chemistry and Chemical Engineering,Heze University,Heze Sha ndon g274015,Chi na;4. Biological Resources Laboratory,Yantai Institute of Coastal Zone Research,Chi nese Academy of Scie nces,Ya ntai Sha ndo ng264003,Chi naAbstract:I n this paper,the beta- carote ne of Spiruli na Powder was determ ined by UV —visible spectropho-tometry. The process for the extraction of bet—carotene was optimized as followed:n —hepta ne?acet on e?etha-nol ?toluene=10?7?6?7as extracti on age nt,extracti on solve nt volume30mL,the extract ion time12h,extrac-ti on temperature35?Key words:Spiruli na Powder;Beta— carote ne;c onten t;determ ine2012年菏泽学院学报第5期。
高效液相色谱法分析蔬菜水果及其制品中类胡萝卜素含量的研究

营养功能高效液相色谱法分析蔬菜水果及其制品中类胡萝卜素含量的研究*刘新艳吕军刘中笑李凌云张延国郑姝宁徐东辉渊中国农业科学院蔬菜花卉研究所,农业部蔬菜质量安全控制重点实验室,农业部蔬菜产品质量安全风险 评估实验室(北京),农业部园艺作物生物学与种质创制重点实验室,北京100081)摘要:通过优化样品前处理和色谱分析条件,建立了蔬菜水果及其制品中类胡萝卜素含量的髙效液相色谱测定方法。
试样中的类胡萝卜素经丙酮-石油醚(V+ V=1 + 1,0.1%BHT)混合溶液提取后,用石油醚液液萃取,再用丙酮定容、乙腈 稀释,最后用配有紫外检测器的髙效液相色谱仪在C3。
色谱柱、波长450 nm处测定,根据色谱峰的保留时间定性,外标法 定量。
结果表明,该方法前处理简单髙效,适用范围广,测定结果精密度髙,可快速分析测定蔬菜水果及其制品中多种类胡 萝卜素含量。
关键词:类胡萝卜素曰蔬菜曰水果曰髙效液相色谱法类胡萝卜素,又称多烯色素,是在天然食品原 料中分布最广泛的色素。
红色、黄色和橙色水果及 根用作物和蔬菜是富含类胡萝卜素的食品。
一般来 说,富含叶绿素的植物组织也富含类胡萝卜素,因为叶绿体和有色体是类胡萝卜素含量较丰富的细胞 器。
根据其结构划分,类胡萝卜素可归为两大类院 一类是纯碳氢化物,被称为胡萝卜素,包括番茄红 素、琢-胡萝卜素、茁-胡萝卜素和酌-胡萝卜素;另一类具有羟基、环氧基、醛基、酮基等含氧基 团,称为叶黄素类,包括叶黄素、玉米黄素、辣椒 红素、隐黄素等。
动物和人不能自身合成胡萝卜 素,主要通过食物获得。
茁-胡萝卜素是人体合成 维生素A的重要前体物质,称为维生素A原。
维 生素A在人体正常生长和组织修复过程中起着重 要作用,对维持人体视觉系统和免疫系统的正常生 理功能尤为重要[2]。
番茄红素是一种红色素,存在于许多水果和蔬菜中,可以作为单线态氧的有效猝 灭剂,能消除羟自由基,在细胞中和脂类结合而有 效抑制脂质的氧化,是非常好的食用抗氧化剂,对 降低恶性肿瘤和冠心病发病率起着重要作用[3]。
类胡萝卜素标准检测法

类胡萝卜素标准检测法类胡萝卜素是一类重要的营养物质,对人体健康具有重要意义。
为了确保产品质量和食品安全,需要对类胡萝卜素进行标准检测。
本文将介绍类胡萝卜素的标准检测方法,以及相关的实验步骤和注意事项。
首先,类胡萝卜素标准检测法的原理是基于其在特定波长下的吸光度进行测定。
常用的检测方法包括高效液相色谱法(HPLC)、紫外-可见分光光度法(UV-Vis)和荧光光度法等。
其中,HPLC法是目前应用最为广泛的一种方法,其准确性高、灵敏度好,能够有效地分离和测定不同种类的类胡萝卜素。
具体的实验步骤如下:1. 样品制备,将待测样品进行适当的处理,如研磨、溶解等,以获得均匀的样品溶液。
2. 仪器设置,根据HPLC仪器的要求,设置合适的流速、柱温、检测波长等参数。
3. 样品进样,将样品溶液注入HPLC仪器的进样口,进行进样操作。
4. 色谱条件,根据实际需要,设置合适的色谱条件,如流动相的组成、梯度elution 程序等。
5. 数据处理,通过仪器自带的软件或其他数据处理软件,对检测到的色谱图进行处理,获得类胡萝卜素的含量数据。
需要注意的是,在进行类胡萝卜素标准检测时,需要注意以下几点:1. 样品制备的均匀性和稳定性对实验结果有重要影响,因此在样品制备过程中要严格控制各项条件。
2. 仪器的准确性和灵敏度直接影响到实验结果的可靠性,因此在进行实验前要对仪器进行严格的校准和验证。
3. 实验操作过程中要注意避免空气氧化、光照等因素对类胡萝卜素的影响,以确保实验结果的准确性。
总之,类胡萝卜素标准检测法是一项重要的实验技术,对于保障产品质量和食品安全具有重要意义。
通过本文的介绍,相信读者对类胡萝卜素的标准检测方法有了更深入的了解,希望能够对相关领域的研究和实践工作有所帮助。
鉴定胡萝卜素的方法

鉴定胡萝卜素的方法鉴定胡萝卜素的方法是根据其特有的物理和化学特性进行分析和鉴定。
下面将详细介绍几种常用的鉴定胡萝卜素的方法。
1. 红外光谱法红外光谱法是通过测量胡萝卜素在红外光谱范围内的吸收光谱来鉴定。
胡萝卜素的红外光谱通常在1500-4000cm-1之间出现特征吸收峰,可以与已知的胡萝卜素标准品进行比较,从而鉴定胡萝卜素的种类和含量。
2. 紫外-可见光谱法紫外-可见光谱法是通过测量胡萝卜素在紫外-可见光谱范围内的吸收光谱来进行鉴定。
胡萝卜素在可见光区域具有强烈的吸收能力,典型的吸收波长为450-550nm,可以通过与胡萝卜素的吸收光谱进行比较来鉴定其存在与否。
3. 高效液相色谱法(HPLC)高效液相色谱法是目前最常用的鉴定胡萝卜素的方法之一。
该方法利用色谱柱对样品中的胡萝卜素进行分离,再通过紫外-可见光谱检测器检测各种胡萝卜素的峰值,进而确定胡萝卜素的种类和含量。
该方法具有高灵敏度、高分辨率、高准确性等优点。
4. 液相质谱法(LC-MS)液相质谱法是一种结合了高效液相色谱与质谱的分析技术。
该方法将色谱分离与质谱分析有机地结合在一起,能够对样品中的胡萝卜素进行高效分离和精确定性,同时还能确定胡萝卜素的分子式、相对分子质量等信息。
5. 化学反应法化学反应法是通过胡萝卜素与特定试剂发生化学反应,产生可观察的色变或沉淀来鉴定胡萝卜素的存在。
例如,利用胡萝卜素与硫酸氢钠和硝酸银反应生成硝酸β-胡萝卜素银沉淀的方法,可以初步确认样品中存在胡萝卜素。
总结起来,鉴定胡萝卜素的方法主要包括红外光谱法、紫外-可见光谱法、高效液相色谱法、液相质谱法和化学反应法。
这些方法各具特点,在实际应用中可以根据需要选择适合的方法进行鉴定。
在实际应用中,基于多个方法的综合分析可以提高鉴定的准确性和可靠性。
胡萝卜素的鉴定方法

胡萝卜素的鉴定方法胡萝卜素是一类存在于植物中的天然有机化合物,也是一种重要的营养成分。
它们具有丰富的维生素A前体,有助于维持视力和皮肤健康,还具有抗氧化作用,有助于降低患癌症和心血管疾病的风险。
因此,对胡萝卜素的鉴定方法具有重要的营养和医疗意义。
常见的胡萝卜素主要有β-胡萝卜素、α-胡萝卜素、γ-胡萝卜素和其他类胡萝卜素。
以下是几种常用的鉴定方法:1. 超高效液相色谱法(UHPLC):UHPLC是一种高效的色谱分析技术,可以准确地分离和鉴定胡萝卜素。
该方法快速且高效,能同时检测多种胡萝卜素。
在此方法中,样品先经过净化和提取,再利用UHPLC仪器进行色谱分离和定量分析。
2. 气相色谱法(GC):GC是一种常用的色谱分析技术,适用于鉴定胡萝卜素类化合物的结构和定量分析。
该方法将样品溶解于有机溶剂中,然后注入GC仪器进行分析。
通过与标准品进行比较,可以确定样品中胡萝卜素化合物的含量和种类。
3. 高效液相色谱法(HPLC):HPLC是一种常见的分析技术,适用于胡萝卜素的定量和质量分析。
该方法将样品溶解于有机溶剂中,然后通过HPLC仪器进行分析。
利用吸收光谱或荧光检测器,可定量分析样品中各种胡萝卜素的含量。
4. 紫外可见光谱法(UV-Vis):UV-Vis光谱法是一种常用的鉴定胡萝卜素的方法。
通过在250-550nm波长范围内测量样品的吸收光谱,可以判断样品中胡萝卜素的存在和含量。
该方法简单易行,但需要与标准品进行比较来确定化合物类型和含量。
5. 质谱法(MS):质谱法是一种高灵敏度和选择性的分析技术,可以准确鉴定和定量分析胡萝卜素。
该方法将样品分子离子化,并在质谱仪器中进行质量分析,从而确定胡萝卜素的分子量和结构。
质谱法通常与其他色谱技术(如GC-MS或LC-MS)结合使用,提高鉴定的准确性和可靠性。
总结起来,胡萝卜素的鉴定方法有超高效液相色谱法、气相色谱法、高效液相色谱法、紫外可见光谱法和质谱法。
这些方法各有优劣,可以根据实际需要选择合适的方法进行胡萝卜素的鉴定和定量分析。
类胡萝卜素检测

类胡萝卜素检测
类胡萝卜素(Carotenoids)是一类广泛存在于动物、高等植物、真菌中的天然色素的总称,种类繁多,已经发现的天然类胡萝卜素就有700多种,按其化学结构和溶解性的不同可分为胡萝卜素类(Carotenes)和叶黄素类(Xanthophylls)两大类。
其中,胡萝卜素类主要包括α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素和番茄红素等;叶黄素类主要包括叶黄素、α-隐黄质、β-隐黄质、玉米黄素(玉米黄质)、虾青素、辣椒红素和藏红素(栀子黄)等。
迪信泰检测平台采用高效液相色谱(HPLC)方法,使用Agilent或者Waters高效液相色谱仪,配备DAD检测器或ELSD检测器,可检测各类样品中类胡萝卜素含量变化。
此外,我们还提供生化法检测类胡萝卜素含量以及其他色素检测服务,以满足您的不同需求。
检测项目。
检测指标。
检测方法。
类胡萝卜素。
高效液相色谱法/生化法。
胡萝卜素。
高效液相色谱法。
β-胡萝卜素。
高效液相色谱法。
番茄红素。
高效液相色谱法。
叶黄素。
高效液相色谱法。
β-隐黄质。
高效液相色谱法。
玉米黄素/玉米黄质/隐黄素。
高效液相色谱法。
虾青素。
高效液相色谱法。
其他类胡萝卜素。
迪信泰检测平台可根据需求定制其他物质测定方案,具体可免费咨询技术支持。
检测7种类胡萝卜素的方法[发明专利]
![检测7种类胡萝卜素的方法[发明专利]](https://img.taocdn.com/s3/m/be97a914a4e9856a561252d380eb6294dd88228d.png)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 202011376641.9(22)申请日 2020.11.30(71)申请人 深圳大学地址 518000 广东省深圳市南山区南海大道3688号(72)发明人 陈峰 刘宾 (74)专利代理机构 深圳中一联合知识产权代理有限公司 44414代理人 郝文婷(51)Int.Cl.G01N 30/02(2006.01)G01N 30/06(2006.01)G01N 30/34(2006.01)G01N 30/72(2006.01)G01N 30/86(2006.01)(54)发明名称检测7种类胡萝卜素的方法(57)摘要本申请涉及分析化学技术领域,提供了一种检测7种类胡萝卜素的方法,同时对岩藻黄醇、岩藻黄素、硅甲藻黄素、硅藻黄素、新黄素、玉米黄素、紫黄素7种不同的类胡萝卜素进行检测,首先提供了7种类胡萝卜素的标准品的标准曲线,再提供少量的样品进行检测,根据待测样品的质谱图的保留时间、定量离子对和定性离子对的数值即可确定各中类胡萝卜素的种类,并根据定量离子对的质谱峰面积及标准曲线即可计算得到各类胡萝卜素的含量。
该检测方法所需样品量少,检测快速、高效、灵敏度高,重现性较好,降低了实验误差并提高了数据的准确性,可实现快速、准确的大通量检测。
权利要求书2页 说明书12页 附图4页CN 112557536 A 2021.03.26C N 112557536A1.一种检测7种类胡萝卜素的方法,其特征在于,包括如下步骤:配制岩藻黄醇标准品、岩藻黄素标准品、硅甲藻黄素标准品、硅藻黄素标准品、新黄素标准品、玉米黄素标准品、紫黄素标准品的混合标准溶液,将所述混合标准溶液进行超高效液相色谱质谱检测得到标准图谱,并制作各标准品的标准曲线,获取各标准品的回归方程;配制待测样品,将所述待测样品在与所述混合标准溶液相同的检测条件下进行超高效液相色谱质谱检测,获得所述待测样品的质谱图;根据所述待测品的质谱图的保留时间、定量离子对和定性离子对的数值确定岩藻黄醇、岩藻黄素、硅甲藻黄素、硅藻黄素、新黄素、玉米黄素、紫黄素的种类,并根据各种类的定量离子对的质谱峰面积计算得到所述待测品中岩藻黄醇、岩藻黄素、硅甲藻黄素、硅藻黄素、新黄素、玉米黄素、紫黄素的含量。
类胡萝卜素检测
类胡萝卜素是广泛分布在生物中的一种光辅助合成类色素,属于脂溶性化合物,种类繁多,
迄今为止已确定结构的就有600多种,如虾青素、玉米黄素、番茄红素、β-胡萝卜素、叶黄
素等都是重要类胡萝卜素。
类胡萝卜素的提取方法:
(1)有机溶剂提取法:利用丙酮、乙醇、甲醇等有机溶剂提取,常用于科学研究中生物样
本类胡萝卜素的提取,目前乙醇是最安全的提取溶剂。
(2)植物油提取法:能较好的保持生物中类胡萝卜素的天然性,常用于海洋生物中类胡萝
卜素的提取。
(3)超临界二氧化碳提取法:能保持类胡萝卜素天然性的同时提取率能达到99%以上,是
一种新的提取技术,能解决有机溶剂提取的局限性。
注:类胡萝卜素遇光和氧容易分解,建议整个实验过程在黄色弱光中进行。
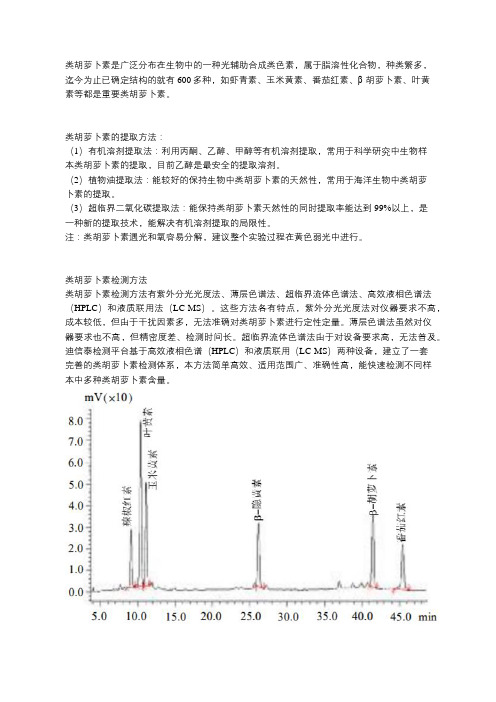
类胡萝卜素检测方法
类胡萝卜素检测方法有紫外分光光度法、薄层色谱法、超临界流体色谱法、高效液相色谱法(HPLC)和液质联用法(LC-MS)。
这些方法各有特点,紫外分光光度法对仪器要求不高,成本较低,但由于干扰因素多,无法准确对类胡萝卜素进行定性定量。
薄层色谱法虽然对仪
器要求也不高,但精密度差、检测时间长。
超临界流体色谱法由于对设备要求高,无法普及。
迪信泰检测平台基于高效液相色谱(HPLC)和液质联用(LC-MS)两种设备,建立了一套
完善的类胡萝卜素检测体系,本方法简单高效、适用范围广、准确性高,能快速检测不同样
本中多种类胡萝卜素含量。
注:类胡萝卜素标准溶液HPLC色谱图
迪信泰生物检测【biotech-pack-analytical】。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
类胡萝卜素(以β-胡萝卜素计)的测定
A.1.1 原理
根据在碱性条件下,样品中其它色素及酯类可被皂化,可用水除去。
不被皂化的总类胡萝卜素,可溶于乙醚中,通过测定其特征吸光度计算含量。
A.1.2 试剂
所用试剂均为分析纯试剂。
a)混合溶剂:正己烷、丙酮、乙醇、甲苯体积比为10:7:6:7。
b)乙醚
c) 40%KOH甲醇溶液:20克KOH溶于少量水中,用甲醇定容于50ml。
d)无水硫酸钠
A.1.3 仪器
分光光度计、恒温水浴锅。
A.1.4 操作方法
A.1.4.1 样品处理
称取0.03g至0.05g(精确至0.0001g)样品于50ml的比色管中,加35ml混合溶剂(a)和1ml40%KOH溶液(c),35℃恒温水浴并避光超声2小时,将浸泡提取液倒入250ml的分液漏斗中;在浸泡过的样品中加入25ml蒸馏水,轻轻摇荡、静置,合并以上提取液,加入乙醚(b)50ml萃取,并于萃取液中加入100ml蒸馏水,轻轻摇荡、静置,弃去下层溶液,重复洗涤至少两次,萃取液经过10g的无水硫酸钠(d),收集于100ml容量瓶中,用乙醚(b)定容至刻度线。
A.1.4.2 测定
以乙醚(b)作空白,用带塞的1cm玻璃比色皿在453.0nm处测定吸光度。
A.1.5 计算
类胡萝卜素含量(g/kg)=A453.0×V×10
G×E
式中:A:波长为453.0nm处的吸光度;
V:定容萃取溶液的体积,ml;
G:样品重量(g);
E:总类胡萝卜素的吸光系数(2500)。
A.1.6 检验结果报告
保留两位有效数字。
本方法来源于《中国螺旋藻战略联盟食用螺旋藻行业标准》。
