制药企业计算机系统验证方法
药品生产中计算机处理系统的验证指南.docx

药品生产中计算机处理系统的验证指南目录I. INTRODUCTION 绪论□ .OVERVIEW概述III. HARDW ARE 硬件A. Types 类型1. Input Devices 输入设备2. Output Devices 输岀设备.3. Signal Converters 信号转换器4. Cen tral Processi ng Uni t (CPU) 中央处理单元5. Distribution System 分布式系统6. Peripheral Devices 外围设备B. Key Points 关键点1. Location 位置2. Sig nal Con version 信号转换3. I/O Device Operation 输入/输岀设备操作4. Comma nd Over-rides 指令中断5. Maintenance 维护C. Validation of Hardware 硬件确认IV. SOFTWARE 软件A. Levels 分级B. Software Ide ntificatio n 软件验证C. Key Points 关键点1. Software Development 软件升级2. Software Security 软件安全D. Validation of Software 软件确认▽ COMPUTERIZED OPERATIONS 计算机化操作A. Networks 网络B. Manual Back-up Systems 手动备份系统C. I nput/Output Checks 输入/ 输岀检查D. Process Documentation 过程文件E. Mon itori ng of Computerized Operatio ns 计算机化操作的监视F. Alarms 报警G. Shutdown Recovery 停止恢复VI . CGMP GUIDANCE CGMP 指导A. Hardware 硬件B. Software 软件附录:GLOSSARY术语表GUIDE TO INSPECTION OFCOMPUTERIZED SYSTEMS IN DRUGPROCESSING药品生产中计算机处理系统的验证指南FEBRUARY, 1983National Center for Drugs and BiologicsandExecutive Director of Regional OperationsI. INTRODUCTION 绪论Computers are being used in increasing numbers in the pharmaceutical industry. As microprocessors become more powerful, reliable, and less expensive we can expect the proliferation of this technology, with increasing use by even very small pharmaceutical establishments.在制药工业中,越来越多数量的计算机被使用。
计算机系统验证

计算机系统验证1.概述本篇描述了与GMP 相关的计算机系统的验证方法。
计算机系统是用来执行一种特定功能或一组功能的硬件、系统和应用软件及有关外围设施的系统。
与GMP 相关的计算机系统包括以下过程中所使用的计算机系统。
①生产过程。
②生产环境。
③过程掌握。
④质量决断过程。
⑤物料掌握及治理。
计算机系统验证是建立文件来证明计算机系统的开发符合质量工程的原则,能够供给满足用户需求的功能并且能够稳定长期工作的过程。
计算机系统验证可借助于工艺验证的概念来理解。
工艺验证中的“工艺”相当于计算机的“输入”过程和“内部处理’’过程(软件),工艺中用到的设备相当于计算机主机、外围设备(硬件)以及与其相关的生产设备或质量掌握设备,工艺的“产品”相当于计算机的“输出”或对另一台设备的掌握等。
计算机系统验证与工艺验证缺乏之处是:术语上的不同(如数据处理概念)和由于软件的特性,使一般用户对软件和软件的开发相对不生疏。
本篇将围绕计算机系统的验证,描述以下内容。
①验证范畴。
②名词解释。
③计算机系统分类。
④计算机系统进展生命周期。
⑤验证明施过程。
2.范畴本文所争论的计算机系统验证,适用于制药企业被确定为与GXP 相关的计算机系统,该系统包括以下内容。
(1)物料掌握及治理系统如BPCS、SAP 系统等。
(2)试验室设备掌握系统及信息治理系统如LIMS 系统。
(3)生产工艺及掌握系统如PLC(可编程序规律掌握器)等。
(4)公用设施掌握系统。
在功能上,上述这些系统符合诸如以下GMP 的某一属性。
(1)自动掌握①工艺掌握。
②环境掌握。
③质量掌握。
④自动清洗。
⑤在线灭菌等。
(2)物料掌握①物料状态掌握及隔离。
②先进先出(或先近效期先出)。
③批次追赶。
④物料平衡。
⑤发货查询。
(3)根底数据掌握①生产处方。
②批生产文件。
③产品及包装形式信息。
④鉴别产品名称、编码、批号等信息。
3.名词解释1.操作系统(Operation system)应实现治理(处理器、存储器/外部设备和信息)的要求而特地编制的一个规模较大的、能够协调和调度全部设备及各个应用程序高效运行的程序。
制药企业计算机系统验证方法

中国卫生产业Medical apparatus and instruments 医疗器械中国GMP 附录二《计算机化系统》自2015年12月1日颁布以来,不但给制药企业使用自动化系统提供法规依据,而且加大了制药企业使用自控系统的决心,目前有一些制药企业已经在使用EMS 系统来实现生产洁净区的温湿度、压差、尘埃粒子等的在线监控和记录,但在实施EMS 系统时,制药企业就必须要考虑到计算机系统验证问题,那么该文就以EMS 系统为例,介绍如何采用目前国际通用的GAMP5所建议的方法,来实施EMS 系统验证。
1EMS(environmental monitoring system)系统介绍EMS(环境监测系统),由现场仪表、软件与硬件组成,用来对制药企业的关键区域的温湿度、在线粒子及微生物进行参数监控、显示报警警告、提供诊断,以及生成和打印报表。
2EMS 系统验证目前,各国的法规监管机构纷纷颁布了对计算机化系统的管理规范,如美国FDA 的21CFR Part11(电子记录和电子签名),EU GMP 的Annex11(计算机化系统),这些法规规定制药行业的生产、质量、储存、流通的各个环节所使用的计算机化系统必须符合上述法规要求。
而目前整个行业对计算机系统验证所使用的方法均参考国际药物工程协会(ISPE)所制定的GAMP5(良好自动化生产实践指南),而EMS 系统也是属于计算机化系统中典型的一类。
3EMS 系统验证流程3.1用户需求规范(URS )用户需求(URS)是从用户的角度描述系统的需求。
它应当根据系统的工艺需求,描述系统所需具备的功能、控制的参数、数据采集、数据存储、数据输出、数据备份、数据还原、权限控制、电子签名等各项要求,确保系统的项功能满足法规要求及符合预定用途。
用户需求(URS)是验证活动的起点,也是验证活动的终点。
将通过需求追溯矩阵(RTM)确认每一条用户需求被满足。
3.2验证计划VP验证计划中需要介绍系统概述、人员职责、风险评估和确认的方法和交付物等,是验证纲领性文件。
计算机系统验证中文版

确认系统在规定的运行环境中运行时,全部生产工艺活动所发挥的执 行、控制等性能,满足事先批准的规格的要求,并文件化的行为。
2021/4/2
22
GAMP4 (7)
ISPE GAMP4: 规格与确认的基本框架
用户需求标准 (URS)
验证
功能标准 (FS)
验证
设计标准 (DS)
验证
系统构建
2021/4/2
ISPE
International Society for Pharmaceutical Engineering GAMP4:
Good Automation Manufacturing e Guide
GAMP5:
A Risk-Based Approach to Compliant GxP Computerized Systems
用户作业
(1) 系统确认
(2) URS的制定
⇒ D1 用户需求标准的制定
(3) 验证战略的决定
・风险评估
⇒ M3 风险评估
・系统构建评估
⇒ M4 SW/HW的分类
・供应商评估
⇒ M2 供应商审核
(4) 验证计划书的制定
(5) 系统规格的审核
⇒ M5 设计复核与需求追踪能力矩阵
与批准
(6) 系统开发过程的监控
计算机系统验证的实施与要点
2021/4/2
2009年1月19日 日挥株式会社 樱井 国幸
1
讲师介绍
樱井 国幸 (Sakurai Kuniyuki) 日挥株式会社 第2工程本部 医药服务事业部 GMP技术部主管 ・1976年进日挥公司。从事石油精制、石油化学、原料药等仪器设计方 面的工作。 ・之后,从事安全系统、研究所网络以及基础设施系统的设计工作,从 1992年开始从事药品生产设备等生产管理系统(MES)的设计。 ・1996年到1999年为止,负责LNG工厂综合信息系统(ERP,分析信息系 统、厂房信息系统、电子文件管理系统、维护管理系统,等等)的建立。
制药企业计算机化系统验证简述

制药企业计算机化系统验证简述制药企业计算机化系统验证是GMP管理的一个重要组成部分,根据GMP的要求,制药企业计算机化系统验证是通过文件来证明计算机化系统能够提供满足用户需求的功能,并且能够稳定工作。
1、计算机系统与计算机化系统的区别计算机系统:包括软件和硬件两部分。
计算机化系统:除计算机系统本身外,还包括受控的功能和过程,甚至包括系统的运行环境。
计算机化系统可以由下图表示:2、计算机化系统的重要组成计算机化系统中,硬件和软件很重要。
硬件分为2类,分别是:标准硬件和定制硬件;软件分为4类,分别是:标准软件、可配置软件、不可配置软件、定制软件。
硬件分类硬件分类说明示例验证方法类别一:标准硬件根据用户需要的品牌、型号要求,直接从供应商处购买。
开关、阀门、PLC模块确认品牌、型号、序列号、连接是否正确类别二:定制硬件没有符合用户需求的硬件,需要自行定制。
连接线路、纯化水模块设计说明、验收测试、评估或审计、验证等软件分类软件分类说明示例验证方法类别一:基础软件分层式软件和基础软件工具操作系统确认品牌、型号、序列号类别三:不可配置软件供应商提供的软件,只能输入参数,不能配置程序仪器仪表软件、标准商业软件包简化的生命周期方法类别四:可配置软件供应商提供的软件,可以输入参数,可以配置程序,但是不能更改实验室管理系统、生产管理系统、仓储/物料管理系统生命周期方法软件代码类别五:定制软件设计制定程序和编制源代码使其适应用户需要,风险高内部或外部开发的应用程序严格的生命周期方法3、计算机化系统应用范围制药企业常用的计算机化系统类型使用部门具体内容物料仓储和配送系统(ERP)实验室 1、实验室管理系统;2、实验室仪器(HPLC/GC/UV)生产1、生产管理系统;2、生产设备(PLC)公用设施1、水系统自控系统;2、空调系统自控系统管理1、企业资源信息管理软件(ERP);2、电子文档管理系统4、V验证模型在进行计算机化系统验证之前,应进行科学的风险评估以确定验证的范围和深度。
药品GSP计算机信息系统验证方案(已通过认证)

计算机信息系统验证方案1.引言:根据《药品经营质量管理规范》(简称GSP)实施要求,药品经营行业全面推行计算机管理手段,实现药品质量可控、可追溯。
公司于2013年7月请科晴公司对本公司的软件系统进行重新改造,并于2013年9月5日改造安装完成。
在软件投入使用前,需对该软件操作系统进行一次全面验证,以保证该计算机软件能够按照GSP及本公司实际经营情况进行运作。
2.验证方案审批2.1验证方案起草2.2验证方案审批3.验证目的:通过对计算机系统控制的验证,检测计算机系统的登录、查询、锁定、解锁、打印以及经营各环节操作等功能模块状态,确定其功能符合GSP的要求和公司药品经营的实际情形。
4.验证周期4.1系统升级、软件修改或系统遭受病毒攻击,需重新验证;4.2停用8个月以上,重新使用前必须再验证;4.3连续使用时每年再验证一次。
5.验证范围及标准6.验证所需文件和培训6.1验证文件一览表6.2培训6.2.1在本方案实施前,应对方案实施过程中涉及人员进行培训,以保证方案顺利实施,并做好培训记录。
培训内容包括6.1验证文件一览表但不限于此内容。
培训内容表6.2.参加验证培训人员验证人员培训确认表7.验证管理小组及职责8.配套设备简介:9.验证实施条件9.1验证涉及的相关文件均获批复;9.2验证小组成员已经过相关培训;9.3各部门、各岗位计算机系统已安装待验。
10.验证方法:本验证采用软件测试中的“黑盒测试法”,即只看软件功能的设定和符合情况,不考虑计算机本身结构。
检查软件功能是否按照GSP的规定正常使用。
11验证方案的实施11.1验证方案批准后,验证人员应根据验证方案所规定的方法、步骤进行各项目的验证,并及时认真地填写《验证检测记录》(附件1),并汇总测试结果。
把不符合项填入《不符合项汇总表》(附件2)。
11.2在测试过程中发现错误或者故障时,测试人员应将偏差描述、偏差原因分析,测试条件、偏差等级、偏差结果分析、采取措施、偏差结果判定等进行详细记录,填写《偏差分析处理记录》(附件3)。
计算机化系统验证流程-MES系统
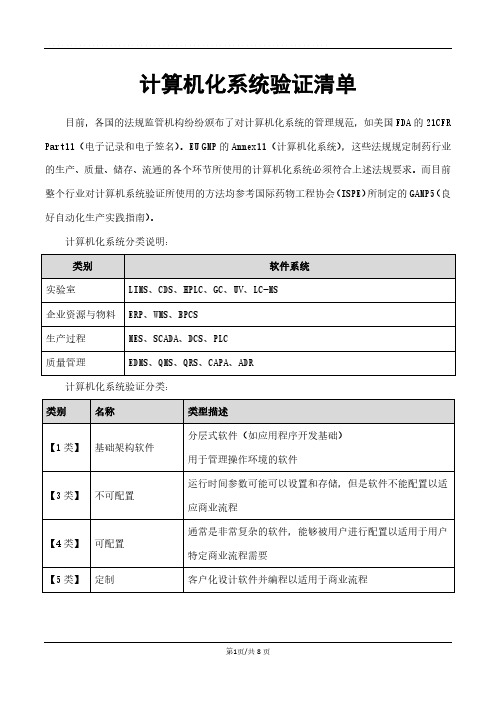
计算机化系统验证清单
目前,各国的法规监管机构纷纷颁布了对计算机化系统的管理规范,如美国FDA的21CFR Part11(电子记录和电子签名)。
EU GMP的Annex11(计算机化系统),这些法规规定制药行业的生产、质量、储存、流通的各个环节所使用的计算机化系统必须符合上述法规要求。
而目前整个行业对计算机系统验证所使用的方法均参考国际药物工程协会(ISPE)所制定的GAMP5(良好自动化生产实践指南)。
计算机化系统分类说明:
计算机化系统验证分类:
1.1计算机化系统验证流程
1.2计算机化系统验证清单
序号验证阶段内容框架类别
【1】计划阶段
01
用户需求说明
(URS)
【编写用户需求】
【审核用户需求】
【批准用户需求】
用户需求(URS)是从用户的角度描述系统的需求。
它应当
根据系统的工艺需求,描述系统所需具备的功能、控制参
数、数据采集、数据存储、数据输出、数据备份、数据还
原、权限控制、电子签名等各项要求,确保系统的功能满
足法规要求及符合预定用途。
用户需求(URS)主要内容:
1、文件的整体介绍,内容包括:
文件内容摘要
目的:阐述写该项目URS的目的。
适用范围:要确定文件用在项目建设中哪个阶段,指导
什么工作。
参考文献:主要列出在描述URS时引用的文献资料名
称、版本、章节等。
2、项目简介、背景
这部分内容应该摘自项目计划书。
3、文件内容,包括:
甲方编写。
SAP计算机系统验证安装确认验证方案-扬子江药业

安装确认方案Installation Qualification 页码:Page1 / 32扬子江药业集团有限公司SAP计算机系统验证安装确认验证方案System Installation Qualification Protocol编制角色姓名签名签名日期编制人审核人批准人颁发部门:质量管理部执行日期:分发部门:财务公司IT处、销售支持部、制造部生产供应部、生产计划与物料管理处版本号:V1.0安装确认方案Installation Qualification 页码:Page2 / 32目录一、验证对象 (4)1.1安装概述 (4)1.2验证目的 (6)1.3验证范围 (6)二、验证组织 (7)2.1验证组成员及职责 (7)2.2验证文档审批流程 (8)三、验证方法 (8)3.1测试期间应遵循的规则 (9)3.2IQ测试 (9)3.3评论或意见处理 (11)3.4IQ偏差的处理 (11)四、进行测试的组件说明 (11)五、测试人员表 (12)六、IQ测试和验收标准 (13)6.1测试环境 (13)6.2IQ测试表 (13)6.3IQ验证中用到的独立文档 (25)七、总结和结论 (26)八、备注/评论 (27)九、问题日志 (29)9.1问题记录 (29)9.2问题解决方法 (29)9.3问题记录表 (30)十、术语表 (31)十一、附录/附件 (32)安装确认方案Installation Qualification 页码:Page3 / 3211.1除测试表以外的其它测试 (32)安装确认方案Installation Qualification 页码:Page4 / 32一、验证对象1.1 安装概述➢项目介绍扬子江药业集团创建于1971年,是一家跨地区、多产业的国家大型医药企业集团。
集团扬子江药业集团的SAP ERP系统安装的版本是mySAP ERP 2004(ECC5.0 SP1),该版本发行于2004年,SAP软件公司官方提供的最后维护期限是2013年3月份,此后不再提供对于该版本的官方技术支持和系统补丁。
试论制药企业计算机系统验证方法

试论制药企业计算机系统验证方法摘要:现如今,自动化系统已经在制药行业开始实施,如果计算机自动化系统想要在制药企业进行普遍和有效及长久的应用,根据计算机自动化系统本身的特殊性和唯一性,所使用的计算机自动化系统就要满足使用者需要的所有功能。
但是根据现阶段的实际情况,我国医药行业面临着新的挑战,在计算机系统验证方面没有积累过多的经验,在实际的制药工作中会出现偏差。
所以,我们要对计算机自动化系统验证的方法及过程进行了解,紧密结合系统的实施和组合,确保计算机自动化系统验证的效果。
文章从EMS系统的简介、验证以及验证的流程进行了论述,对制药企业计算机系统验证工作进行了探讨,仅供参考。
关键词:EMS系统;计算机验证;验证方法和流程中图分类号:TP597.2文献标识码:A1 EMS系统介绍EMS系统主要由软件、硬件和现场仪表三部分组成。
其主要功能是对制药企业重点区域的微生物参数、在线颗粒物、温湿度等进行实时监测。
同时,它还可以显示报警和警告,对问题提供诊断对策并生成相应的报告。
2 EMS系统验证目前,随着全球经济一体化的深入,大多数国家的法律法规监管部门都逐步颁布了具体的管理制度和操作规范,对计算机化系统进行管理。
随着FDA制定的21CFRPart11法规的严格执行,企业运营的每个环节都采用了计算机化系统适用于医药企业的运输、储存、生产和质量管理等[1]。
在我国制药工业中,对计算机化系统进行验证的方法是参照国际制药工程协会编制的GAMP5,这对自动化生产实践有很好的指导意义,而EMS系统在计算机化系统中是很常见的。
3 EMS系统验证流程3.1用户需求规范在验证计算机系统时,如果我们从用户的角度分析计算机系统的实际需求,我们可以称之为用户需求。
我们要充分掌握系统运行的各种工艺要求,更清晰、全面地描述各种参数的潜在要求,以确保系统的功能能够满足我们的预定值要求。
用户需求是实时计算机系统验证的起点和终点。
每一个用户的需求都将通过需求可追溯性得到确认和满足。
制药企业计算机系统管理与验证

1
据企业需求,确定
需要验证的计算机
系统范围。
制定验证计划:根
2
据验证范围,制定
详细ห้องสมุดไป่ตู้验证计划,
包括验证步骤、方
法、标准等。
执行验证:按照验
3
证计划,对计算机
系统进行测试和验
证,确保其满足企
业需求。
记录验证结果:将
4
验证过程中的数据、
结果进行记录,形
成验证报告。
持续改进:根据验
5
证结果,对计算机
系统进行优化和改
系统升级:随着技术的进步,制药企业需要不断升级 计算机系统,以满足新的管理与验证需求。
兼容性问题:系统升级可能带来兼容性问题,需要解 决新旧系统之间的数据迁移和整合问题。
人员培训:系统升级需要员工具备相应的技能和知识, 企业需要加强员工培训,确保系统升级的顺利进行。
跨部门协作与沟通
建立跨部门协 作机制,明确 各部门职责和 协作流程
进,提高系统效率
和稳定性。
验证结果与改进
验证结果:系统是否 符合法规要求,是否 满足企业需求
验证周期:定期进行 系统验证,确保系统 持续符合法规要求
改进措施:根据验证 结果,对系统进行优 化和改进
验证文档:记录验证 过程和结果,形成文 档,便于管理和追溯
制药企业计算机系统管 理与验证的挑战与对策
证
05
PIC/S GMP Guide PE009: 计算机化系统
验证
06
WHO GMP: 药品生产质量
管理规范
07
中国GMP:药 品生产质量管
理规范
08
中国GSP:药 品经营质量管
理规范
09
药企计算化系统验证管理操作规程

XXXXX有限公司【生产质量计算化系统验证管理规程】适用于我公司在药品生产质量管理过程中应用的计算机化系统管理目录1.计算机化系统定义分类1.1系统定义1.2管理原则1.3硬件分类1.4系统分级1.5系统清单2.计算机化系统验证管理规程2.1系统生命周期及管理2.2风险评估管理2.3供应商管理2.4系统台账管理2.6权限安全管理2.7数据安全管理2.8应急预案2.9验证文件的管理3.计算机化系统验证操作规程3.1可行性研究3.2工程计划3.3需求定义3.4系统设计3.5系统测试3.6用户需求标准(URS)3.7安装确认阶段3.8 运行确认阶段3.9性能确认阶段3.10运行阶段3.11系统变更3.12系统引退附件:1、计算机化系统清单2、计算机化系统权限清单3、新用户使用电子系统申请表4、现有用户更改系统权限申请表5、现有用户取消系统授权申请表6、数据备份记录表7、系统验证证书XXXXX有限公司目的:计算机化系统验证工作应遵从的基本程序,使计算机系统验证符合GMP的法规要求,同时使验证工作有组织、有计划的顺利进行。
为了测试、评估计算机和PLC釆取的URS、设计、采购、安装、验证、使用过程,确保计算机和PLC符合设计要求和使用要求,特制定本规程。
范围:适用于公司药品生产质量管理过程中应用的计算机化系统、PLC控制系统。
用于公司所有GMP计算机和自动化系统的管理,此类系统用于或为GMP 法规环境提供支持。
责任:质量部、设备工程部、总办(信息管理)对此规程和实施负责。
参与计算机化系统软件的规划、选型、购置、安装、调试、验收、验证、维修、检查、改造及供应商审计等工作,并在计算机化系统使用及维护过程中提供技术支持。
使用部门:根据计算机化系统标准管理规程正确使用、维护、验证计算机化系统。
依据:中华人民共和国食品药品监督管理《药品生产质量管理规范》等相关条款和要求。
正文:1.计算机化系统定义由硬件、系统软件、应用软件以及相关外围设备组成的,可执行某一功能或一组功能的体系。
试论制药企业计算机系统验证方法

科学技术创新2020.11断故障是否彻底被排除。
如果确认风电机组恢复正常运行,则将本次处理记录生成日志,保留在数据库中。
3大数据在风电机组状态监测中的具体应用3.1基于大数据制定风电机组日常维修方案随着各行各业对电力能源需求的不断上涨,风电场的发电任务更重,这也直接造成了风电机组经常会超负荷运行。
长此以往,风电机组发生故障的规律也会明显的上升。
为了能够让风电机组始终平稳、高效的运行,风电场方面必须要定期做好风电机组的维修工作。
但是风电机组的内部组成复杂,各类元件、设备种类和数量较多,人工检修费时费力,且不容易发现安全隐患。
利用大数据处理技术,直接获取风电机组各部位的运行参数,可以让设备管理人员一目了然的监测运行情况。
根据监测信息,制定风电机组的维护方案,最大程度上避免严重故障的发生。
3.2基于大数据实现风电机组常见故障处理在风电机组运行中,一些突发问题也有可能导致风电机组出现异常工况或严重故障。
在风电机组出现故障后,如何尽快确定故障发生位置和故障产生原因,是技术人员必须要解决的问题。
大数据处理技术在状态监测方面的应用,也可以为故障处理带来极大的便利。
一方面,大数据技术可以实现对风电机组工况的实时监督和同步反馈。
只要风电机组的运行参数异常,系统会自动进行报警,提醒技术人员引起重视。
这样就可以在出现重大故障前,及时采取应对措施,避免故障损失的扩大化。
另一方面,通过大数据分析,还能够向技术人员提供一些维修建议,这对于及时排除故障、恢复风电机组正常运行也有显著的帮助。
4大数据技术应用前后的效果对比为了更加直观的验证大数据处理技术在风电机组状态监测方面的运用效果,本风电场分别选取了大数据处理技术应用前和应用后1年里故障发生次数,并进行对比。
通过对比发现,在未使用大数据处理技术时,风电机组一年内累积发生7起故障,其中有2次严重故障。
机组发电的连续性较差。
在应用大数据处理技术后,风电机组在一年内监测到异常工况10次,经过及时处理,9次异常情况得到了有效处理,全年仅发生1起故障,经过技术人员抢修未造成严重事故。
医药公司计算机验证计划

XXXY医药有限公司
计算机系统验证计划
按照新修订的药品经营质量管理规范的要求,为保证我公司计算机系统能够按照GSP要求,药品经营行业全面推进计算机升级改造完成,特对计算机系统XXX软件进行一次全面验证;
一、验证目的
为规范公司各岗位的计算机操作,使其贯穿并记录公司经营全过程管理和质量管理,确保药品质量的可追溯、药品经营的高效性、达到无纸化的目标;通过计算机系统控制的验证,检测计算机系统的登陆、查询、锁定、解锁、打印以及经营各环节操作等功能模块状态,确认其符合GSP的要求和公司经营的实际情形;
二、参与人员
验证总负责人:
验证实施负责人:
验证技术支持:
验证成员:
三、验证范围
信息部
1)系统登录
2)系统权限设置
3)数据备份
1)系统权限修改、管控
2)数据修改及监管
3)药品信息管理
4)首营企业审核审批
5)首营品种
6)验收记录
采购部
1)拒绝超经营范围和经营方式购进
2)采购订单
3)采购记录
销售部
1)销售出库拒绝向超经营范围和经营方式的客户销售2)销售记录
3)销后退回不支持原始销售数据的任何更改
储运部
1)收货确认系统应当支持收货人员查询采购记录
2)养护计划和养护记录
3)定期盘点
4)出库复核
5)运输跟踪与记录
6)电子监管码扫码及数据上传
1)药品有效期预警和超效期自动锁定
2)疑问药品的控制
3)单据确认与打印
4)各类信息的查询
5)不得采用手工编辑或菜单选择方式录入信息四、验证时间
计算机系统使用后一个月内完成验证
五、验证计划确定。
制药行业CSV计算机信息系统验证方案

制药行业CSV计算机信息系统验证方案验证文件名称验证文件编码计算机信息系统验证方案TS2013-0901受控状态:受控验证编号:TS2013—0901编制部门:质量管理部门编制日期:2013年09月05日审核批准:*****审批日期:2017年09月05日1.引言:根据《药品经营质量管理规范》(简称GSP)实施要求,药品经营行业全面推行计算机管理手段,实现药品质量可控、可追溯。
公司于2013年7月请科晴公司对本公司的软件系统进行重新改造,并于2013年9月5日改造安装完成。
在软件投入使用前,需对该软件操作系统进行一次全面验证,以保证该计算机软件能够按照GSP及本公司实际经营情况进行运作。
2.验证方案审批2.1验证方案起草计算机信息系统验证方案验证文件编码:TS2013-0901起草部门签字日期会签部门签字日期2.2验证方案审批批准部门签字日期3.验证目的:通过对计算机系统控制的验证,检测计算机系统的登录、查询、锁定、解锁、打印以及经营各环节操作等功能模块状态,确定其功能符合GSP的要求和公司药品经营的实际情形。
4.验证周期4.1系统升级、软件修改或系统遭受病毒攻击,需重新验证;4.2停用8个月以上,重新使用前必须再验证;4.3连续使用时每年再验证一次。
5.验证范围及标准验证项目验证标准系统登录1.使用用户名及密码登录后,登录信息相符;2.人员信息更改与登录信息相符。
3.权限变更与变更人员操作权限相符系统权限设置、管控1.购、销、存各流程入口、出口,与数据录入、修改的权限应有质管部审核;2.质管部可查询业务经营相关权限设置;3.各操作岗位通过输入用户名及密码登录,在权限范围内录入、查询数据。
系统权限修改、管控经质量管理人员审核批准后方可修改,修改的原因和过程应当在系统中记录首营企业审核审批维护信息与库存信息相符数据备份按日备份数据,保证系统日志的完整性,首营品种(从批发公司购进)审核及药品批件管理采购首营品种应索取加盖供货单位公章原印章的药品生产或者进口批准证明文件复印件并予以审核,方可采购。
GMP附录——计算机化系统

制药工厂常见的计算机化系统: – 电子文档管理系统 • (如:Q-PaCe系统、SISQP系统) – MES系统 • 生产数据采集 • 电子批记录系统 • 产品释放 • 质量追溯 – 专用软件 • Excel电子表格 • 临床实验软件 • 药物安全性评价软件
软件分类
计算机化系统验证
计算机化系统验证
数据合规性要求
访问控制:只有经许可的人员才能进入和 使用系统。 权限分配:应当对进入和使用系统制订授 权、取消和授权变更的操作规程。 审计追踪:用于记录数据的输入和修改以 及系统的使用和变更。 电子签名:明确了直接对电子数据进行电 子签名是合规的,但电子签名需要符合相 应法规。
电子数据安全性要求查
计算机化系统验证(Computer System Validation, CSV):
建立文件来证明系统的开发符合质量工程的原 则,能够提供满足用户需求的功能并且能够长 期稳定工作的过程。
计算机化系统生命周期:包括由概念提出,需 求理解,经由开发、放行和投入使用,直至系 统退役全过程。
制药工厂常见的计算机化系统: – 企业资源管理信息系统 • (如SAP、用友系统) – 实验室设备控制及信息管理系统 • 图谱软件(HPLC、GC) • 实验室信息管理系统(LIMS系统) – 设备基础设施自动化控制系统(如PLC可编 程逻辑控制器) • 药品生产工艺设备自动化控制 – 原料合成、发酵、冻干机、包装生产 线等 • HAVC、制药用水系统的控制
GMPቤተ መጻሕፍቲ ባይዱ录——计算机化系统
2015.9
2015年5月26日,CFDA正式发布了 2010版GMP法规的新附录之一 《计算机化系统》
将作为正式的法规于2015年12月1日起执行
计算机系统(Computer SYStem) ——由硬件、系统软件、应用软件以及相 关外围设备组成的,可执行某一功能或一 组功能的系统。 计算机化系统(Computerized System) ——指受控系统、计算机控制系统以及人 机接口的组合体系。可以说计算机系统是 计算机化系统的一部分。如果计算机系统 只是用于数据处理,则计算机系统本身就 代表着待验证的整个系统。
论药品生产企业计算机化系统的验证

1 关 于 计 算 机 化 系 统 的 法 规 要 求
系统验证 内容 的专 门规定 , 只是在 《 物料》 、 《 文件》 等章
节 中有所涉及 , 且 都 比较 零 散 , 没有 系统规定 。 虽 然 如
美 国《 联邦管理法》 ( C o d e o f F e d e r a l R e g u l a t i o n s , 以 此 , 但 随着计 算机化 系统在药 品生产 与质量管 理 中的 下简称C F R ) 第2 1 章第2 1 节 的第6 8 条对 药 品生产与质 广 泛 应 用 , 根据G M P的要 求 , 对 计 算 机 化 系 统进 行 验 证
对则
过程 按照验 证
上, 将之 与具体的工艺或操作相 结合 , 实现最 终管理和 目标控制 。 在制 药行业 , 计算机 化系统就是将具体的生
产 过 程 在 相 关 软 件 的 全 面 监 控 下 和 硬 件 的参 与 下 按 照 相 关 的规 程 进 行 运 转 , 从 而 实现 管 理 的 自动 化 、 无 纸 化 和 集 成 信 息化 的 系统 。 根据 G MP 关于验证的定义 , 所 谓
2 验 证 内 容 的研 究
2 . 1 验证 方式 的选择
就验 证 的方式 而言 , 根据 G M ̄ 要求, 可 以 分 为2 种基本形式 : 一 是针 对 具 体 硬 件 , 如 设施 、 设 备等 , 按 设计确 认 ( D Q ) 、 安 装 确 认 ( I Q ) 、 运行确认 ( O Q ) 、 性能确认 ( P Q ) 的 顺 序 进行 ; 二 是针对 具体 的工作程 序 ( 如 工 艺 规
计算机化系统验证总结

计算机化系统验证——风险评估1.1U5上一篇文章发出去之后,有位前辈帮我指出了一个比较大的问题:“计算机化系统”。
在此先给大家道个歉,由于自己疏忽没有用正确的文字去描述,在此更正。
开始前,我本来想自己解释下关于“计算机系统”与“计算机化系统”的概念或者区别,后来百度之后发现另一个前辈解释的更好,在此我就引用这位前辈的解释了(如果涉及到相关版权问题,我将尽快删除这段解释)。
PIC/S中关于“计算机系统”的定义是:软件与硬件的组合,实现特定的功能。
“A group of hardware components and associated software, designed and assembled toperform a specific function or group of functions//Pic/s中有另外的对于“计算机化系统”的定义是:通过计算机系统实现、与计算机系统集成的一系列的流程或者操作。
”计算机化系统”的关键词在于前半句"Process or operation"。
“A process or operation integrated with a com puter system.w谈到“计算机化系统"♦实际包括的不仅是物理存在的系统本身•也包括与系统所支持的流程与操作。
现在很多的企业在做“计算机化系统”验证的时候,更多侧重的往往是项目阶段的系统实施,侧重的是对“计算机系统”本身的功能需求与功能测试,当然这不能说做得不对,但确实是做得不够。
以笔者的感觉而言,很少有企业能够理解计算机系统运行、维护阶段的要求也是验证的一部分;很少有企业能够清楚讲清楚系统究竟如何支持业务流程,产生哪些数据,这些数据应该如何保留,如何销毁;很少有企业能够真正管理好计算机化系统,保持其验证状态.....运维阶段对于“计算机化系统”而言其实往往比项目阶段的系统实施更为重要。
医药计算机验证总结

医药计算机验证总结医药计算机验证是指通过验证和核实计算机系统的正确性和可靠性,以确保医药行业的系统能够满足安全、有效和规范的要求。
本文将总结医药计算机验证的重要性、主要步骤和挑战。
首先,医药计算机验证对于确保药品的安全性和研发流程的规范性至关重要。
计算机系统在医药行业中广泛应用于药物研发、临床试验、药品生产和监管等各个环节。
验证计算机系统可以有效降低错误率,提高数据的准确性和可靠性,确保医药行业的工作流程能够按照国家法规和规章制度进行。
其次,医药计算机验证的主要步骤包括需求分析、系统开发和测试、验证文档编制和执行、问题跟踪和解决,以及验证报告的编写和归档等。
需求分析阶段需要明确系统的功能需求、性能要求和安全规范。
系统开发和测试阶段需要按照需求规定的规范和标准进行软件和硬件的开发和测试。
验证文档编制和执行阶段需要编写验证计划、验证方案、验证测试脚本,并按照计划进行测试和验证。
问题跟踪和解决阶段需要及时记录和解决系统中出现的问题。
验证报告的编写和归档阶段需要总结验证过程中的结果和问题,并将验证报告归档备查。
然而,医药计算机验证也面临着一些挑战。
首先,医药行业的技术不断更新和演进,使得验证工作需要及时跟进新的技术和规范要求。
其次,验证过程需要对系统进行全面的测试,这需要投入大量的资源和时间。
此外,验证过程中可能会出现一些无法预料或难以重现的问题,需要进行详细的调查和分析。
综上所述,医药计算机验证对于确保医药行业的安全性和规范性非常重要。
通过严格的验证过程,可以提高计算机系统的可靠性和准确性,确保医药行业的工作流程符合规定和要求。
然而,医药计算机验证也面临一些挑战,需要不断更新和优化验证方法和流程,以满足医药行业的发展需求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制药企业计算机系统验证方法药品生产厂家在工业4.0、中国制造2025的影响下,逐步开始尝试实施自动化系统,但制药企业实施自动化系统有其特殊性,系统不但要满足用户所需要的功能,并且需要对系统实施计算机化系统验证,目前计算机系统验证在国内药企来说都没有太多经验,本文将介绍如何运用将系统实施与验证结合的方法,来进行计算机系统验证。
标签:EMS系统;计算机化系统验证;CSV;GAMP5[Abstract] The drug manufacturer in industrial 4.0,China manufacturing 2025,and gradually began to try to implement automation system,but pharmaceutical companies implementation of automation system has its particularity,system is not only to meet user needs the function,and the need for the implementation of computerized system validation of the system,at present the computer system validation in the domestic pharmaceutical companies are not too much experience. This paper introduces how to use the method of system implementation and validation in combination with,to verify the computer system.[Key words] EMS system;Computerized system validation;CSV;GAMP5中国GMP附录二《计算机化系统》自2015年12月1日颁布以来,不但给制药企业使用自动化系统提供法规依据,而且加大了制药企业使用自控系统的决心,目前有一些制药企业已经在使用EMS系统来实现生产洁净区的温湿度、压差、尘埃粒子等的在线监控和记录,但在实施EMS系统时,制药企业就必须要考虑到计算机系统验证问题,那么该文就以EMS系统为例,介绍如何采用目前国际通用的GAMP5所建议的方法,来实施EMS系统验证。
1 EMS(environmental monitoring system)系统介绍EMS(环境监测系统),由现场仪表、软件与硬件组成,用来对制药企业的关键区域的温湿度、在线粒子及微生物进行参数监控、显示报警警告、提供诊断,以及生成和打印报表。
2 EMS系统验证目前,各国的法规监管机构纷纷颁布了对计算机化系统的管理规范,如美国FDA的21CFR Part11(电子记录和电子签名),EU GMP的Annex11(计算机化系统),这些法规规定制药行业的生产、质量、储存、流通的各个环节所使用的计算机化系统必须符合上述法规要求。
而目前整个行业对计算机系统验证所使用的方法均参考国际药物工程协会(ISPE)所制定的GAMP5(良好自动化生产实践指南),而EMS系统也是属于计算机化系统中典型的一类。
3 EMS系统验证流程3.1 用户需求规范(URS)用户需求(URS)是从用户的角度描述系统的需求。
它应当根据系统的工艺需求,描述系统所需具备的功能、控制的参数、数据采集、数据存储、数据输出、数据备份、数据还原、权限控制、电子签名等各项要求,确保系统的项功能满足法规要求及符合预定用途。
用户需求(URS)是验证活动的起点,也是验证活动的终点。
将通过需求追溯矩阵(RTM)确认每一条用户需求被满足。
3.2 验证计划VP验证计划中需要介绍系统概述、人员职责、风险评估和确认的方法和交付物等,是验证纲领性文件。
3.3 功能规范FS功能规范(FS)是用于描述计算机化系统组成和功能是如何满足用户需求(URS)和GMP的要求。
3.4 硬件设计规范(HDS)硬件设计规范(HDS)主要定义系统的硬件组成、系统组织结构和接口。
它是对功能规范(FS)进一步的描述,为系统的建造提供参考标准。
3.5 软件设计规范(SDS)软件设计包括两个层面,高级层面定义了软件的模块(分系统)组成完成的软件系统,模块和外部系统内接口。
次级层面描述各个软件模块的操作。
3.6 风险评估(RA)在风险评估阶段,需要进行GXP评估、系统影响性评估、系统复杂性评估以及功能风险评估。
GXP评估是通过判断系统是否影响产品质量、病人的安全或数据完整性,若系统判断为是,那么该系统则需要GXP合规。
系统通过系统影响性评估(SIA)来判断系统属于直接影响系统、还是间接影响系统,还是无影响系统(评估方法见GAMP5附录M3页),直接影像系统需要考虑系统的验证,而间接或者无影响系统则只需要简单测试或者不测试。
系统复杂性评估是对系统的软硬件进行分类,分类方法见GAMP5的附录M4,经过系统复杂性评估后,可决定系统的验证生命周期,具体操作方式可参见GAMP5的附录M3,一旦系统软件被判断为GAMP5的第4、5类,那么则需要更进一步的功能风险评估,功能风险评估的方法可参见GAMP5附录M3,根据功能风险的高、中、低来决定后续测试的复杂程度。
3.7 设计确认(DQ)设计确认是用文件的方式来验证该系统的拟议设计适合其预期使用目的。
主题专家应对每个设计文件进行设计审核和批准。
在相关的设计文件获得批准后,再继续进行后续的相关确认活动。
设计确认应验证已经达到了规范阶段(该文第3.3~3.5节)的可交付成果的要求并且这些可交付成果已经获得批准。
3.8 系统建造系统建造由系统供应商完成,不属于本文所讲的计算机系统验证范畴,但仍属于整个EMS系统工程的一部分。
3.9 工厂验收验收测试(FAT)系统在供应商处进行软件组态和硬件安装,安装完毕后进行工厂验收测试,工厂验收测试的目的是用来确认应用软件和硬件能够按照FS规定的执行。
在FAT测试执行之前必须有已经过批准测试方案。
3.10 现场验收测试(SAT)现场验收测试确认发货到现场后的安装,上电,系统的功能是正常的,并能达到业主在工厂验收测试时接受的功能。
此外还要包含那些没有测试的接口/集成测试的子系统。
3.11 安装确认(IQ)安装确认是用文件的方式来证明该系统是按照工程和供应商的规范安装的。
安装确认通常包括,但不限于:系统组件标识,包括硬件、软件和文档。
外部连接,如电源、网络、公用设备(在适用情况下)。
环境条件确认(在适用情况下)。
通电测试。
进行的组件安装确认方案,并且应追踪相关的安装确认状态。
在对每个组件进行安装确认时,将使用适用于每个组件类型的组件安装确认方案模板。
安装确认计划应在获得预先批准后执行。
相关的安装确认方案执行后获得批准后,就可对组件/过程域进行运行确认。
安装确认计划执行后获得批准也就标志着安装确认结束。
3.12 运行确认(OQ)运行确认是以文件的方式来验证在选定的环境下在整个预期运行范围内该系统能够按照运行规范的要求正常运行。
运行确认通常验证系统是否按照GxP 规定的功能正常地运行(按照功能风险评估),包括但不限于:常见关键功能、安全、电子记录和电子签名、时间同步(如适用)、备份/恢复测试(如适用)(在系统交付使用之前完成)、数据存档/恢复测试(如适用)(在系统交付使用之前完成)、工艺区域特定的关键功能测试(例如画面、历史)、在适用的情况下应测试每个功能的操作限度在适用的情况下应测超出试临界值、在适用的情况下应测试相关关键工艺参数(CPP)的过程操作边界。
3.13 性能确认(PQ)EMS的验证,通常来说需要根据URS来定。
PQ的实施,主要是针对性能来的,而性能并不是指EMS系统本身的性能,而是指工艺或受控对象的性能,了解了这个,才是实施PQ的前提。
对于EMS来说,是拿一定时间的环境运行特性来做PQ,来说明环境状态是好的。
从这一点就可以看出,EMS的PQ不是对自身控制系统的确认。
3.14 需求追溯矩阵(RTM)需求追溯矩阵(RTM)主要用于追溯需求在设计与开发阶段、确认阶段实现情况。
通过追溯矩阵检查需求是否通过适当的配置或设计得到满足,测试或验证活动是否可以追溯至用户需求。
3.15 验证报告验证报告将总结对各项验证活动执行结果总结,回顾各项风险措施是否已经正确执行,偏差、变更情况是否已正确处理并且关闭,验证的结论等。
4 结语采用GAMP5的方法来对EMS系统进行验证,不但满足各个国家现行的法规要求,并且充分利用供应商的知识和经验,避免重复劳动,缩短工程工期。
[参考文献][1] 国际制药工程协会(ISPE).遵从GXP 计算机化系统监管的风险管理方法(GAMP5)[Z].2008.[2] 欧洲药品生产管理规范,卷4,人与兽用医药产品的使用:良好的生产管理规范附录11:计算机系统[Z].2011.[3] 中国药品生产质量管理规范(GMP),附录二:计算机化系统[Z].2012.[4] 曹辉.制药设备自动化系统验证方法[J].化工与医药工程,2014(4):40-47.[5] 陆永杰,姚建林.冻干系统设备的计算机化系统验证研究[J].机电信息,2015(8):9-13.[6] 曾英,王悦丰.制药企业遵循GAMP5的计算机化系统验证实践探讨[J].上海医药,2011,32(8):403-405.[7] 刘放,冯国忠.浅析电子记录管理的主要问题[J].机电信息,2012(29):21-25.[8] 朱伟根.电子记录系统在现代制药生产过程中的作用与应用[J].医药工程设计,2010,31(2):34-36.(收稿日期:2015-11-26)。
