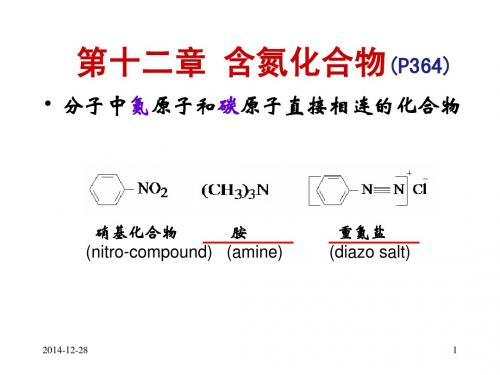
第十二章含氮化合物
合集下载
第十二章含氮有机化合物05

NO2 Zn NH4Claq
NHOH
10
C.在碱性介质中还原产物比较复杂,具体产物取决
于所有试剂:
氧化偶氮苯
偶氮苯
氢化偶氮苯
11
4、硝基苯的苯环上取代反应:硝基为强的第二类定 位基,间位取代,不发生烷基化和酰基化 5、硝基对邻对位的影响,硝基的邻对位上易于发生 亲核取代:
Cl
1.
OH NO2 NaCO 3aq
比较碱性(给电子能力;或比较其共轭酸的稳定性) (1)芳胺<NH3<脂肪胺)
23
• 苯胺的碱性
N
H H
PKb : 9.37
24
诱导效应
溶剂化效应
R N H OH2 H OH2 H OH2 R2 N H OH2 H OH2 R3 N H O H H
(2)脂肪胺: 气态:NH3<C2H5NH2<(C2H5)2NH<(C2H5)3N 水溶液: NH3<C2H5NH2 <(C2H5)3N <(C2H5)2NH
第十二章含氮有机化合物
• 含氮有机化合物是指分子结构中含有碳氮 键的一类化合物。 • 包括: 胺、氨基酸、腈、硝基化合物、酰胺、 重氮和偶氮化合物、含氮杂环化合物及含 氮生物碱等。
• 含氮有机化合物在自然界中分布很广,不 仅在工业、农业和日常生活中具有重要的 意义,而且在生理过程中起着非常重要的 作用。
NH3
SN2
RNH2 + TsO
-
2、加布里埃尔(Gabriel)合成法
O C C O - + NK
O
+R
X
THF 或 DMF
C NR C O
水 解 或 肼 解
第十二章胺、重氮等含氮化合物

R3NR' X
季铵盐:离子,易溶于水相;多碳,易溶于有机相。 季铵盐可将水相中的负离子带入有机相,起到相转移催化的作用。 Phase Transfer Catalysis (PTC)
R-L + M Nu Q X
R-X NaCN 有机相 水相
R-Nu + M L
有机相 R-L1 + Q Nu
R-Nu + Q L
N CH3
70%
托品酮
O (天然产物)
8
四.不饱和胺——烯胺
RNH2 +
CC O H
C C NHR H OH
C C NR
C C NHR
H 伯胺的亚胺比烯胺稳定。
仲胺的烯胺 C C NR2 像烯醇醚,较稳定,为重要中间体。
历程:
CC O H H
C C OH H
R2NH
C C NHR2 H OH
C C NR2 H OH2
RCH2NH2
RR'C=NOH
Na/EtOH or LiAlH4
RR'CHNH2
(3)醛酮还原胺化
R
C R'
O
+ R2NH2
R C NR2
H2/Ni
R'
R CHNHR2
R'
CH3COCH3 + CH3CH2CH2NH2 H2/Ni
(CH3)2CHNHCH2CH2CH3
PhCHO NH3 H2/Ni
PhCH2NH2
CH3COCH3 + HCHO + (CH3)2NH
1. H 2. OH
CH3COCH2CH2N(CH3)2 66-75%
《有机化学》第十二章有机含氮化合物

(电子效应的影响)
:
:
:
:
:
2. 芳胺
NH3 >
NH2
N
H H
综上所述: 脂肪胺 > NH3 > 芳香胺>酰胺
NH2 >
NH
>
N
pkb 9.30
13.80
近乎中性
取代芳胺的碱性:
取代基对芳胺碱性的影响,与其对酚的酸性的影响刚好相反。
在芳胺分子中,当取代基处于氨基的对位或间位时, 给电子基团使碱性↑,而吸电子基团使碱性↓。且取代基 在对位时影响更显著。如:
RNH2 1°
R2NH 2°
R3N 3°
§12-1-2胺的制备方法 1. 氨或胺的烃基化 亲核试剂:NH3、RNH2(以1°胺为宜)。 烃基化试剂:卤代烃
RX + NH3
RNH3+X NH3 RNH2 + NH4+X
2. 腈和酰胺的还原
O
=
CH3
N C6H5
C
CH3
LiAlH4, 醚
CH3
N C6H5
的卤代烃还要高。 (2) 溶解性 硝基化合物的相对密度都大于1,不溶于水。硝基化
合物不仅溶于有机溶剂,而且还溶于浓硫酸。
(3) 多硝基化合物受热易分解而发生爆炸,如:TNT 炸药、2,4,6-三硝基苯酚(俗称:苦味酸)。
但有的多硝基化合物具有类似天然麝香的香气,而被 用作香水、香皂和化妆品的定香剂。如:
硝基中,氮原子和两个氧原子上的p轨道相互重叠, 形成包括O、N、O三个原子在内的共轭体系:
O RN
O
或
R N =O
O
:
由于键长的平均化,硝基中的两个氧原子是等同的
2、 物理性质 (1) b.p: 因-NO2是一个强极性基团,因此硝基化合物具有较
有机化学 第12章 含氮化合物

NH2 对氨基苯磺酸
4.命名芳胺时,当氮上同时连有芳基和脂肪烃基时, 应在芳胺名称前冠以N– ,明确取代基位置。
NHCH3 N(CH3)2 CH3 NCH2CH3
N-甲基苯胺
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
5.氨基连在侧链上的芳胺,一般以脂肪胺为母体来 命名
CH2CH2NH2 2-苯乙胺
(二)氨与醇或酚反应
Al2O3 350~400℃,0.5MPa
CH3OH + NH3
CH3NH2 + (CH3)2NH + (CH3)3N + H2O
OH
+ NH3
(NH4)2SO3 150℃,0.6MPa
NH2
+ H2O
二、由还原反应制胺
(一)硝基化合物的还原 这是制备芳胺常用的方法。 (二)醛和酮的还原氨化 醛和酮与氨或胺反应后,再进行催化氢化,称为醛 和酮的还原氨化。
NH2 MnO2,H2SO4 ~10℃ O O
§12—4 季铵盐和季铵碱
一、季铵盐 叔胺与卤代烷反应,生成季铵盐。 季铵盐是无色晶体,溶于水,不溶于非极性
有机溶剂。 季铵盐的最重要用途是用作阳离子表面活性 剂和相转移催化剂
二、相转移催化剂
(一)含义ຫໍສະໝຸດ 当两种反应物互不相溶时,就 构成了两相。由于反应物之间不容易接触, 反应较难进行,甚至不发生反应。若加入一 种催化剂使反应物之一由原来所在的一相, 穿过两相之间的界面,转移到另一相中,使 两种反应物在均相中反应,则反应较易进行。 这种催化剂叫做相转移催化剂。
(三)与叔胺反应 脂肪族叔胺在强酸性条件下,与亚硝酸形成盐。芳 香族叔胺与亚硝酸反应,生成氨基对位取代的亚硝 基化合物(芳环上的亲电取代反应)。
有机化学:第12章 含氮化合物

R4N+X22:46:50
R4N+OH- + X-
Br CO2H + NH3 (1 mol)
NH2 CO2H OH-
NH3+ CO2-
65-70%
PhNH2 + PhCH2Cl
PhNHCH2Ph 96%
Et3N + PhCH2Cl
Et3N+CH2PhClTEBA Triethybenzylammonium chloridel
——3o胺、叔胺
22:46:50
胺的命名
四、芳香族仲胺、叔胺,基前以N-示区 别苯环的取代(P223)
22:46:50
[胺的分类之二:芳香胺、脂肪胺(P222)]
胺的命名
五、结构比较复杂的胺,将氨基为取代 基(P223)
22:46:50
六、二元胺的命名
——[胺的分类之三:一元胺、二元胺等(P222)]
H2NCH2CH2CH2CH2NH2: 1,4-丁二胺
(腐胺)
H2NCH2CH2CH2CH2CH2NH2:1,5-戊二胺
(尸胺) 腐胺、尸胺是肉腐烂时产生的,极臭、剧毒
(P224)
22:46:50
七、季铵类化合物的命名
——胺、铵(P222)
(季铵碱,碱性与KOH相当)
22:46:50 (俗名: 1227——杀菌剂)
22:46:50
胺的命名
原则:
一、简单胺按所含烃基命名(P223)
22:46:50
胺的命名
二、多个烃基时表示出烃基个数(P223)
[胺的分类之一:伯、仲、叔(P222)]
22:46:50
胺的命名
三、烃基不同时先列简单的(P223)
有机化学第十二章含氮化合物

2020/2/9
一 命名 1 硝酸酯和亚硝酸酯的命名与有机酸酯的命名相同,如
C H O 3N O 2
硝酸甲酯
C H C 2H O 2N O
亚硝酸乙酯
2 硝基和亚硝基化合物中将硝基和亚硝基看作为取代基
CH3NO2
NO2 CH3
CH3
硝基甲烷
2020/2/9
邻硝基甲苯
NO
对亚硝基甲苯
硝酸酯和芳香多硝基化合物都有爆炸性,常 被用做炸药,如
R-CH2NH2 H2O2
RCH=N-OH
肟
R2NH H2O2
R2N-OH
羟胺
(CH3)3N H2O2
2020/2/9
(C H 3)3N - O 氧化三甲胺
3 烷基化 胺和卤代烃反应,脱掉一分子卤化氢
+ C H C 3 H N 2 H 2 C H C 3 H 2 I
伯胺
C ( H C 3 H 2 N ) 2 H H . I
2020/2/9
3 胆碱 4 苯胺 存在于煤焦油中,是油状液体,沸点184℃。工业上用 硝基苯加氢还原制造。有毒。是重要的有机合成原料。 在特能领域使用苯胺制造二苯胺,二苯胺是发射药的 安定剂,可以延长发射药的储存期。
2020/2/9
2020/2/9
3 硝基对芳环上邻、对位基团的影响 (1)对邻、对位上卤原子的影响
Cl 高温高压
+ H2O 催化剂
OH
Cl NO2
+ H2O Na2CO3
NO2
2020/2/9
OH NO2
+HCl
NO2
(2) 对酚的酸性的影响(比较下列化合物的酸性)
OH NO2
OH
有机化学_第十二章_有机含氮化合物

2 、胺的物理性质
低级胺为气体或易挥发性液体; 高级胺为固体; 芳香胺为高沸点的液体或低熔点的固体; 胺具有特殊的气味; 胺能与水形成氢键; 一级胺和二级胺本身分子间也能形成氢键。
(三)胺的化学反应 1、结构
N H H
H
N
(1) 氨和胺中的N是不等性的 sp3杂化,未共用电子
对占据一个sp3杂化轨道。
甲胺
苯胺
甲基乙基环丙胺
2、IUPAC命名法:
选含氮最长的碳链为母体,称某胺。 N上其它烃基为取代基,并用N定其位
CH3
CH3NH2 methylamine H3C N C2H5 N-ethyl-N,4-di ethylbenzenamine
甲胺
N,4-二甲基-N-乙基苯胺
N,N- dimethyl-3-methyl-2-pentanaime CH N( C H ) 3 2 52
NO 2
(3)磺化反应
NH NH NH HSO NHSO H 2 2 3 4 3 H SO 2 4 1 8 0 ℃ H O 2 SO H 3
*有 未 共 用 电 子 对
R N H 2
*碱 性 *亲 核 性
R N 3
*被 氧 化 剂 氧 化 *有 活 泼 氢 *与 强 碱 作 用
1、胺的碱性和胺盐的生成 (1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: 碱的pKb;其共轭酸的pKa;
形成铵正离子的稳定性。
(3)影响碱性强弱的因素: 电子效应:3o胺 > 2o胺 > 1o胺 空间效应:1o胺 > 2o胺 > 3o胺 溶剂化效应:NH3 > 1o胺 > 2o胺 > 3o胺
溶剂化效应是给电子的,N上的H越多,溶剂化效应越大, 形成的铵正离子就越稳定。不同溶剂的溶剂化效应是不同的。
第十二章胺重氮等含氮化合物

Hofmann产物 主要
+ CH3CH=CHCH2 33%
Zaitsev产物 次要
5
6.亲电取代
NR2 + E+
NR2 +
NR2 E
E
E+ = X+, NO2+, SO3, RCO+. 卤代,硝化,磺化,付-克。
三.胺的制备
1.氨或胺的烷基化
RNH2 + R'X 过量
RNHR' + RNH3 X
2.Gabriel 合成法
NK DMF
O NCH2Ph NH2NH2
O
O
NH2CH2Ph
3.还原法
含 C-N 化合物
(1)硝基化合物
PhNO2 Fe/HCl
PhNH2
H2N
NO2 Sn/HCl
H2N
NH2
6
(2)酰胺、腈和
O
RCNH2(R')
1. LiAlH4 2. H2O
RCH2NH2(R')
RCN 1. LiAlH4 2. H2O
CH3(CH2)3NH2
NaNO2 + HCl H2O
CH3(CH2)3-N N Cl
-N2
CH3CH2CH2CH2 H2O
CH3CH2CH2CH2OH + CH3CH2CHCH3
25%
13% OH
CH3CH2CH2CH2Cl + CH3CH2CHCH3 + CH3CH=CHCH3
5%
26% Cl
10%
-H2O
C C NR2 -H
C C NR2
H 亚胺正离子不稳定。
NH O
+ CH3CH=CHCH2 33%
Zaitsev产物 次要
5
6.亲电取代
NR2 + E+
NR2 +
NR2 E
E
E+ = X+, NO2+, SO3, RCO+. 卤代,硝化,磺化,付-克。
三.胺的制备
1.氨或胺的烷基化
RNH2 + R'X 过量
RNHR' + RNH3 X
2.Gabriel 合成法
NK DMF
O NCH2Ph NH2NH2
O
O
NH2CH2Ph
3.还原法
含 C-N 化合物
(1)硝基化合物
PhNO2 Fe/HCl
PhNH2
H2N
NO2 Sn/HCl
H2N
NH2
6
(2)酰胺、腈和
O
RCNH2(R')
1. LiAlH4 2. H2O
RCH2NH2(R')
RCN 1. LiAlH4 2. H2O
CH3(CH2)3NH2
NaNO2 + HCl H2O
CH3(CH2)3-N N Cl
-N2
CH3CH2CH2CH2 H2O
CH3CH2CH2CH2OH + CH3CH2CHCH3
25%
13% OH
CH3CH2CH2CH2Cl + CH3CH2CHCH3 + CH3CH=CHCH3
5%
26% Cl
10%
-H2O
C C NR2 -H
C C NR2
H 亚胺正离子不稳定。
NH O
有机化学 第十二章 含氮化合物
胺的化学性质(P374)
结 构 分 析
2014-12-28
18
1、 胺的碱性和成盐反应
1) 胺的碱性
胺的水溶液和氨一样发生解离反应而呈碱性:
Kb值愈大或pKb值愈小则碱性愈强;反之愈弱。
2014-12-28 19
一些胺的pKb值
2014-12-28
20
①
脂肪胺的碱性大于芳香胺
脂肪胺 氨
芳香胺
2014-12-28
6
12. 2. 1 胺的分类、命名和结构(P370)
1 、 胺的分类:
① RNH2:伯胺; R2NH:仲胺; R3N:叔胺 ② RNH2--脂肪胺; ArNH2 --芳香胺 ③ RNH2:一元胺; H2NRNH2:二元胺;多元胺
*注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义 叔碳
Hofmann 消除的取向
2014-12-28
33
比较:卤代烷的消除取向—Saytzeff 取向 (决定于产物的稳定性)
H H3C CH2 CH ' CH X
H CH2 NaOC2H5 H3C CH2 CH CH
H CH2
主要
主要产物为双键上取代基最多的烯烃。
2014-12-28 34
Hofmann消除取向的解释 (决定于反应物的结构) 从β-氢的位阻和酸性的差别分析
1 含氮化合物的还原 2 酰胺的降解制备 3 氨或胺的烃基化
2014-12-28
50
1、 含氮化合物的还原
(1)硝基化合物的还原
还原剂:H2-Ni(orPt)、Fe(orSn)+HCl、(NH4)2S……
NO2 + 3H 2 NO2
Fe+HCl Ni 常温常压
有机化学第十二章含氮化合物

三、 胺的物理性质
①物态:低级的脂肪族甲胺(二甲胺、三甲胺)、乙胺在 常温下为气体,其他为液体,高级胺为固体;
❖低级的脂肪胺具有难闻的气味:
(CH3)3N H2N(CH2)4NH2
1,4-丁二胺(腐胺)
三甲胺
H2N(CH2)5NH2
1,5-戊二胺(尸胺)
❖芳胺为无色高沸点液体或低溶点固体,气味不如脂肪胺 大,但毒性较大,可透过皮肤吸入。
H2NCH2CH2NH2
H2N
NH2
乙二胺
有机化学第十二章含氮化合物
对苯二胺
3、芳香族仲胺或叔胺命名时,要标出N上的取代基。
CH3 N C2H5
N-甲基-N-乙基苯胺
CH3 N CH3
N,N-二甲基苯胺
4、对比较复杂的胺,是把氨基作为取代基来命名
CH3CHCH2CHCH3
CH3CH2CHCH2CHCH3
含氮的有机化合物可以看作是相应的无机氮化合物的衍生物。 有机含氮化合物的种类很多,范围也很广,它们的结构特征是 含有碳氮键(C—N、C=N、C≡N)有的还含有N—N、N=N、N≡N、 N—O、N=O 及N—H键等。
本章主要讨论胺,简介硝基化合物及有机磷化合物。
❖胺可以看作是氨分子中的氢被烃基取代的衍生物:
··
·
·
··
··
N
H
H
有机化学第十二章含氮化合物
:
:
:
:
:
NH3 >
NH2
N
H H
NH 2 >
NH
>N
RNR R
pkb 9.30
13.80
近乎中性
综上所述: 脂肪胺 > NH3 > 芳香胺 取代芳胺的碱性取决于取代基的性质。
有机-12-12-含氮化合物

CH3COCl
O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
O NHCCH3
=
Br2
O NHCCH3
=
H2O/H+
NH2
Br
Br
硝化: 芳香胺硝化,氨基应加以保护 磺化:苯胺用浓硫酸磺化时,首先生成盐,在加热下失 水生成对氨基苯磺酸(重排)
NH2
c H2SO4
NH3
+H
SO4
-
NH3+
Δ -H2O
内盐 SO3-
四. 个别化合物
H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
Байду номын сангаас
CH3 N CH2CH3 H2NCH2CH2CH2CH2NH2 1,4-丁二胺(腐胺)
N-甲基-N-乙基环戊胺
芳香胺:把芳香胺作为母体,其它烃基作为取代基
NHCH3 CH2CH3 Cl N-甲基苯胺 N CH2CH3 N,N-二乙基-4-氯苯胺 邻乙基苯胺 NH2 CH2CH3
复杂胺:以烃为母体,以氨基为取代基
R–C≡N R–N=C=O
Ar–N2+Cl-
异氰酸酯
亚胺 R–CH=NH
§12.1 胺
一. 分类、命名
胺可以看作是氨的烃基衍生物 伯胺(一级胺) 仲胺(二级胺) 叔胺(三级胺) 季铵盐(四级铵盐)
RNH2 R2NH R3N R4N+XArNH2 Ar2NH Ar3N
注意:伯/仲/ 叔胺与伯/仲/ 叔卤代烃及 伯/仲/叔醇分 类方法的区 别
脂肪胺亲核性比氨强,氨与卤代烃反应得混合物
季铵盐是强酸强碱盐,不能与碱作用生成季铵碱 季铵盐与AgOH作用因生成卤化银沉淀,可得到季 铵碱
R4N+X- + AgOH R4N+OH- + AgX↓
有机化学含氮化合物

例:
NH 2 + CH 3 COCl 苯胺 乙酰 苯胺 NHCOCH
3
NHCOCH
HNO
3
3
H2O H+
NH 2
NO 2 对硝基 乙酰 苯胺
NO 2 对硝基 苯胺
5)磺酰化:胺分子中N原子上的H被磺酰基(R—SO2—) 取代,生成磺酰胺。
RNH
2
+
NaOH
SO 2 Cl 苯磺酰 氯
RNHSO
2
苯磺酰 胺
O 2N Cl NO 2 + H 2 O
Na 2 CO
3
O 2N HO NO 2 + HCl
(煮沸)
★ 原因:—NO2 的吸电子作用使苯环上电子密度降低, 亲核取代易发生。 ② 对酚的酸性的影响:邻、对位上的硝基使酚的酸性 增强。如苯酚pka=9.89,邻硝基酚pka=7.17,对硝 基酚pka=7.16;2,4—二硝基酚pka=3.96。—NO2 对间位取代基也有一定影响,但较弱。如间硝基酚 pka=8.28。
N 2+
0~ 5℃
Hale Waihona Puke PH =6NN
N (C H 3 ) 2
N 2C l
OH
OH 0~ 5℃ PH =8
N
N
CH3
N 2C l
CH3
N (C H 3 ) 2 0~ 5℃ PH =6
N
N
N (C H 3 ) 2
II. 胺 类 12.4 胺的结构与命名
1)结构:
R NH 2 (ArNH2 ) 一级胺 ) 伯胺( R 2 NH (Ar NH ) 2 ( 仲胺 二级胺 ) R3N (Ar 3 N ) 叔胺( 三级胺 ) 脂肪胺 芳香胺
NH 2 + CH 3 COCl 苯胺 乙酰 苯胺 NHCOCH
3
NHCOCH
HNO
3
3
H2O H+
NH 2
NO 2 对硝基 乙酰 苯胺
NO 2 对硝基 苯胺
5)磺酰化:胺分子中N原子上的H被磺酰基(R—SO2—) 取代,生成磺酰胺。
RNH
2
+
NaOH
SO 2 Cl 苯磺酰 氯
RNHSO
2
苯磺酰 胺
O 2N Cl NO 2 + H 2 O
Na 2 CO
3
O 2N HO NO 2 + HCl
(煮沸)
★ 原因:—NO2 的吸电子作用使苯环上电子密度降低, 亲核取代易发生。 ② 对酚的酸性的影响:邻、对位上的硝基使酚的酸性 增强。如苯酚pka=9.89,邻硝基酚pka=7.17,对硝 基酚pka=7.16;2,4—二硝基酚pka=3.96。—NO2 对间位取代基也有一定影响,但较弱。如间硝基酚 pka=8.28。
N 2+
0~ 5℃
Hale Waihona Puke PH =6NN
N (C H 3 ) 2
N 2C l
OH
OH 0~ 5℃ PH =8
N
N
CH3
N 2C l
CH3
N (C H 3 ) 2 0~ 5℃ PH =6
N
N
N (C H 3 ) 2
II. 胺 类 12.4 胺的结构与命名
1)结构:
R NH 2 (ArNH2 ) 一级胺 ) 伯胺( R 2 NH (Ar NH ) 2 ( 仲胺 二级胺 ) R3N (Ar 3 N ) 叔胺( 三级胺 ) 脂肪胺 芳香胺
第十二章 含氮有机化合物

CH3 CH3 N
HCl + NaNO2 80C
CH3 N CH3
N=O
翠绿色
H
+
CH3 OH N= =N
桔黄色
N(CH3)2 HCl
OH
CH3
CH3
NaNO2 CH3 N NO CH3 CH3
+
6.氧化 胺比较容易被氧化,尤其是伯芳胺极易被氧化。苯胺在放 置时就会被空气氧化而颜色变深。
NH2 O
HO
+
R
/
CCl
(CH3CO)2O
O C R/ RNH
HO O NH CCH3
NH2
+ CH3COOH
磺化反应(兴斯堡Hinsberg反应):10、20、30胺的反应表 现有区别,可用来鉴定三类胺。
1
0
RNH2
+
O Cl S O
O RNH S O
NaOH
RNO2S
Na+
有酸性
20
R2NH +
O Cl S O
R CH2 NO2
+ NaOH
R CH2 NO2
Na
+ H2O
特点: 硝基化合物含有α-H,可溶于NaOH溶液,不 含α-H的硝基化合物无此性质.
2.还原反应 硝基化合物在不同条件下还原,得到不同的还原物,用强 还原剂还原的最终产物是伯胺.例如,在酸性介质中以Fe 粉还原硝基苯生成苯胺:
稀 Fe 、 HCl NO 2
N H H
:
N
三. 胺的制备 1.腈的还原
RC
N
+2H2
Ni
RCH2NH2
2.硝基化合物的还原
含氮有机化合物ppt课件

CH3CH2CH2NH2 CH 3CH 2NHCH 2CH 3 CH3CH2-N-CH 2CH2CH3 CH 3
丙胺
二乙胺
甲乙丙胺
2.对于氮原子上连接有脂肪烃基的芳香仲胺和叔胺,常 在脂肪烃基之前冠以“N-”或“N,N-”字:
NH CH3
CH 3 N CH3
N-甲基苯胺
N,N-二甲基苯胺
3.对于比较复杂的胺,常以烃为母体,把氨基作为取代 基来命名。例如:
O
O
N+OH-
OCH3
OCH3
学 习 结 束 !
(一)尿素
尿素简称脲,白色结晶,熔点为133℃,易溶于水和乙醇。
O H2N C NH2
1.弱碱性
尿素分子中含有两个氨基,呈弱碱性,可与强酸生成盐。
硝酸脲
2.水解反应
脲在酸或碱的催化下,加热时发生水解;在脲酶作用下, 水解反应在常温下就能进行。
CO(NH2)2 + H2O 脲酶 CO2 + 2NH3
O
CH3
H3C C O CH2 CH2 N+ CH3 OH-
CH3
(四) 肾上腺素和去甲肾上腺素
肾上腺素和去甲肾上腺素是肾上腺髓质分泌的激素。人工 合成的肾上腺素为白色结晶性粉末,无臭,味苦,极微溶于 水。肾上腺素分子中有酚羟基和甲氨基,具酸碱两性;具有 邻苯二酚结构,遇光和空气易氧化变质。
HO HO
CO(NH2)2 + 2NaOH Na2CO3 + 2NH3
CO(NH2)2 + H2O + 2HCl CO2 + 2NH4Cl
3.与亚硝酸反应
脲能与亚硝酸反应,生成氮气、二氧化碳和水
CO(NH2)2 + 2HNO2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 NH2
NH
N CH3
NH2
胺
芳香胺 芳香仲胺 HN(C6H5)2
NHCH3
N(CH3)2
芳香叔胺 N(C6H5)3
2008-9-27
15
此外,胺能与酸作用生成胺盐。铵盐分子中的 四个氢原子被四个羟基取代后的产物叫做季铵盐, 其相应的氢氧化物叫做季铵碱。例如:
[(CH3)4N] X
季铵盐
[(CH3)4N] OH
NaNO2/HBr
N2Br
Cu2Br2/HBr
Br Br
N2Br
2008-9-27
38
(2) 硝化
NH2 H2SO4
H2SO4 浓 HNO3 浓
NH2 H2SO4 NO2 NaOH NH COCH3
NH2 NO2 NH2
NH2
HNO3 COCH3 乙酸
NH
乙酐
H2O/HO
NO2 NH COCH3
HNO3 乙酐
NO2 NO2 H2O/HO
NH2 NO2
39
2008-9-27
(3) 磺化
2008-9-27
24
(2)成盐及应用
NH2 HBr NH3Br NaOH NH2
不溶于水
溶于水
不溶于水
利用这一性质可分离、提纯和鉴别不溶于水的胺 类化合物。 由于铵盐的水溶性较大,所以含有氨基、亚氨基 或取代氨基的药物常以铵盐的形式供用。
2008-9-27
25
2.烃基化反应
CH3NH2
伯胺 CH3X
2008-9-27
41
第三节 重氮化合物和偶氮化合物
重氮和偶氮化合物分子中都含有氮氮重键(— N2—)官能团。其中—N2—基团的一端与烃基相连, 另一端与非碳原子相连的化合物,叫做重氮化合物。 例如:
2008-9-27
42
N N 的形式两端都与碳原 —N2—基团以 子相连的化合物叫做偶氮化合物。例如:
2008-9-27
21
3.水溶性:低级胺都易溶于水,因为它们都可以 与水形成氢键,叔胺虽然自身不能形成氢键,但 是仍可与水形成氢键。芳胺一般难溶于水。 胺有难闻的气味,许多脂肪胺有鱼腥味,如丁二 胺和戊二胺有腐烂肉的气味,它们又分别称为腐 胺和尸胺。芳香胺的毒性大,有些能致癌。 许多胺有一定生理作用,气态胺对中枢神经系统 有轻微抑制作用。很多药物都含胺的结构,同时 胺是合成药物的重要中间体。
加符号“N”,表示其位置。
(CH3)2CHNHCH3
甲异丙胺
NHCH3
N-甲 基苯胺
NHC2H5 (CH3)2NH
N-乙基环己胺
二甲胺
N(CH3)2
(H5C6)3N
(CH3)3N
三甲胺
N,N-二甲基苯胺
三苯 胺
2008-9-27
18
(2)复杂胺的命名法
复杂的胺命名时是以烃为母体,氨基及取代氨 基作为取代基。例如:
2008-9-27
36
6. 芳环上的取代反应
NH3 强致活基团 NH2 或胺基 O
强致钝基团
NHCR 中等致活基团
2008-9-27
37
(1)卤化
NH2
Br2
NH2 Br Br Br
白色
+
HBr
NH2
乙酐
NH CCH3 O Br2
乙酸
NH CCH3 O H2O/OHBr
NH2
Br
2008-9-27
1.硝基苯(C6H5NO2 ) 硝基苯为浅黄色液体,具有苦杏仁味,是制造苯胺、药物 和染料的重要原料。不溶于水,其蒸气有毒,密度1.203g /ml,熔点5.7℃,沸点210℃,可作为高沸点溶剂。 2.2,4,6-三硝基甲苯(TNT) TNT是黄色结晶,熔融而不分解(240℃才爆炸),受震 而相当稳定,须经起爆剂(雷汞)引发才猛烈爆炸,不腐 蚀金属,是一种优良的炸药。
[(CH3)2N(CH2CH3)]OH
氢氧化二甲基二乙铵
[(CH3CH2)2NH2]Cl 或 (CH3CH2)2NH HCl
氯化二乙铵 (或二乙胺盐酸盐)
2008-9-27
20
二、胺的物理性质
1.状态:脂肪胺中的低级胺,如甲胺、乙胺,常 温下为气体,丙胺以上的为液体,十二碳胺以上 的为固体。芳香胺常为高沸点的液体或固体。 2.沸点:伯胺与仲胺分子间可以形成氢键,叔胺 因氮原子上无氢原子,自身分子间不能形成氢键, 所以相同分子量的化合物的沸点是伯胺>仲胺> 叔胺>烷烃。但胺分子间的氢键较醇、羧酸弱, 所以胺的沸点比相近分子质量的醇、羧酸低。
2008-9-27
32
5.与亚硝酸反应
NaNO2/HX RNH2 0~ 5 ℃
RX + ROH + 烯 + N2↑
NH2 NaNO2/HX 0~ 5 ℃
重氮盐
N2X
H2O
OH
+ N2↑
2008-9-27
33
该反应称为重氮化反应。该反应在药物合成和 有机合成中具有重要作用。
R2NH
NaNO2/HX
2008-9-27
5
芳香硝基化合物的命名
一般是以芳烃为母体,硝基作为取代基来命名。
NO2
O2N CH3 NO2 NO2 O2N NO2 OH NO2
SO3H
间-硝基苯磺酸
2,4,6-三硝基甲苯 (TNT)
2,4,6-三硝基苯酚 (苦味酸)
2008-9-27
6
二、硝基化合物的物理性质
硝基化合物一般都是极性分子,具有较大的偶极 矩,有较高的沸点和密度。芳香族硝基化合物, 多为淡黄色的液体或固体,相对密度都大于1g/m 3,不溶于水,易溶于有机溶剂。分子中硝基数目 增加,热稳定性减小。多硝基化合物具有爆炸性。 硝基化合物常有特殊气味,如硝基苯具有苦杏仁 味。有的多硝基化合物有强烈香味,可作香料, 多硝基化合物有毒,能使血红蛋白变性失去携带 氧气的功能而引起中毒症状。
2008-9-27
28
4.磺酰化反应
SO2Cl
苯磺酰氯
+ RNH2 NaOH
伯胺 NaOH
SO2NHR
苯磺酰胺(可溶碱)
SO2NRNa
苯磺酰胺钠盐(可溶水)
2008-9-27
29
SO2Cl
苯磺酰氯
+ R2NH NaOH
仲胺
SO2NR2
苯磺酰胺(不溶碱)
利用磺酰化反应可合成磺胺类药物;可用来分 离和鉴别伯、仲、叔胺。例如:
季铵碱
[(CH3)2NH] X
胺盐
2008-9-27
16
3.胺的命名
(1)简单胺的命名法 以胺为母体,在烃基名称后面加“胺”字, 称为“某胺”。
(CH3)3CNH2
叔丁胺
CH2NH2
苯甲 胺(苄胺 )
NH2
环己胺
2008-9-27
17
若在仲胺或叔胺中,如果氮原子同时连有环基
和烷基,命名时烷基作为取代基并在烷基的名称前
R2N NO + H2O
N-亚硝基胺
H2O/H
R2NH + HNO2
2008-9-27
34
R 3N
HNO2
[R3NH] NO2
HNO2
H2O/H
R3N
N(CH3)2
(CH3)2N
NO
+
H2O
2008-9-27
35
不同的胺与亚硝酸反应现象不同,可用于鉴别 芳香伯、仲、叔胺。例如:
NH2 无现象 NHCH3 N(CH3)2 HNO2 黄色油状物 翠绿色溶液
第十二章 含氮化合物
2008-9-27
1
有机含氮化合物的范围是很广泛的,它们可 以看作是烃分子中的氢原子被各种含氮原子的官 能团取代而生成的化合物。例如前面各章遇到过 的酰胺、肟、腙等,都属含氮化合物。此外,与 生命现象有直接关系的氨基酸、肽、蛋白质及生 物碱等,都属于含氮化合物的范畴,它们另在后 续章节中讨论。
2008-9-27
11
3.苦味酸 苦味酸的系统名称为2,4,6-三硝基苯酚,为黄色 片状的晶体,熔点为122℃,可溶于乙醇,乙醚 和热水.其水溶液显强酸性,有苦味,故俗称苦 味酸。苦味酸及其盐类易爆炸,可做烈性炸药。 由于其酸性足以与有机碱(如胺,含氮杂环和生 物碱等)生成稳定的难溶性盐类,故可作生物碱 的沉淀剂。因为苦味酸能使蛋白质凝固,故可用 作蛋白质的沉淀剂,可用于丝和毛的染色。苦味 酸还有杀菌止痛功能,医药上可作治疗烧伤的药 物。
2008-9-27
22
三、胺的化学性质
1.碱性
(1)弱碱性 胺的碱性强弱是电子效应、溶剂化 效应和立体效应综合影响的结果。不同胺的碱性强弱 的一般规律为: 脂胺(仲>伯>叔)>氨>芳香胺[(苯胺>二 苯胺>三苯胺)、N,N-二甲苯胺>N-甲苯胺>苯胺]
2008-9-27
23
当芳胺的苯环上连有给电子基时,可使其碱性 增强,而连有吸电子基时,则使其碱性减弱。 例如,下列芳胺的碱性强弱顺序为: 对甲苯胺>苯胺>对氯苯胺>对硝基苯胺
2008-9-27
12
第二节 胺
胺类是指氨分子中的氢原子被烃基取代而生 成的一系列衍生物。 例如: RNH2、R2NH 、R3N
2008-9-27
13
一、胺的分类、构造异构和命名
1.胺的分类
2008-9-27
14
脂伯胺 脂 胺 脂仲胺
脂叔胺 芳香伯胺
CH2NH2
NH2
(CH3CH2)2NH
(CH3CH2)3N
O O NH H
+
O NH C CH3+ CH COOH 3
NH
N CH3
NH2
胺
芳香胺 芳香仲胺 HN(C6H5)2
NHCH3
N(CH3)2
芳香叔胺 N(C6H5)3
2008-9-27
15
此外,胺能与酸作用生成胺盐。铵盐分子中的 四个氢原子被四个羟基取代后的产物叫做季铵盐, 其相应的氢氧化物叫做季铵碱。例如:
[(CH3)4N] X
季铵盐
[(CH3)4N] OH
NaNO2/HBr
N2Br
Cu2Br2/HBr
Br Br
N2Br
2008-9-27
38
(2) 硝化
NH2 H2SO4
H2SO4 浓 HNO3 浓
NH2 H2SO4 NO2 NaOH NH COCH3
NH2 NO2 NH2
NH2
HNO3 COCH3 乙酸
NH
乙酐
H2O/HO
NO2 NH COCH3
HNO3 乙酐
NO2 NO2 H2O/HO
NH2 NO2
39
2008-9-27
(3) 磺化
2008-9-27
24
(2)成盐及应用
NH2 HBr NH3Br NaOH NH2
不溶于水
溶于水
不溶于水
利用这一性质可分离、提纯和鉴别不溶于水的胺 类化合物。 由于铵盐的水溶性较大,所以含有氨基、亚氨基 或取代氨基的药物常以铵盐的形式供用。
2008-9-27
25
2.烃基化反应
CH3NH2
伯胺 CH3X
2008-9-27
41
第三节 重氮化合物和偶氮化合物
重氮和偶氮化合物分子中都含有氮氮重键(— N2—)官能团。其中—N2—基团的一端与烃基相连, 另一端与非碳原子相连的化合物,叫做重氮化合物。 例如:
2008-9-27
42
N N 的形式两端都与碳原 —N2—基团以 子相连的化合物叫做偶氮化合物。例如:
2008-9-27
21
3.水溶性:低级胺都易溶于水,因为它们都可以 与水形成氢键,叔胺虽然自身不能形成氢键,但 是仍可与水形成氢键。芳胺一般难溶于水。 胺有难闻的气味,许多脂肪胺有鱼腥味,如丁二 胺和戊二胺有腐烂肉的气味,它们又分别称为腐 胺和尸胺。芳香胺的毒性大,有些能致癌。 许多胺有一定生理作用,气态胺对中枢神经系统 有轻微抑制作用。很多药物都含胺的结构,同时 胺是合成药物的重要中间体。
加符号“N”,表示其位置。
(CH3)2CHNHCH3
甲异丙胺
NHCH3
N-甲 基苯胺
NHC2H5 (CH3)2NH
N-乙基环己胺
二甲胺
N(CH3)2
(H5C6)3N
(CH3)3N
三甲胺
N,N-二甲基苯胺
三苯 胺
2008-9-27
18
(2)复杂胺的命名法
复杂的胺命名时是以烃为母体,氨基及取代氨 基作为取代基。例如:
2008-9-27
36
6. 芳环上的取代反应
NH3 强致活基团 NH2 或胺基 O
强致钝基团
NHCR 中等致活基团
2008-9-27
37
(1)卤化
NH2
Br2
NH2 Br Br Br
白色
+
HBr
NH2
乙酐
NH CCH3 O Br2
乙酸
NH CCH3 O H2O/OHBr
NH2
Br
2008-9-27
1.硝基苯(C6H5NO2 ) 硝基苯为浅黄色液体,具有苦杏仁味,是制造苯胺、药物 和染料的重要原料。不溶于水,其蒸气有毒,密度1.203g /ml,熔点5.7℃,沸点210℃,可作为高沸点溶剂。 2.2,4,6-三硝基甲苯(TNT) TNT是黄色结晶,熔融而不分解(240℃才爆炸),受震 而相当稳定,须经起爆剂(雷汞)引发才猛烈爆炸,不腐 蚀金属,是一种优良的炸药。
[(CH3)2N(CH2CH3)]OH
氢氧化二甲基二乙铵
[(CH3CH2)2NH2]Cl 或 (CH3CH2)2NH HCl
氯化二乙铵 (或二乙胺盐酸盐)
2008-9-27
20
二、胺的物理性质
1.状态:脂肪胺中的低级胺,如甲胺、乙胺,常 温下为气体,丙胺以上的为液体,十二碳胺以上 的为固体。芳香胺常为高沸点的液体或固体。 2.沸点:伯胺与仲胺分子间可以形成氢键,叔胺 因氮原子上无氢原子,自身分子间不能形成氢键, 所以相同分子量的化合物的沸点是伯胺>仲胺> 叔胺>烷烃。但胺分子间的氢键较醇、羧酸弱, 所以胺的沸点比相近分子质量的醇、羧酸低。
2008-9-27
32
5.与亚硝酸反应
NaNO2/HX RNH2 0~ 5 ℃
RX + ROH + 烯 + N2↑
NH2 NaNO2/HX 0~ 5 ℃
重氮盐
N2X
H2O
OH
+ N2↑
2008-9-27
33
该反应称为重氮化反应。该反应在药物合成和 有机合成中具有重要作用。
R2NH
NaNO2/HX
2008-9-27
5
芳香硝基化合物的命名
一般是以芳烃为母体,硝基作为取代基来命名。
NO2
O2N CH3 NO2 NO2 O2N NO2 OH NO2
SO3H
间-硝基苯磺酸
2,4,6-三硝基甲苯 (TNT)
2,4,6-三硝基苯酚 (苦味酸)
2008-9-27
6
二、硝基化合物的物理性质
硝基化合物一般都是极性分子,具有较大的偶极 矩,有较高的沸点和密度。芳香族硝基化合物, 多为淡黄色的液体或固体,相对密度都大于1g/m 3,不溶于水,易溶于有机溶剂。分子中硝基数目 增加,热稳定性减小。多硝基化合物具有爆炸性。 硝基化合物常有特殊气味,如硝基苯具有苦杏仁 味。有的多硝基化合物有强烈香味,可作香料, 多硝基化合物有毒,能使血红蛋白变性失去携带 氧气的功能而引起中毒症状。
2008-9-27
28
4.磺酰化反应
SO2Cl
苯磺酰氯
+ RNH2 NaOH
伯胺 NaOH
SO2NHR
苯磺酰胺(可溶碱)
SO2NRNa
苯磺酰胺钠盐(可溶水)
2008-9-27
29
SO2Cl
苯磺酰氯
+ R2NH NaOH
仲胺
SO2NR2
苯磺酰胺(不溶碱)
利用磺酰化反应可合成磺胺类药物;可用来分 离和鉴别伯、仲、叔胺。例如:
季铵碱
[(CH3)2NH] X
胺盐
2008-9-27
16
3.胺的命名
(1)简单胺的命名法 以胺为母体,在烃基名称后面加“胺”字, 称为“某胺”。
(CH3)3CNH2
叔丁胺
CH2NH2
苯甲 胺(苄胺 )
NH2
环己胺
2008-9-27
17
若在仲胺或叔胺中,如果氮原子同时连有环基
和烷基,命名时烷基作为取代基并在烷基的名称前
R2N NO + H2O
N-亚硝基胺
H2O/H
R2NH + HNO2
2008-9-27
34
R 3N
HNO2
[R3NH] NO2
HNO2
H2O/H
R3N
N(CH3)2
(CH3)2N
NO
+
H2O
2008-9-27
35
不同的胺与亚硝酸反应现象不同,可用于鉴别 芳香伯、仲、叔胺。例如:
NH2 无现象 NHCH3 N(CH3)2 HNO2 黄色油状物 翠绿色溶液
第十二章 含氮化合物
2008-9-27
1
有机含氮化合物的范围是很广泛的,它们可 以看作是烃分子中的氢原子被各种含氮原子的官 能团取代而生成的化合物。例如前面各章遇到过 的酰胺、肟、腙等,都属含氮化合物。此外,与 生命现象有直接关系的氨基酸、肽、蛋白质及生 物碱等,都属于含氮化合物的范畴,它们另在后 续章节中讨论。
2008-9-27
11
3.苦味酸 苦味酸的系统名称为2,4,6-三硝基苯酚,为黄色 片状的晶体,熔点为122℃,可溶于乙醇,乙醚 和热水.其水溶液显强酸性,有苦味,故俗称苦 味酸。苦味酸及其盐类易爆炸,可做烈性炸药。 由于其酸性足以与有机碱(如胺,含氮杂环和生 物碱等)生成稳定的难溶性盐类,故可作生物碱 的沉淀剂。因为苦味酸能使蛋白质凝固,故可用 作蛋白质的沉淀剂,可用于丝和毛的染色。苦味 酸还有杀菌止痛功能,医药上可作治疗烧伤的药 物。
2008-9-27
22
三、胺的化学性质
1.碱性
(1)弱碱性 胺的碱性强弱是电子效应、溶剂化 效应和立体效应综合影响的结果。不同胺的碱性强弱 的一般规律为: 脂胺(仲>伯>叔)>氨>芳香胺[(苯胺>二 苯胺>三苯胺)、N,N-二甲苯胺>N-甲苯胺>苯胺]
2008-9-27
23
当芳胺的苯环上连有给电子基时,可使其碱性 增强,而连有吸电子基时,则使其碱性减弱。 例如,下列芳胺的碱性强弱顺序为: 对甲苯胺>苯胺>对氯苯胺>对硝基苯胺
2008-9-27
12
第二节 胺
胺类是指氨分子中的氢原子被烃基取代而生 成的一系列衍生物。 例如: RNH2、R2NH 、R3N
2008-9-27
13
一、胺的分类、构造异构和命名
1.胺的分类
2008-9-27
14
脂伯胺 脂 胺 脂仲胺
脂叔胺 芳香伯胺
CH2NH2
NH2
(CH3CH2)2NH
(CH3CH2)3N
O O NH H
+
O NH C CH3+ CH COOH 3
