小鼠体能测试实验
小鼠体内实验的原理及步骤

小鼠体内实验的原理及步骤
小鼠体内实验是一种常用的动物模型,用于研究人类疾病的发生机制、新药的疗效以及毒理学研究等。
以下是小鼠体内实验的一般原理和步骤:
原理:
小鼠模型可以模拟人类疾病的发生和发展过程,并且小鼠的遗传背景和生理学特点与人类有高度的相似性。
通过在小鼠体内进行实验,可以观察和分析病理生理变化或药物作用,深入了解机制。
步骤:
1. 实验设计:制定研究目的、假设和实验方法。
选择合适的小鼠品系、性别和年龄,确保实验结果的可靠性和可重复性。
2. 小鼠饲养:提供适宜的饲料和水源,维持小鼠健康的饲养环境,包括适宜的温度、湿度和光照条件。
3. 模型建立:根据研究目的,采用不同方法建立疾病模型,如基因敲除、药物诱导或移植等。
4. 实验操作:根据具体实验方法,进行小鼠的操作,如给药、注射、取样、手术等。
需要进行安全有效的操作,以保证实验的正确性和可行性。
5. 观察记录:观察并记录小鼠的行为、生理指标、疾病表型等变化。
可以利用图像学、生化学和遗传学等方法进行定量分析。
6. 数据分析:对实验结果进行统计学分析,验证假设并得出结论。
可以采用图表、统计学指标和图像等形式呈现结果。
7. 论文撰写:将实验结果进行整理、分析和总结,撰写研究论文,并在相关学术期刊上发表或进行学术交流。
需要注意的是,在进行小鼠体内实验时,要遵守动物实验伦理规范和有关法律法规,确保对小鼠的福利和尊重。
小鼠活体试验实验报告

小鼠活体试验实验报告实验目的:本实验旨在评估特定化合物对小鼠生理功能的影响,以及该化合物在小鼠体内的代谢和分布情况,为进一步的药物开发和安全性评估提供基础数据。
实验材料:1. 实验动物:健康成年小鼠,体重20-25g,性别和年龄一致。
2. 化合物:待测试化合物,纯度≥98%。
3. 实验试剂:生理盐水、麻醉剂、血液采集器材等。
4. 仪器设备:恒温水浴箱、离心机、显微镜、血液分析仪等。
实验方法:1. 小鼠分组:将小鼠随机分为对照组和实验组,每组10只。
2. 给药方式:实验组小鼠通过口服方式给予一定剂量的化合物,对照组给予等体积的生理盐水。
3. 观察指标:记录小鼠的行为反应、体重变化、食物和水的摄入量。
4. 血液采集:在给药后的第1天、第3天和第7天,对小鼠进行血液采集,进行血液常规和生化指标分析。
5. 组织采集:实验结束后,对小鼠进行解剖,采集肝脏、肾脏等组织样本,进行组织学检查和化合物分布分析。
实验结果:1. 行为反应:实验组小鼠在给药后表现出轻微的嗜睡和活动减少,但无明显异常行为。
2. 体重变化:实验组小鼠体重增长速度略低于对照组,但差异不显著。
3. 食物和水摄入量:实验组小鼠的食物和水摄入量在给药初期略有下降,随后逐渐恢复至正常水平。
4. 血液分析:实验组小鼠的血液常规和生化指标与对照组相比,未发现显著差异。
5. 组织学检查:实验组小鼠的肝脏和肾脏组织未见明显病理变化。
6. 化合物分布:化合物在小鼠体内的分布主要集中在肝脏和肾脏,表明这两个器官可能是化合物的主要代谢和排泄途径。
结论:根据本实验结果,待测试化合物在小鼠体内的代谢和分布情况良好,未引起明显的生理功能异常。
然而,实验组小鼠在给药初期出现轻微的体重增长减缓和食物水摄入量下降,提示该化合物可能具有一定的副作用。
因此,建议在后续研究中进一步探讨该化合物的安全性和有效性,为临床应用提供更多的科学依据。
实验日期:2024年4月14日实验人员:[实验人员姓名]指导教师:[指导教师姓名]。
小鼠常规操作实验报告

小鼠常规操作实验报告引言实验目的是训练小鼠进行常规操作,包括进食、喝水、爬梯子等。
通过这些训练,我们可以观察小鼠的学习能力、记忆力以及空间感知能力。
本实验旨在提供一种简单、有效的方法,用于评估小鼠智能水平的变化。
材料与方法材料1. 10只小鼠2. 实验室饲料3. 饮水器4. 粘贴纸和透明胶带5. 梯子方法1. 将10只小鼠分成两组,每组5只。
2. 将小鼠放在一个特制的笼子里,内置有标有数字的小盒子。
3. 将实验室饲料放在盒子的一个角落,让小鼠进食。
4. 固定饮水器在笼子的一侧,让小鼠喝水。
5. 在另一侧的笼子上固定梯子,让小鼠爬梯子。
6. 观察小鼠进行进食、喝水和爬梯子的情况,记录每只小鼠的表现。
7. 每天重复上述步骤,直到小鼠能够熟练完成这些操作。
结果小鼠编号进食情况喝水情况爬梯子情况1 能进食能喝水未爬梯子2 能进食能喝水能爬梯子3 能进食未喝水能爬梯子4 能进食能喝水能爬梯子5 能进食能喝水未爬梯子6 能进食能喝水能爬梯子7 能进食能喝水能爬梯子8 能进食能喝水能爬梯子9 能进食不稳定喝水能爬梯子10 能进食能喝水未爬梯子讨论与结论根据我们的实验结果,有8只小鼠能够正确进食、喝水并爬梯子,而有2只小鼠还需要进一步训练。
这表明这些小鼠具有一定的学习能力和记忆力,能够记住进食和喝水的位置。
在训练过程中,小鼠可能会出现一些变化,例如开始时可能不稳定地喝水或不愿意爬梯子,但随着训练的进行,它们逐渐掌握了这些操作。
然而,我们也注意到,有些小鼠在爬梯子的时候表现不稳定,可能需要进一步的训练和指导。
这表明不同小鼠在空间感知和运动协调方面存在差异,需要根据个体情况进行个别训练。
总的来说,这个训练实验为评估小鼠的智能水平提供了一种简单、有效的方法。
通过观察小鼠的进食、喝水和爬梯子等行为,我们可以获得对其学习能力和记忆力的初步了解。
在进一步研究中,可以将这种常规操作训练与其他认知任务相结合,深入探究小鼠的智能水平和认知能力。
实验指南︱小鼠悬尾实验测试方法总结

实验指南︱小鼠悬尾实验测试方法总结1.引言1.1 概述概述小鼠悬尾实验是一种常见的动物实验方法,用于评估小鼠的身体平衡和协调能力。
该实验通过将小鼠的尾巴固定在一个平衡杆上,观察小鼠在杆子上的表现,从而判断它们的运动能力和协调性。
这种实验方法广泛应用于神经科学领域,特别是对神经系统功能和疾病模型的研究中。
小鼠悬尾实验的基本原理是利用小鼠天生的悬尾反射。
当小鼠的尾巴被悬挂在一个平衡杆上时,小鼠会试图通过调整身体的姿势来保持平衡。
正常的小鼠能够紧紧抓住平衡杆,并在杆子上稳定地站立一段时间。
而神经系统功能异常的小鼠可能会出现平衡失调、摇晃、倒地等表现,这些现象可以作为评估小鼠神经系统功能的指标。
在进行小鼠悬尾实验之前,需要合理设计实验的流程和步骤。
首先,选择适合的小鼠品系和年龄,以确保实验结果的可靠性和一致性。
其次,制定实验前的准备工作,如对小鼠进行训练和适应环境,以减少外界环境因素对实验结果的影响。
最后,进行实验和数据分析,评估小鼠的平衡和协调能力,从而得出结论。
小鼠悬尾实验具有许多优点,例如操作简单、成本低廉、实验时间较短等。
此外,该实验方法还可以应用于各种疾病模型的研究,比如帕金森病、脊髓损伤等。
通过对小鼠悬尾实验的应用前景展望,我们可以看到该实验方法在神经科学领域的广阔前景,有望为疾病的早期检测和治疗提供有力的支持。
总之,小鼠悬尾实验是一种有效的评估小鼠神经系统功能的实验方法。
本文将介绍小鼠悬尾实验的背景和意义,以及实验的基本步骤。
同时,我们还将总结该实验方法的优缺点,并展望其在神经科学领域的应用前景。
通过深入了解和掌握小鼠悬尾实验,我们可以更好地应用该方法进行相关研究,推动神经科学的进步和发展。
1.2 文章结构文章结构:本文主要分为引言、正文和结论三个部分。
引言部分包括概述、文章结构和目的等内容。
在概述中,简要介绍小鼠悬尾实验的背景和意义,引起读者的兴趣。
然后,说明文章的结构,即正文和结论的内容组织。
小白鼠实验的实训报告讨论

一、引言小白鼠实验作为一种常见的动物实验模型,广泛应用于医学、生物学、心理学等研究领域。
通过对小白鼠进行各种实验,可以模拟人类生理、心理、病理等过程,为科学研究提供有力支持。
本文以小白鼠实验实训报告为基础,对实验过程、结果及讨论进行综述,以期为后续相关研究提供参考。
二、实验目的1. 掌握小白鼠的基本生物学特性,熟悉小白鼠的饲养和管理方法。
2. 掌握小白鼠实验操作技能,包括动物抓取、注射、给药等。
3. 通过小白鼠实验,了解实验设计原则,提高实验操作水平。
4. 分析实验结果,培养科研思维和论文写作能力。
三、实验材料与方法1. 实验动物:选取健康小白鼠若干只,体重约20-25g,雌雄不限。
2. 实验器材:小白鼠笼具、电子秤、注射器、剪刀、手术刀、酒精棉球、生理盐水等。
3. 实验方法:(1)小白鼠抓取与固定:采用侧卧位固定小白鼠,避免造成伤害。
(2)注射操作:采用皮下注射或腹腔注射,注意注射部位、深度和注射速度。
(3)给药:根据实验要求,给予相应药物或生理盐水。
(4)观察指标:观察小白鼠的行为、生理指标等,如活动能力、进食量、体重等。
四、实验结果1. 小白鼠抓取与固定:实验过程中,成功抓取并固定小白鼠,未造成伤害。
2. 注射操作:成功进行皮下注射和腹腔注射,注射部位无感染。
3. 给药:按照实验要求,给予相应药物或生理盐水,小白鼠无明显不良反应。
4. 观察指标:实验期间,小白鼠活动能力、进食量、体重等指标无明显异常。
五、讨论1. 实验结果分析本次小白鼠实验成功完成了动物抓取、注射、给药等操作,未出现意外情况。
实验过程中,小白鼠的行为、生理指标等无明显异常,表明实验操作规范,实验条件符合要求。
2. 实验设计与实施在实验设计方面,遵循科学、严谨、合理原则,充分考虑实验目的和实验条件。
在实验实施过程中,严格按照实验步骤进行操作,确保实验结果的准确性。
3. 实验经验与反思(1)实验过程中,注意观察小白鼠的反应,及时调整实验操作,避免造成伤害。
小鼠抗疲劳体能测试实验报告

实验四:小鼠抗疲劳体能测试
一、实验目的
1、通过实验学习小鼠的抓取、保定等基本操作
2、通过小鼠负重游泳实验测试小鼠抗疲劳体能
二、实验原理
运动耐力是抗疲劳能力最直接的表现,小鼠负重后放入水槽中游泳,游泳时间的长短可以反映小鼠运动抗疲劳的程度。
游泳时间越长,小鼠抗疲劳能力越强。
测试小鼠抗疲劳能力还应在游泳结束后,每隔一定时间(一般两个小时)测定小鼠血液中乳酸含量。
本实验由于时间限制,未进行后面的测定乳酸含量操作。
三、实验器材
天平、烧杯、保险丝、水槽、计时器
四、实验材料
小鼠1只
五、实验操作
1、将烧杯置于天平上并去皮
2、将小鼠置于烧杯内,称量小鼠的体重并记录
3、按照小鼠体重的10%取保险丝,并将保险丝系在小鼠尾巴的根部,记录保险
丝实际的质量
4、准备好水槽
5、将小鼠倒入水槽,同时开始计时
6、当小鼠沉入水中不再浮出水面超过5秒钟,停止计时,并捞出小鼠
7、记录小鼠游泳的时间
8、处理小鼠,判断其雌雄并记录,整理实验器材
本次实验所用的两只小鼠,雌鼠的抗疲劳能力优于雄鼠
八、注意事项
1、保险丝应系在小鼠尾巴的根部,防止拉断尾巴
2、绳子要系紧,防止中途掉落
3、水槽里的水不要太浅,系保险丝的绳子不能太长,防止保险丝接触水槽底部,
使小鼠零负重游泳
4、小鼠应单只游泳,最好不要2只一起实验。
如果条件有限,必须两只一起,
那么不能使小鼠彼此靠近,否则会影响实验结果
5、实验在室温下进行,注意水温不能过高或过低。
小鼠运动造模实验报告(3篇)

第1篇一、实验背景帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,其主要特征是黑质多巴胺能神经元变性死亡,导致纹状体内多巴胺含量显著减少。
PD的临床症状主要包括静止性震颤、运动迟缓、肌强直和姿势平衡障碍等。
为了研究PD的发病机制和治疗方法,本研究采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的小鼠模型进行实验研究。
二、实验目的1. 通过MPTP诱导建立帕金森病小鼠模型。
2. 观察小鼠的运动行为变化,评估造模效果。
3. 为后续PD的病理机制研究和治疗方法提供实验基础。
三、实验材料1. 实验动物:SPF级C57BL/6雄性小鼠50只,8周龄,体重(252)g,购自上海斯莱克实验动物有限公司。
2. 试剂:1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)、生理盐水、苯巴比妥钠等。
3. 仪器:动物行为观察箱、电子秤、显微镜、组织切片机等。
四、实验方法1. 实验分组:将50只小鼠随机分为实验组和对照组,每组25只。
2. 造模方法:实验组小鼠腹腔注射MPTP,剂量为15mg/kg,每天一次,连续5天;对照组小鼠给予等体积的生理盐水。
3. 行为观察:在造模前后及造模后不同时间点,观察小鼠的运动行为变化,包括活动量、姿势、步态等。
4. 组织学检查:取小鼠脑组织,进行HE染色和免疫组化染色,观察神经元形态和数量变化。
五、实验结果1. 行为观察:实验组小鼠在造模后表现出明显的运动迟缓、姿势异常、步态不稳等症状,与对照组相比,运动量明显减少,姿势异常率显著增加(P<0.05)。
2. 组织学检查:实验组小鼠脑组织HE染色结果显示,神经元形态不规则、核固缩、细胞质减少,神经元数量显著减少(P<0.05)。
免疫组化染色结果显示,实验组小鼠脑组织中多巴胺能神经元表达降低,与对照组相比差异显著(P<0.05)。
六、实验结论1. 成功建立了MPTP诱导的帕金森病小鼠模型。
动物运动功能测试专题大小鼠负向趋地实验(GeotaxisTest)

动物运动功能测试专题大小鼠负向趋地实验(GeotaxisTest)一、实验背景大小鼠负向趋地实验(Geotaxis T est)用于研究啮齿动物的运动协调性和前庭敏感性,也适用于老年痴呆鼠以及帕金森病动物模式平衡力和肌张力的研究。
啮齿动物通常被放置在头部向下的倾斜网格中。
网格允许抓握,并允许啮齿动物将自己重新定向到向上的位置。
仪器可以分亚克力版本、不锈钢版本及软件版本,上海欣软信息科技有限公司均有销售。
较大的角度会对重新定向造成更大的障碍,较小的角度允许更容易地趋向性。
实验评分分为三类:测量在 60 秒内向上翻身的能力、在 60 秒内翻身失败、在 60 秒内尝试翻身但未能翻身。
二、实验介绍啮齿动物在倾斜平面上从头朝下的位置旋转180° 的先天姿势反应称为负地向运动。
这种反应早在正常幼崽出生后的第二周就出现。
负趋地任务被认为是评估幼崽反射发育(发育里程碑)、运动技能、前庭迷路和小脑完整性的黄金标准测试。
负向趋地性测试目前在新研究中被用作评估脑损伤、中风和缺血的行为功能的主要测试。
通过对年轻啮齿动物应用 Geotaxis 测试,根据自然的、未学习的反射反应确定其运动协调性和前庭敏感性的评估。
了解这些反射性反应可以识别感觉受体并追踪从受体到行为的不同途径。
这种行为分析在需要测量受试者功能状态的毒理学、致畸学和表型筛选等应用中发挥着重要作用。
测试通常在两种情况下进行:第一个场景使用网格,允许动物抓住网格孔,第二个场景使用光滑、高摩擦力的亚克力基板来消除网格孔对动物行为的影响。
在这两种情况下,测试动物对不同倾斜角度下的重力刺激的反应。
三、仪器设备大小鼠负向趋地测试设备的基本结构包括一个可倾斜的平台,在该平台上放置测试动物以确定其对倾斜的内在响应。
该装置由金属和亚克力设计。
金属装置配备了一个 1cm x 1cm 网格的金属网,它在金属框架上旋转,允许从0º 到90º 的可锁定倾斜度。
小鼠自主活动测试仪实验报告

小鼠自主活动测试仪实验报告
实验目的:
本实验旨在通过使用小鼠自主活动测试仪,评估小鼠在不同条件下的运动活动情况,以便了解其运动行为的变化与环境因素、药物等因素之间的关系。
实验方法:
1. 实验动物
选取10只健康小鼠,确保其品种、年龄、性别等因素的一致性。
2. 实验仪器
使用小鼠自主活动测试仪,该仪器包括活动箱、摄像设备、软件分析等部分。
3. 实验步骤
将小鼠放置于活动箱中,让其自由活动。
同时使用摄像设备记录小鼠的运动情况。
根据需要,可以改变活动箱的大小、形状等条件,观察小鼠在不同条件下的活动情况。
4. 数据分析
使用自主活动测试仪的软件,对记录下来的运动数据进行分析。
包括小鼠的运动距离、速度、停留时间等指标的计算与比较。
实验结果:
根据实验数据分析,可以得出小鼠在不同条件下的运动活动情
况。
比如,在不同大小的活动箱中,小鼠的运动距离、速度和停留时间等指标可能会有所差异。
实验结论:
小鼠的自主活动行为受到环境因素的影响,如活动箱的大小、形状等。
此外,药物等外界因素也可能对小鼠的运动活动产生影响。
实验总结:
通过小鼠自主活动测试仪的运用,可以方便地评估小鼠的运动活动情况,并与环境因素、药物等因素进行关联分析。
这有助于我们对小鼠行为特征的研究,并在药物研发、行为学研究等领域具有重要意义。
小鼠耐力试验操作流程

小鼠耐力试验操作流程那咱就开始说说小鼠耐力试验的操作流程哈。
一、试验前的准备。
咱得先把场地啥的都安排好呀。
要有一个合适的试验环境,温度和湿度得控制好呢,一般温度保持在20到26摄氏度,湿度在40% 70%左右就挺合适的。
就像咱人待着舒服的环境,小鼠住着也能更好地发挥嘛。
接着就是小鼠的选择啦。
这可不能随便抓几只就上呀。
要选择健康的、体重差不多的小鼠哦。
最好是同一批出生的,这样它们的基础状态比较接近。
你想啊,如果有的小鼠本身就体弱多病,或者体重差太多,那这试验结果肯定不准呀。
而且在选小鼠的时候,要仔细观察它们的毛发是不是光亮顺滑,眼睛有没有神,动作是不是敏捷。
那些毛毛乱乱的,眼睛无神还老是懒洋洋不爱动的小鼠,可能就不太适合啦。
还有试验器材,像跑步机这种关键的设备,得提前检查好。
看看传送带是不是顺滑,速度调节功能有没有问题。
要是在试验的时候,跑步机突然出故障,那小鼠可就白跑啦,咱的试验也得重新来,多麻烦呀。
二、试验开始喽。
把小鼠放到跑步机上的时候,要轻一点哦,可别吓着它们。
就像轻轻地把小朋友放在小滑梯上一样。
开始的时候,速度要设置得比较慢,给小鼠一个适应的过程。
你想啊,如果突然就开一个很快的速度,小鼠肯定会一脸懵,说不定还会摔倒受伤呢。
在小鼠跑的过程中,要一直盯着它们呢。
看看它们的状态,是跑得起劲,还是已经有点累得摇摇晃晃了。
要是看到小鼠有点坚持不住了,比如说脚步开始乱了,或者跑着跑着停下来的次数变多了,咱就得小心啦。
而且在这个过程中,咱可以给小鼠一点小小的鼓励哦。
虽然小鼠可能听不懂我们说话,但是我们温柔的声音说不定也能给它们力量呢。
就像你在旁边给参加比赛的小伙伴加油一样,说些“小鼠小鼠,加油加油”之类的俏皮话。
三、试验结束后的事儿。
当小鼠实在跑不动的时候,咱就得赶紧停止试验啦。
可不能硬逼着小鼠继续跑,那可太不人道啦。
把小鼠从跑步机上取下来的时候,也要轻手轻脚的,就像把一个累坏了的小宝贝抱起来一样。
然后呢,要对试验数据进行记录。
小鼠肌肉研磨实验报告(3篇)

第1篇实验目的:本实验旨在通过研磨小鼠肌肉组织,研究肌肉组织的物理特性,分析肌肉纤维的形态结构,并探讨肌肉组织在生物力学研究中的应用。
实验材料:1. 实验动物:健康成年小鼠(体重约20-25g,雌雄不限)2. 实验仪器:解剖显微镜、肌肉研磨器、电子天平、移液器、离心机、显微镜、图像采集系统等3. 实验试剂:生理盐水、组织固定液、脱脂乙醇、苏木精、伊红等实验方法:1. 实验动物处理:- 将小鼠置于超净工作台内,用颈椎脱位法处死,置于75%乙醇中浸泡消毒。
- 开放小鼠胸腔,暴露心脏,剪断心脏,用生理盐水冲洗血液。
2. 肌肉组织采集:- 在解剖显微镜下,沿股骨方向剪开小鼠大腿,暴露出股四头肌。
- 用组织剪剪取股四头肌组织,置于冰生理盐水中清洗,去除多余脂肪和结缔组织。
3. 肌肉组织研磨:- 将清洗干净的股四头肌组织放入肌肉研磨器中,加入适量生理盐水,进行研磨。
- 研磨过程中,不断加入生理盐水,直至组织完全研磨成匀浆。
4. 组织学观察:- 将研磨好的肌肉匀浆,用离心机离心,取沉淀物。
- 将沉淀物制成石蜡切片,进行苏木精-伊红染色,显微镜下观察肌肉纤维的形态结构。
5. 生物力学测试:- 将研磨好的肌肉匀浆,用电子天平称量,计算肌肉组织密度。
- 将肌肉匀浆置于生物力学测试仪上,进行拉伸测试,记录肌肉组织的最大拉伸强度、最大拉伸伸长率等力学性能。
实验结果:1. 组织学观察:- 在显微镜下观察到,小鼠股四头肌组织由大量的肌纤维组成,肌纤维呈长条状,排列整齐。
- 肌纤维间有丰富的毛细血管和神经纤维。
2. 生物力学测试:- 肌肉组织密度为1.05g/cm³。
- 最大拉伸强度为1.2MPa,最大拉伸伸长率为30%。
讨论:1. 本实验成功采集了小鼠股四头肌组织,并进行了研磨处理,为后续组织学观察和生物力学测试提供了实验材料。
2. 在组织学观察中发现,小鼠股四头肌组织由大量肌纤维组成,排列整齐,这与文献报道相符。
小鼠日常分析实验报告(3篇)

第1篇一、实验目的本实验旨在通过观察和分析小鼠的日常行为,了解其生理和心理状态,为后续的科学研究提供基础数据。
通过对小鼠活动、进食、睡眠等行为的记录,评估其健康水平和适应环境的能力。
二、实验材料1. 实验动物:健康成年小鼠若干2. 实验器材:电子体重秤、行为观察箱、录音设备、视频记录设备、食物、水、清洁垫料3. 实验环境:温度(22±2)℃,湿度(55±5)%,光照周期12小时/12小时三、实验方法1. 实验动物适应性:将小鼠放入实验环境,适应1周,确保其适应新环境。
2. 行为观察:每天定时观察小鼠的活动、进食、睡眠等行为,记录数据。
3. 体重测量:每周定时测量小鼠体重,记录数据。
4. 视频记录:利用视频记录设备,对小鼠的行为进行长时间记录,以便进行后续分析。
5. 数据处理:对收集到的数据进行分析,包括行为模式、进食量、睡眠时间等。
四、实验结果1. 活动行为(1)活动时间:小鼠在实验期间的活动时间较为规律,白天活动时间较长,夜间活动时间较短。
(2)活动强度:小鼠的活动强度在实验期间无明显变化,保持在中等水平。
2. 进食行为(1)进食量:小鼠的进食量在实验期间保持稳定,无明显波动。
(2)进食时间:小鼠的进食时间规律,主要集中在白天。
3. 睡眠行为(1)睡眠时间:小鼠的睡眠时间在实验期间保持稳定,无明显波动。
(2)睡眠质量:小鼠的睡眠质量较好,无明显异常。
4. 体重变化小鼠在实验期间的体重变化平稳,无明显异常。
五、实验分析1. 活动行为:小鼠的活动时间、强度和规律性表明其生理状态良好,适应环境能力较强。
2. 进食行为:小鼠的进食量、时间和规律性表明其消化系统功能正常,食欲旺盛。
3. 睡眠行为:小鼠的睡眠时间和质量良好,表明其心理状态稳定,适应环境能力较强。
4. 体重变化:小鼠的体重变化平稳,表明其生理状态良好,无疾病风险。
六、实验结论通过对小鼠日常行为的观察和分析,得出以下结论:1. 实验动物生理状态良好,适应环境能力较强。
小白鼠实验报告

小白鼠实验报告一、实验背景小白鼠实验是一种广泛应用于医学领域的动物实验方法。
小白鼠作为常见的实验动物,具有短育龄、较短的生命周期以及与人类相似的生理结构等特点,因此被广泛应用于药物测试、病理研究等领域。
本实验旨在通过研究小白鼠实验结果,揭示其对人类疾病诊断与治疗的意义,从而推进科学研究进程。
二、实验设计本实验选取30只健康的小白鼠作为实验对象。
首先将它们随机分为三组:A组、B组和对照组。
然后,将不同的药物分别注射到A组和B组的小白鼠体内,并对其进行观察和记录。
三、实验过程在实验开始前,实验人员先为每只小白鼠进行体重测量和身体检查,以确保它们身体健康且符合实验要求。
然后,根据实验设计,给A组和B组注射不同的药物。
A组小白鼠注射的是一种新型药物,我们希望通过实验来验证其对某种特定疾病的治疗效果。
实验过程中,我们详细观察了小白鼠的行为变化、精神状态和体重变化,并记录在笔记中。
此外,我们还对A组小白鼠进行了定期的血液检测,以检测药物对其生理指标的影响。
B组小白鼠注射的是一种已经在临床使用的药物,此次实验的目的是进一步研究其副作用和生物代谢途径。
同样地,我们对B组小白鼠进行了与A组相似的观察和记录,并进行了血液检测以评估药物的影响。
与A组和B组相对比的是对照组。
对照组小白鼠没有注射任何药物,仅接受与其他两组相同的生活条件和观察要求。
这样设计的目的是为了与实验组进行对比,验证药物在实验过程中对小白鼠的影响。
四、实验结果与分析根据我们对A组和B组小白鼠的观察和记录,我们得出了以下结论:A组小白鼠在注射新型药物后,体重变化没有明显差异,但在行为和精神状态上出现了改变。
它们表现出更为活跃的行为,精神状态变得更加积极。
血液检测结果显示,新型药物对小白鼠生理指标没有明显影响,这可能意味着它对疾病的治疗效果仍需要进一步研究。
B组小白鼠在注射已有临床应用的药物后,体重也没有明显改变,与对照组小白鼠相比,它们的行为和精神状态没有明显差异。
小鼠耐受力实验
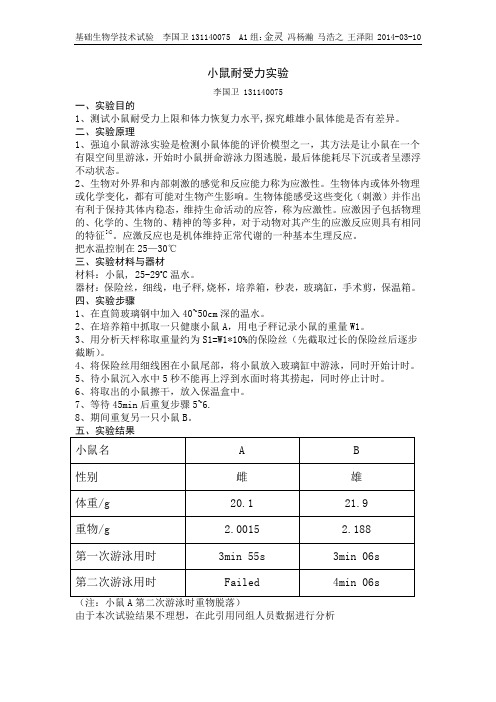
小鼠耐受力实验李国卫 131140075一、实验目的1、测试小鼠耐受力上限和体力恢复力水平,探究雌雄小鼠体能是否有差异。
二、实验原理1、强迫小鼠游泳实验是检测小鼠体能的评价模型之一,其方法是让小鼠在一个有限空间里游泳,开始时小鼠拼命游泳力图逃脱,最后体能耗尽下沉或者呈漂浮不动状态。
2、生物对外界和内部刺激的感觉和反应能力称为应激性。
生物体内或体外物理或化学变化,都有可能对生物产生影响。
生物体能感受这些变化(刺激)并作出有利于保持其体内稳态,维持生命活动的应答,称为应激性。
应激因子包括物理的、化学的、生物的、精神的等多种,对于动物对其产生的应激反应则具有相同的特征[4]。
应激反应也是机体维持正常代谢的一种基本生理反应。
把水温控制在25—30℃三、实验材料与器材材料:小鼠, 25-29o C温水。
器材:保险丝,细线,电子秤,烧杯,培养箱,秒表,玻璃缸,手术剪,保温箱。
四、实验步骤1、在直筒玻璃钢中加入40~50cm深的温水。
2、在培养箱中抓取一只健康小鼠A,用电子秤记录小鼠的重量W1。
3、用分析天枰称取重量约为S1=W1*10%的保险丝(先截取过长的保险丝后逐步截断)。
4、将保险丝用细线困在小鼠尾部,将小鼠放入玻璃缸中游泳,同时开始计时。
5、待小鼠沉入水中5秒不能再上浮到水面时将其捞起,同时停止计时。
6、将取出的小鼠擦干,放入保温盒中。
7、等待45min后重复步骤5~6.8、期间重复另一只小鼠B。
由于本次试验结果不理想,在此引用同组人员数据进行分析六、实验结论1、对于小鼠A,第一次实验正常进行,第二次实验时小鼠尾部重物在游泳时脱落,因此数据不准确,实验失败。
对于小鼠B,第一次实验正常进行,第二次实验游泳时间反而高出第一次实验,观察到的可能存在原因如下:第一次游泳时虽然5秒内未上浮,但体能并没有耗尽;第二次实验时小鼠的毛没有完全被浸湿,产生了较大的浮力;绳子上尤其打结处有气泡,也会产生些许误差。
2、小鼠C、D的数据与期望相符,小鼠体能下降明显,且45min后并不能完全恢复,小鼠C恢复率为83.5%,小鼠D恢复率为96.0%。
体能测试辅学资料

实验动物的若干体能测试【教学目的】1、了解动物应激反应的定义及动物体能测试的常规实验方法;2、了解构建抗应激模型的方法和研究意义。
【教学内容】通过对小鼠负重游泳记录及密闭空间窒息实验,及测量血清乳酸脱氢酶,学习动物体能测试的常规实验方法, 探究雌雄小鼠体能是否有差异。
1.实验准备1.1动物:小鼠。
要求雌雄、年龄比例均衡。
1.2器材:鼠笼、电子天平、50cm×30cm×25cm的玻璃缸、200ml磨口广口瓶、负重物、温度计、秒表、冰箱、恒温箱。
1.3药品:钠石灰(或等量的氢氧化钠和碳酸钙)、凡士林等。
2.实验步骤(一)小鼠游泳实验根据游泳时水温的不同,可分为常温下游泳,水温常调制25~29±1℃;低温下游泳,水温可调至5~15±1℃;高温下游泳,水温可调至39~45±1℃。
后两者是游泳至疲劳,外加应激。
本实验以小鼠游泳时间为小鼠的体能的指标之一。
【方法】玻璃缸内加水,水深20cm,水温保持在20±0.5℃,在每只鼠尾部束其体重10%的重物,将小鼠分别放入玻璃缸内游泳,开始计时。
注意观察,当小鼠头部沉入水中10秒中不能付出水面者即为体力耗竭,即可计时,为小鼠游泳时间。
比较不同组小鼠的抗疲劳能力。
(二) 小鼠耐缺氧实验【小鼠耐常压缺氧能力测试方法】将小鼠放入盛有15g钠石灰的广口瓶内(每瓶只放1只小鼠),用凡士林涂抹瓶口盖严,使之不漏气,立即计时。
以呼吸停止为标准,观察小鼠因缺氧而死亡的时间。
比较各组小鼠耐缺氧的能力。
【注意】1.每个广口瓶最好只放一只小鼠,以防互相扰动影响耐缺氧能力测定。
2.广口瓶一定要密封严格,以防漏气,否则会影响实验结果。
3.广口瓶容积应适当,以小鼠能自由活动为宜。
4.具有静电作用的药物也能延长缺氧死亡时间。
(三) 小鼠耐低温和高温实验耐低温实验常将小鼠放于-5℃以下的低温水箱内;耐高温实验则将小鼠放于45±1℃的恒温箱内。
动物行为实验专题大小鼠爬杆实验(PoleTest)

动物行为实验专题大小鼠爬杆实验(PoleTest)爬杆测试是一种用于评估啮齿动物运动功能的行为测试。
在测试期间,将一只啮齿动物放在极点上,使其头部指向上方,并要求其不间断地降至地面。
测试动物通过转身而不跌倒的能力被用于评估其受伤后的运动功能或功能障碍。
爬杆测试需要最少的设备,并提供直接的结果。
此外,测试可以在实验动物的家庭笼舍中进行,因为它可能更喜欢下降到熟悉的位置。
用于评估啮齿动物运动功能的其他仪器包括平衡木、双杠、地轴测试、静态杆测试和步态测试。
培训协议每次试验后清洁爬杆。
可选配使用跟踪和记录系统(如VisuTrack 软件)辅助观察。
爬杆测试任务将动物放在测杆仪的顶端,使其头部朝上。
向下转动动物的头,让其下降到地板上。
如果动物在下降时暂停,则剔除试验并进行另一次试验。
如果动物在下降时跌倒,将最长持续时间120秒分配给转弯和TD值。
文献评论爬杆试验在脑卒中啮齿动物模型中的评价阮和姚(2020)回顾了在啮齿动物中风模型中的几种行为测试,其中爬杆测试是其中之一。
在Balkaya、Krober、Gertz、Peruzzaro和Endres (2013年)以及Bouë等人(2007年)开展的研究中,通过PoleTest仪器评估了缺血小鼠,并评估了它们的下降转弯潜伏期(Tturn)和下降时间(TD)。
在缺血小鼠中观察到了运动损伤,与假对照相比,损伤后11天内turn和TD值升高。
在朱等人(2012)进行的另一项研究中,评估了氟西汀对极点配置测试性能的影响。
结果表明,氟西汀能够改善卒中后12天和20天的极点测试成绩,提示爬杆测试可可靠地用于评估新治疗方法的神经保护作用。
此外,在黄和蒋(2019)进行的一项研究中,爬杆检验也用于在自体血诱导的ICH模型中研究出血性卒中。
观察到与假对照相比,出血小鼠下降的时间更长。
然而,右美托咪定治疗显著改善了出血性中风小鼠的表现。
总体结果表明,爬杆试验可可靠地评估运动障碍,可用于评估中风啮齿动物模型的长期运动功能。
小鼠抓取考核标准

小鼠抓取考核标准小鼠抓取考核是一项对实验小鼠进行评估和定量分析的方法,旨在评估小鼠在实验中的抓取能力和协调性。
通过该考核标准可以评估小鼠神经功能的发育和病理状态,并对相关疾病的研究提供重要参考。
小鼠抓取是一种小鼠天生具备的本能行为,它对小鼠的生活和求生至关重要。
通过观察和记录小鼠抓取的能力和运动,可以了解小鼠神经系统的发育和功能状态,以及小鼠的生物学特征和行为表现。
小鼠抓取考核主要分为两个方面:抓握能力和运动协调性。
抓握能力是指小鼠使用前肢抓取物体的能力。
考核抓握能力的方法有多种,其中最常用的是“悬垂”法。
该方法首先将小鼠的前肢悬空放置,然后将小鼠向上提起。
如果小鼠能够用前肢紧紧地抓住固定的物体,表明其有较好的抓握能力;如果小鼠不能成功抓握,说明其抓握能力较差。
通过观察小鼠的抓握能力,可以判断小鼠神经系统的发育情况和是否存在异常。
运动协调性是指小鼠在移动和行走过程中的协调能力。
考核运动协调性的方法有多种,其中最常用的是“水平棒”法。
该方法首先在小鼠的笼子上搭建一根水平的棒杆,然后将小鼠放置在棒杆上观察其行走情况。
正常的小鼠应该能够平稳地在棒杆上行走,如果小鼠行走不稳或无法保持平衡,说明其运动协调性较差。
通过观察小鼠的运动协调性,可以识别小鼠是否存在神经系统的异常或运动障碍。
除了抓握能力和运动协调性外,小鼠抓取考核标准还可以包括其他参数,如步态、反射和灵敏度等。
通过多项指标对小鼠进行全面评估,可以更精确地获取小鼠神经功能状态的信息,对小鼠相关疾病的研究提供更全面的参考。
总之,小鼠抓取考核是一项对实验小鼠进行评估和定量分析的方法,通过观察小鼠的抓握能力和运动协调性,可以评估小鼠神经功能的发育和病理状态。
该考核标准的应用对于小鼠相关疾病的研究和药物研发具有重要意义,并可为临床治疗提供参考。
抗疲劳实验方法

抗疲劳作用检验方法1 负重游泳试验1.1 原理运动耐力的提高是抗疲劳能力加强最有力的宏观表现,游泳时间的长短可以反应动物运动疲劳的程度。
1.2 仪器游泳箱(大小约50cm×50cm×40cm),电子天平、铅皮。
1.3 实验方法1.3.1 实验动物成年雄性小鼠,体重18-22g,推荐使用BALB/c小鼠。
1.3.2 剂量设置共设高、中、低、对照四个组,根据推荐的人体每公斤体重日摄入量,扩大10倍作为其中一个剂量组,根据受试物的具体情况另设两个剂量组。
经口给样。
原则上连续给样30d,也可根据试验需要自行设定给样期限。
1.3.3 实验步骤末次给予受试物30min后,置小鼠在游泳箱中游泳,水深不少于30cm,水温25℃±0.5℃,鼠尾根部负荷5%体重的铅皮。
记录小鼠自游泳开始至死亡的时间,作为小鼠游泳时间(min)。
1.4 数据处理及结果判定游泳时间为计量资料,可以用方差分析。
若受试物组游泳时间明显长于对照组游泳时间,且差异有显著性(p<0.05),可以判定该实验阳性。
1.5 注意事项1.5.1 每一游泳箱一次放入的小鼠不宜太多,否则互相挤靠,影响实验结果。
1.5.2 水温对小鼠的游泳时间有明显的影响,因此要求各组水温控制一致,以25℃为宜,如果过低可能引起小鼠痉挛,影响实验结果。
1.5.3 铅皮缠绕松紧应适宜。
1.5.4 观察者应在整个实验过程中使每只小鼠四肢保持运动。
如果小鼠漂浮在水面四肢不动,可用木棒在其附近搅动。
1.5.5 不同批的小鼠因饲养环境、季节等原因的变化体质上会出现差异。
因此受试物组和对照组应采用同一批动物同时进行。
2 爬杆试验2.1 原理运动耐力的提高是抗疲劳能力加强最有力的宏观表现,爬杆时间的长短可以反应动物静用力时疲劳的程度。
2.2 材料爬杆架。
直径0.8-1cm、长约25cm的有机玻璃圆棒(经120目砂纸打磨),上端固定于木板上,下端悬空,距地面约20cm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小鼠体能测试实验
一、实验目的
通过记录小鼠的负重游泳时间测试小鼠的体能。
二、实验原理
将小鼠绑上重物,放在泳缸中游泳,用秒表记录小鼠游泳的时间,当看到小鼠沉入水中5秒钟不浮上来后,停止计时,并将小鼠从水中捞上来。
三、实验器材及动物
游泳缸一个装满水,各项体能正常的实验小鼠一只,细线及充当重物的保险丝,大烧杯一个,电子天平。
四、实验步骤
①、从小鼠的笼中抓出一只小鼠,抓的时候必须抓小鼠的尾巴中部,在抓上
来后将小鼠放在手臂上抓住其尾巴。
②、把小鼠放在电子天平上称出小鼠的重量。
(先将烧杯放在电子天平上去
皮,再将小鼠放入烧杯中,称出的及为小鼠的重量。
)
③、用电子天平称一个小鼠重量1/10左右的重物,用细线绑好。
④、将小鼠放在倒扣的烧杯中使其尾巴露出,一人抓住小鼠的尾巴,一人将
绑有重物的细线绑在小鼠的尾巴根部。
(注意细线的长度不能过长。
)
⑤、把小鼠放在游泳缸中让其游泳,并开始计时。
当小鼠沉入水中且五秒钟
不浮上来时,将小鼠捞出,并停止计时。
⑥、记录好小鼠的负重游泳时间。
五、实验数据记录
小鼠的体重=20.3g
重物的质量=2.08g
小鼠的负重游泳时间=59秒
六、实验结论。
