氮的知识点总结
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氮的知识点总结
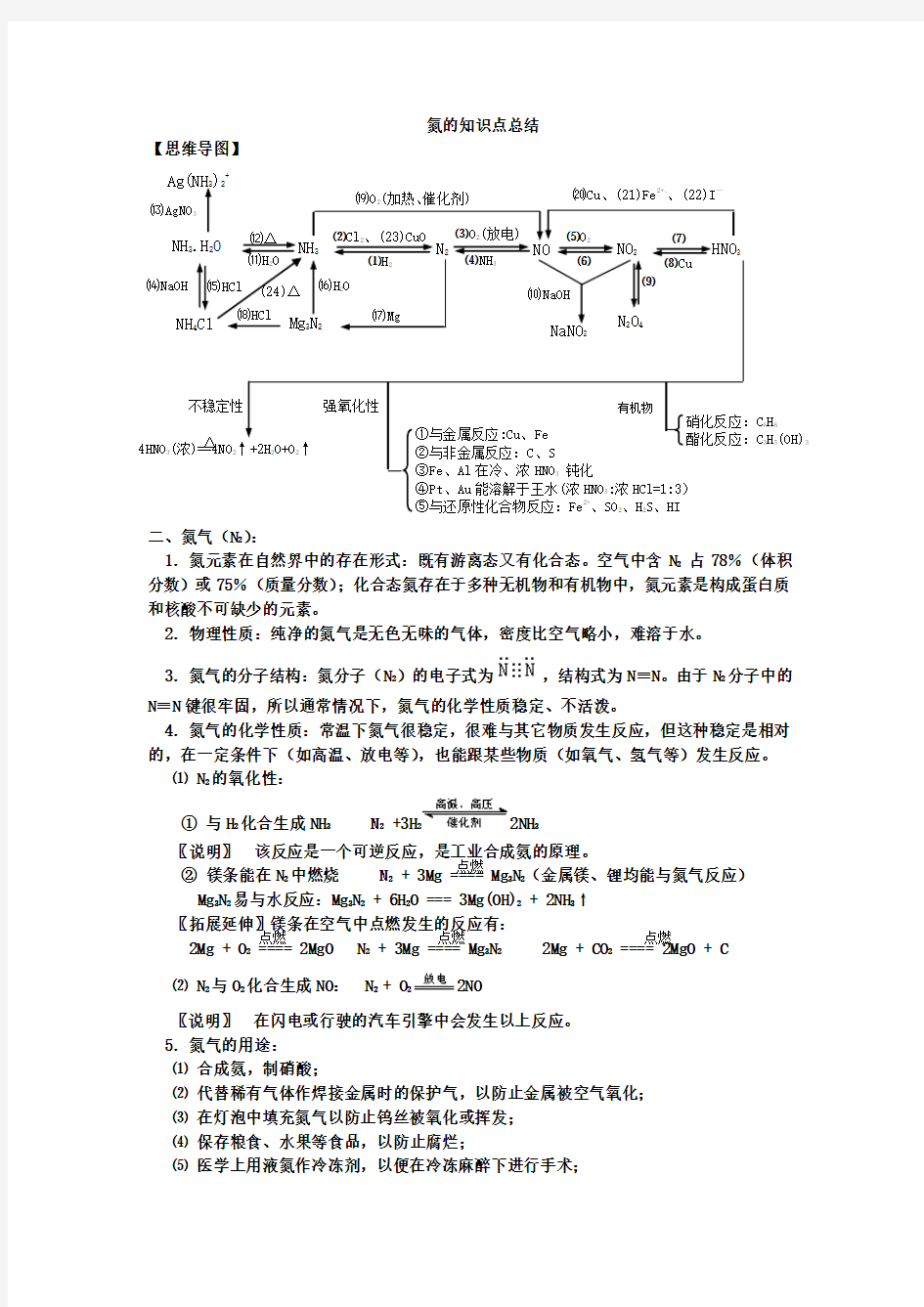
【思维导图】
二、氮气(N 2):
1.氮元素在自然界中的存在形式:既有游离态又有化合态。空气中含N 2 占78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素。
2.物理性质:纯净的氮气是无色无味的气体,密度比空气略小,难溶于水。
3.氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N 。由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼。
4.氮气的化学性质:常温下氮气很稳定,很难与其它物质发生反应,但这种稳定是相对的,在一定条件下(如高温、放电等),也能跟某些物质(如氧气、氢气等)发生反应。 ⑴ N 2的氧化性:
① 与H 2化合生成NH 3 N 2 +3H 22NH 3
〖说明〗 该反应是一个可逆反应,是工业合成氨的原理。
② 镁条能在N 2中燃烧 N 2 + 3Mg ==== Mg 3N 2(金属镁、锂均能与氮气反应)
Mg 3N 2易与水反应:Mg 3N 2 + 6H 2O === 3Mg(OH)2 + 2NH 3↑
〖拓展延伸〗镁条在空气中点燃发生的反应有: 2Mg + O 2 ==== 2MgO N 2 + 3Mg ==== Mg 3N 2 2Mg + CO 2 ==== 2MgO + C
⑵ N 2与O 2化合生成NO : N 2 + O 22NO
〖说明〗 在闪电或行驶的汽车引擎中会发生以上反应。
5.氮气的用途:
⑴ 合成氨,制硝酸;
⑵ 代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;
⑶ 在灯泡中填充氮气以防止钨丝被氧化或挥发;
⑷ 保存粮食、水果等食品,以防止腐烂;
⑸ 医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;
⒆O 2(加热、催化剂) 4HNO 3(浓)==4NO 2↑+2H 2O+O 2↑ 强氧化性 不稳定性 HNO 3 NaNO 2 ⑽NaOH ⒄Mg N 2O 4 ⒃H 2O NH 3.H 2O NH 3 N 2 NO NO 2 Ag(NH 3)2+ NH 4Cl ⒀AgNO 3 ⒁NaOH ⒂HCl ⑿Δ ⑾H 2O Mg 3N 2 ⑵Cl 2、(23)CuO ⑴H 2 ⑶O 2(放电) ⑷NH 3 ⑸O 2 ⑹ ⑺ ⑻Cu ⒅HCl ⒇Cu 、(21)Fe 2+、、(22)I — ①与金属反应:Cu 、Fe ②与非金属反应:C 、S ③Fe 、Al 在冷、浓HNO 3 钝化
④Pt 、Au 能溶解于王水(浓HNO 3:浓HCl=1:3) ⑤与还原性化合物反应:Fe 2+、SO 2、H 2S 、HI 有机物 硝化反应:C 6H 6 酯化反应:C 3H 5(OH)3 ⑼ Δ (24)Δ 点燃 点燃 点燃 点燃
⑹ 利用液氮制造低温环境,使某些超导材料获得超导性能。
6.制法:
⑴ 实验室制法:加热NH 4Cl 饱和溶液和NaNO 2晶体的混合物。 NaNO 2 + NH 4Cl === NaCl + N 2↑+ 2H 2O
⑵ 工业制法:
液氮(沸点-195.8℃) N 2 空气 ────→ ───→
液氧(沸点-183℃) O 2
7.氮的固定:游离态氮转变为化合态氮的方法。
自然固氮 → 闪电时,N 2 转化为NO
生物固氮 → 豆科作物根瘤菌将N 2 转化为化合态氮
工业固氮 → 工业上用N 2 和H 2合成氨气
8.氮的循环:
〖说明〗在自然界,通过氮的固定,使大气中游离态的氮转变为化合态的氮进入土壤,植物从土壤中吸收含氮的化合物制造蛋白质。动物则靠食用植物得到蛋白质。动物的尸体残骸,动物的排泄物以及植物腐败物等在土壤中被细菌分解,变为含氮化合物,部分被植物吸收;而土壤中的硝酸盐也会被细菌分解成氮气,氮气可再回到大气中。这一过程保证了氮在自然界的循环。
三、氮的氧化物:
各种价态氮氧化物:1N +(N 2O )、2N +(NO )、3N +(N 2O 3)、4N +(NO 2、N 2O 4)、5N +(N 2O 5),其中N 2O 3和N 2O 5分别是HNO 2和HNO 3的酸酐。气态的氮氧化物几乎都是剧毒性物质,在太阳辐射下还会与碳氢化物反应形成光化学烟雾。
1.NO 、NO 2性质:
氮的氧化物
一氧化氮(NO) 二氧化氮(NO 2) 物理性质 为无色、不溶于水、有毒的气体
为红棕色、有刺激性气味、有毒的气体,易溶于水 化学性质
①极易被空气中的O 2氧化:
2NO + O 2= 2NO 2
②NO 中的氮为+2价,处于中间价
态,既有氧化性又有还原性 ①与H 2O 反应: 3NO 2 + H 2O =2HNO 3 + NO (工业制HNO 3原理.在此反应中,NO 2同时作氧化剂和还原剂)
②平衡体系:2NO 2 N 2O 4 氮氧化物对环境的污染、危害及防治措施 ①硝酸型酸雨的产生及危害
②造成光化学烟雾的主要因素:氮氧化物(N x O y )和碳氢化合物(C x H y )
在大气环境中受到强烈的太阳紫外线照射后,发生复杂的化学反应,主要生成光化学氧化剂(主在是O 3)及其他多种复杂的化合物,这是一种新的二次污染物,统称为光化学烟雾。光化学烟雾刺激呼吸器官,使人生病甚至死亡。光化学烟雾主要发生在阳光强烈的夏、秋季节。
③破坏臭氧层
措施:空气中的NO 、NO 2污染物主要来自于石油产品和煤燃烧的产物、
△ 净化、液化 分馏
汽车尾气以及制硝酸工厂的废气,因此使用洁净能源,减少氮氧化物
的排放;为汽车安装尾气转化装置;处理工厂废气可以减少排放。
2.NO 、NO 2的制取:
⑴ 实验室NO 可用Cu 与稀HNO 3反应制取:
3Cu +8HNO 3(稀)=3Cu (NO 3)2+2NO ↑+4H 2O ,由于NO 极易与空气中的氧气作用,故只能用排水法收集。
⑵ 实验室NO 2可用Cu 与浓HNO 3反应制取:
Cu +4HNO 3(浓)=Cu (NO 3)2+2NO 2↑+2H 2O ,由于NO 2可与水反应,故只能用排空气法收集。
3.2NO 2 N 2O 4 △H <0 的应用
四、氨和铵盐:
1.氨的合成: N 2 + 3H 2 2NH 3 2.氨分子的结构:NH 3的电子式为,结构式为,氨分子的结构为三角锥形,N 原子位于锥顶,三个H 原子位于锥底,键角107°18′,是极性分子。
3.氨气的物理性质:
氨气是无色、有刺激性气味的气体,在标准状况下,密度是0.771g ·L —1,比空气小。
氨易液化,液氨气化时要吸收大量的热,使周围温度急剧下降,所以液氨可作
致冷剂。
氨气极易溶于水,常温常压下,1体积水中大约可溶解700体积的氨气。氨
的水溶液称氨水。计算氨水的浓度时,溶质应为NH 3 。
〖实验〗选修1P97实验4—8
氨对人的眼、鼻、喉等粘膜有刺激作用,若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛。
4.氨的化学性质:
⑴ 跟水反应:氨气溶于水时(氨气的水溶液叫氨水),大部分的NH 3分子与H 2O 分子结
合成NH 3·H 2O (一水合氨)。NH 3·H 2O 为弱电解质,只能部分电离成NH 4+和OH -。
NH 3 + H 2O NH 3·H 2O NH 4+ + OH -
a .氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色。氨水的浓度越大,密度反而越小(是一种特殊情况)。NH 3·H 2O 不稳定,故加热氨水时有氨气逸出: NH 3·H 2O NH 3↑+ H 2O
b .氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH 3、NH 3·H 2O 、
H 2O )和3种离子(NH 4+和OH -、极少量的H +)。
c .氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。
d .有关氨水浓度的计算:氨水虽然大部分以NH 3·H 2O 形式存在,但计算时仍以NH 3作溶质。
★e .NH 3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH 3。
★比较液氨与氨水: 催化剂 高温高压
