离子及配位聚合习题详细答案
第四章作业答案

二. 填空与选择 1. 合成天然橡胶(聚异戊二烯)的聚合反应式为 合成天然橡胶(聚异戊二烯) 是典型的( 聚合。 (1) ,是典型的(2) 配位聚合 聚合。该类型聚 合反应采用的引发体系为Ziegler Natta引发剂 Ziegler引发剂, 合反应采用的引发体系为Ziegler-Natta引发剂,其基本 组成一般为主引发剂,( ,(3 组成一般为主引发剂,(3)由周期表中第四到第八副族 的过渡金属的卤化物或其它衍生物,助引发剂为( 的过渡金属的卤化物或其它衍生物,助引发剂为(4) 第一到第三主族的非过渡金属的氢化物或金属烷基 的化 合物。 合物。 工业上生产丁基橡胶为典型的( 2. 工业上生产丁基橡胶为典型的(5)阳离子聚合 (自 由基聚合、阴离子聚合、阳离子聚合、 由基聚合、阴离子聚合、阳离子聚合、配位阴离子聚 ),常用的引发体系为 常用的引发体系为( /CH3Cl, 合),常用的引发体系为(6) AlCl3 /CH3Cl,采用极 抑制链转移的发生, 低温度下聚合的原因是( 低温度下聚合的原因是(7)抑制链转移的发生,提高聚 合产物的相对分子量 ,其聚合反应式为(8) 其聚合反应式为( 。
写出合成下列聚合物的程式,并注明主要反应条件。 (1)丁基橡胶
(2)SBS
(3)接近单分散的PS(GPC标样) 接近单分散的PS(GPC标样) PS 标样
什么是聚丙烯的全同指数?通常有哪几种测试方法? 10. 什么是聚丙烯的全同指数?通常有哪几种测试方法? 简要说明。 简要说明。 聚丙烯的全同指数也叫等规度, IIP, 聚丙烯的全同指数也叫等规度, IIP,( Isotactic 等规度 polypropylene), index of polypropylene),是指原生态的聚丙烯当 中等规聚丙烯所占的质量百分数。 中等规聚丙烯所占的质量百分数。 1.沸腾正庚烷萃取法 通常的测试方法有 1.沸腾正庚烷萃取法 聚丙烯的全同指数= 聚丙烯的全同指数 (IIP) 红外光谱法(IR) 2. 红外光谱法(IR) 3.核磁共振法(NMR) 3.核磁共振法(NMR) 核磁共振法 沸腾正庚烷萃取剩余物重 未萃取时的聚合物总重
配位化合物(习题参考答案)
由(2)、(3)计算结果看出,AgCl 能溶于稀 NH3·H2O,而 AgBr 须用浓 NH3·H2O 溶解。 12.解: (1)[HgCl4]2− + 4 I−
K =
ψ
K fψ ([HgI 4 ] 2 − ) K fψ ([HgCl 4 ] )
= 5.78 ×10 14
K ψ 很大,故反应向右进行。
y = 0.49
可见 KCN 可溶解较多的 AgI。 10.解:设 1.0 L 1.0 mol·L−1 氨水可溶解 x mol AgBr,并设溶解达平衡时 c([Ag(NH3)2]+) = x mol·L−1(严格讲应略小于 x mol·L−1)c(Br− ) = x mol·L−1 AgBr(s) + 2NH3·H2O [Ag(NH3)2]+ + Br− + 2H2O 平衡浓度/(mol·L−1) 6.0 − 2 x x x
(2)[Cu(CN)2]− + 2NH3·H2O [Cu(NH3)2]+ + 2CN− + 2H2O
−
Kψ =
K fψ ([Cu(NH 3 ) 2 ] + ) K fψ ([Cu(CN) 2 ] )
= 7.24×10−14
(3)[Fe(NCS)2]+ + 6F−
[FeF6]3− + 2SCN−
+
Kψ =
PDF 文件使用 "pdfFactory" 试用版本创建
[CoF6]3-
[Ru(CN)6]4-
[Co(NCS)4]2―
6.解:已知:[MnBr4]2―μ=5.9 B.M,[Mn(CN)6]3―μ=2.8 B.M。 由: µ= n(n+2) 式求得:
离子聚合习题

2M 0 Xn I
4、以乙二醇二甲醚为溶剂,分别以RLi、RNa、RK为引发剂, 在相同条件下使苯乙烯聚合,判断聚合速度的大小顺序。如改 用环己烷做溶剂,聚合速度的大小顺序如何?说明判断的依据。 解: 乙二醇二甲醚是溶剂化能力很强的溶剂,可使金属反离 子溶剂化。金属离子的半径越小,其溶剂化程度越大,紧密 离子对越容易转变成疏松离子对和自由离子,因此增长或聚 合速率也越大。碱金属原子半径的顺序是:Li<Na<K,在乙二 醇二甲醚中溶剂化后碱金属原子半径的顺序却是:Li>Na>K。 所以苯乙烯的聚合速度顺序是RLi>RNa>RK 。 相反,环己烷为非极性溶剂,溶剂化能力较弱,反离子基本 未溶剂化,各种碱金属的烷基化合物多以紧密离子对存在, 离子对中两离子的距离将随反离子半径增加而增大,从而使 聚合速率增加。因此在环己烷中苯乙烯的聚合速度是:RLi> RNa>RK 。
1、解释下列概念 离子对 异构化聚合 活性聚合 离子对:带有相反电电荷的离子当二者间的距离小于某一临 界距离时,可称为离子对。 异构化聚合:在聚合链增长过程中,伴有分子内重排的聚合 常称为异构化聚合。 活性聚合;没有链转移和链终止的聚合反应称为活性聚合。
2、分析下列引发体系和单体,何种引发体系可引发何种单体聚 合?聚合反应类型是什么?写出链引发反应式。 引发体系
CH3CH2CH(CH3)2 +CH2
• 自发链终止(动力学链不终止)
CH3 CH3CH2C (SnCl5) CH3 CH3CH2C(CH3) CH2 +H (SnCl5)
• 与反离子的一部分结合
CH3 CH3CH2C (SnCl5) CH3 CH3 CH2C(CH3)2Cl + SnCl4
和反离子结合后生成的SnCl4,还可以和溶剂CH3Cl重新生成引发 剂,故动力学链仍未终止。
高分子化学第五章答案

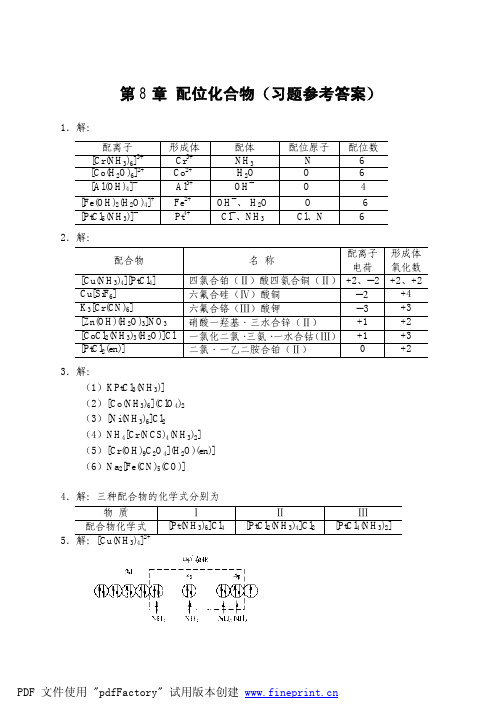
第五章聚合方法思考题 5.1聚合方法(过程)中有许多名称,如本体聚合、溶液聚合和悬浮聚合,均相聚合和非均相聚合,沉淀聚合和淤浆聚合,试说明它们相互问的区别和关系。
答聚合方法有不同的分类方法,如下表:按聚合体系中反应物的相态考虑,本体聚合是单体加有(或不加)少量引发剂的聚合。
溶液聚合是单体和引发剂溶于适当溶剂中的聚合。
悬浮聚合一般是单体以液滴状悬浮在水中的聚合,体系主要由单体、水、油溶性引发剂、分散剂四部分组成。
按聚合体系的溶解性进行分类,聚合反应可以分成均相聚合和非均相聚合。
当单体、溶剂、聚合物之间具有很好的相溶性时,聚合为均相聚合;当单体、溶剂、聚合物之间相溶性不好而产生相分离的聚合,则为非均相聚合。
聚合初始,本体聚合和溶液聚合多属于均相体系,悬浮聚合和乳液聚合属于非均相聚合;如单体和聚合物完全互溶,则该本体聚合为均相聚合;当单体对聚合物的溶解性不好,聚合物从单体中析出,此时的本体聚合则成为非均相的沉淀聚合;溶液聚合中,聚合物不溶于溶剂从而沉析出来,就成为沉淀聚合,有时称作淤浆聚合。
思考题5.2本体法制备有机玻璃板和通用级聚苯乙烯,比较过程特征,说明如何解决传热问题、保证产品品质。
答间歇本体聚合是制备有机玻璃板的主要方法。
为解决聚合过程中的散热困难、避免体积收缩和气泡产生,保证产品品质,将聚合分成预聚合、聚合和高温后处理三个阶段来控制。
①预聚合。
在90-95℃下进行,预聚至10%~20%转化率,自动加速效应刚开始较弱,反应容易控制,但体积已经部分收缩,体系有一定的黏度,便于灌模。
②聚合。
将预聚物灌入无机玻璃平板模,在(40-50℃)下聚合至转化率90%。
低温(40~50℃)聚合的目的在于避免或减弱自动加速效应和气泡的产生(MMA的沸点为100℃),在无机玻璃平板模中聚合的目的在于增加散热面。
③高温后处理。
转化率达90%以后,在高于PMMA的玻璃化温度的条件(100~120℃)下,使残留单体充分聚合,通用级聚苯乙烯可以采用本体聚合法生产。
离子聚合习题答案

离子聚合习题答案离子聚合习题答案离子聚合是一种重要的化学反应过程,常见于溶液中的离子物种之间的相互作用。
在离子聚合的习题中,我们需要根据已知的条件和反应方程式,推导出最终的产物和反应物的摩尔比例关系。
下面将通过一些典型的离子聚合习题,来探讨其答案和解题思路。
习题一:已知溶液A中含有1mol Na+离子和2mol Cl-离子,溶液B中含有1mol Ca2+离子和3mol OH-离子。
当A和B两溶液混合后,发生离子聚合反应。
求反应后生成的产物以及摩尔比例。
解答:根据已知条件,我们可以写出反应方程式:2Na+ + Ca2+ + 3Cl- + 3OH- -> 2NaCl + Ca(OH)2根据反应方程式,我们可以得出产物为2mol NaCl和1mol Ca(OH)2。
因此,反应后生成的产物摩尔比例为NaCl:Ca(OH)2 = 2:1。
习题二:已知溶液A中含有1mol Fe2+离子和2mol OH-离子,溶液B中含有1mol Al3+离子和3mol Cl-离子。
当A和B两溶液混合后,发生离子聚合反应。
求反应后生成的产物以及摩尔比例。
解答:根据已知条件,我们可以写出反应方程式:3Fe2+ + 2Al3+ + 6OH- + 6Cl- -> 3Fe(OH)2 + 2AlCl3根据反应方程式,我们可以得出产物为3mol Fe(OH)2和2mol AlCl3。
因此,反应后生成的产物摩尔比例为Fe(OH)2:AlCl3 = 3:2。
习题三:已知溶液A中含有1mol K+离子和2mol SO42-离子,溶液B中含有1molMg2+离子和3mol OH-离子。
当A和B两溶液混合后,发生离子聚合反应。
求反应后生成的产物以及摩尔比例。
解答:根据已知条件,我们可以写出反应方程式:2K+ + Mg2+ + 2SO42- + 6OH- -> MgSO4 + 2KOH根据反应方程式,我们可以得出产物为1mol MgSO4和2mol KOH。
第七章配位聚合

7 绪论7.1 课程的知识要点聚合物的立体异构现象、全同立构、间同立构、无规立构、立构规整性聚合物、光学活性聚合物;配位聚合的基本机理、特点、基本概念及催化剂;Ziegler-Natta 引发体系、使用Z-N引发剂注意的问题。
7.2 本章习题1.名词解释:配位聚合、定向聚合、立构选择性聚合、立构规整度、全同指数、光学活性聚合物。
2. 配位阴离子聚合与典型的阴离子聚合有何不同?其特点如何?3. Z-N引发剂有哪些组分?使用时应注意哪些问题?4. 丙烯用TiCl3-AlEt3引发聚合,用何物质调节聚丙烯分子量?5.聚合物有哪些立体异构体?为什么通常含手征性碳原子的聚合物不显示旋光活性?要制备光学活性高分子应采取哪些措施?6.写出下列单体可能的立构规整性聚合物的结构:7.工业上生产的聚乙烯有几种?它们分别是由何种引发剂体系生产的?依据什么标准来划分聚乙烯种类?8.工业上生产的顺丁橡胶有几种?它们分别是由何种引发剂体系生产的?依据什么标准来划分顺丁橡胶种类?9.立构规整聚丁二烯有几种?它们分别由何种引发剂合成?10.使用Ziegler-Natta引发体系时,为保证实验成功,需要采取那些必要措施?用什么方法除掉残存的引发剂?7.3 模拟考试题1.如何制备光学活性聚合物?2.写出下列单体可能的立构规整性聚合物的结构:3.工业上生产的聚乙烯有几种?它们分别是由何种引发剂体系生产的?依据什么标准来划分聚乙烯种类?4. 丙烯用TiCl3-AlEt3引发聚合,用何物质调节聚丙烯分子量?5.聚合物有哪些立体异构体?为什么通常含手征性碳原子的聚合物不显示旋光活性?要制备光学活性高分子应采取哪些措施?6.工业上生产的顺丁橡胶有几种?它们分别是由何种引发剂体系生产的?依据什么标准来划分顺丁橡胶种类?1.4 模拟考试题答案1.如何制备光学活性聚合物?答:1)改变手性碳原子C*的近邻环境2)将侧基中含有手性C*的烯烃聚合2.写出下列单体可能的立构规整性聚合物的结构:答:略。
高分子化学第五章答案

第五章聚合方法思考题 5.1聚合方法(过程)中有许多名称,如本体聚合、溶液聚合和悬浮聚合,均相聚合和非均相聚合,沉淀聚合和淤浆聚合,试说明它们相互问的区别和关系。
答聚合方法有不同的分类方法,如下表:按聚合体系中反应物的相态考虑,本体聚合是单体加有(或不加)少量引发剂的聚合。
溶液聚合是单体和引发剂溶于适当溶剂中的聚合。
悬浮聚合一般是单体以液滴状悬浮在水中的聚合,体系主要由单体、水、油溶性引发剂、分散剂四部分组成。
按聚合体系的溶解性进行分类,聚合反应可以分成均相聚合和非均相聚合。
当单体、溶剂、聚合物之间具有很好的相溶性时,聚合为均相聚合;当单体、溶剂、聚合物之间相溶性不好而产生相分离的聚合,则为非均相聚合。
聚合初始,本体聚合和溶液聚合多属于均相体系,悬浮聚合和乳液聚合属于非均相聚合;如单体和聚合物完全互溶,则该本体聚合为均相聚合;当单体对聚合物的溶解性不好,聚合物从单体中析出,此时的本体聚合则成为非均相的沉淀聚合;溶液聚合中,聚合物不溶于溶剂从而沉析出来,就成为沉淀聚合,有时称作淤浆聚合。
思考题5.2本体法制备有机玻璃板和通用级聚苯乙烯,比较过程特征,说明如何解决传热问题、保证产品品质。
答间歇本体聚合是制备有机玻璃板的主要方法。
为解决聚合过程中的散热困难、避免体积收缩和气泡产生,保证产品品质,将聚合分成预聚合、聚合和高温后处理三个阶段来控制。
①预聚合。
在90-95℃下进行,预聚至10%~20%转化率,自动加速效应刚开始较弱,反应容易控制,但体积已经部分收缩,体系有一定的黏度,便于灌模。
②聚合。
将预聚物灌入无机玻璃平板模,在(40-50℃)下聚合至转化率90%。
低温(40~50℃)聚合的目的在于避免或减弱自动加速效应和气泡的产生(MMA的沸点为100℃),在无机玻璃平板模中聚合的目的在于增加散热面。
③高温后处理。
转化率达90%以后,在高于PMMA的玻璃化温度的条件(100~120℃)下,使残留单体充分聚合,通用级聚苯乙烯可以采用本体聚合法生产。
离子聚合测验题答案

离子聚合测验题一.填空题1.只能进行阳离子聚合的单体有异丁烯和乙烯基醚等。
2.阳离子聚合的引发体系有 BF3+H2O 、 SnCl4+H2O 和 AlCl3+H2O 等。
3.阴离子聚合体系中活性中心离子对可能以松散离子对、紧密离子对和自由离子等三种形态存在。
4.阳离子聚合的特点是快引发、快增长、易转移、难终止。
5. 异丁烯阳离子聚合最主要的链终止方式是向单体链转移。
合成高相对分子质量的异丁烯,需要进行低温聚合的原因是抑制链转移。
6.离子聚合中溶剂的极性加大,反应速率加快,原因是极性溶剂使离子对松散。
7.丁基橡胶是以异丁烯和异戊二烯为单体,按阳离子反应历程,以AlCl3+H2O 为催化剂,采用溶液聚合方法,在 -100℃温度下聚合制得的。
8.在芳香烃溶剂中,以n-丁基锂为引发剂引发苯乙烯聚合,发现引发速率和增长速率分别是正丁基锂浓度的1/6级和1/2级,表明引发过程和增长过程中存在着。
9.要制备SBS热塑性弹性体,可以采用_阴离子___聚合的原理。
先用碱金属引发剂引发聚合,生成丁二烯结构单元,然后再加入苯乙烯单体,最后加终止剂使反应停止。
二.选择题1. 阳离子聚合的引发剂(C D )A C4H9Li B NaOH+萘 C BF3+H2O D H2SO42. 阳离子聚合的单体(A D )A CH2=CH-C6H5B CH2=C(CH3)COOCH3C CH2=CH-CH3D CH2=CH-OR3.只能采用阳离子聚合的单体是(C )A 氯乙烯B MMAC 异丁烯D 丙烯腈。
4.在高分子合成中,容易制得有实用价值的嵌段共聚物的是(B )A配位聚合 B阴离子活性聚合 C自由基共聚合 D阳离子聚合5.阳离子聚合的特点可以用以下哪种方式来描述(B )A慢引发,快增长,速终止 B快引发,快增长,易转移,难终止C 快引发,慢增长,无转移,无终止 D慢引发,快增长,易转移,难终止6.合成丁基橡胶的主要单体是(B ):A丁二烯+异丁烯 B异丁烯+异戊二烯 C丁二烯7.制备高分子量聚异丁烯是以BF3为催化剂,在氯甲烷中,于-100℃下聚合,链终止的主要形式为(B ):A双基终止 B向单体转移终止 C向溶剂转移终止8.无终止阴离子聚合,调节聚合物分子量的有效手段是(B ):A、温度B、引发剂浓度C、溶剂性质9.升高温度对阳离子聚合反应速率和分子量的影响规律是(C ):A Rp↑M↑B Rp↑M↓C Rp↓M↓10.对阴离子聚合机理的特点说法错误的是(C ):A 快引发B 慢增长C 快终止D 无终止11.在具有强溶剂化作用的溶剂中进行阴离子聚合反应时,聚合速率将随反离子的体积增大而(B ):A 增大B 下降C 不变D 无规律变化12.许多阴离子聚合反应都比相应的自由基聚合有较快的聚合速率,主要是因为(C)A.阴离子聚合的p k 值大于自由基聚合的p k 值B.阴离子聚合活性种的浓度大于自由基活性种的浓度C 阴离子的p k 值和活性种的浓度大于自由基的p k 值和活性种的浓度D 阴离子聚合没有双基终止13.制备相对分子质量分布较窄的聚苯乙烯,应选择(B )。
《高分子化学教程》习题问题详解(第三版)王槐三科学出版社

《高分子化学教程》习题答案(王槐三第三版)第1章1、解释下列概念(1) 高分子化合物:由众多原子或原子团主要以共价键结合而成的相对分子质量在1万以上的化合物。
(2) 重复结构单元:将大分子链上化学组成和结构可重复的最小单位称为重复结构单元(在高分子物理里也称为链节)。
(3) 结构单元:由1个单体分子通过聚合反应而进入聚合物重复单元的那一部分叫结构单元。
(4) 平均相对分子质量:高分子化合物中同系物相对分子质量的统计平均值。
(5) 平均聚合度:所有大分子链上所含重复结构单元数量的统计平均值。
(6) 多分散性和分散指数:多分散性是指聚合物材料中所含大分子同系物的相对分子质量不相等的这一特性。
分散指数是指重均相对分子质量与数均相对分子质量的比值。
2、写出合成下列聚合物的聚合反应方程式并标出结构单元 (1) 涤纶n HOOCCOOH n HO(CH 2)2OH (2n -1)H 2OHO[OCCOO(CH 2)2O]n H +=+结构结构单元单元(2) 尼龙-610n HOOC COOH n H 2N(CH 2)6NH 2(2n -1)H 2OHO [ OC(CH 2)8COHN(CH 2)6NH ]+=+(CH 2)8n H 结构单元结构单元(3) 有机玻璃n CH 2CH 3COOCH 3CCH 2CH 3C 3=[]n CH 2CH 3C 3结构单元:(4) 聚乙烯醇n CH 2 = CHOCOCH 3CH 2CH []OCOCH 3n聚合[]CH 2CH OHn(5) 环氧树脂 (见P8) (6) 聚碳酸酯HOCH 3CH 3C Cl C O ClH OC 3CH 3OCCl + (2n - 1)HCl=+n n []OH n O(7) 聚己二氨基甲酸丁二酯n OCN(CH 2)6NCO + n HO(CH 2)2OH = []OCNH(CH 2)6NHCOO(CH 2)4O n(8) 维尼纶[]CH 2CH OHn + CH 2O 缩醛化CH 2CHCH 2CH CH 2CH CH 2O(9) 丁腈橡胶nCH 2CHCN CH 2CHCH CH CH 2CHCH 2CHCHCH 2nn +[](10) ABS 树脂nCH 2CHCN CH 2CHCH CH 2n ++ nCH 2CH+ BPOCH 2CHCH 2CHCHCH 2CH 2CH n[]3、写出合成下列聚合物的聚合反应方程式并命名聚合物 (1)HO OC(CH 2)8CONH(CH 2)6NH n H[]HO OC(CH 2)8CONH(CH 2)6NH n H[]n HOOC(CH 2)8COOH + n H 2N(CH 2)6NH 2 =尼龙-610 (2)[]OCNH(CH 2)6NHCOO(CH 2)4O n见第2题(7)小题 聚己二氨基甲酸丁二酯(3) H O(CH 2)5CO OH[]nn HOOC(CH 2)5OH = HO []OC(CH 2)5O H + (n-1)H 2On聚6-羟基己酸酯 4、参见教材p3315、分别写出单独或与别的单体进行聚合的反应方程式并命名聚合物。
高分子化学(第四版)习题参考答案Chap.3

第四版习题答案(第三章)思考题2. 下列烯类单体适于何种机理聚合?自由基聚合、阳离子聚合还是阴离子聚合?并说明原因。
CH 2=CHCl CH 2=CCl 2 CH 2=CHCN CH 2=C(CN)2 CH 2=CHCH 3 CH 2=C(CH 3)2 CH 2=CHC 6H 5 CF 2=CF 2 CH 2=C(CN)COOR CH 2=C(CH 3)-CH=CH 2答:CH 2=CHCl :适合自由基聚合,Cl 原子是吸电子基团,也有共轭效应,但均较弱。
CH 2=CCl 2:自由基及阴离子聚合,两个吸电子基团。
CH 2=CHCN :自由基及阴离子聚合,CN 为吸电子基团。
CH 2=C(CN)2:阴离子聚合,两个吸电子基团(CN )。
CH 2=CHCH 3:配位聚合,甲基(CH 3)供电性弱。
CH 2=CHC 6H 5:三种机理均可,共轭体系。
CF 2=CF 2:自由基聚合,对称结构,但氟原子半径小。
CH 2=C(CN)COOR :阴离子聚合,取代基为两个吸电子基(CN 及COOR ) CH 2=C(CH 3)-CH=CH 2:三种机理均可,共轭体系。
3. 下列单体能否进行自由基聚合,并说明原因。
CH 2=C(C 6H 5)2 ClCH=CHCl CH 2=C(CH 3)C 2H 5 CH 3CH=CHCH 3CH 2=CHOCOCH 3 CH 2=C(CH 3)COOCH 3 CH 3CH=CHCOOCH 3 CF 2=CFCl 答:CH 2=C(C 6H 5)2:不能,两个苯基取代基位阻大小。
ClCH=CHCl :不能,对称结构。
CH 2=C(CH 3)C 2H 5:不能,二个推电子基,只能进行阳离子聚合。
CH 3CH=CHCH 3:不能,结构对称。
CH 2=CHOCOCH 3:醋酸乙烯酯,能,吸电子基团。
CH 2=C(CH 3)COOCH 3:甲基丙烯酸甲酯,能。
CH 3CH=CHCOOCH 3 :不能,1,2双取代,位阻效应。
第章离子及配位聚合习题参考答案

第四章 离子聚合和配位聚合-习题参考答案1、分析下列引发体系与单体,并判断何种引发体系可引发何种单体?按哪种机理进行聚合?写出反应式。
答: 1、(C 6H 5COO)2 引发自由基聚合Na +引发阴离子聚合BF 3 + H 2O 引发阳离子聚合 (CH 3)3COOH + Fe 2+ 引发自由基聚合H 2SO 4 引发阳离子聚合n C 4H 9Li引发阴离子聚合(NH 4)2S 2O 8 引发自由基聚合 n H 2CCHC 6H 5CH 2CH6H 5n自由基、阴离子、阳离子聚合n H 2CCH CH CH 2CH 2CH CH CH 2n自由基、阴离子、阳离子聚合n H 2CCHClCH 2CHCln自由基聚合n H 2CC(CN)CH 2C(CN)2n阴离子聚合n H 2CC(CH 3)COOCH 3CH 2C COOCH 3CH 3n自由基聚合n H 2CC(CH 3)2CH 2CCH 3CH 3n阳离子聚合n H 2CCH OC 4H 9CH 2CHOC 4H 9n阳离子聚合4、用萘钠引发α一甲基苯乙烯聚合,获得分子量为354000的聚合物1.77kg ,计算反应初始加入的萘钠为多少克? 解:300011810000054.3=⨯=Xn2/][118/100077.1/][][C n C M Xn ⨯==[C]=mol 01.0300030萘钠用量为:0.01×23=0.23克。
离子聚合和配位(聚丙烯)

HX CC
HH
CH2
C
H
间同立构高分子
非极性溶剂中:链增长活性中心与抗衡阳离子表现为紧 密离子对,相互间作用较强,单体与链增长活性中心加 成是主要受这种相互作用的影响,有利于获得全同立构 高分子。以烷基锂引发的甲基丙烯酸甲酯的阴离子聚合 为例,一般认为其机理如下:
于阴离子的进攻,另一方面,形成的碳阴离子活性中心由于
取代基的共轭效应而稳定,因而易阴离子聚合:
H2C CH X
降低电子云密度,易 与富电性活性种结合
H R CH 2 C
X
分散负电性,稳定活性中心
H2C CH X: -NO2, -CN, -COOR, -Ph, -CH=CH2 X
但对于一些同时具有给电子p-π共轭效应的吸电子取代基单 体,由于p-π给电子共轭效应减弱了吸电子诱导效应对双键 电子云密度的降低程度,因而不易受阴离子的进攻,不易 阴离子聚合。如:
Ziegler-Natta催化剂的乙烯的配位聚合则可在低(中)压 条件下进行,不易向高分子链转移,得到的是线形高分子,分 子链之间堆砌较紧密,密度大,常称高密度聚乙烯(HDPE)。
紧密离子对
溶剂分离离子对 自由离子
离解程度增加
反应活性增加
阴 离 子 聚 合 单体
阴离子聚合单体必须含有能使链增长活性 中心稳定化的吸电子基团,主要包括带吸电子 取代基的乙烯基单体、一些羰基化合物、异氰 酸酯类和一些杂环化合物。
(1)带吸电子取代基的乙烯基单体
一方面,吸电子性能能使双基上电子云密度降低,有利
高聚物生产技术_习题答案_第一章

向大分子转移(如果存在其形式如下):
~CH2-CH• + Cl
~CH-CH2 ~
Cl
~CH2-CH2 + Cl
• ~C-CH2 ~ Cl
第一章习题参考答案
第 解答: 6 题
各种自由基活性的比较: (1)>(3)>(2)>(5)>(6)>(4)>(7)>(8) 各种自由基的活性与作用: 排序中的前四种属于活泼和较活泼的自由基,因此具有引发作用; 排序中的第五位,因存在如下形式的共轭而使自由基聚合能力下降,最多也 只能形成低聚合物;(RCH=CHCH2• RCH-CH-CH2•) 排序中的第六位,因此共轭效应较大,属于较低活活性自由基,即使能反应, 也只能形成二聚体; 排序中的第七、八位,因共轭效应和空间位阻较大,使其不具备引发能力而 成为实际性的阻聚剂。
1
题
第一章习题参考答案
第 解答:
低密度聚乙烯、聚氯乙烯、聚苯乙烯、聚醋酸乙烯酯、聚甲基丙烯酸甲酯及 其他丙烯酸酯类、聚四氟乙烯、聚丙烯腈、丁苯橡胶、丁腈橡胶、氯丁橡胶、 ABS树脂、各种共聚物等 。
2
题
第一章习题参考答案
第 解答: 3 题
自由基是带独电子的基团,它产生于共价键化合物的均裂。 R: R 2R· 自由基的加成反应 自由基易与含双键的烯烃单体进行加成,其产物是新自 由基。这是自由基聚合反应链增长的基础。 自由基的夺取原子反应 有两情况,一是夺取其他分子上的氢原子,本身失 去活性,同时又产生新的自由基。这是链转移和歧化终止的基础。 自由基的偶合反应 当两个自由基相遇时发生偶合反应,活性消失,并形成 稳定的共价键化合物。这是偶合终止的基础。 自由基的氧化还原反应 自由基可以接受或给出电子,使其失去活性。这是 氧化还原引发的基础。 自由基的消去反应 有些体积较大的自由基可以自行消去结构式中的一部分, 变成较小的自由基。因此,又叫做自由基的破碎反应。
离子聚合课后习题
极性溶剂中,反离子溶剂化,半径越大,Kp越小 极性溶剂中,反离子溶剂化,半径越大,Kp越小 非极性溶剂中,反离子未溶剂化,半径越大,Kp越大 非极性溶剂中,反离子未溶剂化,半径越大,Kp越大
写出用阴离子聚合方法合成三种不同端基(-OH、-COOH、 写出用阴离子聚合方法合成三种不同端基( OH、 COOH、 -NH2)的聚丁二烯遥爪聚合物的反应过程 NH2)
以乙二醇二甲醚为溶剂,分别以RLi、RNa、RK为引发剂, 为引发剂, 以乙二醇二甲醚为溶剂,分别以RLi、RNa、RK为引发剂 在相同条件下使苯乙烯聚合, 在相同条件下使苯乙烯聚合,判断采用不同引发剂时聚合 速度的大小。如改用环己烷做溶剂, 速度的大小。如改用环己烷做溶剂,聚合速度的大小顺序 如何, 如何,说明判断依据
(1)乙二醇二甲醚是极性很强的溶剂,可使金属离子溶剂化。金属反 (1)乙二醇二甲醚是极性很强的溶剂 可使金属离子溶剂化。 乙二醇二甲醚是极性很强的溶剂, 离子的半径越小,其溶剂化程度越大, 离子的半径越小,其溶剂化程度越大,因而松对和自由离子活性种 浓度越大,链增长速度也越大。碱金属离子半径Li<Na<K,所以苯 浓度越大,链增长速度也越大。碱金属离子半径Li<Na<K,所以苯 乙烯在乙二醇二甲醚中的聚合速度是RLi>RNa>RK 乙烯在乙二醇二甲醚中的聚合速度是RLi>RNa>RK (2)环己烷基本无溶剂化能力,所以活性种反离子基本未溶剂化。金 (2)环己烷基本无溶剂化能力 所以活性种反离子基本未溶剂化。 环己烷基本无溶剂化能力, 属离子半径越大,正负离子的解离度越大,增长速率越大。 属离子半径越大,正负离子的解离度越大,增长速率越大。故在环 己烷中RLi<RNa<RK 己烷中RLi<RNa&,加入二氧化碳、 遥爪聚合物概念:活性聚合结束,加入二氧化碳、 环氧乙烷或二异氰酸酯进行反应,形成带有羧基、 环氧乙烷或二异氰酸酯进行反应,形成带有羧基、 羟基、氨基等端基的聚合物。 羟基、氨基等端基的聚合物。如果是双阴离子引 则大分子两端都带有这些端基, 发,则大分子两端都带有这些端基,即为遥爪聚 合物。 合物。 • 该题应用什么引发体系? 该题应用什么引发体系?
第五章--配位聚合

第五章--配位聚合第五章配位聚合习题参考答案1.举例说明聚合物的异构现象,如何评价聚合物的立构规整性?解答:(1)聚合物的异构现象:①结构异构聚合物,如聚甲基丙烯酸甲酯与聚丙烯酸乙酯:CH3|-[-CH2-C-]n--[-CH2-CH-]n-||CO2CH3CO2C2H5聚甲基丙烯酸甲酯聚丙烯酸乙酯②几何异构聚合物,汉分子链中由于双键或环形结构上取代基在空间排列方式不同造成的立体异构称为几何异构,也称顺-反异构。
如丁二烯聚合所形成的1,4-聚丁二烯,其结构单元有顺式结构和反式结构两种:~~~CH2 CH2~~~~~~CH2HC = C C = CH H H CH2~~~顺式结构(顺-1,4聚丁二烯)反式结构(反-1,4聚丁二烯)③光学异构聚合物,如聚环氧丙烷有一个真正的手性碳原子:H|~~~O-C*-CH2~~~|CH3④构象异构聚合物,当大分子链中原子或原子团绕单键自由旋转所占据的特殊空间位置或单键连接的分子链单元的相对位置的改变称构象异构。
构象异构可以通过单键的旋转而互相转换。
(2)当大分子链上大部分结构单元(大于75%)是同一种立体构型时,称该大分子为有规立构聚合物,或立构规整聚合物、定向聚合物。
反之,称为无规立构聚合物。
2.写出下列单体聚合后可能出现的立构规整聚合物的结构式及名称:(1)CH2=CH-CH3(2)CH2-CH-CH3O反式结构(反-1,4聚异戊二烯)全同3,4-聚异戊二烯(R 为-C(CH 3)=CH 2) 间同3,4-聚异戊二烯(R 为-C(CH 3)=CH 2)全同1,2-聚异戊二烯(R 乙烯基) 间同3,4-聚异戊二烯(R 为乙烯基)H H CH 3 R H H CH 3 R H H H H R H H R H HH H H R H H H R H H H CH 3 R H H R CH 3 H H3.什么是配位聚合?主要有几类催化剂(或引发剂),各有什么特点?解答:(1)配位聚合:是指单体分子的碳-碳双键先在显正电性的低价态过渡金属的空位上配位,形成某种形式的络合物(常称σ-π络合物),经过四元环过渡态,随后单体分子插入过渡金属-碳键中进行增长的聚合过程。
配位化学习题及答案

配位化学习题及答案
配位化学学习题及答案
配位化学是化学中一个重要的分支,涉及到配合物的结构、性质和反应等方面。
以下是一些配位化学的学习题及答案,希望能帮助大家更好地理解这一领域的
知识。
1. 什么是配合物?
答案:配合物是由中心金属离子和周围的配体组成的化合物。
配体通常是能够
提供一个或多个孤对电子给中心金属离子的分子或离子。
2. 什么是配位数?
答案:配位数是指一个中心金属离子周围配体的数量。
例如,对于[Fe(CN)6]4-
这个配合物来说,铁离子的配位数为6。
3. 什么是配位键?
答案:配位键是指中心金属离子和配体之间的化学键。
这种键通常是由配体中
的孤对电子和中心金属离子形成的。
4. 什么是配位化合物的立体化学?
答案:配位化合物的立体化学涉及到配体和中心金属离子之间的空间排布。
这
种排布对于配合物的性质和反应有很大的影响。
5. 什么是配合物的分子结构?
答案:配合物的分子结构是指配体和中心金属离子之间的空间排布。
这种排布
可以通过X射线衍射等方法来确定。
通过以上学习题及答案,我们可以更好地理解配位化学这一领域的知识。
希木
大家能够通过学习不断提高自己的化学水平,为将来的科研和工作打下坚实的
基础。
无机化学离子共存及配位化合物练习题

无机化学离子共存及配位化合物练习题在无机化学中,离子共存是一种常见的现象,是指在一个物质中同时存在不同的离子或离子组合。
离子共存的情况下,常常会发生配位化合物的生成,这是由于不同离子之间通过配位键结合而形成的化合物。
1. 问题一:下列物质中,哪些是离子共存的情况?a) NaClb) CaOc) CuSO4d) NH4OH解答:离子共存是指在一个物质中同时存在不同的离子或离子组合。
根据物质的离子化程度,我们可以判断出哪些是离子共存的情况。
a) NaCl: Na+和Cl-离子共存于氯化钠中。
b) CaO: Ca2+和O2-离子共存于氧化钙中。
c) CuSO4: Cu2+和SO42-离子共存于硫酸铜中。
d) NH4OH: NH4+和OH-离子共存于氢氧化铵中。
因此,答案是a) NaCl,b) CaO,c) CuSO4,d) NH4OH都是离子共存的情况。
2. 问题二:下面是一些离子的名称,请给出它们的化学式。
a) 高锰酸根离子b) 氧化亚铁离子c) 氢氧根离子d) 亚硝酸根离子解答:离子的名称可以通过化学式来表示。
a) 高锰酸根离子:MnO4-b) 氧化亚铁离子:Fe2+c) 氢氧根离子:OH-d) 亚硝酸根离子:NO2-因此,答案是a) MnO4-,b) Fe2+,c) OH-,d) NO2-。
3. 问题三:给出以下离子的配位数。
a) 铁离子b) 铜离子c) 银离子d) 锌离子解答:配位数是指一个离子或原子周围配位体的数目。
a) 铁离子的配位数可以是2、4、6或8。
b) 铜离子的配位数可以是2、4、5、6或8。
c) 银离子的配位数可以是2、3或4。
d) 锌离子的配位数可以是2、4或6。
因此,答案是a) 2、4、6或8,b) 2、4、5、6或8,c) 2、3或4,d) 2、4或6。
4. 问题四:给出以下配位化合物的化学式。
a) 四氟合铜(II)酸根b) 六水合硝酸铁(III)c) 五氯化铋(III)d) 二氯合二乙烯铂(II)解答:配位化合物的化学式可以根据离子和配位体的配位数推导得出。
第四章离子聚合

第四章 离子聚合 习题参考答案1.与自由基聚合相比,离子聚合活性中心有些什么特点? 解答:离子聚合和自由基聚合的根本不同就是生长链末端所带活性中心不同。
离子聚合活性中心的特征在于:离子聚合生长链的活性中心带电荷,为了抵消其电荷,在活性中心近旁就要有一个带相反电荷的离子存在,称之为反离子,当活性中心与反离子之间得距离小于某一个临界值时被称作离子对。
活性中心和反离子的结合,可以是极性共价键、离子键、乃至自由离子等多种形式,彼此处于平衡状态:BA B +A B+AB +A +IIIIIIIVⅠ为极性共价物种,它通常是非活性的,一般可以忽略。
Ⅱ和Ⅲ为离子对,引发剂绝大多数以这种形式存在。
其中,Ⅱ称作紧密离子对,即反离子在整个时间里紧靠着活性中心。
Ⅲ称作松散离子对,即活性中心与反离子之间被溶剂分子隔开,或者说是被溶剂化。
Ⅳ为自由离子。
通常在一个聚合体系中,增长物种包括以上两种或两种以上的形式,它们彼此之间处于热力学平衡状态。
反离子及离子对的存在对整个链增长都有影响。
不仅影响单体的的聚合速度,聚合物的立体构型有时也受影响,条件适当时可以得到立体规整的聚合物。
2.适合阴离子聚合的单体主要有哪些,与适合自由基聚合的单体相比的些什么特点? 解答:对能进行阴离子聚合的单体有一个基本要求: ① 适合阴离子聚合的单体主要有:(1)有较强吸电子取代基的烯类化合物主要有丙烯酸酯类、丙烯腈、偏二腈基乙烯、硝基乙烯等。
(2)有π-π共轭结构的化合物主要有苯乙烯、丁二烯、异戊二烯等。
这类单体由于共轭作用而使活性中心稳定。
(3)杂环化合物 ② 与适合自由基聚合的单体相比的特点:(1)有足够的亲电结构,可以为亲核的引发剂引发形成活性中心,即要求有较强吸电子取代基的化合物。
如VAc ,由于电效应弱,不利于阴离子聚合。
(2)形成的阴离子活性中心应有足够的活性,以进行增长反应。
如二乙烯基苯,由于空间位阻大,可形成阴离子活性中心,但无法增长。
配位化学习题及答案(1)

配位化学习题及答案(1)配位化学习题及答案(1)配位化学练习题⼀.是⾮题1.配合物的配位体都是带负电荷的离⼦,可以抵消中⼼离⼦的正电荷。
2+2+ 2+2.[Cu(NH)] 的积累稳定常数β是反应[Cu(NH)]+NH,[Cu(NH)]的平33332333衡常数。
3. 配位数是中⼼离⼦(或原⼦)接受配位体的数⽬。
4.配离⼦的电荷数等于中⼼离⼦的电荷数。
5.配合物中由于存在配位键,所以配合物都是弱电解质。
θ6.根据稳定常数的⼤⼩,即可⽐较不同配合物的稳定性,即K愈⼤,该配合物f愈稳定。
7. 对同⼀中⼼离⼦,形成外轨型配离⼦时磁矩⼤,形成内轨型配合物时磁矩⼩。
3+8.Fe(?)形成配位数为6的外轨型配合物中,Fe离⼦接受孤对电⼦的空轨道32是spd。
9.中⼼离⼦的未成对电⼦数越多,配合物的磁矩越⼤。
10. 配离⼦的配位键越稳定,其稳定常数越⼤。
⼆.选择题1. 下列叙述正确的是()A. 配合物由正负离⼦组成B. 配合物由中⼼离⼦(或原⼦)与配位体以配位键结合⽽成C. 配合物由内界与外界组成D. 配合物中的配位体是含有未成键的离⼦2.下⾯关于螯合物的叙述正确的是( )A、有两个以上配位原⼦的配体均⽣成螯合物B、螯合物和具有相同配位原⼦的⾮螯合物稳定性相差不⼤C、螯合物的稳定性与环的⼤⼩有关,与环的多少⽆关D、起螯合作⽤的配体为多齿配体,称为螯合剂,,,,,,,,,,,,3.已知lgAgNH=7.05, ,21.7, =7.57,lgAgCNlgAgSCN,,,,,,,,,,,232222,,,,2,,,,,,3,,,,=13.46;当配位剂的浓度相同时,AgCl在哪种溶液中的溶解度lgAgSO,,,,,2232,,1最⼤( )A. NH?HOB. KCNC. NaSOD. NaSCN 322234.为了保护环境,⽣产中的含氰废液的处理通常采⽤FeSO法产⽣毒性很⼩的配 4合物是( )3, A、Fe(SCN) B、Fe(OH) 363, C、Fe(CN) D、Fe [(Fe(CN)] 2 665. 下列说法中错误的是()A. 在某些⾦属难溶化合物中,加⼊配位剂,可使其溶解度增⼤3+3+B.FeNaFFe 在溶液中加⼊后,的氧化性降低3-C.[FeF] 在溶液中加⼊强酸,也不影响其稳定性63+D.[FeF] 在溶液中加⼊强碱,会使其稳定性下降66.对于⼀些难溶于⽔的⾦属化合物,加⼊配位剂后,使其溶解度增加,其原因是()A. 产⽣盐效应B. 配位剂与阳离⼦⽣成配合物,溶液中⾦属离⼦浓度增加C. 使其分解D. 阳离⼦被配位⽣成配离⼦,其盐溶解度增加7.下列分⼦或离⼦能做螯合剂的是( )-A. HN-NH B. CHCOO C. HO-OH D.HNCHCHNH 22 322228. 配位数是()A.() 中⼼离⼦或原⼦接受配位体的数⽬B.() 中⼼离⼦或原⼦与配位离⼦所带电荷的代数和C.中⼼离⼦(或原⼦)接受配位原⼦的数⽬D.中⼼离⼦(或原⼦)与配位体所形成的配位键数⽬ 9.关于配合物,下列说法错误的是( )A.配体是⼀种可以给出孤对电⼦或π键电⼦的离⼦或分⼦B.配位数是指直接同中⼼离⼦相连的配体总数 C.⼴义地讲,所有⾦属离⼦都可能⽣成配合物 D.配离⼦既可以存在于晶体中,也可以存在于溶液中210.分⼦中既存在离⼦键、共价键还存在配位键的有( )3+AlCl A. B. C.[Co(NH)]Cl D. NaSOKCN3633243+11.下列离⼦中,能较好地掩蔽⽔溶液中Fe离⼦的是( )- ---A.F B.Cl C. Br D. I12. 下列说法中错误的是()A. B. 配合物的形成体通常是过渡⾦属元素配位键是稳定的化学键C. D. 配位体的配位原⼦必须具有孤电⼦对配位键的强度可以与氢键相⽐较13. 下列命名正确的是()A. [Co(ONO)(NH)Cl]Cl ?III 亚硝酸根⼆氯五氨合钴()352B. [Co(NO)(NH)] ?III 三亚硝基三氨合钴()2333C. [CoCl(NH)]Cl ?III 氯化⼆氯三氨合钴()233D. [CoCl(NH)]Cl ?III 氯化四氨氯⽓合钴()23414. 影响中⼼离⼦(或原⼦)配位数的主要因素有()A. 中⼼离⼦(或原⼦)能提供的价层空轨道数B.空间效应,即中⼼离⼦(或原⼦)的半径与配位体半径之⽐越⼤,配位数越⼤C. 配位数随中⼼离⼦(或原⼦)电荷数增加⽽增⼤D. 以上三条都是15. 下列说法中正确的是()A. 配位原⼦的孤电⼦对越多,其配位能⼒就越强B. 电负性⼤的元素充当配位原⼦,其配位能⼒就强C. 能够供两个或两个以上配位原⼦的多齿配体只能是有机物分⼦D. 内界中有配位键,也可能存在共价键16.CoCl?5NH?HO已知某化合物的组成为,其⽔溶液显弱酸性,加⼊强碱并加332AgNO热⾄沸,有氨放出,同时产⽣三氧化⼆钴的沉淀;加于另⼀份该化3 AgClAgNO合物的溶液中,有沉淀⽣成,过滤后,再加⼊⽽⽆变化,但加3 AgCl热⾄沸⼜产⽣沉淀,其重量为第⼀次沉淀量的⼆分之⼀,故该化合物的化学式为()A.[CoCl(NH)]Cl?HOB.[Co(NH)HO]Cl235235233C.[CoCl(NH)]Cl?HOD.[CoCl(NH)]Cl?NH?HO 3522234323+17.Fe 离⼦能与下列哪种配位体形成具有五元环的螯合离⼦()--2- A. CO B.CHCOCHCOCH C. HNCHCHNHD.OOCCHCOO 24323222222-18.下列各配合物具有平⾯正⽅形或⼋⾯体的⼏何构型,其中CO离⼦作为螯合 3剂的是( )+ + A.[Co(NH)CO]B.[Co(NH)CO]353333C.[Pt(en)CO]D.[Pt(en)( NH)CO] 33319.下列配离⼦能在强酸性介质中稳定存在的是( )3,2,3,2,,,,,,,AgSONiNHFeCOHgCl232433244A. B. C.; D.。
[课件]第六章 离子聚合习题PPT
![[课件]第六章 离子聚合习题PPT](https://img.taocdn.com/s3/m/be9c24cdaeaad1f346933f77.png)
解:丁基锂引发单阴离子聚合 n=1
(1)平均聚合度
n ([ M ] [ M ])1 0 . 75 0 X 150 n [ C ] 0 . 005
(2)反应的动力学链长
Xn 1
X 1 150 1 149 n
(2)当聚合时间为4000S时,首先计算聚合达到4000S时已经 消耗的单体数目. d [ M ] [M ] R k [ C ][ M ] ln 0 kp[ C ] t 阴离子聚合动力学方程为: p p dt
M
] [M 0 ln [M C ] t 2 0 0 0 2000 1 ] 2 0 0 0 kp[ 4000 2 kp[ C] t 4000 ] [M 0 ln [M ] 4 0 0 0
[ C ] 0 . 868 mol L 1 3 50 10 3 0 . 868 ( 1 . 0 ml 10 ) 2 1 [ C ] 0 . 01736 1 . 736 10 mol L 3 50 10
2 ([ M ] [ M ]) 2 0 . 96 0 X 110 n [ C ] 0 . 01736
如果大分子同时开始增长和终止,则
X w 110
X X
w n
1
M M 104 110 11440 n w
6-5、25℃,四氢呋喃中,以丁基锂做引发剂(0.005mol· L-1),与1-乙 烯基萘(0.75 mol· L-1)进行阴离子聚合, 计算:(1)平均聚合度;(2)动力学链长。
解:将5g苯乙烯在50ml四氢呋喃中,苯乙烯的浓度为:
5 / 104 1 [ M ] 0 . 96 mol L 0 0 . 05
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 离子聚合和配位聚合-习题参考答案
1、分析下列引发体系与单体,并判断何种引发体系可引发何种单体?按哪种机理进行聚合?写出反应式。
答: 1、
(C 6H 5COO)2 引发自由基聚合
Na +
引发阴离子聚合
BF 3 + H 2O 引发阳离子聚合
(CH 3)3COOH + Fe 2+ 引发自由基聚合
H 2SO 4 引发阳离子聚合 n C 4H 9Li
引发阴离子聚合
(NH 4)2S 2O 8 引发自由基聚合 n H 2C
CHC 6H 5
CH 2CH
C 6H 5
n
自由基、阴离子、阳离子聚合
n H 2C
CH CH CH 2CH 2CH CH CH 2
n
自由基、阴离子、阳离子聚合
n H 2C
CHCl
CH 2
CHCl
n
自由基聚合
n H 2C
C(CN)
CH 2
C
2
n
阴离子聚合
n H 2C
C(CH 3)COOCH 3
CH 2
C COOCH 3
CH 3
n
自由基聚合
n H 2C
C(CH 3)2
CH 2
C
CH 3
3
n
阳离子聚合
n H 2C
CH OC 4H 9CH 2
CH
4H 9
n
阳离子聚合
4、用萘钠引发α一甲基苯乙烯聚合,获得分子量为354000的聚合物1.77kg ,计算反应初始加入的萘钠为多少克? 解:
3000118
100000
54.3=⨯=
Xn
2
/][118
/100077.1/][][C n C M Xn ⨯==
[C]=
mol 01.03000
30
萘钠用量为:0.01×23=0.23克。
