年产10万吨乙酸乙酯毕业设计说明书
年产10万吨乙酸乙酯毕业设计说明书
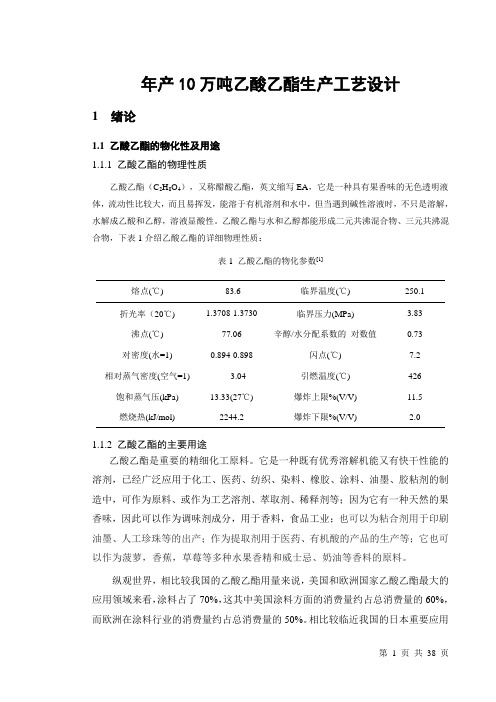
年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。
课程设计--年产10万吨PET生产的工艺设计

目录总论.................................................................................................................................... - 3 -1 综述...................................................................................................................................... - 4 -1.1聚对苯二甲酸乙二醇酯(PET)的简介.................................................................. - 4 -1.1.1 PET一般性质................................................................................................. - 4 -1.1.2 PET的组织结构............................................................................................. - 4 -1.2 聚对苯二甲酸乙二醇酯(PET)的特性与应用..................................................... - 5 -1.2.1 特性................................................................................................................ - 5 -1.2.2 应用................................................................................................................ - 7 -1.2.3 PET的加工特性............................................................................................. - 8 -1.2.4 PET的加工方法............................................................................................. - 9 -1.3 中国生产消费现状及产品构成............................................................................... - 9 -1.3.1国内生产消费水平现状................................................................................. - 9 -1.3.2 产品构成........................................................................................................ - 9 -2 PET生产工艺的比较与确定............................................................................................. - 10 -2.1 PET的生产工艺简介.............................................................................................. - 10 -2.1.1 酯交换法生产工艺简介(DMT法)........................................................... - 10 -2.1.2 直接酯化法生产工艺简介(PTA法)....................................................... - 11 -2.1.3 环氧乙烷法生产工艺简介(EO法)......................................................... - 12 -2.2 各生产工艺优劣势比较及工艺选择..................................................................... - 12 -2.2.1 PTA法的生产优势....................................................................................... - 13 -2.2.2 DMT法的生产优势....................................................................................... - 14 -2.2.3生产工艺的选择........................................................................................... - 15 -2.3工艺过程介绍.......................................................................................................... - 15 -2.3.1反应机理及条件........................................................................................... - 15 -2.3.2 工艺生产流程图.......................................................................................... - 18 -3 物料衡算与能量衡算........................................................................................................ - 19 -3.1物料平衡关系示意图.............................................................................................. - 19 -3.2化学与物理变化...................................................................................................... - 19 -3.3计算过程.................................................................................................................. - 20 -3.3.2.物料衡算计算过程...................................................................................... - 22 -3.3.3物料平衡结果总汇。
年产8万吨乙酸乙酯生产车间的设计毕业设计论文

毕业论文(设计)题目:年产 8 万吨乙酸乙酯生产车间的设计学生姓名:学号:所在学院:材料与化工学院专业班级:届别:指导教师:皖西学院本科毕业设计(论文)创作诚信承诺书1.本人郑重承诺:所提交的毕业设计(论文),题目《年产8 万吨乙酸乙酯生产车间的设计》是本人在指导教师指导下独立完成的,没有弄虚作假,没有抄袭、剽窃别人的内容;2.毕业设计(论文)所使用的相关资料、数据、观点等均真实可靠,文中所有引用的他人观点、材料、数据、图表均已标注说明来源;3.毕业设计(论文)中无抄袭、剽窃或不正当引用他人学术观点、思想和学术成果,伪造、篡改数据的情况;4.本人已被告知并清楚:学校对毕业设计(论文)中的抄袭、剽窃、弄虚作假等违反学术规范的行为将严肃处理,并可能导致毕业设计(论文)成绩不合格,无法正常毕业、取消学士学位资格或注销并追回已发放的毕业证书、学士学位证书等严重后果;5.若在省教育厅、学校组织的毕业设计(论文)检查、评比中,被发现有抄袭、剽窃、弄虚作假等违反学术规范的行为,本人愿意接受学校按有关规定给予的处理,并承担相应责任。
学生(签名):日期:年月日目录1 前言 (2)2 工艺设计方案 (3)2.1 原料路线确定的原则和依据 (3)表 1 四种工艺优缺点比较 . (4)3 设计方案的确定 (6)3.1 反应原理 (6)3.2 工艺流程图 (8)4 物料衡算 (9)4.1 (1)全流程的工艺数据 (9)4.2 一步缩合反应釜的物量衡算 (9)4.3 二步缩合反应釜的物料衡算 (9)4.4 单效蒸发器的物料衡算 (10)4.5 脱乙醛塔的物料衡算 (11)4.6 脱乙醇塔 (11)4.7 脱重组分塔 (12)5 热量衡算 (13)5.1 基本数据 (13)5.2 一步缩合釜的热量衡算: (14)5.3 二步缩合反应釜热量衡算: (14)5.4 单效蒸发器的热量衡算 (14)5.5 冷凝器的热量衡算 (15)5.6 脱乙醛塔的热量衡算 (15)5.6.1再沸器的热负荷155.7 脱乙醇塔的热量衡算 (16)5.7.1 再沸器的热负荷165.8 脱组分精馏塔的热量衡算 (17)5.8.1再沸器的热负荷 (17)5.9 脱重组分的冷凝器的热量衡算 (17)6 主要设备的设计与辅助设备的选型 (18)6.1一步缩合反应釜的设计 (18)6.1.1缩合釜釜体的设计 (18)6.2单效蒸发器的设计与选型 (20)6.2.1蒸发器的选择理由 (20)6.2.2蒸发器计算与设计 (20)6.3脱乙醛塔的设计与计算 (21)6.3.1脱乙醛塔的基础数据 (21)6.3.3塔板结构设计 (21)6.3.4塔高的确定 (22)6.4辅助设备的选型 (24)6.4.1泵的选型 (24)6.4.2再沸器的选型[26] (24)6.4.3冷凝器选型 (26)6.4.4工艺设备一览表 (26)7. 车间布置设计 (29)7.1概述 (29)7.2车间布置 (29)7.3本设计的生产车间布置 (31)8. 总结 (31)参考文献: (32)33附录 : .........................................................致谢 (34)年产 8 万吨乙酸乙酯生产车间的设计学生:解东(指导老师:钟煜)( 皖西学院材料与化工学院)摘要:乙酸乙酯其分子式为CH3COOC2H5,乙酸乙酯是一种无色透明的特殊的水果味的液体。
年产10万吨硫酸毕业设计

1设计任务书 (2)1.1项目 (2)1.2设计内容 (2)1.3设计规模 (2)1.4设计依据 (2)1.5产品组成、性质及用途 (2)1.6产品质量规格 (5)1.7原料方案 (6)原料:硫铁矿 (6)1.8工艺技术指标 (6)1.9生产方式 (8)2工艺线路及流程设计 (8)2.1硫酸的工艺基础 (8)2.2工艺路线选择 (10)2.3流程的设计 (10)2.4工艺操作设计 (10)3物料横算 (13)3.1转化—吸收系统的物料衡算 (13)4发烟硫酸吸收塔的设计 (15)4.1发烟硫酸吸收塔的计算 (15)4.2发烟硫酸吸收塔的设计结构图 (16)5设备一览表 (17)6车间防护 (18)6.1 有毒害性物质的防护 (18)6.2 泄漏应急处理 (18)6.3 急救措施 (18)6.4 噪声的防护 (19)6.5生产要求 (19)7经济评估 (20)7.1经济投资 (20)7.2经济分析 (20)8人员配置 (21)9三废处理 (21)9.1三废处理的意义 (21)9.2三废处理 (21)致谢: (23)参考文献: (24)年产10万吨硫酸的工艺设计1设计任务书1.1项目硫酸生产的工艺设计1.2设计内容1.2.1生产工艺设计1.2.2设计转化吸收塔1.3设计规模1.3.1 年产:10万吨1.3.2 年生产日:300天1.3.3日生产能力:10/300=333吨/天1.4设计依据该设计说明书是依据湖北远大富驰医药化工股份有限公司的生产技术资料的基础上,并结合设计任务书的内容年产10万吨硫酸技术要求。
1.5产品组成、性质及用途1.5.1硫酸组成【1】硫酸(英文名:Sulphuric acid for industrial use),H2SO4或SO3·H2O,相对分子质量98.078,是指SO3与H2O摩尔比等于1的化合物,或指100%H2SO4,外观为无色透明油状液体,密度(20℃)为1.8305g/㎝³。
产万吨乙酸乙酯生产车间的设计论文pptx

03
引入新型设备
探索新型设备或技术,如高效能搅拌器、新型塔板等,提高设备效率
和产品质量。
设备改进方案
01
选用高可靠性设备
选用具有高可靠性和稳定性的设备, 减少设备故障率,提高生产连续性和 稳定性。
02
优化设备参数
针对关键设备,研究其工作参数对生 产效率和产品质量的影响,优化设备 参数以提高生产效率和产品质量。
相关工作
概述过去和现在的乙酸乙酯生产技术和设备 ,分析其优缺点。
介绍国内外的生产厂家和技术特点,对比国 内外生产工艺和设备的差异。
论文大纲
介绍论文的主要内容和结构安排。 重点突出万吨级乙酸乙酯生产车间设计的创新点和技术特点。 强调论文对于解决实际工程问题的贡献和意义。
02
乙酸乙酯的生产工艺
工艺流程
车间布局设计
平面布置
空间高度
根据生产工艺流程和设备特点,合理规划车 间的平面布局,便于生产操作和设备维护。
根据设备尺寸和操作空间要求,合理确定车 间的高度,确保设备正常运行和作业安全。
物流通道
消防安全
合理设置物料和人员流动通道,避免交叉污 染和人流物流混杂现象。
按照国家消防规范要求,合理设置消防设施 和通道,确保车间消防安全。
对未来工作的展望
进一步优化生产工艺流程,实现生产过程的自动化和 智能化控制,提高生产效率和产品质量。
开展多联产和循环经济模式的研究,将乙酸乙酯生产 与相关产业有机结合,实现资源的最大化利用。
加强绿色生产技术的研究和应用,降低乙酸乙酯生产 过程中的环境污染和资源浪费。
加强国际合作与交流,引进国外先进技术和管理经验 ,提高我国乙酸乙酯生产的国际竞争力。
反应流程
年产10万吨醋酸工艺设计毕业设计

乙酸的晶体结构显,分子间通过氢键结合为二聚体(亦称二缔结物),二聚体也存在于120℃的蒸汽状态。二聚体有较高的稳定性,现在已经通过冰点降低测定分子量法以及X光衍射证明了分子量较小的羧酸如甲酸、乙酸在固态及液态,甚至气态以二聚体形式存在。当乙酸与水溶和的时候,二聚体间的氢键会很快的断裂。其它的羧酸也有类似的二聚现象。
159.8
282.5
43
4.78
4.75
4.79
5.786
表1-1纯醋酸的物理性质[3]
1.3醋酸的化学性质
1.3.1 酸性
2CH3COOH + Na2CO3→2CH3COONa + CO2+ H2O
2CH3ቤተ መጻሕፍቲ ባይዱOOH + Cu(OH)2→(CH3COO)2Cu + 2H2O
CH3COOH + C6H5ONa→C6H5OH (苯酚)+ CH3COONa
中国工业生产合成醋酸同样从发酵法、乙醇—乙醛氧化法及电石乙炔—乙醛氧化路线开始,60年代末全国已形成60kt/a的生产能力. 70年代开始发展乙烯路线,引进了每套年产约7万吨大型装置.轻油氧化制醋酸,天然气制甲醇,低压羰基化制醋酸的工艺路线正积极研究。可以肯定这些将会使我国的醋酸生产出现一个飞跃。
1.2醋酸的物理性质
1.3.3溶剂
液态乙酸是一个亲水(极性)质子化溶剂,与乙醇和水类似。因为介电常数为6.2,它不仅能溶解极性化合物,比如无机盐和糖,也能够溶解非极性化合物,比如油类或一些元素的分子,比如硫和碘。它也能与许多极性或非极性溶剂混合,比如水,氯仿,己烷。乙酸的溶解性和可混合性使其成为了化工中广泛运用的化学品。
年产10万吨醋酸工艺设计
反应工程课程设计说明书年产吨乙酸乙酯的反应器的设计

反应工程课程设计说明书--年产吨乙酸乙酯的反应器的设计目录一设计任务书3二概述6三工艺设计计算71.设计依据72 设计方案 73 设计计算731间歇反应釜的生产计算732连续反应釜的生产计算9 33热量的衡算 12四设备设计与选型171反应釜及夹套的设计计算172搅拌器的设计183夹套式反应釜附属装置的确定21五总结24六参考文献25化学工程与工艺专业《化学反应工程》课程设计任务书一设计项目年产2000学号×100吨乙酸乙酯的反应器的设计二设计条件生产规模5800 吨年生产时间连续生产8000小时年间隙生产6000小时年物料损耗按5计算乙酸的转化率60三反应条件反应在等温下进行反应温度为80℃以少量浓硫酸为催化剂硫酸量为总物料量的1当乙醇过量时其动力学方程为- rA kCA2A为乙酸建议采用配比为乙酸乙醇 15摩尔比反应物料密度为085㎏l反应速度常数k为1500kmolmin 四设计目的和要求通过课程设计要求更加熟悉工程设计基本内容掌握化学反应器设计的主要程序及方法锻炼和提高学生综合运用理论知识和技能的能力独立工作和创新能力概述此次课程设计是结合《化学反应工程》这门课程的内容及特点所进行的一次模拟设计它结合实际进行计算对我们理解理论知识有很大的帮助同时通过做课程设计我们不仅熟练了所给课题的设计计算而且通过分析课题查阅资料方案比较等一系列相关运作让我们对工艺设计有了初步的设计基础在设计过程中解决所遇难题对我们养成独立思考态度严整的工作作风有极大的帮助并为我们以后从事这个行业做好铺垫酯化反应是有机工业中较成熟的一个工艺尽管现在研制出不同的催化剂合成新工艺但设计以硫酸作为催化剂的传统工艺是很有必要的酯化反应器设计的基本要求是满足传质和传热要求因此需要设计搅拌器另外反应器要有足够的机械强度抗腐蚀能力结构要合理便于制造安装和检修经济上要合理设备全寿命期的总投资要少夹套式反应釜具有以下特点1温度容易控制2浓度容易控制3传质和传热良好4设备使用寿命长产品乙酸乙酯简介无色澄清液体有强烈的醚似的气味清灵微带果香的酒香易扩散不持久分子量 8811沸点772℃微溶于水溶于醇醚等多数有机溶剂通过给定设计的主要工艺参数和条件综合系统地应用化工理论及化工计算知识完成对反应釜的工艺设计和设备设计工艺设计计算1 设计依据《乙酸乙酯生产设计任务书》2 设计方案对于乙酸乙酯的生产既可以采用间歇式生产也可以采用连续式生产本次设计将根据自己的生产规模计算对设计方案进行比较得出合理的工艺设计流程3 工艺计算及方案选择31 间歇釜进料com 流量的计算com1 乙酸乙酯的产量化学反应方程式乙酸乙酯的相对分子质量为88所以要求的生产流量为F酯com2 乙酸的流量乙酸采用工业二级品含量98乙酸与乙酸乙酯的物质的量比为11乙酸的转化率物料损失以5计则乙酸的进料量FA0com3 乙醇的流量乙醇与乙酸的摩尔配比为51则乙醇的进料量为F乙醇 5×1966 983kmolhcom4硫酸的流量总物料的质量流量如下计算W总 FAMAF乙M乙W硫酸因硫酸为总流量的1则W硫酸 com 5759即可算其物质的量流量F硫酸5759 98 059com5 总物料量流量F FA0F乙醇 F硫酸 1966 983059 11855 kmolh表1 物料进料量表名称乙酸乙醇浓硫酸流量kmolh 1966 983 059 com 反应体积及反应时间计算当乙醇过量时可视为对乙酸浓度为二级的反应其反应速率方程A为乙酸当反应温度为80℃催化剂为硫酸时反应速率常数k 1500 09m3 kmolh因为乙醇大大过量反应混合物密度视为恒定等于085kgL当乙酸转化率由间歇釜反应有根据经验取非生产时间则反应体积因装料系数为075故实际体积要求每釜体积小于5m3则间歇釜需3个每釜体积V 319 m3圆整取实际体积32 连续性进料的计算com 流量的计算com1 乙酸乙酯的产量化学反应方程式乙酸乙酯的相对分子质量为88所以要求的生产流量为F酯com2 乙酸的流量乙酸采用工业二级品含量98乙酸与乙酸丁酯的物质的量比为11乙酸的转化FA0com3 乙醇的流量乙醇与乙酸的摩尔配比为51则丁醇的进料量为com4硫酸的流量总物料的质量流量如下计算W总 FAMAF乙M乙W硫酸因硫酸为总流量的1则W硫酸 com 4321即可算其物质的量流量F硫酸 432198 044表2 物料进料量表当乙醇过量时可视为对乙酸浓度为二级的反应其反应速率方程A为乙酸当反应温度为80℃催化剂为硫酸时反应速率常数k 15因为乙醇大大过量反应混合物密度视为恒定等于085因硫酸少量忽略其影响对于连续式生产若采用两釜串联系统为定态流动且对恒容系统不变不变若采用两釜等温操作则代数解得所以装料系数为075故实际体积V com 299故采用一条的生产线生产即可即两釜串联反应器的体积V 5com 反应时间连续性反应时间com 设计方案的选择经上述计算可知间歇釜进料需要45m3反应釜3个而连续性进料需2个4m3反应釜根据间歇性和连续性反应特征比较间歇进料需2条生产线连续性需1条生产线虽然间歇生产的检测控制等装备就比连续性生产成本高所耗费的人力物力大于连续生产但该课题年产量少选择间歇生产比连续生产要优越许多故而本次设计将根据两釜串联的的间歇性生产线进行并以此设计其设备和工艺流程图附表3 物料物性参数[1]名称密度80oC 熔点oC 沸点oC 黏度mPas 百分含量乙酸1045 167 118 045 98 乙醇0810 -1141 783 052 98 乙酸乙酯0894 -836 772 025 98表4乙酸规格质量[1]GB1628-79一级二级外观≤铂钴30号透明液体无悬浮物KMnO4试验min ≥50 乙酸含量990 980 甲酸含量015 035 乙醛含量005 010 蒸发残渣002 003 重金属以Pb计00002 00005 铁含量 00002 000054工艺流程图热量核算31工艺流程反应釜的简单工艺流程图32物料衡算物质进料出料乙酸196 784 乙醇983 8414 乙酸乙酯 0 118 水 0 118 根据乙酸的每小时进料量为在根据它的转化率和反应物的初始质量比算出各种物质的进料和出料量具体结果如下表33能量衡算com算总式式中进入反应器的能量化学反应热供给或移走的热量有外界向系统供热为正有系统向外界移去热量为负离开反应器物料的热量com各种物质在不同条件下的值对于气象物质它的气相热容与温度的函数由下面这个公式计算[2]各种液相物质的热容参数如下表[3]液相物质的热容参数物质 A B×102 C×104 D×106 乙醇59342 36358 -1216418030 乙酸-18944 10971 -28921 29275 乙酸乙酯47479 81081 -26421 36081 水92053 -15208 21058 032259 由于乙醇和乙酸乙酯的沸点为785℃和772℃所以乙醇的值同理乙酸乙酯的值3 水的值乙酸的值com象物质的参数如下表气相物质的热容参数[4]物质乙醇4396 0628 5546 -7024-2685 乙酸乙酯10228 -14948 13033 -15736 5999 乙醇的值乙酸乙酯的值com物质在80℃下的焓值1 每摩尔水的焓值同理每摩尔的乙醇的焓值每摩尔乙酸的焓值每摩尔乙酸乙酯的焓值com衡算1的计算470493292的计算-123632143的计算37795777653346384392060426846160425293630084因为即47049329 -12363214 5293630084求得 7123293240故应是外界向系统供热设备设计与选型1.反应釜体及夹套的设计计算11 筒体和封头的几何参数的确定com 筒体和封头的型式选择圆筒体椭圆形封头com 筒体和封头的直径反应物料为液夜相类型由表HDi 10^14 考虑容器不是很大故可取HDi 10 由式Di反应釜内径的估算值应圆整到公称直径DN系列故可取1600 mm 封头取相同内径其直边高度ho由附表12[3] 初选ho 40 mmcom 确定筒体高度H当 Dg 1600 mm ho 25 mm 时由附表12[3]可查得椭圆形封头的容积为 V封 0617 m查得筒体1米高的容积V1米 201 m3≈145m取 H 1450 mm 则 HDi 14501600≈10 选取椭圆封头其公称直径为1600mm曲面高度为400mm直边高度为25mm容积为0587 m3 com 夹套直径高度的确定根据筒体的内径标准经计算查取选取DN 1800的夹套夹套封头也采用椭圆形并与夹套筒体取相同直径夹套高度H2≥式中η为装料系数η 075 代入上式取H2 1100 mm12釜体及夹套厚度的计算com料根据设备的工作条件可选择Q235A作为釜体及夹套材料由附表6[2]查得所选材料许用应力为[σ]100 113 MPa13 设备的壁厚计算com 釜体筒体壁厚计算com 内压设计计算根据工作条件可选取P 02MPa为设计内压根据式10-12[2]筒体的设计厚度≈38mm式中δd 圆筒设计厚度mmDi 圆筒内径 mmP 内压设计压力MPaΦ焊接接头系数考虑到夹套的焊接取08表10-9[2]C2 腐蚀裕量取 2 mm[σ]t材料许用应力[σ]100 113 MPa考虑到钢板负偏差初选C1 06 mm 表10-10[1]所以内压计算筒体壁厚38 06 44mmcom 外压设计计算按承受025MPa 的外压设计设筒体的设计壁厚δ 7 mm 并决定LDo Doδ之值Do筒体外径Do Di 2δd 1600 2×7 1614 mmL 筒体计算长度L H2 h 1400×400 1533 mm h为封头的曲面高度则LDo ≈ 095Doδ≈ 23010-15[2]查得A 000045由图10-17[2]差得 B 65 MPa 则许用外压为[P] 028 MPa>025 MPaδ 7 mm 满足025 MPa 外压稳定要求考虑壁厚附加量 C C1 C2 062 26 mm 后筒体壁厚δn δ C 7 26 96 mm 圆整到标准钢板规格δn 取 10 mm综合外压与内压的设计计算釜体的筒体壁厚为10mm经计算校核满足设备安全要求com 釜体封头壁厚计算按内压计算S封P 02MPaDi 1600mmΦ 08[σ]t 113MpaC 062 26mm代入得 S封 44mm因为釜体的筒体S筒釜 10mmS封头 10mm[P]>PT S封筒 10 mm10-12[] 筒体的设计厚度δd C2 2 ≈ 45 mm考虑到钢板负偏差初选C1 06 mm故夹套筒体的厚度为4506 51mm圆整到标准系列取6 mm经校核设备稳定安全com 夹套封头壁厚设计与选择S封夹S封夹 26 ≈ 51 mmS封夹 6mm12[2]可查取到夹套封头尺寸公称直径1800mm曲面高度400mm直边高度25mmcom 反应釜设计参数表4 夹套反应釜的相关参数项目釜体夹套公称直径DNmm 1600 1800 公称压力PNMPa 02 025 高度mm 1680 1200 筒体壁厚mm 10 6 封头壁厚mm 10 62搅拌器设计21 搅拌器的形式选择根据工作条件由于物料的黏度不大考虑到物料的流动搅拌目的及转速要求选择搅拌器的形式为双叶螺旋桨式桨叶直径为800 mmcom 搅拌器转速n根据相关的工艺经验数据选择n 100 rpmcom 传动功率P搅拌的雷诺数Re则KT可查取表3-9[1]com 电机功率本设计中考虑传动效率为90则P电 P09 1309 144KWBLD15-2-29Q型减速器其出轴转速为100rpm适用com 电动机的选择选用电动机的型号为JO2-22-122搅拌轴直径的设计计算com 搅拌轴材料选用Q235-A选取其[τ] 16MPa [τ]为轴材料的许用切应力单位MPa对于Q235-A取12~20MPa圆整取d 40 mmcom 搅拌轴刚度计算式中[θ]为轴的许用扭转角°m 对于一般的传动可取05~10 °m 07经计算比较轴径为40mm 满足强度刚度要求故选择搅拌轴径为40 mm3夹套式反应釜附属装置的确定支座的选定以下参考书[3]com釜需外加保温故选B型悬挂式支座com 反应釜总重 Q Q1 Q2 Q3 Q4式中Q1筒体与夹套筒体总重Q2封头与夹套封头总重Q3料液重按水压试验时充满水计Q4附件重人孔重900N其它接管和保温层按1000N计故Q Q1 Q2 Q3 Q4 12357 4690 53057 1900 72004N按两个支座承载计每个支座承载36002N由表11-6[2] 选支座B4 JBT 4735-9232 人孔C选用长圆型回转盖快开人孔人孔PN06400×300 JB 579-79-133 接管及其法兰选择com 水蒸气进口管φ108×4L 200mm10号钢法兰PN06 DN100 HG 20592-97com 冷却水出口管φ57×35L 150 mm无缝钢管法兰PN06 DN50 HG 20592-97com 进料管com 1乙酸进料管管径根据管子规格圆整选用的无缝钢管L 150mm法兰PN025 DN25 HG 20592-97com2乙醇醇进料管管径根据管子规格圆整选用的无缝钢管L 200mm 法兰PN025 DN50 HG 20592-97com3 浓硫酸进料管管径根据管子规格圆整选用的无缝钢管L 100mm法兰PN025 DN10 HG 20592-97com 出料管出料总质量流量因密度则体积流量为由表1-1[4]得因进料黏度低选取管道中流速则管径根据规格选取φ57×35的无缝钢管法兰PN06 DN50 HG 20592-97com 温度计接管φ45×25L 100mm无缝钢管法兰PN025 DN40 HG 20592-97com 不凝气体排出管φ32×35L 100 mm无缝钢管法兰PN06 DN25 HG 20592-97com 压料管φ57×35L 200 mm无缝钢管法兰PN025 DN50 HG 20592-97com 压料管套管φ108×4L 200 mm10号钢法兰PN025 DN100 HG 20592-97总结经过接近两周的努力课程设计终于完成了在此我首先要感谢给予我很多帮助的指导教师作为一名化工系大三的学生我觉得能做这样的课程设计是十分有意义的在已度过的三年大学生活里我们大多数接触的是专业基础课我们在课堂上掌握的仅仅是专业基础课的理论面如何去面对现实中的各种化工工艺的设计如何把我们所学到的专业基础理论知识用到实践中去呢我想做类似的大作业就为我们提供了良好的实践平台在做本次课程设计的过程中我感触最深的当属查阅了很多次设计书和指导书为了让自己的设计更加完善更加符合工程标准一次次翻阅化工原理设计书是十分必要的同时也是必不可少的我们做的是课程设计而不是艺术家的设计艺术家可以抛开实际尽情在幻想的世界里翱翔我们是工程师一切都要有据可依有理可寻不切实际的构想永远只能是构想永远无法升级为设计在这个过程中我学到了很多知识CAD作图查阅文献资料word排版等这对我们的以后的发展更为有益比如为即将面临的毕业论文考研或毕业后的工作打下坚实的基础对于那些在设计过程中帮助过我的所有老师和同学我再一次的表示深深的感谢参考文献[1]陈国桓主编.《化工机械基础》.第二版化学工业出版社2007[2]陈甘棠主编.《化学反应工程》.第三版.化学工业出版社2009[3]柴诚敬主编.《化工原理》.修订版高等教育出版社2005[4]《实用化学手册》.科学出版社[5]周大军揭嘉主编《化工工艺制图》化学工业出版社2005[6]印永嘉等主编.《物理化学简明教程》第四版.高等教育出版社2007。
乙酸乙酯酯化法毕业设计摘要精选

乙酸乙酯酯化法毕业设计摘要精选乙酸乙酯是无色透明液体,低毒性,有甜味,浓度较高时有刺激性气味,易挥发,对空气敏感,能吸水分,使其缓慢水解而呈酸性反应。
易燃。
蒸气能与空气形成爆炸性混合物。
以下是我们为你整理的乙酸乙酯酯化法毕业设计摘要,希望能帮助你毕业设计摘要的写作。
乙酸乙酯是一种非常重要的化工原料与低毒性绿色溶剂,广泛应用于涂料、染织、香料等领域。
乙醇乙酸酯化法是国内最主要的合成乙酸乙酯方法,该方法能间接利用生物资源,因此随着石化资源日渐减少,乙醇乙酸酯化法有着不错的发展前景。
由于酯化反应为可逆反应,因此引入精馏,与反应耦合构成反应精馏,利用反应精馏技术,来改进目前已经工业化的乙酸乙酯生产工艺是近年来研究热点。
本文考虑到传统酯化反应催化剂浓硫酸对设备的强腐蚀性,从考虑改善催化剂入手,选择了具有较高催化活性同时也对普通不锈钢材有良好缓蚀作用的杂多酸磷钨酸作为新型催化剂,解决了催化和设备腐蚀问题。
鉴于磷钨酸催化合成乙酸乙酯反应动力学的定量研究尚未见报道,这也使得评估其工业化价值非常困难。
本文通过大量实验定量测得了常压下在333、15K-378。
15K温度范围内磷钨酸催化乙酸与乙醇酯化反应的反应速率常数,并整理归纳导出了动力学方程和动力学参数的定量表达式,为磷钨酸催化剂应用于乙酸乙酯的工业化生产特别是反应精馏塔中的反应速率进行定量计算提供依据。
本文研究表明:在磷钨酸催化下,乙醇和乙酸合成乙酸乙酯的酯化反应为二级反应,反应速率常数可用Arrheniu方程描述,不仅与温度有关,而且受催化剂磷钨酸浓度影响。
在本文所研究的温度和催化剂浓度范围内,活化能和指前因子均随催化剂浓度增大而增大,指前因子κ0=ep(-4、23247+3、27731HPWu),活化能Ea、R=53、56093ep(HPWu、0。
39354)+5160。
65301、由于反应活化能随催化剂浓度变化的幅度不大,取不同催化剂磷钨酸浓度下得到的活化能均值作简化,可以得到反应活化能Ea为45、52KJmol-1,指前因子κ0=(0。
年产3万吨乙酸乙酯_毕业设计说明书

1 绪论1.1 乙酸乙酯概述1.1.1 乙酸乙酯的简介乙酸乙酯(EA),又名醋酸乙酯,英文名称:Ethyl acetate。
分子式为:C2H8O4。
它是一种无色透明具有流动性并且是易挥发的可燃性液体[1],呈强烈清凉菠萝香气和葡萄酒香味。
乙酸乙酯能很好的溶于乙醇、氯仿、乙醚、甘油、丙二醇、和大多数非挥发性油等有机溶剂中,稍溶于水(25℃时,1mL乙酸乙酯可溶于10mL水中),而且在碱性溶液中易水解成乙酸和乙醇。
水分能使其缓慢分解而呈酸性。
乙酸乙酯与水和乙醇皆能形成二元共沸混合物,与水形成的共沸混合物沸点为70.4℃,其中含水量为6.1%(质量分数)。
与乙醇形成的共沸混合物的沸点为71.8℃。
还与7.8%的水和9.0%的乙醇形成三元共沸混合物,其沸点为70.2℃。
下表为乙酸乙酯的一些物化参数。
表1.1 乙酸乙酯的物化参数[2]熔点(℃) -83.6 临界温度(℃) 250.1折光率(20℃) 1.3708-1.373临界压力(MPa) 3.83沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5 燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.0 室温下的分子偶极距 6.555×10-301.1.2 乙酸乙酯的用途乙酸乙酯是重要的精细化工原料。
它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的生产中,或作为原料、或作为工艺溶剂、萃取剂、稀释剂等等;由于它具有天然水果香味,因此还可作为调香剂组分,应用于香料、食品工业中;也可作为粘合剂用于印刷油墨、人造珍珠等的生产;作为提取剂用于医药、有机酸的产品的生产等;此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料。
年产10万吨乙酸乙酯毕业设计说明书

年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。
产万吨乙酸乙酯生产车间的设计论文pptx

03
生产车间设计
生产车间总体布局设计
车间类型
根据生产任务和规模,设计为单 层钢结构厂房,面积约10000平 方米。
布局原则
按照工艺流程和安全规范进行布 局,确保物料流通顺畅,操作安 全便捷。
区域划分
将车间划分为原料区、反应区、 分离区、产品储存区、办公区等 ,各区域相对独立,互不干扰。
2023
产万吨乙酸乙酯生产车间 的设计论文
目录
• 引言 • 乙酸乙酯生产工艺流程 • 生产车间设计 • 环境保护和安全措施 • 经济效益分析 • 结论与展望 • 参考文献
01
引言
研究背景和意义
乙酸乙酯是一种重要的有机化工原料,广泛应用于涂料、溶 剂、食品添加剂等领域,市场需求量大,生产车间设计具有 现实意义。
评价指标
选取投资回报率、净利润率、毛利率等财务指标 作为评价标准。
评价方法
采用静态和动态分析方法,综合评估项目的经济 效益。
结论
根据评价结果,得出项目是否具有经济可行性和 投资价值的结论。
06
结论与展望
研究结论
工艺流程优化
通过对比传统工艺流程,本研究提出了更加高效、环保的工艺流程,能够实现万吨级乙酸 乙酯生产的高产、低耗。
辅助设施
设计化验室、控制室、仓库等辅助设施,满足生 产过程中的检测、控制和物料储存需求。
安全设施
设计消防设施、安全出口、应急照明等安全设施 ,确保车间的安全运行和员工的生命财产安全。
04
环境保护和安全措施
废水处理方案
废水来源
详细描述了生产过程中产生废水的环节和主要来源。
产3万吨乙酸乙酯毕业设计说明

(1)乙酸/乙醇酯化法
有机羧酸与醇类在无机强酸催化作用下发生酯化作用生成酯类,这是有机羧酸
的主要性质之一,乙酸乙酯即是由乙酸、95%浓度的乙醇和 96%浓度硫酸(加料量
的 1%)催化剂参与下进行酯化反应制得的。这个反应是可逆的,将乙醇过量以及
有效移除反应产生的水,可以提高乙酸乙酯的产得率,通常反应的平衡转化率为
引燃温度
3.04
(℃)
426
饱和蒸气 压(kPa)
13.33(27℃)
爆炸上 限%(V/V)
11.5
燃烧热 (kJ/mol)
2244.2
爆炸下 限%(V/V) 2.0
室温下的
分子偶极 6.555×10-30
距
1.1.2 乙酸乙酯的用途 乙酸乙酯是重要的精细化工原料。它是一种具有优异溶解性能和快干性能的溶
第 6 页 共 75 页
到金融危机的影响,但是由于 2007 年新增的产能发挥作用,产能仍达到约 95.0 万 吨/年,同比增长约 33.8%。表 1.4 为我国近年来乙酸乙酯的供需关系。
目前,国内乙酸乙酯主要消费地区集中在华东、中南、华北、东北地区,产品 主要用于生产涂料、制药和粘合剂。我国乙酸乙酯的总需求量已达 150 万吨/年, 供大于求,届时消费结构将有所变化,其中在制药和粘合剂行业消费的比例将会有 所下降,随着新型高档涂料的不断发展,预计涂料行业对乙酸乙酯的需求量将会有 较大幅度的增加,随着油墨方面的需求量也将有所上升。
2CH3CHO
CH3COOC2H5
乙醇铝会在反应过程中被破坏,因此为使反应连续进行,须配备足够的催化剂
来维持反应的进行;在低温反应条件下,乙酸乙酯的收率可达 98%。
乙醛缩合法具有反应条件温和、原料消耗少、工艺简单、设备腐蚀小等特点, 因而此工艺在生产成本方面具有突出优势,同时又有较好的环境效益,发达国家多 采用这种工艺。
年产万吨乙酸乙酯毕业设计说明书

年产万吨乙酸乙酯毕业设计说明书集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]1绪论乙酸乙酯概述1.1.1 乙酸乙酯的简介乙酸乙酯(EA),又名醋酸乙酯,英文名称:Ethyl acetate。
分子式为:C 2H8O4。
它是一种无色透明具有流动性并且是易挥发的可燃性液体[1],呈强烈清凉菠萝香气和葡萄酒香味。
乙酸乙酯能很好的溶于乙醇、氯仿、乙醚、甘油、丙二醇、和大多数非挥发性油等有机溶剂中,稍溶于水(25℃时,1mL乙酸乙酯可溶于10mL 水中),而且在碱性溶液中易水解成乙酸和乙醇。
水分能使其缓慢分解而呈酸性。
乙酸乙酯与水和乙醇皆能形成二元共沸混合物,与水形成的共沸混合物沸点为70.4℃,其中含水量为%(质量分数)。
与乙醇形成的共沸混合物的沸点为71.8℃。
还与%的水和%的乙醇形成三元共沸混合物,其沸点为70.2℃。
下表为乙酸乙酯的一些物化参数。
表乙酸乙酯的物化参数[2]熔点(℃)临界温度(℃)折光率(20℃)临界压力(MPa)沸点(℃)辛醇/水分配系数的对数值对密度(水=1)闪点(℃)相对蒸气密度(空气=1)引燃温度(℃)426饱和蒸气压(kPa)(27℃)爆炸上限%(V/V)燃烧热(kJ/mol)爆炸下限%(V/V)室温下的分子偶极距×10-301.1.2 乙酸乙酯的用途乙酸乙酯是重要的精细化工原料。
它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的生产中,或作为原料、或作为工艺溶剂、萃取剂、稀释剂等等;由于它具有天然水果香味,因此还可作为调香剂组分,应用于香料、食品工业中;也可作为粘合剂用于印刷油墨、人造珍珠等的生产;作为提取剂用于医药、有机酸的产品的生产等;此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料。
国外乙酸乙酯的消费结构与我国有所不同,美国和欧洲国家乙酸乙酯最大的应用领域是涂料,其中美国涂料方面的消费量约占总消费量的60%,欧洲在涂料行业的消费量约占总消费量的50%。
0 工艺设计说明

一、工艺设计依据本设计的主要灵感主要来源于:中科院兰州化学物理研究所《担载纳米金催化乙醇选择氧化制乙酸乙酯》、浙江工商大学膜科学与工程研究所《渗透汽化在酯水体系分离中的应用》和南京工业大学《生物质发酵与膜渗透汽化制备无水乙醇的方法》等相关科研成果。
二、生物质发酵制备乙醇工艺设计1.工艺概述在本设计方案中采用生物质发酵与膜渗透汽化制备高纯度乙醇,采用生物质发酵与渗透汽化(PV)、蒸汽渗透(VP)技术集成制备乙醇。
将发酵罐中含低浓度乙醇的发酵液抽出,通过微滤膜、透醇膜使乙醇透过增浓到含乙醇40~95wt%,然后送入无机透水膜分离器渗透脱除剩余水,最终达到≥99.5wt%的无水乙醇产品2.流程简述将原料液置于发酵罐内,在一定温度下水解反应,将发酵罐内含乙醇3~20wt%的发酵液通过泵抽出,通过无机微滤膜反应器,将微滤膜的透过液加热至40-70度,然后输入到无机透醇膜分离器,透醇膜的透过侧保持真空度1-5mm汞柱,乙醇经透醇膜渗透汽化后增浓到40-65wt%,将该增浓的乙醇液加热到70-90度,送入精馏塔进行蒸馏,塔顶蒸馏出气体的乙醇含量为90—95wt%,经透水膜分离器预热后进入透水膜分离器,透水膜的透过侧保持真空度1-5mm汞柱,使所含的水蒸气渗透除去,将未透过的气体冷凝收集的≥99.5wt%无水乙醇。
上述无机微滤膜分离器流出的未透过液、透醇膜分离器流出的未透过液、透水膜分离器流出的透过液返回发酵罐继续参与水解反应。
3.工艺特色本方案将乙醇发酵与无机膜渗透汽化、蒸汽渗透技术耦合,降低发酵过程中乙醇的抑制作用,在连续制备时可大大提高生物反应器的生产能力,而采用渗透汽化生产无水乙醇,可以降低能耗50%左右,大大降低了乙醇的生产成本。
同时,该方案解决了利用生物质原料制备无水乙醇的核心问题:生物反应器的生产能力和乙醇提纯的能耗问题。
与现有工艺相比,产品转化率高,操作方便,生产总能耗小。
三、乙醇一步法制备乙酸乙酯工艺设计1.工艺概述经过预处理的乙醇和空气进反应器中反应,得到乙酸乙酯、水、乙醇和乙酸的混合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。
1.2 乙酸乙酯的产能和市场需求1.2.1 世界乙酸乙酯的产能与消费情况日前乙酸乙酯的生产与消耗主聚集在欧美和亚洲地区,这其中亚洲地区的生产和消费又主要集中在日本,中国及东南亚国家[4]。
近年来,国际乙酸乙酯的生产能力持续上涨。
2001年全世界乙酸乙酯的生产能力仅有125.0万吨/年,2006年生产能力增加到222.0万吨/年,2001~2006年生产能力的年均增长率高达惊人的12.2%。
尤其是英国的BP化学公司是目前世界上最大的乙酸乙酯生产厂家,生产能力为22.0万吨/年,约占全世界总生产能力的9.91%。
还有中国江苏索普集团公司,生产能力为20.0万吨/年,约占9.01%。
表2为国外乙酸乙酯的生产情况。
在涂料方面,乙酸乙酯涂料被水性和高固含量涂料、粉末涂料和双组分涂料抢占了市场额;尽管这种变化还在继续,但乙酸乙酯市场仍旧保有实力,特别指出东南亚地区慢慢成为全球最重要的乙酸乙酯的产地和消费地,所以越来越多的资金开始投向亚洲和中国。
1.2.2 中国乙酸乙酯的生产消费状况(1)生产状况根据资料记载,中国的乙酸乙酯的发展史应从20世纪50年代算起。
随着工业化的进程,乙酸乙酯的前景可观。
特别指出集中于华南和华东地区的厂家就要20多家。
国内最大的乙酸乙酯生产企业江苏索普集团产能达到20.0万吨/年,约占国内总生产能力的22.2%,80%的乙酸乙酯用于出口;第二是山东金沂蒙集团公司,生产能力为16.0万吨/年,约占国内总生产能力的13.3%,主要原料乙酸、乙醇均能自给。
(2)乙酸乙酯的消费状况与发展前景随着生产能力的提升,生产量的增加,即使2008年金融危机也不能影响国内乙酸乙酯的需求,表4为我国近年来乙酸乙酯的供需关系。
乙酸乙酯的消费大部分在工业发达地区,主要用途是生产涂料、制药和粘合剂,各方面的需要已达到150.0万吨/年,近年来随着新型工业的发展,乙酸乙酯的诉求量还会持续上升。
随着乙酸乙酯用途的不断开发,将会使乙酸乙酯在其他方面用量的比例也有一定的增加。
1.3 本课题研究的目的、意义和内容1.3.1 本课题研究的目的和意义乙酸乙酯有着它本身的有点,普遍用于人造香精、清漆、涂料、药物和有机酸的萃取溶剂等的原料。
随着世界科学技术的发展,汽车业、药物、涂料等的大量使用,更是带动乙酸乙酯工业的飞速发展。
但国内有65%以上的生产厂家采用相对落后的酯化法生产乙酸乙酯,为了防止国外技术垄断,本课题采用缩醛法生产10万吨乙酸乙酯,希望这套具有先进、可行、经济效益高的设计方案可以帮助国内改进技术,满足需求。
1.3.2 本课题研究的内容(1)选择原材料和制备工艺合理生产,采用先进的生产设备及控制手段,该提案的制备(工艺流程图,该报告的标题);(2)在原材料的基础上,产品和生产规模,绘制流程草图,和物料平衡和热平衡(物料平衡图,原材料消耗,能源消耗计);(3)对主体设备和辅助设备的工艺计算与设备选型,并列出设备一览表;(4)绘制主体设备图;(5)绘制带控制点的工艺流程图;(6)车间布局设计(车间平面布置图、立面布置图);(7)进行技术分析、经济效益分析、安全评价与环保评价。
2. 乙酸乙酯的生产工艺流程比较与确定2.1 乙酸乙酯的主要生产工艺目前,乙酸乙酯的工业生产方式主要有乙酸和乙醇酯化法、乙醛缩合法、乙醇脱氢法和乙酸跟乙烯加成4种。
最原始的乙酸酯化法工艺在国外被逐渐废除,因此大规模生产装置主要采用乙醛缩合法、乙醇脱氢法和乙酸跟乙烯加成法,其中新建装置多采用乙酸跟乙烯的加成法,我国的乙酸乙酯则主要采用乙酸酯化法进行生产[8]。
下面主要介绍两种乙酸乙酯的工业生产方法。
(1)乙酸/乙醇酯化法有机羧酸的主要性质之一是:有机羧酸与醇类在无机强酸催化下发生酯化作用生成酯类,乙酸乙酯便是由乙酸、95%浓度的乙醇和96%浓度硫酸(加料量的1%)催化剂作用下进行酯化反应制得的,这个反应是可逆的,通过控制乙醇的加入量,排除生成的水,可以提高乙酸乙酯的转化率,一般情况下,反应平衡时的转化率为67%。
CH3COOH+CH 3CH 2OHCH 3COOC 2H 5浓硫酸+H 2O工业生产的规模决定了需要选取的原料及设备,上述反应选取浓硫酸为催化剂,有其酸性强、吸水性好、易控制、价格低的优点;也必不可少的要接受浓硫酸对设备的腐蚀,容易引起磺化、炭化和聚合等的副反应,且产物纯度有所降低,后续工作较难处理的缺陷。
(2)乙醛缩合法通过查阅资料可知;醛类在醇盐的催化作用下,可以自身缩合为酯类,如下面:CH 3CHOCH 3COOC 2H 52由于浓硫酸的存在,所加的醇盐会被破坏,因此为了反应的持续进行,为了产物的最大产出,必须要确保足够量的醇盐,而且温度要低。
通过实验表明乙醛缩合法有反应温度较低、原料耗费少、设备腐蚀程度小、工艺流程简单等的优点,是很多发达国家青睐的生产方式。
但是乙醛缩合法的原料限制较大,所以选择在原料充分的地区比较实用。
从一圈的来源来说,第一是从石油中获得,第二是生物合成,石油的急剧减少使得自然地方式不太适用,所以生物合成成了生产乙醛的主要途径,考虑到我国的生物生产技术比较先进,所以乙醛缩合法又是一项节能的绿色工程。
2.2 设计方案的确定目前在世界范围内,上述四种工艺都已经投入运行,但在国内投入运行的只有酯化法、乙醛缩合法、乙醇脱氢法,乙酸/乙烯加成法在国内还不够成熟。
酯化法中新研究出的催化剂造价过高,乙醇脱氢法适合在乙醇产量高的地区或者是价格廉价的地区较合适,日本所有的乙酸乙酯都是采用乙醛缩合法,并且综合上面的概述中几种工艺的对比,本课题采用乙醛缩合法生产乙酸乙酯。
2.3 乙醛缩合法生产工艺2.3.1反应原理采用乙醛缩合法制备乙酸乙酯主要由以下三个阶段:(1)乙醛的缩合反应本设计中,两个串联反应釜提供了反应场所,反应式为:CH3CHO Al(OC2H5)3CH3COOC2H5通过实验可以知道,在第一个釜式反应器中反应放出大量的热;而釜式反应器恰好有热量转移容易的特点,比管式反应器易控温,安全性高;第二个采用釜式反应器是考虑到后来温度下降,且造价低廉。
(2)催化剂的脱除可用加水的方法破坏掉催化剂,而后经由蒸发器将粗乙酸乙酯蒸出,氢氧化铝残液从下面排除,残液再经过一个分离器进一步分离出氢氧化铝,液体部分可以再返回蒸发器(3)精馏提纯可以用一塔脱乙醛;二塔脱乙醇,脱出的乙醇用作生产催化剂;三塔上得到产品,塔下出重组分的三塔模式。
还可以巧妙地设计一个小塔,作用是分离三塔得到的重组分,有效的分离较纯副产物乙缩醛,做到循环利用。
2.3.2 工艺流程如下为乙醛缩合法合成乙酸乙酯各个工序的简述。
图4为乙醛缩合法生产乙酸乙酸工艺流程简图。
用乙醇铝作催化剂,乙醛通过自缩合反应生成乙酸乙酯,向单效蒸发器中加入过量的水,将催化剂乙醇铝破坏,再经过蒸发器将生成的氢氧化铝脱除。
再依次通过脱乙醛精馏塔、脱乙醇粗馏塔和脱重组分塔,分开脱除粗乙酯中的乙醛、乙醇和乙缩醛,在脱重组分精馏塔塔顶得到较纯净的乙酸乙酯产物。
图1 乙醛缩合法生产乙酸乙酸工艺流程简图3 物料衡算3.1数据采集3.1.1全流程的工艺数据(1)生产规模年产10万吨乙酸乙酯(2)生产时间年工作时间为8000个小时(3)生产效率一步缩合反应釜中乙醛转化率为85.4%,二步缩合反应釜中乙醛的转化率为88.3%,在两个釜中主反应的选择性都为99%。
3.1.2 操作条件(1)操作压力:全流程的操作为常压操作(2)操作温度:一步反应缩合反应的反应器和两步反应温度,反应器的操作温度为10℃。
单效蒸发器的操作温度为90℃。
脱乙醛塔塔顶温度和塔底温度为:26.2℃和77.2℃。
脱乙醇塔塔顶温度和塔底温度为:76.3℃和78.2℃。
脱重组分塔塔顶温度和塔底温度为:83℃和110℃。
3.1.3 原料和产品的控制指标表2原料乙醛和产品乙酸乙酯的标准项 目优 等 品 指 标乙酸乙酯 乙醛 纯度/% 99.7 99.7 水分/% 0.3 0.03 乙醇含量0.1在乙醛进料前进行干燥,干燥后的乙醛纯度为99.9%。
3.2 一步缩合反应釜的物量衡算本次设计为连续操作,因此以单位kg/h 为基准。
纯净乙酸乙酯在脱重组分出口量应为:W =h kg /5.124628000997.010107=⨯⨯。
则需乙醛进料(纯度为0.999): h kg WF /97.12474999.0==。
因反应过程中有损失,将乙醛的入口流量定为12500kg/h 。
图2 一步缩合物料平衡简图201.0中含有:乙醛:kg/h 5.124870.99912500=⨯ 水:kg/h 5.120.999)-(112500=⨯ 201.1中含有:催化剂用量为 :h kg /5.15628999.05.12487=÷则催化剂原料中含:乙酯:h kg /12501751405.1562=⨯ 302.1201.1201.2201.0R201铝:h kg /64.4417555.1562=⨯ 乙醇:h kg /250175285.1562=⨯氯化铝:h kg /86.1717525.1562=⨯ 乙醇和铝在催化剂的作用下生成乙醇铝:↑−→−223233H +O)CH 2Al(CH OH CH 6CH +2Al53.96 276.36 324.32 44.64*0.98 224.05 262.93201.1物流中需加入60kg/h 的乙醇来保护催化剂中的乙醇铝,防止其水解失效。
