第12章 萃取
第12章第59讲无机化工流程题的解题策略2025年高考化学一轮复习讲义(新人教版)

第59讲无机化工流程题的解题策略[复习目标] 1.提升应用物质的转化及条件控制、分离提纯操作等相关知识解决实际问题的能力。
2.树立“绿色化学”的观念,形成资源综合利用、物能充分利用的意识。
1.常考无机化工流程的呈现形式2.读图要领(1)箭头:进入的是投料(反应物),出去的是含产品中元素的物质(流程方向)、副产物或杂质(支线方向)。
(2)三线:出线和进线均表示物料流向或操作流程,可逆线表示物质循环。
3.流程图中主要环节的分析(1)原料的预处理①溶解:通常用酸溶,如用硫酸、盐酸等。
水浸与水接触发生反应或溶解浸出固体加水(酸)溶解得到离子酸浸在酸溶液中反应,使可溶性金属离子进入溶液,不溶物通过过滤除去浸出率固体溶解后,离子在溶液中的含量的多少②灼烧、焙烧、煅烧:改变结构,使一些物质能溶解,并使一些杂质在高温下氧化、分解。
③审题时要“瞻前顾后”,注意物质性质及反应原理的前后联系。
(2)核心反应——陌生方程式的书写①氧化还原反应:熟练应用氧化还原反应规律判断产物,并根据化合价升降相等配平。
②非氧化还原反应:结合物质性质和反应实际判断产物。
(3)常用的分离方法①过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
②萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
③蒸发结晶:提取溶解度随温度变化不大的溶质,如从溶液中提取NaCl。
④冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
⑤蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
⑥冷却法:利用气体液化的特点分离气体,如合成氨工业采用冷却法分离平衡混合气体中的NH3。
一、调控化学反应速率提高效率1.向铬铁矿(FeCr2O4)中通入O2进行焙烧,焙烧时气体与矿料逆流而行,目的是___________。
第12章 反应分离技术

与传统的固相萃取技术相比,免疫亲和柱可在适当的缓冲液冲洗后再生
重复使用。
免疫亲和色谱技术的要点
抗体的制备
抗体作为固定相的配体,直接影响目标测定物的特异性亲和力, 是IAC建立的关键因素
制成IAC基体
基体的基本要求 低效基体,不能在HPLC系统使用 开发新型基体材料,高效能+机械稳定性,能在HPLC系统使用
抗体与基体的偶联
活化 偶联方式:随机偶联与定向偶联
洗脱方式
冲洗液 洗脱液(酸性,碘化钠,有机改性剂,降低K) 抗体再生
单抗制备复杂,成本高,但也具有很多优点。
单抗问世后, 不少生物技术公司在研制适宜于培养杂 交瘤细胞的生物反应器及其培养基。这些大规模生 产单抗技术的建立和不断完善, 将降低免疫亲和色谱 吸附剂的价格。
混合蛋白 样品
平衡液
带有配体的树 脂珠或胶粒
含配体溶液
洗下未结合的蛋白
收集目的蛋白
免疫亲和色谱的原理
利用抗原与抗体的高亲和力、高专一性和 可逆结合的特点以及色谱技术的差速迁移理 论而建立的一种新型色谱技术。
就是将被测物的特异性抗体固定在适当的固相载 体上,制备成免疫亲和色谱的固定相(免疫亲和色 谱柱),根据被测物的反应原性、抗原抗体结合的 特异性记忆,抗原抗体复合物在一定条件下能够可 逆解离的特性进行色谱分离。
中药中的黄曲霉毒素
实际检测中常与HPLC、质谱、荧光分光方 法联合使用
思考题
在离子交换色谱操作中,怎样选择离子交 换树脂?
离子交换分离的一般流程 举例说明离子交换树脂在天然产物分离中
的应用 免疫Βιβλιοθήκη 和色谱原理,特点,要点生物工业中最常用的交换剂为离子交换树脂。 几乎所有的生物大分子都是极性的,都可使其带 电,所以离子交换法已广泛用于生物大分子的分离 纯化。
各章问答题

化工原理各章问答题第1章流体流动1. 什么是流体稳定流动,什么是流体流动的连续性方程,它是如何得到的,能够解决什么问题?2. 什么叫化工单元操作?常用的化工单元操作有哪些?3. 在相同管径的两条园形管道中,同时分别流动着油和清水(μ油>μ水),若雷诺数相同,且密度相近,试判断油速大还是水速大?为什么?4. 何谓层流流动?何谓湍流流动?用什么量来区分它们?5. 输送相同体积的水和油,哪一种能耗较大,为什么?6. 何为等压面,构成等压面的条件是什么?7. 流体流动阻力有几种表现形式,产生阻力的主要原因是什么?应分别如何计算?8. 一定量的液体在园形直管内作稳定连续滞流流动。
若管长及液体的物性不变,而管径减至原来的一半,问因流动阻力而产生的能量损失为原来的若干倍?9. 何为绝对压力、表压力、真空度,它们的关系为何?10.何为流体静力学基本方程,其适用的条件是什么,由流体静力学基本方程可以得到什么结论?11.何为机械能衡算方程,应用时应注意什么?12.何为牛顿粘性定律,何为粘度,其意义为何,温度对粘度如何影响?13.试根据莫狄磨擦系数图的4个区域,讨论各个区域影响磨擦系数的因素14.根据流体力学原理(柏努利方程)制作的几种流量计有哪几种?第2章流体输送机械1. 离心泵起动时,为什么要把出口阀关闭?2. 离心泵为什么会出现气蚀现象?3. 何谓离心泵的“气缚”和“气蚀”现象,它们对泵的操作有何危害?应如何防止?4. 原用以输送水的离心泵,现改用来输送相对密度为1.2的水溶液(而其粘度与水相近)。
若管路布局不变,泵的前后两个开口容器液面间的垂直距离不变,试说明泵的流量、扬程、出口处压力表的读数和轴功率有何变化?5. 何为离心泵的性能曲线,它们是在什么条件下绘制得到的?6. 现想测定某一离心泵的性能曲线,将此泵装在不同的管路上进行测试时,所得性能曲线是否一样?为什么?7. 当离心泵启动后不吸液,其原因主要有哪些?8. 按图写出离心泵开泵及停泵操作程序。
5_挥发油-简答题1201~1211

题目编号: 1201
5
简答题
节
教材名称
页码
天然药物化学
难度系数:
作者
徐丽萍
第 12 章
B (A B C 三级,A 简单,C 最难)
题目:挥发油的哪些性质可用于挥发油的检识?
答案:可用于挥发油检识的性质有:挥发性、气味、物理常数(如比重、比旋度、折光率等) 、化学常数(酸值、 酯值、皂化值)及化学官能团的颜色反应或沉淀反应。 答案关键词:挥发油,检识
B (A B C 三级,A 简单,C 最难)
题目:在减压(1.333KPa)的条件下,采用分馏法分离挥发油时,通常按照温度的不同,可分为几个馏份?各馏 份可能含有哪些类型的成分?
答案: 通常分为三个馏份。各馏份及所含成分为: 1.低沸程馏份(35℃~70℃/1.333KPa) :可能含有单萜烯类化合物。 2.中沸程馏份(70℃~100℃/1.333KPa) :可能含有单萜含氧衍生物,如醇、酚、醛、酮、酯等。 3.高沸程馏份(100℃~140℃/1.333KPa) :可能含有倍半萜及其含氧衍生物和薁类化合物。
答案关键词:丁香,丁香酚,提取分离,原理
题目编号: 1209
第 12 章
节
页码
难度系数:
C (A B C 三级,A 简单,C 最难)
题目:用于提取挥发油的溶剂应具有什么特点?为什么?
答案: 用于提取挥发油的溶剂应为低沸点亲脂性的有机溶剂。这是由于挥发油具有亲脂性和挥发性的特点,选 用低沸点亲脂性的有机溶剂,既保证挥发油可溶于提取溶剂,又可避免回收溶剂时损失挥发油。 答案关键词:挥发油,提取,溶剂,低沸点,亲脂性
编号方法:题目编号按章编号:章号在前占 2 位,共用四位数。如简答题第十一章第二题: 1102 答题卡请同时提供电子版文档,如果某种类型题没有,就不用填该类型卡。如果提供卡中有没有所须类型,可仿照设计
12章 磺化反应

OH + HO3S
OH
↓+
KO3S
OH
↓
SO3Na
OH SO3H OH SO3K
(3)中和盐析法 稀释后的磺化物用亚硫酸钠、氢氧化钠、碳酸钠、氨水等碱性物 质中和,利用中和生成的硫酸钠、硫酸铵或硫酸镁使磺酸以钠盐、 铵盐、或镁盐的形式盐析出来。
(4)脱硫酸钙法
2ArSO3H + Ca(OH)2 → (ArSO3)2Ca + H2O H2SO4 + Ca(OH)2 → CaSO4↓+2H2O
磺化
+ H2SO4
+ H2O
SO3H
磺化是磺基(或磺酰卤基)中的硫原子与有机分子 中的碳原子相连接形成C—S键的反应,得到的产物 为磺酸化合物(RSO2OH或ArSO2OH); 硫酸化是硫原子与氧原子相连形成O—S键的反应, 得到的产物为硫酸烷酯(ROSO2OH)。
12.1.2 磺化目的及应用
芳香族 化合物
亲电取代
过量硫酸磺化法(液相磺化法,H2SO4) 共沸去水磺化法(气相磺化法, H2SO4) 三氧化硫磺化(SO3) 氯磺酸磺化(ClSO3H) 芳伯胺烘焙磺化法
置换磺化(亚硫酸盐法)
脂肪族 化合物
氧磺化(SO2+O2) 游离基反应 氯磺化(SO2+Cl2) 加成磺化(NaHSO3) 置换磺化
合成鞣剂的制备 磺化、缩合 水溶性的阴离子染料 酸性、直接染料
可将-SO3H转化为其它基团,如-OH,-NH2, -CN,-Cl等。磺酰氯、磺酰胺等
SO3H 碱性水解
OH
Cl O Cl
Cl O Cl
利用-SO3H的可水解性,辅助定位或提高反 应活性。
OH
有机化学第二版高占先课后习题第12章答案
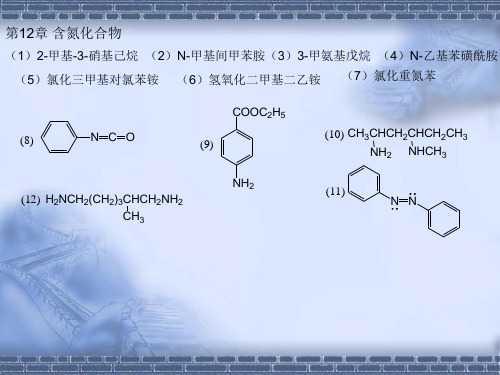
H N
O NH2 H N
NH2
OHH N
H2/Pd
12-12 根据下列反应,试确定A的构造式。
(1)CH3I过量 A(C8H15N) (2湿)Ag2O, △ 答案 A N H
(1)CH3I过量 (2湿)Ag2O, △
12-13 (1)利用RX和NH3合成伯胺的过程有什么副反应? (2)如何避免或减少这些副反应? (3)在这一合成中哪一种卤代烷不合适? (1)可发生二烷基化、三烷基化反应,生成R2NH和R3N; (2)使NH3大量过量,以增加 RX和NH3的碰撞机会生成RNH2; (3)叔卤代烃将发生消除反应,芳卤ArX也不易发生该反应。
CH3 (4)
2HNO3 2 H2SO4
CH3 NO2
Cl2 hv
CH2Cl NO2
(1) NaCN
CH2COOH NO2
Fe/HCl
CH2COOH NH2
(2) H3O,△
NO2
NO2
NO2
NH2
(5)
2HNO3 2 H2SO 4
NO2
((NH4)2S
NO2
NO2
NaNO 2-HCl 0~5¡ æ
pH=8~10
NH2 NaNO2-HCl
0~5℃
N N OH
(3)
参考(1)合成
OH COCH3 CH2CH3
HNO3 H2SO4
CH2CH3
Sn/HCl
CH2CH3
CH3COCl AlCl3
Zn-Hg HCl
CH2CH3
NaNO2-HCl 0~5℃ pH=8~10
OH H3CH2C
NO2
HO
NH2
NaNO2 / HCl
第十二章 复杂物质的综合分析及分析化学中常用的分离方法

2.溶剂萃取分离
在含有被分离物质的水溶液中,加入萃 取剂和与水不相混溶的有机溶剂,震荡, 利用物质在两相中的分配不同的性质, 使一些组分进入有机相中,使另一些组 分仍留在水相中,从而达到分离的目的。
梨形分液漏斗
溶剂萃取分离
萃取分离的基本原理
萃取分离的依据
物质
亲水性 离子型化合物 相互转换
疏水性 共价键化合物
(CH3CH2)2O + H+ = (CH3CH2)2O+H (CH3CH2)2O+H + FeCl4- = [(CH3CH2)2OH] +[FeCl4] -
被 (CH3CH2)2O 萃取
3.离子交换法
利用离子交换剂与溶液中的离子发生交换反应进行分离的方法, 称为离子交换分离法。 离子交换分离法分离效率高,既能用于带相反电荷的离子之间 的分离,还可用于带相同电荷或性质相近的离子之间的分离, 同时还广泛用于微量组分的富集和高纯物质的制备等。方法的 缺点是操作较麻烦,周期长。所以,分析化学中一般只用它来 解决一些比较困难的分离问题。
沉淀将痕量组分共沉淀分离富集。 利用生成混晶进行共沉淀分离
利用生成混晶对痕量组分进行共沉淀分离富集。例如利用 Pb2+与Ba2+生成硫酸盐混晶,用BaSO4共沉淀分离富集Pb2+。 有机共沉淀剂 a. 利用胶体的凝聚作用进行共沉淀:辛可宁,丹宁,动物胶; b. 利用形成离子缔合物进行共沉淀:甲基紫,孔雀绿,品红, 亚甲基蓝;
Db
表示相同条件下,两组分于同一萃取体系内在两相中分配比 的比值,当两分配比相差越大,分离因素就越大,分离效率高 萃取的选择性越好,两组分可以定量分离。
溶剂萃取分离 溶剂萃取的主要类型
第十二章 定量分析的一般步骤

呼伦贝尔学院 分析化学
破碎过10号筛后,d=2mm,m=0.2×22=0.8kg, 若将缩分1次后留下的10kg试样连续缩分3次: 留下 10×(1/2)3=1.25kg,
此量大于要求的m值(0.8kg),仍有代表性。 故 应再缩分3次。
三、关于取样的几点说明: 1.气体试样的采取 气体取样装置由取样探头、试样导出管和贮样器三部分 组成。 2.液体试样的采取 液体物料,组成比较均匀、采样比较容易。 对于液体物料的采样应注意两点: ⑴ 采样容器和采样用的管道必须清洁,取样前应用被分 析的物料冲洗。
根据被测组分的含量,选择合适的分析方法: 常量组分一般采用滴定分析法或重量分析法; 当重量分析法和滴定分析法均可采用的情况下,一般采用 滴定分析法。 微量组分采用光度分析法或其它仪器分析法。
四、共存组分的影响
在选择分析方法时,必须考虑干扰组分对测定的影响, 尽量选择特效性较好的分析方法或者加入掩蔽剂或者控制条 件可以消除干扰的方法。
第12章 定量分析中的一般步骤
教学要求:
1.理解试样全分析的基本原理和一般步骤; 2.了解试样的采取、制备和分解方法; 3.了解选择分离方法和选择测定方法的原则
定量分析的一般步骤: 取样 试样预处理
测定
数据处理 结果表示
§12.1 试样的采取和制备
一、 取样的基本原则
取样是定量分析中的第一步; 取样的基本原则:具有代表性; 取样的基本步骤:
TiO
合
2
量
H
2O
比
2
色
法
测
定TiO
2
EDTA法测定CaO MgO合量
EDTA法测定CaO
KIO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2)萃取剂与稀释剂不互溶的体系
对第 i 级~N 级作物料衡算:
B X i 1 X N S Yi YS
原 a)直角坐标图解法 理
B -----操作线方程 Yi X i 1 X N Y S S 过点(XN,YS) (XF,Y1)
§12.2 萃取过程的流程和计算
' yA 0.6
§12.2 萃取过程的流程和计算
E 0.3 0.2 1 R 0.6 0.3 3
(2)溶剂比S/F是最小溶剂比(S/F)min多少倍? 化 工 原 理
A
25
S F MF MS S F min M F M S MF M S M F MS
5
0.6
0.8 G 0.2 B% S
化 工 原 理
0.2 B
B
0.8 0.4 0.6 S% H A%
三个顶点分别表示A、B、S三个纯组分。 每条边代表某二元混合物的组成,不含第三组分。 E 点: xA =0.4, xB =0.6 三角形内任一点代表某三元混合物的组成。
% A %B % S 100 %
22
B YE ( X R X F ) S ——单级萃取的操作线方程
化 工
过点(XF,0),
Y
YE
相平衡关系: YE f X R
简化: YE KX R
B 斜率为 原 S
理
E1
B S
XR XF X
§12.2 萃取过程的流程和计算
23
例1 单级萃取 采用纯溶剂进行单级萃取。已知料液组成 xF=0.3 (质量 分率,下同),选择性系数为6,在萃余相中 ,kA x A x B 0.25 < 1 ,溶解度曲线如图所示。试求: (1)萃取液量与萃余液量的比值; (2)溶剂比S/F是最小溶剂比(S/F)min多少倍?(用线段 化 A 表示) 工 原 理
化 工 原 理
14
A在萃取相中的质量分率 B在萃取相中的质量分率
A在萃余相中的质量分率 B在萃余相中的质量分率
yA yB
kA kB
xA yA xB x A
yB xB
§12.1 萃取的基本概念
β=1 ,
15
y A yB xA xB A、B两组分不能用萃取分离;
β>1,组分A在萃取相中浓集; β越大,组分A与B萃取分离的效果越好。 化 工 原 理 2)选择性系数和分配系数的关系 kA愈大,kB愈小,选择性系数愈大 选择性系数表示萃取剂对组分A、B溶解能力差别的大小
被分离体系相对挥发度α大,用蒸馏方法分离; 如果α接近1,可用反萃取,结晶分离等方法。 化 工 原 理
17
4. 萃取剂的其它性质
1)萃取剂的密度 萃取剂与被分离混合物应有较大的密度差 2)界面张力 首要考虑的还是满足分层的要求。 一般不选界面张力过小的萃取剂。
§12.1 萃取的基本概念
3)粘度 粘度小对萃取剂有利
§12.2 萃取过程的流程和计算
RN S
化 工 原 理 △ 操作线 E1 F R1 R2 M RN
29
F E1 R1 E2 R2 E3 .... Ri Ei 1 .... RN 1 EN
——操作点
如此反复,直至萃余相 组成小于等于指定值为
MF S F MS
R ME E MR
E ' R' F
FD F D F DS R’ R
● ●
F S RE M
GF S max F GS
G
理 S min
M
E
最小萃取 剂用量
最大萃取 剂用量
§12.2 萃取过程的流程和计算
2)萃取剂与稀释剂不互溶的体系
kg ( A) 萃取相中溶质A的浓度(质量比) Y kg ( S ) 萃余相中溶质A 的浓度(质量比) X kg( A) kg( B) 由物料衡算
§12.1 萃取的基本概念
二、 三角形相图 1. 三元组成的表示法
4
化 工 原 理 等腰直角三角形 等边三角形 不等腰直角三角形
组分的浓度以摩尔分率,质量分率表示均可。 常用 xA、xB、xS分别表示 A、B、S 的质量分率。
§12.1 萃取的基本概念
A 0.8 0.6 E 0.4 M 0.2 0.6 0.8 0.2 0.4 G B% S% F A% S E 0.4 0.6 M 0.8 A 0.2 F 0.4
' B
24
xA x 1 xS
' A
xB x 1 xS
——脱溶剂浓度
' xA xA 0.25 ' xB 1 xA
' xA 0.2
' ' y A xA yA xA yA 1 6 ' ' yB xB (1 y A ) xB 1 y A 0.25
Y
31
化 工 原 理
E
Y1
E1
P1
P2 OX S N XF X
§12.2 萃取过程的流程和计算
b)解析法 分配曲线: Y KX 设: A KS ——萃取因子 m B
化 工 原 理
32
(对应吸收中的脱吸因子)
交替应用 物料衡算关系 分配曲线方程 操作线方程 和 相平衡关系
B Yi X i 1 X N Y S S
E2
止,共轭线的个数即为
E3 理论级数
§12.2 萃取过程的流程和计算
萃取剂用量和组成、最终萃余相组成等有关。 其它条件一定时,点△的位置由溶剂比决定:
S/F较小时,点△在左侧,S用量越小, △越靠近S;
化 工
30
Note: 点△的位置与联接线斜率、原料液的流量和组成、
S/F较大时,点△在右侧,S用量越大, △越靠近S。
S,yS E,yE S
B S
S F,xF R,xR R,x’R E,y’E
§12.2 萃取过程的流程和计算
解:(1)萃取液量与萃余液量的比值
R E F ' ' R x E y A A FxF
化 工 原 理
' E xF xA ' R yA xF
FxF F S xM
A
7
F
差点 G
M
和点
杠 杆
xM 0 F MS S xF xM FM 三角形相图的应用:
1. 查取浓度; 2. 表示混合、分离等过程; 3. 定量计算----杠杆原理。
B
差点
S
§12.1 萃取的基本概念
三、 三角形相图中的相平衡关系
1. 溶解度曲线 共轭相: 互成平衡的两相 化 萃取剂的加入量应使总 组成点落在两相区内
2. 分配系数和分配曲线
1)分配系数
9
化 工 原 理
组分A在E相中的组成 y A k A 组分A在R相中的组成 x A
yB kB xB
分配系数表达了某一组分在两个平衡液相中的分配关系。 kA值与联结线的斜率有关。
§12.1 萃取的基本概念
10
化 工 原 理 联结线的斜率>0 kA>1,yA>xA
化 工 原 理
28
F S M E1 RN
对第二级作总物料衡算
F E2 R1 E1或F E1 R1 E2
R1 E3 E2 R2或R1 E2 R2 E3
依此类推,对第n级作总物料衡算
RN 1 S RN E N 或RN 1 E N RN S
联结线的斜率=0
kA =1,yA=xA
联结线的斜率<0
kA< 1, yA<xA
§12.1 萃取的基本概念
2)分配曲线
11
y A f (xA )
化 工 原 理
§12.1 萃取的基本概念
4. 温度对相平衡关系的影响
12
物系的温度升高,组分间的互溶度加大 温度升高,分层区面积缩小
化 工 原 理 T1<T2<T3
18
5. 一般工业要求
化 化学稳定性好、不易聚合、分解、腐蚀性小、无毒、 工 来源容易,价格便宜等 原 理
§12.2 萃取过程的流程和计算
一、单级萃取的流程与计算 1. 单级萃取的流程
原料液F 化 工 原 理
19
萃余相R
理论 萃取级
xF
萃取剂S
xR
萃取相E
离开的两相 Ri、Ei呈相平 衡关系
ys
yE
2. 单级萃取的计算 1)萃取剂与稀释剂部分互溶的体系
已知:F、xF、yS、xR(或 yE) 、 相平衡关系 求:S、R、E、另一相浓度
§12.2 萃取过程的流程和计算
20
确定点F、S(或S0)、点R,点E,作联结线,找到点M, 利用杠杆原理求各量。
化 工 原
E ' FR' R' FE '
E’
21
化 工 原 理
BX F SY0 SYE BX R
S (Y0 YE ) B( X R X F ) B YE Y0 ( X R X F ) S 类似于吸收中 Ya Yb LS ( X b X a ) GB
§12.2 萃取过程的流程和计算
当萃取剂为纯溶剂时, Y0=0
2. 萃取剂S与稀释剂B的互溶度
组分B与S的互溶度影响溶解度曲线的形状和分层面积。
§12.1 萃取的基本概念
16
Emax
化 工 原 理
Emax
分层区面积大, B、S互溶度小, 可能得到的萃取液的最高浓度y’max较高。
B、S互溶度愈小,愈有利于萃取分离。
