清北学堂-化学竞赛练习题
第32届全国高中化学竞赛清北学堂模拟试一

第32届全国高中化学竞赛清北学堂模拟试一·竞赛时间(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第一题(17分)某金属元素A位于第一过渡系,主要以含氧矿物形式存在于地壳中,且分布广泛,其单质熔点较低。
A存在一种含氧酸根AO x y-,在酸性水溶液中短时间内可稳定地存在,其中A的氧化态数值与其族序数相同。
1-1.写出A的元素符号及价层电子组态。
1-2.在元素周期表中,处于相邻位置的过渡元素常具有一些相似的性质。
以下是以B盐(K y AO x)为原料,制备两种含A化合物的方法:1)向热、浓的草酸溶液中加入B的酸性浓溶液,再加入一定量碳酸钾饱和溶液,冷却结晶可得一种红棕色晶体C;2)向含有KI(浓度约为50g/L)并被Ba(OH)2所饱和的水溶液中滴加B的饱和水溶液,可得一种暗绿色沉淀D,已知D遇酸易分解。
1-2-1.写出C与D的化学式(不考虑结晶水数目),并估算C的磁矩大小。
1-2-2.写出D与空气中CO2反应的化学方程式。
1-2-3.写出制备C的总反应方程式。
1-3.A元素存在一种羰基化合物E。
右图示出E及相关化合物的生成与转化的流程图。
其中箭头表示在一定条件下的转化过程,制备E的过程中给出了所有反应物和产物(但未给出比例),而其他过程给出所有反应物及其参与反应的计量系数的比例。
已知上图所示出的所有未知化合物中仅G和M中不含A元素,且F是A的一种常见盐类。
根据图中的关系与所属条件,写出H—O的化学式。
第二题(9分)五氧化二氮是硝酸的酸酐,可通过在低温下用五氧化二磷脱水制得。
其常温是晶体,具有很高的蒸汽压,在气相或在惰性溶剂中都能全部分解,产物为氧、二氧化氮和四氧化二氮的混合物。
第34届全国高中学生化学竞赛清北学堂模拟试卷3答案

第34届全国高中学生化学竞赛清北学堂模拟试卷3(参考答案)第1题(19分)众所周知,还原剂可以显著影响有机反应中还原反应的结果。
而对于一些无机化合物,还原剂的不同也会导致生成不同的产物。
1-1下列反应均以K2MCl6作为反应物,请分别写出下列化学反应方程式1-1-1 在KCN过量的条件下以水作为溶剂,加入过氧化氢作为歧化反应的催化剂,生成1:3的两种含M化合物,在这两种化合物中M的配位数相同且与反应物相比没有升高1-1-2 在KCN过量的条件下以水作为溶剂,不加入过氧化氢,氮气气氛下反应一段时间,加入乙醇析出灰黑色晶体。
已知该过程未发生氧化还原反应,M的配位数并未改变但1mol 产物中的离子数量为1molK2MCl6中的三分之五倍1-1-3 在KCN过量的条件下以甲醇作为溶剂,加入过氧化氢作为氧化剂,生成唯一的含M 产物,该产物中阴阳离子数目比为1:31-1-4 不加入KCN,以水作为溶剂,加入KBH4作为还原剂,生成M的三价配合物。
该配合物溶液与上一小问配合物溶液在浓度相同的情况下可近似认为溶液电导率相等。
已知该配合物包含两种数目比为1:1的配体1-2 已知五种含M产物中M的质量分数分别为34.62%、48.82%、38.90%、36.39%、40.40%,推断M的元素符号1-3事实上,在进行这四个反应时,仅有上述五种产物被以固体形式分离了出来,溶液中依旧存在着极为复杂的混合物体系1-3-1 尽可能多地写出副产物化学式1-3-2 推测从溶液体系中分离得到产物的实验步骤1-3-3从混合物的分离角度考虑X-1-4中得到的产物构型,并画出其结构1-1-1 4K2MCl6+24KCN→K5M(CN)6+3KM(CN)6+24KCl1-1-2 K2MCl6+8KCN+2H2O→K4MO2(CN)4+6KCl+4HCN1-1-3 2K2MCl6+16KCN+H2O2→2K3M(CN)8+12KCl+2KOH1-1-4K2MCl6+3KBH4+12H2O→K3M(OH)3Cl3+3KCl+3H3BO3+12H2 (每个2分)1-2 Re(2分)1-3-1K2ReO(CN)5、K3Re(OH)3(CN)3、K3ReO2(CN)4、K2Re(CN)4 (每个1分)1-3-2加入乙醇析晶(1分)、过滤、分别用冰水、乙醇、乙醚洗涤晶体(1分)1-3-3经式(1分)(2分)第2题(10分)将某只含一种金属元素的样品盐晶体在氩气气氛中热分解,在65-135℃失重4.72%,对应失去全部结晶水,在250-292℃失重11.26%,该过程中生成了一种物质A,A的1H-NMR 信息如下图所示。
第34届全国高中学生化学竞赛清北学堂模拟试卷2
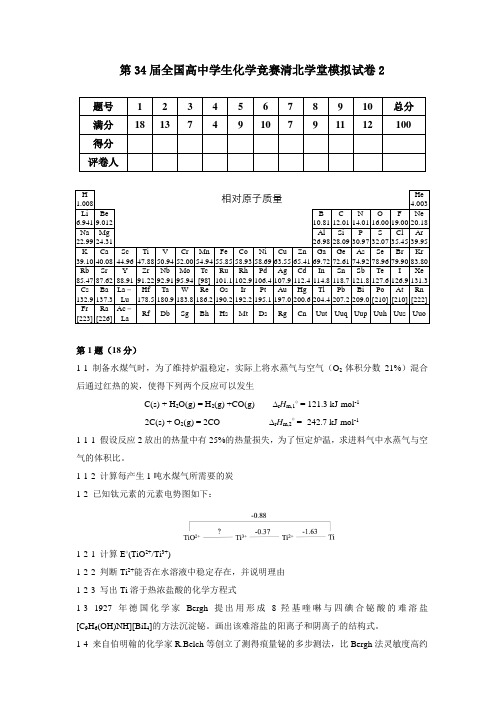
第34届全国高中学生化学竞赛清北学堂模拟试卷2题号 1 2 3 4 5 6 7 8 9 10 总分满分18 13 7 4 9 10 7 9 11 12 100 得分评卷人H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.41Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo第1题(18分)1-1 制备水煤气时,为了维持炉温稳定,实际上将水蒸气与空气(O2体积分数21%)混合后通过红热的炭,使得下列两个反应可以发生C(s) + H2O(g) = H2(g) +CO(g) ∆r H m,1⊖ = 121.3 kJ·mol-12C(s) + O2(g) = 2CO ∆r H m,2⊖ = -242.7 kJ·mol-11-1-1 假设反应2放出的热量中有25%的热量损失,为了恒定炉温,求进料气中水蒸气与空气的体积比。
第31届全国高中化学竞赛清北学堂模拟试卷5

第31届全国⾼中化学竞赛清北学堂模拟试卷5第31届全国⾼中化学竞赛清北学堂模拟试卷5·竞赛时间3⼩时。
迟到超过半⼩时者不能进考场。
开始考试后1⼩时内不得离场。
时间到,把试卷(背⾯朝上)放在桌⾯上,⽴即起⽴撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的⽅框内,不得⽤铅笔填写。
草稿纸在最后⼀页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在⾸页左侧指定位置,写在其他地⽅者按废卷论处。
·允许使⽤⾮编程计算器以及直尺等⽂具。
第1题(13分) 1803年,英国科学家和物理学家Wollaston 在处理铂矿时偶然发现了⼀种玫瑰⾊的复盐结晶。
⽤氢⽓还原该盐得到了铑。
这是除铂外⾸例从⾃然界中提取出的铂系⾦属。
铂系⾦属中除锇外电⼦排布都很特殊。
1-1写出铂和铑的电⼦构型。
铂系⾦属对酸很不活泼。
如Ru ,Os ,Rh ,Ir 在常温下连王⽔都不能溶解。
但是Pd 和Pt 可溶于王⽔中。
1-2写出Pt 溶于王⽔的化学⽅程式。
含铂40.14%的盐A 受热分解得到单质铂,⼀种盐B 和⼀种黄绿⾊⽓体C 。
A 中阴离⼦呈⼋⾯体结构,其阴离⼦与K 2C 2O 4作⽤⽣成⼀种呈平⾯四边形的阴离⼦D 。
D 与⼀种⼆元化合物反应⽣成阴离⼦E。
E 中Pt 59.22%。
E 可双聚形成中性化合物F 。
1-3画出A 中阴离⼦,D ,E ,F 的结构。
写出B ,C 的化学式。
Pd 与氯⽓在⼤于823K 时⽣成α-PdCl 2。
⼩于823K 时β-PdCl 2为原⼦簇化合物,其化学式可表⽰为(PdCl 2)6。
它与A 中阴离⼦属于同⼀点群。
α-PdCl 2为扁平链状结构。
1-4画出两种PdCl 2的结构。
第2题(9分)2-1在下⾯的结构中,硼原⼦的Lewis 酸碱性分别为:B 1 _____、B 2 _____(选填“酸”、“碱”),画出其满⾜⼋隅体规则的主要共振式。
1.008Zr Nb Mo Tc Ru Rh P d Ag Cd InSn Sb Te I Hf Ta W Re Os Ir P t Au Hg Tl P b Bi P o At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.2 [210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNe Ar Kr Xe Rn 相对原⼦质量Rf Db Sg Bh Hs Mt2-2右上⾯结构是否有芳⾹性,画出其满⾜⼋隅体规则的共振式。
第32届全国高中化学竞赛清北学堂模拟试卷3

第32届全国高中化学竞赛清北学堂模拟试卷三·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
第1题(9分)1-1为什么主族元素同周期最高氧化态的稳定性从左到右逐渐降低?1-2众所周知,钾比钠活泼,也比钙活泼。
但是传统化工工业使用如下两种方法制备钾单质,两者制备钾的原理不同,前者通过钾的沸点较小被从体系中蒸出推动平衡制备钾,后者将二者与另一组分形成一混合体系制备钾。
选择用钙制备钾过程中形成混合体系的另一组分并简述其原因。
KCl + Na = NaCl + K 2KCl + Ca = CaCl2 + 2KA.水B.乙醇C.液氨D.四氯化碳1-3许多过渡金属配合物遵循18电子规则,这是因为此时它们的价轨道均被占据,达到了类似稀有气体的电子构型。
可是在有些时候倾向于形成外层16电子的配合物,请解释原因。
1-4高锰酸钾法是一种重要的氧化还原滴定方法,高锰酸钾法的读数方式与其他滴定法有所不同。
请指出这一不同并说明为何会采用此种读数方式。
1-5Birch还原在有机合成中有着重要的应用,它可以有效将炔烃还原为反式烯烃。
然而,它无法还原末端炔烃,简述理由。
第2题(12分)2-1-1在镁橄榄石(Mg2SiO4)晶体中,每个Mg均形成一个[MgO6]八面体。
每个O原子与几个Mg原子连接?每个O原子与几个Si原子连接?2-1-2锌橄榄石与镁橄榄石的结构相似。
与锌橄榄石相比,镁橄榄石的密度更大还是更小?简述理由。
2-1-3给镁橄榄石逐渐加压,镁橄榄石由正交晶系转化为立方晶系(又名林伍德石),此过程中其体积是变大还是变小?2-2磷能与碱金属形成多种多样的化合物,如Li3P7和RbP7等。
第32届全国高中化学竞赛清北学堂模拟试卷5
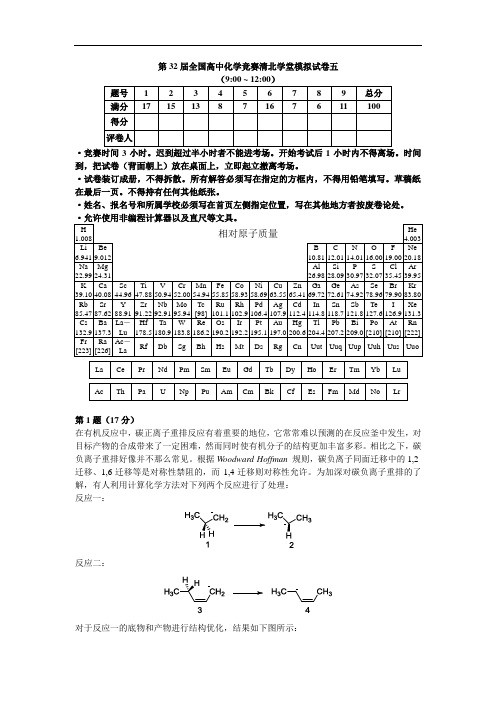
第32届全国高中化学竞赛清北学堂模拟试卷五·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
第1题(17分)在有机反应中,碳正离子重排反应有着重要的地位,它常常难以预测的在反应釜中发生,对目标产物的合成带来了一定困难,然而同时使有机分子的结构更加丰富多彩。
相比之下,碳负离子重排好像并不那么常见。
根据Woodward-Hoffman 规则,碳负离子同面迁移中的1,2-迁移、1,6-迁移等是对称性禁阻的,而1,4-迁移则对称性允许。
为加深对碳负离子重排的了解,有人利用计算化学方法对下列两个反应进行了处理:反应一:反应二:对于反应一的底物和产物进行结构优化,结果如下图所示:1-1-1碳负离子重排与碳正离子重排在基团迁移的方向上有什么不同,根据所给信息,简要说明原因?1-1-2分别写出“自由”碳正离子和“自由”碳负离子中心碳“原子”的杂化方式并说明为什么二者杂化方式不同。
1-1-3请利用共振论解释反应物1a、反应物1b和产物2的能量差别。
1-2了解一个反应的趋向,不仅要研究该反应的底物和产物,还要研究该反应的过渡态。
理论化学对于反应一和反应二的计算结果如图所示:1-2-1画出碳负离子1,2-迁移和1,4-迁移过渡态中轨道作用示意图。
1-2-2请利用休克尔理论解释两个反应活化能的差异。
第2题(15分)EDTA能与许多金属阳离子反应生成1 : 1的络合物。
2-1-1画出EDTA与铜离子所形成络离子的结构。
2-1-2指出这种络离子所属点群。
2-2以下是hcp堆积和ccp堆积中原子的配位多面体,指出这两种配位多面体的所属点群。
清北学堂第34届化学竞赛模拟试题

清北学堂第34届全国高中化学竞赛模拟试卷题号123456789总分满分12916101496816100得分评卷人·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
H1.008相对原子质量He 4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.41Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-La Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb LuAc Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr第1题(8分)写出下列反应的方程式1-1锡溶于热的氢氧化钾溶液,放出无色无味气体,溶液中仅生成一种物种。
第31届全国高中化学竞赛清北学堂模拟试卷3

第31届全国高中化学竞赛清北学堂模拟试卷3清北学堂(2022年8月27日9:00~12:00)题号满分得分评卷人1122831041451061471488910总分100·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
1.008He4.003ONeBCNFLiBe6.9419.01210.8112.0114.0116.0019.0020 .18AlSiPSClArNaMg26.9828.0930.9732.0735.4539.9522.9924.31KCaScTi VCrMnFeCoNiCuZnGaGeASeBrKr39.1040.0844.9647.8850.9452.0054.9455. 8558.9358.6963.5565.3969.7272.6174.9278.9679.9083.80SnSbTeI某eRbSrYZrNbMoTcRuRhPdAgCdIn85.4787.6288.9191.2292.9195.9498.91101 .1102.9106.4107.9112.4114.8118.7121.8127.6126.9131.3HfTaWReOIrPt AuHgTlPbBiPoAtRnCBaLa[210][222]132.9137.3-Lu178.5180.9183.9186.2190.2192.2195.1197.0200.6204.4207.2209.0[2 10][210]FrRa[223][226]Ac-LrRfDbSgBhHMtH相对原子质量第1题(12分)写出下列化学反应方程式:1-1光照下,[Cr(bipy)3]3+在碱性水溶液中得到一种六配位的带两个正电荷的配合物;1-2吡咯、4–醛基吡啶和醋酸锌以合适比例混合反应得到一种平面型分子,其中有机物分子画出结构;1-3草酸除铁锈;1-4TiCl3与羟胺在酸性溶液中反应;1-5FeCl3与羟胺在酸性溶液中反应;1-6硝基苯与SnCl2的盐酸溶液反应;第2题(8分)2-3实验证实,即使溶液中无小球藻存在,碳酸盐中18O的含量也会发生变化。
第33届全国高中化学竞赛清北学堂模拟试卷A1

第33届全国高中化学竞赛清北学堂模拟试卷A1·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
第1题(12分) 写出下列化学反应的方程式1-1过量锡与少量氯气反应。
1-2高温下往氯化铜中通入氨气。
1-3用氧化汞制备次氯酸酐。
1-4往硒单质中加入30%过氧化氢。
1-5膦与甲醛反应。
1-6亚硝酸银热分解。
第2题(9分)锌是一种重要的过渡金属元素,以前由火法炼锌制备锌单质。
现在主要被湿法取代。
首先对富集后的含铁高的锌精矿,焙烧高于500 度后生成一些铁酸锌(ZnFe2O4)。
为检测锌矿中的铁杂质含量。
取100 克锌矿进行上述操作后,用热的中等浓度硫酸使所有固体溶解得到硫酸锌和硫酸铁。
将溶液倒入500ml 容量瓶中并定容。
取100ml 溶液加入NaOH溶液。
得到易于沉出的一种含铁矾A2.83 克,其中含钠的百分含量为4.743%,含硫13.23%。
锌全部以硫酸锌的形式存在于溶液中。
2-1请写出A 的化学式,写出计算过程。
2-2 请计算铁在锌矿中的百分含量。
第3题(16分)某无色双原子气体A是一种自由基,对人体呼出气中A水平的检测可以在一定程度上判断肺部的疾病状况。
双原子分子B是A的价层等电子体,但B的稳定性远不如A,B是一种星际分子。
A是一种常见的配体。
分子B含的两种元素X和Y可以形成大量的中性分子或阴阳离子。
对于中性分子而言,最容易制备的是一种橙黄色晶体C,其中一种元素的含量是30.4%。
3-1写出A B C代表的三种物质3-2写出一种C的制备方法化合物C可以被二氟化银氟化,首先生成一种角型分子D,进一步氟化可以得到E。
第34届全国高中学生化学竞赛清北学堂模拟试卷3
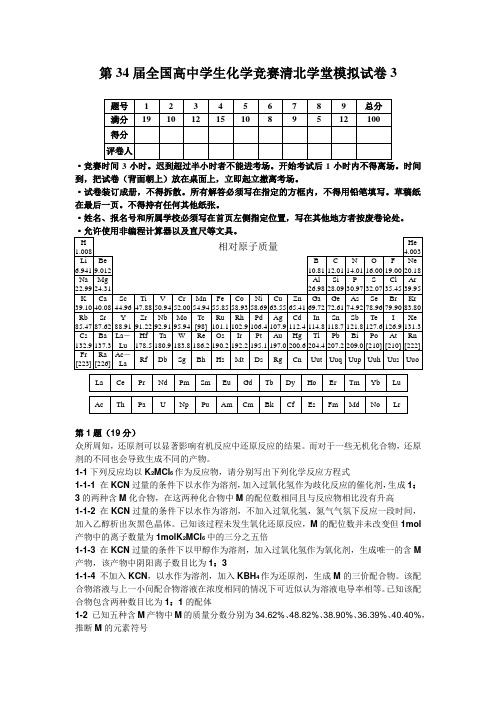
第34届全国高中学生化学竞赛清北学堂模拟试卷3·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第1题(19分)众所周知,还原剂可以显著影响有机反应中还原反应的结果。
而对于一些无机化合物,还原剂的不同也会导致生成不同的产物。
1-1下列反应均以K2MCl6作为反应物,请分别写出下列化学反应方程式1-1-1 在KCN过量的条件下以水作为溶剂,加入过氧化氢作为歧化反应的催化剂,生成1:3的两种含M化合物,在这两种化合物中M的配位数相同且与反应物相比没有升高1-1-2 在KCN过量的条件下以水作为溶剂,不加入过氧化氢,氮气气氛下反应一段时间,加入乙醇析出灰黑色晶体。
已知该过程未发生氧化还原反应,M的配位数并未改变但1mol 产物中的离子数量为1molK2MCl6中的三分之五倍1-1-3 在KCN过量的条件下以甲醇作为溶剂,加入过氧化氢作为氧化剂,生成唯一的含M 产物,该产物中阴阳离子数目比为1:31-1-4 不加入KCN,以水作为溶剂,加入KBH4作为还原剂,生成M的三价配合物。
该配合物溶液与上一小问配合物溶液在浓度相同的情况下可近似认为溶液电导率相等。
已知该配合物包含两种数目比为1:1的配体1-2 已知五种含M产物中M的质量分数分别为34.62%、48.82%、38.90%、36.39%、40.40%,推断M的元素符号1-3事实上,在进行这四个反应时,仅有上述五种产物被以固体形式分离了出来,溶液中依旧存在着极为复杂的混合物体系1-3-1 尽可能多地写出副产物化学式1-3-2 推测从溶液体系中分离得到产物的实验步骤1-3-3从混合物的分离角度考虑X-1-4中得到的产物构型,并画出其结构第2题(10分)将某只含一种金属元素的样品盐晶体在氩气气氛中热分解,在65-135℃失重4.72%,对应失去全部结晶水,在250-292℃失重11.26%,该过程中生成了一种物质A,A的1H-NMR 信息如下图所示。
清北学堂年全国高中化学竞赛模拟试卷(四)

清北学堂20XX 年全国高中化学竞赛模拟试卷(四)张祖德教授命制第一题:Lewis 酸碱定义为凡是能接受电子对的物种称为Lewis 酸,凡是能给出电子对的物种称为Lewis 碱。
1. 试写出XeF 2(g)与SbF 5(g)以摩尔比:① 1︰1, ② 2︰1, ③ 1︰2,进行Lewis酸碱反应的方程式。
2. 试画出反应物分子的空间几何构型,指出中心原子的杂化类型(中心原子上的孤电子对要标出来)。
3.试画出三种原子以上的离子团物种的几何构型。
第二题:IIA 、IIIA 族元素的单核共价化合物属缺电子化合物,它们往往以多聚的形式出现:如Be 3Cl 6、B 2H 6、Al 2Cl 6,化合物分子中含有桥键,如,称为氢桥键,ClAl称为氯桥键。
三氯化镓发生下面一系列反应:(B)(C)(D)(E)(F)(G)GaCl 3Me 3SiH 3Li[GaH 4)Li[BH 4]NH 3低温1.(A)是结构对称的,具有氯桥键的镓的氢化物,分子中的镓原子符合八隅律。
试画出(A)的几何构型。
2.(B)是镓的二元共价化合物,(C)是含硼、镓的三元共价化合物。
画出(B)和(C)的结构式。
3.(D)是镓的混合价态的二元离子化合物,当(A)加热生成(D)时,有最轻的气体放出。
试写出该反应的离子方程式[其中(D)必须以离子式表示]4.1mol(C)与2mol NH 3反应,生成(F)共价化合物混合物与(G)离子化合物。
(1) 写出生成(F),(G)的反应方程式。
(2) 画出(G)中正、负离子团的结构式。
第三题:1.甲酸与二甲基胺缩合,形成N, N -二甲基甲酰胺(A) (1) 试画出(A)的共振结构式,标出形式电荷(2) 试比较N -甲基乙酰胺(B),丙酰胺(C)和(A)的熔点高低: > > (填入化合物的编号A 、B 、C )。
并解释之。
2.化学式为(CHCOOH)2为两种异构体的酸(A)和(B)。
其中一种酸称为马来酸(maleic acid),另一种酸称为富马酸(fumaric acid)。
清北学堂第34届全国高中学生化学竞赛模拟题答案

清北学堂第34届全国高中学生化学竞赛模拟题参考答案第一题:1-16CO+3B2H6==2B3O3(CH3)31-24Mn(CO)5(NO2)==2Mn(NO3)2+Mn2(CO)10+10CO1-31-43Cr2O3+13C==2Cr3C2+9CO1-5th Es+ 4He==101 t6Md+0110 Ne+ h8U==101 t6Md+11H+301n第二题2-1M:砷A:As2O3B:AsCl3C:AsCl5D:AsH3E:H3AsO4F:H2S G:As2S5H:As(OH)32-2AsH3+3KOH=K3As+3H2O2K3As+6H2O=As2H2+6KOH+2H22-3As2O3+4CH3COONa=2Na2CO3+(Me2As)2O+CO2第三题3-1单体:sp杂化二聚体:sp2杂化多聚体:sp3杂化3-2BeCl2是酸,I2S2是碱3-33-43-5用软硬酸碱理论解释:由于水中的O是比S更硬的碱,对于属于硬酸的Be来说具有更好的亲核性,它会取代S2I2,因而游离出S2I2。
第四题4-1232-208=24;24/4=6α;核电荷减少2×6=12,核电荷之差为90-82=8;12-8=4β4-2E=[m(232Th)-m(208Pb)-6m(4He)]×c2=42.67MeV4-31.00kg含2.64×1021粒子;232Th衰变常数λ=1.57×10-18s-1;A=Nλ=4.08×106dps;每次衰变释放能量42.67MeV,产生能量的速率为2.79×105W4-4228Th=208Pb+54He;A=Nλ=9.58×1020y-1;N He=9.58×1022;V He=3.56L4-55.75y第五题5-11条C3轴,3条C2轴,3个镜面,3条S6轴5-2[Ru2(C6Me6)2(SC6H4Br)3][BF4]5-3[Ru2(C6Me6)2H3][PF6]:+2,7,符合;[Ru2(C6Me6)2(SC6H4Br)3][BF4]:+2,6,符合5-4前一配离子中因为Ru周围配体不能提供足够的电子使Ru满足18电子规则,Ru、Ru 间形成三键,使得Ru-Ru距离较短。
第32届全国高中化学竞赛清北学堂模拟试卷一

第32届全国高中化学竞赛清北学堂模拟试一(9:00 ~ 12:00)·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
·允许使用非编程计算器以及直尺等文具。
第1题(6分)随着2017年我国在南海海域开采可燃冰的工作取得重大突破,“包合物”这个词语出现在大众视野中。
1-1看似“包合物”离我们很远,但是实际上,我们生活中随处可见其身影。
例如我们口服的药物,大多以药物及其他组分组成的外壳形成“包合物”的形式进入我们的身体。
简单说明这种“包合物”有什么优点?1-2下图为可燃冰的部分相图,根据下图我们知道,如果想得到水的包合物,则必须在高压条件下制备。
实际上,我们在利用管道运输天然气的时候,管道内部压力也是很大的,而且并不能完全除去体系中的水蒸气,所以会在管道内部出现可燃冰。
现在可以通过加入甲醇或乙二醇等醇类或者特殊高聚物的方法来阻止其在管道内部形成可燃冰,据此提出加入这两种物质能够避免可燃冰出现的原因。
第2题(25分)含有非金属元素X的二元化合物A在一般情况下呈现橙黄色,其中X的质量分数为30.4%。
A可以通过一种黄色的离子化合物B与一常见有刺激性气味的气体C反应制备而得到,或通过B与一个生活中常见的二元离子化合物D反应而得到。
D中X的质量分数为64.6%,A可以在少量银的催化下转变成另一种物质E,物质E在氰化钾的作用下能够重新生成A,A可以与三氯化铁反应生成1:1的加合物F。
2-1写出上述A-F的化学式。
2-2画出物质F的结构。
A可以与D反应得到一种离子化合物G,经过测定该物质的电导率与氯化钾相同,而且阳离子的质量分数为10.4%,反应中生H。
第32届全国高中化学竞赛清北学堂模拟试卷4
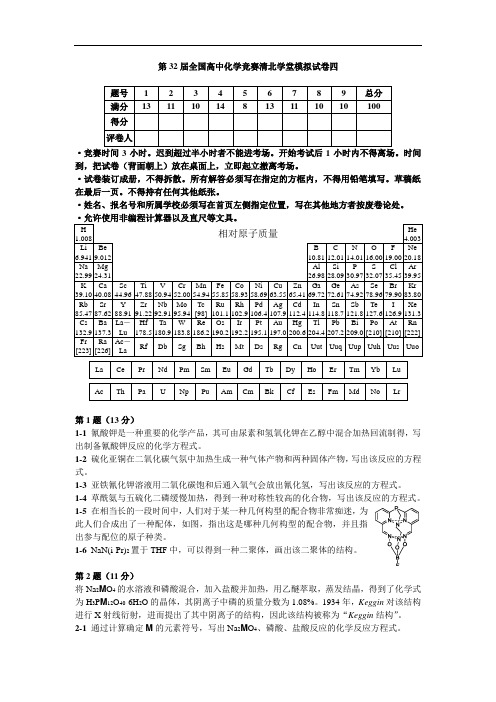
第32届全国高中化学竞赛清北学堂模拟试卷四·竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
·试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
·姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
第1题(13分)1-1氰酸钾是一种重要的化学产品,其可由尿素和氢氧化钾在乙醇中混合加热回流制得,写出制备氰酸钾反应的化学方程式。
1-2硫化亚铜在二氧化碳气氛中加热生成一种气体产物和两种固体产物,写出该反应的方程式。
1-3亚铁氰化钾溶液用二氧化碳饱和后通入氧气会放出氰化氢,写出该反应的方程式。
1-4草酰氨与五硫化二磷缓慢加热,得到一种对称性较高的化合物,写出该反应的方程式。
1-5在相当长的一段时间中,人们对于某一种几何构型的配合物非常痴迷,为此人们合成出了一种配体,如图,指出这是哪种几何构型的配合物,并且指出参与配位的原子种类。
1-6NaN(i-Pr)2置于THF中,可以得到一种二聚体,画出该二聚体的结构。
第2题(11分)将Na2M O4的水溶液和磷酸混合,加入盐酸并加热,用乙醚萃取,蒸发结晶,得到了化学式为H3P M12O40·6H2O的晶体,其阴离子中磷的质量分数为1.08%。
1934年,Keggin对该结构进行X射线衍射,进而提出了其中阴离子的结构,因此该结构被称为“Keggin结构”。
2-1 通过计算确定M的元素符号,写出Na2M O4、磷酸、盐酸反应的化学反应方程式。
2-2Keggin结构阴离子具有α、β、γ、δ和ε五种可能的异构体结构,其中α结构和ε结构均具有和甲烷相同的对称性,β结构和δ结构均具有和氨相同的对称性,下图示出了其中的δ结构和ε结构:2-2-1 请简述δ型Keggin结构和ε型Keggin结构的不同点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的杂化情况。
第 16 题 碳化钙 CaC2 在 1100℃与氮气反应生成单质碳和一种
8
清北学堂—刘奉岭老师
钙盐,这种钙盐与 CO2 和 H2O 反应生成含氮 66.64%的一 种 5 原子分子 A 和另一种盐。A 很容易聚合,其二聚体有 多种结构。写出上述反应的方程式,画出 A 的 3 种原子 排布次序不同的二聚体的结构。
第 13 题 配离子[N{(RuCl4(H2O)}2]3-中两个中心离子及桥连配
体是直线形,若水分子看成一个整体,该离子有五个镜面, 画出其结构。
第 14 题 化学家在羰基原子簇化合物方面进行过许多研究,曾
经制得过多种原子簇化合物。一种含 Fe 元素的原子簇 Fe4C(CO)n 是由 Fe 和 C 原子形成多面体骨架,CO 在骨 架外配位,在骨架内相邻 2 个原子之间形成正常的双电子 键,Fe 原子满足 18 电子规则,骨架结构没有 C3 轴(考 虑骨架对称性时可不考虑 CO 配体)。画出骨架结构,求 出 Fe4C(CO)n 中的 n 值。
Fe 满足 18 电子规则,画出[(CO)2Fe(2-L)2Fe(CO)2]的结 构简图。
9-2 在 冰 醋 酸 热 溶 液 中 , 用 KMnO4 氧 化 Mn(CH3COO)23H2O,得到含 3 个 Mn(III)离子的络离子 A+,A+中的 CH3COO- 2 个氧原子都配位、每个 Mn(III) 离子各有 1 个水分子与之配位,络离子有三重旋转轴。写
出生成 A+的方程式,用 O O 表示 CH3COO-, 画出 A+ 的结构简图。
9-3 减压蒸馏不带结晶水的醋酸锌,得到一种结晶 形的中性配合物 X,配合物 X 由 4 个 Zn 离子与配体形成,
具有 4 个三重旋转轴。写出生成 X 的方程式,用 O O 表 示 CH3COO-, 画出 X 的结构简图,并指出上述配合物是 顺磁性还是抗磁性。
3-2 若用 O 式;
O 表示 CH3COO-配体,画出 A 的结构
3-3 写出生成 A 的化学反应方程式。
第4题
有 机 配 体 C9H7- 可 以 和 金 属 镍 形 成 配 合 物
[Ni(C9H7)(NO)n],在该配合物中
_
Ni-NO 在一条直线上。指出上述
配合物中的 n 是多少,画出配合
物的结构(氢原子可忽略),并指出 Ni 的氧化态。C9H7-的
第6题 镍 是 银白色金属,质地坚硬,具有磁性和良好的可塑
性。有很好的耐腐蚀性,耐强碱,在空气中不被氧化,在 稀酸中可缓慢溶解。金 属 镍 主 要 用 于 电 镀 工 业 ,镀 镍 的 物品美观、干净、又不易锈蚀。极细的镍粉,在化学 工 业 上 常 用 作 催 化 剂 。 镍能形成许多配合物,常见的是 四配位的配合物。
用 A 表示,求出该四
方形分子管的化学
式,指出镍的氧化态,
写出二氰胺根 N(CN)2-
离子的大
m n
键。
第7题 下图是两种配体与镉Cd形成的配合物的晶胞立体图,
H C
Cd
N S
图中各个原子上标上了元素符号。该晶体的晶胞参数为: a=7.732 Å, b=14.811 Å, c=8.715 Å, =90.00°,=104.01°, =
5-2 铝和某些醇形成的配合物 Al(OR)3 一般以聚合形 式存在。例如异丙醇与铝形成的配合物 Al(OR)3 就聚合成
2
清北学堂—刘奉岭老师
[Al(OR)3]4,这 4 个 Al 原子处于两种不同的化学环境,配 位数都是偶数。为了画图简单,可以以 O 表示异丙醇与 铝形成的配合物 Al(OR)3 中的 RO-离子,画出该配合物的 合理结构。
分数分别为:N 85.12%, H 4.38%, X2–由周期表中同周期
的两种相邻元素形成,其结构是 2 个成键原子连接 2 个化
学环境相同的环,写出制取 A 的化学反应方程式(阴离
子用 X2–表示),画出 X2–的结构。
8-2 当冠醚中的氧被氮取代时,可以制得配位性能很
好的穴状配体,右图就是一种穴状 配体。当该穴状配体与同一主族相
结构如右图。
第5题 铝是我们比较熟悉的金属,其化合物我们经常接触。
矾就是铝和其他正离子与 SO42-离子形成的带结晶水的复 盐,一般写成 MAl(SO4)2·12H2O。
5-1 在炸油条时,一般加入矾和小苏打,起到起泡的 作用。有些不法商贩炸出的油条有很重的氨气味,写出这 种情况下炸油条时矾与小苏打反应的离子方程式。
6-1 配合物[Ni(en)2]2+在丙酮中 333 K 回流 36 小时, 得到一种含 14 元环有一定对称性的有机配体,配体中所 有配位原子都在同一个环上,画出该配体与镍形成配合物 所有可能的结构。
6-2 邻氨基苯甲醛与 Ni2+生成了 16 元环的环状配合 物,该配合物具有 C4,请画出该配合物的结构。
(1)为什么四方反棱柱的配合物比立方体的同种配合 物稳定?
(2)试画出 MX6Y2(X、Y 为单齿配体,M 为中心体) 立方反棱柱有几种几何异构体?若 X, Y 看成球形,指出 各种异构体所属点群。
(3)一般来说,若某种分子的几何构型不存在对称面或 对称中心,那么这种几何构型一定存在旋光异构体。试判 断上面的立体异构体中,有几种存在旋光异构体?
6
清北学堂—刘奉岭老师
第9题
9-1 实验证实,Fe(CO)5 与乙炔在光照条件下生成了 新的络合物 A,其结构如
图。同时 Fe(CO)5 与乙炔 O
O
在光照条件下也生成了电
A 中 性 络 合 物 [(CO)2Fe(2 -
L)2Fe(CO)2],该配合物有
Fe (CO)3
对称中心、1 个二重旋转轴和 1 个镜面,没有 Fe-Fe 键,
为[NH3]的氨溶液中形成配位数从 1 到 n 的 n 种配合物, 用 K1, K2, ……, Kn 分别表示配合物的逐级平衡常数, M(NH3)、M(NH3)2、……、M(NH3)n 的总平衡常数表示为 β1=K1, β2=K1K2, ……, βn= K1K2……Kn,若溶液中金属离子 的分析浓度为 cM,试推求出溶液中各物种的平衡浓度[M]、 [M(NH3)]、[M(NH3)2]、……、[M(NH3)n];已知 Cd2+与 NH3 形 成 配 合 物 的 β1=447, β2=5.63×104, β3=1.55×106, β4=1.32×107 , 当 Cd2+ 的 分 析 浓 度 为 1.000 mol L-1, [NH3]=0.1 mol L-1, 求溶液中[Cd(NH3)2]2+、[Cd(NH3)4]2+ 的平衡浓度。
7
清北学堂—刘奉岭老师
第 11 题 画出[Mo2O4(C2O4)2(H2O)2]2-具有对称中心的可能结
构(Mo 是 6 配位的,用 O︵O 表示 C2O42-),要体现出钼之 间是否成键。
第 12 题 减压蒸馏不带结晶水的醋酸锌,得到一种结晶形的
中性配合物 X,配合物 X 具有 4 个三重旋转轴,写出生成 X 的方程式,用 O︵O 表示醋酸根,画出 X 的结构简图。
5
清北学堂—刘奉岭老师
性的?
8-3 有一种 AB 型碱金属盐的阴离子,含元素 N、C、
O、H 式量为 73.038,其质量分数分别为:N 38.36%, C
16.64%, O 43.81%。计算求出该阴离子的化学式,画出对
称性高的阴离子所对应的能量最低结构的三种共振式(带
形式电荷的需标出,孤对电子可以不画),并指出各种不
4
清北学堂—刘奉岭老师
90.00°。 7-1 该晶体属于什么晶系? 7-2 画出两种配体的结构简式。 7-3 写出配合物的化学式。 7-4 指出Cd的氧化数。 7-5 计算该晶体的密度。
第8题
氮是我们最熟悉的元素之一,在自然界中广泛存在,
在生物体内亦有重要作用,是组成氨基酸的基本元素之一。
氮在地壳中的含量很少,自然界中绝大部分的氮是以单质
NMe MeN
邻的 2 种元素 M1 和 M2 的单质在 N 乙二氨溶液中反应后生成离子化 合物 Y,Y 中相对原子质量较小的
N
N
N
Me Me
NMe MeN
M1 离子的最外层电子排布是 3s2。写出 M1 和 M2 的元素
符号及 M2 离子的最外层电子排布,并回答该穴状配体中
的 NMe 能否用 NH 代替,为什么?Y 是顺磁性还是抗磁
分子的形式存在于大气中。
8-1 肼及其衍生物是重要的高能材料。人们曾经制得
一种高能物质 A,该物质是肼的盐,其中的阴离子是 X2–。
制取 A 的过程是:将肼的硫酸盐与 BaX 在溶液中反应,
生成的产物经过滤后在 373K 通过真空蒸出杂质后得到。
A 由 3 种元素组成化学式量为 230.24, 其中 N、H 的质量
第 10 题 1939 年 J.L. Hoard 等 发 表 了 关 于 配 合 物
K4[Mo(CN)8]·2H2O 的经典论文,第一次证实了八配位配 合物的存在。用小黑点·表示 CN-离子,画出[Mo(CN)8]4中配位多面体的结构(将相邻配体用线连接起来,以显示 出配位多面体的结构);已知钼离子中的电子占据 dxy 轨道, 画出中心离子 d 轨道分裂的能级图,并标上 d 轨道的符号。
清北学堂—刘奉岭老师
化学竞赛练习题
第1题 某分子由 C、Cl、Zn 三种元素组成,其中 Zn 元素的
空间位置完全等价。分子中 C 处于由 6 个 Zn 组成的八面 体的中心;Zn 处于由 1 个 C 和 5 个 Cl 组成的八面体的中 心。
1-1 写出满足上述条件的分子的化学式; 1-2 分子的对称性与下列哪些分子相同:IF5,立方烷, 甲烷,XeF4,SF6 1-3 分子中有几种不同化学环境的原子?
