物理化学作业
物理化学练习题

物理化学练习题一、选择题:1. 下面哪个不属于正常气体状态方程?A. 理想气体状态方程B. 非理想气体状态方程C. 范德瓦尔斯方程D. 道立兹分子动力学理论方程2. 下列哪个是斯托克斯定律的表达式?A. F = -6πηrvB. F = -6πηvrC. F = 6πηvrD. F = -6πηrv^23. 下列何者不是溶解度的影响因素?A. 温度B. 压力C. 溶质性质D. 溶剂性质4. 下列物质溶解之后会发生水合反应的是?A. NaClB. HClC. NaOHD. CH3COOH5. 以下哪个量不是热力学函数?A. 温度B. 焓C. 熵D. 自由能二、填空题:1. 理想气体状态方程为________。
2. 理想气体的库仑定律表示为________。
3. 斯托克斯定律适用于流体中________颗粒。
4. 水的溶解度与温度成________关系。
5. 标准状态下,溶解度的浓度单位为________。
6. 水的化学式为________。
7. 热力学第一定律也被称为________定律。
8. 摩尔体积恒定的变化过程被称为________过程。
三、解答题:1. 请解释理想气体状态方程的含义,并列举实际应用的例子。
2. 描述斯托克斯定律并解释其适用条件。
3. 温度对溶解度的影响是如何体现的?请给出实例说明。
4. 简述热力学第一定律的意义和应用。
5. 选择一个物理化学实验,并解释其背后涉及到的物理化学概念和原理。
四、计算题:1. 以氧气为例,当温度为25℃,压力为1 atm时,若氧气的摩尔质量为32 g/mol,则求氧气的密度。
2. 已知一容器中含有100g的NaCl溶解在500 mL的水中,求NaCl在水中的摩尔浓度。
3. 已知某化学反应的ΔH为-100 kJ/mol,ΔS为-50 J/K,求该反应的ΔG,若温度为298 K。
以上就是物理化学练习题的题目。
请根据题目要求进行解答和计算,希望能够帮助你巩固和应用物理化学的知识。
物理化学习题集(离线必做)

浙江大学远程教育学院 《物理化学》课程作业(必做)姓名:学 号:年级:2014春药学学习中心:杭州学习中心—————————————————————————————第一章 热力学第一定律一、填空题1. △U=Q+W 适用于 宏观上静止且无外力场存在的封闭 系统。
2. △H=Q P 的适用条件是 封闭系统在非体积功为0且等压 。
3. 系统的性质分为广度性质和 强度性质 。
4. 水(101325Pa ,273.15K )在等温等压下凝结成冰(101325Pa ,273.15K )过程 的W 小于 零(填“小于”、“大于”或“等于” )。
二、简答题1. 什么是系统?什么是环境?答:将一部分物质从其他部分中划分出来,作为研究的对象,这一部分物质就称为系统; 系统之外与系统密切相关的部分称为环境。
2. 什么是热力学第一定律?答:将能量守恒与转化定律应用于宏观的热力学系统即为热力学第一定律。
三、计算题1. 1 mol 单原子理想气体在298K 时,分别按下列三种方式从15.00dm 3膨胀到40.00 dm 3: (1)自由膨胀; (2)等温可逆膨胀;(3)在恒定外压为终态压力下等温膨胀。
分别求上述三种过程的Q 、W 、ΔU 和ΔH 。
答:(1)自由膨胀;0)(0)(1212e ===V V V V p W -⨯--因为理想气体的热力学能和焓都只是温度的函数,而理想气体自由膨胀过程温度不变,所以:ΔU =ΔH =f (T )=0 (2)等温可逆膨胀;因为理想气体的热力学能和焓都只是温度的函数,所以等温过程ΔU=ΔH=0W=-nRTln(v2/v1)=-1x8.314x298ln(40/15)=-2430J Q=-w=2430J(3)在恒定外压为终态压力下等温膨胀。
ΔU=ΔH=0P=nRT/V=(1×8.314×298)/(40/1000)=61.94KPa W=-61.94 × (40-15) =-1548.5J Q=-w=1548.5J2. 已知298.2K 时,NaCl(s)、H 2SO 4(l)、Na 2SO 4 (s)和HCl(g)的标准摩尔生成焓分别为-411、-811.3、-1383和-92.3 kJ·mol -1,求下列反应2NaCl(s) + H 2SO 4(l) = Na 2SO 4(s) + 2HCl(g)在298.2K 时的△r H m ө。
材料物理化学作业-热力学第一定律

材料物理化学作业第一章 热力学第一定律1.某体系在压力101.3kPa 下,恒压可逆膨胀,体积增大5L ,计算所做的功。
2. 在300K 的常压下,2mol 的某固体物质完全升华过程的体积功为多少?3.2mol H 2在00C ,压力为101.3kPa 下恒压可逆膨胀至100L ,求W 、Q 、ΔU 、ΔH 。
4.计算1mol 铅由250C 加热到3000C 时所吸收的热。
已知铅的C p =23.55+9.74×10-3T/K J ·K -1·mol -15.1mol 单原子理想气体,温度为250C ,压力为101.3kPa ,经两种过程达到同一末态:Ⅰ、恒压加热,温度上升到12170C ,然后再经恒容降温到250C 。
Ⅱ、恒温可逆膨胀到20.26kPa 。
分别计算两个过程的W 、Q 、ΔU 和ΔH 。
6.已知250C 时下列反应的热效应:2Pb+O 2=2PbO ΔH 1=-438.56kJ ·mol -1 S+O 2=SO 2 ΔH 2=-296.90kJ ·mol -1 2SO 2+ O 2=2SO 3 ΔH 3=-197.72kJ ·mol -1 Pb+S+2O 2=PbSO 4 ΔH 4=-918.39kJ ·mol -1 求反应PbO+SO 3= PbSO 4的热效应。
7.已知250C 时下列反应的热效应:Ag 2O+2HCl (g )=2Agl+H 2O (l ) ΔH 1=-324.71kJ ·mol -12 Ag+21O 2= Ag 2O ΔH 2=-30.57kJ ·mol -1 21H 2+21Cl 2=HCl (g ) ΔH 3=-92.31kJ ·mol -1 H 2+21O 2= H 2O (l ) ΔH 4=-285.84kJ ·mol -1 求AgCl 的生成热。
《物理化学》课程作业(必做).doc

浙江大学远程教育学院 《物理化学》课程作业(必做)学 号: 学习中心:第一章热力学第一定律一、 填空题1. 系统的性质分为广度性质和 _________2. 热力学第_定律的数学表达式是__________________________ o3. 水从25°C 加热到35°C,水的热力学能 增人 ° (填"增大〃、"减小"或“不变〃)4. 理想气体在恒定外压下绝热膨胀,气体的焙 不变 ° (填“增大"、“减小"或“不变〃)5. AU=Q V 的适用条件是_____________________________ o6. 02(g )的的标准摩尔燃烧焙 等于 零(填“小于〃、"大于〃或"等于〃)。
二、 简答题1. 什么是系统?什么是环境?答:将一部分物质从其他部分中划分出来,作为研究对象,这 一部分物质就称为系统;系统之外与系统密切相关的部分称为环境。
2. 什么是等压过程?什么是可逆过程?答:等压过程是在环境压力恒定下,系统始,终态 压力相同且等于环境压力的过程。
某系统经过一•过程由状态1变为状态2 Z 后,如果能使系 统和环境都完全复原,则该过程称为可逆过程。
3. 什么是热力学第一定律?答:自然界的一切物质都具有能量,能量有多咱不同的形式, 能量可以从一种形式转化为另一种形式,能量的总量在转化过程中保持不变。
4. 什么是标准摩尔生成焰?什么是标准摩尔燃烧焰?答:在标准压力和指定温度下,由最稳定的单质生成lmol 物质的焙变,称为该物质的标准摩尔 生成焙。
在标准压力和指定温度下,lmol 物质完全燃烧的焙变,称为该物质的标准摩尔燃 烧焙。
5. Zn 与稀硫酸发生放热置换反应,请问在开口瓶屮进行还是在闭口瓶屮进行放热更多?为 什么?答:锌与稀硫酸,在开口吋,先接触空气,在与硫酸反应,2Zn+02+2H2S04=2ZnS04+2H20 在闭口时,直接与氢离子反应,Zn+H2S04=ZnS04+H2姓名: 年级:H20生成H2的反应吸热,所以,在闭口吋比在开口吋放出的热量多。
物理化学(作业集)

(1)可逆膨胀
根据熵判据,过程(1)是可逆过程
(2)真空膨胀
熵是状态函数,真空膨胀与过程1中可逆过程的始终态柑同,熵变也相同,因此
根据熵判据,过程(2)是不可逆过程。
2:在标准压力100 kPa和373 K时,把1.0 mol可逆压缩为液体,计算该过程的。已知该条件下水的蒸发热为,=,水蒸气可视为理想气体。
5:气体节流膨胀过程是恒_______过程。
答案
焓
6:“熵判据”的表达式是_______0。
答案
7:Gibbs函数在恒温条件下的压力系数=_______,恒压下的温度系数_______。
答案
V。一S
8:在绝热恒容容器中反应生成液态水,Q_______0,W_______0,_______0,_______0,_______0。(<,>,= )
答案
2:293K时,0. 50 kg水(A)中溶有甘露糖醇(B)该溶液的蒸汽压为2 322.4 Pa。已知这该温度时,纯水的蒸汽压为2 334. 5 Pa。求甘露糖醇的摩尔质量。
答案
代入数据,得
第四章测试题
一.填空题
1:封闭系统化学平衡的热力学条件为_______。
答案
2:的标准平衡常数为则的分解压p=_______。
先恒压加热
后恒温可逆膨胀
整个过程
2:1 mol水在及101 325 Pa下向真空蒸发变成及101 325 Pa的水蒸气,试计算此过程的,并判断此过程是否为自发过程。已知水在, 101 325 Pa下的。
答案
解该相变为不可逆相变,因为
经过分析知.,该不可逆相变与同条件下可逆相变的始终态相同,故可利用可逆相变计算该过程的熵变.
物理化学-第一章作业

or
W
p1(V2
V1 )
p1
(
nRT p2
nRT p1
)
nRT (1
p1 ) p2
1mol 8.314J mol1 K 1 300K (1 0.1105 Pa ) 0.25105 Pa
1.5103 J
Q W 1.5103 J
(2)
T'
p2V1
p2
nRT p1
p2 T
nR
nR
p1
W nRT nR(T T ' ) nR(T p2 T ) nRT (1 p2 )
9. 在定容条件下,加热氦气,起始体积为100 dm3,温度为
273 K,压力为标准压力,加热后压力增加至2倍标准压力,
试计算ΔU和ΔH
解
氦气为理想气体,且是定容过程,则pv=nRT,
Cv,m
3R 2
T2
p2 p1
T1
2 273K
546K
U
nCv,mT
100 103 Pa 100 103 m3 8.314J mol1 K 1 273K
解 题目中的过程是不可逆相变过程,
H2O(s, 273.2K ) H1 H2O(l, 273.2K ) H2 H2O(l, 373.2K ) H3 H2O(g, 373.2K )
H1 nH fus 1mol 6.002kJ mol 1 6.002kJ
H2 nCp,mT 1mol 75.3J mol1 K 1 (373.2 273.2)K 7.53kJ
mol 1
K 1 (673.2 373.2)K
1.4105 J
U Q W 5.7 105 J 1.4105 J 4.3105 J
物理化学练习题及答案

物理化学练习题及答案
以下是物理化学练题及其答案:
1. 已知氯气在0℃时密度比空气大
2.44倍,求氯气的摩尔质量。
答案:70.91 g/mol
2. 算出10mol一氧化碳和15mol氧气在完全燃烧下产生的水的
质量并写出反应式。
答案:反应式2CO + O2 → 2CO2;水的质量为180g。
3. 有一容积为1L的,温度为25℃,内装有SO2Dioxide,在标
准状况下浓度为1mol/L。
求体积为1L的内的SO2质量。
答案:64.07g
4. 已知非极性H2O2在正己烷中的溶解度为0.25 g/L,求该物
质在正己醇中的溶解度。
假设两种溶剂的体积相等。
答案:0.2 g/L
5. 已知分子式为C4H10的有机物A和分子式为C2H6O的有机物B在相同的条件下燃烧生成的CO2的质量之比为27:22,求A 和B的分子式。
答案:A为C4H10,B为C2H6O2。
6. 在65℃时,硫的三种同素异形体均匀自由某室温下倾斜的中慢慢流出。
它们的密度分别为1.96,2.07和2.30g/cm³。
问它们按照密度从小到大的顺序排列,应先流出的是哪一个?
答案:轻硫S8。
以上是物理化学练题及答案。
物理化学作业答案

物理化学作业答案第一章热力学第一定律一、判断题(正确打√,错误打×)1. 由于p和V都是状态函数,则pV也是状态函数。
(√ )2. 状态函数改变后,状态一定改变。
(√ )3. 孤立系统内发生的一切变化过程,其 U Δ必定为零。
(√ )4. 温度越高,Q值越大。
(×)5. 等压过程是指系统在变化过程中系统的压力等于环境的压力。
(×)6. 不做非体积功是指系统的始态和终态的体积相同。
(×)7. 在标准状态下,最稳定单质的焓值等于零。
(×)8. O2 (g)的标准摩尔燃烧焓等于零。
(√ )9. H2O(l)的标准摩尔燃烧焓等于零。
(√ )10. H2和O2在绝热钢瓶中发生反应的U △ 等于零。
(√)二、选择题(选1个答案)1. 是状态函数。
( A )A.G B.△U C.W D.Q2. 不是状态函数。
( D )A.H B.U C.S D.△G3. 具有广度性质。
( B )A.T B、U C.P D.ρ(密度)4. 具有强度性质。
( D )A.S B.V C.G D.η(粘度)5. 的标准摩尔生成焓等于零。
( A )A.C(石墨) B.C(金刚石) C.CO2 D.CO6.的标准摩尔燃烧焓等于零。
( C )A.C(石墨) B.C(金刚石) C.CO2 D.CO7. 理想气体在外压为 101.325kPa 下的等温膨胀,该过程的。
( A )A.Q>0 B.Q<0 C.△U>0 D.△U<08. 101.325kPa和 273.15K的水等温等压变为冰,该过程的。
( D )A.Q>0 B.△U=0 C.△H>0 D.△H<09. 下列叙述中不属于状态函数特征的是。
( C )A.系统变化时,状态函数的改变值只由系统的始、终态决定。
B.系统状态确定后,状态函数的值也确定。
C.状态函数均有加和性。
D.经循环过程,状态函数的值不变。
《物理化学(上)》作业

µ2; µ4 D. µ3>µ4=µ1>µ2
上述各状态化学势大小的顺序为 C. µ2<µ1=µ3<µ4
第 1 页 共 6 页 在您完成作业过程中,如有疑难,请登录学院网站“辅导答疑”栏目,与老师进行交流讨论!
12.设 NaCl 在水中完全电离,则 0.15mol·kg 为 1.86 K·kg·mol ) A. 272.6K A. 电解质 B. 273.2K B. 气体溶质 C. 挥发性溶质
《物理化学(上) 》作业
一.单选题 1.下列物理量中属于强度性质的是 A. H B. S C. p D. G 2.298.2K 时,1mol 的氧气(可视为理想气体)经等温可逆膨胀后,体积胀大 10 倍,对于该过程来说, 其ΔH 和 W 分别为 A. ΔH=0, W=0 C. ΔH=5708.6 J, W=-5708.6 J
Θ -1
B.ΔS = –108.78J·K , ΔG = 0 D.ΔS =0, ΔG = – 40.6kJ
-1
T, V, n j
i
B. (S/ni)
T, p, nji
C. (H/ni)S, p, nji
D. (µi/ni)T, p, nji
9.在恒温封闭的容器中有 a.b 两杯稀盐水溶液,盐的浓度分别为 ca 和 cb (ca>cb) ,放置足够长的时间 B. a 杯液体量减少,b 杯液体量增加 D. a.b 两杯中盐的浓度会同时增加 C.ΔmixF=0
Θ
10.在 298.2K, p 压力下, A.B 两种液体混合形成理想溶液,对于该混合过程下列关系正确的是 A.ΔmixH=0 11.设有下列各状态 373.2K.p 的 H2O(l) 373.2K.p 的 H2O(g) A. µ1>µ2=µ4>µ3
物理化学(第一章)作业及答案

每次物理化学作业及答案§1.1 热力学基本概念第一周(1) 练习1“任何系统无体积变化的过程就一定不对环境作功。
”这话对吗?为什么?答:不对,应该是无体积变化的过程,系统就一定不对环境作体积功。
系统和环境之间交换能量的方式,除体积功外,还有非体积功,如电功,表面功等.2“凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明之。
答:不正确。
系统的温度下降,内能降低,可以不放热给环境.例如: (13页例1-4) 绝热容器中的理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而转换为对外做的体积功.而温度不变时则系统既不吸热也不放热。
不对, 等温等压相变过程,温度不变,但需要吸热(或放热), 如一个大气压下,373.15K 下,水变成同温同压的水蒸汽的汽化过程,温度不变,但需要吸热。
3在一绝热容器中盛有水,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q或W大于、小于还是等于零?⑴以电热丝为系统Q<0; W>0;⑵以水为系统; Q>0;W=0;⑶以容器内所有物质为系统Q=0; W>0;⑷将容器内物质以及电源和其它一切有影响的物质看作整个系统。
Q=0;W=0.4在等压的条件下,将1mol理想气体加热使其温度升高1K,试证明所作功的数值为R。
证明:∵等压过程则P1=P2=P e∴W=-p(V2-V1)=-p[ nR(T+1)/p- nRT/p]= -p×(nR/p)= -R51mol理想气体,初态体积为25dm3,温度为373.2K,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm3时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50dm3时气体的平衡压力下,使气体膨胀到50dm3,然后再在外压等于体积为100dm3时气体的平衡压力下使气体膨胀到终态。
(4)在外压等于气体终态压力下进行膨胀。
天津大学《物理化学》在线作业一

《物理化学》在线作业一
一个大气压下,100℃的液态水蒸发为同温度的水蒸气,此过程系统的焓变△H ()。
A:大于零
B:小于零
C:等于零
D:小于等于零
参考选项:B
电泳现象说明( )。
A:分散介质带电
B:胶体粒子带电
C:胶体粒子带正电荷
D:胶体粒子处于等电状态
参考选项:B
某化学反应在恒压、绝热和只作体积功的条件下进行,系统温度由升高时,过程的焓变( )。
A:小于零
B:大于零
C:等于零
D:不能确定
参考选项:C
只考虑温度、压力两个因素对平衡的影响时,单组分系统可平衡共存的最多相数为()。
A:4
B:3
C:2
D:1
参考选项:B
一定温度下,液体的分子间作用力越大,其表面张力 ( )
A:越大
B:越小
C:与分子间作用力无关
D:可能大也可能小
参考选项:A
25℃时氮气、氢气、氧气和二氧化碳在水中的亨利系数分别为8.68 GPa、7.2 GPa、4.40 GPa和0.166 GPa。
则25℃、101.325 kPa下的上述气体,在水中溶解度最小的是:
1。
(完整版)物理化学作业答案

第二章 热力学第一定律2.11 1 mol 理想气体于27°C ,101.325kPa 的始态下,先受某恒定外压温压缩至平衡态,再恒容 升温至97.0°C ,250.0 kPa ,求过程的W ,Q , U , H,已知气体的C v,m =20.92J 。
mol -1•K -1。
解:111325.10115.3001V kPa p K T mol n ===−−→−=0dT 22215.3001V p K T moln ==−−→−=0dV 233300.25015.3701V V kPap K T moln ====因为23V V =,有3322T p T p=,kPa kPa T T p p 72.20215.37015.30000.2503232=⨯==02=WkJJ p pnRT p nRT p nRT V V p W 497.2)]1325.10172.202(15.300314.81[)1()(12111211221=-⨯⨯⨯=-=+-=--=所以 kJ W W W 497.221=+=()()()kJkJ W U Q kJ J T T R Cn T TnC H kJJ T T nC U mV mp m V 033.1497.2464.1(046.2)]15.30015.370()314.892.20(1[)(464.1)15.30015.370(92.201[13,13,13,-=-=-∆==-⨯+⨯=-+=-=∆=-⨯⨯=-=∆2.39 某双原子理想气体1 mol 从始态350K ,200kPa 经过如下五个不同过程达到各自的平衡态,求各过程的功W1) 恒温可逆膨胀到50kPa ;2) 恒温反抗50kPa 恒外压不可逆膨胀; 3) 恒温向真空膨胀到50kPa ; 4) 绝热可逆膨胀到50kPa ;5) 绝热反抗50kPa 恒外压不可逆膨胀; 解:(1)kJ J p p nRT W 034.4)20050ln 350314.81(ln12-=⨯⨯⨯== (2)kJj p nRTp nRT p V V p V p W 182.2)]200350314.8150350314.81(50[)()(1212-=⨯⨯-⨯⨯⨯=--=--=∆-=(3)0=amb p ,0=∆-=V p W amb(4)对绝热可逆过程:R C m p 5.3,=,R C m V 5.2,=()K K T p p T R R C R T m p 5.235]350)20050[()(5.3/1/12,=⨯=⨯= 因为Q=0,所以()()[]kJJ T T nC Q U W m V 380.23505.235314.85.21012,-=-⨯⨯⨯=--=-∆=(5)Q=0,所以 ()12,T T nC U Q U W m V -=∆=-∆=而 )(11222p nRT p nRT p V p W --=∆-= 联合上述二式可得)350(314.85.21350314.8120050314.8)1(22K T K T -⨯⨯=⨯⨯⨯+⨯- 解出 K T 2752=于是()()[]kJ J T T nC U W m V 559.13505.235314.85.2112,-=-⨯⨯⨯=-=∆= 第三章 热力学第二定律 3.1 卡诺热机在的高温热源和的低温热源间工作。
物理化学习题作业(下册)

Θ E Zn 2 + / Zn = E Zn 2 + / Zn −
RT 1 ln = −0.8792 (V ) 2 F a Zn 2 +
即到10 −4 mol ⋅ dm −3时,Zn的析出电势为 − 0.8792 V。
2 H + + 2e → H 2 ,
Θ EH + / H = EH + / H −
一、选择题(每题2分,共20分) 选择题(每题 分 分 1、用同一电导池分别测定浓度为0.01和0.1mol·kg-1的两个电解质溶液,其电 、用同一电导池分别测定浓度为 的两个电解质溶液, 和 的两个电解质溶液 阻分别为1000 和500 ,则它们的摩尔电导率比为( )。 则它们的摩尔电导率比为( 阻分别为 A、1:5 、 A、KCl 、 B、5:1 、 C、10:5 、 D、5:10 、 D、AlCl3 、 2、有4个浓度都是 、 个浓度都是0.01mol·kg-1的电解质溶液,其中 ±最大的是( ) 的电解质溶液,其中γ 最大的是( 个浓度都是 B、CaCl2 、 C、Na2SO4 、 3、已知EӨ(Fe3+,Fe2+)=0.771V,EӨ(Sn4+,Sn2+)=0.150V,则反应 、已知 , , 2Fe3++Sn2+=Sn4++2Fe2+在25℃时的为( )kJ·mol-1。 ℃时的为( A、-268.7 、 A、氢电极 、 B、-177.8 、 C、-119.9 、 D、119.9 、 )。 4、不能用于测定溶液pH值的电极是( 、不能用于测定溶液 值的电极是 值的电极是( B、醌氢醌电极 、 D、Ag,AgCl(s)︱Cl-电极 、 , ( ) 电极 5、二级反应的速率常数的单位是( 、二级反应的速率常数的单位是( A、s-1 、 B、dm6/(s·mol2) 、 ( )。 D、dm3/(s·mol) 、 ( ) C、s-1·mol-1 、
《物理化学》作业及复习题一及答案

《物理化学》作业及复习题一1. 热力学第一定律的数学表达式?在热化学中的两个形式及适用条件?△U=Q+W 封闭体系,恒温恒容,非体积功为零:△U=Q V 封闭体系,恒温恒压,非体积功为零:△H=Q p2. 热力学第二定律的数学表达式?在化学中的两个判据及适用条件?S (系统)+△S (环境)≥0封闭体系,恒温恒容,非体积功为零:△A ≤0 封闭体系,恒温恒压,非体积功为零:△G ≤03. 你学过哪些状态函数?哪些是容量性质?哪些是强度性质?焓、吉布斯函数和亥姆霍兹函数是如何定义的?T,V ,p,U,H,S,A,G V,U,H,S,A,G 是容量性质, T, p 是强度性质 H=U+pV A=U-TS G=H-TS4. 系统经绝热不可逆膨胀△S > 0,经绝热不可逆压缩△S .> 0,经绝热可逆膨胀或压缩△S .= 0。
5.A. △H>0, 且△S>0B. △H>0,且△S<0 D. △H<0,且△S<06. 欲使一过程的△A=0,应满足的条件是:A. 可逆绝热过程C. 恒温恒压且只作膨胀功的可逆过程 7. 实际气体经不可逆循环,则:A .△U=0,△H>0 B.△U>0,△H>0 C. △U=0, △H<0 8. 1mol 、25℃的液体苯在弹式量热计中完全燃烧,放热3264KJ ,则反应的恒压热是 Q p =Q V +RT △n .。
9. 270 K 、101.325 Kpa 时,1 molA. ΔS 系统+ΔS 环境 ≥ 0B. ΔS 系统+ΔS 环境 > 0 D. ΔS 系统+ΔS 环境 < 010. 某系统状态A 经不可逆过程到状态B ,再经可逆过程回到状态A ,则系统的亥姆霍兹函数ΔA = 0 。
11. 在绝热封闭条件下,体系的∆S 的数值可以直接用作过程方向性的判据, ∆S = 0 表示可逆过程;∆S > 0 表示 _不可逆过程_ ;∆S < 0 表示 _不存在或者违背热力学第二定律的过程_ 。
物理化学第二版作业答案

物理化学第二版作业答案IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】物理化学作业题答案第六章 相平衡思考题5.在含有氨的容器中氯化铵固体分解达平衡,43NH Cl(s)NH (g)HCl(g)+。
指出该系统的独立组分数、相数和自由度?答:反应中有三个物种,一个平衡限制条件,没有浓度限制条件。
所以独立组分数为2,相数为2,自由度为2。
习题解析3.3CaCO (s)在高温下分解为CaO(s)和2CO (g),根据相律解释下述实验事实。
(1) 在一定压力的2CO (g)中,将3CaCO (s)加热,实验证明在加热过程中,在一定的温度范围内3CaCO (s)不会分解。
(2) 在3CaCO (s)的分解过程中,若保持2CO (g)的压力恒定,实验证明达分解平衡时,温度有定值。
解:(1) 该系统中有两个物种,2CO (g)和3CaCO (s),所以物种数2S =。
在没有发生反应时,组分数2C =。
现在是一个固相和一个气相两相共存,2P =。
当2CO (g)的压力有定值时,根据相律,条件自由度*12121f C P =+-=+-=。
这个自由度就是温度,即在一定的温度范围内,可维持两相平衡共存不变,所以3CaCO (s)不会分解。
(2)该系统有三个物种,2CO (g),3CaCO (s)和CaO(s),所以物种数3S =。
有一个化学平衡,1R =。
没有浓度限制条件,因为产物不在同一个相,故2C =。
现在有三相共存(两个固相和一个气相),3P =。
若保持2CO (g)的压力恒定,条件自由度*12130f C P =+-=+-=。
也就是说,在保持2CO (g)的压力恒定时,温度不能发生变化,即3CaCO (s)的分解温度有定值。
5.结霜后的早晨冷而干燥,在-5℃,当大气中的水蒸气分压降至 Pa 时,霜会升华变为水蒸气吗若要使霜不升华,空气中水蒸气的分压要有多大?已知水的三相点的温度和压力分别为 K 和611 Pa ,水的摩尔气化焓1vap m 45.05 kJ mol H -∆=⋅,冰的摩尔融化焓1fus m 6.01 kJ mol H -∆=⋅。
物理化学相平衡作业 图片版
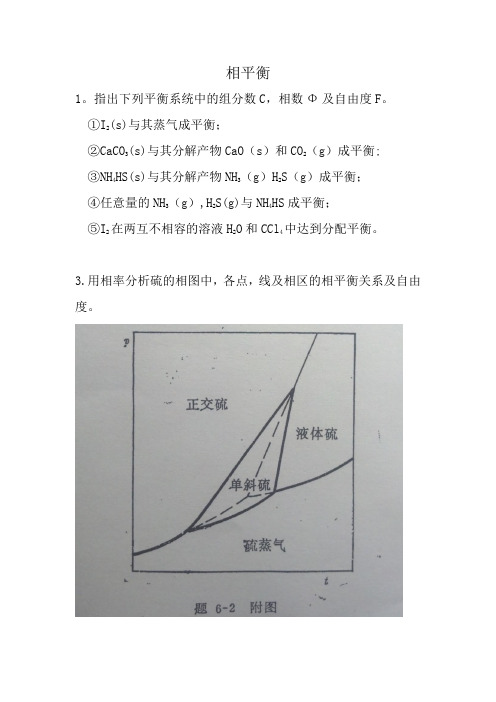
相平衡
1。
指出下列平衡系统中的组分数C,相数Φ及自由度F。
①I2(s)与其蒸气成平衡;
②CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;
③NH4HS(s)与其分解产物NH3(g)H2S(g)成平衡;
④任意量的NH3(g),H2S(g)与NH4HS成平衡;
⑤I2在两互不相容的溶液H2O和CCl4中达到分配平衡。
3.用相率分析硫的相图中,各点,线及相区的相平衡关系及自由度。
7.水异丁醇系统液相部分互溶,在101.325KPa下,系统的共沸点为89.7℃,气(G),液(l1),液(l2)三相平衡时的组成ω(异丁醇)依次为:70.0%,8.7%,85.0%,今有350g水和150g 异丁醇形成的系统在101.325KPa压力下,由室温加热,问:
①温度刚要达到其共沸点时,系统处于相平衡时存在哪些相?其质量各为多少?
②当温度由共沸点刚有上升趋势时,系统处相平衡时存在哪些相?其质量各为多少?
14.固态完全互溶,具有最高熔点的A-B二组分系统的相图如下,
指出各相点的相平衡关系,各条线的意义,a,b样品的冷却曲线。
18.二元凝聚系统Hg-Cd相图示意如附图,指出各个相区的稳定相和三相线上的相平衡关系。
16.某A-B二组分凝聚系统相图如下:
①指出个相区稳定存在时的相;
②指出图中的三相线,哪几个相成平衡,相平衡关系如何?
③绘出图中状态点为a,b,c三点样品的冷却曲线,并注明各阶段时的相变化。
20.A-B二元凝聚系统相图如下,标出图中各相区的稳定相,并
指出图中的三相线及三相平衡关系。
固体表面物理化学作业

5.举例说明固体在形成表面的过程中,一般采取什么方式来降低表面能量。
①优势暴露具有低表面自由能的表面,如原子最密排面。
②降低表面暴露面积,如形成球形表面。
③调整表面原子几何构型。
6.什么是表面弛豫与表面再构?作用结果如何?
表面弛豫:垂直表面方向以周期方式移动。
表面再构:晶体表面相中的原子排列和化学组成与体相不完全相同的现象。它与表面弛豫和表面吸附有关。
面心立方晶胞Face-centered cubic unit cell(fcc)
3.试计算fcc{111}的面间距。
dhkl=
故fcc(111)面的面间距d111= =a/√。
Pt{100}-(2x3)-O
①表层原子排列:
②矩阵表达式Pt- -O
1.举例说明造成固体表面非均匀性的因素。
平台、螺形位错、刃形位错、吸附原子、单原子高度台阶、褶皱、扭折、平台处空位、空位电子等。
2.写出立方晶胞三种点阵的中英文表达方式。
简单立方晶胞simple cubicunit cell(sc)
体心立方晶胞Body-Centered Cubic unit cell(bcc)
物理化学网上作业 1、2、3(中南大学)

物理化学1、2、3(一) 单选题1.对于不做非体积功的隔离系统,熵判据为()。
(D)2.恒温恒压下体系经一个不可逆循环过程后,以下对其U、H、S、G、A五个热力学函数的变化值描述正确的是((A)都为零)。
3.当5mol的H2(g)与4mol的Cl2(g)混合,最后生成2mol的HCl(g)。
若以下式为基本单元:(A) 1mol4.在298K时,H2O(l)的饱和蒸气压为1702Pa,0.6mol的不挥发溶质B溶于0.540kg的H2O(l)时,溶液的蒸气压比H2O(l)的饱和蒸气压降低42Pa,则该溶液中H2O的活度系数为()。
(D) 0.99485.盐碱地的农作物长势不良,甚至枯萎,其主要原因是()。
(D)水分从植物向土壤倒流6.热力学第三定律可以表示为()。
(B)在0K时,任何完整晶体的熵等于零7.在298K,下,苯和甲苯形成溶液。
第一份溶液体积为2dm3,苯的摩尔分数为0.25,苯的化学势为,则()。
(B)8.热力学基本关系式dG=-SdT+Vdp可适用于下列哪种情况()。
(B) 理想气体向真空膨胀9.欲测定有机物燃烧热Qp,一般使反应在氧弹中进行,实际测得热效应为QV,公式为()(B)生成物与反应物中气相物质的量之差10.在298K下,1mol理想气体等温膨胀,压力从1000kPa变到100kPa,系统Gibbs自由能变化值为()。
(D)-5.70kJ11.下列物理量中,不属于体系性质的是()。
(B)12.某纯物质体系的,当压力升高时其熔点将()。
(A)升高13.使用热力学判据判断某过程方向时,下表p表示()。
(B)体系总压14. 1mol的373K、标准压力下的液态水,经下列两个不同过程变成同温同压下的水蒸汽:⑴等温、等压可逆蒸发;⑵真空蒸发。
这两个过程中功和热的关系为()。
(A)15.下述说法,哪一个正确?()。
(C)水的生成焓即是氢气的燃烧焓1.某反应进行完全所需时间是有限的,且等于,则该反应是()(C)零级反应2.根据某一反应的值,下列何者不能确定?()(D)提高温度与反应速率的变化趋势3.破坏臭氧层的反应机理为在此机理中,NO是()(C)催化剂4.A、B两液体混合物在T-x图上出现最高点,则该混合物对拉乌尔定律产生()(B)负偏差5.298K下蔗糖水溶液与纯水到达渗透平衡时,整个体系的组元数C、相数条件自由度数为()(B)6.理想气体反应CO(g)+2H2(g)==CH3OH(g),若反应起始原料CO与H2的分子比为1:2,CO的平衡转化率为则()(B) 与p有关7.CuSO4与水可生成三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为()(B)2种8.下面关于化学动力学与化学热力学关系的表述中不正确的是()(C)化学动力学中不涉及状态函数问题9.某一物质X,在三相点时的温度是20℃,压力是200kPa。
物理化学作业答案

(2)25 ØC时
因此,
7.14250C时,电池Zn|ZnCl2(0.555mol kg-1)|AgCl(s)|Ag的电动势E=1.015V。已知,Eθ(Zn2+|Zn)=--0.7620V,Eθ(Cl-1|AgCl|Ag)=0.2222V,电池电动势的温度系数 。。
1)写出电池反应;
即
(2)计算100°C时反应的 ,需要知道反应的 。
由题给条件,25°C时
,所以 与温度无关,根据范特霍夫方程的积分式
代入数据,得
第六章相平衡
6.1指出下列平衡系统中的组分数C,相数P及自由度F。
1)I2(s)与其蒸气成平衡;
2)CaCO3(s)与其分解产物CaO(s)和CO2(g)成平衡;
3)NH4HS(s)放入一抽空的容器中,并与其分解产物NH3(g)和H2S(g)成平衡;
1)恒温可逆膨胀到50kPa;
2)恒温反抗50kPa恒外压不可逆膨胀;
3)恒温向真空膨胀到50kPa;
4)绝热可逆膨胀到50kPa;
5)绝热反抗50kPa恒外压不可逆膨胀;
解:(1)
(2)
(3) ,
(4)对绝热可逆过程: ,
因为Q=0,所以
(5)Q=0,所以
而
联合上述二式可得
解出
于是
第三章热力学第二定律
可知,
另由k的单位可知反应级数n=1
则由一级反应的速率:
得 时,分解率
(2)当T=303.15K, 时,由一级反应速率方程知:
进一步由 得,
所以
即保存温度不能超过13.31
解:为了防止毛细管内方液面上升,需抵抗掉附加压力 的作用,故需施加的压力的大小等于附加压力。
中国地质大学(北京)《物理化学》-在线作业一

地大《物理化学》在线作业一对于相律, 下面的陈述中正确的是A:相律不适用于有化学反应的多相系统B:影响相平衡的只有强度因素C:自由度为零意味着系统的状态不变D:平衡的各相中, 系统包含的每种物质都不缺少时相律才正确参考选项:B一单相体系, 如果有3 种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为A:3 个B:4 个C:5 个D:6 个参考选项:B由CaCO3(s), CaO(s), BaCO 3(s), BaO(s)及CO2(s)构成的平衡体系其自由度为A:F=2B:F=1C:F=0D:F= 3参考选项:C在标准压力下,100℃的液态水气化为100℃的水蒸汽,体系的熵变为:A:ΔS体> 0B:ΔS体< 0C:ΔS体= 0D:难以确定参考选项:A由于电极的极化,随着电流密度的增大()A:阴极电势升高,阳极电势降低B:电池的端电压增大C:电解池耗电能降低D:以上说法都不对参考选项:D对于低压混合气体的B组分,以下哪个表达式不对( )A:PBVB=nBRTB:PBV=nBRTC:PB/P=nB/ΣnBD:PB=PyB参考选项:A对热力学能的意义,下列说法中正确的是A:只有理想气体的热力学能是状态的单值函数B:对应于某一状态的热力学能是不可测定的C:当理想气体的状态改变时,热力学能一定改变D:体系的热力学能即为体系内分子之间的相互作用势能参考选项:B表面活性剂在结构上的特征是()A:一定具有磺酸基或高级脂肪烃基B:一定具有亲水基C:一定具有亲油基D:一定具有亲水基和憎水基参考选项:D任意的可逆循环过程,体系的熵变A:一定为零B:一定大于零C:一定为负D:是温度的函数参考选项:A半衰期与初始浓度无关的反应是()A:零级反应B:一级反应C:二级反应D:三级反应参考选项:B关于三相点下面的说法中不正确的是A:纯物质和多组分系统均有三相点B:三相点就是三条两相平衡线的交点C:三相点的温度可随压力改变D:三相点是纯物质的三个相平衡共存时温度和压力所决定的相点参考选项:A,B,C当用三角形坐标来表示三组分物系时,若某物系其组成在平行于底边BC的直线上变动时,则该物系的特点不包括A:B的百分含量不变B:A的百分含量不变C:C的百分含量不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学作业1(总1页)
--本页仅作为文档封面,使用时请直接删除即可--
--内页可以根据需求调整合适字体及大小--
2 物理化学作业
1、某实际气体的状态方程为2pV nRT p p αβ=++,式中α,β为常数,在等温下将物质的量为n 的气体从p 1压缩到p 2,试计算该气体的A ∆,G ∆。
2、取,3p θ⨯的氧气10升,反抗恒外压p θ进行绝热不可逆膨胀,求该过程的Q 、W 、U ∆、H ∆、S ∆、A ∆、G ∆,已知2O 在298K 时的规定熵为
20511J K mol --⋅⋅。
3、在308K 的10升密闭容器中盛有压力为的和一个内盛乙醚液体的薄玻球,现用振动运动击碎玻球,在等温下乙醚全部汽化,视气体为理想气体,试求该过程的熵变,并判断过程的方向性。
已知,308K 时乙醚的汽化热为1kJ mol -⋅,乙醚的正常沸点为308K 。
4、液态As 的蒸气压与温度的关系为
5665ln 20.30/a p p T K
=-+ 固态As 的蒸气压(升华平衡)与温度的关系为15999ln
29.76/a p p T K =-+ 试求As 的三相点(即气-固-液呈三相平衡共有一个蒸气压),并求此时的压力。
