第1章 分散系
第一章 第一节 第2课时 分散系及其分类 课时练 (含答案)—2023-2024学年(人教版20

第一章第一节第2课时分散系及其分类课时练(含答案)—2023-2024学年(人教版2023)高中化学必修1第2课时分散系及其分类题组一分散系1.下列关于分散系的说法不正确的是()A.所有的分散系都是混合物B.悬浊液中分散质颗粒不能透过滤纸C.碘酒这种分散系的溶质是酒精D.雾是小水滴的聚集体分散到大气中形成的分散系2.科学家曾在英国《自然》杂志上报道,他们用DNA制造出一种臂长7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。
下列分散系中的分散质的粒子直径和上述镊子的臂长具有相同数量级的是()A.溶液B.悬浊液C.胶体D.乳浊液3.(2022·重庆西南大学附中高一月考)按溶液、胶体、悬浊液的顺序排列正确的是()A.苏打水、鸡蛋清、有色玻璃B.碘酒、云、泥水C.白糖水、食盐水、汽水D.石灰乳、雾、油泼面汤题组二胶体的制备及性质4.在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色。
下列说法正确的是()A.用激光笔照射,会产生丁达尔效应B.将液体静置片刻,会出现沉淀现象C.所得胶体中分散质的粒子直径大于100 nmD.可用滤纸分离提纯得到氢氧化铁胶体5.下列现象或应用与胶体有关且说法正确的是()A.清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱B.向饱和氯化铁溶液中加入NaOH溶液,产生红褐色的Fe(OH)3沉淀C.向有污染的水中加入胶体,具有杀菌消毒的作用D.将Fe(OH)3胶体放置一段时间后,会出现浑浊6.(2022·四川巴州高一检测)下列关于胶体的叙述错误的是() A.病毒蛋白质分子的直径约为80 nm,在空气中可以形成气溶胶B.胶体和溶液的分散质均能透过滤纸C.纳米材料粒子直径在1~100 nm,因此纳米材料属于胶体D.自然界中云、雾、烟都是胶体7.(2022·河北武安第一中学高一月考)下列液体,不会产生丁达尔效应的分散系是()①稀牛奶②纯水③淀粉溶液④硫酸钠溶液⑤向沸水中滴入FeCl3饱和溶液形成红褐色液体⑥肥皂水A.②④ B.③④ C.②④⑥ D.④8.下列关于三种分散系的说法正确的是()A.胶体不均一、不稳定、静置后产生沉淀;溶液均一、稳定,静置后不产生沉淀B.胶体与悬浊液的本质区别是胶体是均一、透明的,而悬浊液是浑浊的C.光线通过时,胶体产生丁达尔效应,溶液不能产生丁达尔效应D.实验室可用FeCl3饱和溶液和NaOH溶液混合制备Fe(OH)3胶体9.(2023·成都高一期末)下列有关分散系的说法不正确的是() A.乳浊液和悬浊液都属于浊液,它们的分散质粒子的直径均大于100 nmB.直接加热氯化铁饱和溶液制取Fe(OH)3胶体C.按照分散剂的不同,胶体可分为液溶胶、气溶胶和固溶胶D.可用丁达尔效应区分CuSO4溶液和Fe(OH)3胶体10.(2022·上海高一开学考试)下列分散系最不稳定的是()A.向NaOH溶液中通入CO2得到的无色溶液B.向CuSO4溶液中加入NaOH溶液得到的分散系C.向沸水中逐滴滴入FeCl3饱和溶液得到的红褐色液体D.向Fe(OH)3固体中加入盐酸得到的棕黄色液体11.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9 m)恢复了磁性。
高中化学 必修第一册 第1章 第1节 第2课时 分散系及其分类
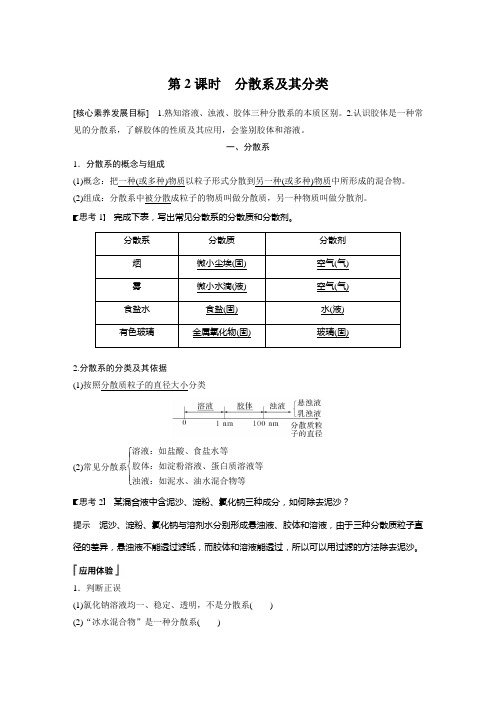
第2课时 分散系及其分类[核心素养发展目标] 1.熟知溶液、浊液、胶体三种分散系的本质区别。
2.认识胶体是一种常见的分散系,了解胶体的性质及其应用,会鉴别胶体和溶液。
一、分散系1.分散系的概念与组成(1)概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
思考1 完成下表,写出常见分散系的分散质和分散剂。
分散系分散质 分散剂 烟微小尘埃(固) 空气(气) 雾微小水滴(液) 空气(气) 食盐水食盐(固) 水(液) 有色玻璃金属氧化物(固) 玻璃(固)2.分散系的分类及其依据(1)按照分散质粒子的直径大小分类(2)常见分散系⎩⎪⎨⎪⎧ 溶液:如盐酸、食盐水等胶体:如淀粉溶液、蛋白质溶液等浊液:如泥水、油水混合物等思考2 某混合液中含泥沙、淀粉、氯化钠三种成分,如何除去泥沙?提示 泥沙、淀粉、氯化钠与溶剂水分别形成悬浊液、胶体和溶液,由于三种分散质粒子直径的差异,悬浊液不能透过滤纸,而胶体和溶液能透过,所以可以用过滤的方法除去泥沙。
1.判断正误(1)氯化钠溶液均一、稳定、透明,不是分散系( )(2)“冰水混合物”是一种分散系( )(3)分散系有的是纯净物,有的是混合物( )(4)分散系可以是固态、液态或气态( )(5)油水混合物属于乳浊液( )答案 (1)× (2)× (3)× (4)√ (5)√2.溶液、胶体和浊液三种分散系的本质区别是( )A .是否是大量分子或离子的集合体B .是否能通过滤纸C .分散质粒子直径的大小D .是否均一、透明、稳定答案 C解析 溶液、胶体和浊液三种分散系的本质区别在于分散质粒子直径的大小。
二、胶体1.胶体的树状分类思考1 (1)Fe(OH)3胶体中的分散质粒子与淀粉溶液中分散质粒子在组成上有什么区别? 提示 Fe(OH)3胶体中的分散质粒子是Fe(OH)3集合体,而淀粉胶体中一个淀粉分子就是一个分散质粒子。
第一章 物质的聚集状态

时,二者数值近似相等。
27
1.4 稀溶液的通性
稀溶液:溶剂与溶质分子之间、溶质分子之间没 有相互作用的溶液,为一种理想化的溶液模型。 稀溶液的通性:
在难挥发的非电解质稀溶液中,溶液的某些性质仅与 溶剂中溶质的独立质点数相关,而与溶质本身的性质无关, 如溶液的蒸气压、沸点、凝固点和渗透压等,这类性质称 为稀溶液的通性或依数性。包括:蒸气压下降、沸点升高、 凝固点降低和渗透压现象。
M x[M (C) M (H)] x (12.0g mol1 1.01g mol1 )
解得:x = 6,该化合物的分子式为C6H6。
10
1.2.2 分压定律
道尔顿理想气体分压定律 理想气体混合物中的各组分气体均 充满整个容器,混合气体中任一组 分的分压与该组分气体在相同温度 约翰· 道尔顿(1766下独占整个容器所产生的压力相同, 1844 ) 英国化学家、物理学家、 而总压力p等于混合体系中各组分 近代化学之父。 气体的分压之和。
28
1.4.1 溶液蒸汽压的下降
液体的蒸发
一定温度下,敞口容 器中液体将不断蒸发 至没有液体留下。 一定温度下,密 闭容器中的液体 随着蒸发进行, 最终将达到液体 蒸发与气体凝结 的动态平衡状态, 蒸气压力不再变 化。
a 敞口容器
b 密闭容器中
液体的饱和蒸汽压 在一定温度下,液体与其蒸气平衡时 的蒸气压力为该温度下的液体的饱和蒸气压,简称蒸气压。
26
物质的量浓度与质量摩尔浓度:
nB nB nB cB V m/ m
i)两组分溶液,溶质B含量较少时:
nB nB nB cB bB m mA mB mA
(1-9)
ii) 稀薄水溶液中: 当cB的单位为mol L-1,bB的单位为mol kg-1
第一章 气体、溶液和胶体分散系

第一章 气体、溶液和胶体分散系5. 正常人血浆中Ca 2+和HCO 3-的浓度分别是2.5 mmol·L -1和27 mmol·L -1,化验测得某病人血浆中Ca 2+和HCO 3-的质量浓度分别是300 mg·L -1和1.0 mg·L -1。
试通过计算判断该病人血浆中这两种离子的浓度是否正常。
解:该病人血浆中Ca 2+ 和HCO 3-的浓度分别为11-1222L mmol 5.7mmolmg 40L mg 003 )(Ca )(Ca )(Ca --+++⋅=⋅⋅==M c ρ121-1-3-3-3L mmol 106.1mmol mg 61L mg .01 )(HCO )(HCO )(HCO ---⋅⨯=⋅⋅==M c ρ该病人血浆中Ca 2+和HCO 3-的浓度均不正常。
7. 某患者需补充0.050 mol Na +,应补充多少克NaCl 晶体? 如果采用生理盐水(质量浓度为9 g·L -1) 进行补Na +,需要多少毫升生理盐水?解:应补NaCl 晶体的质量为m (NaCl) = n (NaCl) · M (NaCl) = n (Na +) · M (NaCl)= 0.050 mol ×58.5 g·mol -1 = 2.93 g所需生理盐水的体积为mL 325L 325.0L g 9mol g 58.5mol 0.050)NaCl (11-==⋅⋅⨯==-盐水盐水ρm V16.从某种植物中分离出一种结构未知的有抗白血球增多症的生物碱, 为了测定其摩尔质量,将19.0 g 该物质溶入100 g 水中,测得溶液的凝固点降低了0.220 K 。
计算该生物碱的摩尔质量。
解:该生物碱的摩尔质量为f A Bf B T m m k M ∆⋅⋅= 1331molg 106.1K0.220kg 10100g 0.19mol kg K 86.1---⋅⨯=⨯⨯⨯⋅⋅=19. 蛙肌细胞内液的渗透浓度为240 mmol·L -1, 若把蛙肌细胞分别置于质量浓度分别为10 g·L -1,7 g·L -1和3 g·L -1 NaCl 溶液中,将各呈什么形态?解:10 g·L -1,7 g·L -1和 3 g·L -1 NaCl 溶液的渗透浓度分别为 1111os1L mmol 342L mol 0.342mol g 58.5L g 102(NaCl)----⋅=⋅=⋅⋅⨯=c1111os2L mmol 402 L mol 0.240mol g 58.5L g 72(NaCl)----⋅=⋅=⋅⋅⨯=c1111os3L mmol 031L mol 0.103mol g 58.5L g 32(NaCl)----⋅=⋅=⋅⋅⨯=c 与蛙肌细胞内液相比较,10 g·L -1,7 g·L -1 和3 g·L -1 NaCl 溶液分别为高渗、等渗和低渗溶液。
第一章溶液和胶体

Van’t Hoff (范特霍夫)
V nRT
cRT bRT
:渗透压;V:溶液体积; T: 热力学温度; n: 溶质物质的量; c:物质的量浓度; R:气体常数; R = 8.314 J ·mol-1 ·K-1
▪ 渗透压平衡与生命过程的密切关系
①人的营养循环; ② 植物的生长; ③给患者输液的浓度。水主分要在依小靠肠营的养吸素收吸
(374℃) 。即高于647.35K水只能以气态的形式存在, 再加多大外压气体也不能液化。所以647.35K和221Pa是 气-液平衡曲线的顶端。就是水的临界状态。临界状态是气液 共存的一种边缘状态。 8、超临界流体
处于超过物质本身的临界温度和临界压力状态时的流体。 特点:密度接近于液体,溶解度高,黏度、扩散系数接近于气 体,扩散速率快,容易实现快速分离。
二、稀溶液的依数性
1、 蒸气压下降(核心) (1)液体的饱和蒸气压(简称蒸气压) 蒸发:在液体表面,超过平均动能的分子克服邻 近分子的吸引进入气相中的过程。 凝聚:在一密闭容器中,在不断蒸发的同时,部 分蒸气分子又会重新回到液体的过程。 饱和蒸气:一定温度,在密闭容器中,当蒸发与 凝聚达到平衡时液面上的蒸气。 饱和蒸气压:由饱和蒸气产生的压强。 蒸气压只与液体本质和温度有关。不决定于液体 或蒸气的体积。
Δp: 纯溶剂蒸气压与稀溶液蒸气压之差。
对于稀溶液,溶剂物质的量nA 远远大于溶质物质 的量nB ,即nA nB
X B nB (/ nB nA ) nB / nA
设溶液的浓度以1000g溶剂(水)中含的溶质物质的
量nB为单位,则溶液的质量摩尔浓度b为: b = nB(mol ∙ kg-1)
相的概念
系统中物理性质和化学 性质完全相同的且与其他部 分有明确界面分隔开来的任 何均匀部分,叫做相。
人教版高一化学必修1同步练习第一章第一节分散系及其分类

(2)第一章第一节课时2分散系及其分类1、下列分散系中分散质的粒子直径最大的是( )A.蔗糖溶液B.少量植物油和水的混合物Fe(OH)胶体C.3D.硫酸溶液2、下列分散系属于悬浊液的是( )A.牛奶B.蔗糖溶液C.泥浆水D.氢氧化铁胶体3、将少量下列选项中的物质加入10mL水中,能形成均一、稳定、透明的分散系的是( )FeCl溶液A.蔗糖B.植物油C.硫酸钡D.NaOH溶液和34、下列关于分散系的说法不正确的是( )A.分散系的稳定性:溶液>胶体>浊液B.分散质粒子的大小:溶液>胶体>浊液C.分散质粒子的直径为几纳米或几十纳米的分散系是胶体D.可以用过滤的方法将悬浊液中的分散质从分散剂中分离出来5、下列说法正确的是( )A.胶体区别于其他分散系的本质特征是有丁达尔效应B.向浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体C.Fe(OH)3胶体属于介稳体系D.Fe3+、H+、Cl-在Fe(OH)3胶体中可以大量共存6、下列有关说法正确的是()A.氯化钠溶液均一稳定透明,不是分散系B.冰水混合物是一种分散系C.分散系有的是纯净物有的是混合物D.分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合有9种方式7、“纳米材料”是粒子直径为1-100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液②是胶体③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥静置后,会析出黑色沉淀A.①④⑥B.②③④C.②③⑤D.①③④⑥8、下列叙述正确的是( )A.直径在1~100nm之间的粒子称为胶体B.胶体是带电的C.利用丁达尔效应可以区分溶液与胶体D.胶体粒子很小,可以透过半透膜9、下列说法正确的是( )A.溶液不一定是混合物B.同种分子构成的物质一定是纯净物C.混合物一定由两种或两种以上的元素组成D.含有氧元素的化合物都是氧化物10、淀粉溶液是一种胶体,已知淀粉遇碘变蓝色。
第一章 溶液和胶体分散系

第一章溶液和胶体分散系一、填空题1,难挥发非电解质稀溶液在不断沸腾时,它的沸点______;而在冷却时,它的凝固点______。
2,用半透膜将渗透浓度不同的两种溶液隔开,水分子的渗透方向是______。
3,将红细胞放入低渗溶液中,红细胞______;将红细胞放入高渗溶液中,红细胞______。
4,质量浓度相同的葡萄糖(C6H12O6)、蔗糖(C12H22O11)和NaCl溶液,在降温过程中,最先结冰的是______,最后结冰的是______。
5,产生渗透现象的两个必要条件是______和______。
6,液体的蒸发是一种______过程,所以液体的蒸气压随温度的升高而______。
当温度升高到液体的蒸气压等于外界大气压力时,此温度称为该液体的______。
7,将两根胡萝卜分别放在甲、乙两个量筒中,在甲中倒入浓盐水,在乙中倒入纯水。
由于渗透作用,量筒甲中的胡萝卜将______,而量筒乙中的胡萝卜将______。
二、是非题1,液体的蒸气压与液体的体积有关,液体的体积越大,其蒸气压就越大。
2,通常所说的沸点是指液体的蒸气压等于101.325 kPa时的温度。
3,电解质的聚沉值越大,它对溶胶的聚沉能力越大。
4,难挥发非电解质的水溶液在沸腾时,溶液的沸点逐渐升高。
5,当渗透达到平衡时,半透膜两侧溶液的渗透浓度一定相等。
6,两种溶液相比较,渗透压力比较高的溶液,其物质的量浓度也一定比较大。
7,由于血浆中小分子物质的质量浓度低于大分子物质的质量浓度,所以血浆中晶体渗透压力也低于胶体渗透压力。
8,由于乙醇比水易挥发,因此在室温下,乙醇的蒸气压大于水的蒸气压。
9,0.1 mol·L-1葡萄糖溶液与0.1 mol·L-1甘油溶液的凝固点和沸点均相等。
10,将相同质量的葡萄糖和甘油分别溶解在100 g水中,所得两种溶液的蒸气压相等。
三、问答题1,什么叫渗透现象?产生渗透现象的条件是什么?2,什么叫分散系、分散相和分散介质?3,按分散相粒子的大小,可把分散系分为哪几类?4,难挥发非电解质稀溶液在不断的沸腾过程中,它的沸点是否恒定?四、计算题1,将3.42 g蔗糖(C12H22O11,M = 342 g·mol-1 )溶于100 g水中,已知水的凝固点降低系数k f = 1.86 K· kg·mol-1,试计算此蔗糖溶液的凝固点。
新人教高中化学必修1讲义03 第一章第一节第3讲 分散系及胶体

第一章物质及其变化第一节物质的分类及转化第3讲分散系及其分类【讲】知识点1分散系1.分散系的概念与组成(1)概念:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:分散系中被分散成粒子的物质叫做分散质,另一种物质叫做分散剂。
(3)常见分散系及其组成2.分散系的分类及其依据①溶液、浊液、胶体三种分散系本质的区别是粒子直径大小②分散系都是混合物【练】1、下列分散系中,分散质微粒直径最大的是()A.新制氢氧化铜悬浊液B.淀粉溶液C.氢氧化钠溶液D.豆浆答案:A。
解析:A为浊液,B、D为胶体,C为溶液,答案选A。
2、下列关于硫酸铜溶液和泥水的说法中不正确的是()A.都是混合物B.都是分散系C.分散剂相同D.分散质粒子相同答案:D。
解析:硫酸铜溶液和泥水两种分散系都是混合物,它们的分散剂都是水,但分散质粒子不同,硫酸铜溶液的分散质粒子是铜离子和硫酸根离子,泥水(悬浊液)的分散质粒子是固体小颗粒。
3、下列物质不属于分散系的是()A.食盐水B.酒精C.盐酸D.泥浆答案:B。
解析:酒精是乙醇的俗名,是纯净物。
知识点2 胶体1.胶体:分散质粒子直径在 之间的分散系是胶体2.常见胶体:氢氧化铁胶体、氢氧化铝胶体、鸡蛋清、淀粉胶体、血液、墨水、硅酸胶体 、 蛋白质胶体、豆浆、墨水、云、烟、雾、有色玻璃等 3胶体的分类根据分散剂的状态分类⎩⎨⎧气溶胶:如烟、云、雾液溶胶:如豆浆、稀牛奶固溶胶:如烟水晶、有色玻璃4氢氧化铁胶体的制备①实验操作:在小烧杯中加入40 mL 蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热,即可得到氢氧化铁胶体。
②反应原理:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
Fe(OH)3胶体不能写成“Fe(OH)3↓”。
注意事项:①实验操作中,必须选用氯化铁饱和溶液而不能用氯化铁稀溶液。
若氯化铁溶液浓度过低,则不利于氢氧化铁胶体的形成②向沸水中滴加FeCl 3饱和溶液,而不是直接加热煮沸FeCl 3饱和溶液,否则会因溶液浓度过大直接生成Fe(OH)3沉淀而无法得到Fe(OH)3胶体③实验中必须用蒸馏水,而不能用自来水。
人教版高一化学必修第一册教学设计 第一章 第一节 第二课时《分散系及其分类》

《分散系及其分类》教学设计一、教材分析本节课在新人教版教材中位于第一章“物质及其变化”的第一节“物质的分类及转化”。
分散系的概念既承接了初中关于溶液、浊液的相关知识,也是对上节课中“物质的分类”的进一步细化。
胶体作为一类重要的分散系,在生产生活中有着重要的应用。
对胶体相关知识的学习有助于学生完善认知结构,体会化学的实用价值,并在学习的过程中发展多方面的素养。
与旧人教版相比,新人教版删除了从状态角度对分散系的划分(9种分散系),改为讨论胶体的分类,避免了旧教材中的分散系分类矛盾。
新教材还将胶体的介稳性、电泳、聚沉等拓展部分删除,只保留了最核心的内容。
二、学情分析通过本节教材第一课时的学习初步把握了简单的分类方法及其应用,知道溶液和浊液属于混合物,但还没有从分散系的角度对混合物进行分类。
在生活中,已经接触过很多的分散系、胶体的实例,初中物理中学过光的散射,为丁达尔效应的理解打下了基础。
学习过氢氧化铁是一种沉淀,难以理解胶体这种存在状态。
胶体知识与学生以前所学的知识有所不同,它研究的不是某种物质所特有的性质,而是物质的聚集状态所表现出来的性质。
这对学生而言是一个较为陌生的领域,是学生通过分类思想来研究物质、观察物质新的切入点。
三、素养目标【教学目标】1、认识胶体是一种分散系及胶体的性质。
2、能根据牛奶及其他物质的丁达尔效应进行推理、归纳,形成初步结论。
3、能利用胶体知识解释生活中的现象,解决生活中的实际问题。
【评价目标】1、通过对牛奶的认识过程,诊断并发展学生对分散系和胶体的系统认识水平。
2、通过对牛奶除杂实验设计,诊断并发展学生的分析推理水平以及概念归纳水平。
3、通过对牛奶的全面认识的讨论,诊断并发展学生对化学学科价值的认识水平。
四、教学重点、难点1、教学重点:分散系的概念及分类;胶体的丁达尔效应2、教学难点:对胶体的概念和性质的理解五、教学方法1、讲授法(牛奶的历史)2、探究法(牛奶的探究)3、实验法(氢氧化铁胶体的制备、丁达尔效应)4、任务驱动法(去除牛奶中的乳糖)六、教学设计思路本节课以牛奶的探究为情境,首先通过对牛奶是混合物的初步认识,自然引出分散系的概念;接着对稀牛奶丁达尔现象的剖析,完善分散系的分类以及胶体的定义,通过氢氧化铁胶体的制备,加深理解胶体的存在状态,并利用分类思想对胶体进行分类;最后,引导学生设计除去牛奶中乳糖的方法,把本节课所学知识拓展应用于解决生活实际问题。
人教版高一化学必修一第一章分散系及其分类练习题(含答案)

A. 是盐B. 是酸
C. 是电解质D. 是化合物
6.“纳米材料”(1nm=10-9m)是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,得到的分散系为
B.二者不发生反应,故无法证明质量守恒,故B不符合;
C.有空气中的氧气参与,无法称量参与反应的氧气的的质量,故无法证明质量守恒,故C不符合;
D.铁与硫酸铜反应生成铜和硫酸亚铁,可证明质量守恒,故D符合;
答案为D。
3.A
【详解】A.水是纯净物,不属于分散系,故A符合题意;
B.碘酒是碘的乙醇溶液,属于分散系,故B不符合题意;
C.不能与盐酸反应D.一定是浊液
2.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的的是
A. B.
C. D.
3.下列物质不属于分散系的是
A.水B.碘酒C.空气D.有色玻璃
4.分类学习是我们掌握知识的重要方法。下列属于碱的是
A.NH3B.NaHCO3C.Ca(OH)2D.Cu2(OH)2CO3
⑨水的化学式为H2O,属于氧化物;
⑩碳酸钠的化学式为Na2ቤተ መጻሕፍቲ ባይዱO3,属于盐类;
(1)属于混合物的有①⑤;
(2)属于单质的有②⑦;属于盐类的有⑧⑩;
(3)属于氧化物的有③⑥⑨;属于溶液的有⑤;
(4)属于有机物的是④。
11.B丁达尔效应NaCl溶液渗析电解质氯化铁使血液中蛋白质胶体聚沉电泳
【详解】(1)分散质微粒直径在1-100nm之间的分散系属于胶体。将微粒直径为几纳米到几十纳米的材料分散到液体分散剂中,由分散质的直径在1~100nm之间,可知该分散系属于胶体,其具有胶体的性质。胶体的分散质微粒较大,不能透过半透膜,但能透过滤纸。胶体都能产生丁达尔效应。胶体较稳定,不会分层。综上所述B符合题意,故选B;
基础化学第一章 溶液 第一节 分散系 ppt课件

分散相
液 固 气
气 液 固
气 液 固
分散介质 名称
实例
气
液气溶胶 云、雾
气
固气溶胶 烟、粉尘、沙尘暴
气
气气溶胶 空气、混合气体
液
泡沫
汽水、泡沫、肥皂
液
乳状液 牛奶、含水原油
液
溶胶
油墨、泥浆、卤化银溶胶
固
固体泡沫 馒头、沸石、泡沫塑料
固
固体乳剂 珍珠、肉冻
固
基础固化学体第一悬章 浮溶液剂第一节 合分散金、有色玻璃
稳定
不稳定
电子显微镜不可见 超显微镜可观察其存在 一般显微镜可见
能透过半透膜
能透过滤纸, 不能透过半透膜
不能透过滤纸
单相体系 基础化学第一章 溶液 第一节 分散 多相体系
6
系
第一节 分散系
一、分散系的概念
• 体系:被划分出来作为研究对象的一部分 物质或空间
• 相:体系中物理性质和化学性质完全相同 的均匀部分
• 均相体系:只含有一个相的体系 纯水、生理盐水
• 非均相体系:含有两个或两个以上相的体 系 水、冰水、水蒸气共存体系
基础化学第一章 溶液 第一节 分散
1
系
分散系
一种物质(或几种物质) 分散到另一种物质里所形成的混合物。 分散质:被分散成微粒的物质。
分类 分子或离子分散系
粗分散系
胶体分散系
粒子直径
<1nm
>100nm
1nm –100nm
分散相 分散系 是否均相 稳定性
分子或离子
固体
液体
分子、离 高分子化 子或原子 合物
真溶液
悬浊液 乳浊液
溶胶
普通化学赵士铎 第三版课后习题答案

低温自发 任意温度均自发
高温自发 任意温度均不可能自发
2.9 (2)(反应为气体物质的量增加的过程,rSm>0)
2.10 不可以。因为物质的 Sm ,不是指由参考状态的元素生成该物质(B=+1)反应的标准 摩尔熵。
2.11 H: G: S:
-40 kJ
-38kJ -6.7JK-1
-40 kJ
-38 kJ -6.7 JK-1
反应在标准状态, 任意温度均自发 2.14 (略)
2.15 2AsH3(g)=2As(s)+3H2(g) rHm(298K)=-132.8kJmol-1<0 rSm(298K)=15.71Jmol-1K-1<0
标准状态, 任意温度下 AsH3 的分解反应均自发。加热的目的是加快反应速率。
4
第三章 化学平衡原理
1.92 10-4 2
mol L1
s1
(1) /(2)得: (0.200mol L1 )m 4.8 105 mol L1 s1
0.400mol L1
1.92 104 mol L1 s1
m2
k
4.8 105 mol L1 s1 / 2 6.0 104 mol-1 L s1
2.12 Sn(白锡)= Sn(灰锡) rHm(298K)= fHm(灰锡)+(-1)fHm(白锡)=-2.1kJmol-1<0 rSm(298K)= Sm(灰锡)-Sm(白锡)=-7.41Jmol-1K-1<0 反应在标准状态,低温自发。在转变温度,rGm(T)=0 rGm(T)rHm(298K)-TrSm(298K) T[rHm(298K)/ rSm(298K)] 283K
故: c(O2,aq) = 2.88×10-4 mol·L-1 (2) K = 85.5/1.37×10-3 = 6.24×104
第一章 物质的聚集状态

式中nB表示溶液中溶质B的物质的量,其SI单位为mol;V为 溶液的体积,其SI单位为m3,在分析化学中,体积的常用单 位为L或mL;浓度cB常用单位为mol/L。
分散质
分散剂
实 例
气 液 固 气 液 固 气 液 固
气 气 气 液 液 液 固 固 固
空气 云、雾 烟灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙) 有色玻璃、合金
液态分散系(分散介质是液态)
分散相粒 子直径 /nm <1 分散系类型 分散相 主要性质 实例
低分子或离子分 散系 胶 体 分 散 系 粗 分 散 系 高分子溶液
611
T/K
从图中可以看出,
1) 随着温度的升高,水,水溶液,冰的饱和蒸气压都升高。
其中冰的曲线斜率大,随温度变化显著。 2) 同一温度,水溶液的饱和蒸气压低于水的饱和蒸气压。
p/Pa 1.013 10
611
5
A B
l1
l2 A′
l3
B′ T2 273 373 T1 T/K
3) 373 K时,水的饱和蒸气压等于外界大气压强,如图中 A 点,故 373 K 是水的沸点。大气压强 1.013 10 5 Pa 。
若 p 固 > p 液, p 固 < p 液, 饱和蒸气压图
则平物质的饱和蒸气压 p,对温度 T 做图,即得到物质饱和蒸气
压图。下面是水,水溶液,冰体系的饱和蒸气压图。
p/Pa 1.013 10 5 A
2分散系及其分类讲义人教版2019高中化学必修一知识点+习题+作业

第一章物质及其变化第一节知识点二分散系及其分类1.分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2.分散质:分散系中分散成粒子的物质。
3.分散剂:分散质分散在其中的物质。
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm -100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。
-溶液分散质]八班万「心粒子胶体:分子胶体…,、—分散系>胶体> 4分散剂」:气溶胶;液溶胶;固溶狡、心户1悬浊液―浊液f[乳浊液注意:三种分散系的本质区别:分散质粒子的大小不同。
【习题】1.据中央电视台报道,近年来我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系( )A.乳浊液B.溶液C.胶体D.悬浊液2.下列有关说法正确的是( )A.氯化钠溶液均一稳定透明,不是分散系B .冰水混合物是一种分散系C分散系有的是纯净物有的是混合物D.分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合有9种方式3.“纳米材料”是粒子直径为1〜100 nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液①是胶体①能产生丁达尔效应①能透过滤纸①不能透过滤纸①静置后,会析出黑色沉淀A. □□□B. □□□C. □□□D. □□□□4.当光束通过下列分散系:□有尘埃的空气口稀硫酸□蒸馏水口血液,能观察到丁达尔效应的是( ) A . □□B . □□C □□D . □□5.现有如下各混合物: □ 将1 g 氯化钾加入99 g 水中□ 将1 g 可溶性淀粉加入100 g 水中,搅拌均匀后煮沸 □ 将1 g 碳酸钙粉末加入100 g 水中,充分振荡 □ 将0.1 g 植物油加入10 g 水中,充分振荡混匀 □ 将96 mL 酒精与5 mL 水充分混合。
第1章分散体系

思 考 题:
浓度均为0. 浓度均为 1mol⋅L-1的①BaCl2②NaCl ⋅ ③ C12H22O11其蒸气压下降顺序是 ( ①>②>③ ) ② ③
4. 应用
计算∆p 或 p ① 计算 例3. 计算293K时,17.1g蔗糖溶于 计算 时 蔗糖溶于1000 蔗糖溶于 g水中,溶液的蒸汽压下降值。 水中, 水中 溶液的蒸汽压下降值。 解:293K时,p*(H2O)=2.33kPa 时 M(蔗糖)=342g.mol-1 M(H2O)=18.02g.mol-1
48 / 98 ol = = 9.42m ⋅ kg-1 52 / 1000
48 / 98 = 0.15 (3) x(B) = ) 48 / 98 + 52 / 18
x(A) = 1 − x(B) = 0.85
1.3 稀溶液的依数性
(colligative properties)
3-1 依数性: 依数性:
4. 质量分数ω 定义: ① 定义: 用溶质的质量除以溶液的质量表 示浓度称为质量分数,用ω表示。 表示。 示浓度称为质量分数, 表示 公式: ② 公式
m(B) ×100% % ω(B) = m(A) + m(B)
思考题
质量摩尔浓度的优点是( 质量摩尔浓度的优点是( d a. 准确度高 c. 计算方便 )
1.1 分散系分类
1-1 分散体系的定义
由一种或几种物质分散在另一种物 一种或几种物质分散在另一种物 所形成的体系。 质中所形成的体系。 分散质(相 ( 分散质 相)(dispersion phase) 被分散的物质 分散剂(介质 介质) 分散剂 介质 (dispersed medium) ) 起分散作用的物质
3. 摩尔分数 (mole frction substance)xi 某组分物质的量占溶液 溶液总 ① 定义: 某组分物质的量占溶液总 物质的量的分数。 物质的量的分数。 ② 公式:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P= P* XA
因为:XA=(1-XB) 则:P= P* (1-XB) =P* -XBP*
p : 溶液的蒸气压;
P*:纯溶剂的饱和蒸气压;
XA:溶剂的摩尔分数
→ P* -P= P*XB
ΔP=P*XB
ΔP:蒸气压降低值
P*:纯溶剂的蒸气压 XB:溶质的摩尔分数
nB xB nA nB
例7:将下列水溶液按蒸汽压降低的顺序排列。 (1) 0.1mol · kg –1的KCl 、H2SO4和C6H12O6 (2) 0.1 mol · kg –1的CH3COOH、KCl和C6H12O6 解: (1) 0.1mol · kg –1的KCl 、H2SO4和C6H12O6 0.2 0.3 0.1 蒸汽压: 居中 最低 最高 (2) 0.1 mol · kg –1的CH3COOH、KCl和C6H12O6 0.1~0.2 0.2 0.1 蒸汽压: 居中 最低 最高
第1章 分散系
学习目标:
理解分散系的概念及分类; 了解理想气体状态方程及分压定律; 掌握各种溶液的组成标度及有关计算; 掌握稀溶液的通性、有关计算及应用; 了解胶体溶液、表面活性物质和乳浊液的基本知识。
第1节 分散系 一.分散系的概念
把一种(或多种)物质分散在另一种(或多
种)物质中所得到的体系。
分散质:被分散的物质。 处于不连续的状态 (量少)
处于连续的状态(量多) 分散剂:分散其他物质的物质。 注意: ① 分散系:混合物 ② 相对多少:分散剂>分散质
请试着举出几种分散系的实例
二. 分散系的分类
1. 根据分散质和分散剂的状态 ——可以分为九种分散系 分散质 气 液 固 气 液 固 气 液 固 分散剂 气 气 气 液 液 液 固 固 固 实 例 空气 云、雾 烟、灰尘 泡沫、汽水 牛奶、酒精的水溶液 泥土水 泡沫塑料、面包 珍珠(包藏水的碳酸钙) 合金、有色玻璃
物理量 压力(P) 体积(V) 温度(T) 单位 帕斯卡(Pa/atm/kPa) 立方米(m3/L) 开尔文(K)
物质的量(n)
摩尔 (mol)
摩尔气体常数R 8.315J.mol-1.k-1/0.082atm.L. mol-1.k-1
单位换算关系
1atm=1.013×105Pa=1.013×102kPa
nB mB CB 1000 1000 V (m l) M B V (m l) 13.34 0.997 1 1000 2.55(m ol L ) 46 (100 13.34)
例6:在100ml水中溶解17.1g蔗糖(C12H22O11),溶液的
密度为1.0638g/ml,求蔗糖的物质的量浓度,质量摩尔
pO2=p总 . xO2 =1.0×105×0.50
=0.50×105(Pa)
=1.0×105×0.40
=0.40×105(Pa)
例3:某容器中含有NH3、O2、N2等气体的混合物。取样分析
后,其中n(NH3)=0.320mol,n(O2)=0.180mol,
n(N2)=0.700mol。混合气体的总压p=133.0kPa。试计算各种 分气体的分压。 解:n=n(NH3)+n(O2)+n(N2) =0.320mol+0.180mol+0.700mol =1.200mol
第3节 稀溶液的依数性
溶液的性质有两类: 一类与溶液中溶质的本性有关,如溶液颜色、密度、酸碱 性、导电性等。 另一类与溶液中溶质的独立质点数有关,而与溶质的本性 无关,如蒸汽压下降、溶液的沸点升高、溶液的凝固点下降 和溶液的渗透压等。它们表现出一定的共同性和规律性,我 们把这一类性质称为稀溶液的通性或依数性。
浓度。
解:M蔗糖=342(g/mol) n蔗糖=17.1/342=0.05(mol) V = (100+17.1)/1.0638 = 110.0 (ml)=0.11(L) (1) c(蔗糖) = 0.05/0.11 = 0.454 (mol/L) (2) b(蔗糖) = 0.05/0.1 = 0.5 (mol/kg)
0.10 x CO 2 0.10 n 1. 0 n N 2 0.40 x N2 0.40 n 1 .0 n O 2 0.50 x O2 0.50 n 1. 0
n CO 2
pCO2=p总 . xCO2 =1.0×105×0.10 =0.10×105(Pa) pN2=p总 . xN2
-1 8.315J.mol .K-1
例1:一学生在实验室中于73.3kPa和25℃条件下 收集250m分子质量。
解: pV m RT
M m RT 0.118g 8.315kPa.L .mol-1.K-1 (25 273)K M pV 73.3kPa 250103 L
1nm<d<100nm
浊 液
d>100nm
少量分子的集合体 大量分子的集合体 或大分子化合物 蛋白溶液 淀粉溶液 均匀/透明/介稳定 能 不能
石灰乳、牛奶、原油、 乐果杀虫剂 不均匀/不透明/不稳定 不能 不能
特点
能否透过滤 纸(100nm) 能否透过半 透膜(1nm)
第2节 气体
1. 理想气体 1) 描述气体状态的物理量
mB B的质量 B V 混合物的体积
n= m M
例4:当250g 溶液中含有NaCl 40g 时,其溶液的bB= ?
mB 解: bB 1000 M B mA
401000 3.26(m ol Kg 1 ) 58.4 (250 40)
例5:已知 13.34g 乙醇溶于100g水中所配成的乙醇溶液 的密度为0.997 g· ml-1, 求 bB 和 CB 。 mB 1000 解: bB M B mA 13.34 1000 2.9(mol Kg 1 ) 100 46
3) 理想气体状态方程
pV nRT
如在标况下1摩尔气体,压力、温度、体积一般有如下关系: P=101325Pa;V=22.4L;T=273.15K;
pV 101325 Pa 22.414103 m3 3 R 8.315Pa.m .mol-1.K-1 nT 1.0mol 273.15K 8.315kPa.L .mol-1.K-1
n(NH3 ) 0.320 p(NH3 ) p 133.0kPa 35.5kPa n 1.200
n(O2 ) 0.180 p(O2 ) p 133.0kPa 20.0kPa n 1.200
p(N2 ) p - p(NH3 ) - p(O2 )
(133.0 - 35.5- 20.0 77.5kP a
nB 溶质B的物质的量 cB V 混合物体积
2.质量摩尔浓度 (mol· kg-1)
nB 溶质B的物质的量 bB mA 溶剂的质量
3. 摩尔分数
nB B组分的物质的量 xB n总 混合物的物质的量
4. 质量分数
B
mB B的质量 m总 混合物的质量
5. 质量浓度 (kg· m-3 或g.L-1)
第2节 溶液的组成标度
分散质以分子或离子均匀地分散在分散剂中的分散系称为溶 液。
溶 液
气态溶液(空气) 液态溶液:(水溶液) 溶质
固态溶液 (合金)
溶剂
对于溶液的组成可以用不同的方法表示,主要有质量 分数(ωB)、物质的量浓度(CB)、质量摩尔浓度、物质的 量分数等。
dm-3 ) 1.物质的量浓度 (mol·
→
2dm3 2dm3
2×105Pa
2×105Pa
P总
将N2和O2按上图所示混合。测得混合气体的P总为4×105Pa。
则:P总=PN2 + PO2
一个容器内有几种混合气体,在相互间不发生化学反应的条 件下,总压强P总与各种气体的分压Pi之间有如下关系: P总= ∑Pi ——— 道尔顿分压定律的数学表达式 混合气体的分压定律
⑧
降温到T2<273K时,冰线和溶液线相交于B’点;
2)计算公式 ① 沸点升高公式
o T = K · b = T T b b B b b 沸点升高值:
Kb ( K· kg· mol-1),沸点升高常数(表1-2),与溶剂的 本性有关,而与溶质的本性无关; bB(mol.kg-1):质量摩尔浓度
例9 68.4g蔗糖(C12H22O11, M=342 gmol-1)溶于1000g水中,计算 该溶液的沸点。 解:查表1-2,水的沸点升高常数Kb=0.512 Kkgmol-1。
m(C12 H 22 O11 ) Tb K b bB K b M (C12 H 22 O11 )m(H 2 O)
④
拟使水的饱和蒸气压等于外界大气压力1.013×105Pa,
需要使温度大于373K;
⑤在373K时,溶液的饱和蒸气压小于外界大气压力1.013×105Pa, 溶液未达到沸点; 只有当温度升到T1时(>373K),溶液的饱和蒸气压才达 到1.013×105Pa。
⑥ 冰线与水线的交点B处,冰和水的饱和蒸气压相等; ⑦ 在273K时,溶液的饱和蒸气压低于冰的饱和蒸气压, 即 P冰>P溶;
16.0 g m ol1
所以该气体的相对分子质量为16.0。
2. 道尔顿理想气体分压定律
组分气体: 理想气体混合物中每一种气体叫做组分气体。 分压: 组分气体B在相同温度下占有与混合气体相同体积时 所产生的压力,叫做组分气体B的分压。
n B RT pB V
分压与总压的关系
+
2dm3
气 态 分 散 系
液 态 分 散 系 固 态 分 散 系
2. 当分散剂是液体时,根据分散质粒子的大小 (本质特征)
