第一章分散体系和溶液详解演示文稿
合集下载
01%20第一章%20分散体系ppt

无机及分析化学
西南科技大学
6
拉乌尔定律(1887年,法国物理学家): 在一定温度下,难挥发非电解质稀溶液的蒸 气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数
p p XA
0 A
XA XB 1
0 p pA (1 X B )
p : 溶液的蒸气压; 0 :纯溶剂的蒸气压; pA XA:溶剂的摩尔分数
无机及分析化学 西南科技大学
9
f
同理,蒸气压下降的结果导致溶液凝固点下降
水溶液的沸点上升和凝固点下降示意图
无机及分析化学 西南科技大学
10
1.2.4 溶液的渗透压
1.渗透现象与渗透压 只允许溶剂的分子通过,不能允许溶质分子 通过的膜叫做半透膜。用半透膜将浓度不等的溶 液隔开,
浓度较低一边的溶剂分子透过半透膜进入浓度高
nB xB n总
B
VB V总
西南科技大学
无机及分析化学
3
§1.2 稀溶液的通性
稀溶液的通性:难挥发的非电解质的稀溶液的性质 与浓度(或者是与溶液中的“粒子数”的多少)有
关而与溶质的性质无关. Ostwald 称其为“依数
性” 。 这些性质包括:蒸气压下降、沸点升高、凝 固点下降及渗透压等 例如:溶液的几种性质与水的比较
胶体分散体系在生物界和非生物界都普遍存在, 在实际生产和生活中占有重要地位。 如在石油、冶金、造纸、橡胶、塑料、纤维、 肥皂等工业部门,以及其他学科如生物学、土壤学、 医学、气象、气象学中都广泛地接触到与胶体分散系 有关的问题。
无机及分析化学
西南科技大学
22
1.溶胶的光学性质 丁达尔效应 现象:将一束光线照射到透明的溶胶上,在与光线
x
高一化学分散系及其分类课件ppt.ppt

科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
有光亮通路
(2)溶液和胶体的区别
科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
交叉分类法
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶,酒精的水溶液
固
液
油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
9种类型的分散系:
依据分散质粒子的大小对分散剂是液态(包括水)的分散系进行再分类。
请同学阅读课本24页倒数第三段,并画出溶液、胶体、浊液的分类图。
知识回顾
什么是溶液? 什么是溶质? 什么是溶剂?
一. 分散系
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
被分散的物质称做分散质,
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
当一束光通过胶体时,从入射光的垂直方向上可看到有一条光带,这个现象叫丁达尔现象, 利用此性质可鉴别胶体与溶液。
2、 布郎运动
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
3、 电泳现象
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
有光亮通路
(2)溶液和胶体的区别
科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
交叉分类法
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶,酒精的水溶液
固
液
油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
9种类型的分散系:
依据分散质粒子的大小对分散剂是液态(包括水)的分散系进行再分类。
请同学阅读课本24页倒数第三段,并画出溶液、胶体、浊液的分类图。
知识回顾
什么是溶液? 什么是溶质? 什么是溶剂?
一. 分散系
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
被分散的物质称做分散质,
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
当一束光通过胶体时,从入射光的垂直方向上可看到有一条光带,这个现象叫丁达尔现象, 利用此性质可鉴别胶体与溶液。
2、 布郎运动
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
3、 电泳现象
溶液和胶体 医科大学化学讲课PPT

稀溶液 (2)AgNO3 过量:
分散系的分类: 胶粒表面分子的解离: 人在淡水中游泳,会觉得眼球胀痛。
溶液 浓溶液
渗透
溶剂的净转移
Π(Pa或kPa)
纯溶剂
溶液
渗透压力 osmotic pressure
恰好能阻止渗透进行 而施加于溶液液面上的额外压力
Π(Pa或kPa)
稀溶液
浓溶液
渗透压力之差
(二)渗透压力与浓度、温度的关系
第二节 混合物和溶液的组成标度
第三节 稀溶液的通性/依数性
第四节 溶胶
难挥发、非电解质、稀溶液
稀溶液:
bB≤0.2 mol·kg-1的溶液
依数性:(colligative) 只与溶质的数目有关而与溶质本性无关的性 质称为溶液的依数性。又称稀溶液的通性。
稀溶液的通性包括:
1. 溶液的蒸气压下降; 2. 溶液的沸点升高;
➢无关:分散相粒子的化学性质
2. 扩散/diffusion
➢物质从高浓度区域向低浓度区域转移, 直到均匀分布的现象。
➢在生物体内,扩散是物质输送或物质通过 细胞膜的推动力之一。
有关:
➢扩散速率与物质的浓度梯度成正比。
3. 沉降 / sedimentation
重力、离心力使胶粒下沉 碰撞力、静电力抗衡下沉 达到动态平衡---沉降平衡 容器底部胶粒浓度较大
分散系的分类:
按分散相粒子直径的由小到大
小分子、小离子
<1 nm
分子分散系/溶液
高分子
1-100 nm
分子聚集体
胶体分散系
>100 nm
大颗粒/大液滴
粗分散系
第一章 溶液和胶体分散系
法杨斯规则(Fajans):
分散系的分类: 胶粒表面分子的解离: 人在淡水中游泳,会觉得眼球胀痛。
溶液 浓溶液
渗透
溶剂的净转移
Π(Pa或kPa)
纯溶剂
溶液
渗透压力 osmotic pressure
恰好能阻止渗透进行 而施加于溶液液面上的额外压力
Π(Pa或kPa)
稀溶液
浓溶液
渗透压力之差
(二)渗透压力与浓度、温度的关系
第二节 混合物和溶液的组成标度
第三节 稀溶液的通性/依数性
第四节 溶胶
难挥发、非电解质、稀溶液
稀溶液:
bB≤0.2 mol·kg-1的溶液
依数性:(colligative) 只与溶质的数目有关而与溶质本性无关的性 质称为溶液的依数性。又称稀溶液的通性。
稀溶液的通性包括:
1. 溶液的蒸气压下降; 2. 溶液的沸点升高;
➢无关:分散相粒子的化学性质
2. 扩散/diffusion
➢物质从高浓度区域向低浓度区域转移, 直到均匀分布的现象。
➢在生物体内,扩散是物质输送或物质通过 细胞膜的推动力之一。
有关:
➢扩散速率与物质的浓度梯度成正比。
3. 沉降 / sedimentation
重力、离心力使胶粒下沉 碰撞力、静电力抗衡下沉 达到动态平衡---沉降平衡 容器底部胶粒浓度较大
分散系的分类:
按分散相粒子直径的由小到大
小分子、小离子
<1 nm
分子分散系/溶液
高分子
1-100 nm
分子聚集体
胶体分散系
>100 nm
大颗粒/大液滴
粗分散系
第一章 溶液和胶体分散系
法杨斯规则(Fajans):
大学基础化学 第一章 溶液 PPT课件

稀溶液中 nA>> nB
xB
=
nB nA + nB
nB nA
=
nB mA /MA
=
bB M A
△p= p* xB
由以上两式,得 Δp = p*AM AbB = kbB
p Kv bB
在一定温度下,难挥发非电解质稀溶液的蒸气 压下降与溶质的质量摩尔浓度成正比,而与溶质的 种类和性质无关.
适用条件:难挥发 、非电解质的稀溶液。
第一章 溶液 (Solution)
主要内容
第一节 溶解过程 第二节 溶液的浓度(组成量度) 第三节 稀溶液的依数性
目的要求
1. 了解溶解过程及相似相容原理; 2. 熟悉溶液浓度(组成量度)的各种表达形式; 3. 熟悉稀溶液的蒸气压下降、沸点升高、凝固点
降低概念及计算; 4. 掌握溶液渗透压的概念及其计算,熟悉渗透压
•电解质:p= i K bB 如: 对于NaCl: i=2;对于CaCl2: i=3 •K为比例系数,只与溶剂有关,与溶质无关. •当溶质为挥发性时,溶液的蒸气压等于溶剂 和溶质贡献之和。
例 已知293K时水的饱和蒸气压为2.338kPa,将6.840g蔗糖
(C12H22O11)溶于100.0g水中,计算蔗糖溶液的蒸汽压.
常见溶剂的T 0b和Kb值
溶剂 Tb0 /
Kb
溶剂
℃ /(K·kg·mol-1)
水 100
0.512 四氯 化碳
Tb0 /
℃ 76.7
Kb
/(K·kg·mol-1)
5.03
乙酸 118
2.93 乙醚 34.7
2.02
苯 80
2.53 萘
218
5.80
分散体系.ppt
nB nA nB = p﹡﹒ mA ﹒MA = K﹒bB
注意:p、△p均与p﹡单位一致. K—蒸气压下降常数 拉乌尔定律又可以说,在一定温度下,稀溶液的蒸气压下降与溶质B的质 量摩尔浓度bB呈正比,与溶质本性无关. 二.溶液的沸点升高 液体的蒸气压随温度升高而增加。当温度升高到一定程度,此时液体 蒸气压等于外界压力时,液体沸腾。此时的温度为液体的沸点Tb。 ∵溶液的蒸气压p<纯溶剂的蒸气压p﹡ ∴溶液的沸点 Tb>Tb﹡ 沸点升高值 △Tb=Tb-Tb﹡ ∵蒸气压降低值与溶液质量摩尔浓度bB呈正比。 同理, △Tb = Kb﹒bB
沸点升高常数(查表1-2)
Kb的单位:K﹒Kg﹒mol-1 mol Kb仅与溶剂性质有关 ①Kb的物理意义: 溶液质量浓度为1mol·kg-1时,溶液的沸点升高值。 ②已知Kb,可由△Tb 求B的摩尔质量MB,常用此法测定难挥发非电
解质B的摩尔质量MB。 nB △Tb = Kb· = Kb•
MA mB MB·mA
①△p= p* - p
蒸气压 下降值 纯溶剂 蒸气压 溶液蒸气压
②设XB、XA分别为溶质B、溶剂A的摩尔分数, 在一定温度下,p = p﹡·XA 所以 △p = p﹡- p﹡·XA = p﹡﹒XB ③拉乌尔定律:在一定温度下,稀溶液的蒸气压下降与溶质 B的摩尔分数成正比。 ④当溶液很稀,nA+nB≈nA ⑤△p = p﹡﹒
1. 物质的量浓度CB(mol·L --1) --每升溶液中含溶质B的物质的量。 CB = nB V
2.质量摩尔浓度bB(mol·L-1)—1000克溶剂中含有溶质B的物质的量。
nB(mol)
bB=
mA(kg)
=
mB MB·mA
比较CB与bB两种浓度: 当bB≤0.1mol·kg-1时,视为稀溶液(mA≈V),则bB≈CB 3.质量分数wB---每100克溶液中含溶质B的质量(克) mB wB = mA+mB
注意:p、△p均与p﹡单位一致. K—蒸气压下降常数 拉乌尔定律又可以说,在一定温度下,稀溶液的蒸气压下降与溶质B的质 量摩尔浓度bB呈正比,与溶质本性无关. 二.溶液的沸点升高 液体的蒸气压随温度升高而增加。当温度升高到一定程度,此时液体 蒸气压等于外界压力时,液体沸腾。此时的温度为液体的沸点Tb。 ∵溶液的蒸气压p<纯溶剂的蒸气压p﹡ ∴溶液的沸点 Tb>Tb﹡ 沸点升高值 △Tb=Tb-Tb﹡ ∵蒸气压降低值与溶液质量摩尔浓度bB呈正比。 同理, △Tb = Kb﹒bB
沸点升高常数(查表1-2)
Kb的单位:K﹒Kg﹒mol-1 mol Kb仅与溶剂性质有关 ①Kb的物理意义: 溶液质量浓度为1mol·kg-1时,溶液的沸点升高值。 ②已知Kb,可由△Tb 求B的摩尔质量MB,常用此法测定难挥发非电
解质B的摩尔质量MB。 nB △Tb = Kb· = Kb•
MA mB MB·mA
①△p= p* - p
蒸气压 下降值 纯溶剂 蒸气压 溶液蒸气压
②设XB、XA分别为溶质B、溶剂A的摩尔分数, 在一定温度下,p = p﹡·XA 所以 △p = p﹡- p﹡·XA = p﹡﹒XB ③拉乌尔定律:在一定温度下,稀溶液的蒸气压下降与溶质 B的摩尔分数成正比。 ④当溶液很稀,nA+nB≈nA ⑤△p = p﹡﹒
1. 物质的量浓度CB(mol·L --1) --每升溶液中含溶质B的物质的量。 CB = nB V
2.质量摩尔浓度bB(mol·L-1)—1000克溶剂中含有溶质B的物质的量。
nB(mol)
bB=
mA(kg)
=
mB MB·mA
比较CB与bB两种浓度: 当bB≤0.1mol·kg-1时,视为稀溶液(mA≈V),则bB≈CB 3.质量分数wB---每100克溶液中含溶质B的质量(克) mB wB = mA+mB
溶液—分散系(基础化学课件)

/
L
C ( NaOH ) n( NaOH ) m( NaOH )
V
M ( NaOH )V
C(NaOH ) 4 0.2mol / L 40 0.5
c(NaOH ) (NaOH ) 8 0.2mol / L
M (NaOH ) 40
溶液的质量 密 度 溶液的体积
物质的量浓度cB与质量浓度ρB之间的换算:
cB
B
MB
B cBM B
物质的量浓度cB与质量分数ωB之间的换算:
cB
1000B
MB
课堂练习: 将 4克氢氧化钠溶液溶于水配成500mL溶液,求ρ
(NaOH)、ϲ(NaOH)
(
NaOH
)
m
(
N V aOH
)
0 4 . 5
8 mol
B
mB m
式中mB和m的单位相同,质量分数可用小数或百分数表示, 药学上常用符号%(g/g)表示。
2. 体积分数:溶液中溶质B的体积(VB)除以溶液的体积(V)。
用符号 B 或 (B) 表示。
B
VB V
式中VB和V的单位相同,体积分数可用小数或百
示,药学上常用符号%(ml/ml)表示。
分数表
3. 质量浓度:溶质B的质量 (mB) 除以溶液的体积 (V )。
溶液
•溶 液
• 由至少两种物质组成的均一、稳定 的混合物。
• 被分散的物质(溶质)以分子或者 更小的质点分散于另一物质(溶剂) 中。
分散系
体系
体系:被划 分出来作为 研究对象的 一部分物质 或空间。
•分散系:一 种或几种物 质分散在另 一种物质中 所得到的体 系。
分散系
相:体系中物理性质和化学性质完全相同的均匀部分。 相与相间有明显的界面。
章胶体分散体系和大分子溶液优选演示

方法 (1)化学凝聚法:溶液中进行的氧化还原、水解、
复分解 等反应,只要有一种产物的溶解度很小, 就可控制反应条件使析出的产物分子凝聚成溶胶 粒子。如:
A 2O s 3 32 H S A 2 S 3 s(溶 胶 32 H O )
Fe、Al、Cu 等金属盐的水解,形成金属氢氧化物溶胶: F e C3l 3H2O F e ( O H3()溶胶) 3 H C l
(3)更换溶剂法:改换溶剂也可以制得溶胶。如 将松香的 酒精溶液滴入水中。由于松香在水中 的溶解度很小,形成松香的水溶胶。
溶胶的净化
1.渗析法 将需要净化的溶胶放
在羊皮纸或动物膀胱等 半透膜制成的容器内, 膜外放纯溶剂。
利用浓差因素,多余 的电解质离子不断向膜 外渗透,经常更换溶剂, 就可以净化半透膜容器 内的溶胶。
章胶体分散体系和大分子溶液
(优选)章胶体分散体系 和大分子溶液
§13.1胶体和胶体的基本特性
一 .分散体系的分类 一种或几种物质分散在另一种物质中所构成的体 系叫作“分散体系”。被分散的物质称作“分散 相”,而另一种物质叫作“分散介质”。 1 .分子分散体系:分散粒子的半径小于10-9m, 相当于单个分子或离子的大小,此时分散相与分 散介质形成均匀的一相,属于单相体系。如NaCl 溶于水形成的“真溶液”。
c2
B dx F
x
那么在 dx 范围内的扩散量为 DA dc dx ,浓度梯度的增量为
分散体系的分类
2 .胶体分散体系:分散粒子的半径在10—9—10— 7m的范围内,分散相与分散介质不是一相,存在 相界面。它是高度分散的多相体系,具有很大的 比表面和很高的表面能。因此,胶体粒子有自动 聚集的趋势,是热力学不稳定体系。如难溶于水 的固体物质高度分散在水中所形成的胶体分散体 系,简称“溶胶”。 如AgI溶胶,SiO2溶胶等。
复分解 等反应,只要有一种产物的溶解度很小, 就可控制反应条件使析出的产物分子凝聚成溶胶 粒子。如:
A 2O s 3 32 H S A 2 S 3 s(溶 胶 32 H O )
Fe、Al、Cu 等金属盐的水解,形成金属氢氧化物溶胶: F e C3l 3H2O F e ( O H3()溶胶) 3 H C l
(3)更换溶剂法:改换溶剂也可以制得溶胶。如 将松香的 酒精溶液滴入水中。由于松香在水中 的溶解度很小,形成松香的水溶胶。
溶胶的净化
1.渗析法 将需要净化的溶胶放
在羊皮纸或动物膀胱等 半透膜制成的容器内, 膜外放纯溶剂。
利用浓差因素,多余 的电解质离子不断向膜 外渗透,经常更换溶剂, 就可以净化半透膜容器 内的溶胶。
章胶体分散体系和大分子溶液
(优选)章胶体分散体系 和大分子溶液
§13.1胶体和胶体的基本特性
一 .分散体系的分类 一种或几种物质分散在另一种物质中所构成的体 系叫作“分散体系”。被分散的物质称作“分散 相”,而另一种物质叫作“分散介质”。 1 .分子分散体系:分散粒子的半径小于10-9m, 相当于单个分子或离子的大小,此时分散相与分 散介质形成均匀的一相,属于单相体系。如NaCl 溶于水形成的“真溶液”。
c2
B dx F
x
那么在 dx 范围内的扩散量为 DA dc dx ,浓度梯度的增量为
分散体系的分类
2 .胶体分散体系:分散粒子的半径在10—9—10— 7m的范围内,分散相与分散介质不是一相,存在 相界面。它是高度分散的多相体系,具有很大的 比表面和很高的表面能。因此,胶体粒子有自动 聚集的趋势,是热力学不稳定体系。如难溶于水 的固体物质高度分散在水中所形成的胶体分散体 系,简称“溶胶”。 如AgI溶胶,SiO2溶胶等。
溶液胶体分散体系PPT课件

• 理论46学时 • 实验24学时
作业 无机化学实验
成绩考核
• 理论考试占70% • 平时占10% • 实验占20%
2021
4
理论学时分配
章节
标题
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章 第九章 第十章 第十一章 第十二章 第十三章
溶液和胶体分散系 化学热力学基础 化学平衡 化学反应速率 酸碱解离平衡 难溶强电解质的沉淀-溶解平衡 氧化还原反应和电极电势 原子结构和元素周期律 分子结构 配位化合物 定量分析中的误差与有效数字 滴定分析法 吸光光度法 2021
基础化学课程简介
化学的研究对象
化学研究的主要对象是实物(习惯上实物仍 称为物质)。化学是在原子、分子层次上研究物 质的组成、结构、性质及其变化规律的自然科学。
基础化学的研究对象
化学热力学初步知识、化学动力学初步 知识、实验数据误差分析、分光光度法、滴 定分析法、四大化学平衡的有关规律及计算。
2021
V 0.10L
生理盐水的浓度为:
c(NaCl) (NaCl)
M(NaCl)
9.0gL1 58.5gmol1
0.15molL1
2021
16
【例5】将0.27gKCl晶体溶于100g水中,计算溶 液中KCl的质量摩尔浓度。
解: KCl的摩尔质量为74.5g·mol-1。KCl 的质 量摩尔浓度为:
n(KCl) b(KCl)
2021
8
第二节 混合物和溶液的组成标度
溶液
液态溶液 固态溶液
溶剂
如果组成溶液的物质有不同的
溶质 状态,通常将液态物质称为溶剂,
题目 气态或公固式态物质符称号为意溶义质。 单位
关于分散系和溶液的浓度课件

质里所形成的系统。
分散系
(固、液、气态)
分散相 被分散的物质。
分散介质
容纳分散相的连续介 质。(分散剂)
5
第一节 分散系
二、分散系的分类 按分散相粒子直径的由小到大
小分子、小离子 分子离子分散系/真溶液
<1 nm
高分子
1-100 nm
分子聚集体
胶体分散系
>100 nm
大颗粒/大液滴
粗分散系
表1 按分散相颗粒大小分类的分散系
第一章 溶液
内容提要
第一节 分散系 第二节 溶液的浓度 第三节 稀溶液的依数性
第一章 溶液和胶体
本次课学习目标
1.了解分散系定义及分类; 2.掌握物质的量浓度及质量浓度并能熟练地进行 有关浓度的计算。
第一节 分散系
一、分散系定义
分散质 分散 分散剂
一种或几种物质以细小
分散系 的粒子分散在另一种物
摩尔的基本单元(原子、离子.分子及其它 粒子或这些粒子的特定组合),如:
1
n(H)、 n(O2)、 n(2 N2) n(H2SO4)、 n(N2+3H2 ) 等。
某系统的基本单元数为NA=6.02×1023时,该系统的物
质的量nB为1摩尔,即: nB=1.0 mol
第二节 溶液的浓度
一、溶液浓度的表示方法 (一)物质的量浓度CB
m C2 a 0.01 g0 cC2anC V 2aM V C2 a40 g .0 1 m L 0-1o 0.l00m 2L o -5 1 l2m .5m L -1
答:正常人血清中Ca2+离子的物质的量浓度是2.5 mmol·L-1。
第二节 溶液的浓度
一、溶液浓度的表示方法 (一)物质的量浓度CB
分散系
(固、液、气态)
分散相 被分散的物质。
分散介质
容纳分散相的连续介 质。(分散剂)
5
第一节 分散系
二、分散系的分类 按分散相粒子直径的由小到大
小分子、小离子 分子离子分散系/真溶液
<1 nm
高分子
1-100 nm
分子聚集体
胶体分散系
>100 nm
大颗粒/大液滴
粗分散系
表1 按分散相颗粒大小分类的分散系
第一章 溶液
内容提要
第一节 分散系 第二节 溶液的浓度 第三节 稀溶液的依数性
第一章 溶液和胶体
本次课学习目标
1.了解分散系定义及分类; 2.掌握物质的量浓度及质量浓度并能熟练地进行 有关浓度的计算。
第一节 分散系
一、分散系定义
分散质 分散 分散剂
一种或几种物质以细小
分散系 的粒子分散在另一种物
摩尔的基本单元(原子、离子.分子及其它 粒子或这些粒子的特定组合),如:
1
n(H)、 n(O2)、 n(2 N2) n(H2SO4)、 n(N2+3H2 ) 等。
某系统的基本单元数为NA=6.02×1023时,该系统的物
质的量nB为1摩尔,即: nB=1.0 mol
第二节 溶液的浓度
一、溶液浓度的表示方法 (一)物质的量浓度CB
m C2 a 0.01 g0 cC2anC V 2aM V C2 a40 g .0 1 m L 0-1o 0.l00m 2L o -5 1 l2m .5m L -1
答:正常人血清中Ca2+离子的物质的量浓度是2.5 mmol·L-1。
第二节 溶液的浓度
一、溶液浓度的表示方法 (一)物质的量浓度CB
PPT -分散体系和溶液的量

1.5什么是分散体系
什么是分散体系
1.什么是分散体系? 你见过山间雾霭和蓝天白云吗?
你吃过松软的馒头吗? 分散体系:由一种或几种物质分散 到另一种物质中所形成的体系。 分散质:被分散的物质。 分散剂:起分散作用的物质。
云、雾都是水分散到空气中形成 馒头是气体分散到面粉中形成
什么是分散体系
2.分散体系的类型
基本单元:可以是组成物质的任何自然存在的原子,分子,电 子,离子,光子等一切物质的粒子,也可以是按需要人为地将它们进 行分割或组合而实际上并不存在的个体或单元。
溶液量的表示及其性质
3.什么是基本单元?
例:已知1L
H2SO4溶液中含H2SO4
98g,分别求c(H2SO4)和c(
1 2
H2SO4 )各
解:因为溶液极稀,密度ρ约为1 kg∙L-1
D. 3×10-2
m(Cl2 )
2106 g
b(Cl2 )
n(Cl2 ) m( H 2O)
M (Cl2 )
V
1kg
71g mol1 L1 1mL 103
3105Βιβλιοθήκη mol kg1一方面,由溶质的本性决定。如, 密度、颜色、导电性、酸碱性等。
另一方面,与溶质的本性无关,由溶 质粒子数目的多少决定。
①溶液的蒸气压下降 ②溶液的沸点升高 ③溶液的凝固点下降 ④溶液的渗透压
依数性
溶液量的表示及其性质
4.例题 (1)1升水中溶解了1.80 g葡萄糖(Mr=180 g∙mol-1,不考虑体积变化), 分别求其物质的量浓度、质量摩尔浓度、物质的量分数、质量分数。
不稳定,扩散慢,不能透过
体
滤纸及半透膜,无光散射。
系
相——体系中具有 相同化学性质和物 理性质的均匀部分。
什么是分散体系
1.什么是分散体系? 你见过山间雾霭和蓝天白云吗?
你吃过松软的馒头吗? 分散体系:由一种或几种物质分散 到另一种物质中所形成的体系。 分散质:被分散的物质。 分散剂:起分散作用的物质。
云、雾都是水分散到空气中形成 馒头是气体分散到面粉中形成
什么是分散体系
2.分散体系的类型
基本单元:可以是组成物质的任何自然存在的原子,分子,电 子,离子,光子等一切物质的粒子,也可以是按需要人为地将它们进 行分割或组合而实际上并不存在的个体或单元。
溶液量的表示及其性质
3.什么是基本单元?
例:已知1L
H2SO4溶液中含H2SO4
98g,分别求c(H2SO4)和c(
1 2
H2SO4 )各
解:因为溶液极稀,密度ρ约为1 kg∙L-1
D. 3×10-2
m(Cl2 )
2106 g
b(Cl2 )
n(Cl2 ) m( H 2O)
M (Cl2 )
V
1kg
71g mol1 L1 1mL 103
3105Βιβλιοθήκη mol kg1一方面,由溶质的本性决定。如, 密度、颜色、导电性、酸碱性等。
另一方面,与溶质的本性无关,由溶 质粒子数目的多少决定。
①溶液的蒸气压下降 ②溶液的沸点升高 ③溶液的凝固点下降 ④溶液的渗透压
依数性
溶液量的表示及其性质
4.例题 (1)1升水中溶解了1.80 g葡萄糖(Mr=180 g∙mol-1,不考虑体积变化), 分别求其物质的量浓度、质量摩尔浓度、物质的量分数、质量分数。
不稳定,扩散慢,不能透过
体
滤纸及半透膜,无光散射。
系
相——体系中具有 相同化学性质和物 理性质的均匀部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
比表面:单位体积的表面积,用符号S。
表示。
S(总表面积)
S。= ——————— V (总体积)
【例】:1立方厘米的正方体 粒子。S = 6 (平方厘米)
S。= 6/1 = 6厘米-1
平均分为1000个小立方体后 S = 0.1×0.1×6×1000
= 60(平方厘米) S。= 60/1 = 60厘米-1
B、离子吸附: 固体吸附剂对强电解质溶液的吸附主要是
离子吸附。 ①离子选择性吸附
制备As2S3溶胶:
2H3AsO3 + 3H2S
As2S3 + 6H2O
H2S发生电离:
H2S
H+ + HS-
As2S3 选择吸附HS- 而带负电荷。
②、离子交换吸附:当固体从溶液中吸附某种
离子后,同时它本身又向溶液排放出等电量的
(4)多相体系 如不溶于水的盐溶液;水与油 组成的体系及 憎液溶胶等。 特点 各组分的物理性质和化学性质不同,并 具有明显的界面。
(5)分散相(分散质) (6)分散剂(分散介质)连续相 (7) 分散系=分散质+分散剂
1.4.1 分散度与比表面 分散度:即物质的分散程度,分散质粒子
越小,分散程度越大。
2H+ + 2OH- = H2O
各种不同的离子其交换吸附能力是不同的:
当 c 一定时,离子在交换剂上的交换吸附程度 与离子的价数和它的水合离子半径有关。
一般来说,离子价数越高,交换能力越强; 同价离子中,水合离子半径越小,离子交换能 力越强。
交换能力: Al3+ > Ca2+ > Cs+ > Rb+ > K+ > Na+ > Li+
[吸附质]+[吸附剂] [吸附质·吸附剂]+吸附热
A、分子吸附:是指固体吸附剂对溶液中的非 电解质或弱电解质分子的吸附。
这类吸附与溶质、溶剂及固体吸附剂三者的 性质都有关。遵循的原则是所谓的“相似相 吸原理”。即极性的吸附剂容易吸附极性的 溶质或溶剂;非极性的吸附剂容易吸附非极 性的溶质或溶剂。
红墨水+活性炭 品红的苯溶液 + 活性炭
Fe(OH)3胶体
光锥 丁达尔效应示意图
光学原理:强光照到分散质粒子上,若粒子直 径大于入射光 波长,则发 生反射或折射。若粒子 直径与入 射光波长相比拟,则发生散射。 散射光 称为乳光。
溶胶中分散质粒子直径: 1 ~ 100 nm
第一章分散体系和溶液详解 演示文稿
优选第一章分散体系和溶液
主要内容
溶液和胶体 化学反应速率与化学平衡 电解质溶液和离解平衡 滴定分析法和酸碱滴定
原子结构与分子结构
参考书目:
①《无机化学》(生物类),孙淑声、赵钰 琳编著,北京大学出版社,1988年6月 ②《定量化学分析简明教程》,彭崇慧、冯 建章等,北京大学出版社,1997年9月第2版 ③《无机及分析化学教程》,倪静安 尚少明 等编,高等教育出版社,2006年5月第1版
溶液)
> 100 nm 粗分散系(悬浊液、乳状液)
1.2 胶体溶液
胶体是一种高度分散的多相体系. 分散质为固相 (1~100nm) 分散剂为液相
憎液溶胶:如金溶胶、氢氧化铁溶胶 亲液溶胶:高分子化合物溶液 (单相体系)
(无相界面)
1.4.5 溶胶的性质
1、光学性质(丁达尔效应:动画)
凸透镜 光源
1.4.2 表面能 液体或固体表面粒子比内部粒子能量高,
多出的这部分能量称为体系的表面能。
1g水滴分散成直径2nm的小水滴,总 面积为原来的625万倍,增加的能量可将这 1g水的温度升高50℃。同一体系,其分散 度越大,其表面能越大。胶体是一种高度 分散的多相体系,具有很大的比表面,因 此表面能很大。能量越高,体系越不稳定, 胶体是热力学的不稳定体系。
Cl- > Br- > NO3- > I-
离
子 半
+
+
+
+
+
径
Li+ < Na+ < K+ < Rb+ < Cs+
水
合
离
H
子
+O
半
径
H H
H
+
O
Li+
Rb+
交换能力:Cs+ > Rb+ > K+ > Na+ > Li+
离子交换吸附是一个可逆过程。离子在交换 剂上交换的吸附量,还与进行交换的离子浓 度有关。 应用:土壤保肥,植物根系吸收养分、分离 提纯物质、用离子交换树脂来净化水等。
1.1 分散系 1.2 胶体溶液 Βιβλιοθήκη .3 溶液 1.4 稀溶液的依数性
1.1 分散系
基本概念
1.相——体系中具有相同化学性质和物理性 质的均匀部分。以分子和离子状态分散
2.相的特点 (1)任何部分的物理性质和化学性质相同。 (2)一个相并不一定是一种物质,如食盐溶液 (NaCl和H2O)。
(3)单相体系 如饱和食盐水、糖水等。 特点 溶质与溶剂已成一体,组分间没有界面
同种电荷离子,这种过程称为离子交换吸附。 能进行离子交换的物质为离子交换剂。如; NaR(磺化媒),阴、阳离子交换树脂。
2NaR + Ca2+ 2R-SO3H+Ca2+ 2R-N(CH3 )3OH+SO42-
2Na+ + CaR2 (R-SO3)2+2H+
[R-N(CH3 )3]2 SO4+2OH-
1.4.3 固体在溶液中的吸附 物质分子自动聚集到界面的过程,称为吸附。 被吸附的粒子由于自身的热运动,有些可能 脱离固体表面重新回到周围的介质中去,此 过程叫做解吸。 被固体表面所吸住的分子或离子称为吸附质, 具有吸附能力的固体物质称为吸附剂,吸附剂的 比表面积越大,则吸附作用越显著。
吸附和解吸的关系: 动态平衡
(HA表示酸性物质)
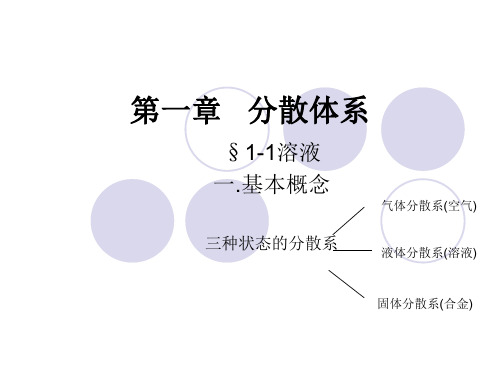
1.4.4 分散系的分类: 1、按聚集状态分 气-气(空气) 气-液(汽水)
气-固(浮石) 液-气(云、雾) 液-液(牛奶)
液-固(肉冻) 固-气(烟、尘) 固-液(溶液)
固-固(合金)
2、按分散质粒子的大小分
< 1 nm
真溶液 (1nm = 10-9 m)
1-100 nm 胶体分散系(溶胶、高分子
学时分布
章节
名称
课时
第一章 溶液与胶体
3
第二章 化学反应速率与化学平衡 6
第三章 电解质溶液和离解平衡
10
第四章 滴定分析法和酸碱滴定
12
第六章 原子结构和分子结构
8
总复习
1
总计
40
重要的不是知识的数量,而是 知识的质量。有些人知道的很多, 但却不知道最有用的东西。
列夫● 托尔斯泰
第一章 分散系和溶液
