有色样品的澄清度检查
2020版《中国药典》溶液澄清度与颜色检验操作规程

2020版《中国药典》溶液澄清度与颜⾊检验操作规程⼀、⽬的:制订详尽的⼯作程序,规范检验操作,保证检验数据的准确性。
⼆、范围:本标准适⽤于样品溶液澄清度与颜⾊的检查。
三、职责:1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录;2、化验室负责⼈:监督检查检验员执⾏本操作规程。
四、内容:1、溶液颜⾊检查法:1.1定义:本法系将药物溶液的颜⾊与规定的标准⽐⾊液⽐较,或在规定的波长处测定其吸光度。
品种项下规定的“⽆⾊”系指供试品的颜⾊相同于⽔或所⽤溶剂,“⼏乎⽆⾊”系指供试品溶液的颜⾊不深于相应⾊调0.5号标准⽐⾊液。
1.2仪器:纳⽒⽐⾊管(25ml),全⾃动⾊差计1.3第⼀法除另有规定外,取各品种项下规定量的供试品,加⽔溶解,置于25ml的纳⽒⽐⾊管中,加⽔稀释⾄10ml。
另取规定⾊调和⾊号的标准⽐⾊液10ml,置于另⼀25ml纳⽒⽐⾊管中,两管同置⽩⾊背景上,⾃上向下透视;或同置⽩⾊背景前,平视观察,供试品管呈现的颜⾊与对照管⽐较,不得更深。
如供试品管呈现的颜⾊与对照管的颜⾊深浅⾮常接近或⾊调不完全⼀致,使⽬视观察⽆法辨别两者的深浅时,应改⽤第三法(⾊差计法)测定,并将其测定结果作为判定依据。
1.3.1⽐⾊⽤重铬酸钾溶液:精密称取在120℃⼲燥⾄恒重的基准重铬酸钾0.4000g,置500ml量瓶中,加适量⽔溶解并稀释⾄刻度,摇匀,即得。
每lml溶液含0.800mg的K2Cr207。
1.3.2⽐⾊⽤硫酸铜溶液:取硫酸铜约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml;精密量取10ml,置碘量瓶中,加⽔50ml、醋酸4ml与碘化钾2g,⽤硫代硫酸钠滴定液(0.1mol/L)滴定,⾄近终点时,加淀粉指⽰液2ml,继续滴定⾄蓝⾊消失。
每lml硫代硫酸钠滴定液(0.1mol/L)相当于24.97mg的CuS04·5H20。
根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每lml溶液中含62.4mg的CuS04·5H20,即得。
伞棚灯检测与澄明度检测仪的区别

伞棚灯检测与澄明度检测仪的区别
检查内容的区别:伞棚灯用来检查澄清度,澄明度检测仪用来检查可见异物
检查光源的区别:伞棚灯用的一片基于IOD原理的一片LED光源,光的均匀度和稳定性远远优于澄明度检测仪的两排灯管,检查结果分辨率更高,
更稳定更准确;
有色样品的检查:对于有颜色样品的检查,伞棚灯可以通过调节背景光的颜色,保证样品在检查的过程中置于跟其同样的背景光颜色下,检查结果
分辨率更高,更准确更稳定。
澄明度检查仪没有此功能;
检查样品架:伞棚灯有专门的比浊管样品架,并且可以进行旋转,检查结果分辨率更高,更稳定更准确。
澄明度检查仪没有此功能;
溶液颜色检查:可实现俯视和平视在同一视觉范围内
伞棚灯技术优势:
1. 实现了浊度标准0.5以下样品的目视检测;
2. 弥补了有色样品的澄清度检查缺陷;
3. 可完成微量样品的澄清度检查;
4. 溶液颜色检查:可实现俯视和平视在同一视觉范围内
5. 减小了检测窗口面积,减少了大面积强光直接刺激检测人眼;
6. 无需在暗室的环境下操作,普通理化实验室环境即可;
7. 可根据样品,调节背景光光的强弱;
伞棚灯应用领域:
药检医疗:药品、食品、化妆品、原料,生物制品检查。
卫生食品:水质、饮料
环保行业:水质检查
兽药饲料:原料、生物药品
化工原料:液体检查
大学、科研院所:液体常规物性指标。
溶液澄清度与颜色检查标准程序

溶液澄清度与颜色检查标准程序1.目的:建立溶液澄清度与颜色检查标准程序,指导规范操作。
2.范围:适用于物料与产品的澄清度与颜色检查的操作。
3.职责:质量部检验人员对本规程的实施负责。
4.澄清度检查:4.1简述澄清度是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。
4.2本项规程的编制依据为:《中国药典》(2010版二部)附录“澄清度检查法”及《中国药品检验标准操作规程》(2010版)“澄清度检查法”。
4.3仪器与用具4.3.1比浊用玻璃管内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底40mm)一致。
4.3.2伞棚灯用可见异物检查法标准操作规范中第一法灯检法项下的检查装置,照度为1000lx。
4.3.3紫外-可见分光光度计4.4试药与试液硫酸肼和乌洛托品均应为分析纯。
4.4.1浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解(必要时可在40℃水浴中温热溶解),再加水稀释至刻度,摇匀,放置4~6h;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24h,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
4.4.2浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置于1cm吸收池中,照《分光光度法检查标准程序》(SOP-)检查,在550nm 波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48h内使用,用前摇匀。
4.4.3浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
浊度标准液(级号)0.5 1 2 3 4浊度标准原液/ml水/ml2.5097.505.095.010.090.030.070.050.050.04.5检验操作4.5.1在室温条件下,除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液分别置于配对的比浊用玻璃管中,液面高度为40mm。
浅谈澄清度检查和色度检查

药典的附录中关于澄清度检查法,第一法(目视法)首先我们要把浊度和色度区分开来:浊度是暗场,光是透射过检测物品人眼看到的,所以是灰度成像,没有颜色。
就像晚上我们仰望晴朗的星空。
符合郎博.比尔定律及曲线。
色度是明场,光是通过检测物品反射的人眼的,是有颜色的。
就像白天和灯光下我们看到的景物,符合直线定律。
浊度检测用的是暗场,检测物品的背景一般是C光白,就像阴天的天空一样。
色度检测用的是明场,检测物品的背景一般是亚光黑,就像黑锅底一样不反光,注意每个人的白平衡是不一样的。
第二法(仪器法)浊度检测有两种,第一种是散射光;入射光和接收光成90度,一般的浊度检测仪都是散射光,优点仪器体积小、便捷、速度快、价格低。
缺点精度低,误差大。
第二种是透射光,就是分光光度计的OD600。
此种方法检测精度也不是很高,现在最先进的超微距透射成像测量法,输出有三种方式IOD值、谱线轮廓线、3D成像。
仪器价格高。
色度检测,用的是反射光分为点和像,目前市场上所售都是点光源反射,精度低。
现在最先进的是超微距反射光成像测量法,输出有三种方式(R/G/B)的IOD值、(R/G/B)谱线轮廓线、3D成像。
仪器价格高。
澄清度检查时,遇到有颜色的液体怎样检查颜色的定义-------色度+亮度。
澄清度检查时用的是暗场,检查物品和人眼(或镜头)间是没有亮度的,如有余光是遗漏下的可折射出颜色,一定要转化成灰度片来计算。
一副真彩色图片转化为灰度图片时,其每一个点的灰度值是由真彩色图片的红、绿、蓝三个颜色通道,各自的灰度值按照加权平均公式:0.3×红色+0.59×绿色+0.11×蓝色计算得出的。
彩色的浊度测量值和黑白浊度测量值不同时,以加权平均浊度值(黑白)为准。
通过以上两图的比较可以看出浊度的差别。
澄清度检查操作规程(含表格)

澄清度检查操作规程(ISO13485-2016/YYT0287-2017)1.0目的规范待测物澄清度检查操作要求,使澄清度检查符合ChP2015规定。
2.0适用范围适用于待测物澄清度检查。
3.0引用/参考文件ChP2015通则0902澄清度检查法《试剂及试液管理规程》《实验室仪器设备管理规程》《物料与产品检验管理规程》4.0职责理化QC对待测物进行澄清度检查并报告,QA执行监督。
5.0程序5.1仪器及器具要求伞棚灯、比浊用玻璃管(内径15—16mm,平底,具塞,以无色硬质中性玻璃制成)、浊度仪(目视法无法判定时需要使用)5.2浊度标准贮备液制备称取于105℃干燥至恒重的硫酸肼1.00g置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,有效期2个月,用前摇匀。
5.3浊度标准原液的制备取浊度标准贮备液15.0ml置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置lcm吸收池中,按照《紫外-可见分光光度法检测操作规程》在550nm的波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
5.4浊度标准液制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
5.55.2-5.4条款中配制的标准溶液按照《试剂及试液管理规程》进行贮存、领用,并粘贴《溶液标签》进行管理。
浊度标准液(级号) 0.5 1 2 3 4浊度标准原液(ml)水(ml) 2.597.55.095.010.090.030.070.050.050.05.6目视检查法除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,暗室内置于伞棚灯下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
8-1-3-2 澄清度检查法规定-2015版中国药典

澄清度检查法规定-2015版中国药典澄清度检查介绍;澄度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
除另有规定外,应采用第一法进行检测。
品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0 .5号浊度标准液的浊度。
“几乎澄清”,系指供试品溶液的浊度介于0 .5号至1号浊度标准液的浊度之间。
2015版药典澄清度检查法第一法目视法本法系在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径 15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备 5 分钟后,在暗室内垂直同置于伞棚灯下,照度为 1000 lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
除另有规定外,供试品溶解后应立即检视。
品种项下规定的“澄清”,系指供试品溶液的澄清度相同于所用溶剂,或未超过 0.5 号浊度标准液。
“几乎澄清”则指供试品溶液的浊度介于0.5 号至 1 号浊度标准液的浊度之间。
浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置 4~6 小时;取此溶液与等容量的 10%乌洛托品溶液混合,摇匀,于25℃避光静置24 小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液 15.0ml,置 1000ml 量瓶中,加水稀释至刻度,摇匀,取适量,置 1cm 吸收池中,照紫外-可见分光光度法(附录Ⅳ A),在 550nm 的波长处测定,其吸光度应在 0.12~0.15 范围内。
本液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
上海胤煌科技有限公司可以提供专业的澄清度检测设备,欢迎大家咨询。
欧洲药典-澄清度检测规定

欧洲药典-澄清度检测规定欧洲药典:Clarity and degree of opalescence of liquidsVISUAL METHOD一般方法Using identical test-tubes of colourless, transparent, neutral glass with a flat base and an internal diameter of 15-25 mm, compare the liquid to be examined with a reference suspension freshly prepared as described below, the depth of the layer being 40 mm. Compare the solutions in diffused daylight 5 min after preparation of the reference suspension, viewing vertically against a black background. The diffusion of light must be such that reference suspension I can readily be distinguished from water R, and that reference suspension II can readily be distinguished from reference suspension I.在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液ⅠA liquid is considered clear if its clarity is the same as that of water R or of the solvent used when examined under theconditions described above, or if its opalescence is not more pronounced than that of reference suspension I.如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
SOP-QM-8062-00 澄清度检查法

1.目的:建立澄清度检查的操作规程,保证检验人员操作规范化、标准化,确保检验结果的准确性。
2.范围:本规程适用于澄清度的检查。
3.责任:本文件由QC检验员负责起草,质量部经理审核,质量管理负责人批准,QC检验员负责本操作规程的实施。
4.内容:4.1.第一法(目视法)本法系在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备后5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
除另有规定外,供试品溶解后应立即检视。
品种项下规定的“澄清”,系指供试品溶液的澄清度相同于所用溶剂,或未超过0.5号浊度标准液。
4.1.1浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
4.1.2浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-可见分光光度法(附录ⅣA),在550nm的波长处测定,其吸光度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
4.1.3浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
4.2.第二法(浊度仪法)供试品溶液的浊度用浊度仪测定。
溶液中不同大小、不同特性的微粒物质包括有色物质均可使人射光产生散射,通过测定透射光或散射光的强度,可以检查供试品溶液的浊度。
仪器测定模式通常有三种类型,透射光式、散射光式和透射光-散射光比较测量模式(比率浊度模式)。
欧洲药典澄清度目视法

欧洲药典澄清度目视法欧洲药典(European Pharmacopoeia)是欧洲卫生部门公认的药品质量控制标准。
其中,澄清度(Clarity)是药品测试中重要的一个品质参数,目视法是常用的澄清度测试方法之一。
下面将详细介绍欧洲药典中关于澄清度目视法的相关内容。
1. 澄清度的原理和定义:澄清度是描述药物溶液的透明度及其中不可溶性物质的微粒数量和大小的参数。
药品溶液澄清度良好,可以确保药物在制造、运输和存储过程中的质量稳定性和安全性。
欧洲药典中将澄清度定义为药品溶液透明度的特性,通过目视法进行检测。
2. 目视法的步骤:(1)准备样品:选取规定体积的药品溶液样品,样品要求无色透明。
(2)准备比色皿:用干净的、透明的比色皿作为观察容器。
(3)观察澄清度:将样品倒入比色皿中,放置在白色背景下,通过目视检测样品的透明度。
观察时可以调整观察角度和光线条件以增加检测的准确性。
3. 结果评估:(1)合格:样品透明度良好,无任何浑浊、悬浮颗粒或沉淀。
(2)不合格:样品出现浑浊、悬浮颗粒或沉淀现象,即澄清度不合格。
4. 澄清度的限度要求:欧洲药典制定了不同药物的澄清度限度要求。
例如,对于注射用药品,澄清度要求高,通常要求样品无浑浊、无可见颗粒或微粒;而对于口服药品,澄清度要求相对较低,但仍需要保证样品足够清澈透明。
5. 数据记录和报告:在药品质量控制中,澄清度的目视检测结果需要记录并报告。
需要记录的信息包括样品的标识信息、测试环境的温度和光线条件以及检测人员的签名等。
报告时应标明澄清度的检测方法为目视法,并将检测结果与欧洲药典的澄清度限度要求进行比较。
需要特别指出的是,澄清度的目视检测方法有一定的主观性,检测结果受到个体主观判断和光线条件等因素的影响。
因此,在具体的药品质量控制中,除了目视法外,还需要结合其他仪器和测试方法进行综合评估和确认,以确保澄清度的准确性和可靠性。
综上所述,欧洲药典中关于澄清度的目视法是药品质量控制中重要的测试方法之一。
澄清度检查法

澄清度检查法操作规程1 目的建立澄清度检查法操作规程,使其规范化、合理化。
2 范围适用于澄清度检查法的检验操作。
3 职责3.1 质量控制部检验人员对具体操作负责;3.2 质量保证部负责监督本规程的执行。
4 定义4.1 澄清:指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
4.2 几乎澄清:指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
5 内容5.1 概述与原理澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度,是利用药物与杂质在特定溶剂中溶解性能的差异而设计的检查项目,主要用于原料药与注射剂的质量控制。
浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果,它表征光线透过水层时受到障碍的程度。
5.2 仪器与用具5.2.1 比浊用玻璃管:内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm) 一致。
5.2.2 伞棚灯用可见异物检查法标准操作规范中第一法灯检法项下的检查装置,照度为1000 Lx。
5.3 试药与试液5.3.1 浊度标准贮备液的制备:称取于105℃干燥至恒重的硫酸肼1.00g置l00ml 量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,在两个月内使用,用前摇匀。
5.3.2 浊度标准原液的制备:取浊度标准贮备液15.0ml,置l000ml量瓶中,加水稀释至刻度,摇匀,取适量,置lcm吸收池中,照紫外一可见分光光度法(SOP-QC-00-001-00)在550nm的波长处测定,其吸光度应在0.12~0.l5范围内。
本液应在48h内使用,用前摇匀。
5.3.3 浊度标准液的制备:取浊度标准原液与水,按下表配制,即得。
本液应临5.4 操作方法5.4.1 除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5min 后,于暗室内垂直同置于伞棚灯下,照度为1000 lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
澄清度检查法

澄清度检查法■澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
■【增订】品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄清”,系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
第一法(目视法)■除另有规定外,按各品种项下规定的浓度要求外,在室温条件下将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较。
除另有规定外,供试品溶液溶解后应立即检视。
第一法无法准确判定二者的澄清度差异时,改用第二法进行测定并以其测定结果进行判定。
■【修订】照度标准贮备液的制备称取105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热使溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-可见分光度法(附录ⅣA),在550nm 的波长处测定,其吸光度应在0.12~0.15范围内。
该溶液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
浊度标准液■第二法(仪器法)供试品溶液的浊度可采用仪器法测定。
、溶液中不同大小、不同特性的微粒物质包括有色物质均可使入射光产生透射和散射,通过测定透射光或散射光的强度,可以检查供试品溶液的浊度。
仪器测定模式通常有三种类型,透射光式、散射光式和透射光-散射光比较测量模式(比率浊度模式)。
1.仪器的一般要求采用适宜的散射光浊度仪,光源峰值波长约为860nm左右;测量范围应包含0.01~100NTU。
澄清度检验操作规程

GMP文件
目的建立澄清度检验操作规程,便于检验人员正确操作,确保检验结果的准确。
范围适用于辅料澄清度的检查
职责检验人员对本标准负责。
内容
1、简述:
本法系在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15-16mm,平底,具塞,以无色、透明、中性硬质量玻璃制成)中,在浊度标准液制备5分钟后,在暗处从水平方向观察、比较,用以检查溶液的澄清度或其浑浊程度,除另有规定外,供试品溶解后应立即检视。
品种项下的“澄清”系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄清”系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
2. 浊度标准贮备液的制备
称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃水浴中温热溶解,并用水稀释至刻度,摇匀,放置4-6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
3.浊度标准标准液的制备
取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀后,取适量的浊度标准原液和水,按下表配制,即得。
本液应现用现配。
.。
澄清度检查法

澄清度检查法澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度,是利用药物与杂质在特定溶剂中溶解性能的差异而设定的检测项目,主要用于原料药与注射剂的质量控制。
包括第一法(目测法)和第二法(浊度仪法),除另有规定外,应采用第一法进行检查。
目测法原理浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果,它表征光线透过水层时受到障碍的程度。
是光线在水溶液中的透射或散射一种水质的物理参数。
2015版药典收载两种方法:目视法,浊度仪法(散射光式)方法详解1)第一法目视法是在室温条件下,将供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管中,在暗室内垂直同置于伞棚灯下,照度为1000Ix,从水平方向观察、比较。
2)浊度标准贮备液的制备:105℃干燥至恒重的硫酸肼和乌洛托品按照药典进行配制,有效期为2个月。
3)浊度原液应及时在550nm波长处进行吸光度的测定,应在0.12~0.15范围内,有效期为48小时。
采用浊度标准原液及水按照药典制备0.5、1、2、3、和4号浊度标准液4)目视法检查照度为1000Ix,过高或过低均会造成干扰。
方法特点及适用性1)目视法由于操作简便快捷可作为首选方法,同时该方法可以进行有色供试品溶液的浊度判断。
2)对于无色供试品溶液,目视法无法准确判断其浊度是否符合标准规定时,或多人观测存在差异时,应采用第二法。
3)第二法仅适用于无色供试品溶液的浊度测定。
操作要点及注意事项1.除另有规定外,按各品种项下规定的浓度要求,在室温条件下用水或适宜的溶剂配制一定浓度的供试品溶液,一般采用振摇方式处理,确保供试品溶解完全。
同时平行配制相应的浊度标准液,供试品溶解后应立即检视。
2.目视法检查时,玻璃管应无磨损,应加强对伞棚灯照度的控制。
澄清度检测方法

澄清度检测方法澄清度是衡量溶液清晰程度的重要指标,对于评价溶液的质量和安全性具有重要意义。
本文将介绍澄清度检测的几种常见方法,包括目视检测法、比浊法、浊度检测法、紫外可见光谱法、电导率检测法、核磁共振法、高效液相色谱法、气相色谱法等方面。
1. 目视检测法目视检测法是最简单、最直观的检测方法,通过观察溶液的颜色、透明度等外观特征来判断溶液的澄清度。
该方法适用于对溶液中悬浮物、沉淀物等明显的杂质进行检测。
目视检测法的优点是操作简单、成本低,但检测结果易受主观因素影响,精度较低。
2. 比浊法比浊法是通过比较溶液与标准溶液的浊度来测定溶液的澄清度。
将待测溶液与标准溶液分别置于比浊管中,在一定波长下测定透射光强度,计算浊度差异,从而确定待测溶液的澄清度等级。
比浊法适用于测定微量悬浮物和胶体杂质,但需要使用标准溶液进行对比,操作相对繁琐。
3. 浊度检测法浊度检测法是通过测定溶液中悬浮物的数量和大小来评价溶液的澄清度。
该方法主要利用光学原理,通过测量透射光强度来反映溶液中的悬浮物数量和大小。
浊度检测法适用于测定高浓度悬浮液的澄清度,但精度受悬浮物性质和测量条件的影响。
4. 紫外可见光谱法紫外可见光谱法是通过测定溶液在紫外可见光区的吸收光谱来分析物质的结构和浓度。
在澄清度检测中,可以利用紫外可见光谱法测定溶液中特定物质的含量,从而反映溶液的澄清度。
该方法具有高精度和高灵敏度,适用于测定痕量杂质和特定物质的含量。
5. 电导率检测法电导率检测法是通过测量溶液的电导率来反映溶液中离子的浓度和种类。
在澄清度检测中,可以利用电导率检测法测定溶液中离子的浓度,从而反映溶液的澄清度。
该方法适用于测定含有大量离子的溶液,如盐水、废水等,但无法反映非离子性杂质的含量。
6. 核磁共振法核磁共振法是一种利用核磁共振原理测定溶液中特定原子核的磁矩和数量的方法。
在澄清度检测中,可以利用核磁共振法测定溶液中特定原子核的数量和分布,从而反映溶液的澄清度。
8-1-5 欧洲药典澄清度检测规定

欧洲药典:Clarity and degree of opalescence of liquidsVISUAL METHOD一般方法Using identical test-tubes of colourless, transparent, neutral glass with a flat base and an internal diameter of 15-25 mm, compare the liquid to be examined with a reference suspension freshly prepared as described below, the depth of the layer being 40 mm. Compare the solutions in diffused daylight 5 min after preparation of the reference suspension, viewing vertically against a black background. The diffusion of light must be such that reference suspension I can readily be distinguished from water R, and that reference suspension II can readily be distinguished from reference suspension I.在内径15~25mm,平底,无色、透明、中性玻璃管中,加入等量的供试溶液与浊度标准液,使液位的深度都为40mm,按如下所述方法进行比较。
浊度标准液制备5分钟后,以色散自然光照射浊度标准溶液和供试溶液,在黑色背景下从垂直方向观察、比较澄清度或浑浊程度。
色散自然光必须较容易区分浊度标准溶液Ⅰ与水,浊度标准溶液Ⅱ与浊度标准溶液ⅠA liquid is considered clear if its clarity is the same as that of water R or of the solvent used when examined under the conditions described above, or if its opalescence is not more pronounced than that of reference suspension I.如果供试溶液的澄清、透明程度与水相同,或者与所用溶剂相同,或者其澄清度不超过Ⅰ号浊度标准溶液,那么可判定该溶液为澄清。
澄清度检查法标准操作规程
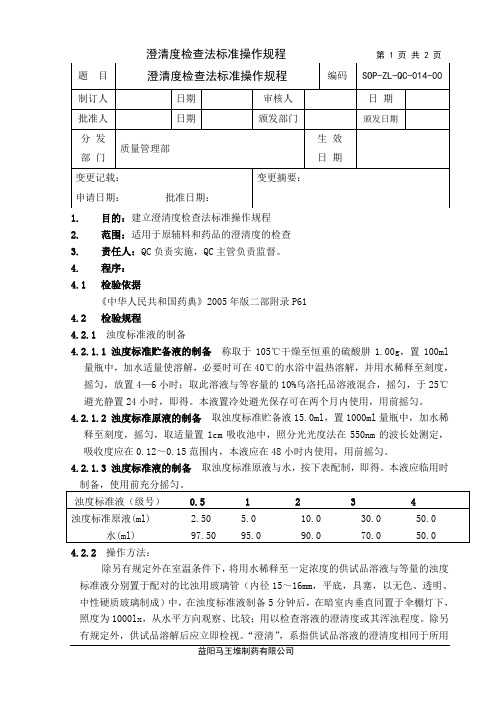
澄清度检查法标准操作规程第 1 页共 2 页1. 目的:建立澄清度检查法标准操作规程2. 范围:适用于原辅料和药品的澄清度的检查3. 责任人:QC负责实施,QC主管负责监督。
4. 程序:4.1 检验依据《中华人民共和国药典》2005年版二部附录P614.2 检验规程4.2.1浊度标准液的制备4.2.1.1 浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4—6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存可在两个月内使用,用前摇匀。
4.2.1.2浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量置1cm吸收池中,照分光光度法在550nm的波长处测定,吸收度应在0.12~0.15范围内,本液应在48小时内使用,用前摇匀。
4.2.1.3浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时4.2.2 操作方法:除另有规定外在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
除另有规定外,供试品溶解后应立即检视。
“澄清”,系指供试品溶液的澄清度相同于所用益阳马王堆制药有限公司SOP-ZL-QC-014-00澄清度检查法标准操作规程第 2 页共 2 页溶剂,或未超过0.5号浊度标准液。
4.2.3注意事项:4.2.3.1澄清度检查用的浊度标准贮备液、原液和标准液,均应用澄清的水(可用0.45μm孔径滤膜或G5垂熔玻璃漏斗滤过而得)。
4.2.3.2浊度标准贮备液、浊度标准原液、浊度标准液,均应按规定制备、使用,否则影响结果。
澄清度检查法
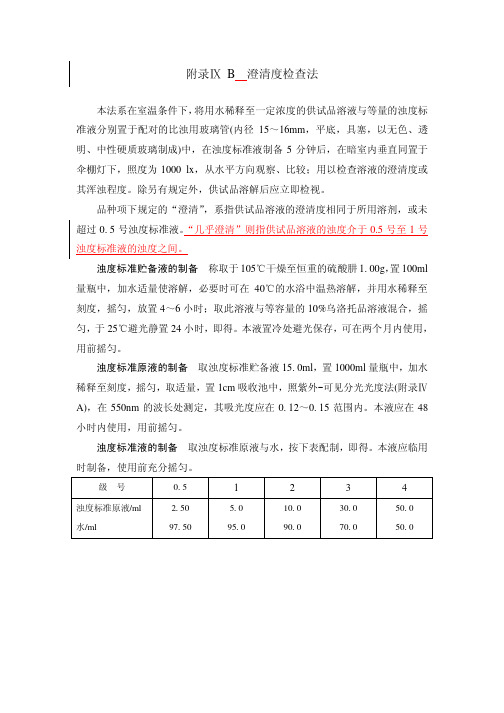
附录ⅨB澄清度检查法
本法系在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000 lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
除另有规定外,供试品溶解后应立即检视。
品种项下规定的“澄清”,系指供试品溶液的澄清度相同于所用溶剂,或未超过0.5号浊度标准液。
“几乎澄清”则指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml 量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-可见分光光度法(附录ⅣA),在550nm的波长处测定,其吸光度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
级号0.5 1 2 3 4
浊度标准原液/ml 水/ml 2.50
97.50
5.0
95.0
10.0
90.0
30.0
70.0
50.0
50.0。
澄明度检查细则和判断标准

澄明度检查细则和判断标准一、注射液1.检查装置(1) 光源采用日光灯。
无色溶液注射剂于光照度为1000~1500Ix的位置,透明塑料容器或有色溶液注液剂于光照度为2000~3000Ix的位置,用目检视。
(2) 式样采用伞棚式装置,两面或单面用。
(3) 背景为不反光黑色。
在背部右侧和底部为不反光白色(供检查有色异物)。
(4) 距离供试品至人眼距离为20~25cm。
(5) 检查应在避光室内或在暗处进行。
2.检查人员条件(1) 视力远距离和近距离视力测验,均为0.9或0.9以上(不包括矫正后视力)。
(2) 色盲测验应无色盲。
3.检查方法及时限(1) 水(醇)溶剂型注射液将供试品如数抽取,擦净安瓿(瓶)外壁污痕(或保持外壁清洁),集中放置。
检查时按下表拿取支数连续操作,于伞棚边缘外,手持安瓿颈部使药液轻轻翻转,用目检视。
50ml或50ml 以上的注射液按直、横、倒三步法旋转检视。
不同规格注射剂每次拿取支数和检查时限规定如下:(2) 油溶剂型注射液油溶剂注射液按水(醇)溶剂型注射液的检查方法检查,其检查时限延长一倍。
如有结晶析出,可在80℃以上水浴中加热30分钟,振摇,放冷至20~30℃检查,若结晶不溶者判为不合格。
(3) 混悬型注射液按水(醇)溶剂型注射液的检查方法及时限检查色块等异物。
4.判断标准按以上装置及方法检查,除特殊规定品种外,未发现有异物或仅带微量白点者作合格论。
注射剂在出厂检验时,其不合格率不得过5%.贮存期的注射剂不合格率不得过7.5%(属麻醉药品管理范围的注射剂,不得过10%)。
如检查结果超过规定时,则加倍抽样复试,应符合规定。
符合上述规定的药品,在使用时仍应注意挑选,不合格品不准应用。
5.特殊品种(1) 葡萄糖酸钙注射液除带少量白点外,应符合规定。
(2) 胰岛素注射液除带少量白点及短小纤维状物外,应符合规定。
(3) 右旋糖酐类注射液除带轻微乳光及微量白点外,应符合规定。
(4) 输血用枸橼酸钠注射液除带少量白点外,应符合规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有色样品的澄清度检查专用伞棚灯
物体颜色
物体的颜色,普遍的认知是“物体是什么颜色就反射(或透射)什么颜色”,甚至有的说“物体所以呈现某种颜色,是因为它把其他颜色的光都吸收了的缘故”,我们认为,这两种说法是不妥的乃至错误的。
非发光物体的颜色取决于施照光源的颜色和被照物体对光的吸收特性。
在没有光源的黑暗环境里,任何物体都不会呈现其颜色,只有在光照下,物体才可呈现一定的颜色。
同一物体在颜色不同的光源下呈现着不同的颜色;而在同一光源下的不同物体一般也呈现着不同的颜色。
通常所谓物体的颜色是指这种物体在白光(阳光、白炽灯光、日光灯光等)下的颜色。
白光是由红、橙、黄、绿、蓝、靛、紫七色光组成的,单色光源只有一种颜色,从波动理论讲,单色光就是波长单一的光。
我们熟知的白光可由七色光复合而成,却很少了解白光也可以由较少颜色的光复合而成。
实验表明,如果把适当颜色的两种单色光按一定的强度比例混合,可以形成白光。
图1
这样的两种颜色就称为互补色。
图1是互补色示意图,图中每条直径两端的单色光互为互补色。
如红光与青光为互补色,黄光与蓝光为互补色,等等。
当白光照射不透明物体时,由于物体对不同波长的光吸收、反射的程度不同,而使物体呈现了不同的反射颜色。
若物体对各种波长的光都完全吸收,则物体呈现黑色;若完全反射,则呈现白色;若对各种波长的光,吸收程度相差无几,则呈现灰色;如果物体有选择地吸收某一或某些波长的光,那么这种物体的颜色就由它所反射的光的颜色来决定,即反光物体的颜色是与其选择吸收光成互补色的颜色。
例如,树叶由于吸收了阳光中紫色而呈现绿色。
当白光照射透明或部分透明物体时,因其对不同波长的光吸收、透射的程度不同而使物体呈现了不同的透射颜色。
若物体对各种波长的光透过的程度相同,这种物体就是无色透明的;若只让一部分波长的光透过,其他波长的光被吸收,则这种部分透光物体的颜色就由透过光的颜色来决定,即透光的物体呈现的是与其选择吸收光成互补色的透光颜色。
例如,高锰酸钾溶液吸收了白光中的绿色光而呈现了紫色的透光颜色。
总之,物体反光和透光所呈现的颜色都是由与物体选择吸收光成互补色的光而决定的颜色。
当然,如果物体选择吸收的不只是一种颜色的光,那么物体(反光或透光)的颜色就将由几种吸收光的互补光复合而成。
有色样品澄清度检查目视法试验步骤
关键词:照度:1000lx;伞棚灯;背景光色调可调。
主要作用:配合《中国药典.澄清度检查目视法》的推广和应用
依据:2015版《中国药典分析检测技术指南》2017年07月第一版,第449-452页澄清度检查法通则0902
仪器与标准浊度液
1.HN-200A 澄清度专用伞棚灯
2.澄清度检查专用石英比浊管
3.标准浊度液0.5、1、2、3、4
4.样品:三种有颜色的浊度液(实际浊度与2号比浊管一致)
标准浊度管0.5、1、2、3、4 样品:绿色、黄色、蓝色
第一组:绿色样品和无色比浊管
照度1000xl 白光
照度1000lx 绿光第二组黄色样品和无色比浊管
照度1000lx 白光
照度1000lx 黄光第三组蓝色样品和无色比浊管
照度1000lx 白光
照度1000lx 蓝光第四组水和比浊管
照度1000lx 白光
以上图片因拍摄手机、色彩系统、图片保存格式、电脑、显示器的误差均没有实际的图像效果好。
通过以上试验证明:有色样品在做澄清度检查试验时,调节伞棚灯的光色和样品颜色一致,标准浊度管的颜色是和光的色调一致的,随着光色的变化而变化的;光色和样品颜色一致时样品的颜色饱和度更好;这样就把样品和标准比浊管背景一致,大大减少背景误差,可使人眼看清、判断浊度标号。
参考文献:
《2015版中国药典- 澄清度检查法》
《中国药典分析检测技术指南》
百度:光色
丁香园---《欧洲药典》
澄清度检查法之仪器法的方法学研究———北京市药品检验所---李文东。
