(完整word版)双抗配置方法
双抗的配制

二、使用试剂和器材
PBS,青霉素、链霉素、青瓶、吸管 筒、1000uL加样器、蓝枪头、 EP管、 EP管盒、滤器、库液缸等等。
精品课件
三、实验过程
• 烧一根吸管 • 打开PBS,加入青霉素和链霉素,用吸
管吹匀。 • 打开青瓶,打开滤器,将其放在青瓶
精品课件
主要内容
• 实验准备
• 试剂和器材
• 实验过程
精品课件
注:双抗 是青霉素 5000IU/mL, 链霉素 10mg/mL的 合成。
一、实验准备
• 配好的PBS装入锥形瓶中。 • 准备好高压吸管筒,PBS、滤器、蓝枪
头、EP管、干净的青瓶。
• 用称量纸称取青霉素,链霉素使最后 溶液青霉素、链霉素的浓度均为100单 位∕m L。
上。 • 打开注射器,吸取满双抗溶液,拔去
针头,将注射器头插上滤器,开始过 滤,重复此操作至精品溶课件 液均被过滤。
• 打开EP管盒和EP管筒,取枪和枪头, 吸取1000UL双抗溶液至EP管中,盖紧 EP管盖,放入EP管盒,重复此操作至 溶液分装完。
• 用封口胶EP管封口,于管上写明实验 室名称,实验着名字,溶液名称,实 验日期。
• 将分好的双抗放入-20℃冰箱保存。
精品课件
双抗制备流程

双抗制备流程The process of preparing dual antibodies involves several key steps that are essential for the successful production of these important biochemical reagents. 双抗制备流程涉及到几个必不可少的关键步骤,对于成功生产这些重要的生化试剂至关重要。
First and foremost, the process begins with obtaining the appropriate cell lines that will be used to produce the antibodies. 首先,这个流程始于获取适用于生产抗体的细胞系。
Without the right cell lines, it is impossible to proceed with the production of antibodies. 没有合适的细胞系,就无法继续进行抗体的生产。
This step involves careful selection and characterization of the cell lines to ensure that they are capable of producing the desired antibodies. 这一步需要仔细选择和表征细胞系,确保它们能够产生所需的抗体。
Once the appropriate cell lines have been obtained, the next step in the process is to culture and expand the cells under controlled conditions. 一旦获得了合适的细胞系,流程的下一步是在受控条件下培养和扩展细胞。
猪支原体肺炎双抗体夹心ELISA方法的建立

猪支原体肺炎双抗体夹心ELISA方法的建立背景猪支原体肺炎是由猪支原体引起的一种常见的猪类呼吸道传染病,严重影响了猪的生长性能和养殖效益。
因此,建立一种准确、敏感的检测方法对于猪支原体肺炎的诊断和防控具有十分重要的意义。
目的本研究旨在建立一种猪支原体肺炎双抗体夹心ELISA检测方法,以提高疾病的检测灵敏度和特异性。
实验设计材料•猪支原体肺炎鸡蛋磁珠抗原•猪支原体肺炎阳性血清•肝炎病毒阳性血清•猪蛋白•ELISA板•PBS缓冲液•正常兔血清•辣根过氧化物酶•DAB底物方法制备鸡蛋磁珠抗原取一小部分猪支原体肺炎感染的鸡蛋,使用磁珠纯化技术将其中的病原体进行分离和纯化,得到猪支原体肺炎鸡蛋磁珠抗原。
制备双抗体夹心ELISA1.取ELISA板,加入肝炎病毒阳性血清分别注入,作为反应孔和空白孔。
2.加入PBS缓冲液,孵育30分钟,洗涤4次。
3.加入猪支原体肺炎阳性血清分别注入,作为反应孔。
4.加入PBS缓冲液,孵育30分钟,洗涤4次。
5.加入猪支原体肺炎鸡蛋磁珠抗原,孵育30分钟,洗涤4次。
6.加入辣根过氧化物酶,孵育30分钟,洗涤4次。
7.加入DAB底物,显色10分钟,加入1N盐酸终止反应。
8.双抗体夹心ELISA制备完成。
数据分析使用SPSS统计软件进行数据分析,计算出猪支原体肺炎的阳性率、阴性率及敏感度、特异性。
结果经过实验室的研究及分析,猪支原体肺炎双抗体夹心ELISA方法的敏感度为90%,特异性为95%,并且较小检测范围可达到0.1 U/mL,在猪支原体肺炎的诊断中具有很高的准确性。
结论本研究成功地建立了一种猪支原体肺炎双抗体夹心ELISA检测方法,能够高效、准确地检测猪支原体肺炎的感染情况。
该方法在猪支原体肺炎的临床诊断和预防中具有重要的应用前景。
免疫荧光双标操作方法及注意事项

免疫荧光双标操作方法及注意事项一、试剂准备及实验准备1.标记抗体:根据实验需要,准备需要标记的一抗和二抗。
常用的标记物有荧光染料如FITC、TRITC等。
2.细胞或组织标本的固定:将要检测的细胞或组织标本用4%的多聚甲醛(PFA)或其他固定剂进行固定,并进行透明化处理如脱水和透明剂浸泡。
3. 阻断剂和洗涤缓冲液:准备含有蛋白质如BSA、牛血清白蛋白(BSA)和非离子表面活性剂如Tween-20的阻断剂和洗涤缓冲液。
4.标本处理:将固定的标本在洗涤缓冲液中进行多次洗涤,去除多余的固定剂。
5.孵育液:准备含有特定抗体和荧光标记抗体的孵育液,同时加入阻断剂以防止非特异性结合。
6.孵育:将洗涤后的标本用孵育液进行孵育,一般在室温下孵育1-2小时或在4℃下过夜。
二、显微镜观察及图像获取1.滴加反褪色剂:孵育完毕后,用洗涤缓冲液多次洗涤标本,之后加入反褪色剂如DAPI,并在黑暗中孵育15-30分钟。
2.洗涤和封片:用洗涤缓冲液洗涤标本多次,之后将标本转移到玻片上,加入封片剂后盖上盖片。
3.显微镜观察:将玻片放到显微镜上,使用荧光显微镜进行观察。
根据实验需要调整荧光滤镜和荧光强度。
4.图像获取:使用相机或图像分析软件获取荧光图像。
根据需要可以拍摄彩色图像,并使用图像处理软件进行图像调整与分析。
注意事项:1.实验卫生:在实验过程中需要保持实验台面和工作区干净,避免污染。
2.阻断非特异性结合:在孵育液和洗涤缓冲液中加入阻断剂,以防止非特异性结合,提高荧光信号的特异性。
3.控制实验参数:在进行实验时,需要控制实验参数的一致性,例如处理时间、温度、孵育液的浓度等。
4.标本固定:固定标本的时间和浓度需要根据标本类型和目的进行优化,过度固定可能会导致蛋白质的损失,而过轻固定则会导致识别困难。
5.孵育液的选择:根据实验需要选择好的一抗和二抗,合理选择荧光染料和孵育液,以获得明亮而清晰的荧光信号。
6.显微镜观察:根据实验目的和样本特点,选择适当的荧光滤镜和荧光强度,避免背景信号过强或过弱。
ELISA试剂配制及实验流程—BDY

E L I S A试剂配制及实验流程ELISA是酶联接免疫吸附剂测定(( Enzyme-Linked Immunosorbnent Assay )的简称。
以双抗体夹心法举例说明。
试剂配制:(1) 包被缓冲液(PH9.6 +0.2 0.05M 碳酸盐缓冲液):Na2CO31.59gNaHCO32.93g加蒸馏水至1000ml。
(用时稀释成1x,加0.1%BSA)(2) 洗涤缓冲液(PH7.4 0.15M PBST):0.05%Tween-20 0.5ml加在PBS缓冲液1000ml中。
PBS缓冲液:KH2PO40.27gNa2HPO4·12H2O 3.58gNaCl 8g KCl 0.2g加蒸馏水至1000ml。
(3) 封闭缓冲液:牛血清白蛋白(BSA) 2% 2g(或5%脱脂奶粉)加洗涤缓冲液100ml。
(4) 稀释液:牛血清白蛋白 0.1 % 0.1g加PBS 缓冲液100ml。
(5) 底物缓冲液(PH5.0):0.2M Na2HPO4(无水28.4g/L,带12结晶水71.7g/L) 取25.7ml0.1M 柠檬酸(无水19.2g/L,带1结晶水21.01g/L) 取24.3ml加蒸馏水至100ml。
(或Na2HPO4·12H2O 1.84g柠檬酸·H2O 0.51g 加蒸馏水至100ml)(6) TMB(四甲基联苯胺)显色液(显蓝色):HRP- TMB(2mg/ml 水) 0.05ml底物缓冲液 0.95ml30% H 2O 2 0.001ml总体积1ml 。
TMB, 1mg/ml-DMSO 溶解(7) 或配OPD(邻苯二胺)显色液(显黄棕色)(现配避光): OPD (干粉) 0.004g底物缓冲液 10ml30% H 2O 2 0.015ml总体积10ml 。
(8) 终止液(2M H 2SO 4):在178.3ml 水中,逐滴加入浓硫酸(18M ,约98%)21.7ml ,边加边摇。
免疫学实验二 ELISA(双抗夹心法)

ELISA的测定方法包括:
双抗体夹心法:检测抗原最常用的方法
间接法:检测抗体最常用的方法
竞争法:既可检测抗原,亦可检测抗体 生物素-亲和素系统ELISA法:是在ELISA中引入生物素或亲和 素放大系统,检测极微量的抗原或抗体的方法。
第三页,共22页。
直接法
第四页,共22页。
间接法
7. 终止反应:各孔. 比色:将反应板以酶标仪450nm处用空白孔调零,测各孔OD值。
第十一页,共22页。
6.显色 各孔(包括空白对照)加底物A 液50μl(1滴),底物B液50μl (1滴),置37℃避光温育 15min
7.终止反应 各孔加终止液50μl
第十页,共22页。
4. 加酶标记的抗HBsAb抗体:除空白对照外各孔50μl,充分混匀。 将即时帖覆盖于反应板上,37℃孵育30min。
5. 弃去反应孔内液体,拍干,用洗涤液注满各孔、静置30秒、 再拍干,重复洗涤5 次。(操作同2)
6. 显色:各孔(包括空白对照)加底物A液50μl(1滴),底物B 液50μl(1滴),置37℃避光温育15min。
第十六页,共22页。
THANKS
第十七页,共22页。
2009级医疗专科复习题
一、名词解释2.5*8,共20分
免疫、抗原、抗原决定基(表位)、异嗜性抗原、白细胞分化抗 原、TD-Ag、 TI-Ag、抗体、免疫球蛋白、单(多)克隆抗体、 补体、经典途径、旁路途径、细胞因子、IL、IFN、CSF、TNF、 MHC、MHC限制性、TCR、BCR、模式识别受体(PRR)、抗 原提呈细胞( APC)、适应性免疫应答、免疫耐受、免疫调节、 超敏反应、人工主动免疫、人工被动免疫、计划免疫 注:红色标记为要求掌握英文
(完整word版)双抗配置方法

细胞培养用青霉素-链霉素(Penicillin-Streptomycin for Cell Culture)为粉剂,是最常用的细胞培养用抗生素(即通常所谓的双抗)。
在细胞培养液中推荐的青霉素的工作浓度为100U/ml,链霉素的工作浓度为0.1mg/ml。
一个包装的细胞培养用青霉素-链霉素可以配制80L细胞培养液。
大家好,我的双抗颜色变了,以前都是买的,现在想配制一些,具体应该怎么配制呢?请教各位。
谢谢!双抗的配置:用1X浓度的盐溶液配置成100X或者200X的贮存液(一般用100X),分装成小瓶,冰冻保存。
使用前根据培养液的量,加入到培养瓶内,每小瓶最好一次用完。
青霉素与链霉素在培养液中的用量分别为100U/ml培养液与100ug/ml培养液(100U/ml)。
我的配置方法:100ml瓶内,装入90ml1640 10ml小牛血清,再向内加入100W单位链霉素(一小瓶链霉素就是100W单位)。
然后去除20ml液体,剩余80ml,然后用这80ml 液体来溶解80W单位的青霉素(一小瓶青霉素是80W单位)。
但使用之前请看明白各位用的青霉素和链霉素每小瓶都是多少单位的,别用错哦。
然后80ml分装成80小瓶就行了。
最简单的方法:临床应用的注射用青霉素是80万单位/瓶,硫酸链霉素是100mg/瓶。
向青霉素瓶中加4ml超纯水,硫酸链霉素瓶中加5ml超纯水,分别溶解。
然后取4ml硫酸链霉素溶液放入青霉素瓶中,混匀,就配成1000X的双抗溶液啦,过滤除菌后分装到1.5ml的试剂保存管中-20度冻存。
1000X的双抗在培养基中加入液体量少,对培养基的扰动小。
而且使用灵活,还可以做其他用途。
配制一次成本不到10元钱。
呵呵,我还要懒~~!!把适量无菌PBS分别溶解青霉素和链霉素,是用无菌一次性的针管溶解的~~!!然后把它们转移到消毒好的小广口瓶中,慢慢的把PBS加到80ml即可~~!!这样青霉素的正好是1W单位/ml,链霉素浓度高了点,但对细胞没什么影响~~!!把配好的双抗分装,不用的冻起来好了~~!!对一般细胞0.25% 胰酶(胰蛋白酶,Trypsin)配方:100ml PBS,0.25g胰酶步骤:1先配100mlPBS(1000mlPBS:8.0gNaCl,3.4785gPO4HNa2·12H2O/2.9gPO4HNa2 ,0.2gKCl,0.2gPO4H2K溶于1000ml蒸馏水)2 称胰酶0.25g3 加入PBS中,低速搅拌〈4h冰浴中,或者4℃过夜低速搅拌0.5h冰浴中4 调PH7.45 仍在冰浴中6 过滤,分装,-20℃保存,4℃短期内用完tip:低速很重要,机械搅拌对酶是一种冲击,如果起沫,酶就变性了。
0106双抗溶液配制标准操作规程
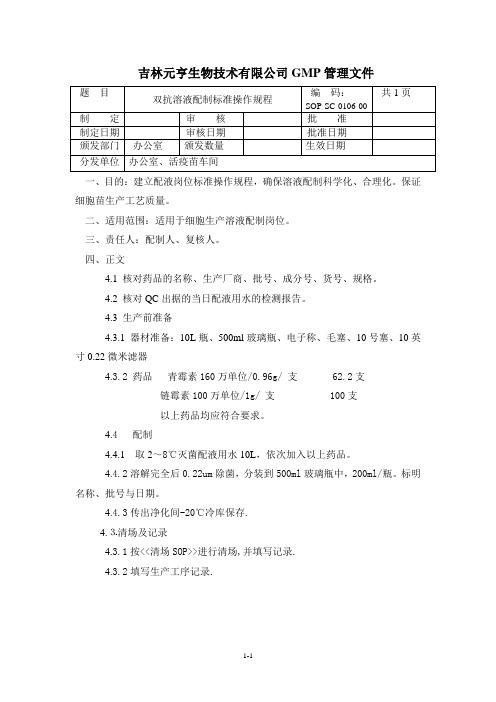
吉林元亨生物技术有限公司GMP管理文件
一、目的:建立配液岗位标准操作规程,确保溶液配制科学化、合理化。
保证细胞苗生产工艺质量。
二、适用范围:适用于细胞生产溶液配制岗位。
三、责任人:配制人、复核人。
四、正文
4.1 核对药品的名称、生产厂商、批号、成分号、货号、规格。
4.2 核对QC出据的当日配液用水的检测报告。
4.3 生产前准备
4.3.1 器材准备:10L瓶、500ml玻璃瓶、电子称、毛塞、10号塞、10英寸0.22微米滤器
4.3.2 药品青霉素160万单位/0.96g/ 支 62.2支
链霉素100万单位/1g/ 支 100支
以上药品均应符合要求。
4.4 配制
4.4.1 取2~8℃灭菌配液用水10L,依次加入以上药品。
4.4.2溶解完全后0.22um除菌,分装到500ml玻璃瓶中,200ml/瓶。
标明名称、批号与日期。
4.4.3传出净化间-20℃冷库保存.
4.⒊清场及记录
4.3.1按<<清场SOP>>进行清场,并填写记录.
4.3.2填写生产工序记录.
1-1。
双抗体夹心法原理

双抗体夹心法原理
双抗体夹心法是一种常用的免疫学实验方法,用于检测目标分子在细胞或组织中的定位及表达水平。
其原理基于两种具有不同特异性的抗体与目标分子同时结合,形成“夹心”结构。
在实验中,首先需要选择两种抗体,其中一个抗体具有对目标分子的高亲和性,称为第一抗体;而另一个抗体与第一抗体非常特异地结合,称为第二抗体。
第一抗体通常是经过动物免疫获得的,能够识别目标分子的特定表位。
而第二抗体则是针对第一抗体的抗动物抗体。
实验的步骤如下:首先,将待检测的细胞或组织样本固定在载玻片上,然后用第一抗体与样本中的目标分子结合。
接着,加入第二抗体,第二抗体结合到第一抗体上形成的“夹心”结构。
第二抗体往往标记有荧光染料或酶,以便进一步的可视化和检测。
最后,通过显微镜观察,“夹心”结构的形成和标记物的位置可用于确定目标分子的存在与表达水平。
双抗体夹心法具有高度特异性和敏感性,可以在细胞或组织水平上定位目标分子。
通过使用不同种类的第一抗体和第二抗体,也可以实现多重标记,从而检测多个目标分子的表达情况。
这种技术在免疫组化、免疫荧光等领域得到广泛应用,并为研究细胞功能以及了解疾病发生机制提供了重要的工具。
双抗的配制——精选推荐

请教大家,我想在全培养基里加青、链霉素的双抗抗菌液,查到的资料很多不知道用哪个好?求配制方法,主要是正确的重量和配比?青霉素:氨苄青霉素;链霉素为硫酸链霉素。
还有那个国际单位u和重量该怎么换算?另外,双抗添加使用上有什么特别的细节?先谢谢了!!我们用的双抗的配制1. 所用纯净水(双蒸水)需要15磅高压20分钟灭菌。
2.具体操作均在超净台内完成。
青霉素是80万单位/瓶,用注射器加4ml灭菌双蒸水。
链霉素是100万单位/瓶,加5ml灭菌双蒸水,即每毫升各为20万单位。
3.使用时溶入培养液中,使青链霉素的浓度最终为100单位/ml。
1单位=1微克可分别取4ml青链霉素配成混和液,这样青链霉素的浓度各为10万单位/ml,然后将8ml溶液稀释十倍,青链霉素的浓度各为1万单位/ml,用时可向培养液中加入1%的双抗,即可达到终浓度为100单位/ml.加入抗生素的终浓度为青霉素100U/ml,链霉素100U/ml。
不知道你的青霉素、链霉素是多少单位的,假如青霉素为80万U/瓶,将其溶解于4ml三蒸水中,每升培养液中加入0.5ml。
链霉素为100万U/瓶,将其溶解在5ml三蒸水中,每升培养液加入0.5ml。
与配置好的培养液一起过滤。
不用换算成重量的。
不过现在有现成的双抗买,10 ml的100×,用的稀释一下就行,比较方便。
一般市售青霉素为80万单位/瓶,将其溶解于4ml三蒸水中每升培养液加0.5ml此时青霉素的终浓度为100u/ml;链霉素为1g/瓶,将其溶解于5ml中,每升培养液加0.5ml,此时链霉素的终浓度为链霉素100μg/ml。
取青霉素100万单位,链霉素1g,分别溶于100mL灭菌Hanks液中,浓度为青霉素10000U/mL 和链霉素10000ug/mL。
使用浓度为100mL培养基内加1mL,则培养基内的终浓度为100U/mL 青霉素和100ug/mL青霉素G钾1mg=1598单位。
细胞融合法制备双特异性单克隆抗体流程

细胞融合法制备双特异性单克隆抗体流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!1. 简介细胞融合法制备双特异性单克隆抗体是一种重要的生物技术手段,可以用于治疗、诊断及研究领域。
细胞融合法制备双特异性单克隆抗体流程

细胞融合法制备双特异性单克隆抗体流程下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!一、引言双特异性单克隆抗体(BsAb)作为一种新型的抗体药物,在肿瘤治疗和免疫治疗中具有潜在的应用前景。
双抗配制

细胞培养中双抗的使用方法
一、什么是双抗?
双抗是一种含有青霉素(10,000 IU)和链霉素(10,000µg/mL)在100倍的工作浓度的混合液。
二、如何配制双抗?
用20mL空针抽16毫升三蒸水(或PBS),溶160万单位/瓶的青霉素G钠一支,过滤除菌;用10mL空针抽10毫升三蒸水(或PBS),溶一支100万单位/瓶的硫酸链霉素一支,过滤除菌。
分装至EP管中,-20度保存。
使用前每100ml培养液加双抗各100ul-150ul即可。
细胞培养液双抗浓度:青霉素G钠,100-1000U/ml;硫酸链霉素,100-1000μg/ml(100万单位=1g)。
三、培养液中需要加入双抗吗?
加不加双抗不是绝对的,视实际情况而定。
如果你实验室条件足够好,如果你操作足够规范,就尽量不要加双抗了。
相反,如果你实验条件不够,操作也没有绝对把握,还是加的好。
最好的方法是做个实验对照,看有没有必要加双抗。
四、如何加双抗?
加在DMEM里,因为如果是直接在换液传代滴加的话,那个双抗的浓度实在不好控制,如果加多了话对细胞毒性太大,如果担心时效,可以Z在培养液配好后分装于100ml的小玻璃瓶中,在每启用一瓶之前加,加了之后应尽快用完。
五、双抗的保存
将双抗配制好,最好滤菌后再分装到EP管中,保存到-20℃以下的冰箱。
用时取一支,若一支没用完,可以立即保存到-20度继续再用,但反复冻融的次数不宜过多。
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求。
2019年免疫学实验一抗,二抗的选择与搭配原则和方法.ppt

• 3.样本的物种
选择物种相同或有交叉反应的抗体,抗体可能与 不同物种的同种靶蛋白有交叉反应,因其氨基酸 序列同源性较高,如果样本的种类未列入抗体说 明书上的交叉反应种属表中,并不意味着该抗体 不适用于检测该物种的蛋白,而只是表示该物种 尚未用此抗体检测验证过,应通过序列比对的方 法来预测交叉反应,可应用 Expasy 和 NCBI BLAST来进行不同物种蛋白同 源性比对。
• 4.一抗宿主物种的选择 • 一般说来,在使用偶联二抗结合无偶联物的一抗时,一抗 宿主动物的物种选择较为重要,对于免疫组化而言,尽可 能选择与样本不同种系物种的一抗,从而避免二抗与样本 内源性免疫球蛋白产生交叉反应, • 例如:检测小鼠样本蛋白,则不应选择小鼠或大鼠源的一 抗,最好选兔源的一抗,则二抗则可选择偶联了检测分子 (酶、荧光素、生物素等)的抗兔IgG。 • 如果选择有偶联物的一抗则不适用上述情况,除免疫组化 外的其它对不含内源性免疫球蛋白样本的检测方法,则抗 体宿主物种的影响不大,如对不含IgG的细胞裂解物样本 的western blotting检测,尽管如此,含有血清的组织裂解 物和组织培养上清中含有免疫球蛋白,还原变性样本中含 IgG,在western blot检测中则结合出现IgG分子 50 and 25 kDa的重链和轻链条带。
• 3二抗的偶联标记
主要有酶(辣根过氧化酶HRP和碱性磷酸酶AP或其衍 生物APAAP,PAP),荧光基团(FITC、Rhodamine、 Texas Red、PE、Rhodamine、Dylight等)、生物素、 金颗粒。 选用哪种探针的二抗主要取决于具体的实验。 对于Western Blot和ELISA,最常用的二抗是酶标二抗; 细胞或组织标记实验(细胞免疫化学,组织免疫化学,流 式细胞术)中通常使用荧光基团标记的二抗, 免疫组化中也可以使用辣根过氧化酶或碱性磷酸酶标记的 二抗。 如果想要更大程度的放大检测信号,可以使用 Biotin/Avidin检测系统。 在一些荧光检测方案中,则需要选择不同的荧光标记; 金颗粒标记的二抗则更多的应用于免疫电镜中。
双抗体夹心法原理

双抗体夹心法原理以FABP 为例(检测抗原)阳性反应Y1=F14A (标记了胶体金)Y2=F104B (固定在NC 膜上即T 线)Y3=羊抗鼠IgG (固定在NC 膜上即C 线)此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以。
也有个别的检测项目是双抗原夹心检测抗体的,原理类似。
样品(血清)含FABP 蛋白金标记F14A 抗体金-F14A-FABP金-F14A-FABP-F14A金-F14A-羊抗鼠IgG金-F14A-FABP羊抗鼠IgG 显示红色 显示红色金标记F14A 抗体不显色 显示红色金-F14A-羊抗鼠IgG阴性反应阳性反应竞争法原理以吗啡为例(检测抗原)阳性反应Y1=胶体金标记的吗啡单抗 Y2=吗啡-BSA 偶联物 Y3=羊抗鼠此方法主要用于小分子抗原(毒品、农药、肽链等)的检测。
由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线。
金-吗啡抗体-吗啡吗啡-BSA金标记吗啡抗体显示红色不显色金-吗啡抗体-吗啡羊抗鼠样品(尿液)含吗啡显示红色显示红色 金标记吗啡抗体金-吗啡抗体-羊抗鼠阴性尿液抗体-吗阴性反应阳性反应间接法原理以HIV为例(检测抗体)显示红色显示红色显示红色不显色此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC膜上,标记多为蛋白A(ProteinA或叫SPA,抗体Fc端结合而与其它蛋白质不结合)。
此方法要求胶体金过量,一般来说样品再加入前需要稀释或者加极少量后再加缓冲液。
斑点免疫渗滤法使用就是间接法。
双抗体夹心免疫层析法

双抗体夹心免疫层析法《神奇的双抗体夹心免疫层析法》哎呀呀,你知道吗?有一种特别神奇的方法叫双抗体夹心免疫层析法!这名字听起来是不是特别高大上?刚开始我听到的时候,也是一头雾水呢。
就像我们玩捉迷藏,得找到藏起来的小伙伴一样,这个方法也是要找到我们身体里那些“调皮捣蛋”的小东西。
比如说病毒啦、细菌啦,它们偷偷藏在我们身体里,让我们生病。
那这个双抗体夹心免疫层析法到底是怎么工作的呢?我来给你讲讲哈!想象一下,我们身体里的病毒或者细菌就像是一个个小坏蛋,而我们要找到它们就得有厉害的“武器”。
这个方法里的抗体就像是警察手里的“通缉令”。
有一种抗体专门负责抓住小坏蛋的头,另一种抗体专门抓住小坏蛋的脚。
比如说,我们要检测是不是感染了新冠病毒。
那这两个抗体就像两个特别厉害的小战士,一个在前,一个在后,把新冠病毒这个“小怪兽”紧紧地夹在中间,跑都跑不掉。
这时候就会出现一条明显的线,就好像是小战士给我们发出的信号:“嘿,我们抓到它啦!”我之前问过老师:“老师老师,那这和我们平常做的检查有啥不一样呀?”老师笑着说:“这可不一样啦!双抗体夹心免疫层析法又快又准,就像孙悟空的火眼金睛,一下子就能把那些坏东西找出来!”有一次,我们学校组织了一次健康检查,就用到了这个方法。
我看着医生叔叔阿姨们认真地操作,心里可好奇啦!我就凑过去问:“叔叔,这个真的能马上知道我们有没有生病吗?”叔叔耐心地回答我:“小朋友,这个方法可厉害啦,很快就能出结果!”你说,科技是不是太神奇啦?以前,要是想知道有没有生病,得等好久,还不一定准。
现在有了这个双抗体夹心免疫层析法,就像是给我们的健康多了一层超级保护罩!反正我觉得,以后肯定还会有更多更厉害的方法来保护我们的健康,让我们不再害怕那些看不见的小坏蛋!你难道不期待吗?我觉得呀,我们得好好学习,说不定以后也能发明出更厉害的检测方法呢!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细胞培养用青霉素-链霉素(Penicillin-Streptomycin for Cell Culture)为粉剂,是最常用的细胞培养用抗生素(即通常所谓的双抗)。
在细胞培养液中推荐的青霉素的工作浓度为100U/ml,链霉素的工作浓度为0.1mg/ml。
一个包装的细胞培养用青霉素-链霉素可以配制80L细胞培养液。
大家好,我的双抗颜色变了,以前都是买的,现在想配制一些,具体应该怎么配制呢?请教各位。
谢谢!
双抗的配置:
用1X浓度的盐溶液配置成100X或者200X的贮存液(一般用100X),分装成小瓶,冰冻保存。
使用前根据培养液的量,加入到培养瓶内,每小瓶最好一次用完。
青霉素与链霉素在培养液中的用量分别为100U/ml培养液与100ug/ml培养液(100U/ml)。
我的配置方法:
100ml瓶内,装入90ml1640 10ml小牛血清,再向内加入100W单位链霉素(一小瓶链霉素就是100W单位)。
然后去除20ml液体,剩余80ml,然后用这80ml 液体来溶解80W单位的青霉素(一小瓶青霉素是80W单位)。
但使用之前请看明白各位用的青霉素和链霉素每小瓶都是多少单位的,别用错哦。
然后80ml分装成80小瓶就行了。
最简单的方法:
临床应用的注射用青霉素是80万单位/瓶,硫酸链霉素是100mg/瓶。
向青霉素瓶中加4ml超纯水,硫酸链霉素瓶中加5ml超纯水,分别溶解。
然后取4ml硫酸链霉素溶液放入青霉素瓶中,混匀,就配成1000X的双抗溶液啦,过滤除菌后分装到1.5ml的试剂保存管中-20度冻存。
1000X的双抗在培养基中加入液体量少,对培养基的扰动小。
而且使用灵活,还可以做其他用途。
配制一次成本不到10元钱。
呵呵,我还要懒~~!!
把适量无菌PBS分别溶解青霉素和链霉素,是用无菌一次性的针管溶解的~~!!
然后把它们转移到消毒好的小广口瓶中,慢慢的把PBS加到80ml即可~~!!
这样青霉素的正好是1W单位/ml,链霉素浓度高了点,但对细胞没什么影响~~!!
把配好的双抗分装,不用的冻起来好了~~!!
对一般细胞0.25% 胰酶(胰蛋白酶,Trypsin)
配方:100ml PBS,0.25g胰酶
步骤:1先配100mlPBS(1000mlPBS:8.0gNaCl,3.4785gPO4HNa2·12H2O
/2.9gPO4HNa2 ,0.2gKCl,0.2gPO4H2K溶于1000ml蒸馏水)
2 称胰酶0.25g
3 加入PBS中,低速搅拌〈4h冰浴中,或者4℃过夜
低速搅拌0.5h冰浴中
4 调PH7.4
5 仍在冰浴中
6 过滤,分装,-20℃保存,4℃短期内用完
tip:低速很重要,机械搅拌对酶是一种冲击,如果起沫,
酶就变性了。
低温,防止酶失活
对难消化的细胞:在上述配方中,加入0.02g的EDTA(0.02%)
tip:因为EDTA可以络合Ca2+,增加消化效力。
